Аэробные микроорганизмы что это такое
Аэробы — Википедия
Материал из Википедии — свободной энциклопедии
Аэро́бы (от греч. αηρ — воздух и βιοζ — жизнь) — организмы, которые нуждаются в свободном молекулярном кислороде для процессов синтеза энергии, в отличие от анаэробов. К аэробам относятся подавляющее большинство животных, все растения, а также значительная часть микроорганизмов.
По отношению к молекулярному кислороду выделяют:
Организмы, получающие энергию и образующие АТФ при помощи только окислительного фосфорилирования субстрата, где окислителем может выступать только молекулярный кислород. Рост большинства аэробных бактерий прекращается при концентрации кислорода в 40—50% и выше. В атмосфере чистого кислорода не способны развиваться никакие прокариоты. Облигатные (строгие) аэробы (например, некоторые виды псевдомонад) не могут жить и размножаться в отсутствие молекулярного кислорода, поскольку используют его в качестве акцептора электронов. Молекулы АТФ образуются ими при окислительном фосфорилировании с участием цитохромоксидаз, флавинзависимых оксидаз и флавинзависимых дегидрогеназ. При этом, если акцептором электронов является кислород, выделяется сравнительно большое количество энергии (до 12 молекул АТФ из 1 молекулы C 6H12O6).
Некоторые аэробные (требующие для роста наличия О2 в среде) микроорганизмы гибнут на воздухе. Они могут развиваться при концентрации кислорода около 2% (в 10 раз ниже, чем в атмосфере), за что и получили название микроаэрофилов. Обычно такие требования к внешним условиям связаны с их метаболической активностью: кислород ингибирует нитрогеназу, гидрогеназу и другие ферменты, из-за чего при его концентрации более 2% делается невозможной азотфиксация, окисление водорода и некоторые другие процессы. Если в среде есть связанный азот и органические соединения, то и азотфиксаторы, и водородокисляющие бактерии хорошо растут и при 21% содержании кислорода[1].
- ↑ Борисов Л.Б. Медицинская микробиология, вирусология и иммунология. — МИА, 2005. — С. 154-156. — ISBN 5-89481-278-X.
Аэробные микроорганизмы. Аэробные бактерии для септика. Аэробные микробы – общая информация.
Аэробные бактерии могут существовать только в кислородной среде. Кислород необходим для их жизнедеятельности, питания, роста и размножения. При уменьшении количества кислорода аэробные микроорганизмы снижают свою активность, интенсивность их метаболизма падает. Если поступление кислорода прекращается, то аэробные бактерии погибают.
Аэробные микробы
Аэробные микробы — это одноклеточные, принадлежащие к очень большому биологическому сообществу, в которое входят не только самые разные микроорганизмы, но также растения, большинство простейших и высшие многоклеточные животные. Практически все виды живых существ на планете Земля являются аэробными, так как всем этим видам для жизнедеятельности необходим свободный кислород.

аэробные бактерии дышат кислородом
Кроме дыхания кислородом аэробным бактериям необходимо питаться. Поэтому можно смело сказать: нам повезло, что на Земле нашлись замечательные аэробные бактерии, для которых органические загрязнения хозяйственно-бытовых стоков являются питательной средой. Когда биологи обнаружили, что органика в природе разлагается не сама по себе, а при участии бактерий, то до появления системы автономной канализации на основе аэробных бактерий ждать оставалось совсем не долго.
Сегодня каждый владелец загородной дачи или коттеджа может заказать и установить на своем участке систему аэробной очистки стоков — установку глубокой биологической очистки (УГБО), которая обладает высочайшей эффективностью. Именно в результате деятельности аэробных бактерий черные и серые стоки быстро превращаются в прозрачную чистую воду без запаха!
Высокий уровень очистки стоков — это высокая степень разложения биологических соединений на более простые составляющие и их поглощение. Бактерии устроены так, что внутрь через оболочку-мембрану могут проникать только полезные для данного вида вещества. Аэробные микроорганизмы, использующие кислород, отличаются высоким уровнем метаболизма и поэтому перерабатывают загрязнения быстрее, чем анаэробные (бескислородные), которые используются в септиках. Сам кислород, как участник процесса обработки стоков, также играет очень важную роль. Имея очень сильную окислительную способность, кислород способен самостоятельно окислить и разложить загрязнения на более простые элементы, а также способствует обеззараживанию сточных вод, уничтожая опасные бактерии.
аэробные станции очистки компактны, эффективны и экологичны
При регулярном поступлении хозяйственно-бытовых стоков в очистную установку, аэробные микробы перерабатывают органику, поглощают ее составляющие, размножаются и со временем образуют так называемый активный ил. Активный ил — это осадок, состоящий из огромного числа аэробных бактерий, которые эффективно нейтрализуют органические загрязняющие вещества.
Процесс насыщения стоков кислородом происходит в аэротэнке, где постоянно работает воздушный компрессор. Конечно, наличие электрооборудования лишает систему энергонезависимости. Но это единственный путь для организации эффективной очистки сточных вод. Анаэробные бактерии не нуждаются в подаче кислорода или другого газа. Да, Вы сможете сэкономить, установив более простой и дешевый септик без воздушного компрессора. Но при этом потеряете в качестве очистки стоков. Сравните: аэробная технология осветляет воду до 97%, анаэробная — только до 70%. И это не просто цифры, это — один из главных показателей уровня комфортности проживания в загородном доме.
Решение задачи с утилизацией хозяйственно-бытовых стоков в домах, не подключенных к городской канализации, было знаменательным событием. Именно поэтому сегодня большинство людей слышали об аэробных микроорганизмах именно в связи с установками глубокой биологической очистки стоков.
Аэробные микроорганизмы, использующиеся в очистных сооружениях, расщепляют органические соединения до воды и углекислого газа. То есть на выходе из установки глубокой биологической очистки Вы получаете действительно экологически чистые компоненты, которые не загрязняют окружающую среду. Углекислый газ без запаха (запах — это неразложившиеся молекулы загрязнений) уходит в атмосферу, а практически чистая вода сливается в систему отвода.
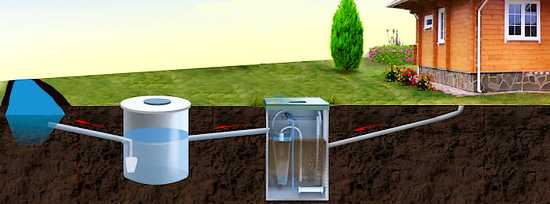
чистая вода из УГБО отводится сразу в канаву
Если вода из УГБО очищена настолько, что не имеет запаха и ее можно сливать в канаву, то вода из септика осветлена лишь частично и ее необходимо подвергнуть дополнительной обработке. К счастью для загородного домовладельца строить дополнительные очистительные сооружения не надо. В почве живут различные виды бактерий, в том числе аэробные. В кубическом сантиметре земли их миллионы. Среди этих бактерий есть и такие, которые смогут эффективно нейтрализовать оставшиеся в воде загрязнения. Если на участке песчаный грунт — недоочищенная вода из септика выводится непосредственно в почву через колодец поглощения. Если грунт глинистый или высоко поднялись грунтовые воды, то придется делать искусственный «островок» фильтрующего грунта из гравия, щебня и песка — так называемое поле фильтрации. В обоих случаях вода из септика будет доочищена бактериями, которые естественным образом живут у нас под ногами. У разных групп бактерий есть своя специализация. В целом вокруг нас в природе благодаря различным микроорганизмам постоянно идет переработка органики и неорганических веществ.
Где еще используются аэробные микробы? Кроме биологической переработки сточных вод аэробные бактерии нашли свое место даже в современной промышленности. Используется способность бактерий в процессе жизнедеятельности выделять определенные ферменты, которые катализируют окислительно-восстановительные химические реакции. Для промышленных задач бактерии разводятся в питательной среде при оптимальной температуре в так называемом биореакторе (ферментере). Через биореактор прокачивается воздух, иногда дополнительно насыщаемый кислородом, постоянно происходит перемешивание раствора. Эффективность использования ферментов микробного происхождения объясняется возможностью производить их в огромных количествах, используя простые методы ферментации и способы повышения продуктивности работы микроорганизмов. Достижения микробиологии позволяют изменять ДНК бактерий, повышая их эффективность.

биореактор для производства лекарств
Аэробные микробы активно используются в пищевой промышленности, производстве лекарств, участвуют в повышении концентрации металлов при биологической очистке промышленных сточных вод в горнодобывающей промышленности, помогают выделять из растворов железо, медь, сульфаты, эффективны при флотационном обогащении руд, играют важную роль в процессах бактериально-химического выщелачивания (извлечения) металлов из рудных концентратов и горных пород, очищают каменный уголь от серы, снижают концентрацию взрывоопасного метана в шахтах, повышают нефтеотдачу пластов при вторичной добыче нефти, и многое другое... Как видим, микроскопические аэробные микроорганизмы оказывают значительную помощь человеку на очень разных направлениях — от частного использования в небольшой установке глубокой биологической очистки стоков до масштабных проектов в горнорудной и нефтедобывающей отраслях.
Популярные модели

АСТРА 3
- Проживание: 3 чел.
- Производительность: 0,6 м 3
- Вес: 120 кг

АСТРА 5
- Проживание: 5 чел.
- Производительность: 1,0 м 3
- Вес: 250 кг

АСТРА 5 миди
- Проживание: 5 чел.
- Производительность: 1,0 м 3
- Вес: 225 кг

АСТРА 5 лонг
- Проживание: 5 чел.
- Производительность: 1,0 м 3
- Вес: 285 кг
Аэробные и анаэробные бактерии | В чем различие?
Какие именно бактерии используются в станциях биологической очистки и в чем отличие одних от других? Что нельзя делать, чтобы ваша колония бактерий в септике не погибла? Читайте в статье.
Бактерии живут во всем окружающем нас мире, в земле, воздухе, на вашем рабочем столе и экране телефона. Основная классификация бактерий основана на том, необходим ли им кислород для жизнедеятельности или нет.
Анаэробные бактерии
Анаэробные бактерии не нуждаются в кислороде и способны жить в различных средах, где нет света и кислорода, например, в почве, в желудочно-кишечном тракте животных и человека и т.д. Анаэробные бактерии отвечают за гниение, процессе их деятельности органические соединения постепенно разлагаются с выделением метана, который и является причиной неприятного гнилостного запаха.
Анаэробные бактерии царствуют в пластиковых септиках, которые представляют собой емкость с небольшими отверстиями, иногда разделенную перегородками. Малое количество кислорода дает плодородную среду для появления и развития этих бактерий. Отходы в таком септике не перерабатываются полностью - часть из них образуют твердый осадок, оседая на дно и медленно перегнивая. Степень очистки стоков в таком септике не превышает 30-40%, а темная, влажная среда способствует развитию вредных микроорганизмов, в связи с чем, воду и отходы с такого септика нельзя использовать для удобрения - это может привести к заражению. С небольшой периодичностью такие септики необходимо откачивать ассенизаторской машиной.
Наглядный пример принципа работы такого септика - обычный деревянный туалет, имеющий характерный запах работы анаэробных организмов.
Именно анаэробные микроорганизмы вызывают воспалительно-гнойные заболевания различных видов: гангрены, абсцессы, пневманию, менингиты, инфекции глубоких тканей, некрозы и другие заболевания инфекционного характера.
Однако другой подвид анаэробных бактерий также являются частью нормальной микрофлоры кишечника человека и полости рта. Таким образом, различные подвиды анаэробов могут быть как полезными, так и опасными для человека.
Аэробные бактерии
Другой группой бактерий выступают аэробные микроорганизмы. Они живут только в присутствии кислорода и вызывают не гниение, а окисление органики в процессе синтеза энергии, при этом выделяется тепло и углекислота, а не метан, поэтому неприятного запаха в процессе переработки отходов жизнедеятельности человека не возникает. Органические отходы под действием аэробов преобразуются в активный ил и чистую, прозрачную воду. Именно на этом принципе работает любая автономная канализация для загородного дома: как чешский Топас, так и его русский аналог - Юнилос Астра, и недавно появившиеся станции Евробион и Биодека.
С помощью постоянной подачи кислорода и поступления органических отходов в станцию биологической очистки, поддерживается существование колонии аэробных бактерий. После переработки сточных вод, чистая вода из автономной канализации удаляется в канаву или дренажный колодец, а активный ил оседает на дне и стенках станции. Активный ил достаточно чистить раз в 3-6 месяцев, в зависимости от активности эксплуатации. Сточные воды очищаются до 98% и чистая вода из станции может использоваться для полива не плодовых деревьев, газонов, мытья дорожек, веранды или машины.
Бактерии в автономной канализации появляются естественным образом после начала ее использования, дополнительное добавление бактерий в нее не требуется. При грамотной установке и эксплуатации согласно рекомендациям производителя, в дальнейшем покупка бактерий также является лишней тратой денег. Первым признаком неправильной работы станции является сильный гнилостный запах из нее, если его нет, то бактерии в вашей станции отлично справляются со своей задачей. В случае появления неприятного запаха из канализации, обратитесь в компанию, которая производила установку станции, возможно, дело вовсе не в гибели бактерий, а в поломке какой-либо системы.
Как уберечь бактерии от гибели?
- Пользуйтесь станцией регулярно, так как бактериям нужна пища. При этом лить в станцию кефир, молоко и прочую человеческую еду также не нужно, бактерии питаются отходами человеческой деятельности.
- При долгом отсутствии в доме (например, в зимнее время), консервируйте станцию.
- Не используйте средства, содержащие хлор, фенол, щелочи, кислоты, альдегиды и т.д. В основном, поколение современных моющих средств не содержат вышеперечисленные вещества, тем не менее стоит внимательно читать этикетку.
- Пользуйтесь мягкой туалетной бумагой, не спускайте в канализацию мусор, овощные очистки, предметы гигиены и т.д.
- Проводите регулярное сервисное обслуживание самостоятельно или при помощи специалиста компании.
Аэробные бактерии
Аэробные бактерии – это микроорганизмы, которым для нормальной жизнедеятельности необходим свободный кислород. В отличие от всех анаэробов у них он участвует и в процессе выработки энергии, необходимой им для размножения. Эти бактерии не имеют выраженного ядра. Они размножаются почкованием или делением и при окислении образуют различные токсичные продукты неполного восстановления.
Особенности аэробовНе многие знают, что аэробные бактерии (простыми словами аэробы) – это такие организмы, которые могут обитать и в почве, и в воздухе, и в воде. Они активно участвуют в круговороте веществ и обладают несколькими специальными ферментами, обеспечивающими их разложение (например, каталазой, супероксиддисмутазой и другими). Дыхание данных бактерий осуществляется путем прямого окисления метана, водорода, азота, сероводорода, железа. Они способны существовать в широком диапазоне при парциальном давлении 0,1-20 атм.
Культивирование аэробных грамотрицательных и грамположительных бактерий подразумевает не только использование подходящей для них питательной среды, но и количественный контроль кислородной атмосферы и удержание оптимальных температур. Для каждого микроорганизма этой группы существует и минимум, и максимум кислородной концентрации в среде, окружающей его, необходимой для его нормального размножения и развития. Поэтому к прекращению жизнедеятельности таких микробов ведет как уменьшение, так и повышение содержания кислорода за предел «максимума». Все аэробные бактерии гибнут при концентрации кислорода от 40 до 50%.
Виды аэробных бактерий
По степени зависимости от свободного кислорода все аэробные бактерии делят на такие виды:
1. Облигатные аэробы – это «безусловные» или «строгие» аэробы, которые способны развиваться только, когда в воздухе высокая концентрация кислорода, так как они получают энергию из окислительных реакций с его участием. К ним относятся:
- некоторые виды псевдомонад;
- многие сапрофиты;
- дифтерийные палочки;
- холерный вибрион;
- туберкулезная палочка;
- возбудители туляремии.
2. Факультативные аэробы – микроорганизмы, развивающиеся даже при очень низком количестве кислорода. К данной группе относится:
- дрожжевая палочка;
- большинство патогенных микробов (менингококки, гонококки).
При попадании в обычную внешнюю среду такие бактерии практически всегда гибнут, поскольку большое количество кислорода негативно действует на их ферменты.
Микроаэрофильный организм — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 марта 2016; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 марта 2016; проверки требуют 4 правки. Аэробные и анаэробные бактерии предварительно идентифицируются в жидкой питательной среде по градиенту концентрации O2:1. Облигатные аэробныебактериив основномсобираются в верхней части пробирки, чтобы поглощать максимальное количество кислорода. (Исключение: микобактерии — рост плёнкой на поверхности из-за восколипидной мембраны.)
2. Облигатные анаэробные бактерии собираются в нижней части, чтобы избежать кислорода (либо не дают роста).
3. Факультативные бактерии собираются в основном в верхней части пробирки (так какокислительное фосфорилирование является более выгодным, чем гликолиз), однако они могут быть найдены на всем протяжении среды, так как от O2 не зависят.
4. Микроаэрофилы собираются в верхней части пробирки, но их оптимум — малая концентрация кислорода.
5. Аэротолерантные анаэробы не реагируют на концентрацию кислорода и равномерно распределяются по пробирке.
Микроаэрофильный организм — микроорганизм, требующий, в отличие от строгих анаэробов, для своего роста присутствия кислорода в атмосфере или питательной среде, но в пониженных концентрациях по сравнению с содержанием кислорода в обычном воздухе или в нормальных тканях организма хозяина (в отличие от аэробов, для роста которых необходимо нормальное содержание кислорода в атмосфере или питательной среде). Многие микроаэрофилы так же являются капнофилами, то есть им требуется повышенная концентрация углекислого газа. В лаборатории такие организмы легко культивируются в «свечной банке». «Свечная банка» это ёмкость, в которую перед запечатыванием воздухонепроницаемой крышкой вносят горящую свечу. Пламя свечи будет гореть до тех пор, пока не потухнет от недостатка кислорода, в результате чего в банке образуется атмосфера, насыщенная диоксидом углерода, с пониженным содержанием кислорода.
Многие, но не все, микроаэрофильные бактерии плохо переносят нормальные или повышенные концентрации кислорода в атмосфере, а также проявляют чувствительность к антибактериальным препаратам, действие которых имитирует действие атомарного кислорода (повышение образования свободных радикалов), а именно к нитроимидазолам, в частности метронидазолу, тинидазолу.
Пурпурные бактерии — Википедия
Пурпурные бактерии (Purple bacteria) — разнородная группа фотосинтезирующих протеобактерий, обитающих в солёных и пресных водах. Пурпурные бактерии относятся к классам альфа-, бета-, и гамма-протеобактерий.
Пурпурные бактерии были обнаружены при изучении бескислородного фотосинтеза. Было доказано выделение ими в качестве побочного продукта фотосинтеза не кислорода, а серы, как выяснили позднее и анаэробность многих из них. Так в экспериментах сначала выявили реакцию бактерий на разные концентрации кислорода, оказалось, что даже при следовом содержании его в среде бактерии перемещались в бескислородную зону чашек Петри. Затем на одну сторону чашки фокусировали свет, оставляя другую тёмной — бактерии стремились переместиться в световую зону.
Полиморфны, их размеры колеблются в широких пределах (от 1 до 20 мкм), размножаются бинарным делением или почкованием. Для данных клеток характерна очень хорошо развитая система внутрицитоплазматических фотосинтетических мембран. Ряд водных форм имеет газовые вакуоли. Подвижные виды обладают активным фототаксисом. Некоторые виды могут образовывать цисты и экзоспоры[1]. Предпочитают расти на свету в анаэробных условиях. Клеточная стенка грамотрицательного типа, покрыта слизистым чехлом или капсулой, у некоторых представителей имеется S-слой из гексагонально расположенных белков. В качестве запасных веществ у них обнаружены поли-β-гидроксиалконаты и гликоген.
Используют широкий спектр соединений азота, многие способны к азотофиксации. Источником углерода могут быть углекислый газ или органические вещества. Диоксид углерода фиксируют в цикле Калвина, активность которого подавляется добавлением органики. В темноте роль органических веществ как источника энергии увеличивается, происходят брожения разного типа. Энергия также может получаться путём анаэробного дыхания с сульфатом, серой, Fe3+, CO и органическими соединениями в качестве акцепторов электронов. Сахара́ используются через гликолиз или КДФГ-путь. Имеют полный или незамкнутый ЦТК и глиоксилатный шунт[2].
Синтез бактериохлорофиллов подавляется кислородом, но может идти и в темноте. Содержат красные пигменты: бактериохлорофиллы a и b и каротиноиды, что является причиной того, что колонии или скопления их клеток окрашены в пурпурный цвет. Пигменты дают им возможность использовать свет в тёмно-красном, красном, оранжевом и фиолетовом диапазонах спектра[3]. Фотосинтетические мембраны являются производными ЦПМ и сохраняют с ней отчётливую связь. Имеют вид отдельных пузырьков, трубок или пластинок (ламелл), которые расположены по периферии клетки. В качестве доноров электронов для фотосинтеза используют H2S, S0 или органические вещества[2].
Для большинства представителей необходима высокая интенсивность света (~500 лк), только род Amoebobacter требует низкой освещённости (50—100 лк) при пониженных температурах роста. Большинство видов мезофилы, психроактивные организмы включают Amoebobacter и Lamprocystis, а термофильные виды относятся к родам Halorhodospira, Rhodocista и Thermochromatium. Экстремальных термофилов среди пурпурных бактерий не обнаружено. В основном, это нейтрофильные микроорганизмы, которые хорошо растут при pH 6—8, но есть кислото- (Rhodobacter acidophila) и щёлочелюбивые (Ectothiorhodospira, Halospira). Эти же роды содержат экстремально галофильных представителей, синтезирующих осмопротекторы (глицин-бетаин, экотин, трегалозу).
По характеру отложения серы пурпурные бактерии подразделяют на пурпурных серных бактерий (имеющие включения серы в цитоплазме) и пурпурных несерных бактерий, откладывающих её снаружи.
Пурпурные серные бактерии[править | править код]
Сюда относятся в основном представители гаммапротеобактерий. Облигатные анаэробы. Прототрофы и фотолитоавтотрофы. Для родов Thiocapsa и Thiospirillum показана возможность хемолитоавтотрофного роста с молекулярным водородом и сульфидом в качестве доноров электронов. Подвижные формы обладают полярными жгутиками. Способность использовать органические вещества как доноры электронов ограничена. В основном они служат как источники углерода, могут сбраживать пируват до ацетата. Бактериохлорофиллы имеют максимумы поглощения 470 нм, 870 нм и 1070 нм[2].
Пурпурные несерные бактерии[править | править код]
Сюда обычно относят представителей из порядков Rhodospirillales, Rhodobacterales и Rhodocyclales. Имеют ферменты защиты от O2. В микроаэрофильных и аэробных условиях способны расти в темноте. Имеют склонность к фотоорганогетеротрофному образу жизни, предпочитая в качестве доноров электронов и источника углерода органические вещества, однако могут быть и фотолитоавтотрофами. У подвижных форм есть жгутики, у многих присутствуют газовые вакуоли. Есть и неподвижные формы. Нуждаются в некоторых витаминах. Бактериохлорофиллы имеют максимумы поглощения 400 нм, 800 нм и 1030 нм[2].
У ряда пурпурных несерных бактерий без глиоксилатного шунта (Rhodospirillum rubrum, Rhodobacter sphaeroides) обнаружен цитратмалатный цикл, в котором ацетил-КоА превращается в глиоксилат в цепи реакций
- ацетил-КоА + пируват → цитрамалил-КоА → цитрамалат → мезаконил-КоА → 3-метилмалил-КоА → глиоксилат + пропионил-КоА.
Образовавшийся глиоксилат включается в ЦТК при участии малатсинтазы, а пируват регенерирует из пропионил-КоА через карбоксилазную реакцию:
- пропионил-КоА → метилмалонил-КоА → сукцинил-КоА → сукцинат → фумарат → малат → оксалоацетат → ФЕП → пируват.
Пурпурные серобактерии — это в основном водные микроорганизмы. Помимо этого они встречаются в почве, но там их роль невелика. Развиваются обычно в бескислородных водах с сероводородом, куда проникает свет, в редких случаях обнаруживаются на бо́льших глубинах. Пурпурные несерные бактерии предпочитают богатые органикой воды и болотистые почвы, при этом редко образуют скопления, придающие воде окраску. Иногда развиваются в прибрежных морских водах. Пурпурные серные бактерии, наоборот, создают видимые скопления в прозрачных водоёмах на границе анаэробной зоны. Такие слои лучше всего формируются в меромиктических (с более высокой придонной солёностью) или голомиктических (с сезонной стратификацией) водоёмах и по берегам морей в лиманных областях. В прибрежных зонах морей могут образовывать красные приливы. Представители Ectothiorhodospira тяготеют к солёным и щелочным местообитаниям, морским эстуариям. В глобальном круговороте серы функционально тесно связаны с сульфатредукторами.
Для пурпурных бактерий отмечено сосуществование аналогичных видов в одном и том же слое водоёма за счёт разобщения их активности во времени. Например, Chromatium okenii и Chromatium vinosum по константе сродства и скорости окисления сульфида. В смешанной культуре второй организм вытесняет первый, а в природе они сменяют друг друга в течение суток: утром, когда сульфида много C. okenii быстро окисляет сероводород, концентрация которого падает, а вечером C. vinosum начинает медленно окислять малые количества H2S, в то время как первый микроорганизм прекращает свой рост[4].
Пурпурные несерные бактерии[5]
Входящие в класс альфа-протеобактерий
- Род Rhodospirillum — спириллы с полярными жгутиками
- Род Rhodopseudomonas — палочки с полярными жгутиками, размножаются почкованием
- Род Rhodobacter — палочки, размножаются бинарным делением
- Род Rhodovulvum — яйцеобразные клетки
- Род Rhodopila — большие сферические клетки, ацидофилы (pH 5,0)
Входящие в класс бета-протеобактерий
- Род Rhodocyclus — кольцеобразные изогнутые клетки
- Род Rubrivivax — искривлённые палочки
- Род Rhodoferax — искривлённые палочки
Пурпурные серные бактерии[5]
Входящие в класс гамма-протеобактерий
- Род Ectothiorhodospira — спириллы с полярными жгутиками (откладывают серу снаружи)
- Род Halorhodospira — спириллы, экстремальные галофилы (откладывают серу снаружи)
нет газовых вакуолей
- Род Chromatium — овальные палочки с полярными жгутиками
- Род Thiocapsa — диплококки и тетрады, неподвижны
- Род Thiocystis — сферические или овальные клетки с полярными жгутиками
- Род Thiospirillum — большие спириллы с полярными жгутиками
- Род Thiorhodovibrio — маленькие спириллы
- Род Rhabdochromatium — крупные палочки-веретёнца (1,5—1,7 × 16—32 мкм)
есть газовые вакуоли
- Род Amoebobacter — неправильные сферические или овальные клетки, неподвижны
- Род Lamprobacter — палочки с полярными жгутиками
- Род Lamprocystis — сферические или овальные клетки с полярными жгутиками
- Род Thiodiction — неподвижные палочки, образующие сетку
- Род Thiopedia — неподвижные сферические клетки в плоских тетрадах
- ↑ Гусев, Минеева, 2003, с. 303.
- ↑ 1 2 3 4 Нетрусов, Котова, 2012, с. 187.
- ↑ D. A. Bryant, N.-U. Frigaard. Prokaryotic photosynthesis and phototrophy illuminated (англ.) // Trends Microbiol. : journal. — 2006. — November (vol. 14, no. 11). — P. 488. — doi:10.1016/j.tim.2006.09.001. — PMID 16997562.
- ↑ Нетрусов, Котова, 2012, с. 207.
- ↑ 1 2 Нетрусов, Котова, 2012, с. 204.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп.. — М.: Издательский центр «Академия», 2012. — С. 46. — 384 с. — ISBN 978-5-7695-7979-0.
- Гусев М.В, Минеева Л.А. Микробиология. — 4-е издание, стереотипное. — Москва: Издательский центр «Академия», 2003. — 464 с. — ISBN 5-7695-1403-5.
- Большая Советская Энциклопедия (рус.). Дата обращения 22 января 2010. Архивировано 15 апреля 2012 года.
- Биология и медицина — Пурпурные бактерии (рус.). Дата обращения 22 января 2010.
- Билич Г. Л., Крыжановский В. А. Биология. Полный курс: В 4 т. — издание 5-е, дополненное и переработанное. — М.: Издательство Оникс, 2009. — Т. 1. — 864 с. — ISBN 978-5-488-02311-6
Серобактерии — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 ноября 2018; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 ноября 2018; проверки требуют 3 правки. Пример бактериального мата Thioploca
Пример бактериального мата Thioploca Серобактерии (Тиобактерии) — весьма разнородная группа прокариотов, окисляющих восстановленные соединения серы.
К серобактериям относят многие фототрофные бактерии (пурпурные и зелёные серобактерии, некоторые цианобактерии), а также целый ряд нефотосинтезирующих (бесцветных серых) бактерий (с особенно низкой степенью родства, даже внутри родов)[1]. Обитают в пресных и солёных водах. Изучение серобактерий послужило С. Н. Виноградскому основанием для установления хемосинтеза.
Энергию для синтеза органических веществ они получают, окисляя сероводород
- 2h3S+O2⟶2h3O+2S{\displaystyle {\mathsf {2H_{2}S+O_{2}\longrightarrow 2H_{2}O+2S}}}
или другие восстановленные соединения серы: сульфиды металлов, полисульфиды, неорганические тиосульфаты, политионаты, молекулярную серу.
Основным продуктом окисления соединений серы являются сульфаты. Некоторые серобактерии способны к неполному окислению — например, до элементарной серы. Некоторые из таких бактерии способны накапливать хлопья серы в клетках (pоды Chromatiaceae) или вне клеток (рода из группы зелёных серных, pоды Ectothiorhodospiraceae) и в условиях нехватки сероводорода окислять их дальше, до сульфат-иона:
- 2S+3O2+2h3O⟶2h3SO4+Q{\displaystyle {\mathsf {2S+3O_{2}+2H_{2}O\longrightarrow 2H_{2}SO_{4}+Q}}}
Промежуточными продуктами окисления являются тиосульфат-ион (S2O32-), сульфит-ион (SO32-), тетратионат-ион (S4O62-)[1].
Бактерии, способные к микролитотрофии с использованием восстановленных соединений серы или способные окислять соединения серы, не используя их в качестве источника энергии:
Пурпурные серобактерии:
Зелёные серобактерии[2]:
- Тип Chlorobi
- Семейство Chlorobiaceae (все роды)
Представители цианобактерий
Сульфидоокисляющие археи[1]:
Известны симбиозы сульфидокисляющих бактерий с трубчатыми червями и моллюсками, обитающими в донных гидротермах, а также с моллюсками, морскими ежами и другими беспозвоночными, обитающими на границе кислородной и бескислородной зоны литоральных илов.
Серные бактерии, образуя серную кислоту, способствуют разрушению горных пород, каменных и металлических сооружений. Колоссальное количество серных бактерий имеется в Чёрном море, где на глубине около 200 м вода насыщена сероводородом.
Илы, содержащие серобактерий, применяют для очистки сточных вод от сероводорода (за счёт превращения его в сульфат), а также для выщелачивания сульфидных руд. Предлагают использовать для очистки стоков штаммы бактерий, окисляющие сульфид до элементарной серы — это решает проблемы необходимости аэрации (для аэробных серобактерий), утечки сероводорода в атмосферу (издержки аэрации), коррозии труб, закисления почв и активации сульфатредукторов в местах выхода сточных вод. Закисление почв, прежде богатых сульфидами, в результате деятельности сульфидокислителей бывает весьма значительным (до pH = 1), что делает такие почвы непригодными для растений. Также известны случаи коррозии бетонных конструкций (например, канализационных труб) с участием этих бактерий — бетон содержит серу, которую серобактерии окисляют до сульфата, что повышает концентрацию протонов в растворе у поверхности труб — что, в свою очередь, ведёт к растворению карбонатов, входящих в состав бетона, и к интенсивному разрушению труб[1].
- ↑ 1 2 3 4 Современная микробиология. Прокариоты: В 2-х томах / Под ред. Й. Ленглера, Г. Древса, Г. Шлегеля. — М.: Мир, 2005.
- ↑ Нетрусов А. И., Котова И. Б. Микробиология: учебник для студентов вузов. — М.: Академия, 2006. — 352 с.
Бактероиды — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 июня 2015; проверки требуют 19 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 июня 2015; проверки требуют 19 правок.Бактероиды[2] (лат. Bacteroides) — род грамотрицательных анаэробных палочковидных бактерий семейства Bacteroidaceae.
Являются представителями нормальной микрофлоры кишечника, составляют примерно 1010 — 1011 клеток на грамм сухих каловых масс[3][4]. Бактероиды вовлечены в процессы сбраживания углеводов, утилизации белков и биотрансформации жёлчных кислот[5]. Некоторые виды патогенны, способны вызывать так называемые анаэробные инфекции у человека.
Хемоорганогетеротрофы, облигатные анаэробы (в литературе имеется информация, что Bacteroides fragilis[en] способен расти при низких концентрациях кислорода (до 500 нМ)[6]). Основными продуктами брожения являются уксусная кислота, изовалериановая кислота, янтарная кислота. Основным источником энергии являются полисахариды[7]. Способны восстанавливать холестерин[8], гидролизовать мукополисахарид хондрин сульфат[9]. Не образуют индол, синтезируют каталазу, гидролизуют эскулин[10], сбраживают различные углеводы. Грамотрицательные, палочковидные неподвижные бактерии, не образуют спор, имеют полисахаридную капсулу, состоящую из двух полисахаридов[11].
Геномы изученных видов представлены кольцевыми двуцепочечными молекулами ДНК, процент % Г+Ц пар составляет 40—48 %[12][13][14], обнаружен транспозон, переносимый при конъюгации[15], также обнаружена возможность переноса генетической информации между Escherichia coli и Bacteroides fragilis[16] и так называемые «челночные» плазмиды для осуществления такого переноса[17].
Некоторые бактероиды способны вызывать так называемые анаэробные инфекции[18]. Представители родов Bacteroides, Prevotella, и Porphyromonas объединены в единый патокомплекс[19], представители этих родов способны вызывать хронический синусит, хроническое воспаление среднего уха, инфекции ротовой полости, различные абсцессы и некротическую пневмонию[20], токсигенные Bacteroides fragilis ассоциированны с воспалительной диареей[21]. Bacteroides fragilis вырабатывает энтеротоксин, стимулирующий дегенерацию эпителиоцитов кишечника человека[22] и разрезание Е-кадгерина[23]. Побочные продукты метаболизма представителей рода Bacteroides ингибирует функцию полиморфноядерных лейкоцитов человека[24]. Также известны данные об антибиотикорезистентности Bacteroides fragilis[25].
- ↑ 1 2 Genus Bacteroides (англ.). LPSN. (Проверено 6 мая 2017).
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии / Под ред. А. А. Воробьева, А. С. Быкова. — М.: Медицинское информационное агентство, 2003. — С. 62. — ISBN 5-89481-136-8.
- ↑ Finegold, S. M., Sutter V. L., Mathisen G. E. Normal indigenous intestinal flora, p. 3-31. In D. J. Hentges (ed.), 1983, Human intestinal microflora in health and disease. Academic Press, New York.
- ↑ Moore, W. E. C., Holdeman L. V. Human fecal flora: the normal flora of 20 Japenese-Hawaiians // Appl. Microbiol., 1974. № 27 Р. 961—979.
- ↑ Hentges, D. J. Anaerobes as normal flora, p. 37—53. In S. M. Finegold and W. L. George (ed.), Anaerobic infections in humans. Academic Press, San Diego, 1989.
- ↑ Bacteroides fragilis: Not as Anaerobic as We Thought — Journal Watch Infectious Diseases (недоступная ссылка)
- ↑ Xu J., Gordon J. I. Inaugural Article: Honor thy symbionts // Proc. Natl. Acad. Sci. USA, Sep 2003, Vol. 100, № 18, P. 10452
- ↑ Bacteroides sp. Strain D8, the First Cholesterol-Reducing Bacterium Isolated from Human Feces
- ↑ DIGESTION-OF-PROTEOGLYCAN-BY-BACTEROIDES-THETAIOTAOMICRON (неопр.) (недоступная ссылка). Дата обращения 30 августа 2008. Архивировано 10 ноября 2013 года.
- ↑ Кремлёв А. М., Менделеев Д. И.,. Эскулин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- ↑ The capsular polysaccharide of Bacteroides fragilis comprises two ionically linked polysaccharides. — JBC
- ↑ Bacteroides fragilis
- ↑ Virology Journal | Full text | Genome sequence of the Bacteroides fragilis phage ATCC 51477-B1
- ↑ Bacteroides thetaiotaomicron VPI-5482 Genome Page (недоступная ссылка)
- ↑ Abstracts: A new Bacteroides conjugative transposon that carries an ermB gene. Feedback-resistant acetohydroxy acid synthase increases valine production in Corynebacterium glu …
- ↑ Plasmid transfer from Escherichia coli to Bacteroides fragilis: differential expression of antibiotic resistance phenotypes — PNAS
- ↑ Family of Shuttle Vectors for Ruminal Bacteroides
- ↑ Bacteroides Infection: eMedicine Infectious Diseases
- ↑ Bacteroides, Prevotella, and Porphyromonas species… [Int J Antimicrob Agents. 2000 — PubMed result]
- ↑ Red Book® Online — Sign In Page
- ↑ Association of enterotoxigenic Bacteroides fragilis infection with …
- ↑ Bacteroides fragilis toxin stimulates intestinal epithelial cell shedding and {gamma}-secretase-dependent E-cadherin cleavage — Wu et al. 120 (11): 1944 — Journal of Cell Science
- ↑ Bacteroides fragilis enterotoxin cleaves the zonula adherens protein, E-cadherin — PNAS
- ↑ Arch Surg — Abstract: A Bacteroides By-product Inhibits Human Polymorphonuclear Leukocyte Function, January 1986, Rotstein et al. 121 (1): 82
- ↑ Резистентность к антибиотикам анаэробных бактерий группы Bacteroides fragilis, выделенных в Европе
Научные базы данных[править | править код]
Анаэробные организмы - это... Что такое Анаэробные организмы?
Аэробные и анаэробные бактерии предварительно идентифицируются в жидкой питательной среде по градиенту концентрации O2:1. Облигатные аэробные (нуждающиеся в кислороде) бактерии в основном собираются в верхней части пробирки, чтобы поглощать максимальное количество кислорода. (Исключение: микобактерии — рост пленкой на поверхности из-за восколипидной мембраны.)
2. Облигатные анаэробные бактерии собираются в нижней части, чтобы избежать кислорода (либо не дают роста).
3. Факультативные бактерии собираются в основном в верхнем (окислительное фосфорилирование является наиболее выгодным, чем гликолиз), однако они могут быть найдены на всем протяжении среды, так как от O2 не зависят.
4. Микроаэрофилы собираются в верхней части пробирки, но их оптимум — малая концентрация кислорода.
5. Аэротолерантные анаэробы не реагируют на концентрации кислорода и равномерно распределяются по пробирке.
Анаэробы — организмы, получающие энергию при отсутствии доступа кислорода путем субстратного фосфорилирования, конечные продукты неполного окисления субстрата при этом могут быть окислены с получением большего количества энергии в виде АТФ в присутствии конечного акцептора протонов организмами, осуществляющими окислительное фосфорилирование.
Анаэробы — обширная группа организмов, как микро-, так и макроуровня:
Помимо этого анаэробное окисление глюкозы играет важную роль в работе поперечно-полосатой мускулатуры животных и человека (особенно в состоянии тканевой гипоксии).
Термин «анаэробы» ввел Луи Пастер, открывший в 1861 году бактерии маслянокислого брожения. Анаэробное дыхание — совокупность биохимических реакций, протекающих в клетках живых организмов при использовании в качестве конечного акцептора протонов не кислорода, а других веществ (например, нитратов) и относится к процессам энергетического обмена (катаболизм, диссимиляция), которые характеризуются окислением углеводов, липидов и аминокислот до низкомолекулярных соединений.
Степень аэробности среды
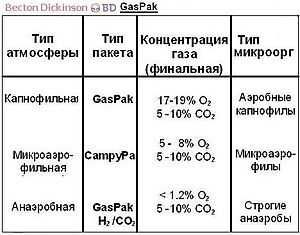 Интерполяция руководства к системам BD Gaspak, описывающая условия среды генерируемые пакетом[1]
Интерполяция руководства к системам BD Gaspak, описывающая условия среды генерируемые пакетом[1] Для измерения потенциала среды М. Кларк предложил использовать величину pH20 — отрицательный логарифм парциального давления газообразного водорода. Диапазон [0-42,6] характеризует все степени насыщения водного раствора водородом и кислородом. Аэробы растут при более высоком потенциале [14-20], факультативные анаэробы [0-20], а облигатные — при наиболее низком [0-10].[2]
Классификация анаэробов
Согласно устоявшейся в микробиологии классификации, различают:
- Факультативные анаэробы
- Капнеистические анаэробы и микроаэрофилы
- Аэротолерантные анаэробы
- Умеренно-строгие анаэробы
- Облигатные анаэробы
Если организм способен переключаться с одного метаболического пути на другой (например, с анаэробного дыхания на аэробное и обратно), то его условно относят к факультативным анаэробам[3].
До 1991 года в микробиологии выделяли класс капнеистических анаэробов, требовавших пониженной концентрации кислорода и повышенной концентрации углекислоты (Бруцеллы бычьего типа — B. abortus)[2]
Умеренно-строгий анаэробный организм выживает в среде с молекулярным O2, однако не размножается. Микроаэрофилы способны выживать и размножаться в среде с низким парциальным давлением O2.
Если организм не способен «переключиться» с анаэробного типа дыхания на аэробный, но не гибнет в присутствии молекулярного кислорода, то он относится к группе аэротолерантных анаэробов. Например, молочнокислые и многие маслянокислые бактерии
Облигатные анаэробы в присутствии молекулярного кислорода O2 гибнут — например, представители рода бактерий и архей: Bacteroides, Fusobacterium, Butyrivibrio, Methanobacterium). Такие анаэробы постоянно живут в лишенной кислорода среде. К облигатным анаэробам относятся некоторые бактерии, дрожжи, жгутиковые и инфузории.
Токсичность кислорода и его форм для анаэробных организмов
Среда с содержанием кислорода является агрессивной по отношению к органическим формам жизни. Это связано с образованием активных форм кислорода в процессе жизнедеятельности или под действием различных форм ионизирующего излучения, значительно более токсичных, чем молекулярный кислород O2. Фактор, определяющий жизнеспособность организма в среде кислорода[4] — наличие у него функциональной антиоксидантной системы, способной к элиминации:супероксид-аниона(O2−),перекиси водорода(H2O2), синглетного кислорода(O.), а также молекулярного кислорода (O2) из внутренней среды организма. Наиболее часто подобная защита обеспечивается одним или несколькими ферментами:
- супероксиддисмутаза, элиминирующая супероксид-анион(O2−) без энергетической выгоды для организма
- каталаза, элиминирующая перекись водорода(H2O2) без энергетической выгоды для организма
- цитохром- фермент, отвечающий за перенос электронов от NAD•H к O2. Этот процесс обеспечивает существенную энергетическую выгоду организму.
Аэробные организмы содержат чаще всего три цитохрома, факультативные анаэробы — один или два, облигатные анаэробы не содержат цитохромов.
Анаэробные микроорганизмы могут активно воздействовать на среду[2] , создавая подходящий окислительно-восстановительный потенциал среды (напр. Cl.perfringens). Некоторые засеянные культуры анаэробных микроорганизмов, прежде чем начать размножаться, снижают pH20 с величины [20-25] до [1-5], ограждая себя восстановительным барьером, другие — аэротолерантные — в процессе жизнедеятельности продуцируют перекись водорода, повышая pH20[5].
Дополнительная антиоксидантная защита может обеспечиваться синтезом или накоплением низкомолекулярных антиоксидантов: витамина С, А, E, лимонной и других кислот.
Получение энергии путем субстратного фосфорилирования. Брожение. Гниение.
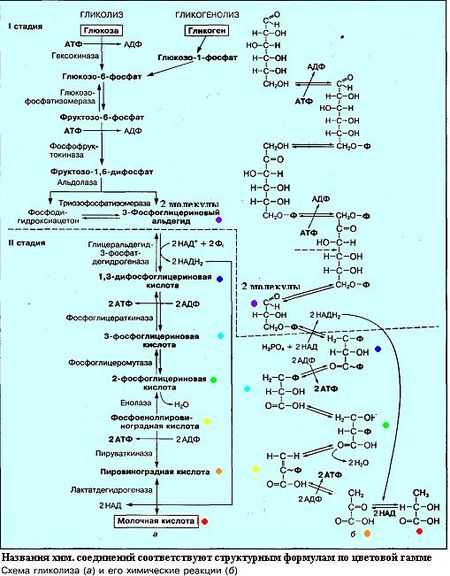 Схема гликолиза с образованием молочной кислоты
Схема гликолиза с образованием молочной кислоты - Также анаэробные организмы могут получать энергию путем катаболизма аминокислот и их соединений (пептидов, белков). Такие процессы именуют гниением, а микрофлору в энергетическом обмене которой преобладают процессы катаболизма аминокислот называют гнилостной.
- Анаэробные микроорганизмы расщепляют гексозы (например, глюкозу) разными путями:
- Гликолиз (Путь Эмдена-Мейергофа) после которого продукт подвергается брожению
- окислительный пентозофосфатный путь (другие названия: Фосфогликонатный путь, иначе гексозомонофосфатный(ГКМ), иначе путь Варбурга — Диккенса — Хореккера)
- Путь Энтнера — Дудорова (особенно значимый, когда субстратами служат глюконовая, маннановая, гексуроновые кислоты или их производные)
В качестве примера организма, сбраживающего сахара по пути Энтнера — Дудорова, можно привести облигатно анаэробную бактерию Zymomonas mobilis. Однако ее изучение позволяет предполагать, что Z. mobilis — вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен и у некоторых клостридиев, что еще раз подчеркивает неоднородность эубактерий, объединенных в эту таксономическую группу.[6].
При этом характерным только для анаэробов является гликолиз, который в зависимости от конечных продуктов реакции разделяют на несколько типов брожению:
В результате расщепления глюкозы расходуется 2 молекулы, а синтезируется 4 молекулы АТФ. Таким образом общий выход АТФ составляет 2 молекулы АТФ и 2 молекулы НАД·Н2. Полученный в ходе реакции пируват утилизируется клеткой по-разному в зависимости от того, какому типу брожения она следует.
Антагонизм брожения и гниения
В процессе эволюции сформировался и закрепился биологический антагонизм бродильной и гнилостной микрофлоры:
Расщепление микроорганизмами углеводов сопровождается значительным снижением pH среды, в то время как расщепление белков и аминокислот — повышением (защелачиванием). Приспособление каждого из организмов к определенной реакции среды играет важнейшую роль в природе и жизни человека, например, благодаря бродильным процессам предотвращается загнивание силоса, заквашенных овощей, молочных продуктов.
Культивирование анаэробных организмов
 Выделение чистой культуры анаэробов схематично
Выделение чистой культуры анаэробов схематично Культивирование анаэробных организмов в основном является задачей микробиологии.
Сложнее дело обстоит с культивированием анаэробных многоклеточных организмов, поскольку для их культивирования часто необходима специфическая микрофлора, а также определённые концентрации метаболитов. Применяется, например, при исследовании паразитов человеческого организма.
Для культивирования анаэробов применяют особые методы, сущность которых заключается в удалении воздуха или замены его специализированной газовой смесью (или инертными газами) в герметизированных термостатах — анаэростатах[7].
Другим способом выращивания анаэробов(чаще всего микроорганизмов) на питательных средах — добавление содержащих редуцирующие вещества (глюкозу, муравьинокислый натрий и др.), уменьшающие окислительно-восстановительный потенциал.
Общие питательные среды для анаэробных организмов
Для общей среды Вильсона — Блера базой является агар-агар с добавлением глюкозы, сульфита натрия и двуххлористого железа. Клостридии образуют на этой среде колонии чёрного цвета за счет восстановления сульфита до сульфид — аниона, который соединяясь с катионами железа (II) дает соль чёрного цвета. Как правило, черные на этой среде образования колонии, появляются в глубине агарового столбика.[8]
Среда Китта — Тароцци состоит из мясопептонного бульона, 0,5% глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20 — 30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина или вазелинового масла для изоляции от доступа кислорода.
Общие методы культивирования для анаэробных организмов
GasPak — система химическим путем обеспечивает постоянство газовой смеси, приемлемой для роста большинства анаэробных микроорганизмов. В герметичном контейнере, в результате реакции воды с таблетками боргидрида натрия и бикарбоната натрия образуется водород и диоксид углерода. Водород затем реагирует с кислородом газовой смеси на палладиевом катализаторе с образованием воды, уже вторично вступающей в реакцию гидролиза боргидрида.
Данный метод был предложен Брюером и Олгаером в 1965 году. Разработчики представили одноразовый пакет, генерирующий водород, который был позднее усовершенствован ими до саше, генерирующих двуокись углерода и содержащих внутренний катализатор[9][10].
Метод Цейсслера применяется для выделения чистых культур спорообразующих анаэробов. Для этого производят посев на среду Китт-Тароцци, прогревают 20 мин при 80 °C (для уничтожения вегетативной формы), заливают среду вазелиновым маслом и инкубируют 24 ч в термостате. Затем производят посев на сахарно-кровяной агар для получения чистых культур. После 24-часового культивирования интересующие колонии изучаются — их пересеивают на среду Китт-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод ФортнераМетод Фортнера — посевы производят на чашку Петри с утолщенным слоем среды, разделённым пополам узкой канавкой, вырезанной в агаре. Одну половину засевают культуру аэробных бактерий, на другую — анаэробных. Края чашки заливают парафином и инкубируют в термостате. Первоначально наблюдают рост аэробной микрофлоры, а затем (после поглощения кислорода) — рост аэробной резко прекращается и начинается рост анаэробной.
Метод Вейнберга используется для получения чистых культур облигатных анаэробов. Культуры, выращенные на среде Китта-Тароцци, переносят в сахарный бульон. Затем одноразовой пастеровской пипеткой материал переносят в узкие пробирки (трубки Виньяля) с сахарным мясо-пептонным агаром, погружая пипетку до дна пробирки. Засеянные пробирки быстро охлаждают, что позволяет фиксировать бактериальный материал в толще затвердевшего агара. Пробирки инкубируют в термостате, а затем изучают выросшие колонии. При обнаружении интересующей колонии на её месте делают распил, материал быстро отбирают и засеивают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод ПеретцаМетод Перетца — в расплавленный и охлаждённый сахарный агар-агар вносят культуру бактерий и заливают под стекло, помещённое на пробковых палочках(или фрагментах спичек) в чашку Петри. Метод наименее надежен из всех, но достаточно прост в применении.
Дифференциально — диагностические питательные среды
- Среды Гисса («пестрый ряд»)
- Среда Ресселя (Рассела)
- Среда Эндо
- Среда Плоскирева или бактоагар «Ж»
- Висмут-сульфитный агар
Среды Гисса: К 1 % пептонной воде добавляют 0,5 % раствор определенного углевода (глюкоза, лактоза, мальтоза, маннит, сахароза и др.) и кислотно-щелочной индикатор Андреде, разливают по пробиркам, в которые помещают поплавок для улавливания газообразных продуктов, образующихся при разложении углеводородов.
Среда Ресселя (Рассела) применяется для изучения биохимических свойств энтеробактерий(шигелл, сальмонелл). Содержит питательный агар-агар, лактозу, глюкозу и индикатор (бромтимоловый синий). Цвет среды травянисто-зелёный. Обычно готовят в пробирках по 5 мл со скошенной поверхностью. Посев осуществляют уколом в глубину столбика и штрихом по скошенной поверхности.
Среда Эндо
Среда Плоскирева (бактоагар Ж) — дифференциально-диагностическая и селективная среда, поскольку подавляет рост многих микроорганизмов, и способствует росту патогенных бактерий (возбудителей брюшного тифа, паратифов, дизентерии). Лактозоотрицательные бактерии образуют на этой среде бесцветные колонии, а лактозоположительные — красные. В составе среды — агар, лактоза, бриллиантовый зелёный, соли желчных кислот, минеральные соли, индикатор (нейтральный красный).
Висмут-сульфитный агар предназначен для выделения сальмонелл в чистом виде из инфицированного материала. Содержит триптический гидролизат, глюкозу, факторы роста сальмонелл, бриллиантовый зелёный и агар. Дифференциальные свойства среды основаны на способности сальмонелл продуцировать сероводород, на их устойчивости к присутствию сульфида, бриллиантового зелёного и лимоннокислого висмута. Маркируются колонии в чёрный цвет сернистого висмута (методика схожа со средой Вильсона — Блера).
Метаболизм анаэробных организмов
Метаболизм анаэробных организмов имеет несколько различных подгрупп:
Анаэробный энергетический обмен в тканях человека и животных[12]
Анаэробное и аэробное энергообразование в тканях человекаНекоторые ткани животных и человека отличаются повышенной устойчивостью к гипоксии (особенно мышечная ткань). В обычных условиях синтез АТФ идет аэробным путем, а при напряженной мышечной деятельности, когда доставка кислорода к мышцам затруднена, в состоянии гипоксии, а также при воспалительных реакциях в тканях доминируют анаэробные механизмы регенерации АТФ. В скелетных мышцах выявлены 3 вида анаэробных и только один аэробный путь регенерации АТФ.
3 вида анаэробного пути синтеза АТФК анаэробным относятся:
- Креатинфосфатазный (фосфогеный или алактатный) механизм — перефосфорилирование между креатинфосфатом и АДФ
- Миокиназный — синтез (иначе ресинтез) АТФ при реакции трансфосфорилирования 2 молекул АДФ(аденилатциклаза)
- Гликолитический — анаэробное расщепление глюкозы крови или запаса гликогена, заканчивающийся образованием молочной кислоты (иначе именуется «лактатным»).
Необходимо отметить, что прямым следствием гликолиза является критическое снижение рН тканей — ацидоз. Это ведет к снижению эффективного транспорта кислорода гемоглобином, и формирует положительную обратную связь.
Каждый механизм имеет свое время удержания максимальной мощности и оптимум энергообеспечения тканей. Наибольшая мощность и наименьшее время удержания:
- креатинфосфаткиназный механизм (3600 Дж/(кг·мин), при времени 6—12 сек)
- лактатный (2510 Дж/(кг·мин), при времени 30—60 сек)
- аэробный (600 Дж/(кг·мин), при времени около 600 секунд).
Примечания
- ↑ Газогенерирующие контейнерные системы GasPak: Инструкция МК. — OOO "МК, официальный дистрибьютер Becton Dickinson International", 2010. — С. 7.
- ↑ 1 2 3 К. Д. Пяткин. Микробиология с вирусологией и иммунологией. — М:"Медицина", 1971. — С. 56.
- ↑ Л. Б. Борисов. Медицинская микробиология, вирусология и иммунология. — МИА, 2005. — С. 154-156. — ISBN 5-89481-278-X
- ↑ Д. Г. Кнорре. Биологическая химия:Учеб. для хим., биол. и мед.спец.вузов. — 3. — М.:Высшая школа, 2000. — С. 134. — ISBN 5-06-003720-7
- ↑ D. A. Eschenbach, P. R. Davick, B. L. Williams. Prevalence of hydrogen peroxide-producing Lactobacillus species in normal women and women with bacterial vaginosis. — J Clin Microbiol. 1989 February; 27(2): 251–256.
- ↑ М. В. Гусев, Л. А. Минеева. Микробиология. — М:МГУ, 1992. — С. 56.
- ↑ А. А. Воробьев. Атлас по медицинской микробиологии, вирусологии и иммунологии. — МИА, 2003. — С. 44. — ISBN 5-89481-136-8
- ↑ Л. Б. Борисов. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии. — Медицина, 1992. — С. 31-44. — ISBN 5-2225-00897-6
- ↑ J. H. Brewer, D. L. Allgeier. Disposable hydrogen generator. — Science 147:1033-1034. — 1966.
- ↑ J. H. Brewer, D. L. Allgeier. Safe self-contained carbon dioxide-hydrogen anaerobic system. — Appl. Microbiol.16:848-850. — 1966.
- ↑ G. F. Smirnova. Metabolism peculiarities of bacteria restoring chlorates and perchlorates. — Microbiol Z. 2010 Jul-Aug;72(4):22-8.
- ↑ Филиппович Ю. Б., Коничев А. С., Севастьянова Г. А. Биохимические основы жизнедеятельности организма человека. — Владос, 2005. — С. 302. — ISBN 5-691-00505-7
См. также
Ссылки
Микробиом человека — Википедия
Микробиом человека представляет собой совокупность всех микробов населяющих организм человека[1], включая такие его участки как кожа, молочные железы, половые органы, легкие, слизистые оболочки,
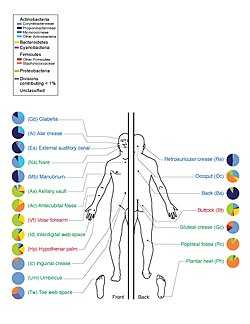 Микробиота кожи человека, с относительным распространением бактерий различных классов
Микробиота кожи человека, с относительным распространением бактерий различных классов биологические жидкости, желчевыводящие пути и желудочно-кишечный тракт.
Микробиом человека включает себя бактерии, археи, грибы, протисты и вирусы. Хотя микроорганизмы могут также жить на теле человека, они обычно исключаются из этого определения. В контексте геномики термин « микробиом человека» иногда используется для обозначения коллективных геномов резидентных микроорганизмов;[2] Однако термин «метагеном человека» имеет то же значение.
Первая оценка о количестве микроорганизмов, населяющих человека, говорит о том, что число клеток микробов в десять раз больше, чем число клеток человека, однако более поздние оценки снизили это соотношение до 3: 1 или даже приблизительно до того же числа.[3][4][5][6] Часть микроорганизмов в организме человека являются комменсальными, то есть они сосуществуют, не причиняя вреда людям; другие имеют муталистические (взаимовыгодные) отношения со своими хозяевами.[2][7] И наоборот, некоторые непатогенные микроорганизмы могут нанести вред организму человека посредством производимых ими метаболитами, такими как триметиламин, который человеческий организм превращает в N-оксид триметиламина посредством окисляющего комплекса FMO3.[8][9] Определенные микроорганизмы выполняют ряд очень важных задач, которые, как известно, полезны для человека-хозяина, однако роль большинства из них не совсем понятна. Нормальной же микробиотой иногда считается та, которая должна присутствовать при нормальных обстоятельствах, не вызывая заболевания.[2]
Для анализа микробиоты человека был проведён проект «Микробиом человека», решающий ряд таких задач как секвенирование и анализ генома микробиоты человека, уделяя особое внимание микробиоте, населяющую кожу, рот, нос, пищеварительный тракт и влагалище.[2] Он достиг вехи в 2012 году, когда опубликовал свои первоначальные результаты.[10]
Несмотря на то, что такие термины как флора или микрофлора часто используются в литературе, в технических терминах это является неправильным понятием, поскольку корень слова «флора» относится к растениям, а термин биота относится к совокупности организмов в конкретной экосистеме. В настоящее время применяется более подходящий термин « микробиота», хотя его использование не затмило укоренившееся использование и распознавание флоры в отношении бактерий и других микроорганизмов. Оба термина используются в различной литературе.[11]
Хронология эволюции, млн. летПо состоянию на 2014 год в различных источниках часто сообщалось, что число микробных клеток в организме человека примерно в 10 раз больше, чем число клеток человека. Эта цифра основана на оценках того, что микробиом человека насчитывает порядка 100 триллионов бактериальных клеток, и 10 триллионов собственных клеток взрослого человека.[12] В 2014 году Американская академия микробиологии опубликовала часто задаваемые вопросы, в которых подчеркивалось, что число микробных клеток и количество клеток человека являются приблизительными. Также они отметили, что недавние исследования позволили получить новую оценку количества клеток человека – приблизительно 37,2 триллиона, что означает, что отношение микробных к человеческим клеткам при первоначальной оценке 100 триллионов бактериальных клеток верна, ближе к 3: 1.[12][13] В 2016 году другой научной группой была произведена новая оценка, показавшая, что соотношение составляет примерно 1: 1.[6][14]
Проблема определения микробиома связана с идентификацией членов микробного сообщества, которое включает бактерии, эукариоты и вирусы.[15] В основном для идентификации этих сообществ используется ДНК, хотя также известны случаи использования РНК, белков и метаболитов.[15][16] Исследования микробиома на основе ДНК обычно можно отнести к недавним метагеномным исследованиям с использованием метода дробовика (shotgun sequencing) . Данный метод представляет собой целый метагеномный подход, который также можно использовать для изучения функционального потенциала различных сообществ.[15] Одна из проблем, которая присутствует в исследованиях микробиома человека, состоит в том, чтобы в исследование не было вовлечено человеческое ДНК.[17]
Один из основных вопросов, помимо простого анализа микробиома человека, заключается в том, существует ли общий «скелет», либо существует общая группа микроорганизмов, которая в дальнейшем имеет видовое разнообразие у людей.[18][19] Если такой скелет существует, то можно было бы выявить возникающие болезни в зависимости от изменения видового состава, что является одной из целей проекта «Микробиом человека». Известно, что микробиом человека (микробиом кишечника) сильно варьируется и является уникальным для всех людей, что также наблюдалось у тестируемых групп мышей.[20]
13 июня 2012 года директор NIH Фрэнсис Коллинз сделал заявление о важности проекта «Микробиом человека» (HMP).[21] Заявление сопровождалось серией научных статей, опубликованных в журнале Nature[22][23] и Публичной научной библиотеке (PLoS) в тот же день. Анализируя карту микробиома здоровых людей с использованием методов секвенирования генома, учёные создали справочную базу данных для нормальных вариаций микробных сообществ. Из 242 здоровых добровольцев были собрано более 5000 биологических образцов, взятых с различных участков тела. В результате был произведён анализ полной ДНК человека и населяющей его микробиоты. Интерпретировать такие данные смогли путём идентификации генов бактериальной рибосомальной РНК, 16S рРНК. Исследователи выявили, что более 10000 видов микроорганизмов составляют сложную экосистему у человека, определив 81-99 % родов в такой экосистеме.
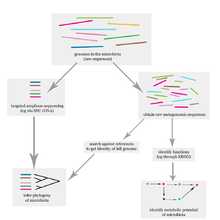 Блок-схема, иллюстрирующая, как человеческий микробиом изучается на уровне ДНК.
Блок-схема, иллюстрирующая, как человеческий микробиом изучается на уровне ДНК. Метод дробовика[править | править код]
Зачастую бывает невозможным культивировать огромное разнообразие бактерий, архей или вирусов, в лабораторных условиях. Решением проблемы становится внедрение технологий секвенирования, используемых в технологии метагеномики. Анализ полной картины функционирования и характеризация специфичных микробных штаммов несут в себе огромный потенциал для открытий терапии и диагностики состояний здоровья.[24]
Сбор образцов и выделение ДНК[править | править код]
Главной задача состоит в том, чтобы собрать достаточное для анализа количество микробной ДНК, при это сохранив чистоту данного образца; по этой причине используются различные методы обогащения. В частности метод экстракции ДНК является универсальным инструментом при работе с каждым бактериальным штаммом, где важно изолировать устойчивые участки генома, которые не поддаются быстрому лизису. Механическое разрушение, как правило, более предпочтительно чем химическое.[24]
Подготовка библиотеки данных и секвенирование[править | править код]
Наиболее часто для реакций секвенирования используются такие платформы как Illumina, Ion Torrent, Oxford Nanopore MinION и Pacific Bioscience Sequel. Нет никаких указаний относительно правильного количества образца для его использования.[24]
Сборка метагенома[править | править код]
Несмотря на то, что подход активно используется, существуют некоторые трудности, которые необходимо преодолеть. Охват зависит от обилия каждого генома в его конкретном сообществе; геномы с низкой численностью могут подвергаться фрагментации, если глубина секвенирования недостаточна (используется для того чтобы удалось избежать образования пробелов). К счастью, существуют ассемблеры, упрощающих поиск корреляции для метагенома, поскольку, если присутствуют сотни штаммов, глубина секвенирования должна быть увеличена до максимума.[24]
Контин Биннинг[править | править код]
Априори не известно ни от какого генома происходит каждый континг, ни от количества геномов, присутствующих в образце. Основной целью данного шага является разделение контингов на различные виды. Основополагающие методы для осуществления данного анализа могут быть контролируемые (к примеру, базы данных с известными последовательностями) или неконтролируемые (прямой поиск континг групп в собранных данных). Однако оба метода требуют метрики для определения оценки сходства между конкретным контигом и группой, в которую он должен быть помещен, и алгоритмом для преобразования сходства в распределении группы.[24]
Анализ результатов после обработки[править | править код]
Необходимо провести ряд статистических анализов таких как ANOVA для подтверждения результатов. Такие тесты могут оценить и определить степень различия между различными группами. Если тесты связаны с графическими инструментами, то можно легко произвести интерпретацию результатов для более лёгкого представления и понимания.[24]
Как только полученный метагеном собран в правильной последовательности, можно получить функциональный потенциал микробиома. Существует ряд проблем при вычислении таких систем, так как системы сборки метагенома имеют более низкое качество из за сложности таких систем, а многие гены могут быть неполными или фрагментированными. После шага идентификации генов, данные могут быть использованы для проведения функциональной аннотации путем множественного выравнивания генов-мишеней с базами данных ортологов.[25]
Маркерный анализ генов[править | править код]
Это техника, в который используются праймеры для наведения на конкретную генетическую область с целью установления филогенетического ряда. Генетическая область характеризуется сильно изменчивой областью, которая может предоставить детальную идентификацию. Наряду с этим, существуют также консервативные области, которые функционируют как места связывания праймеров, используемых в ПЦР. Основным геном, характеризующимбактерии и археи, является 16S рРНК ген, тогда как идентификация грибков основана на Внутреннем транскрибированном спейсере (ITS). Этот метод является быстрым и достаточным для получения классификации микробного сообщества. Также метод подходит для загрязнённой ДНК (загрязнением от хозяина). Сродство праймера варьируется среди всех последовательностей ДНК, что может привести к смещению во время реакции амплификации. Следовательно, оптимизация выбора праймера может помочь уменьшить такие ошибки, при учёте полного знания микроорганизмов, присутствующих в образце, и их относительной численности.[26]
Маркерный анализ гена может зависеть от выбора праймера; в этом виде анализ желательно проводить в рамках хорошо проверенного протокола (например, тот, который используется в Проекте «Микробиом Земли»). Первый шаг в данном анализа — это удаление ошибок секвенирования. Многие платформы секвенирования очень надежны, но большая часть очевидного разнесения последовательностей по-прежнему обусловлена ошибками в процессе секвенирования. Чтобы уменьшить число этих ошибок, можно воспользоваться объединением последовательностей в Оперативную Таксономическую Единицу (OTU), которая уже в дальнейшем используется в следующем шаге. Но это метод отбрасывает ОНП, поскольку они объединяются в одну OTU. Другой подход основан на олиготипировании, которое включает специфичную информацию о секвенировании рРНК 16s для выявления небольших вариаций нуклеотидов и о различии тесно связанных отличных таксонов. Эти методы дают в качестве выходных данных таблицу последовательностей ДНК и количество различных последовательностей на образец.[26]
Другим важным шагом в анализе является присвоение таксономического названия микробным последовательностям. Это осуществляется использованием подходов, основанных на машинном обучении, достигающие точность на уровне рода около 80 %. Другие популярные аналитические пакеты обеспечивают поддержку таксономической классификации с использованием точных совпадений со справочными базами данных и должны обеспечивать большую специфичность, но обладают более худшей чувствительностью.[26]
Филогенетический анализ[править | править код]
Многие методы, основанные на филогенетическом предположении, используют 16Sр РНК гены для архей и бактерий и 18SRNA гены для эукариотических клеток. Филогенетические сравнительные методы основаны на сравнении множества признаков у микроорганизмов; принцип таков: чем ближе они связаны, тем больше у них общих черт. Обычно эти методы используют с филогенетическим обобщенным методом наименьших квадратов или другими статистическими анализами, для получения более значимых результатов. Обычно это осуществляется на основе приложения PICRUSt, использующей существующие базы данных.[27]
Филогенетическое осведомленное расстояние обычно выполняется с помощью UniFrac или подобных инструментов, таких как индекс Сорезена или индекс Рао, для количественной оценки различий между различными сообществами. На все эти методы негативно влияет горизонтальный перенос генов (HGT), поскольку это может привести к ошибкам и привести к корреляции отдаленных видов. Существуют различные способы снижения негативного воздействия HGT: использование нескольких генов или вычислительных инструментов для оценки вероятности предполагаемых событий HGT.
Бактерии[править | править код]
Бактерии и грибки населяют кожу и слизистые оболочки в различных частях тела. Их роль является частью построения нормальной, здоровой физиологии человека, однако, если численность микробов выходит за пределы их типичного диапазона (часто из-за нарушения иммунной системы), или если микробы заселяют (например, из-за плохой гигиены или травмы) участки тела, как правило, не колонизированные или стерильные (например, кровь или нижние дыхательные пути или брюшная полость) это может привести к серьёзным заболеваниям (вызывающему, соответственно, бактериемию/сепсис, пневмонию и перитонит).[28]
Результаты работы над проектом «Микробиом человека» показали, что у людей содержатся тысячи видов бактерий со своими особенностями на различных участках тела. Такие участки как кожа и влагалище обладают меньшим видовым разнообразием, чем рот и кишечник, где разнообразие крайне велико. Также, бактерии одного и того же вида, обнаруженные в ротовой полости, имеют несколько подтипов, обитающих в разных местах полости рта.[29][30]
Согласно проведённой оценке, от 500 до 1,000 видов бактерий, проживающих в кишечнике человека принадлежат нескольким группам: в основном преобладают Firmicutes и Bacteroidetes, но встречаются и Proteobacteria, Verrumicrobia, Actinobacteria, Fusobacteria и Cyanobacteria.[31]
Ряд таких бактерий как, Actinomyces viscosus и A. naeslundii, обитают в полости рта и являются частью липкого вещества, называемого зубным налётом. Если они не удалены во время чистки, вся масса затвердевает и образует зубной камень. Некоторые бактерии выделяют ряд кислот, растворяющих зубную эмаль, вызывая кариес.
Микрофлора влагалища состоит в основном из различных видов лактобацилл. Долгое время считалось, что наиболее распространенным из этих видов был Lactobacillus acidophilus, но позже было показано, что на самом деле наиболее распространенным является L. iners, за которым следует L. crispatus. Другими лактобациллами, обнаруженными во влагалище, являются L. jensenii, L. delbruekii и L. gasseri. Нарушение микрофлоры влагалища может привести к инфекциям, таким как бактериальный вагиноз или кандидоз.
Археи[править | править код]
Археи присутствуют в кишечнике человека, но в гораздо более меньших количествах чем бактерии.[32] Преобладающей группой являются метаногены, в частности Methanobrevibacter smithii and Methanosphaera stadtmanae.[33] Однако только около 50 % людей имеют легко детектируемые разновидности данных архей.[34]
По состоянию на 2007 год, не было обнаружено явных примеров патогенов,[35][36] несмотря на то, что была предложена взаимосвязь между присутствием некоторых метаногенов и пародонтитом.[37]
Грибы[править | править код]
Грибы, в частности дрожжи, присутствуют в кишечнике человека.[38][39][40][41] Наиболее изученными являются штаммы Кандиды из за их способности становиться патогенными при иммунодефиците, или даже вызывая нарушения у здорового хозяина.[39][40][41] Часть грибов колонизирует кожу,[38] такие как штаммы Malassezia, где они потребляют масла, выработанных из сальных желез.[42][43]
Вирусы[править | править код]
Вирусы, в особенности бактериальные вирусы (бактериофаги), населяют различные участки тела включая кожу,[44] кишечник,[45] лёгкие,[46] ротовую полость.[47] Была установлена взаимосвязь вирусов с некоторыми заболеваниями. Вирусы отражают сложность взаимоотношений с бактериальными сообществами.[48][49][50]
Кожа[править | править код]
Исследование 20 участков кожи на каждом из десяти здоровых людей выявило 205 идентифицированных родов в 19 бактериальных типах, при этом большинство бактерий принадлежит четырем типам: Actinobacteria (51.8 %), Firmicutes (24.4 %), Proteobacteria (16.5 %), and Bacteroidetes (6.3 %).[51] На здоровой коже человека присутствует большое количество грибковых родов с некоторыми изменениями по областям тела; однако при патологических состояниях определенные роды имеют тенденцию доминировать в пораженной области (к примеру при атопическом дерматите преобладают Malassezia).[52]
Кожа служит барьером для предотвращения проникновения патогенных микробов, являясь их постоянными или временным местом обитания. Типы резидентных микроорганизмов различаются в зависимости от типа кожи на теле человека. Большинство микробов находятся на поверхностных клетках кожи или предпочитают связываться с железами (сальными или потовыми), так как они снабжают микробов водой, аминокислотами, жирными кислотами и другими питательными веществами.[2]
Слизистая оболочка глаз[править | править код]
Небольшое количество грибов и бактерий обычно присутствуют в конъюктиве[53][54] , включая Грамположительные кокки (Staphylococcus и Streptococcus), Грамотрицатльные палочки и кокки (Haemophilus and Neisseria)[54] и грибки (Candida, Aspergillus, and Penicillium.[53] Слезы содержат бактерициды, такие как лизоцим, так что микроорганизмам трудно выжить и колонизировать эпителиальные поверхности.
Желудочно-кишечный тракт[править | править код]
Микробиом человека появляется с рождением и зависит от того, каким путём ребёнок был рождён.[55] К примеру рождение детей Кесаревым сечением привносит более патогенную микрофлору такую как Escherichia coli и Staphylococcus и гораздо увеличивает время развития непатогенной, полезной микробиоты.[56] У детей рожденных вагинально наблюдается нормальная, непатогенная полезная микробиота схожая по составу с материнской.[57]
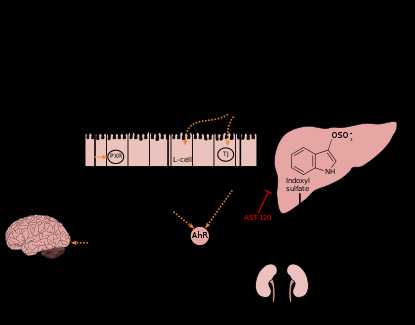 Диаграмма показывает метаболизм триптофана к индолу и производным индола в толстой кишке. Clostridium sporogenes метаболизирует индол в 3-индолпропионовую кислоту (IPA), высокоэффективный нейропротекторный антиоксидант. В кишечнике IPA связывается с рецепторами прегнана X (PXR), тем самым способствуя гомеостазу слизистой оболочки и барьерной функции. После всасывания и распределения в мозг, IPA оказывает нейропротекторное действие против церебральной ишемии и болезни Альцгеймера. Виды Lactobacillus метаболизируют индол в индол-3-альдегид (I3A), который действует на арильный углеводородный рецептор (AhR) в кишечных иммунных клетках, в свою очередь увеличивая выработку интерлейкина-22 (IL-22). Активация AhR заметно влияет на иммунитет кишечника, поддерживая функцию эпителиального барьера, повышая иммунную толерантность к комменсальной микробиоте и защищает от патогенных инфекций. Сам индол действует как секретирующий глюкагон-подобный пептид-1 (GLP-1) в клетках кишечника L и как лиганд для AhR. Индол также может метаболизироваться печенью в индоксилсульфат, соединение, которое в высоких концентрациях вредно для здоровья человека. Накопление индоксилсульфата в плазме крови токсично и связано с сосудистыми заболеваниями и почечной дисфункцией. AST-120 (активированный уголь), кишечный сорбент, который принимается внутрь, адсорбирует индол, в свою очередь, уменьшая концентрацию индоксилсульфата в плазме крови.
Диаграмма показывает метаболизм триптофана к индолу и производным индола в толстой кишке. Clostridium sporogenes метаболизирует индол в 3-индолпропионовую кислоту (IPA), высокоэффективный нейропротекторный антиоксидант. В кишечнике IPA связывается с рецепторами прегнана X (PXR), тем самым способствуя гомеостазу слизистой оболочки и барьерной функции. После всасывания и распределения в мозг, IPA оказывает нейропротекторное действие против церебральной ишемии и болезни Альцгеймера. Виды Lactobacillus метаболизируют индол в индол-3-альдегид (I3A), который действует на арильный углеводородный рецептор (AhR) в кишечных иммунных клетках, в свою очередь увеличивая выработку интерлейкина-22 (IL-22). Активация AhR заметно влияет на иммунитет кишечника, поддерживая функцию эпителиального барьера, повышая иммунную толерантность к комменсальной микробиоте и защищает от патогенных инфекций. Сам индол действует как секретирующий глюкагон-подобный пептид-1 (GLP-1) в клетках кишечника L и как лиганд для AhR. Индол также может метаболизироваться печенью в индоксилсульфат, соединение, которое в высоких концентрациях вредно для здоровья человека. Накопление индоксилсульфата в плазме крови токсично и связано с сосудистыми заболеваниями и почечной дисфункцией. AST-120 (активированный уголь), кишечный сорбент, который принимается внутрь, адсорбирует индол, в свою очередь, уменьшая концентрацию индоксилсульфата в плазме крови. Отношения между кишечной микробиотой и организмом человека не только комменсальные (безвредное сосуществование), а скорее a мутуалистическое (взаимовыгодное).[2] Некоторые микроорганизмы в кишечнике помогают хозяину усваивать различные пищевые волокна в короткоцепочечные жирные кислоты, такие как уксусная кислота или масляная кислота, которые в дальнейшем поглощаются организмом человека.[58][59] Бактерии кишечника играют важную роль в синтезе Витамина B и Витамина K, также метаболизируя жёлчные кислоты, стерины, и ксенобиотики.[2][59] В результате метаболических циклов бактерии производят вещества подобные гормонам, и по всей видимости микробиота функционирует как эндокринная железа.[59] Нарушение регуляции кишечной микробиоты коррелировало с множеством воспалительных и аутоиммунных состояний.[58][60]
Состав кишечной флоры человека изменяется со временем, когда меняется диета, а также по мере изменения общего состояния здоровья.[61][62]Систематический обзор 15 рандомизированных контролируемых исследований на людях с июля 2016 года показал, что некоторые коммерчески доступные штаммы пробиотических бактерий из родов Bifidobacterium и Lactobacillus (B. longum, B. breve, B. infantis, L. helveticus, L. rhamnosus, L. plantarum и L. casei) при приеме внутрь в суточных дозах 10 9 −10 10 колониеобразующие единицы (КОЕ) для 1-2 месяцев, обладают лечебными действиями (то есть улучшают поведенческие результаты) при некоторых расстройствах центральной нервной системы — включая тревогу, депрессию, расстройства аутистического спектра и обсессивно-компульсивное расстройство — и улучшает определенные аспекты памяти .[63] Однако, изменения микробиома также могут вызвать пагубные состояния для здоровья. В работе Musso et al., Было обнаружено, что кишечная микробиота у особей с ожирением имеет больше бактерий типа Firmicutes и меньше Bacteroidetes, чем у здоровых людей.[64] Другое исследование, проведённое Gordon et al., подтвердило, что именно состав микробиоты вызывает ожирение, а не наоборот. Это было сделано путем трансплантации кишечной микробиоты от мышей с ожирением, или мышей со специальной диетой к мышам контрольной группы мышам, лишенным микробиома. Они обнаружили, что у мышей, которым трансплантировали микробиоту кишечника от мышей больных ожирением уровень жира оказался гораздо выше при одинаковом питании нежели чем у мышей, которым пересадили микробиом, от животных с диетой.[65]
Уретра и мочевой пузырь[править | править код]
Похоже, что в мочеполовой системе имеется микробиота,[66][67] что является неожиданным фактом, по причине отсутствия результатов при анализе классическими лабораторными микробиологическими методами культивирования для обнаружения инфекции мочевыводящих путей; .[68] Классические методы культивирования не обнаруживают многие виды бактерий и других микроорганизмов.[68] Однако на основе методов секвенирования была произведена идентификация микроорганизмов, с целью определения есть ли различия в микробиоте между здоровыми людьми и людьми с проблемами мочевыводящих путей.[66][67]
Влагалище[править | править код]
Микробиота влагалища включает в себя организмы, которые играют важную роль в защите от инфекций и поддержании здоровья влагалища.[69] Наиболее распространенные микроорганизмы, обнаруженные у женщин в пременопаузе, относятся к роду Lactobacillus, подавляющие рост патогенных организмов производством перекиси водорода и молочной кислоты.[70][69][71] Композиция микробиоты сильно зависит от стадии менструального цикла.[2][72] Была установлена взаимосвязь между половыми актами, приёмами антибиотиков и потерей лактобацилл в организме женщин.[71] Более того, исследования показали, что половой акт с презервативом, по-видимому, изменяет уровень лактобацилл и увеличивает уровень кишечной палочки во влагалище.[71] Все изменения, происходящие в здоровой вагинальной микробиоте, могут указывать на развитие различных инфекций, включая кандидоз или бактериальный вагиноз.[73][70][74]
Плацента[править | править код]
До недавнего времени плацента считалась стерильной, однако было выявлено несколько непатогенных бактерий, находящихся в плацентарной ткани.[75][76][77]
Матка[править | править код]
До недавнего времени верхний репродуктивный тракт женщины считался стерильной средой. Разнообразные микроорганизмы населяют матку здоровых, бессимптомных женщин репродуктивного возраста. Микробиом матки значительно отличается от микробиома влагалища и желудочно-кишечного тракта.[78]
Ротовая полость[править | править код]
В полости рта создаются необходимые условия для роста микроорганизмов, включая воду, питательные вещества и подходящую температуру.[2] Анаэробные бактерии в полости рта включают в себя: Actinomyces, Arachnia, Bacteroides, Bifidobacterium, Eubacterium, Fusobacterium, Lactobacillus, Leptotrichia, Peptococcus, Peptostreptococcus, Propionibacterium, Selenomonas, Veillella, Trepone .[79] Роды грибов, включают, среди прочих: Candida, Cladosporium, Aspergillus, Fusarium, Glomus, Alternaria, Penicillium и Cryptococcus .[80]
Бактерии накапливаются как в твердых, так и в мягких тканях полости рта, в биопленке, позволяя им прилипать . В результате они получают защиту от факторов окружающей среды и противомикробных агентов.[81] Слюна играет ключевую роль в поддержании условий для роста биоплёнки и реколонизацию бактерий, поставляя питательные вещества и регулируя температуру. Также контролирует рост микроорганизмов посредством вымывания части биоплёнки.[82][83]
Бактерии в полости рта развили механизмы, чтобы чувствовать их окружающую среду и избегать внесение изменений в организм хозяина. Тем не менее, высокоэффективная врожденная система защиты человека постоянно контролирует бактериальную колонизацию и предотвращает бактериальную инвазию в локальные ткани. Существует динамическое равновесие между бактериями зубного налета и врожденной защитной системой организма.[84]
Здоровое равновесие представляет собой некий симбиоз, когда микробы из полости рта ограничивают рост и присоединение болезнетворных микроорганизмов, а организм человека обеспечивает условия для их роста и развития.[85][86] Изменение жизни человека, включая его иммунную систему, питание, преобразование видового состава нарушает данное равновесие из взаимовыгодного в паразитическое.[86] Было показано, что сахарный диабет и сердечно-сосудистые заболевания связаны со здоровьем полости рта.[85]
Постоянная гигиена полости рта является основным методом для предотвращения развития различных заболеваний.[87] Очистка полости рта уменьшает — разрастание потенциальных патогенных бактерий.[88] Однако правильной гигиены полости рта может быть недостаточно, так как это сложная система, в которой нужно учитывать иммунный ответ, генетику и видовой состав.[88] Антибиотики могут быть использованы при борьбе с инфекциями, однако могут быть неэффективны против биоплёнок.[88]
Лёгкие[править | править код]
Как и в случае полости рта, верхняя и нижняя дыхательная система обладают механическими средствами для удаления микробов. Бокаловидные клетки производят выделения, которые захватывают микробов и выводят их из дыхательной системы через непрерывно движущиеся ресничные эпителиальные клетки. Наряду с этим, бактерицидный эффект достигается содержанием лизоцима в слизи.[2] Легочная микробиота принадлежит 9 родам: Prevotella, Sphingomonas, Pseudomonas, Acinetobacter, Fusobacterium, Megasphaera, Veillonella, Staphylococcus, и Streptococcus. Считается, что некоторые из этих «нормальных» бактерий могут вызвать очень серьёзные заболевания, особенно у людей с ослабленным иммунитетом. Бактерии включают в себя: Streptococcus pyogenes, Haemophilus influenzae, Streptococcus pneumoniae, Neisseria meningitidis, и taphylococcus aureus. Грибковые роды, которые составляют легочный микобиом, включают Candida, Malassezia, Neosartorya, Saccharomyces, Aspergillus и другие.[89]
Необычное распределение бактериальных и грибковых родов в дыхательных путях наблюдается у людей с муковисцидозом.[89][90] Их бактериальная среда часто содержит устойчивые к антибиотикам и медленно растущие бактерии, и частота этих патогенов изменяется в зависимости от возраста.[90]
Жёлчный тракт[править | править код]
Традиционно считается, что жёлчные пути обычно стерильны, а наличие микроорганизмов в желчи является маркером патологического процесса. Это предположение было подтверждено неудачей в выделении бактериальных штаммов из нормального желчного протока. В 2013 году было показано что нормальная микробиота желчевыводящих путей представляет собой отдельный функциональный слой, который защищает желчный тракт от колонизации экзогенными микроорганизмами.
Болезнь и смерть[править | править код]
Метагеномные и эпидемиологические исследования показывают важную роль для человеческого микробиома в предотвращении широкого спектра заболеваний, от сахарного диабета 2 типа, ожирения, воспалительных заболеваний кишечника до болезни Паркинсона и даже психиатрических заболеваний, таких как депрессия.[91] Симбиотические отношения между микробиотой кишечника и различными бактериями могут влиять на иммунный ответ человека.[92] Самые передовые исследования показывают, что лечение с помощью коррекции микробиома может быть эффективным для лечения диабета.[93]
Рак[править | править код]
Несмотря на то, что рак является смесью генетических заболеваний и факторов окружающей среды, микробы вовлечены в 20 % случаев его развития.[94] Некоторые факторы рака толстой кишки показывают, что в толстой кишке число бактерий в миллион раз выше, чем в тонкой кишке, и примерно в 12 раз больше случаев рака в толстой кишке по сравнению с тонкой кишкой, что, возможно, устанавливает патогенную роль микробиоты в раке прямой кишки,[95] Микробный анализ может быть использован в качестве прогностического инструмента при оценке колоректального рака.[95]
Микробиота может влиять на канцерогенез тремя основными путями: (i) изменением баланса пролиферации и гибели опухолевых клеток, (ii) регулированием функции иммунной системы и (iii) влиянием на метаболизм, изменяя усвояемость принимаемых пищевых продуктов и фармацевтических препаратов.[95] Опухоли, развивающиеся на различных участках обычно включают микробиоту. Микробы в данных местах лучше приспосабливаются на основе пониженного содержания кислорода или источника дополнительного питания. Уменьшение популяции специфичных микробов или вызванный окислительный стресс могут увеличить риск развития рака.[94][95] Из 1030 всех известных микробов, 10 из них выделены Международным агентством по изучению рака как канцерогенные.[94][95] Бактерии могут выделять белки или другие факторы, которые непосредственно управляют пролиферацией клеток человека, что может усиливать или ослаблять иммунную систему хозяина, в том числе вызывать острое или хроническое воспаление.
Нарушение равновесия между хозяином и микробиотой снижает устойчивость к злокачественным новообразованиям, возможно вызывая воспаление и рак. После преодоления защитных барьеров микробы вызывают провоспалительные или иммуносупрессивные программы различными путями.[94] Например, связанные с раком микробы, по-видимому, активируют передачу сигналов NF-κΒ в микроокружении опухоли. Другие рецепторы, такие как Nod-подобные рецепторы могут играть роль в опосредовании колоректального рака.[94] Аналогично Helicobacter pylori aпо-видимому, увеличивает риск рака желудка из-за его хронической воспалительной реакции в желудке.[95]
Воспалительное заболевание кишечника[править | править код]
Воспалительное заболевание кишечника включают в себя язвенный колит и болезнь Крона. Эти заболевания сопровождаются нарушением состава в микробиоте кишечника (также известным как дисбиоз) и проявляется в форме уменьшения микробного разнообразия в кишечнике.[96][97] Было установлено, что дисбиоз коррелирует с дефектами генов хозяина, которые изменяют врожденный иммунный ответ у людей.[96]
Вирус иммунодефицита человека[править | править код]
Развитие заболевания ВИЧ влияет на изменение кишечной микробиоты. Вирус нарушает целостность эпителиального барьера, воздействую на плотные контакты. Эти расстройства приводят к развитию во
Анаэробные организмы — Википедия. Что такое Анаэробные организмы
Аэробные и анаэробные бактерии предварительно идентифицируются в жидкой питательной среде по градиенту концентрации O2:1. Облигатные аэробные бактерии в основном собираются в верхней части пробирки, чтобы поглощать максимальное количество кислорода. (Исключение: микобактерии — рост пленкой на поверхности из-за восколипидной мембраны.)
2. Облигатные анаэробные бактерии собираются в нижней части, чтобы избежать кислорода (либо не дают роста).
3. Факультативные бактерии собираются в основном в верхнем (окислительное фосфорилирование является более выгодным, чем гликолиз), однако они могут быть найдены на всем протяжении среды, так как от O2 не зависят.
4. Микроаэрофилы собираются в верхней части пробирки, но их оптимум — малая концентрация кислорода.
5. Аэротолерантные анаэробы не реагируют на концентрации кислорода и равномерно распределяются по пробирке
Анаэробы — организмы, получающие энергию при отсутствии доступа кислорода путём субстратного фосфорилирования, конечные продукты неполного окисления субстрата при этом могут быть окислены с получением большего количества энергии в виде АТФ в присутствии конечного акцептора протонов организмами, осуществляющими окислительное фосфорилирование.
Анаэробы — обширная группа организмов, как микро-, так и макроуровня:
Помимо этого анаэробное окисление глюкозы играет важную роль в работе поперечно-полосатой мускулатуры животных и человека (особенно в состоянии тканевой гипоксии).
Термин «анаэробы» ввел Луи Пастер, открывший в 1861 году бактерии маслянокислого брожения. Анаэробное дыхание — совокупность биохимических реакций, протекающих в клетках живых организмов при использовании в качестве конечного акцептора электронов не кислорода, а других веществ (например, нитратов) и относится к процессам энергетического обмена (катаболизм, диссимиляция), которые характеризуются окислением углеводов, липидов и аминокислот до низкомолекулярных соединений.
Степень аэробности среды
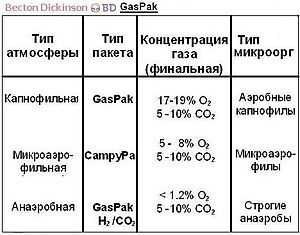 Интерполяция руководства к системам BD Gaspak, описывающая условия среды генерируемые пакетом[1]
Интерполяция руководства к системам BD Gaspak, описывающая условия среды генерируемые пакетом[1] Для измерения потенциала среды М. Кларк предложил использовать величину pH20 — отрицательный логарифм парциального давления газообразного водорода. Диапазон [0-42,6] характеризует все степени насыщения водного раствора водородом и кислородом. Аэробы растут при более высоком потенциале [14-20], факультативные анаэробы [0-20], а облигатные — при наиболее низком [0-10].[2]
Классификация анаэробов
Согласно устоявшейся в микробиологии классификации, различают:
- Факультативные анаэробы
- Капнеистические анаэробы и микроаэрофилы
- Аэротолерантные анаэробы
- Умеренно-строгие анаэробы
- Облигатные анаэробы
Если организм способен переключаться с одного метаболического пути на другой (например, с анаэробного дыхания на аэробное и обратно), то его условно относят к факультативным анаэробам[3].
До 1991 года в микробиологии выделяли класс капнеистических анаэробов, требовавших пониженной концентрации кислорода и повышенной концентрации углекислоты (Бруцеллы бычьего типа — B. abortus)[2]
Умеренно-строгий анаэробный организм выживает в среде с молекулярным O2, однако не размножается. Микроаэрофилы способны выживать и размножаться в среде с низким парциальным давлением O2.
Если организм не способен «переключиться» с анаэробного типа дыхания на аэробный, но не гибнет в присутствии молекулярного кислорода, то он относится к группе аэротолерантных анаэробов. Например, молочнокислые и многие маслянокислые бактерии
Облигатные анаэробы в присутствии молекулярного кислорода O2 гибнут — например, представители рода бактерий и архей: Bacteroides, Fusobacterium, Butyrivibrio, Methanobacterium). Такие анаэробы постоянно живут в лишенной кислорода среде. К облигатным анаэробам относятся некоторые бактерии, дрожжи, жгутиковые и инфузории.
Токсичность кислорода и его форм для анаэробных организмов
Среда с содержанием кислорода является агрессивной по отношению к органическим формам жизни. Это связано с образованием активных форм кислорода в процессе жизнедеятельности или под действием различных форм ионизирующего излучения, значительно более токсичных, чем молекулярный кислород O2. Фактор, определяющий жизнеспособность организма в среде кислорода[4] — наличие у него функциональной антиоксидантной системы, способной к элиминации:супероксид-аниона(O2−),перекиси водорода(H2O2), синглетного кислорода(O.), а также молекулярного кислорода (O2) из внутренней среды организма. Наиболее часто подобная защита обеспечивается одним или несколькими ферментами:
Аэробные организмы содержат чаще всего три цитохрома, факультативные анаэробы — один или два, облигатные анаэробы не содержат цитохромов.
Анаэробные микроорганизмы могут активно воздействовать на среду[2] , создавая подходящий окислительно-восстановительный потенциал среды (например, Clostridium perfringens). Некоторые засеянные культуры анаэробных микроорганизмов, прежде чем начать размножаться, снижают pH20 с величины [20-25] до [1-5], ограждая себя восстановительным барьером, другие — аэротолерантные — в процессе жизнедеятельности продуцируют перекись водорода, повышая pH20[5].
Дополнительная антиоксидантная защита может обеспечиваться синтезом или накоплением низкомолекулярных антиоксидантов: витамина С, А, E, лимонной и других кислот.
Получение энергии путём субстратного фосфорилирования. Брожение. Гниение
 Схема гликолиза с образованием молочной кислоты
Схема гликолиза с образованием молочной кислоты - Также анаэробные организмы могут получать энергию путём катаболизма аминокислот и их соединений (пептидов, белков). Такие процессы именуют гниением, а микрофлору в энергетическом обмене которой преобладают процессы катаболизма аминокислот называют гнилостной.
- Анаэробные микроорганизмы расщепляют гексозы (например, глюкозу) разными путями:
- Гликолиз (Путь Эмдена-Мейергофа) после которого продукт подвергается брожению
- окислительный пентозофосфатный путь (другие названия: Фосфогликонатный путь, иначе гексозомонофосфатный(ГКМ), иначе путь Варбурга — Диккенса — Хореккера)
- Путь Энтнера — Дудорова (особенно значимый, когда субстратами служат глюконовая, маннановая, гексуроновые кислоты или их производные)
В качестве примера организма, сбраживающего сахара по пути Энтнера — Дудорова, можно привести облигатно анаэробную бактерию Zymomonas mobilis. Однако её изучение позволяет предполагать, что Z. mobilis — вторичный анаэроб, произошедший от цитохромсодержащих аэробов. Путь Энтнера — Дудорова обнаружен и у некоторых клостридиев, что ещё раз подчеркивает неоднородность эубактерий, объединенных в эту таксономическую группу.[6].
При этом характерным только для анаэробов является гликолиз, который в зависимости от конечных продуктов реакции разделяют на несколько типов брожения:
В результате расщепления глюкозы расходуется 2 молекулы, а синтезируется 4 молекулы АТФ. Таким образом общий выход АТФ составляет 2 молекулы АТФ и 2 молекулы НАД·Н2. Полученный в ходе реакции пируват утилизируется клеткой по-разному в зависимости от того, какому типу брожения она следует.
Антагонизм брожения и гниения
В процессе эволюции сформировался и закрепился биологический антагонизм бродильной и гнилостной микрофлоры:
Расщепление микроорганизмами углеводов сопровождается значительным снижением pH среды, в то время как расщепление белков и аминокислот — повышением (защелачиванием). Приспособление каждого из организмов к определенной реакции среды играет важнейшую роль в природе и жизни человека, например, благодаря бродильным процессам предотвращается загнивание силоса, заквашенных овощей, молочных продуктов.
Культивирование анаэробных организмов
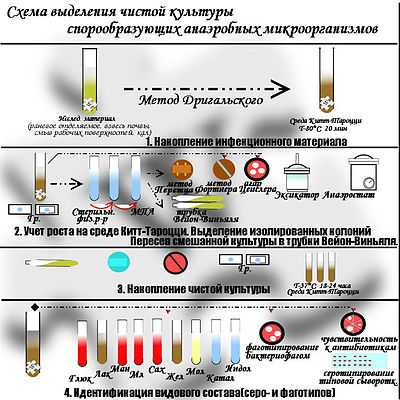 Выделение чистой культуры анаэробов схематично
Выделение чистой культуры анаэробов схематично Культивирование анаэробных организмов в основном является задачей микробиологии.
Сложнее дело обстоит с культивированием анаэробных многоклеточных организмов, поскольку для их культивирования часто необходима специфическая микрофлора, а также определённые концентрации метаболитов. Применяется, например, при исследовании паразитов человеческого организма.
Для культивирования анаэробов применяют особые методы, сущность которых заключается в удалении воздуха или замены его специализированной газовой смесью (или инертными газами) в герметизированных термостатах — анаэростатах[7].
Другим способом выращивания анаэробов(чаще всего микроорганизмов) на питательных средах — добавление редуцирующих веществ (глюкозу, муравьинокислый натрий, казеин, сульфат натрия, тиосульфат, цистеин, тиогликолят натрия и др.), связывающих токсичные для анаэробов перикисные соединения.
Общие питательные среды для анаэробных организмов
Для общей среды Вильсона-Блера базой является агар-агар с добавлением глюкозы, сульфита натрия и двуххлористого железа. Клостридии образуют на этой среде колонии чёрного цвета за счет восстановления сульфита до сульфид — аниона, который соединяясь с катионами железа (II) дает соль чёрного цвета. Как правило, черные на этой среде образования колонии, появляются в глубине агарового столбика.[8]
Среда Китта-Тароцци состоит из мясопептонного бульона, 0,5 % глюкозы и кусочков печени или мясного фарша для поглощения кислорода из среды. Перед посевом среду прогревают на кипящей водяной бане в течение 20 — 30 минут для удаления воздуха из среды. После посева питательную среду сразу заливают слоем парафина или вазелинового масла для изоляции от доступа кислорода.
Общие методы культивирования для анаэробных организмов
GasPak — система химическим путём обеспечивает постоянство газовой смеси, приемлемой для роста большинства анаэробных микроорганизмов. В герметичном контейнере, в результате реакции воды с таблетками боргидрида натрия и бикарбоната натрия образуется водород и диоксид углерода. Водород затем реагирует с кислородом газовой смеси на палладиевом катализаторе с образованием воды, уже вторично вступающей в реакцию гидролиза боргидрида.
Данный метод был предложен Брюером и Олгаером в 1965 году. Разработчики представили одноразовый пакет, генерирующий водород, который был позднее усовершенствован ими до саше, генерирующих двуокись углерода и содержащих внутренний катализатор[9][10].
Метод Цейсслера применяется для выделения чистых культур спорообразующих анаэробов. Для этого производят посев на среду Китт-Тароцци, прогревают 20 мин при 80 °C (для уничтожения вегетативной формы), заливают среду вазелиновым маслом и инкубируют 24 ч в термостате. Затем производят посев на сахарно-кровяной агар для получения чистых культур. После 24-часового культивирования интересующие колонии изучаются — их пересеивают на среду Китт-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод ФортнераМетод Фортнера — посевы производят на чашку Петри с утолщенным слоем среды, разделённым пополам узкой канавкой, вырезанной в агаре. Одну половину засевают культуру аэробных бактерий, на другую — анаэробных. Края чашки заливают парафином и инкубируют в термостате. Первоначально наблюдают рост аэробной микрофлоры, а затем (после поглощения кислорода) — рост аэробной резко прекращается и начинается рост анаэробной.
Метод Вейнберга используется для получения чистых культур облигатных анаэробов. Культуры, выращенные на среде Китта-Тароцци, переносят в сахарный бульон. Затем одноразовой пастеровской пипеткой материал переносят в узкие пробирки (трубки Виньяля) с сахарным мясо-пептонным агаром, погружая пипетку до дна пробирки. Засеянные пробирки быстро охлаждают, что позволяет фиксировать бактериальный материал в толще затвердевшего агара. Пробирки инкубируют в термостате, а затем изучают выросшие колонии. При обнаружении интересующей колонии на её месте делают распил, материал быстро отбирают и засеивают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод ПеретцаМетод Перетца — в расплавленный и охлаждённый сахарный агар-агар вносят культуру бактерий и заливают под стекло, помещённое на пробковых палочках(или фрагментах спичек) в чашку Петри. Метод наименее надежен из всех, но достаточно прост в применении.
Дифференциально — диагностические питательные среды
- Среды Гисса («пестрый ряд»)
- Среда Ресселя (Рассела)
- Среда Эндо
- Среда Плоскирева или бактоагар «Ж»
- Висмут-сульфитный агар
Среды Гисса: К 1 % пептонной воде добавляют 0,5 % раствор определенного углевода (глюкоза, лактоза, мальтоза, маннит, сахароза и др.) и кислотно-щелочной индикатор Андреде, разливают по пробиркам, в которые помещают поплавок для улавливания газообразных продуктов, образующихся при разложении углеводородов.
Среда Ресселя (Рассела) применяется для изучения биохимических свойств энтеробактерий(шигелл, сальмонелл). Содержит питательный агар-агар, лактозу, глюкозу и индикатор (бромтимоловый синий). Цвет среды травянисто-зелёный. Обычно готовят в пробирках по 5 мл со скошенной поверхностью. Посев осуществляют уколом в глубину столбика и штрихом по скошенной поверхности.
Среда Эндо
Среда Плоскирева (бактоагар Ж) — дифференциально-диагностическая и селективная среда, поскольку подавляет рост многих микроорганизмов, и способствует росту патогенных бактерий (возбудителей брюшного тифа, паратифов, дизентерии). Лактозоотрицательные бактерии образуют на этой среде бесцветные колонии, а лактозоположительные — красные. В составе среды — агар, лактоза, бриллиантовый зелёный, соли желчных кислот, минеральные соли, индикатор (нейтральный красный).
Висмут-сульфитный агар предназначен для выделения сальмонелл в чистом виде из инфицированного материала. Содержит триптический гидролизат, глюкозу, факторы роста сальмонелл, бриллиантовый зелёный и агар. Дифференциальные свойства среды основаны на способности сальмонелл продуцировать сероводород, на их устойчивости к присутствию сульфида, бриллиантового зелёного и лимоннокислого висмута. Маркируются колонии в чёрный цвет сернистого висмута (методика схожа со средой Вильсона-Блера).
Метаболизм анаэробных организмов
Метаболизм анаэробных организмов имеет несколько различных подгрупп:
Анаэробный энергетический обмен в тканях человека и животных
- Основной источник: [12]
Некоторые ткани животных и человека отличаются повышенной устойчивостью к гипоксии (особенно мышечная ткань). В обычных условиях синтез АТФ идет аэробным путём, а при напряженной мышечной деятельности, когда доставка кислорода к мышцам затруднена, в состоянии гипоксии, а также при воспалительных реакциях в тканях доминируют анаэробные механизмы регенерации АТФ. В скелетных мышцах выявлены 3 вида анаэробных и только один аэробный путь регенерации АТФ.
3 вида анаэробного пути синтеза АТФК анаэробным относятся:
- Креатинфосфатазный (фосфогеный или алактатный) механизм — перефосфорилирование между креатинфосфатом и АДФ
- Миокиназный — синтез (иначе ресинтез) АТФ при реакции трансфосфорилирования 2 молекул АДФ (аденилатциклаза)
- Гликолитический — анаэробное расщепление глюкозы крови или запаса гликогена, заканчивающийся образованием молочной кислоты (иначе именуется «лактатным»).
Необходимо отметить, что прямым следствием гликолиза является критическое снижение рН тканей — ацидоз. Это ведет к снижению эффективного транспорта кислорода гемоглобином, и формирует положительную обратную связь.
Каждый механизм имеет своё время удержания максимальной мощности и оптимум энергообеспечения тканей. Наибольшая мощность и наименьшее время удержания:
См. также
Примечания
- ↑ Газогенерирующие контейнерные системы GasPak: Инструкция МК. — OOO "МК, официальный дистрибьютер Becton Dickinson International", 2010. — С. 7.
- ↑ 1 2 3 К. Д. Пяткин. Микробиология с вирусологией и иммунологией. — М:"Медицина", 1971. — С. 56.
- ↑ Л. Б. Борисов. Медицинская микробиология, вирусология и иммунология. — МИА, 2005. — С. 154-156. — ISBN 5-89481-278-X.
- ↑ Д. Г. Кнорре. Биологическая химия:Учеб. для хим., биол. и мед.спец.вузов. — 3. — М.:Высшая школа, 2000. — С. 134. — ISBN 5-06-003720-7.
- ↑ D. A. Eschenbach, P. R. Davick, B. L. Williams. Prevalence of hydrogen peroxide-producing Lactobacillus species in normal women and women with bacterial vaginosis. — J Clin Microbiol. 1989 February; 27(2): 251–256.
- ↑ М. В. Гусев, Л. А. Минеева. Микробиология. — М:МГУ, 1992. — С. 56.
- ↑ А. А. Воробьев. Атлас по медицинской микробиологии, вирусологии и иммунологии. — МИА, 2003. — С. 44. — ISBN 5-89481-136-8.
- ↑ Л. Б. Борисов. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии. — Медицина, 1992. — С. 31-44. — ISBN 5-2225-00897-6.
- ↑ J. H. Brewer, D. L. Allgeier. Disposable hydrogen generator. — Science 147:1033-1034. — 1966.
- ↑ J. H. Brewer, D. L. Allgeier. Safe self-contained carbon dioxide-hydrogen anaerobic system. — Appl. Microbiol.16:848-850. — 1966.
- ↑ G. F. Smirnova. Metabolism peculiarities of bacteria restoring chlorates and perchlorates. — Microbiol Z. 2010 Jul-Aug;72(4):22-8.
- ↑ Филиппович Ю. Б., Коничев А. С., Севастьянова Г. А. Биохимические основы жизнедеятельности организма человека. — Владос, 2005. — С. 302. — ISBN 5-691-00505-7.