Алкогольдегидрогеназа что это такое
Алкогольдегидрогеназа — Википедия
Алкогольдегидрогеназа (алкоголь: НАД±оксидоредуктаза, КФ 1.1.1.1) — фермент класса дегидрогеназ, катализирующий окисление спиртов и ацеталей до альдегидов и кетонов в присутствии никотинамидадениндинуклеотида (НАД). Алкогольдегидрогеназы (алкоголь: НАД±оксидоредуктазы) являются димерами, состоящими из субъединиц с молекулярным весом около 40 000 и содержащими ион цинка Zn2+.
Катализирует реакцию: этанол + НАД+ ⇌ ацетальдегид + НАДН + H+.
Является специфическим для клеток печени. Появление его в сыворотке крови свидетельствует о повреждении клеток печени. Резкое повышение содержания фермента наблюдается при острых гепатитах (при этом его показатели приходят к норме раньше, чем показатели трансаминаз). При обтурационной желтухе, циррозах печени, инфаркте миокарда, мышечной дистрофии Эрба обычно не наблюдается повышения активности фермента в крови.
Оптимум действия фермента находится при pH 8,0. Цианиды, йодоацетат тормозят действие энзима.
В больших количествах фермент находится лишь в печени, но небольшое количество также содержат почки. Следы фермента также обнаруживаются в сердечной и скелетной мускулатуре человека. В сыворотке крови здорового человека отсутствует.
Активность алкогольдегидрогеназы в организме человека зависит от возраста, пола, этнической принадлежности, генетической предрасположенности. Например, молодые женщины не могут обрабатывать алкоголь с той же скоростью, что и молодые мужчины, потому что они не экспрессируют алкогольдегидрогеназу так же высоко, хотя обратное верно для среднего возраста.[1] С ростом частоты и регулярности употребления алкоголя активность алкогольдегидрогеназы снижается[2].
Фармакогенетика алкогольдегидрогеназы[править | править код]
Алкогольдегидрогеназа (АДГ) — фермент, представленный различными формами. Были охарактеризованы 5 классов АДГ. Их фармакогенетика не была широко изучена, но хорошо известны их субстраты: кроме этанола и других алифатических спиртов, включает 4-гидроксиноненаль, альдегиды, полученные перекисным окислением липидов, стероиды, гидроксилированные жирные кислоты, промежуточные соединения медиаторных путей в процессе образования ретиноевой кислоты из витамина А[3].
Класс I (ADh2)[править | править код]
Обладают этанол-окислительной активностью. Гены трех типов ADh2A, ADh2B, и ADh2C кодируют α-, β-, и γ-субъединицы, которые могут образовывать гомо- и гетеродимеры, которые ответственны за большую часть окислительной активности печени по отношению к этанолу[4]. Некоторые исследования продемонстрировали меньший риск стать алкоголиком для азиатов с наличием ADh2B2 аллеля (частота 60—80 % в азиатских популяциях и около 4 % в безалкогольных европейских популяциях)[5]. Также некоторые исследования указывают на распространение аллеля ADh2C1 среди безалкогольной популяции[6].
Класс III (ADh4)[править | править код]
Высоко консервативны, активны по отношению к глутатион-конъюгированному формальдегиду, а также к глутатион-NO и к свободным гидроксилированным жирным кислотам и лейкотриенам. Ферменты класса III участвуют в пути ликвидации формальдегида и имеют древнее происхождение от прокариот, но, несмотря на это, формы фермента АДГ3 варьируются незначительно[3].
Класс IV (ADh5)[править | править код]
Обладают ретинол-дегидрогеназной активностью, участвуют в формировании ретиноевой кислоты и, следовательно, в регуляции дифференцировки клеток позвоночных[7].
Влияние различных АДГ на метаболизм этанола[править | править код]
На основании кинетических свойств различных вариантов и предполагаемого содержания фермента АДГ в печени, исследователи рассчитали вклад различных ферментов АДГ на способность печени окислять этанол. Для человека (средний вес которого 70 кг), у которого концентрация этанола в крови приблизительно 100 мг/100 мл, если он гомозиготен по ADh2B1 и ADh2C1 ферменты класса I окисляют 70 % этанола. Для человека гомозиготного по ADh2B1 и ADh2C2 окислительная способность составляет 80 %. Присутствие ADh2C2 аллели будет связан со слегка пониженной окислительной способности, в то время как наличие adh2b2 и adh2b3 аллели было бы связано с существенно более высокой окислительной способности (то есть более быстрое окисление этанола в ацетальдегид). Эти расчеты приближены, так как не учитывают размер печени и различия экспрессии генов[8].
Гены ADh2B и ALDh3 (ген, кодирующий одного из представителей семейства альдегиддегидрогиназ) являются наиболее сильно связаны с риском развития алкоголизма. Они способны уменьшить риск алкоголизма путем увеличения локальных уровней ацетальдегида, либо за счет быстрого окисления этанола, либо за счет медленного окисления ацетальдегида. Точный баланс между скоростями окисления этанола и ацетальдегида может иметь решающее значение при определении концентрации ацетальдегида в клетках, таким образом, что небольшие различия в относительной активности ADG и ALDH могут вызвать значительные различия в концентрации ацетальдегида) [9].
Из-за этого тонкого баланса, влияние вариаций генов ADG и ALDH на риск развития алкоголизма может быть продемонстрировано только независимо друг от друга, то есть, исследователи могут определить различия в риске между людьми, несущими различные аллели одного гена, но идентичные аллели других генов[4].
Семейство ферментов алкогольдегидрогеназ (АДГ) может принимать участие в метаболизме ретинола (витамина А), а также в метаболизме этанола. Некоторые члены семейства АДГ предпочитают ретинол в качестве субстрата вместо этанола, и их способность окислять ретинол конкурентно ингибируется высокими концентрациями этанола. Кроме того, существует семейство альдегиддегидрогеназ (ALDH), содержащее несколько представителей, предпочитающих ретиналь в качестве субстрата вместо ацетальдегида[10].
Конформационные изменения и катализ алкогольдегидрогеназы[править | править код]
Как показано с помощью рентгеновской кристаллографии, в печени лошади алкогольдегидрогеназа претерпевает глобальные конформационные изменения при связывании НАД+ или НАДН, включающие поворот каталитического домена относительно кофермент-связывающего домена и перестройку активного сайта для получения каталитически-активного фермента. Изменение конформации требует полного кофермента и зависит от различных химических или мутационных замен, которые могут увеличить каталитическую активность за счет изменения кинетики изомеризации и скорости диссоциации коферментов [11].
После того, как фермент связал НАД+, субстрат вытесняет гидроксид, связанный с каталитическим цинком. Этот обмен может включать реакцию двойного замещения, где карбоксильная группа остатка глутаминовой кислоты сначала замещает гидроксид, а затем субстрат замещает остаток глутамата. В полученном фермент-НАД+-алкоголятном комплексе атом водорода переносится на кофермент[11].
- ↑ Parlesak A., Billinger M.H., Bode C., Bode J.C. Gastric alcohol dehydrogenase activity in man: influence of gender, age, alcohol consumption and smoking in a caucasian population (англ.) // Alcohol and Alcoholism (англ.)русск. : journal. — 2002. — Vol. 37, no. 4. — P. 388—393. — doi:10.1093/alcalc/37.4.388. — PMID 12107043.
- ↑ Фармацевтическая опека: клинико-фармацевтические аспекты применения алкоголя в медицине
- ↑ 1 2 Jörnvall, H., Höög, J. O., Persson, B. & Parés, X. Pharmacogenetics of the alcohol dehydrogenase system. Pharmacology 61, 184-91 (2000).
- ↑ 1 2 Edenberg, H. J. The genetics of alcohol metabolism: role of alcohol dehydrogenase and aldehyde dehydrogenase variants. Alcohol Res. Health 30, 5-13 (2007).
- ↑ Whitfield, J. B. et al. ADH Genotypes and Alcohol Use and Dependence in Europeans. Alcohol. Clin. Exp. Res. 22, 1463—1469 (1998).
- ↑ Borràs, E. et al. Genetic polymorphism of alcohol dehydrogenase in europeans: the ADh3*2 allele decreases the risk for alcoholism and is associated with ADh4*1. Hepatology 31, 984-9 (2000).
- ↑ Involvement of Alcohol Dehydrogenase, Short-Chain Dehydrogenase/Reductase, Aldehyde Dehydrogenase, and Cytochrome P450 in the Control of Retinoid Signaling by Activation of Retinoic Acid Synthesis — Biochemistry (ACS Publications). doi:10.1021/bi961176%2B (Accessed: 15th May 2016)
- ↑ O’Connor, S., Morzorati, S., Christian, J. & Li, T.-K. Clamping Breath Alcohol Concentration Reduces Experimental Variance: Application to the Study of Acute Tolerance to Alcohol and Alcohol Elimination Rate. Alcohol. Clin. Exp. Res. 22, 202—210 (1998).
- ↑ Kitson, K. E. Regulation of Alcohol and Aldehyde Dehydrogenase Activity: A Metabolic Balancing Act With Important Social Consequences. Alcohol. Clin. Exp. Res. 23, 955—957 (1999).
- ↑ Zile, M. H. Symposium : Functional Metabolism of Vitamin A in Embryonic Development Vitamin A and Embryonic Development : An Overview 1 , 2. 455—458 (1998).
- ↑ 1 2 Plapp, B. V. NIH Public Access. 493, 3-12 (2011)
что это за фермент и зачем он нужен?
В организме каждого человека есть особенное химическое вещество – специфический фермент алкогольдегидрогеназа (АДГ), основная функция которого заключается в переработке эндогенного этанола. Он участвует в окислительно-восстановительных процессах организма на биохимическом уровне, блокируя активность свободных радикалов. Но поскольку людям свойственно принимать и экзогенный спирт, функции фермента автоматически распространяются и на него.
Родной сестрой алькогольдегидрогеназы считается еще один фермент – ацетальдегидрогеназа, утилизирующая метаболиты спирта. Эволюция словно нарочно так устроила биохимические процессы внутри нас, чтобы встреча с алкоголем проходила естественно и безопасно, ведь брожение, в результате которого и появляется этанол, известно с момента зарождения жизни на планете.
Ферменты, «работающие» с алкоголем определяют многое. От их количества зависит не просто скорость метаболизма этанола, но и склонность человека к спиртовой зависимости или, напротив, к полной непереносимости спирта.
[toc]
Алкогольдегидрогеназа быстрая и медленная
Интересно, что алкогольдегидрогеназа и ацетальдегидрогеназа синтезируются, не зависимо от того, выпивает человек или нет.
Причина – эндогенный или эндокринный алкоголь, вырабатывающийся с момента рождения у каждого. Его необходимо разбить на отдельные компоненты и усвоить, обеспечивая нормальный обмен веществ.
Для большей безопасности организма от токсических свойств алкоголя фермент, расщепляющий его, существует в двух вариантах: медленном и быстром. При работе с внутренним алкоголем такое деление незаметно, но при поступлении в организм этанола извне – играет огромную роль.
Быстрая форма фермента
Она в 90 раз активнее своей сестры. Вырабатывается тогда, когда концентрация алкоголя в крови нарастает колоссальными темпами.
Расщепляя спирт, алькогольдегидрогеназа обеспечивает чувство опьянения, а затем, последовательно – похмелья и протрезвления. В таком механизме действия есть свои плюсы и минусы. Быстрый фермент не дает развиться привыканию к алкоголю, но в тоже время провоцирует интоксикацию, поскольку такой же скоростной альтернативы усвоения метаболитов нет.

Медленный вариант
Алкогольдегидрогеназа медленного действия менее активна, позволяет долгое время находиться в крови не переработанному этанолу. Человек в это время не пьянеет, трезвеет после принятия спиртного гораздо позднее.
В этом варианте и существует риск развития алкогольной зависимости, поскольку возникает иллюзия устойчивости к спиртному, этанол незаметно отравляет организм.
Свойства фермента определяются индивидуальными особенностями человека: возраст, пол, вес.
В процессе жизни быстрая и медленная форма могут меняться местами. Например, молодой и пожилой человек демонстрируют разную переносимость алкоголя, скорость опьянения и отрезвления, интоксикационные процессы.
Ацетальдегидрогеназа, делится на активную и пассивную форму в зависимости от необходимости усваивать алкоголь.
Алкогольдегидрогеназа в таблетках
Обыватели охотно поддерживают миф о существовании таблеток алькогольдегидрогеназы, приняв которые, можно добавить силы своему природному ферменту.
С их точки зрения демонстрация возможности выпивки большого количества алкоголя без признаков опьянения – символ здоровья и долголетия.
Алкогольдегидрогеназа в таблетках должна в этом случае минимизировать негативные свойства алкоголя при его употреблении в больших количествах.
Ученые давно работают в этом направлении. На этом пути было сделано много открытий: например, синтезирован препарат Форслив – ингибитор окислителей, способствующий защите печени от губительного действия токсинов, предпринята попытка классификации ферментов, участвующих в механизме регуляции метаболизма спирта, изучены неизвестные свойства алькогольдегидрогеназы, созданы формулы новых препаратов.
Сегодня существуют специальные лекарственные средства химической защиты от алкоголя: Дисульфирам и Цинамид. Но принцип их действия совершенно иной: они не ускоряют работу ферментов, а, напротив, замедляют и нарушают ее. Иными словами мешают пить, не пьянея, а не гарантируют безопасность избытка алкоголя.
Другим образом помочь человеку остановиться уже при минимальных дозах приема спиртного достаточно сложно.

Триггеры непереносимость алкоголя
В норме комбинация двух перерабатывающих алкоголь ферментов формирует предрасположенность к спиртному на уровне генов. Иными словами, наследственный код человека при рождении содержит информацию о его приспособленности к алкоголю.
Сочетание медленной алкогольдегидрогеназы и скоростной ацетальдегидрогеназы держит уровень спирта в крови долгое время, а токсичный ацетальдегид быстро выводится. При этом создается ощущение комфортности от употребления алкоголя, и как итог – развивается алкогольная зависимость.
При сочетании быстрой алкогольдегидрогеназы и пассивной ацетальдегидрогеназы человек быстро пьянеет, чувствует себя неуверенно и предпочитает либо вовсе не пить, либо употребляет минимальные дозы алкоголя.
Суть в том, что даже небольшое количество этанола в его организме мгновенно трансформируется в ацетальальдегид, который долго находится в крови, вызывая интоксикацию.
Кроме генетически заложенной, есть и приобретенная непереносимость алкоголя. Она выражается в резко отрицательной реакции на любую дозу спирта. Причиной может стать травма головного мозга, печеночная патология или расстройства психики.
Контроль уровня фермента
Вероятно, любому человеку хочется управлять процессом опьянения.
Научных разработок, связанных с этой проблемой много, вывод один – биохимические реакции организма невозможно взять под контроль. Механизм действия алкогольдегидрогеназы уникален и не поддается корректировке.
Чтобы правильно распределить свои силы, необходимо перед приемом первой рюмки принять осознанное решение о возможной дозировке этанола, безопасной для организма.
Для этого нужно определить, какой тип алкогольных ферментов характерен для пациента и на основании этого, рассчитать индивидуальную дозу спиртного, не вызывающую негативных последствий. Помогут в этом как обычно анализы крови, фиксирующие экстенсивные (количественные) изменения.
Карма пьющих?
В быту существует миф о генетической предрасположенности того или иного народа к пьянству. Но с научной точки зрения абсолютно достоверно доказано отсутствие гена предрасположенности к спиртному. Все зависит от алкогольных ферментов.
Например, азиаты пьянеют очень быстро и могут спиваться достаточно рано.
Долгое время, считалось, что происходит это из-за отсутствия в их организме ацетальдегидрогеназы. В реальности монголоиды и азиаты, на самом деле, пьянеют мгновенно, но и трезвеют очень быстро.
Суть заключается в том, что в организме у этих народов ацетальдегидрогеназа имеет самую короткую аллель (ADh2B*47His), способную моментально расщеплять спирт, образуя токсичный ацетальальдегид. Но второй фермент у азиатов и монголоидов медленный, то есть имеет аллель (ALDh3*2), которая позволяет токсинам долго находиться в крови. Такая комбинация ферментов обеспечивает быстрое опьянение от минимальной дозы, почти сразу же наступает тяжелое похмелье, поэтому пьяниц в Азии встретить трудно. В этой части света алкоголизм встречается в сто раз реже, чем в просвещенной Европе.
Если совсем просто, то у азиатов вместо привычки к этанолу развивается стойкая неприязнь к нему. Справедливости ради, следует сказать, что огромная заслуга в этом принадлежит культуре питья, которая прививается в Азии с младенчества и априори не допускает злоупотребления алкоголем.
Народы Севера, например, имеющие сходную внутреннюю организацию биохимических процессов, из-за отсутствия этой культуры спиваются очень быстро. Способствует этому и измененный рацион питания.
Когда-то на Севере преобладал атерогенный профиль, основанный на ограниченном ассортименте продуктов для приготовления пищи. Много жира и белка определяли спокойный характер якутов, эскимосов, чукчей, поскольку липиды из мяса морских животных купировали стресс. Необходимости в алкоголе попросту не было.
В традиции народов Севера существовала молочная водка, изготовленная из квашеного молока, которая подавалась к столу исключительно по праздникам, речи о спивании в таком режиме приема алкоголя не шло.
Советская власть сделала доступным для северян питание, о котором раньше они только слышали, но вместе с преобладанием углеводов в меню, изменился и процесс ферментации в организме. Результатом стало быстрое опьянение с формированием пьянства и алкоголизма.
Самыми устойчивыми к алкоголю оказались индейцы Южной Америки. У них сочетание алкогольдегидрогеназы и атальдегидрогеназы таково, что около 90% трезвеют, не успев захмелеть. Отсюда и смысла в спиртном индейцы не видят.
Вывод напрашивается сам собой: алкогольные ферменты не влияют на тягу к этанолу, не спасают от интоксикации, не дают гарантии от похмелья и развития алкоголизма. Количество и качество употребляемого алкоголя определяет культура человека, уровень жизни, психологические моменты.
Пристрастие к спиртному – это не карма, а результат асоциальности индивидуума, его неспособности управлять эмоциями, поступками. Основная причина алкоголизма – деградация личности.
Русские также не имеют никакого специального гена, предрасполагающего к чрезмерному употреблению алкоголя. У них в организме нормальные ферменты: алкогольдегидрогеназа и ацетальдегидрогеназа, которые помогают поддерживать оптимальный баланс эндогенного и экзогенного алкоголя. Но отсутствие воспитания, терпимое отношение общества и семьи к пьющим – лишают наших соотечественников рассудка.
Россияне обрекают себя на вымирание в буквальном смысле этого слова: импотенция, бесплодие, смерть в молодом возрасте, инвалидность, ДТП с пьяным водителем за рулем, бытовые преступления, увечья, убийства, домашнее насилие, издевательства над детьми – все это последствия алкоголизма.
Вкус и действие алкоголя многие узнают в младших классах школы, а к 20 годам становятся законченными алкоголиками. Пьянство – путь в никуда, тупик, приводящий к трагедии. Об этом следует знать и хорошо думать, прежде чем принять первую рюмку.
А как другие?
Восточная часть Европы населена людьми с таким же уровнем концентрации алкогольдегидрогеназы и ацетальдегидрогеназы, как и у русских. На Западе континента быстрые аллели отсутствуют вообще. Это, в сочетании с культурой питья, определяет отрицательное отношение к алкоголю.
ВашНарколог предупреждает: Спившиеся деревни
Оказывается, на планете существуют полностью спившиеся деревни, которые располагаются повсеместно. Объяснение такому феномену нашли ученые.
Они доказали, что в таких селениях живут преимущественно народы, которые вели ранее жизнь кочевников. Такой образ жизни давал возможность бывать в разных местах и встречаться и тут, и там с разным алкоголем, употребление которого вошло в привычку. Кочевники, ориентировавшиеся на традиции разных народов, приобретя оседлость, выпивать не перестали, а закрепили эту привычку.

Кроме того, жизнь на одном месте поменяла исторический уклад жизни, поэтому индейцы Северной Америки и народы русского Севера, сохранившие свои традиции постоянного перемещения, пьют гораздо меньше своих соотечественников, живущих в условиях цивилизации.
Это связано еще и с уровнем гормонов стресса в организме, которые накапливаются из-за постоянного напряжения, связанного с проблемами цивилизации и непривычного свободно перемещающимся народам.
Все одинаково зависимы от алкоголя?
Однозначного ответа на этот вопрос нет. Относиться к проблеме можно по-разному.
Несмотря на многочисленные научные исследования алкогольдегидрогеназы и ацетальдегидрогеназы, открыты далеко не все секреты их деятельности.

Особенно это касается ингибирования свободных радикалов, способности ферментов окисляться, повышения их уровня в крови. Короткие аллели определяют многое, но не все. Привыкание к алкоголю может зависеть напрямую и от каких-то других вещей, еще неизвестных нам.
Возможно, решающую роль в устойчивости к алкоголю играют смешанные браки, генетически закрепляющие короткие аллели из поколения в поколение.
Многократное смешение рас и народов дает устойчивую генную мутацию. Может быть, нам в самое ближайшее время предстоит получить ответ на вопрос об устойчивости к алкоголю, лежащий совершенно в другой области знаний.
 Ферменты переработки этилового спирта в организме часто становятся предметов домыслов: дескать у кого-то их много, а некоторых нет совсем. Кроме того кто-то утверждает, что можно их так сказать «натренировать» и дальше пить без проблем и тем более без алкоголизма. А как на самом деле обстоят дела в человеком организме с этими энзимами, которые позволяют нам по большей части мало замечать алкогольное отравление. Исходя из археологических изысканий, употребление алкоголя в человеческой культуре появилось задолго до бронзового века, еще 9000 лет назад. В действительности употребление спиртовых продуктов, очевидно, началось еще намного раньше. В естественной среде многие животные поедают бродящие перезрелые ягоды и фрукты, содержащие алкоголь, и беспочвенно утверждать, что наши прародители были образцом трезвости. Закономерно, что в результате эволюции у человека сформировались необходимые ферменты — алкогольдегидрогеназа и ацетальдегиддегидрогеназа, способные эффективно перерабатывать алкоголь. Быстрые и медленные, активные и пассивные алкогольные ферменты В генотипе человека могут существовать различные варианты (аллели) генов, от которых зависит кодировка, а значит эффективность ферментов метаболизма алкоголя. Если популяризировать, то возможны две вариации алкогольдегидрогеназы одну для простоты назовем «быстрой», другую «медленной». Такие названия выбраны не случайно «быстрая» алкогольдегидрогеназа (ADh2B*47His) может до 90 раз эффективнее, а значит быстрее метаболизировать этанол в ацетальдегид. В этом случае при употреблении алкоголя содержание его в крови нарастает медленно, человек гораздо менее пьянеет, слабее привыкает к алкоголю. Есть и обратная сторона, в результате срабатывания «быстрой» алкогольдегидрогеназы образуется больше ацетальдегида, токсическим образом действующего на организм. То же самое справедливо и в отношении ацетальдегиддегидрогеназы. Этот фермент может быть «активным» и «пассивным». Ацетальдегиддегидрогеназа в активной форме быстро превращает ацетальдегид, а пассивная форма (например, ALDН2*487Lys) может делать это только медленно. Различные сочетания форм двух основных ферментов разрушающих алкоголь объясняют разную генетическую предрасположенность у людей к алкоголизму. Если у человека «быстрая» алкогольдегидрогеназа и «пассивная» ацетальдегиддегидрогеназа, то даже небольшая доза этанола моментально превращается в уксусный альдегид, который долгое время находится в крови, и действует токсично.  Похмелье таких людей наступать обычно не к утру, а значительно ранее после потребления спиртного, из-за этого спиртное удовольствия приносит им мало, поэтому среди них алкоголики встречаются крайне редко. По данным научных исследований из Кореи, среди людей с двумя копиями генов с «медленными» и «активными» вариациями этих ферментов в 91 раз чаще отмечаются случаи алкоголизма, чем среди людей обладающих «быстрой» алкогольдегидрогеназой и «пассивной» ацетальдегиддегидрогеназой соответственно. Одним наглядных признаков накопления токсичного ацетальдегида – резкое после выпивки покраснение кожи лица. Следовательно, у человека, лицо которого значительно чаще краснеет после выпивки склонность к алкоголизму меньше. «Пассивная» ацетальдегиддегидрогеназа играет роль естественного защитного механизма от алкогольной зависимости, вызывая преждевременный дискомфорт от употребления алкоголя — похмелье. Узнав, особенности генотипа, а следовательно вариации алкоголь- и ацетальдегиддегидрогеназы имеются у человека, можно соответствующие рекомендации, оценив риски для здоровья, генетическую склонность к алкоголизму, связанные с употреблением спиртного. Генетические исследования становятся все доступнее и проводятся во многих клиниках. Как узнать есть ли у тебя алкогольдегидрогеназа медленная или быстрая Людей, особенно перед праздниками часто интересует, а есть ли у них алкогольдегидрогиназа, как увеличить этот фермент в организме или по крайней мере заставить его работать на полную. Так вот, современный уровень развития медицины еще не позволяет менять биохимию обмена веществ в организме, каждом приходиться пользоваться тем, что есть. Еще раз следует уточнить, алкогольдегидрогиназа и ацетальдегиддегидрогеназа — есть и у тебя и у меня и вообще у всех. Эти ферменты метаболизма этанола наличествуют хотя бы потому, что в каждом человеке есть так называемый эндогенный алкоголь, который самостоятельно, пускай в очень малых образуется в его организме. Наличие эндогенного алкоголя никак не зависит от того пил ли человек спиртные напитки или нет, он есть по факту, а значит, есть и ферменты благодаря которым он не только образовался, но и утилизируется. Ценность наблюдения за переработкой алкоголя в своем организме  Узнать быстрые или медленные у Вас внутренние катализаторы утилизации и выведения алкоголя из организма не сложно, достаточно просто провести за собой наблюдение после употребление спиртного. Если Вы желаете поставить настоящий эксперимент, помните начинать нужно с малых доз, а достоверные результаты будут по крайней мере после проведения серии из трех и более независимых опытов. Вообще, выработка собственной меры — «я свою меру, знаю» есть ничто иное, как самостоятельное определение насколько быстрая или медленная алкогольдегидрогеназа (и менее известная ацетальдегиддегидрогеназа — но ведь важна совместная работа этих ферментов) у человека. К сожалению, психоактивные свойства алкоголя настолько смазывают картину «чистого» проведения опыта, что результаты по определению собственной меры редко соответствуют истине. Чем больше у человека проблем со спиртным, тем меньше на него влияет особенность работы его ферментативной системы. Организм сам, тратя огромные ресурсы, подстраивается под огромные дозы спиртного которые в него заливают алкоголики. Да, на второй стадии алкоголизма толерантность алкоголю намного превышает таковую у вообще не пьющего человека, но алкогольдегидрогеназа тут не причем. Алкогольдегидрогеназа в таблетках Настойчивое желание решить проблему с алкоголем самым простым способом приводит к тому, что возникают устойчивые алкогольные мифы. Так в отношении ферментов, утилизирующих этиловый спирт в организме они тоже имеются. Одним из таких мифов является мнение что есть таблетки, с помощью которых якобы можно «добавить» себе энзимов по переработке алкоголя или сделать их быстрее. Некоторые алкоголики, особенно в период временной повышенной устойчивости хвалятся своей сильной, быстрой алкогольдегидрогеназой или её количеством. Как ни странно начинающие алкоголики, а также те кто уже спился окончательно (на заключительный этапе алкогольной зависимости) нередко хотят именно такую алкогольную толерантность. Ведь выпивать больше всех в их глазах это демонстрация силы и здоровья. Вот почему люди ищут способы как управлять этим ферментом. Алкогольдегидрогеназа в таблетках — это средство, которое хотят купить для того чтобы с помощью медикаментов управлять алкогольной зависимостью, минимизировать вред от злоупотребления. Надо отметить, что наука действительно продвинулась в отношении воздействия на энзимы био-утилизации алкоголя в организме. Так на слаженную работу алкогольдегидрогеназы и ацетальдегидрогеназы активно влияют препараты так называемой химической защиты от алкоголя (прежде всего дисульфирам и цинамид). Но вопреки ожиданиям пьяниц, которые в большинстве своем хотят продолжать пить, но с минимальными вредными последствиями — эти таблетки нарушают и замедляют процесс, а не ускоряют его. Таким образом выходит таблетки подобные есть, только они противоположного действия — мешают пить, а не делают этот процесс безопасным.  Алкогольдегидрогеназа в народах и странах: генетическая устойчивость Исходя из данных генетических популяционных исследований, безопасный вариант алкогольдегидрогеназы (точнее сочетания ферментов метаболизма алкоголя), снижающий риск алкогольной зависимости, выявляется в среднем у 3-7% жителей Восточной Европы в том числе и на соответствующей части России. Это сочетание мало распространено в Западной Европе, в регионах южнее Сахары и в Северной Америке. Чаще всего «быстрая» алкогольдегидрогеназа наблюдается в Северо-Восточной и Юго-Восточной Азии. Статистические данные позволяют утверждать, что генетически жители РФ алкоголизму устойчивы немного меньше, чем американцы или европейцы или, но значительно сильнее, чем азиаты. Но большая часть наших соотечественников обладает «медленной», алкогольдегидрогеназой — это нужно знать и учитывать, хотя непосредственно на клинику лечения алкоголизма это обстоятельство существенного влияния не оказывает. |
Алкогольдегидрогеназа и её роль в развитии алкоголизма
Ферменты переработки этилового спирта в организме часто становятся предметов домыслов: дескать у кого-то их много, а некоторых нет совсем. Кроме того кто-то утверждает, что можно их так сказать «натренировать» и дальше пить без проблем и тем более без алкоголизма. А как на самом деле обстоят дела в человеком организме с этими энзимами, которые позволяют нам по большей части мало замечать алкогольное отравление. Для Вашего удобства сразу приведем ссылки с narcofree.ru на материалы, которые позволят разобраться в теме:
- Какая допускается безопасная доза алкоголя — здесь, сколько можно пить, чтобы не было никаких последствий;
- Что такое эндогенный алкоголь — читать о роли внутреннего этанола в организме, может ли его показать алкотестер;
- Как отличается метаболизм этилового спирта у женщин — узнать отличия действия алкоголя по сравнению с мужчинами;
- Почему возникает непереносимость алкоголя, какие бывают реакции — тут, причем здесь ферменты и аллергия.
Исходя из археологических изысканий, употребление алкоголя в человеческой культуре появилось задолго до бронзового века, еще 9000 лет назад. В действительности употребление спиртовых продуктов, очевидно, началось еще намного раньше. В естественной среде многие животные поедают бродящие перезрелые ягоды и фрукты, содержащие алкоголь.
И беспочвенно утверждать, что наши прародители были образцом трезвости. Закономерно, что в результате эволюции у человека сформировались необходимые ферменты — алкогольдегидрогеназа и ацетальдегиддегидрогеназа, способные эффективно перерабатывать алкоголь.
Быстрые и медленные, активные и пассивные алкогольные ферменты
В генотипе человека могут существовать различные варианты (аллели) генов, от которых зависит кодировка, а значит эффективность ферментов метаболизма алкоголя. Если популяризировать, то возможны две вариации алкогольдегидрогеназы одну для простоты назовем «быстрой», другую «медленной». Такие названия выбраны не случайно «быстрая» алкогольдегидрогеназа (ADh2B*47His) может до 90 раз эффективнее, а значит быстрее метаболизировать этанол в ацетальдегид.
В этом случае при употреблении алкоголя содержание его в крови нарастает медленно, человек гораздо менее пьянеет, слабее привыкает к алкоголю. Есть и обратная сторона, в результате срабатывания «быстрой» алкогольдегидрогеназы образуется больше ацетальдегида, токсическим образом действующего на организм.
То же самое справедливо и в отношении ацетальдегиддегидрогеназы. Этот фермент может быть «активным» и «пассивным». Ацетальдегиддегидрогеназа в активной форме быстро превращает ацетальдегид, а пассивная форма (например, ALDН2*487Lys) может делать это только медленно.
Различные сочетания форм двух основных ферментов разрушающих алкоголь объясняют разную генетическую предрасположенность у людей к алкоголизму. Если у человека «быстрая» алкогольдегидрогеназа и «пассивная» ацетальдегиддегидрогеназа, то даже небольшая доза этанола моментально превращается в уксусный альдегид, который долгое время находится в крови, и действует токсично.
Похмелье таких людей наступать обычно не к утру, а значительно ранее после потребления спиртного, из-за этого спиртное удовольствия приносит им мало, поэтому среди них алкоголики встречаются крайне редко. По данным научных исследований из Кореи, среди людей с двумя копиями генов с «медленными» и «активными» вариациями этих ферментов в 91 раз чаще отмечаются случаи алкоголизма, чем среди людей обладающих «быстрой» алкогольдегидрогеназой и «пассивной» ацетальдегиддегидрогеназой соответственно.
Одним наглядных признаков накопления токсичного ацетальдегида – резкое после выпивки покраснение кожи лица. Следовательно, у человека, лицо которого значительно чаще краснеет после выпивки склонность к алкоголизму меньше.
«Пассивная» ацетальдегиддегидрогеназа играет роль естественного защитного механизма от алкогольной зависимости, вызывая преждевременный дискомфорт от употребления алкоголя — похмелье. Узнав, особенности генотипа, а следовательно вариации алкоголь- и ацетальдегиддегидрогеназы имеются у человека, можно сделать выводы. Дать соответствующие рекомендации, оценив риски для здоровья, генетическую склонность к алкоголизму, связанные с употреблением спиртного. Генетические исследования становятся все доступнее и проводятся во многих клиниках.
Как узнать есть ли у тебя алкогольдегидрогеназа медленная или быстрая
Людей, особенно перед праздниками часто интересует, а есть ли у них алкогольдегидрогиназа, как увеличить этот фермент в организме или по крайней мере заставить его работать на полную. Так вот, современный уровень развития медицины еще не позволяет менять биохимию обмена веществ в организме, каждом приходиться пользоваться тем, что есть. Еще раз следует уточнить, алкогольдегидрогиназа и ацетальдегиддегидрогеназа — есть и у тебя и у меня и вообще у всех.
Эти ферменты метаболизма этанола наличествуют хотя бы потому, что в каждом человеке есть так называемый эндогенный алкоголь, который самостоятельно, пускай в очень малых образуется в его организме. Наличие эндогенного алкоголя никак не зависит от того пил ли человек спиртные напитки или нет. Он есть по факту, а значит, есть и ферменты благодаря которым он не только образовался, но и утилизируется.
Ценность наблюдения за переработкой алкоголя в своем организме
Узнать быстрые или медленные у Вас внутренние катализаторы утилизации и выведения алкоголя из организма не сложно, достаточно просто провести за собой наблюдение после употребление спиртного. Если Вы желаете поставить настоящий эксперимент, помните начинать нужно с малых доз. А достоверные результаты будут по крайней мере после проведения серии из трех и более независимых опытов.
Вообще, выработка собственной меры — «я свою меру, знаю» есть ничто иное, как самостоятельное определение насколько быстрая или медленная алкогольдегидрогеназа (и менее известная ацетальдегиддегидрогеназа — но ведь важна совместная работа этих ферментов) у человека. К сожалению, психоактивные свойства алкоголя настолько смазывают картину «чистого» проведения опыта. Так что результаты по определению собственной меры редко соответствуют истине.
Чем больше у человека проблем со спиртным, тем меньше на него влияет особенность работы его ферментативной системы. Организм сам, тратя огромные ресурсы, подстраивается под огромные дозы спиртного которые в него заливают алкоголики. Да, на второй стадии алкоголизма толерантность алкоголю намного превышает таковую у вообще не пьющего человека, но алкогольдегидрогеназа тут не причем.
Алкогольдегидрогеназа в таблетках
Настойчивое желание решить проблему с алкоголем самым простым способом приводит к тому, что возникают устойчивые алкогольные мифы. Так в отношении ферментов, утилизирующих этиловый спирт в организме они тоже имеются. Одним из таких мифов является мнение что есть таблетки, с помощью которых якобы можно «добавить» себе энзимов по переработке алкоголя или сделать их быстрее.
Некоторые алкоголики, особенно в период временной повышенной устойчивости хвалятся своей сильной, быстрой алкогольдегидрогеназой или её количеством. Как ни странно начинающие алкоголики, а также те кто уже спился окончательно (на заключительный этапе алкогольной зависимости) нередко хотят именно такую алкогольную толерантность. Ведь выпивать больше всех в их глазах это демонстрация силы и здоровья.
Вот почему люди ищут способы как управлять этим ферментом. Алкогольдегидрогеназа в таблетках — это средство, которое хотят купить для того чтобы с помощью медикаментов управлять алкогольной зависимостью, минимизировать вред от злоупотребления.
Надо отметить, что наука действительно продвинулась в отношении воздействия на энзимы био-утилизации алкоголя в организме. Так на слаженную работу алкогольдегидрогеназы и ацетальдегидрогеназы активно влияют некоторые лекарства. А именно, препараты так называемой химической защиты от алкоголя (прежде всего дисульфирам и цинамид). Но вопреки ожиданиям пьяниц, которые в большинстве своем хотят продолжать пить, но с минимальными вредными последствиями — эти таблетки нарушают и замедляют процесс, а не ускоряют его.
Таким образом выходит таблетки подобные есть, только они противоположного действия — мешают пить, а не делают этот процесс безопасным.
Алкогольдегидрогеназа в народах и странах: генетическая устойчивость
Исходя из данных генетических популяционных исследований, безопасный вариант алкогольдегидрогеназы (точнее сочетания ферментов метаболизма алкоголя), снижающий риск алкогольной зависимости, выявляется в среднем у 3-7% жителей Восточной Европы в том числе и на соответствующей части России. Это сочетание мало распространено в Западной Европе, в регионах южнее Сахары и в Северной Америке.
Чаще всего «быстрая» алкогольдегидрогеназа наблюдается в Северо-Восточной и Юго-Восточной Азии. Статистические данные позволяют утверждать, что генетически жители РФ алкоголизму устойчивы немного меньше, чем американцы или европейцы или, но значительно сильнее, чем азиаты. Но большая часть наших соотечественников обладает «медленной», алкогольдегидрогеназой — это нужно знать и учитывать. Хотя непосредственно на клинику лечения алкоголизма это обстоятельство существенного влияния не оказывает.
Утверждение, согласно которому алкогольдегидрогеназа у северных народов практически не вырабатывается — явное упрощение. Россияне в среднем по признакам генетической устойчивости к алкоголю находятся в среднем положении. Профессор Жданов на эту тему придерживается более радикальных взглядов, однако в целях профилактики алкоголизма любую пропаганду необходимо поддержать.
Видео: Геноцид славян Жданов
Можно оценить материал: Вам необходимо включить JavaScript, чтобы проголосоватьМожно поделиться им через соцсети:
А также оставить комментарий.
Популярное по теме:
что это, как повысить уровень, таблетки
Алкогольдегидрогеназа (алкоголь:НАД+-оксидоредуктаза) — фермент, который вырабатывается в организме. Он способен катализировать окисление спирта. Чтобы утилизировать этанол, вступает в действие ацетальдегидрогеназа. Ферменты находятся в организме человека в разном объеме, имеют различную скорость метаболизма. Их большую концентрацию можно обнаружить в печени; малое количество находится в почках. В мускулатуре есть лишь следы ферментов. Они влияют на то, появится ли у человека склонность к выпивке или стойкая непереносимость спиртного.
Виды алкогольных ферментов
Алкогольдегидрогеназа находится в организме каждого человека. И неважно, употребляется ли алкоголь, в каких количествах. Например, эндокринный алкоголь возникает в организме самостоятельно. Для его выведения требуется участие ферментов. Алкогольдегидрогеназа делится на две формы. Активная быстро проходит процесс метаболизма.
Пассивная алкогольдегидрогеназа все процессы осуществляет медленно. Ее участие в метаболизме плохо выражено. Переработка спирта слабая; его значительная часть остается в крови. В зависимости от того, какова его концентрация, происходит более позднее отрезвление. При замедленных реакциях алкогольдегидрогеназы у человека появляется больше опасности попасть под алкогольную зависимость.
Быстрая алкогольдегидрогеназа выполняет функции ктализатора оперативно. Ее действие позволяет активно справляться с метаболизмом этанола в ацетальдегид. Токсины в крови увеличиваются в стремительном режиме. Опьянение наступает быстро; так же скоро приходят похмелье и последующее за ним отрезвление. Люди, имеющие данный тип алкогольдегидрогеназы, почти никогда не привыкают к алкоголю. У них повышается возможность отравиться спиртными напитками из-за быстрого распространения токсинов.
Как узнать свой вид ферментов: симптомы
Человек сможет выявить в себе определенный вид алкогольдегидрогеназы, исследуя свой организм и наблюдая за его реакцией на алкоголь. Симптомы непереносимости спиртных напитков проявляются стандартно. Разной может быть только их сила и яркость. Признаками непереносимости считаются следующие:
- краснота на коже как реакция на попадание спирт в организм в любых дозах;
- покраснение глазных белков и слезоточивость;
- аллергический кашель, возникающий в виде приступов;
- зудящие места на коже;
- головокружение и болезненные пульсирующие удары в голове;
- усиленное потоотделение;
- обморок.
Почему возникает непереносимость алкоголя?
Механизм действия алкогольдегидрогеназы таков, что у человека возникает предрасположенность к употреблению алкоголя или отвращение к нему на уровне генетики. Если алкогольдегидрогеназа медленного типа сочетается с ацетальдегидрогеназой в активной форме, то в крови будет долго сохраняться высокая концентрация алкоголя. Физические ощущения становятся исключительно приятными, что провоцирует стойкую зависимость. Если же скорость и интенсивность у этих двух ферментов поменять местами, то тогда организм будет негативно реагировать на самые маленькие дозы спиртного. Возникают раннее похмелье и симптомы отравления.
Генетическая устойчивость народов и стран
Разные народности имеют свою степень выработки алкогольдегидрогеназы. Русские в большинстве случаев имеют в организме пассивную алкогольдегидрогеназу, от чего склонность к выпивке у них повышается. Наблюдения показывают, что всего лишь 10% русского населения отличаются тем, что имеют быстрый тип фермента.
У азиатских народов алкогольдегидрогеназа вырабатывается в основном в быстрой форме. А вот ацетальдегидрогеназа, наоборот, обладает пассивным типом. Такая генетика провоцирует быстрое опьянение минимальным количеством алкоголя. Так же быстро наступают похмелье и отрезвление. Северные народы переносят алкоголь в больших количествах, так как алкогольдегидрогеназа у них проявляется только в медленной форме.
Непереносимость у мужчин и женщин
Форма и тип алкогольдегидрогеназы могут изменяться на протяжении времени. В зависимости от возраста она может быть быстрой или же медленной. Если проследить за тем, как реагирует организм юноши и зрелой личности, то можно увидеть, какие различные действия алкоголя. В 20 лет человек может отравиться определенной дозой спиртного или сильно запьянеть. В 30 лет та же доза приведет к ощущению расслабленности — не более. Это говорит о том, что к зрелым годам алкогольдегидрогеназа преобразовалась с активной формы в пассивную.
Половой признак оказывает не меньшее влияние на количество фермента, образующегося в организме. Алкогольдегидрогеназа формируется в разных органах и от этого зависит предрасположенность к желанию выпить. Например, мужчины могут употреблять алкоголь в больших количествах по сравнению с женщинами. Все потому, что у них алкогольдегидрогеназа формируется в желудке. Часть этанола еще в желудке метаболизируется, отчего меньшая его доза попадает в кровь.
Чтобы опьянеть, мужчины употребляют много алкоголя за один раз. У женщин спиртное моментально проникает в кровь, поэтому они пьют меньше.
Контроль количества ферментов
Когда человек узнает, что внутри его организма находятся особые ферменты, которые метаболизируют алкоголь, у него возникает вопрос: можно ли повысить уровень алкогольдегидрогеназы, а также скорость ее работы? Было проведено немало исследований, чтобы узнать, можно ли управлять алкогольдегидрогеназой. Их результаты показали, что биохимические процессы не подлежат управлению. И те способы, которые якобы предлагают устранить дефицит фермента — всего лишь миф. Ошибочным является то мнение, что если алкоголь будет перерабатываться в организме быстрее, то это приведет к зависимости от него.
Другое дело, когда алкоголизм перешел во вторую стадию и выше. В этом случае ферменты почти не участвуют в переработке: их роль минимальна. Алкоголик все равно будет пить столько, сколько и обычно, не обращая внимания на явные или скрытые «протесты» собственного организма. Поэтому проблему нужно искоренять, как только она появилась, так как потом это сделать будет все сложнее и сложнее.
Если провести некоторые простые исследования, можно узнать о том, каковы типы алкогольдегидрогеназы и ацетальдегидрогеназы. Правильным будет определить норму спиртного, которая не повредит организму. Человек решает сам, как ему жить, хочет ли он зависеть от алкоголя или желает быть свободным от выпивки. Если он понимает ее опасность, то должен самостоятельно бороться с желаниями выпить больше допустимой дозы.
Медикаментозные препараты
У многих возникает навязчивое желание разрешить раз и навсегда проблему алкогольной зависимости. От этого появляются различного рода выдумки, «алкогольные мифы». Это касается и ферментов, которые избавляют организм от части спирта. Существует мнение, что алкогольдегидрогеназа выпускается в таблетках, которые могут повысить уровень этого фермента в организме или ускорить его действие.
Алкоголики в момент, когда они справляются с собой и не пьют какое-то время, нередко делают акцент на том, что у них сильная и ускоренная алкогольдегидрогеназа. Почти все алкоголики на любой стадии зависимости хотят иметь повышенное количество фермента в организме. Это желание возникает от того, что демонстрация выпитого алкоголя в больших количествах поднимает их самооценку, говорит о крепком здоровье и наличии быстро действующего фермента.
Поэтому многие хотят найти такой способ, который позволил бы им самостоятельно управлять ферментом, усиливать его действие и увеличивать его количество в организме. Многие ищут алкогольдегидрогеназу, продающуюся в виде медикаментов, чтобы владеть собой и управлять своей алкогольной зависимостью, уменьшить вредное действие алкоголя на собственный организм.
Такие препараты, как цинамид и дисульфирам, являются средством химической защиты и уменьшают вредной воздействие алкоголя. Но они вовсе не делают процесс выпивки полностью безопасным.
что это, как повысить уровень, таблетки
Алкогольдегидрогеназа (алкоголь:НАД+-оксидоредуктаза) — фермент, который вырабатывается в организме. Он способен катализировать окисление спирта. Чтобы утилизировать этанол, вступает в действие ацетальдегидрогеназа. Ферменты находятся в организме человека в разном объеме, имеют различную скорость метаболизма. Их большую концентрацию можно обнаружить в печени; малое количество находится в почках. В мускулатуре есть лишь следы ферментов. Они влияют на то, появится ли у человека склонность к выпивке или стойкая непереносимость спиртного.
Виды алкогольных ферментов
Алкогольдегидрогеназа находится в организме каждого человека. И неважно, употребляется ли алкоголь, в каких количествах. Например, эндокринный алкоголь возникает в организме самостоятельно. Для его выведения требуется участие ферментов. Алкогольдегидрогеназа делится на две формы. Активная быстро проходит процесс метаболизма.
Пассивная алкогольдегидрогеназа все процессы осуществляет медленно. Ее участие в метаболизме плохо выражено. Переработка спирта слабая; его значительная часть остается в крови. В зависимости от того, какова его концентрация, происходит более позднее отрезвление. При замедленных реакциях алкогольдегидрогеназы у человека появляется больше опасности попасть под алкогольную зависимость.
Быстрая алкогольдегидрогеназа выполняет функции ктализатора оперативно. Ее действие позволяет активно справляться с метаболизмом этанола в ацетальдегид. Токсины в крови увеличиваются в стремительном режиме. Опьянение наступает быстро; так же скоро приходят похмелье и последующее за ним отрезвление. Люди, имеющие данный тип алкогольдегидрогеназы, почти никогда не привыкают к алкоголю. У них повышается возможность отравиться спиртными напитками из-за быстрого распространения токсинов.
Как узнать свой вид ферментов: симптомы
Человек сможет выявить в себе определенный вид алкогольдегидрогеназы, исследуя свой организм и наблюдая за его реакцией на алкоголь. Симптомы непереносимости спиртных напитков проявляются стандартно. Разной может быть только их сила и яркость. Признаками непереносимости считаются следующие:
- краснота на коже как реакция на попадание спирт в организм в любых дозах;
- покраснение глазных белков и слезоточивость;
- аллергический кашель, возникающий в виде приступов;
- зудящие места на коже;
- головокружение и болезненные пульсирующие удары в голове;
- усиленное потоотделение;
- обморок.
Почему возникает непереносимость алкоголя?
Механизм действия алкогольдегидрогеназы таков, что у человека возникает предрасположенность к употреблению алкоголя или отвращение к нему на уровне генетики. Если алкогольдегидрогеназа медленного типа сочетается с ацетальдегидрогеназой в активной форме, то в крови будет долго сохраняться высокая концентрация алкоголя. Физические ощущения становятся исключительно приятными, что провоцирует стойкую зависимость. Если же скорость и интенсивность у этих двух ферментов поменять местами, то тогда организм будет негативно реагировать на самые маленькие дозы спиртного. Возникают раннее похмелье и симптомы отравления.
Генетическая устойчивость народов и стран
Разные народности имеют свою степень выработки алкогольдегидрогеназы. Русские в большинстве случаев имеют в организме пассивную алкогольдегидрогеназу, от чего склонность к выпивке у них повышается. Наблюдения показывают, что всего лишь 10% русского населения отличаются тем, что имеют быстрый тип фермента.
У азиатских народов алкогольдегидрогеназа вырабатывается в основном в быстрой форме. А вот ацетальдегидрогеназа, наоборот, обладает пассивным типом. Такая генетика провоцирует быстрое опьянение минимальным количеством алкоголя. Так же быстро наступают похмелье и отрезвление. Северные народы переносят алкоголь в больших количествах, так как алкогольдегидрогеназа у них проявляется только в медленной форме.
Непереносимость у мужчин и женщин
Форма и тип алкогольдегидрогеназы могут изменяться на протяжении времени. В зависимости от возраста она может быть быстрой или же медленной. Если проследить за тем, как реагирует организм юноши и зрелой личности, то можно увидеть, какие различные действия алкоголя. В 20 лет человек может отравиться определенной дозой спиртного или сильно запьянеть. В 30 лет та же доза приведет к ощущению расслабленности — не более. Это говорит о том, что к зрелым годам алкогольдегидрогеназа преобразовалась с активной формы в пассивную.
Половой признак оказывает не меньшее влияние на количество фермента, образующегося в организме. Алкогольдегидрогеназа формируется в разных органах и от этого зависит предрасположенность к желанию выпить. Например, мужчины могут употреблять алкоголь в больших количествах по сравнению с женщинами. Все потому, что у них алкогольдегидрогеназа формируется в желудке. Часть этанола еще в желудке метаболизируется, отчего меньшая его доза попадает в кровь.
Чтобы опьянеть, мужчины употребляют много алкоголя за один раз. У женщин спиртное моментально проникает в кровь, поэтому они пьют меньше.
Контроль количества ферментов
Когда человек узнает, что внутри его организма находятся особые ферменты, которые метаболизируют алкоголь, у него возникает вопрос: можно ли повысить уровень алкогольдегидрогеназы, а также скорость ее работы? Было проведено немало исследований, чтобы узнать, можно ли управлять алкогольдегидрогеназой. Их результаты показали, что биохимические процессы не подлежат управлению. И те способы, которые якобы предлагают устранить дефицит фермента — всего лишь миф. Ошибочным является то мнение, что если алкоголь будет перерабатываться в организме быстрее, то это приведет к зависимости от него.
Другое дело, когда алкоголизм перешел во вторую стадию и выше. В этом случае ферменты почти не участвуют в переработке: их роль минимальна. Алкоголик все равно будет пить столько, сколько и обычно, не обращая внимания на явные или скрытые «протесты» собственного организма. Поэтому проблему нужно искоренять, как только она появилась, так как потом это сделать будет все сложнее и сложнее.
Если провести некоторые простые исследования, можно узнать о том, каковы типы алкогольдегидрогеназы и ацетальдегидрогеназы. Правильным будет определить норму спиртного, которая не повредит организму. Человек решает сам, как ему жить, хочет ли он зависеть от алкоголя или желает быть свободным от выпивки. Если он понимает ее опасность, то должен самостоятельно бороться с желаниями выпить больше допустимой дозы.
Медикаментозные препараты
У многих возникает навязчивое желание разрешить раз и навсегда проблему алкогольной зависимости. От этого появляются различного рода выдумки, «алкогольные мифы». Это касается и ферментов, которые избавляют организм от части спирта. Существует мнение, что алкогольдегидрогеназа выпускается в таблетках, которые могут повысить уровень этого фермента в организме или ускорить его действие.
Алкоголики в момент, когда они справляются с собой и не пьют какое-то время, нередко делают акцент на том, что у них сильная и ускоренная алкогольдегидрогеназа. Почти все алкоголики на любой стадии зависимости хотят иметь повышенное количество фермента в организме. Это желание возникает от того, что демонстрация выпитого алкоголя в больших количествах поднимает их самооценку, говорит о крепком здоровье и наличии быстро действующего фермента.
Поэтому многие хотят найти такой способ, который позволил бы им самостоятельно управлять ферментом, усиливать его действие и увеличивать его количество в организме. Многие ищут алкогольдегидрогеназу, продающуюся в виде медикаментов, чтобы владеть собой и управлять своей алкогольной зависимостью, уменьшить вредное действие алкоголя на собственный организм.
Тест: Проверь совместимость своего лекарства с алкоголем Введите в строку поиска название препарата и узнайте насколько он совместим с алкоголемТакие препараты, как цинамид и дисульфирам, являются средством химической защиты и уменьшают вредной воздействие алкоголя. Но они вовсе не делают процесс выпивки полностью безопасным.
алкогольдегидрогеназы - Alcohol dehydrogenase - qwe.wiki
Алкогольдегидрогеназы ( ADH ) ( ЕС 1.1.1.1 ) представляет собой группа дегидрогеназы ферментов , которые происходят во многих организмах и облегчать взаимопревращение между спиртами и альдегидами или кетонами с уменьшением никотинамидадениндинуклеотида (НАД + ) , чтобы NADH. В организме человека и многих других животных , они служат , чтобы сломать спирты , которые в противном случае являются токсичными, и они также участвуют в формировании полезного альдегида, кетона, или спиртовых групп в процессе биосинтеза различных метаболитов . В дрожжах , растениях и многие бактерий , некоторые алкогольдегидрогеназы катализируют обратную реакцию как часть ферментации , чтобы обеспечить постоянную подачу NAD + .
эволюция
Генетические доказательства при сравнении нескольких организмов показали , что глутатион -зависимого формальдегида дегидрогеназу , идентичен класс III алкогольдегидрогеназы (АДГ-3 / ADH5), как предполагают, является родовым ферментом для всей семьи ADH. На раннем этапе в процессе эволюции, эффективный метод для устранения как эндогенный и экзогенного формальдегида имеет важное значение и эта способность сохраняется родовой ADH-3 в течение времени. Gene дублирование АДГ-3, а затем ряд мутаций, привело к эволюции других ADHS.
Способность производить этанол из сахара (который является основой , как алкогольные напитки сделаны) , как полагают, первоначально развивались в дрожжах . Хотя эта функция не является адаптивной с энергетической точки зрения, делая алкоголь в таких высоких концентрациях , так что они будут токсичны для других организмов, дрожжевые клетки могут эффективно устранить их конкуренцию. Так как гниение плодов может содержать более чем на 4% этанол, животные едят фрукты нуждались в системе метаболизировать экзогенный этанол. Считалось , что объяснить сохранение этанола активного АДГ в других , чем дрожжей вида, хотя АДГ-3 , как теперь известно , также играют важную роль в азотной сигнализации оксида .
В организме человека, секвенирование adh2b гена (ответственного за продуцирование дегидрогеназы спирта полипептида ) показывает несколько функциональных вариантов. В одном из них есть SNP (полиморфизм единичного нуклеотида) , что приводит либо к гистидину или остаток аргинина в положении 47 в зрелом полипептиде. В варианте гистидина, фермент является гораздо более эффективным в вышеупомянутой конверсии. Фермент , ответственный за превращение ацетальдегида в ацетат, однако, остается неизменным, что приводит к дифференциальному скорости катализа подложки и вызывает накопление токсичных ацетальдегида, вызывая повреждение клеток. Это обеспечивает некоторую защиту от чрезмерного потребления алкоголя и алкогольной зависимости (алкоголизм). Различные гаплотипы , возникающие в результате этой мутации в большей степени сконцентрированы в областях вблизи Восточного Китая, в регионе также известен своей низкой толерантности к алкоголю и зависимости.
Было проведено исследование, чтобы найти корреляцию между распределением аллелей и алкоголизмом, а также результаты свидетельствуют о том, что распределение аллельного возникло вместе с выращиванием риса в регионе между 12000 и 6000 годами назад. В регионах, где рис был культивируемых, рис был также ферментируют в этанол. Результаты повышенной доступности алкоголя привело к алкоголизму и злоупотреблений со стороны тех, кто в состоянии приобрести его, что приводит к снижению репродуктивной пригодности. Те, у кого вариантных аллеля имеют мало терпимости к алкоголю, тем самым снижая вероятность зависимости и злоупотребления. Гипотеза утверждает, что те люди, с гистидин варианта фермента были достаточно чувствительны к воздействию алкоголя, что дифференцированный репродуктивный успех возникли и соответствующие аллели были переданы через поколения.
Классическая теория эволюции Дарвина будет действовать для выбора против пагубного формы фермента (вариант Arg) из - за пониженной репродуктивный успех лиц , несущих аллель. Результатом будет более высокая частота аллеля , ответственного за His-варианта фермента в тех регионах , которые находились под селективным давлением дольше. Распределение и частота его варианты следует распространению выращивания риса на внутренние районы Азии, с более высокими частотами Его вариантом в тех регионах , которые культивируемые рис дольше всех . Географическое распределение аллелей , кажется, следовательно, являются результатом естественного отбора в отношении лиц с более низким репродуктивным успехом, а именно тех , кто нес вариант аллель Arg и были более восприимчивы к алкоголизму.
открытие
 Лошадь LADH (печени алкогольдегидрогеназы)
Лошадь LADH (печени алкогольдегидрогеназы) Первый изолированный алкогольдегидрогеназы (АДГ) был очищен в 1937 году из Saccharomyces CEREVISIAE (пивные дрожжи). Многие аспекты каталитического механизма для лошади печени ADH фермента были исследованы Теореллем и его сотрудниками. АДГ был также одним из первых олигомерных ферментов , которые имели его аминокислотную последовательность , и трехмерная структура определена.
В начале 1960 - х, он был обнаружен в плодовых мух рода Drosophila .
свойства
Спиртовые дегидрогеназы содержат группу из нескольких изоферментов , которые катализируют окисление первичных и вторичных спиртов в альдегиды и кетоны, соответственно, а также может катализировать обратную реакцию. У млекопитающих это окислительно - восстановительный (снижение / окисления) с участием кофермента никотинамид аденин динуклеотид (NAD + ).
Окисление спирта
Механизм действия в организме человека
меры
- Связывание кофермента НАД +
- Связывание субстрата спирта путем координации с цинком
- Депротонирование His-51
- Депротонирование никотинамид рибозы
- Депротонирование Thr-48
- Депротонирования спирта
- Гидридный переход от алкоксида иона к NAD + , что приводит к NADH и цинк связан альдегид или кетон
- Выпуск альдегида.
Механизм у дрожжей и бактерий является обратной этой реакции. Эти шаги поддерживаются с помощью кинетических исследований.
Вовлеченные субъединиц
Субстрат координирован цинка и этот фермент имеет два атома цинка на субъединицу. Одним из них является активным сайтом, который участвует в катализе. В АЦ лиганды являются Cys-46, Cys-174, His-67, и одна молекула воды. Другая субъединица участвует со структурой. В этом механизме, гидрид из спирта идет в NAD + . Кристаллические структуры показывают , что His-51 deprotonates никотинамидной рибоза, который deprotonates Ser-48. И, наконец, Ser-48 deprotonates спирта, что делает его альдегид. С механистической точки зрения, если фермент добавляет гидрид к повторному поверхности NAD + , полученный водород вводят в положение про-R. Ферменты , которые добавляют гидрид к повторному лицу, считаются дегидрогеназа класса А.
Активный сайт
Активный сайт алкогольдегидрогеназыАктивный центр человеческого ADh2 (PDB: 1HSO) состоит из атома цинка, His-67, Cys-174, Cys-46, Thr-48, His-51, Ile-269, Вал-292, Ала-317 и Phe-319. В широко изученных изоформах лошади печени, Thr-48 представляет собой Ser, и Leu-319 является Phe. Цинка координирует субстрат (спирт). Цинка координируется Cys-46, Cys-174 и His-67. Лей-319, Ала-317, His-51, Ile-269 и Val-292 стабилизации NAD + за счет образования водородных связей . Его-51 и Ил-269 образуют водородные связи с спиртов на никотинамид рибозы. Phe-319, Ала-317 и Val-292 образуют водородные связи с амидом на NAD + .
Структурно сайт цинка
Структурный цинка связывающий мотив в алкогольдегидрогеназы из МД-моделированияМлекопитающие алкогольдегидрогеназы также структурный сайт цинка. Это Zn, ион играет структурную роль и имеет решающее значение для стабильности белка. Структуры каталитического и структурных сайты цинка в печени лошади алкогольной дегидрогеназы (HLADH) как показано в кристаллографических структурах, которые были изучены в вычислительном с квантово-химическим, а также с классическими методами молекулярной динамики. Структурно-сайт цинка состоит из четырех близко расположенных цистеиновых лигандов (Cys97, Cys100, Cys103 и Cys111 в аминокислотной последовательности), расположенных в почти симметричном тетраэдре вокруг иона Zn. Недавнее исследование показало, что взаимодействие между цинком и цистеином определяется прежде всего электростатическим вкладом с дополнительным ковалентным вкладом в связывание.
Типы
Человек
У людей, АДГ существует в нескольких формах , как димер и кодируется , по меньшей мере , семь различных генов. Есть пять классов (IV) алкогольдегидрогеназы, но печеночная форма , которая используется в основном в организме человека является класс 1. Класс 1 состоит из & alpha ; , β, и у субъединиц, которые кодируются генами ADh2A , adh2b и ADh2C . Фермент присутствует на высоких уровнях в печени и слизистой оболочки желудка . Это катализирует окисление из этанола до ацетальдегида (этаналя):
- СН 3 СН 2 ОН + НАД + → СН 3 СНО + НАДН + Н +
Это позволяет потребление алкогольных напитков , но его эволюционная цель, вероятно , распад спиртов , естественно , содержащиеся в пищевых продуктах или продуцируемые бактериями в пищеварительном тракте .
Еще одна эволюционная цель может быть метаболизм эндогенного алкоголя витамина А ( ретинола ), который генерирует гормон ретиноевой кислоты , хотя функция здесь может быть в первую очередь устранение токсичных уровней ретинола.
Алкогольдегидрогеназа также участвует в токсичности других видов алкоголя: Так , например, окисляет метанол для получения формальдегида и этиленгликоль , чтобы в конечном счете , дают гликолевую и щавелевую кислоты . Люди, по крайней мере , шесть немного разные дегидрогеназы спирта. Каждый из них является димером (т.е., состоит из двух полипептидов ), с каждым димером , содержащих два цинковых ионов Zn 2+ . Один из этих ионов имеют решающее значение для функционирования фермента: Он расположен на каталитическом сайте и имеет гидроксильную группу спирта на месте.
Алкоголь дегидрогеназа варьируется между мужчинами и женщинами, между молодым и старым, и среди населения различных районов мира. Например, молодые женщины не в состоянии перерабатывать алкоголь в той же скоростью , как и молодые мужчины , потому что они не выражают алкогольдегидрогеназу как высоко, хотя обратное верно среди людей среднего возраста. Уровень активности не может зависеть только от уровня экспрессии , но и на аллельном разнообразие среди населения.
Человеческие гены , которые кодируют класс II, III, IV, V и алкоголь дегидрогеназы ADh5 , ADH5 , ADH7 и ADH6 , соответственно.
Дрожжи и бактерии
В отличие от людей, дрожжей и бактерий ( за исключением молочно - кислых бактерий и кишечной палочки в определенных условиях) не ферментируют глюкозу в лактат. Вместо этого они ферментируют его в этанол и СО 2 . Общая реакция можно увидеть ниже:
- Глюкоза + 2 АДФ + 2 Pi → 2 этанол + 2 CO 2 + 2 АТФ + 2 Н 2 О
В дрожжах и многие бактерий , алкогольдегидрогеназа играет важную роль в ферментации: Пирувато в результате гликолиза превращается в ацетальдегид и диоксид углерода , и ацетальдегид затем восстанавливает в этанол с помощью алкогольдегидрогеназы под названием ADh2. Целью этого последнего этапа является регенерация NAD + , так что энергия , генерирующим гликолиза может продолжаться. Люди используют этот процесс для производства алкогольных напитков, позволяя дрожжи ферментных различных фруктов или зерно. Дрожжи могут производить и потреблять их собственный алкоголь.
Основным алкогольдегидрогеназы в дрожжах больше, чем человеческий один, состоящий из четырех человек, а не только в двух субъединиц. Он также содержит цинк в своем каталитическом сайте. Вместе с цинксодержащим алкоголем дегидрогеназой животных и человека, эти ферменты из дрожжей и многих бактерий образуют семейство «с длинной цепью» -спирт дегидрогеназа.
Пивные дрожжи также имеет другую дегидрогеназы спирта, ADh3 , который развился из дубликата версии хромосомы , содержащей ADh2 ген. АДГ2 используется дрожжами для превращения этанола в ацетальдегид обратно, и выражаются только тогда , когда концентрация сахара является низкой. Наличие этих двух ферментов позволяет дрожжи для производства спирта , когда сахар в изобилии (и тогда этот спирт убивает микробы конкурирующими), а затем продолжить с окислением спирта только сахар, и конкуренция, ушла.
растения
В растениях, АДГ катализирует ту же реакцию , как у дрожжей и бактерий , чтобы гарантировать , что существует постоянная подача NAD + . Кукуруза имеет две версии АДГ - ADh2 и ADh3, Резуховидка Таля содержит только один ген АДГ. Структура Arabidopsis АДГ составляет 47% -conserved, по отношению к АДГ из печени лошади. Структурно и функционально важные остатки, такие как семь остатков , которые обеспечивают лиганды для каталитических и некаталитических атомов цинка, однако, сохраняются, предполагая , что ферменты имеют одинаковую структуру. АДГ экспрессируется на низких уровнях в корнях молодых растений , выращенных на агаре. Если корни не хватает кислорода, экспрессия АДГ значительно возрастает. Его экспрессия также увеличивается в ответ на обезвоживания, низких температур и АБК , и он играет важную роль в созревания плодов, развитие рассады и развития пыльцы. Различия в последовательностях АДГА у разных видов были использованы для создания филогенеза , показывающий , как тесно связаны различных виды растений. Это идеальный ген для использования из - за его удобный размер (2-3 кб в длине с кодирующей последовательностью нуклеотидов в ≈1000) и низкое число копий.
Железосодержащие
Третье семейство спиртовых дегидрогеназа, не имеющих отношения к выше два, являются железо отработанных из них. Они встречаются у бактерий и грибов. По сравнению с ферментами вышеуказанных семей, эти ферменты являются кислород-чувствительными. Члены железосодержащего алкогольдегидрогеназы семьи включают в себя:
- Saccharomyces CEREVISIAE алкогольдегидрогеназы 4 (ген ADh5)
- Zymomonas Mobilis алкогольдегидрогеназы 2 (ген adhB)
- Кишечная палочка пропандиол оксидоредуктаза EC 1.1.1.77 (ген Fuco), фермент участвует в обмен веществ из фукозы , и который такжекажется, содержит двухвалентный ион (ы).
- Clostridium acetobutylicum НАДФНО - и НАДНА -зависимый бутанол дегидрогеназа EC 1.1.1.- (гены ADh2, bdhA и bdhB), ферментыкоторые обладают активностьюиспользованием бутанола и этанола в качестве субстратов .
- E.coli , adhE, железо-зависимый фермент , который таит в себе три различных вида деятельности: алкогольдегидрогеназы, ацетальдегид дегидрогеназы (ацетилирующий) EC 1.2.1.10 и пирувата-формиат лиазы-deactivase.
- Бактериальный глицерина дегидрогеназы ЕС 1.1.1.6 (ген GLDA или dhaD).
- Clostridium kluyveri НАД-зависимых 4-гидроксибутират - дегидрогеназа (4hbd) EC 1.1.1.61
- Citrobacter freundii и клебсиелл пневмонии 1,3-пропандиол - дегидрогеназа ЕС 1.1.1.202 (ген dhaT)
- Bacillus methanolicus НАД-зависимых метанола дегидрогеназы ЕС 1.1.1.244
- Кишечная палочка и сальмонелла Typhimurium этаноламина использование белок eutG.
- E.coli , гипотетический белок yiaY.
Другие типы
Еще один класс спирт дегидрогеназа принадлежит quinoenzymes и требует хиноидных кофакторов (например, пирролохинолинхинон, PQQ) в качестве ферментных переплете акцепторов электронов. Типичным примером этого типа фермента является метанол-дегидрогеназы из метилотрофных бактерий.
Приложения
В биотрансформации, алкоголь дегидрогеназы часто используются для синтеза энантиомерно чистых стереоизомеров хиральных спиртов. Часто, высокая химио- и энантиоселективность может быть достигнуто. Одним из примеров является алкогольдегидрогеназы из Lactobacillus Brevis ( Lb АДГ), который описан как универсальный биокатализатор. Высокая chemospecificity была подтверждена также в случае субстратов , представляющих два потенциальных сайта редокса. Например , коричный представляет как алифатическую двойную связь и альдегидную функцию. В отличии от обычных катализаторов, алкоголь дегидрогеназа способна избирательно действовать только на последнем, получая исключительно коричный спирт .
В топливных элементах, алкоголь дегидрогеназа может быть использована , чтобы катализировать расщепление топлива для этанола топливного элемента . Ученые в Университете Сент - Луиса использовали углерода при поддержке дегидрогеназы спирта с поли ( метиленового зеленого цвета ) в качестве анода, с нафионовую мембраны, чтобы достигнуть приблизительно 50 μ A / см 2 .
В 1949 году Е. Racker определен одну единицу активности алкогольдегидрогеназы , как количество , которое приводит к изменению оптической плотности от 0,001 в минуту при стандартных условиях анализа . В последнее время международное определение единицы ферментативной (ЕС) был более распространенным: одна единица алкогольдегидрогеназы будет преобразовывать 1,0 мкмоль этанола в ацетальдегид в минуту при рН 8,8 при 25 ° C.
Клиническое значение
Алкоголизм
Там были проведены исследования , показывающие , что АДГ может оказывать влияние на зависимость от метаболизма этанола в алкоголиков. Исследователи предварительно обнаружено несколько генов , которые будут связаны с алкоголизмом . Если варианты этих генов кодируют медленнее метаболизировать формы ADh3 и ADh4, существует повышенный риск развития алкоголизма. Исследования обнаружили , что мутации ADh3 и ADh4 связаны с алкоголизмом в Северо - Восточной Азии населения. Тем не менее, исследования продолжаются с целью выявления генов и их влияние на алкоголизм.
С другой стороны, кажется , что там были мутации в АДГ , которые были естественно выбраны потому , что они защищают от алкоголизма. Это может быть , что они ускоряют превращение спирта в ацетальдегид вызывает пьющие чувствовать себя плохо.
Наркотическая зависимость
Наркотическая зависимость является еще одной проблемой, связанной с АДГ, которые исследователи считают, что может быть связано с алкоголизмом. Одно конкретное исследование предполагает, что наркозависимость имеет семь генов АДГ, связанных с ним. Эти результаты могут привести к обработкам, которые нацелены на эти специфические гены. Тем не менее, необходимы дополнительные исследования необходимо.
Отравление
Фомепизол , препарат , который ингибирует алкогольдегидрогеназу, может быть использован в условиях острого метанола или этиленгликоль токсичности. Это предотвращает превращение метанола в его токсических метаболитов, муравьиной кислоты и формальдегида .
Смотрите также
Рекомендации
Эта статья содержит текст из общественного достояния Pfam и InterPro : IPR001670внешняя ссылка
- PDBsum имеет связи с трехмерными структурами различных спиртовых дегидрогеназ , содержащихся в Protein Data Bank
- ExPASy содержит ссылки на алкогольдегидрогеназы последовательности в Swiss-Prot , к Medline поиску литературы о ферменте, а также с записями в других базах данных.
Алкогольдегидрогеназа — Википедия
Алкогольдегидрогеназа (алкоголь:НАД+-оксидоредуктаза, КФ 1.1.1.1) — фермент класса дегидрогеназ, катализирующий окисление спиртов и ацеталей до альдегидов и кетонов в присутствии никотинамидадениндинуклеотида (НАД). Алкогольдегидрогеназы (алкоголь:НАД+-оксидоредуктазы) являются димерами, состоящими из субъединиц с молекулярным весом около 40 000 и содержащими ион цинка Zn2+.
Функции
Катализирует реакцию: этанол + НАД+ ⇌ ацетальдегид + НАДН + H+.
Является специфическим для клеток печени. Появление его в сыворотке крови свидетельствует о повреждении клеток печени. Резкое повышение содержания фермента наблюдается при острых гепатитах (при этом его показатели приходят к норме раньше, чем показатели трансаминаз). При обтурационной желтухе, циррозах печени, инфаркте миокарда, мышечной дистрофии Эрба обычно не наблюдается повышения активности фермента в крови.
Механизмы действия
Оптимум действия фермента находится при pH 8,0. Цианиды, йодоацетат тормозят действие энзима.
Распространение
В больших количествах фермент находится лишь в печени, но небольшое количество также содержат почки. Следы фермента также обнаруживаются в сердечной и скелетной мускулатуре человека. В сыворотке крови здорового человека отсутствует.
Активность алкогольдегидрогеназы в организме человека зависит от возраста, пола, расовой принадлежности, генетической предрасположенности. С ростом частоты и регулярности употребления алкоголя активность алкогольдегидрогеназы снижается[1]. У мужчин значительная часть этанола метаболизируется алкогольдегидрогеназой желудка, поэтому при традиционном приеме равных доз уровень алкоголя в крови у женщин существенно выше, чем у мужчин[1].
Фармакогенетика алкогольдегидрогеназы
Алкогольдегидрогеназа (АДГ) – фермент, представленный различными формами. Были охарактеризованы 5 классов АДГ. Их фармакогенетика не была широко изучена, но хорошо известны их субстраты: кроме этанола и других алифатических спиртов, включает 4-гидроксиноненаль, альдегиды, полученные перекисным окислением липидов, стероиды, гидроксилированные жирные кислоты, промежуточные соединения медиаторных путей в процессе образования ретиноевой кислоты из витамина А[2].
Класс I (ADh2)
Обладают этанол-окислительной активностью. Гены трех типов ADh2A, ADh2B, и ADh2C кодируют α-, β-, и γ-субъединицы, которые могут образовывать гомо- и гетеродимеры, которые ответственны за большую часть окислительной активности печени по отношению к этанолу[3]. Некоторые исследования продемонстрировали меньший риск стать алкоголиком для азиатов с наличием ADh2B2 аллеля (частота 60—80% в азиатских популяциях и около 4 % в безалкогольных европейских популяциях)[4]. Также некоторые исследования указывают на распространение аллеля ADh2C1 среди безалкогольной популяции[5].
Класс III (ADh4)
Высоко консервативны, активны по отношению к глутатион-конъюгированному формальдегиду, а также к глутатион-NO и к свободным гидроксилированным жирным кислотам и лейкотриенам. Ферменты класса III участвуют в пути ликвидации формальдегида и имеют древнее происхождение от прокариот, но, несмотря на это, формы фермента АДГ3 варьируются незначительно[2].
Класс IV (ADh5)
Обладают ретинол-дегидрогеназной активностью, участвуют в формировании ретиноевой кислоты и, следовательно, в регуляции дифференцировки клеток позвоночных[6].
Влияние различных АДГ на метаболизм этанола
На основании кинетических свойств различных вариантов и предполагаемого содержания фермента АДГ в печени, исследователи рассчитали вклад различных ферментов АДГ на способность печени окислять этанол. Для человека (средний вес которого 70 кг), у которого концентрация этанола в крови приблизительно 100 мг/100 мл, если он гомозиготен по ADh2B1 и ADh2C1 ферменты класса I окисляют 70% этанола. Для человека гомозиготного по ADh2B1 и ADh2C2 окислительная способность составляет 80 %. Присутствие ADh2C2 аллели будет связан со слегка пониженной окислительной способности, в то время как наличие adh2b2 и adh2b3 аллели было бы связано с существенно более высокой окислительной способности (то есть более быстрое окисление этанола в ацетальдегид). Эти расчеты приближены, так как не учитывают размер печени и различия экспрессии генов[7].
Гены ADh2B и ALDh3 (ген, кодирующий одного из представителей семейства альдегиддегидрогиназ) являются наиболее сильно связаны с риском развития алкоголизма. Они способны уменьшить риск алкоголизма путем увеличения локальных уровней ацетальдегида, либо за счет быстрого окисления этанола, либо за счет медленного окисления ацетальдегида. Точный баланс между скоростями окисления этанола и ацетальдегида может иметь решающее значение при определении концентрации ацетальдегида в клетках, таким образом, что небольшие различия в относительной активности ADG и ALDH могут вызвать значительные различия в концентрации ацетальдегида)[8].
Из-за этого тонкого баланса, влияние вариаций генов ADG и ALDH на риск развития алкоголизма может быть продемонстрировано только независимо друг от друга, то есть, исследователи могут определить различия в риске между людьми, несущими различные аллели одного гена, но идентичные аллели других генов[3].
Алкогольдегидрогеназа и витамин А
Семейство ферментов алкогольдегидрогеназ (АДГ) может принимать участие в метаболизме ретинола (витамина А), а также в метаболизме этанола. Некоторые члены семейства АДГ предпочитают ретинол в качестве субстрата вместо этанола, и их способность окислять ретинол конкурентно ингибируется высокими концентрациями этанола. Кроме того, существует семейство альдегиддегидрогеназ (ALDH), содержащее несколько представителей, предпочитающих ретиналь в качестве субстрата вместо ацетальдегида[9].
Конформационные изменения и катализ алкогольдегидрогеназы
Как показано с помощью рентгеновской кристаллографии, в печени лошади алкогольдегидрогеназа претерпевает глобальные конформационные изменения при связывании НАД+ или НАДН, включающие поворот каталитического домена относительно кофермент-связывающего домена и перестройку активного сайта для получения каталитически-активного фермента. Изменение конформации требует полного кофермента и зависит от различных химических или мутационных замен, которые могут увеличить каталитическую активность за счет изменения кинетики изомеризации и скорости диссоциации коферментов[10].
После того, как фермент связал НАД+, субстрат вытесняет гидроксид, связанный с каталитическим цинком. Этот обмен может включать реакцию двойного замещения, где карбоксильная группа остатка глутаминовой кислоты сначала замещает гидроксид, а затем субстрат замещает остаток глутамата. В полученном фермент-НАД+-алкоголятном комплексе атом водорода переносится на кофермент[10].
См. также
Примечания
- ↑ 1 2 Фармацевтическая опека: клинико-фармацевтические аспекты применения алкоголя в медицине
- ↑ 1 2 Jörnvall, H., Höög, J. O., Persson, B. & Parés, X. Pharmacogenetics of the alcohol dehydrogenase system. Pharmacology 61, 184–91 (2000).
- ↑ 1 2 Edenberg, H. J. The genetics of alcohol metabolism: role of alcohol dehydrogenase and aldehyde dehydrogenase variants. Alcohol Res. Health 30, 5–13 (2007).
- ↑ Whitfield, J. B. et al. ADH Genotypes and Alcohol Use and Dependence in Europeans. Alcohol. Clin. Exp. Res. 22, 1463–1469 (1998).
- ↑ Borràs, E. et al. Genetic polymorphism of alcohol dehydrogenase in europeans: the ADh3*2 allele decreases the risk for alcoholism and is associated with ADh4*1. Hepatology 31, 984–9 (2000).
- ↑ Involvement of Alcohol Dehydrogenase, Short-Chain Dehydrogenase/Reductase, Aldehyde Dehydrogenase, and Cytochrome P450 in the Control of Retinoid Signaling by Activation of Retinoic Acid Synthesis - Biochemistry (ACS Publications). DOI:10.1021/bi961176%2B (Accessed: 15th May 2016)
- ↑ O’Connor, S., Morzorati, S., Christian, J. & Li, T.-K. Clamping Breath Alcohol Concentration Reduces Experimental Variance: Application to the Study of Acute Tolerance to Alcohol and Alcohol Elimination Rate. Alcohol. Clin. Exp. Res. 22, 202–210 (1998).
- ↑ Kitson, K. E. Regulation of Alcohol and Aldehyde Dehydrogenase Activity: A Metabolic Balancing Act With Important Social Consequences. Alcohol. Clin. Exp. Res. 23, 955–957 (1999).
- ↑ Zile, M. H. Symposium : Functional Metabolism of Vitamin A in Embryonic Development Vitamin A and Embryonic Development : An Overview 1 , 2. 455—458 (1998).
- ↑ 1 2 Plapp, B. V. NIH Public Access. 493, 3–12 (2011)
Ссылки
Алкогольдегидрогеназа — Википедия. Что такое Алкогольдегидрогеназа
Алкогольдегидрогеназа (алкоголь:НАД+-оксидоредуктаза, КФ 1.1.1.1) — фермент класса дегидрогеназ, катализирующий окисление спиртов и ацеталей до альдегидов и кетонов в присутствии никотинамидадениндинуклеотида (НАД). Алкогольдегидрогеназы (алкоголь:НАД+-оксидоредуктазы) являются димерами, состоящими из субъединиц с молекулярным весом около 40 000 и содержащими ион цинка Zn2+.
Функции
Катализирует реакцию: этанол + НАД+ ⇌ ацетальдегид + НАДН + H+.
Является специфическим для клеток печени. Появление его в сыворотке крови свидетельствует о повреждении клеток печени. Резкое повышение содержания фермента наблюдается при острых гепатитах (при этом его показатели приходят к норме раньше, чем показатели трансаминаз). При обтурационной желтухе, циррозах печени, инфаркте миокарда, мышечной дистрофии Эрба обычно не наблюдается повышения активности фермента в крови.
Механизмы действия
Оптимум действия фермента находится при pH 8,0. Цианиды, йодоацетат тормозят действие энзима.
Распространение
В больших количествах фермент находится лишь в печени, но небольшое количество также содержат почки. Следы фермента также обнаруживаются в сердечной и скелетной мускулатуре человека. В сыворотке крови здорового человека отсутствует.
Активность алкогольдегидрогеназы в организме человека зависит от возраста, пола, расовой принадлежности, генетической предрасположенности. С ростом частоты и регулярности употребления алкоголя активность алкогольдегидрогеназы снижается[1]. У мужчин значительная часть этанола метаболизируется алкогольдегидрогеназой желудка, поэтому при традиционном приеме равных доз уровень алкоголя в крови у женщин существенно выше, чем у мужчин[1].
Фармакогенетика алкогольдегидрогеназы
Алкогольдегидрогеназа (АДГ) – фермент, представленный различными формами. Были охарактеризованы 5 классов АДГ. Их фармакогенетика не была широко изучена, но хорошо известны их субстраты: кроме этанола и других алифатических спиртов, включает 4-гидроксиноненаль, альдегиды, полученные перекисным окислением липидов, стероиды, гидроксилированные жирные кислоты, промежуточные соединения медиаторных путей в процессе образования ретиноевой кислоты из витамина А[2].
Класс I (ADh2)
Обладают этанол-окислительной активностью. Гены трех типов ADh2A, ADh2B, и ADh2C кодируют α-, β-, и γ-субъединицы, которые могут образовывать гомо- и гетеродимеры, которые ответственны за большую часть окислительной активности печени по отношению к этанолу[3]. Некоторые исследования продемонстрировали меньший риск стать алкоголиком для азиатов с наличием ADh2B2 аллеля (частота 60—80% в азиатских популяциях и около 4 % в безалкогольных европейских популяциях)[4]. Также некоторые исследования указывают на распространение аллеля ADh2C1 среди безалкогольной популяции[5].
Класс III (ADh4)
Высоко консервативны, активны по отношению к глутатион-конъюгированному формальдегиду, а также к глутатион-NO и к свободным гидроксилированным жирным кислотам и лейкотриенам. Ферменты класса III участвуют в пути ликвидации формальдегида и имеют древнее происхождение от прокариот, но, несмотря на это, формы фермента АДГ3 варьируются незначительно[2].
Класс IV (ADh5)
Обладают ретинол-дегидрогеназной активностью, участвуют в формировании ретиноевой кислоты и, следовательно, в регуляции дифференцировки клеток позвоночных[6].
Влияние различных АДГ на метаболизм этанола
На основании кинетических свойств различных вариантов и предполагаемого содержания фермента АДГ в печени, исследователи рассчитали вклад различных ферментов АДГ на способность печени окислять этанол. Для человека (средний вес которого 70 кг), у которого концентрация этанола в крови приблизительно 100 мг/100 мл, если он гомозиготен по ADh2B1 и ADh2C1 ферменты класса I окисляют 70% этанола. Для человека гомозиготного по ADh2B1 и ADh2C2 окислительная способность составляет 80 %. Присутствие ADh2C2 аллели будет связан со слегка пониженной окислительной способности, в то время как наличие adh2b2 и adh2b3 аллели было бы связано с существенно более высокой окислительной способности (то есть более быстрое окисление этанола в ацетальдегид). Эти расчеты приближены, так как не учитывают размер печени и различия экспрессии генов[7].
Гены ADh2B и ALDh3 (ген, кодирующий одного из представителей семейства альдегиддегидрогиназ) являются наиболее сильно связаны с риском развития алкоголизма. Они способны уменьшить риск алкоголизма путем увеличения локальных уровней ацетальдегида, либо за счет быстрого окисления этанола, либо за счет медленного окисления ацетальдегида. Точный баланс между скоростями окисления этанола и ацетальдегида может иметь решающее значение при определении концентрации ацетальдегида в клетках, таким образом, что небольшие различия в относительной активности ADG и ALDH могут вызвать значительные различия в концентрации ацетальдегида)[8].
Из-за этого тонкого баланса, влияние вариаций генов ADG и ALDH на риск развития алкоголизма может быть продемонстрировано только независимо друг от друга, то есть, исследователи могут определить различия в риске между людьми, несущими различные аллели одного гена, но идентичные аллели других генов[3].
Алкогольдегидрогеназа и витамин А
Семейство ферментов алкогольдегидрогеназ (АДГ) может принимать участие в метаболизме ретинола (витамина А), а также в метаболизме этанола. Некоторые члены семейства АДГ предпочитают ретинол в качестве субстрата вместо этанола, и их способность окислять ретинол конкурентно ингибируется высокими концентрациями этанола. Кроме того, существует семейство альдегиддегидрогеназ (ALDH), содержащее несколько представителей, предпочитающих ретиналь в качестве субстрата вместо ацетальдегида[9].
Конформационные изменения и катализ алкогольдегидрогеназы
Как показано с помощью рентгеновской кристаллографии, в печени лошади алкогольдегидрогеназа претерпевает глобальные конформационные изменения при связывании НАД+ или НАДН, включающие поворот каталитического домена относительно кофермент-связывающего домена и перестройку активного сайта для получения каталитически-активного фермента. Изменение конформации требует полного кофермента и зависит от различных химических или мутационных замен, которые могут увеличить каталитическую активность за счет изменения кинетики изомеризации и скорости диссоциации коферментов[10].
После того, как фермент связал НАД+, субстрат вытесняет гидроксид, связанный с каталитическим цинком. Этот обмен может включать реакцию двойного замещения, где карбоксильная группа остатка глутаминовой кислоты сначала замещает гидроксид, а затем субстрат замещает остаток глутамата. В полученном фермент-НАД+-алкоголятном комплексе атом водорода переносится на кофермент[10].
См. также
Примечания
- ↑ 1 2 Фармацевтическая опека: клинико-фармацевтические аспекты применения алкоголя в медицине
- ↑ 1 2 Jörnvall, H., Höög, J. O., Persson, B. & Parés, X. Pharmacogenetics of the alcohol dehydrogenase system. Pharmacology 61, 184–91 (2000).
- ↑ 1 2 Edenberg, H. J. The genetics of alcohol metabolism: role of alcohol dehydrogenase and aldehyde dehydrogenase variants. Alcohol Res. Health 30, 5–13 (2007).
- ↑ Whitfield, J. B. et al. ADH Genotypes and Alcohol Use and Dependence in Europeans. Alcohol. Clin. Exp. Res. 22, 1463–1469 (1998).
- ↑ Borràs, E. et al. Genetic polymorphism of alcohol dehydrogenase in europeans: the ADh3*2 allele decreases the risk for alcoholism and is associated with ADh4*1. Hepatology 31, 984–9 (2000).
- ↑ Involvement of Alcohol Dehydrogenase, Short-Chain Dehydrogenase/Reductase, Aldehyde Dehydrogenase, and Cytochrome P450 in the Control of Retinoid Signaling by Activation of Retinoic Acid Synthesis - Biochemistry (ACS Publications). DOI:10.1021/bi961176%2B (Accessed: 15th May 2016)
- ↑ O’Connor, S., Morzorati, S., Christian, J. & Li, T.-K. Clamping Breath Alcohol Concentration Reduces Experimental Variance: Application to the Study of Acute Tolerance to Alcohol and Alcohol Elimination Rate. Alcohol. Clin. Exp. Res. 22, 202–210 (1998).
- ↑ Kitson, K. E. Regulation of Alcohol and Aldehyde Dehydrogenase Activity: A Metabolic Balancing Act With Important Social Consequences. Alcohol. Clin. Exp. Res. 23, 955–957 (1999).
- ↑ Zile, M. H. Symposium : Functional Metabolism of Vitamin A in Embryonic Development Vitamin A and Embryonic Development : An Overview 1 , 2. 455—458 (1998).
- ↑ 1 2 Plapp, B. V. NIH Public Access. 493, 3–12 (2011)
Ссылки
Врождённая непереносимость алкоголя — Википедия
Изменение цвета лица после употребления алкоголяВрождённая непереносимость алкоголя, покраснение при приёме алкоголя (англ. Alcohol flush reaction, Asian Flush, Asian Red, Asian Glow) — состояние, при котором лицо и/или тело человека краснеет, покрывается пятнами, повышается температура кожи из-за накопления ацетальдегида. Накопление ацетальдегида может быть вызвано миссенс-мутацией, генетическим полиморфизмом в гене, кодирующим фермент ацетальдегиддегидрогеназу (ALDh3),[1] который в норме расщепляет ацетальдегид, основной продукт метаболизма этанола.[2] Накопление ацетальдегида также может быть вызвано полиморфизмом гена, кодирующего фермент алкогольдегидрогеназу ADh2B, который катализирует превращение этанола в ацетальдегид.[3] Покраснение связано с эритемой (расширение капилляров) на лице, шее, плечах и в некоторых случаях по всему телу после употребления алкоголя.
Исследования указывают на то, что покраснение лица после употребления алкоголя является следствием недостатка фермента ALDh3. Человек с дефицитом ALDh3, выпивающий две бутылки пива ежедневно, имеет в 6-10 раз более высокий риск развития рака пищевода, чем человек без такого дефицита фермента.[4][5]
Согласно некоторым данным, прием внутрь низких доз препаратов от изжоги, содержащих ранитидин или фамотидин (продаваемых, например, под торговой маркой Zantac или Pepcid AC), могут избавить человека от симптомов покраснения, если препарат применять за 30—60 минут до приема алкоголя.[6] Показано, однако, что ранитидин значительно повышает уровень алкоголя в крови.
Имеется несколько теорий, объясняющих природу данной непереносимости, однако, ни одна из них не является научно доказанной.
Одно из возможных объяснений заключается в том, что фамотидин и подобные ему лекарственные препараты снижают покраснение кожи (эритему), вызываемую приемом алкоголя, так как являются h3-антагонистами или h3-антигистаминами. Данные препараты не снижают концентрацию спирта и продуктов его метаболизма в крови, но снижают эффект связывания гистамина с соответствующими h3-рецепторами.
Согласно другой теории, ацетальдегид вызывает покраснение кожи и расширение сосудов, так как антагонисты Н2-рецепторов ингибируют фермент алкогольдегидрогеназу (превращающий этанол в ацетальдегид) в желудочно-кишечном тракте и в печени,[7] поэтому катаболизм этанола замедляется и эффект воздействия ацетальдегида на человека снижается. Препарат дисульфирам ингибирует фермент ALDH и замедляет выведение ацетальдегида из организма, и вызывает ещё сильное покраснение кожи. Высокий уровень ацетальдегида, вызванный приемом дисульфирама, приводит к таким же симптомам, как и при врождённой непереносимости алкоголя — покраснение кожи, повышенная частота сердечных сокращений, затруднённое дыхание, головная боль, спутанность сознания, нарушение зрения.[8]
Многие люди считают врождённую непереносимость неудобством, но некоторые полагают, что могут сделать организм более толерантным к алкоголю путём регулярного приема алкогольных напитков, возможно, это приводит к повышению концентрации ALDh3 и усилению метаболизма ацетальдегида. Известно, что ацетальдегид является канцерогеном, исследования показали, что лица, имеющие врождённую непереносимость алкоголя, постоянно употребляющие алкоголь, могут иметь повышенный риск развития заболеваний, например, рак печени, пищевода и желудочно-кишечного тракта.[9]
Исследования 1993 года на крысах показали, что потребление сахаров (глюкозы и фруктозы) значительно повышает метаболизм этанола по неизвестному механизму, при этом не изменяется активность алкогольдегидрогеназы.[10]
Люди, которые испытывают после приема алкоголя симптомы покраснения кожи, могут быть менее склонными к алкоголизму. Лекарственный препарат дисульфирам, который используют для лечения алкоголизма, ингибирует ацетальдегиддегидрогеназу и вызывает увеличение концентрации ацетальдегида в крови от пяти до десяти раз. В результате у пациента снижается желание употреблять алкоголь.[11][12]
Лица, имеющие врождённую непереносимость алкоголя, обычно имеют пониженное давление, возможно потому, что употребляют меньше алкогольных напитков.[13]
Наиболее точным способом измерения содержания ацетальдегида в организме является его определение в крови или в выдыхаемом воздухе.[14] Кроме того, определяют концентрации ферментов, метаболизирующих этанол в крови — алкогольдегидрогеназы и альдегиддегидрогеназы. Возможно секвенирование соответствующих генов.
- Купероз (англ. rosacea) — хроническое заболевание кожи, при котором капилляры постоянно расширены, что приводит к появлению сосудистой сеточки на лице. Часто лиц с куперозом ошибочно считают алкоголиками, так как хроническое покраснение лица (крыльев носа, подбородка, щек) похоже на симптомы реакции организма на алкоголь.
- Покраснения, возникающие после приема алкоголя незадолго до или после вдыхания паров органического растворителя трихлорэтилена.
- Карциноидный синдром — сильные покраснения, вызываемые приемом алкоголя, стрессом или некоторой пищей.
- Синдром красных ушей (en:Red ear syndrome) — может быть в том числе вызван употреблением алкоголя.[15]
- ↑ Xiao Q., Weiner H., Crabb D. W. The mutation in the mitochondrial aldehyde dehydrogenase (ALDh3) gene responsible for alcohol-induced flushing increases turnover of the enzyme tetramers in a dominant fashion (англ.) // J. Clin. Invest. (англ.)русск. : journal. — 1996. — Vol. 98, no. 9. — P. 2027—2032. — doi:10.1172/JCI119007. — PMID 8903321.
- ↑ Ohta S., Ohsawa I., Kamino K., Ando F., Shimokata H. Mitochondrial ALDh3 deficiency as an oxidative stress (англ.) // Ann. N. Y. Acad. Sci. (англ.)русск. : journal. — 2004. — Vol. 1011. — P. 36—44. — doi:10.1196/annals.1293.004. — PMID 15126281. Архивировано 2 ноября 2007 года. Архивная копия от 2 ноября 2007 на Wayback Machine
- ↑ Yi Peng, Hong Shi, Xue-bin Qi, Chun-jie Xiao, Hua Zhong, Run-lin Z Ma, Bing Su. The ADh2B Arg47His polymorphism in East Asian populations and expansion of rice domestication in history (англ.) // BioMed Central (англ.)русск. : journal. — 2010. — Vol. 10, no. 15. — P. 15. — doi:10.1186/1471-2148-10-15. — PMID 20089146.
- ↑ Drinkers’ Red Face May Signal Cancer Risk , New York Times, March 23, 2009
- ↑ Brooks P. J., Enoch M-A, Goldman D., Li T-K, Yokoyama A. The Alcohol Flushing Response: An Unrecognized Risk Factor for Esophageal Cancer from Alcohol Consumption (англ.) // Public Library of Science Medicine : journal. — 2009. — Vol. 6, no. 3. — doi:10.1371/journal.pmed.1000050.
- ↑ Haynie D. Asian party-goers strive to get rid of that 'glow' often caused by the first drink (неопр.) (27 апреля 2007). Архивировано 15 июля 2012 года.
- ↑ Joan Caballería, et al. Effects of h3-receptor antagonists on gastric alcohol dehydrogenase activity (англ.) // Digestive Diseases and Sciences (англ.)русск. : journal. — 1991. — Vol. 36, no. 12. — P. 1673—1679. — doi:10.1007/BF01296608. — PMID 1684149.
- ↑ Wright C, Moore RD (June 1990). «Disulfiram treatment of alcoholism». Am. J. Med. 88 (6): 647-55. doi:doi:10.1016/0002-9343(90)90534-K. PMID 2189310.
- ↑ Can heavy alcohol use lead to some kinds of cancer? (неопр.). Science Blog. Архивировано 15 июля 2012 года.
- ↑ Keegan A., Batey R. Dietary carbohydrate accelerates ethanol elimination, but does not alter hepatic alcohol dehydrogenase (англ.) // Alcohol. Clin. Exp. Res. (англ.)русск. : journal. — 1993. — Vol. 17, no. 2. — P. 431—433. — doi:10.1111/j.1530-0277.1993.tb00789.x. — PMID 8488989. (недоступная ссылка)
- ↑ Disulfiram (неопр.). MedlinePlus Drug Information. Дата обращения 16 сентября 2018. Архивировано 15 июля 2012 года.
- ↑ Disulfiram 151, раздел Toxicity, Disulfiram (англ.) на сайте EMedicine
- ↑ Hypertension - Alcohol intake may increase blood pressure
- ↑ Alcohol and the Asian flush reaction | Ye | Studies by Undergraduate Researchers at Guelph (неопр.) (недоступная ссылка). criticalimprov.com. Дата обращения 16 февраля 2011. Архивировано 21 февраля 2014 года.
- ↑ Boulton, P; Purdy, RA; Bosch, EP; Dodick, D. W. Primary and secondary red ear syndrome: implications for treatment. (англ.) // Cephalalgia : an international journal of headache : journal. — 2007. — Vol. 27, no. 2. — P. 107—110. — doi:10.1111/j.1468-2982.2007.01270.x. — PMID 17257229.
Алкогольдегидрогеназа: особый фермент в организме человека
Степень и скорость опьянения человека зависит от содержания уникального фермента в организме — алкогольдегидрогеназа. Он выступает специфическим катализатором и обеспечивает слаженную работу механизма по переработке этанола, попадающего в организм в составе спиртного напитка, превращая его в ацетальдегид. Зная содержания фермента в собственном организме, можно избежать алкоголизма.

Функции катализатора
Алкогольдегидрогеназа — это специальный фермент, обеспечивающий регуляцию процесса уничтожения, так называемого, внутреннего алкоголя. Он помогает окислять попадающие вредные продукты и улучшает обмен веществ. Блокатор обычно вырабатывается клетками печени, участвуя в процессах уничтожения и правильного расщепления веществ. Если фермент при сдаче анализов обнаруживается в кровяной сыворотке, это считается показателем тяжёлого отравления или наличия гепатита.
Помимо алкогольдегидрогеназа, печень продуцирует и фермент ацетальдегидрогеназа. Оба они состоят из пары субъединиц, участвующих в ингибировании. При малом содержании этанола внутри из пары работает только одна. Для расщепления больших объёмов в работу вступают сразу две единицы.
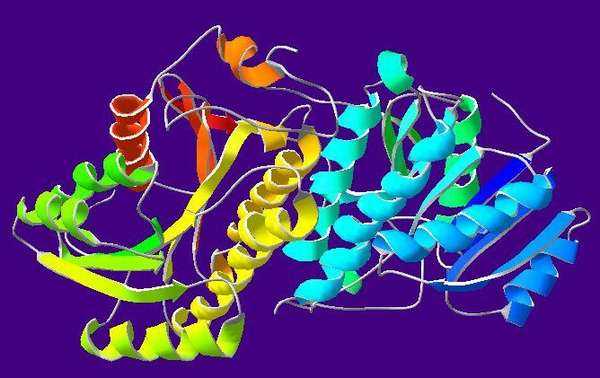 Модель алкогольдегидрогеназы
Модель алкогольдегидрогеназы
В генотипе человека могут быть выявлены два варианта ингибитора. Различают быстрые и медленные АДГ, опираясь на их скорость работы над поступающими продуктами спиртосодержащих веществ.
Существует также и классификация АДГ-ферментов. На сегодняшний момент охарактеризовано 5 классов, которые отличаются воздействием на те или иные продукты распада. Формула их зависит продукта, в отношении которого они активны.
«Быстрая» алкогольдегидрогеназа
Наличие быстрой формы характеризуется оперативной переработкой продуктов распада спиртного. Стадии опьянения проходят скоротечно, этанол в ускоренном режиме синтезируется и выводится.
Гражданин с таким набором генов не склонен к развитию хронического алкоголизма. За короткое время, когда проходят все стадии опьянения, привыкнуть к выпивке довольно сложно. Однако это не гарантирует, что человек будет защищён от интоксикации спиртной продукцией. Количество альдегида в крови резко возрастает, поражая человека и ухудшая его самочувствие.
Формула алкогольдегидрогеназа ADh2B*47His. Она может до 90 раз быстрее переработать попавший в организм этанол.
«Медленная» алкогольдегидрогеназа
При содержании в генотипе медленного типа фермента этанол долгое время сохраняется внутри, медленно синтезируется. Человек неспешно пьянеет, а затем наступает длительный похмельный синдром, серьёзная интоксикация всего организма. У такого пациента возможность стать алкоголиком намного выше.
При этом врачи утверждают, что со временем «медленная» форма катализатора может перейти в «быструю», и наоборот. Определить его наличие в организме и форму, можно сдав соответствующие анализы.
Способ выявления фермента
Люди часто интересуются наличием специфических ферментов и их видами в своём генотипе. Все врачи на вопросы по этой теме отвечают однозначно, ингибиторы есть абсолютно у каждого. Однако, при этом, с помощью анализа крови, биохимии, можно определить к какому типу относятся ферменты в организме конкретного человека. Представляют они «быстрые» или «медленные» катализаторы.
Наличие ферментов обусловлено содержание в организме любого человека, так называемого, эндогенного алкоголя. Он вырабатывается во всех живых существах. А выработкой его и утилизацией занимаются именно алкогольдегидрогеназа и ацетальдегидрогеназа.
 Анализ крови
Анализ крови
К сожалению, современная медицина способна определить только специфический вид фермента, который имеется в организме человека. Изменить, например, медленный ингибитор на «быстрый» пока не представляется возможным. Поэтому человеку, даже определившему свой генотип и его составляющие, придётся пользоваться тем, что есть.
Для поддержания процессов выработки необходимых для расщепления ферментов врачи часто предлагают принимать гепатопротекторы. Они имеют свойство ускорять выработку ферментов для поддержания здоровья внутреннего органа. Хорошим средством, заслужившим доверие пациентов, считается Фосфоглив.
Непереносимость алкоголя
В мире есть большое количество людей, которые просто не могут переносить алкоголь, даже в малых его дозах. Это может передаваться на генном уровне по наследству, даже через поколения. Формирование непереносимости зависит от ряда причин.
Причины непереносимости
Генетическая предрасположенность и наличие определённой совокупности ферментов является причиной непереносимости. Возможно также приобретение плохой усвояемости алкоголя в случае перенесённых травм головы, расстройств психики или печёночных патологий, которые изменяют механизм выработки ферментов.
Например, при наличии в крови «медленного» фермента алкогольдегидрогеназа и «активной» ацетальдегидрогеназы у человека будет в течение долгого времени наблюдаться высокий уровень алкоголя в этой же крови. Ацетальдегид, вырабатываясь, быстро выводится из организма. Это приводит к образованию положительных гормонов, что, в свою очередь, рано или поздно приведёт к алкоголизму, так как ощущения от употребления спиртного у человека только положительные.
Сочетание «быстрой» алкогольдегидрогеназы и «пассивной» ацетальдегидрогеназы обеспечивает наибольшую подверженность организма непереносимости алкогольной продукции. При распитии спиртных напитков, они очень быстро преобразуются в ацетальдегид, который ещё долгое время находится внутри. Раннее похмелье и интоксикация являются характерными признаками такого партнёрства ингибиторов.

Симптоматика непереносимости
Признаки непереносимости алкогольной продукции, как правило, проявляются всегда одинаково:
- краснота кожи на лице и шее,
- покраснение белков глаз,
- кожный зуд, возникающий спонтанно,
- риступообразный кашель,
- слезоточивость,
- сильное потоотделение,
- сильная внезапная боль в голове,
- головокружение,
- тошнота,
- кровопотери,
- обмороки.
У запрограммированного на непереносимость выпивки, могут присутствовать один или сразу несколько симптомов.
Непереносимость у разных народностей
В зависимости от среды обитания и народности у человека варьируется количество вырабатываемых ферментов. При этом разница между народами может быть колоссальной.
Русские в своём большинстве обладают «медленной» алкогольдегидрогеназой и «активной» ацетальдегидрогеназой. Они обуславливают предрасположенность к развитию алкоголизма. «Быстрым» ферментом в стране обладают чуть более 10% населения.
При этом азиатские народности, даже живущие рядом с русскими или на их территории, имеют фермент алкогольдегидрогеназа быстрый и пассивный ацетальдегидрогеназа. Это позволяет азиатским народам получать опьянение от небольших порций спиртного, а затем оперативно восстанавливаться.
Северные народы склонны к развитию «медленных» форм катализатора. Лишь 5% населения склонны к развитию «быстрой» формы, способствующей скорейшему окислению и расщеплению этанола, восстановлению организма.

Непереносимость по половому признаку
Алкогольдегидрогеназа относится к ферментам, позволяющим снизить внутреннее отравление. Вещество у мужчин может выделяться печенью, почками и даже желудком. Таким образом, из-за действия фермента они могут выпить намного больше, нежели женщины.
Помимо этого женский организм содержит меньше воды, чем мужской и это способствует высокому уровню этанола в крови при распитии спиртного, который не успевает окисляться. Это повышает уровень опасности, то есть женщина спивается быстрее мужчины.

Контроль за уровнем фермента
Вопрос контроля за уровнем и выработкой ферментов очень важен. Процесс регуляции активности алкгольдегидрогеназы стал ключевым во многих исследованиях. Повышение ферментативных функций заботят людей, которые не собираются бросать пить, но хотят обезопасить себя. К сожалению, на данном этапе развития медицины, повысить уровень выработки ферментов и их активность, невозможно. Управление биохимическими процессами в организме человека и введение экстенсивного режима работы ферментов не представляется возможным. Кроме того, мнение о том, что повышенная скорость переработки этанола влияет на развитие алкоголизма, затормаживая этот процесс, ошибочно. При наличии зависимости, количество выпитого не изменится, несмотря на явные протесты внутренних органов.
Для борьбы с проблемой нужно сдать анализы и определить уровень и типы ферментов в организме, изучить механизм действия алкогольдегидрогеназы. Не лишним будет сдать тесты на количество спиртного, разрешённого к употреблению. В дальнейшем всё зависит исключительно от человека, он сам выбирает своё будущее.
Алкогольдегидрогеназа в таблетках
Желание людей решить проблему алкоголизма наиболее простыми способами привело к тому, что сейчас существуют устойчивые алкогольные мифы, не имеющие под собой доказательной базы. Например, некоторые, зависимые от выпивки люди, утверждают, что ферменты можно приобрести в таблетках. Считается, что их влияние позволяет окислять и расщеплять продукты распада алкоголя в рекордные сроки и избавить человека от зависимости.
Такая чудо-таблетка не существует, но алкоголики по-прежнему продолжают искать её, чтобы минимизировать вред от злоупотребления спиртного. На сегодняшний день медицина серьёзно продвинулась в данном вопросе и действительно, сейчас имеется своеобразная алкогольдегидрогеназа в таблетках. Однако она работает наоборот, замедляет процессы, ставя защиту от алкоголя. Таким образом, у зависимого появляется химическая защита на спиртное, вместо безопасного злоупотребления выпивкой.
Генетическая устойчивость в разных странах
Проведено множество тематических исследований, которые выявили определённый порядок генетической устойчивости к алкоголизму, в зависимости от места рождения и проживания человека. Так, например, безопасное сочетание ферментов, которое снижает риск развития алкоголизма, выделяется у 3-7% населения Восточной Европы (в том числе и у жителей России). Но такое сочетание плохо распространено в Западной Европе, Северной Америке и регионах, что южнее Сахары.
«Быстрыми» ферментами чаще всего обладают жители Северо-Восточной и Юго-восточной Азии. Генетическая устойчивость к спиртному в России немного меньше, нежели в Америке или Европе. Большая часть русских обладает «медленной» алкогольдегидрогеназой. Этот показатель не влияет на курс лечения от спиртозависимости, но его необходимо знать.