Астровирус что это такое
Астровирусы — Википедия
Материал из Википедии — свободной энциклопедии
Астровирусы[2] (лат. Astroviridae) — семейство вирусов, обнаруженных в 1975 году при помощи электронной микроскопии в стуле человека[3].
Наряду с Picornaviridae и Caliciviridae[en], астровирусы являются третьим семейством безоболочечных вирусов с одноцепочечной геномной (+)РНК[4][5]. Астровирусы человека являются одной из причин гастроэнтеритов у детей раннего периода[4].
У детей и взрослых вызывают гастроэнтериты. Ключевые симптомы — диарея, тошнота, рвота, недомогание и боли в животе. Инфицированные не нуждаются в госпитализации так как симптомы заболевания проходят сами собой в течение короткого периода [6].
Электронная микроскопия, ИФА, иммунофлуоресценция, ПЦР позволяют выявить вирусные частицы, антигены или нуклеиновые кислоты в фекалиях инфицированных людей[7].
Метод ПЦР в реальном времени позволяет обнаружить все генотипы астровирусов человека[8].
Не существует вакцины или противовирусных средств против астровирусной инфекции. Личная гигиена снижает вероятность заболевания.
Вирионы астровирусов имеют размер около 28—35 нм в диаметре, икосаэдрическую форму, а также звездчатую поверхность, с пятью или шестью отростками. Вирусы не содержат оболочки, геном представлен РНК[9].
Семейство астровирусов включает два рода: Mamastrovirus (19 видов), инфицирующие млекопитающих, и Avastrovirus (3 вида), инфицирующие птиц. Виды также разделяются на серовары[10].
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьева, А. С. Быкова. — М. : Медицинское информационное агентство, 2003. — С. 121. — ISBN 5-89481-136-8.
- ↑ Madeley C. R., Cosgrove B. P. Letter: 28 nm particles in faeces in infantile gastroenteritis (англ.) // The Lancet : journal. — Elsevier, 1975. — Vol. 2, no. 7932. — P. 451—452. — doi:10.1016/S0140-6736(75)90858-2. — PMID 51251.
- ↑ 1 2 Brown D. W., Gunning K. B., Henry D. M., et al. A DNA oligonucleotide microarray for detecting human astrovirus serotypes (англ.) // Journal of Virological Methods : journal. — 2008. — January (vol. 147, no. 1). — P. 86—92. — doi:10.1016/j.jviromet.2007.07.028. — PMID 17905448.
- ↑ Matsui S. M., Kiang D., Ginzton N., Chew T., Geigenmüller-Gnirke U. Molecular biology of astroviruses: selected highlights (англ.) // Novartis Found. Symp. : journal. — 2001. — Vol. 238. — P. 219—233; discussion 233—236. — doi:10.1002/0470846534.ch23. — PMID 11444028.
- ↑ Madeley C. R. Virus diarrhoea in hospital (неопр.) // J. Hosp. Infect.. — 1988. — Т. 12, № 3. — С. 145—149. — doi:10.1016/0195-6701(88)90001-1. — PMID 2904454.
- ↑ Guix S., Bosch A., Pintó R. M. Human astrovirus diagnosis and typing: current and future prospects (англ.) // Lett. Appl. Microbiol. : journal. — 2005. — Vol. 41, no. 2. — P. 103—105. — doi:10.1111/j.1472-765X.2005.01759.x. — PMID 16033504. Архивировано 18 января 2013 года.
- ↑ Royuela E., Negredo A., Sánchez-Fauquier A. Development of a one step real-time RT-PCR method for sensitive detection of human astrovirus (англ.) // Journal of Virological Methods : journal. — 2006. — April (vol. 133, no. 1). — P. 14—19. — doi:10.1016/j.jviromet.2005.10.012. — PMID 16321452.
- ↑ Krishna N.K. Identification of structural domains involved in astrovirus capsid biology (англ.) // Viral Immunol. : journal. — 2005. — Vol. 18, no. 1. — P. 17—26. — doi:10.1089/vim.2005.18.17. — PMID 15802951.
- ↑ Lukashov V. V., Goudsmit J. Evolutionary relationships among Astroviridae (англ.) // Journal of General Virology (англ.)русск.. — Microbiology Society (англ.)русск., 2002. — Vol. 83, no. Pt 6. — P. 1397—1405. — PMID 12029155. Архивировано 13 января 2013 года.
Астровирусная инфекция
Представители семейства Astroviridae способны вызывать заболевания у различных позвоночных, наиболее хорошо изучены изоляты от птиц и млекопитающих. До недавнего времени считалось, что с патологией человека ассоциируются 8 серотипов астровирусов человека (HAsV). Однако в последние годы, благодаря широкому применению молекулярно-биологических методов исследований, от пациентов с острой диарейной симптоматикой были выявлены еще несколько групп астровирусов, не относящихся к астровирусам человека (MLB, VA). Данные группы астровирусов детектируются достаточно редко, но могут вызывать групповую заболеваемость. Наибольшее распространение у детей имеют 1 и 2 серотипы (генотипы) астровирусов, у лиц старшего возраста – 4-й. Астровирусная инфекция не обладает клиническими особенностями, позволяющими дифференцировать ее от других кишечных инфекций. Вклад астровирусной инфекции в показатели спорадической заболеваемости в разных регионах земного шара варьирует в широких пределах (4– 17%). В нашей стране на основании проведенных пилотных исследований можно утверждать, что астровирусы уступают по распространенности ротавирусам и норовирусам, составляя около 4% случаев госпитализации с ОКИ.
Показания к обследованию
- В период сезонного подъема заболеваемости (октябрь-март) – все пациенты с симптоматикой ОКИ;
- вне сезонного подъема заболеваемости – пациенты с диарейным синдромом на этапе расширенного обследования.
Материал для исследований
Нативные образцы фекалий, собранные в первые 72 ч от начала заболевания.
Этиологическая лабораторная диагностика включает обнаружение АГ и НК вирусов.
Сравнительная характеристика методов лабораторной диагностики
В первые годы после открытия астровирусов единственным методом их выявления оставалась электронная микроскопия образцов фекалий. В настоящее время лабораторная диагностика астровирусной инфекции включает выявление АГ астровирусов в фекалиях методами ИФА и ИХА и обнаружение НК вирусов методом ПЦР.
Естественное течение астровирусной инфекции характеризуется высокой концентрацией возбудителей в фекалиях в первые трое суток заболевания. В это время для диагностики инфекции эффективно обнаружение НК вирусов методом ПЦР и выявление АГ астровирусов в фекалиях методом ИФА. Опыт применения ИХА тестов для детекции АГ астровирусов пока недостаточен для их сравнительной характеристики.
Показания к применению различных лабораторных исследований
В острую фазу заболевания для диагностики инфекции определяют НК методом ПЦР либо АГ в фекалиях методом ИФА. На поздних стадиях заболевания предпочтение должно отдаваться более чувствительным ПЦР-исследованиям. Поскольку распространенность астровирусов ниже, чем ротавирусов и норовирусов, наборы реагентов для их выявления являются более дорогостоящими, что делает оправданным использование комбинированных (мультиплексных) наборов, при использовании которых астровирусы могут быть выявлены параллельно с более распространенными патогенами.
Особенности интерпретации результатов лабораторных исследований
Все перечисленные выше диагностические исследования являются прямыми, интерпретация их результатов не вызывает затруднений. Частота бессимптомного носительства астровирусов достаточно низка и не снижает диагностическую значимость их обнаружения.
пути передачи, симптомы, анализы, лечение
Астровирусная инфекция представляет собой вирусное поражение кишечника, спровоцированное астровирусами. Фактически астровирус является инфекционным возбудителем, провоцирующим развитие гастроэнтерита.
Данный инфекционный агент поражает преимущественно людей, птиц и млекопитающих. Называют астровирус так по причине его 5- или 6-конечной звездоподобной формы, размером порядка 28-35 нм.
Для репликации астровирусу необходимо проникнуть внутрь органических клеток. Обнаружили астровирус впервые в 70-х гг. прошлого века в Шотландии, когда была зафиксирована вспышка диареи.
Эпидемиология
Астровирусная инфекция поражает детишек младше 7-летнего возраста. Чаще всего патология выявляется у 2-4-летних деток преимущественно в летне-весеннее время с декабрьским пиком.
Основным механизмом передачи считается фекально-оральный способ. Вирус передается бытовым, пищевым или водным путем. Особенно распространены вспышки данной патологии в школах и детсадах, домах престарелых или больницах.
Также астровирусные гастроэнтериты могут внезапно обнаружиться в туристических или призывных группах. При этом заражение обычно происходит при поедании зараженной пищи (чаще морепродуктов) или употреблении инфицированной возбудителем воды.
Пути передачи
 Как выше уже уточнялось вирус характеризуется фекально-оральным механизмом передачи бытовым, водным или пищевым путем.
Как выше уже уточнялось вирус характеризуется фекально-оральным механизмом передачи бытовым, водным или пищевым путем.
Патогенез инфекции пока не особенно изучен, однако, есть предположение, что вирус поначалу поражает эпителиальный слой внутрикишечной оболочки. В результате происходит активация лиазного фермента и возникает осмотический диарейный синдром.
Попутно происходит формирование энтерита с неудержимым поносом и дегидратацией организма, интоксикационной симптоматикой и сниженным аппетитом.
Симптомы астровирусной инфекции
Обычно инкубационный период занимает порядка одного-четырех дней. Для клиники астровирусной инфекции характерны:
- Умеренные рвотные реакции;
- Расстройствами стула в виде вялотекущего водянистого поноса;
- Абдоминальные болезненные ощущения;
- Гипертермические реакции;
- Отчетливо слышимое урчание, бурление в животе, которое слышно окружающим на расстоянии от больного;
- Признаки метеоризма;
- Болезненные ощущения вокруг пупочной области, которые склонны к усилению в периоды опорожнения кишечника;
- Порой диарея может сочетаться с катаром (ринитом) верхних отделов дыхательной системы.
Как правило, астровирусные инфекции не создают каких-либо проблем для больного, поскольку уже через несколько дней иммунная система начинает активно вырабатывать вирусные антитела, которые пытаются справиться с патологией. Но иммунитет имеет кратковременный характер.
Примерно 60-70% 3-4-летних и более 80% 5-10-летних пациентов в крови имеют антитела к астровирусным патогенам.
Более опасен данный вирус для пациентов с угнетенной иммунной системой, но все же не смертельно. Пока медицина не обладает вакциной, помогающей защититься от данной вирусной инфекции.
Диагностика
Выявление астровирусной кишечной инфекции осуществляется преимущественно лабораторными методами при исследовании кала, крови, урины. Ведущее значение в выявлении недуга имеет ПЦР-диагностика, в процессе которой в биоматериале выявляется ДНК астровирусной инфекции.
Также для выявления астровирусного инфекционного заболевания в фекалиях пациента широко применяется методика иммунной электронной микроскопии, иммунофлуоресцентное исследование, ИФА и пр.
Данные методики помогают обнаружить антигены, частицы вируса и нуклеиновые кислоты в каловых массах зараженных людей. При наличии подозрений на наличие кишечной инфекции нужно обратиться к педиатру или терапевту.
Лечение и профилактика
Как уже говорилось выше, астровирусная инфекция инкубирует примерно 1-1,5 суток, а примерно спустя 3-4 дня наступает спонтанное выздоровление. Лечение патологии имеет симптоматический характер, но занимает достаточно длительное время. Также назначается антивирусная специфическая терапия.
При медленном восстановлении после астровирусной кишечной патологии и ослабленном иммунитете рекомендован прием иммуномодулирующих медикаментозных средств.
Зачастую астровирусы соседствуют в коинфекциях (одновременное заражение клеток несколькими вирусами) с такими патогенами, как норовирусы или ротавирусы. После наступления клинического излечения вирус продолжает выделяться в окружающую среду еще на протяжении двухнедельного периода, хотя осложнений после данной инфекции обычно не бывает.
Лучшим способом защиты от астровирусной инфекции считается грамотная профилактика, которая заключается в соблюдении гигиенических правил, ведь вирусные патогены проникают в организм пациента посредством ротовой полости, через грязные руки, воду или зараженную пищу.
Если соблюдать меры предосторожности, чистоту и санитарию при приготовлении еды, то риск развития астровирусной инфекционной патологии будет максимально снижен.
Астровирусы - это... Что такое Астровирусы?
Астровирусы — вирусы, обнаруженные в 1975 году при помощи электронной микроскопии в стуле человека.[2] Астровирусы также выделены из других видов млекопитающих (представители рода Mammoastrovirus) и из птиц (род Aviastrovirus).
Вирионы имеют размер около 28-35 нм в диаметре, икосаэдрическую форму, а также звездчатую поверхность, с пятью или шестью отростками. Наряду с Picornaviridae и Caliciviridae (англ.)русск., астровирусы являются третьим семейством безоболочечных вирусов с (+) одноцепочечной геномной РНК.[3][4] Астровирусы человека являются одной из причин гастроэнтеритов у детей раннего периода.[3]
Симптомы
У детей и взрослых вызывают гастроэнтериты. Ключевые симптомы — диарея, тошнота, рвота, недомогание и боли в животе. Инфицированные не нуждаются в госпитализации так как симптомы заболевания проходят сами собой в течение короткого периода.[5]
Диагностика
Электронная микроскопия, ИФА, иммунофлуоресценция, ПЦР позволяют выявить вирусные частицы, антигены или нуклеиновые кислоты в фекалиях инфицированных людей.[6]
Метод ПЦР в реальном времени позволяет обнаружить все генотипы астровирусов человека.[7]
Профилактика
Не существует вакцины или противовирусных средств против астровирусной инфекции. Личная гигиена снижает вероятность заболевания.
Систематика
Семейство Astroviridae содержит два рода: Mamastroviruses, инфицирующие млекопитающих и Avastroviruses, инфицирующие птиц. Внутри родов виды называются согласно имени хозяина. Виды также разделяются на серовары.[8]
Вирион
Астровирусы имеют звездчатый вирион, с пятью или шестью пиками. Вирусы не содержат оболочки, геном представлен РНК, которая находится внутри кубического капсида, диаметром около 28-35 нм.[9]
Примечания
- ↑ Таксономия вирусов на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ Madeley CR, Cosgrove BP (1975). «Letter: 28 nm particles in faeces in infantile gastroenteritis». Lancet 2 (7932): 451–2. DOI:10.1016/S0140-6736(75)90858-2. PMID 51251.
- ↑ 1 2 Brown DW, Gunning KB, Henry DM, et al. (January 2008). «A DNA oligonucleotide microarray for detecting human astrovirus serotypes». Journal of Virological Methods 147 (1): 86–92. DOI:10.1016/j.jviromet.2007.07.028. PMID 17905448. Проверено 2009-10-24.
- ↑ Matsui SM, Kiang D, Ginzton N, Chew T, Geigenmüller-Gnirke U (2001). «Molecular biology of astroviruses: selected highlights». Novartis Found. Symp. 238: 219–33; discussion 233–6. DOI:10.1002/0470846534.ch23. PMID 11444028.
- ↑ Madeley CR (1988). «Virus diarrhoea in hospital». J. Hosp. Infect. 12 (3): 145–9. DOI:10.1016/0195-6701(88)90001-1. PMID 2904454.
- ↑ Guix S, Bosch A, Pintó RM (2005). «Human astrovirus diagnosis and typing: current and future prospects». Lett. Appl. Microbiol. 41 (2): 103–5. DOI:10.1111/j.1472-765X.2005.01759.x. PMID 16033504.
- ↑ Royuela E, Negredo A, Sánchez-Fauquier A (April 2006). «Development of a one step real-time RT-PCR method for sensitive detection of human astrovirus». Journal of Virological Methods 133 (1): 14–9. DOI:10.1016/j.jviromet.2005.10.012. PMID 16321452.
- ↑ Lukashov VV, Goudsmit J (2002). «Evolutionary relationships among Astroviridae». J. Gen. Virol. 83 (Pt 6): 1397–405. PMID 12029155.
- ↑ Krishna NK (2005). «Identification of structural domains involved in astrovirus capsid biology». Viral Immunol. 18 (1): 17–26. DOI:10.1089/vim.2005.18.17. PMID 15802951.
Что такое астровирус? - Новости - Medkurs.ru
11 февраля 2015Астровирус является инфекционным агентом, вызывающим гастроэнтерит. Ему подвержены некоторые виды млекопитающих и птиц, включая людей, коров, овец и кур. Название вируса происходит от греческого слова «звезда» — это связано с его формой. Как и другие вирусы, он проникает в клетки организма, чтобы реплицировать себя.
Астровирус впервые был обнаружен в 1975 году, после вспышки диареи, с помощью электронного микроскопа. Астровирус был причислен к новооткрытому семейству вирусов astroviridae. Существует два основных типа астровирусов: мамастровирус, которому подвержены животные, и авастровирус, поражающий птиц. Они, в свою очередь, подразделяются на основании видов, на которые они воздействуют, и их серотипов. Серотип представляет собой незначительное изменение формы основного вируса. Существует семь известных серотипов астровируса человека.
Вирус выглядит как пяти- или шестиконечная звезда, отсюда и это название, размер звезды в диаметре — примерно от 28 до 35 нанометров.
Его капсид, или белковая оболочка, имеет форму икосаэдра в форме и не закрыта. Геном вируса представляет собой одноцепочечную рибонуклеиновую кислоту (РНК). Симптомы астровируса похожи на симптомы гастроэнтерита. Наиболее распространенные из них — диарея, тошнота, рвота и лихорадка. Пациенты могут также испытывать боль в животе. Такие симптомы длятся от трех до четырех дней, а затем естественным образом ослабевают – это связано с тем, что организм начинает производить антитела.
Дети в возрасте до 10 лет, а особенно до 2 лет, подвержены большей опасности развития гастроэнтерита из-за астровирусной инфекции.
В возрасте 5 лет у большинства детей уже сформирован иммунитет к нему, однако известны случаи заболевания у взрослых и пожилых людей. Считается, что астровирус является причиной четверти всех случаев гастроэнтерита у детей, а пик заболевания приходится на зиму и дождливый сезон. Наиболее распространенным астровирусом, которому подвержен человек, является вирус серотипа один. В арсенале докторов имеется ряд научных методов для выявления астровируса. Они включают в себя электронную микроскопию, иммуноферментный и имунофлюоресцентный анализы. Чтобы определить вирусные частицы, антигены и вирусные нуклеиновые кислоты, присутствующие в образцах кала, используются все методы.
Астровирусы, как правило, не вызывают значительных проблем для пациента. Организм обычно производит антитела в течение нескольких дней, таким образом пытаясь устранить проблему. Некоторую опасность вирус представляет для людей со слабой иммунной системой. Ученым пока не удалось разработать вакцину или антивирусное лечение. Лучший способ профилактики вируса – банальное соблюдение правил гигиены. Вирус, как правило, проникает в организм пациентов через рот, руки, пищу или воду. Санитария, чистота и соблюдение мер предосторожности при приготовлении пищи являются существенными факторами для снижения риска заболевания астровирусом.
Источник: wisegeek.com
Далее по теме:
Астровирус у ребенка как лечить
Астровирус является инфекционным агентом, вызывающим гастроэнтерит. Ему подвержены некоторые виды млекопитающих и птиц, включая людей, коров, овец и кур. Название вируса происходит от греческого слова «звезда» — это связано с его формой. Как и другие вирусы, он проникает в клетки организма, чтобы реплицировать себя.
Астровирус впервые был обнаружен в 1975 году, после вспышки диареи, с помощью электронного микроскопа. Астровирус был причислен к новооткрытому семейству вирусов astroviridae. Существует два основных типа астровирусов: мамастровирус, которому подвержены животные, и авастровирус, поражающий птиц. Они, в свою очередь, подразделяются на основании видов, на которые они воздействуют, и их серотипов. Серотип представляет собой незначительное изменение формы основного вируса. Существует семь известных серотипов астровируса человека.
Вирус выглядит как пяти- или шестиконечная звезда, отсюда и это название, размер звезды в диаметре — примерно от 28 до 35 нанометров.
Его капсид, или белковая оболочка, имеет форму икосаэдра в форме и не закрыта. Геном вируса представляет собой одноцепочечную рибонуклеиновую кислоту (РНК). Симптомы астровируса похожи на симптомы гастроэнтерита. Наиболее распространенные из них — диарея, тошнота, рвота и лихорадка. Пациенты могут также испытывать боль в животе. Такие симптомы длятся от трех до четырех дней, а затем естественным образом ослабевают – это связано с тем, что организм начинает производить антитела.
Дети в возрасте до 10 лет, а особенно до 2 лет, подвержены большей опасности развития гастроэнтерита из-за астровирусной инфекции.
В возрасте 5 лет у большинства детей уже сформирован иммунитет к нему, однако известны случаи заболевания у взрослых и пожилых людей. Считается, что астровирус является причиной четверти всех случаев гастроэнтерита у детей, а пик заболевания приходится на зиму и дождливый сезон. Наиболее распространенным астровирусом, которому подвержен человек, является вирус серотипа один. В арсенале докторов имеется ряд научных методов для выявления астровируса. Они включают в себя электронную микроскопию, иммуноферментный и имунофлюоресцентный анализы. Чтобы определить вирусные частицы, антигены и вирусные нуклеиновые кислоты, присутствующие в образцах кала, используются все методы.
Астровирусы, как правило, не вызывают значительных проблем для пациента. Организм обычно производит антитела в течение нескольких дней, таким образом пытаясь устранить проблему. Некоторую опасность вирус представляет для людей со слабой иммунной системой. Ученым пока не удалось разработать вакцину или антивирусное лечение. Лучший способ профилактики вируса – банальное соблюдение правил гигиены. Вирус, как правило, проникает в организм пациентов через рот, руки, пищу или воду. Санитария, чистота и соблюдение мер предосторожности при приготовлении пищи являются существенными факторами для снижения риска заболевания астровирусом.
 Гастроэнтерит — сложный воспалительный процесс, охватывающий преимущественно стенки желудка и тонкой кишки. Рассматривать данную патологию следует максимально серьёзно, так как отсутствие своевременного лечения может обернуться для детского организма тяжелым обезвоживанием.
Гастроэнтерит — сложный воспалительный процесс, охватывающий преимущественно стенки желудка и тонкой кишки. Рассматривать данную патологию следует максимально серьёзно, так как отсутствие своевременного лечения может обернуться для детского организма тяжелым обезвоживанием.
Заболевание еще называют желудочным гриппом, но более корректно будет так говорить лишь в случаях, когда причиной является вирусная инфекция.
Причины
Развитию данного заболевания у ребёнка может способствовать проникновение различной инфекции в организм, а также употребление в пищу продуктов питания, содержащих в составе вещества, к которым у ребенка повышена чувствительность. К развитию инфекционного гастроэнтерита может привести попадание в организм следующих микроорганизмов.
- астровирус;
- аденовирус;
- цитомегаловирус;
- ротавирус;
- коронавирус.
- шигеллы;
- иерсинии;
- клостридии;
- протей;
- сальмонеллы;
- кишечная палочка;
- кампилобактер.
Протисты (тип простейших микроорганизмов):
Послужить причиной развития алиментарной формы данной патологии у детей может одновременное употребление в пищу свежих фруктов и овощей с молочными и кисломолочными продуктами. Индивидуальная непереносимость некоторых продуктов питания (некоторые сорта мяса и рыбы) также может спровоцировать развитие гастроэнтерита у детей различной степени тяжести. Алиментарная форма гастроэнтерита не является опасной для детей, и для её лечения бывает достаточно коррекции питания. Лечение инфекционного гастроэнтерита является довольно серьёзной и сложной задачей.
Кроме вышеописанных причин существует целый ряд факторов, способствующих развитию данного заболевания в организме ребёнка. К таким факторам можно отнести:
- Несоблюдение элементарных правил личной гигиены. Дети, своевременно не приученные мыть руки после посещения улицы и перед едой автоматически попадают в группу риска по развитию инфекционного гастроэнтерита.
- Функциональная несостоятельность желудочно-кишечного тракта у детей до года. Особенно это касается новорожденных детей, в организме которых ещё не осуществляется достаточная выработка иммуноглобулинов (IgA).
- Недостаточная механическая и термическая обработка продуктов питания (мяса, рыбы, куриных яиц, овощей и фруктов).
- Контакт ребёнка с человеком, страдающим кишечной инфекцией.
- Несоблюдение родителями правил личной гигиены. Особенно важно, чтобы родители осуществляли мытьё рук с мылом до и после смены памперса, а также перед кормлением ребёнка. В период кормления грудью, каждая женщина должна правильно ухаживать за молочными железами. Если ребёнок находится на искусственном вскармливании, бутылочки и соски должны быть вымыты и обработаны кипятком перед каждым кормлением.
Пути заражения
Заразится инфекционным гастроэнтеритом возможно только посредством фекально-орального механизма. Основными переносчиками инфекции в данном случае являются насекомые и грызуны (тараканы, мухи, мыши и крысы). Попадая в организм, возбудитель заболевания начинает свой цикл развития и размножения.
Симптомы
С момента проникновения инфекции в организм и до появления первых признаков заболевания инкубационный период может составлять от нескольких часов до 5 дней при вирусной или бактериальной инфекции, или до примерно двух недель при заражении простейшими паразитами.
При инфекционном гастроэнтерите происходит резкое угнетение роста нормальной микрофлоры толстого кишечника (лакто- и бифидобактерии). В процессе развития заболевания происходит нарушение всасывания полезных веществ и жидкости в просвете тонкого кишечника, снижается моторика толстого кишечника.
Характерная симптоматика инфекционного гастроэнтерита у детей выглядит следующим образом:
- Появление тянущей боли в животе, не имеющей чёткой локализации. Боль носит периодический характер, и может быть различной степени интенсивности. Если ребёнок не грудного возраста и уже способен обозначить точное место возникновения боли, то чаще всего он указывает на область вокруг пупка.
- Изменение характера стула (диарея). В начальной стадии заболевания стул может иметь кашицеобразную консистенцию, но в процессе прогрессирования он становится водянистым и обильным.
- Чрезмерное газообразование в кишечнике (метеоризм).
- Появление тошноты и рвоты, содержащей частички непереваренной пищи.
- Симптомы отравления организма, среди которых можно выделить слабость, повышение температуры тела в пределах 38-39 градусов, общее недомогание, раздражительность и головную боль.
- Формирование признаков обезвоживания организма. В результате значительной потери жидкости кожа ребёнка выглядит бледной с сероватым оттенком, слизистая оболочка ротовой полости пересыхает, на поверхности языка может наблюдаться густой белый налёт.
Диагностика
Первичным звеном диагностики гастроэнтерита является сбор врачом информации относительно начала заболевания, а также о том, какие симптомы были первичными, а какие появились несколько позже. С целью обнаружения инфекции в организме ребёнка проводится бактериологическое исследование кала. Кроме того, осуществляется анализ крови на наличие антител к возбудителям инфекционных заболеваний.
В процессе проведения исследования кала (копрограммы) могут быть обнаружены признаки недостаточности функции поджелудочной железы, частички непереваренной пищи, слизь, а также остатки клетчатки. Обнаружение в кале эритроцитов может указывать на присутствие скрытого кровотечения в желудочно-кишечном тракте.
Во время проведения клинического анализа крови может быть обнаружено повышенное содержание лейкоцитов, ускорение СОЭ, а также сдвиг формулы крови влево. Биохимическое исследование крови может отмечать увеличение концентрации C-реактивного белка, который сигнализирует о наличии острого воспалительного процесса в организме.
Ещё одним важным вопросом диагностики гастроэнтерита у детей является определение степени тяжести дегидратации (обезвоживания) организма. Если жидкий стул наблюдается не более 3-х раз в день, то можно говорить о лёгкой степени заболевания. Средняя степень тяжести соответствует частоте жидкого стула до 10 раз в сутки, а тяжёлое течение — более 10 раз в сутки.
Лечение
При лёгкой степени течения гастроэнтерита объём потребляемой ребёнком жидкости в первые 6 часов заболевания должен составлять 50 мл на 1 кг массы тела, при средней и тяжелой степени тяжести — 80 мл/кг. В качестве жидкости следует использовать подсоленную и пресную питьевую воду, употребление которой чередуется.
В процессе лечения гастроэнтерита у детей особое внимание следует уделить питанию. В первые сутки рекомендован голод. На 2 день допустим приём пищи небольшими порциями. Если ребёнок находится на грудном вскармливании, то возможно осуществлять осторожные попытки прикладывания к груди. Кормление должно быть более частым, но урезанным по объёму. Детям старшего возраста разрешён к употреблению куриный бульон, каши, приготовленные на воде, отварные овощи, а также не сладкие сухарики из белого хлеба.
Медикаментозная терапия
Для лечения гастроэнтерита у детей различного возраста используются следующие группы лекарственных препаратов:
- Антибактериальные препараты. Подбор конкретного препарата осуществляется в индивидуальном порядке, исходя из типа инфекционного возбудителя.
- Противовирусные препараты. Используются в случае, если причиной заболевания послужило проникновение вируса в организм.
- Кишечные сорбенты. Использование данной группы препаратов ведётся с целью скорейшего выведения токсинов из организма.
- Про- и пребиотики. Их назначение ведётся с целью восстановления баланса нормальной микрофлоры толстого кишечника.
- Пищеварительные ферменты. Их использование целесообразно только при стойком нарушении работы поджелудочной железы и кишечника.
Рекомендации для младенцев и детей
- Восполнение жидкости. Ребенку следует давать средства для пероральной регидратации, доступные в аптеках без рецепта. Если имеются вопросы по их применению, то следует переспросить у педиатра. Не желательно давать ребенку обычную воду – у детей с гастроэнтеритом она не впитывается нормально и не заменяет должным образом потерянные электролиты. Нельзя применять для этой цели также яблочный сок, так как он может усилить диарею.
- Постепенное возвращение к нормальному питанию. Следует поэтапно включать в рацион ребенка мягкие, легко усваиваемые продукты, такие как хлеб (лучше цельнозерновой), рис, бананы и картофель.
- Избегание некоторых продуктов. Не нужно давать ребенку молочные продукты и сладости, такие как мороженое, газированные напитки и конфеты. Они могут усилить диарею.
- Достаточный отдых. Болезнь и обезвоживание организма может делать ребенка слабым и усталым, поэтому ему нужен покой.
- Не давать лишние лекарства. Важно не применять противодиарейные средства, если их не назначал педиатр. Они могут затруднить борьбу иммунной системы ребенка с возбудителем инфекции. Кроме того детям и подросткам противопоказан аспирин из-за риска развития синдрома Рейе (редкого, но потенциально смертельного заболевания). Перед тем как выбрать обезболивающие или жаропонижающие средства следует их обсудить с педиатром.
В случае с заболевшим младенцем, нужно давать отдохнуть его желудку в течении 15-20 минут после рвоты или приступа диареи, а затем предлагать небольшое количество жидкости – грудного молока или детской смеси, если ребенок на искусственном вскармливании. Также можно давать чистую бутилированную кипяченую воду, если ребенок отказывается от молока или смеси, и по назначению врача добавлять в нее Регидрон или его аналоги.
При своевременном обращении за врачебной помощью гастроэнтерит поддаётся успешному лечению.
Вирусный гастроэнтерит — это острое заболевание, которое имеет второе название желудочный грипп. Его способны вызывать вирусы 5 основных групп:
- ротавирусы;
- кишечные аденовирусы;
- астровирусы;
- калицивирусы;
- норовирусы (вирусы группы Норуолк).
Норовирусы поражают детей старшего возраста и взрослых, все остальные проявляются чаще всего у детей грудного и младшего возраста. В редких случаях может заболеть и взрослый человек.
Почему возникает энтеровирусный гастроэнтерит?
Болезнь имеет фекально-оральный механизм передачи: через воду, пищу и бытовые предметы. Водный путь считается особо опасным, так как вызывает массовые заражения. У больных поражаются слизистые оболочки ротовой полости и глотки, тонкого кишечника.
Ротавирусный гастроэнтерит развивается следующим образом: ротавирус через рот попадает в ЖКТ, в клетки слизистой двенадцатиперстной кишки, где активно размножается. От этого клетки слизистой гибнут, отторгаются ворсинки, через которые в кровь всасываются питательные вещества.
Ротавирус — главнейший возбудитель поноса с обезвоживанием. На него приходится самое большое количество госпитализаций детей по поводу кишечных инфекций.
Заражение может произойти:
- При отсутствии правил личной гигиены. Заболевший человек не помыл рук после туалета, дотронулся до какого-то предмета. Здоровый взял предмет в руки, потом руками занес инфекцию в полость рта — это контактно-бытовой путь заражения.
- При питье зараженной воды. Причиной может стать не только вода, взятая из открытых источников, но и бутылированная вода, разлитая с нарушением санитарных норм. Это так называемый водный путь, один из самых опасных, который может повлечь массовые заражения.
- При употреблении зараженных продуктов питания, чаще всего молочных. Этот путь заражения называется алиментарным.
Каковы симптомы заболевания?
- интоксикация,
- рвота,
- понос,
- боли в животе, вздутие,
- снижение объема мочи,
- повышение температуры.
Заболевание протекает 1-7 дней в зависимости от степени тяжести. Тяжелая форма, в основном, развивается у детей в возрасте от 3 месяцев до 1,5 лет, у детей постарше протекает в более легкой форме или вообще бессимптомно. Взрослых болезнь поражает редко, в основном, пожилых людей, либо тех, с кем тесно контактировал больной ребенок.

Бывают атипичные формы со слабовыраженной или совсем не выраженной симптоматикой, когда наличие инфекции можно выявить лишь лабораторными исследованиями. Такие больные, полагающие себя здоровыми, как раз и представляют особую опасность для заражения других.
Диагностика и лечение. Диагностические действия включают в себя:
- сбор анамнеза,
- общий осмотр,
- анализы мочи и крови,
- исследования кала,
- серологический тест,
- консультацию врача-инфекциониста.
Больные с тяжелой и средней тяжести формами заболевания госпитализируются. Легкая форма лечится амбулаторно.
Первая задача лечения заключается в восполнении потери жидкости организмом. Нужно пить много простой и минеральной воды с добавлением солей. Если обезвоживание очень сильное, назначают внутривенное введение электролитов. Показан прием энтеросорбентов для выведения газов и токсинов, назначаются препараты, содержащие бифидобактерии.
Важную роль играет диета, в которую входит жидкая пища, насыщенная белком, витаминами и солями. Питаться нужно дробно, 5-6 раз в день, небольшими порциями.
Возможные осложнения
При серьезной потере жидкости организмом у больного иногда развиваются почечная и сердечно-сосудистая недостаточность, дисбактериоз. Гастроэнтерит у детей с сильными нарушениями иммунной системы, и у пожилых людей при сопутствующих инфекциях может привести к летальному исходу.

Кишечными аденовирусами, в основном, заболевают дети до 2 лет. Передача вируса происходит контактным путем, от человека к человеку. Случаются вспышки инфекции в больницах.
Симптоматика заболевания имеет свою специфику. Кишечные аденовирусы провоцируют более длительные периоды заболевания, нежели другие вирусные гастроэнтериты. Они могут продолжаться до 14 дней.
Для заболевания характерны:
- умеренная интоксикация,
- невысокая, но стабильно держащаяся температура,
- лихорадка,
- боль в животе,
- понос и рвота, выраженные умеренно, длящиеся не более 1-3 дней.
Диагностика и лечение заболевания
Лабораторная диагностика призвана обнаружить антиген вируса в кале с помощью иммуноферментного анализа (ИФА). Также выявляют вирус в культуре клеток, используется РСК-анализ.

Аденовирусный гастроэнтерит — аденовирусная форма, как и ротавирусная, требует восполнения жидкости и солей, утраченных при обезвоживании.
На втором месте — диетотерапия. Исключаются молоко и кисломолочные продукты, ограничиваются углеводы, сахар, овощи и фрукты.
Из медицинских препаратов назначаются комбинированные ферментные препараты (Фестал, Мезим-форте и др.), а также адсорбирующие и вяжущие (Полифепан, Смекта). Полезно применение пробиотиков.
Больным с тяжелой формой, слабой степенью обезвоживания, но выраженной интоксикацией, допустимо введение коллоидных растворов (Гемодез, Реополиглюкин и др.)
Вирусы группы Норуолк (норовирусная инфекция) не растут в культуре клеток, их не удается выделить в чистом виде. Именно вирусы этой группы вызывают почти половину вспышек вирусных гастроэнтеритов.
При заболевании поражается тонкая кишка, другие отделы ЖКТ не затрагиваются. Нарушается всасывание ксилозы, лактозы и жиров.
Механизм передачи инфекции такой же, как и с остальными вирусами. Страдают как дети, так и взрослые. Симптоматика тоже обычная для вирусного заболевания: понос, тошнота, рвота, температура, слабость, сопровождаемая мышечными и головными болями. Причем у детей преобладает рвота, а у взрослых — понос.
Для диагностики норовируса обычно проводят анализы крови ПФА или ПЦР. Лечение направлено на восполнение потери жидкости и электролитов. Назначается частое дробное питье Регидронта и Глюкосалана, чтобы восполнить потерю солей натрия, калия и глюкозы, а также лекарственные средства для ослабления сильной тошноты или рвоты.
При высокой степени обезвоживания могут внутривенно вводиться растворы электролитов.
Энтеровирусная форма гастроэнтерита. Симптомы вирусных гастроэнтеритов, вызываемых калицивирусами и астровирусами, сходны с уже описанными заболеваниями. Причины болезни, симптомы, диагностика и методы лечения почти не отличаются.
Но стоит выделить энтеровирусную форму гастроэнтерита и остановиться на нем подробнее, так как энтеровирус — это вирус очень широкого «спектра действия». Помимо гастроэнтерической формы, он лежит в основе самых разнообразных клинических форм инфекции, которые затрагивают практически весь организм человека: сердечно-сосудистую, нервную систему, ЖКТ и респираторный тракт, почки, глаза, мышцы кожи, эндокринные органы.
Астровирусы — Википедия
Материал из Википедии — свободной энциклопедии
Астровирусы[2] (лат. Astroviridae) — семейство вирусов, обнаруженных в 1975 году при помощи электронной микроскопии в стуле человека[3].
Наряду с Picornaviridae и Caliciviridae[en], астровирусы являются третьим семейством безоболочечных вирусов с одноцепочечной геномной (+)РНК[4][5]. Астровирусы человека являются одной из причин гастроэнтеритов у детей раннего периода[4].
Симптомы
У детей и взрослых вызывают гастроэнтериты. Ключевые симптомы — диарея, тошнота, рвота, недомогание и боли в животе. Инфицированные не нуждаются в госпитализации так как симптомы заболевания проходят сами собой в течение короткого периода[6].
Диагностика
Электронная микроскопия, ИФА, иммунофлуоресценция, ПЦР позволяют выявить вирусные частицы, антигены или нуклеиновые кислоты в фекалиях инфицированных людей[7].
Метод ПЦР в реальном времени позволяет обнаружить все генотипы астровирусов человека[8].
Профилактика
Не существует вакцины или противовирусных средств против астровирусной инфекции. Личная гигиена снижает вероятность заболевания.
Вирион
Вирионы астровирусов имеют размер около 28—35 нм в диаметре, икосаэдрическую форму, а также звездчатую поверхность, с пятью или шестью отростками. Вирусы не содержат оболочки, геном представлен РНК[9].
Классификация
Семейство астровирусов включает два рода: Mamastrovirus (19 видов), инфицирующие млекопитающих, и Avastrovirus (3 вида), инфицирующие птиц. Виды также разделяются на серовары[10].
См. также
Примечания
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьева, А. С. Быкова. — М. : Медицинское информационное агентство, 2003. — С. 121. — ISBN 5-89481-136-8.
- ↑ Madeley C. R., Cosgrove B. P. (1975). «Letter: 28 nm particles in faeces in infantile gastroenteritis». Lancet 2 (7932): 451—452. DOI:10.1016/S0140-6736(75)90858-2. PMID 51251.
- ↑ 1 2 Brown D. W., Gunning K. B., Henry D. M., et al. (January 2008). «A DNA oligonucleotide microarray for detecting human astrovirus serotypes». Journal of Virological Methods 147 (1): 86—92. DOI:10.1016/j.jviromet.2007.07.028. PMID 17905448. Проверено 2009-10-24.
- ↑ Matsui S. M., Kiang D., Ginzton N., Chew T., Geigenmüller-Gnirke U. (2001). «Molecular biology of astroviruses: selected highlights». Novartis Found. Symp. 238: 219—233; discussion 233—236. DOI:10.1002/0470846534.ch23. PMID 11444028.
- ↑ Madeley C. R. (1988). «Virus diarrhoea in hospital». J. Hosp. Infect. 12 (3): 145–9. DOI:10.1016/0195-6701(88)90001-1. PMID 2904454.
- ↑ Guix S., Bosch A., Pintó R. M. (2005). «Human astrovirus diagnosis and typing: current and future prospects». Lett. Appl. Microbiol. 41 (2): 103—105. DOI:10.1111/j.1472-765X.2005.01759.x. PMID 16033504. (недоступная ссылка)
- ↑ Royuela E., Negredo A., Sánchez-Fauquier A. (April 2006). «Development of a one step real-time RT-PCR method for sensitive detection of human astrovirus». Journal of Virological Methods 133 (1): 14—19. DOI:10.1016/j.jviromet.2005.10.012. PMID 16321452.
- ↑ Krishna NK (2005). «Identification of structural domains involved in astrovirus capsid biology». Viral Immunol. 18 (1): 17—26. DOI:10.1089/vim.2005.18.17. PMID 15802951.
- ↑ Lukashov V. V., Goudsmit J. (2002). «Evolutionary relationships among Astroviridae». J. Gen. Virol. 83 (Pt 6): 1397—1405. PMID 12029155.
Ротавирусы — Википедия
| Ротавирусы | |||
|---|---|---|---|
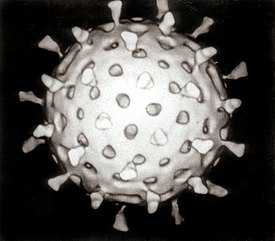 Компьютерная реконструкция ротавируса, основанная на нескольких микрографах | |||
| промежуточные ранги
| |||
| Rotavirus | |||
| |||
| III: дцРНК-вирусы | |||
Ротавирусы[3] (лат. Rotavirus) — род вирусов с двунитевой сегментированной РНК, принадлежащий семейству реовирусов (Reoviridae), возбудители ротавирусной инфекции.
Внешний вид частиц напоминает «колесо с широкой ступицей, короткими спицами и чётко очерченным ободком»[4], из-за чего они и получили своё название (лат. rota — «колесо»).
Известно 9 видов данного рода, обозначаемых латинскими буквами A—I[2]. Человек может инфицироваться видами A, B и C, при этом возбудителем более 90 % ротавирусных инфекций является наиболее часто встречаемый вид — ротавирус A. Виды с A по E могут вызывать болезни у других животных[5]. К виду Ротавирус A относится несколько серотипов[6]. Как и в случае с вирусом гриппа, здесь применяется двойная классификация по подтипам поверхностных белков: серотипы G определяются вариациями гликопротеина VP7, а серотипы P — протеазочувствительным белком VP4[7]. Поскольку гены, определяющие G- и P-типы, наследуются независимо друг от друга, встречаются различные их комбинации[8].
Геном ротавируса состоит из 11 уникальных двунитевых молекул РНК, состоящих в общей сложности из 18 555 нуклеотидов. Нити нумеруются от 1 до 11 в порядке уменьшения длины, каждая представляет собой один ген. Каждый ген кодирует один белок, за исключением гена 9, кодирующего два белка[9]. РНК окружена трёхслойным белковым капсидом в форме усечённого икосаэдра. Каждый из слоёв сложен отдельным вирусным белком. Внутренний и средний слои перфорированы каналами. Средний слой визуально содержит «спицы колеса» (белок VP6) и является важнейшим компонентом вириона.[10] Размер вируса — 76,5 нм в диаметре[11][12], суперкапсида нет[5].
Вирион сформирован шестью структурными вирусными протеинами (VP), которые обозначаются как VP1, VP2, VP3, VP4, VP6 и VP7. Инфицированная вирусом клетка продуцирует также шесть неструктурных белков (NSP), не являющихся частью вирусной частицы. Они обозначаются: NSP1, NSP2, NSP3, NSP4, NSP5 и NSP6.
Упрощённая диаграмма расположения структурных белков ротавирусаПо крайней мере шесть из двенадцати кодируемых геномом вируса белков связываются с РНК[13]. Роль этих белков в репликации вируса до конца не выяснена; их функции, как считается, относятся к синтезу РНК и его упаковке в вирион, транспортировке мРНК к месту репликации, трансляции мРНК и регуляции экспрессии генов[14].
Структурные белки[править | править код]
VP1 располагается в ядре вирусной частицы и представляет собой фермент — РНК-полимеразу[15]. В инфицированной клетке фермент осуществляет синтез мРНК для дальнейшего производства вирусных белков, а также синтез сегментов РНК вирусного генома для новых вирионов.
VP2 формирует ядро вируса и связывает вирусный геном[16].
VP3 также составляет ядро вириона и является ферментом гуанилил-трансферазой. Данный фермент катализирует образование 5'-кэп во время процессинга пре-мРНК[17]. Кэп стабилизирует вирусную мРНК, защищая её от утилизации нуклеазами[18].
VP4 расположен на поверхности вириона и выступает с неё в виде шипа[19]. Он связывается с рецепторами на поверхности клеток и управляет внедрением вируса в клетку[20]. Для того, чтобы вирус смог вызывать инфекцию, VP4 должен быть модифицирован находящимся в кишечнике ферментом трипсином в VP5* и VP8*[21]. Именно VP4 определяет вирулентность вируса. VP4 используется для серотипической классификации ротавирусов наряду с VP7.
VP6 формирует толщу капсида. Этот белок крайне антигенен и может использоваться для определения вида ротавируса[22]. Этот белок используется для определения инфекции, вызванной ротавирусом А, в лабораторных тестах[23].
VP7 — структурный гликопротеин, формирующий наружную поверхность вириона. Он определяет G-тип серологической классификации и вместе с VP4 участвует в формировании иммунитета к инфекции[11].
Неструктурные белки[править | править код]
NSP1, продукт гена 5, является неструктурным РНК-связывающим белком[24]. NSP1 также блокирует продукцию интерферона, части врождённой иммунной системы, защищающей клетки от вирусной инфекции. NSP1 вынуждает протеасомы к лизису ключевых сигнальных компонентов, необходимых для стимуляции продукции интерферона в заражённой клетке и для реакции на интерферон, секретируемый соседними клетками. Целями для протеолитической деградации становятся несколько регуляторных факторов интерферона.[25]
NSP2 — РНК-связывающий белок, аккумулируется в цитоплазматических включениях (вироплазмах) и участвует в репликации генома[26][27].
NSP3 связывается с вирусной мРНК в заражённых клетках и отвечает за выключение синтеза клеточных белков[28]. NSP3 инактивирует два фактора инициации трансляции, необходимые для синтеза белков из мРНК клетки-хозяина. Во-первых, NSP3 выталкивает поли(а)-связывающий белок (PABP) из фактора инициации трансляции eIF4F. PABP необходим для эффективной трансляции транскриптов с 3'-хвостами, которые обнаруживаются у большинства транскриптов клетки-хозяина. Во-вторых, NSP3 инактивирует eIF2, стимулируя его фосфорилирование. В то же время эффективная трансляция вирусной мРНК не требует двух этих факторов, поскольку эта РНК не содержит 3'-концов.[29]
NSP4 — вирусный энтеротоксин, вызывающий диарею. Является первым обнаруженным вирусным энтеротоксином[30].
NSP5 кодируется сегментом 11 генома ротавируса А и в инфицированных вирусом клетках накапливается в вироплазмах[31].
NSP6 является белком, связывающим нуклеиновые кислоты[32], кодируется геном 11 по внефазовой открытой рамке считывания[33].
| Сегмент РНК (Ген) | Размер, спаренных оснований | Белок | Молекулярная масса, kDa | Положение | Копий на частицу | Функция |
|---|---|---|---|---|---|---|
| 1 | 3302 | VP1 | 125 | В вершинах ядра | <25 | РНК-зависимая РНК-полимераза |
| 2 | 2690 | VP2 | 102 | Формирует внутреннюю оболочку ядра | 120 | Стимулирует вирусную РНК-репликазу |
| 3 | 2591 | VP3 | 88 | В вершинах ядра | <25 | метилтрансфераза, мРНК-кэпирующий фермент |
| 4 | 2362 | VP4 | 87 | Шипы на поверхности капсида | 120 | Прикрепление к клетке, вирулентность |
| 5 | 1611 | NSP1 | 59 | Неструктурный белок | 0 | Связывание 5’РНК, блокирование продукции интерферона |
| 6 | 1356 | VP6 | 45 | Толща капсида (средний слой) | 780 | Структурная функция; видоспецифичный антиген |
| 7 | 1104 | NSP3 | 37 | Неструктурный белок | 0 | Усиливает активность вирусной мРНК, выключает синтез клеточных белков |
| 8 | 1059 | NSP2 | 35 | Неструктурный белок | 0 | НТФаза, участвует в упаковке РНК |
| 9 | 1062 | VP71 VP72 | 38 и 34 | На поверхности | 780 | Структурный белок; нейтрализирующий антиген |
| 10 | 751 | NSP4 | 20 | Неструктурный белок | 0 | Энтеротоксин |
| 11 | 667 | NSP5 NSP6 | 22 | Неструктурный белок | 0 | оцРНК- и дцРНК-связывающий модулятор активности NSP2, фосфопротеин |
Таблица составлена на основе штамма обезьяньего ротавируса SA11[34][35][36]. Размеры генов у некоторых других штаммов могут отличаться.
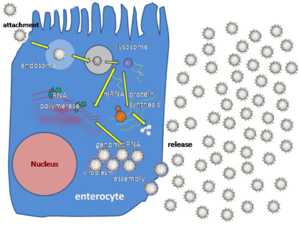 Упрощённое изображение цикла репликации ротавируса
Упрощённое изображение цикла репликации ротавируса Ротавирусы реплицируются главным образом в кишечнике[37] и заражают энтероциты ворсинок тонкого кишечника, что приводит к структурным и функциональным изменениям эпителия[38]. Тройная белковая оболочка делает их устойчивыми к кислой среде желудка и пищеварительным ферментам в кишечнике.
Существует два возможных пути проникновения вируса в клетку: прямая пенетрация через клеточную мембрану и эндоцитоз. Предполагается, что трансмембранное проникновение опосредовано гидрофобной областью VP5, являющегося продуктом расщепления VP4. Эта область закрыта у нерасщеплённого VP4, поэтому вирионы с белковыми шипами, не подвергшимися расщеплению, не способны проникнуть в клетку этим способом. Второй путь проникновения — эндоцитоз. Вирус проникает в клетку путём опосредованного рецепторами эндоцитоза и образует везикулы, известные как эндосомы. Белки в третьем слое (VP7 и шип VP4) нарушают мембрану эндосомы, создав разницу в концентрации кальция. Это вызывает распад VP7-тримеров на одиночные белковые субъединицы, при этом оставшиеся вокруг вирусной двунитевой РНК белки VP2 и VP6 образуют двухслойную частицу (DLP)[39].
Одиннадцать дцРНК-нитей остаются под защитой двух белковых оболочек, где вирусная РНК-зависимая РНК-полимераза создаёт транскрипты мРНК вирусного генома. Оставаясь в ядре вириона, вирусная РНК избегает врождённого иммунного ответа, называемого РНК-интерференцией и вызываемого присутствием двухцепочечной РНК.
Во время инфекции ротавирус производит мРНК для биосинтеза белка и репликации генов. Большинство ротавирусных белков накапливается в вироплазмах, где реплицируется РНК и собираются DLP. Вироплазмы формируются вокруг ядра клетки уже через два часа после начала вирусной инфекции и состоят из вирусных фабрик, создаваемых, как предполагается, двумя вирусными неструктурными белками: NSP5 и NSP2. Ингибирование NSP5 РНК-интерференцией приводит к резкому снижению репликации ротавирусов. DLP мигрируют в эндоплазматический ретикулум, где они получают свой третий, внешний, слой (образованный VP7 и VP4). Потомство вируса высвобождается из клетки путём лизиса[21][40][41].
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ 1 2 Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV). (Проверено 26 марта 2017).
- ↑ Атлас по медицинской микробиологии, вирусологии и иммунологии : Учебное пособие для студентов медицинских вузов / Под ред. А. А. Воробьева, А. С. Быкова. — М. : Медицинское информационное агентство, 2003. — С. 117. — ISBN 5-89481-136-8.
- ↑ Грачева Н. М., Аваков А. А., Блохина Т. А., Щербаков И. Т. Клинические аспекты ротавирусной инфекции // Лечащий врач. — 1998. — № 3. — ISSN 1560-5175.
- ↑ 1 2 Kirkwood C. D. Genetic and antigenic diversity of human rotaviruses: potential impact on vaccination programs (англ.) // The Journal of Infectious Diseases : journal. — 2010. — September (vol. 202, no. Suppl). — P. S43—S48. — doi:10.1086/653548. — PMID 20684716.
- ↑ O'Ryan M. The ever-changing landscape of rotavirus serotypes (неопр.) // The Pediatric Infectious Disease Journal. — 2009. — March (т. 28, № 3 Suppl). — С. S60—S62. — doi:10.1097/INF.0b013e3181967c29. — PMID 19252426.
- ↑ Patton J.T. Rotavirus diversity and evolution in the post-vaccine world (англ.) // Discovery Medicine : journal. — 2012. — January (vol. 13, no. 68). — P. 85—97. — PMID 22284787.
- ↑ Desselberger U., Wolleswinkel-van den Bosch J., Mrukowicz J., Rodrigo C., Giaquinto C., Vesikari T. Rotavirus types in Europe and their significance for vaccination (англ.) // Pediatr. Infect. Dis. J. : journal. — 2006. — Vol. 25, no. 1 Suppl.. — P. S30—S41. — doi:10.1097/01.inf.0000197707.70835.f3. — PMID 16397427.
- ↑ Desselberger, U.; Gray, James. Rotaviruses: methods and protocols (неопр.) / Desselberger, U.; Gray, James. — Totowa, N. J.: Humana Press (англ.)русск., 2000. — С. 2. — ISBN 0-89603-736-3.
- ↑ Carter, J., & Saunders, V. A. (2007). Virology: principles and applications. John Wiley & Sons; 148-151
- ↑ 1 2 Pesavento J. B., Crawford S. E., Estes M. K., Prasad B. V. Rotavirus proteins: structure and assembly (неопр.) // Curr. Top. Microbiol. Immunol.. — 2006. — Т. 309. — С. 189—219. — doi:10.1007/3-540-30773-7_7. — PMID 16913048.
- ↑ Prasad B. V., Chiu W. Structure of rotavirus (неопр.) // Curr. Top. Microbiol. Immunol.. — 1994. — Т. 185. — С. 9—29. — PMID 8050286.
- ↑ Patton J. T. Structure and function of the rotavirus RNA-binding proteins (англ.) // Journal of General Virology (англ.)русск. : journal. — Microbiology Society (англ.)русск., 1995. — Vol. 76, no. 11. — P. 2633—2644. — doi:10.1099/0022-1317-76-11-2633. — PMID 7595370. Архивировано 9 декабря 2012 года.
- ↑ Patton J. T. Rotavirus RNA replication and gene expression (неопр.) // Novartis Found. Symp.. — 2001. — Т. 238. — С. 64—77; discussion 77—81. — doi:10.1002/0470846534.ch5. — PMID 11444036.
- ↑ Vásquez-del Carpió R., Morales J. L., Barro M., Ricardo A., Spencer E. Bioinformatic prediction of polymerase elements in the rotavirus VP1 protein (англ.) // Biol. Res. : journal. — 2006. — Vol. 39, no. 4. — P. 649—659. — doi:10.4067/S0716-97602006000500008. — PMID 17657346.
- ↑ Arnoldi F., Campagna M., Eichwald C., Desselberger U., Burrone O. R. Interaction of rotavirus polymerase VP1 with nonstructural protein NSP5 is stronger than that with NSP2 (англ.) // J. Virol. : journal. — 2007. — Vol. 81, no. 5. — P. 2128—2137. — doi:10.1128/JVI.01494-06. — PMID 17182692.
- ↑ Angel J., Franco M. A., Greenberg H. B. Desk Encyclopedia of Human and Medical Virology (англ.) / Mahy B. W. J., Van Regenmortel M. H. V.. — Boston: Academic Press, 2009. — P. 277. — ISBN 0-12-375147-0.
- ↑ Cowling V. H. Regulation of mRNA cap methylation (англ.) // Biochem. J.. — 2010. — January (vol. 425, no. 2). — P. 295—302. — doi:10.1042/BJ20091352. — PMID 20025612.
- ↑ Gardet A., Breton M., Fontanges P., Trugnan G., Chwetzoff S. Rotavirus spike protein VP4 binds to and remodels actin bundles of the epithelial brush border into actin bodies (англ.) // J. Virol. : journal. — 2006. — Vol. 80, no. 8. — P. 3947—3956. — doi:10.1128/JVI.80.8.3947-3956.2006. — PMID 16571811.
- ↑ Arias C. F., Isa P., Guerrero C. A., Méndez E., Zárate S., López T., Espinosa R., Romero P., López S. Molecular biology of rotavirus cell entry (неопр.) // Arch. Med. Res.. — 2002. — Т. 33, № 4. — С. 356—361. — doi:10.1016/S0188-4409(02)00374-0. — PMID 12234525.
- ↑ 1 2 Jayaram H., Estes M. K., Prasad B. V. Emerging themes in rotavirus cell entry, genome organization, transcription and replication (англ.) // Virus Research : journal. — 2004. — April (vol. 101, no. 1). — P. 67—81. — doi:10.1016/j.virusres.2003.12.007. — PMID 15010218.
- ↑ Bishop R. F. Natural history of human rotavirus infection (неопр.) // Arch. Virol. Suppl.. — 1996. — Т. 12. — С. 119—128. — PMID 9015109.
- ↑ Beards G. M., Campbell A. D., Cottrell N. R., Peiris J. S., Rees N., Sanders R. C., Shirley J. A., Wood H. C., Flewett T. H. Enzyme-linked immunosorbent assays based on polyclonal and monoclonal antibodies for rotavirus detection (англ.) // J. Clin. Microbiol. : journal. — 1984. — 1 February (vol. 19, no. 2). — P. 248—254. — PMID 6321549.
- ↑ Hua J., Mansell E. A., Patton J. T. Comparative analysis of the rotavirus NS53 gene: conservation of basic and cysteine-rich regions in the protein and possible stem-loop structures in the RNA (англ.) // Virology : journal. — 1993. — Vol. 196, no. 1. — P. 372—378. — doi:10.1006/viro.1993.1492. — PMID 8395125.
- ↑ Arnold M.M. The Rotavirus Interferon Antagonist NSP1: Many Targets, Many Questions (англ.) // Journal of Virology : journal. — 2016. — Vol. 90, no. 11. — P. 5212—5215. — doi:10.1128/JVI.03068-15. — PMID 27009959.
- ↑ Kattoura M. D., Chen X., Patton J. T. The rotavirus RNA-binding protein NS35 (NSP2) forms 10S multimers and interacts with the viral RNA polymerase (англ.) // Virology : journal. — 1994. — Vol. 202, no. 2. — P. 803—813. — doi:10.1006/viro.1994.1402. — PMID 8030243.
- ↑ Taraporewala Z. F., Patton J. T. Nonstructural proteins involved in genome packaging and replication of rotaviruses and other members of the Reoviridae (англ.) // Virus Res. : journal. — 2004. — Vol. 101, no. 1. — P. 57—66. — doi:10.1016/j.virusres.2003.12.006. — PMID 15010217.
- ↑ Poncet D., Aponte C., Cohen J. Rotavirus protein NSP3 (NS34) is bound to the 3' end consensus sequence of viral mRNAs in infected cells (англ.) // J. Virol. : journal. — 1993. — 1 June (vol. 67, no. 6). — P. 3159—3165. — PMID 8388495.
- ↑ López, S; Arias, C.F. Rotavirus-host cell interactions: an arms race (англ.) // Current Opinion in Virology. — Elsevier, 2012. — August (vol. 2, no. 4). — P. 389—398. — doi:10.1016/j.coviro.2012.05.001. — PMID 22658208.
- ↑ Hyser J. M., Estes M. K. Rotavirus vaccines and pathogenesis: 2008 (англ.) // Current Opinion in Gastroenterology. — Lippincott Williams & Wilkins (англ.)русск., 2009. — January (vol. 25, no. 1). — P. 36—43. — doi:10.1097/MOG.0b013e328317c897. — PMID 19114772.
- ↑ Afrikanova I., Miozzo M. C., Giambiagi S., Burrone O. Phosphorylation generates different forms of rotavirus NSP5 (англ.) // Journal of General Virology (англ.)русск. : journal. — Microbiology Society (англ.)русск., 1996. — Vol. 77, no. 9. — P. 2059—2065. — doi:10.1099/0022-1317-77-9-2059. — PMID 8811003. Архивировано 26 мая 2012 года.
- ↑ Rainsford E. W., McCrae M. A. Characterization of the NSP6 protein product of rotavirus gene 11 (англ.) // Virus Res. : journal. — 2007. — Vol. 130, no. 1—2. — P. 193—201. — doi:10.1016/j.virusres.2007.06.011. — PMID 17658646.
- ↑ Mohan K. V., Atreya C. D. Nucleotide sequence analysis of rotavirus gene 11 from two tissue culture-adapted ATCC strains, RRV and Wa (англ.) // Virus Genes : journal. — 2001. — Vol. 23, no. 3. — P. 321—329. — doi:10.1023/A:1012577407824. — PMID 11778700.
- ↑ Desselberger U. Rotavirus: basic facts. In Rotaviruses Methods and Protocols. Ed. Gray, J. and Desselberger U. Humana Press, 2000, pp. 1—8. ISBN 0-89603-736-3
- ↑ Patton J. T. Rotavirus RNA replication and gene expression. In Novartis Foundation. Gastroenteritis Viruses, Humana Press, 2001, pp. 64—81. ISBN 0-471-49663-4
- ↑ Claude M. Fauquet; J. Maniloff; Desselberger, U. Virus taxonomy: classification and nomenclature of viruses: 8th report of the International Committee on Taxonomy of Viruses (англ.). — Amsterdam: Elsevier/Academic Press, 2005. — P. 489. — ISBN 0-12-249951-4.
- ↑ Greenberg H. B., Estes M. K. Rotaviruses: from pathogenesis to vaccination (неопр.) // Gastroenterology. — 2009. — May (т. 136, № 6). — С. 1939—1951. — doi:10.1053/j.gastro.2009.02.076. — PMID 19457420.
- ↑ Greenberg H. B., Clark H. F., Offit P. A. Rotavirus pathology and pathophysiology (неопр.) // Curr. Top. Microbiol. Immunol.. — 1994. — Т. 185. — С. 255—283. — PMID 8050281.
- ↑ Baker M., Prasad B. V. Rotavirus cell entry (неопр.) // Current Topics in Microbiology and Immunology. — 2010. — Т. 343. — С. 121—148. — doi:10.1007/82_2010_34. — PMID 20397068.
- ↑ Patton J. T., Vasquez-Del Carpio R., Spencer E. Replication and transcription of the rotavirus genome (англ.) // Curr. Pharm. Des. : journal. — 2004. — Vol. 10, no. 30. — P. 3769—3777. — doi:10.2174/1381612043382620. — PMID 15579070.
- ↑ Ruiz M. C., Leon T., Diaz Y., Michelangeli F. Molecular biology of rotavirus entry and replication (англ.) // TheScientificWorldJournal : journal. — 2009. — Vol. 9. — P. 1476—1497. — doi:10.1100/tsw.2009.158. — PMID 20024520.
Вирус Норуолк — Википедия
| Вирус Норуолк | |||||
|---|---|---|---|---|---|
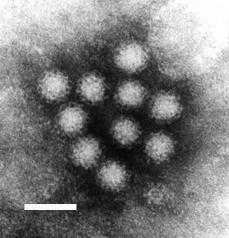 Фотография вирусов Норуолк, полученная с помощью трансмиссионного электронного микроскопа. Разрешение 50 нм | |||||
| |||||
| Norwalk virus | |||||
| IV: (+)оцРНК-вирусы | |||||
Вирус Норуолк[2] или вирус Норфолк[3] (англ. Norwalk virus), — вид РНК-содержащих вирусов из семейства калицивирусов (Caliciviridae), единственный в роде норовирусов[2][3] (Norovirus)[4]. Примерно в 90 % случаев этот вирус является причиной эпидемий желудочно-кишечных заболеваний небактериальной природы во всём мире[5][6][7], а в США отвечает за возникновение 50 % случаев заболевания гастроэнтеритом[8]. Вирусам Норуолк могут быть подвержены люди всех возрастов. Вирусы передаются при прямом контакте с больным и гораздо реже — фекально-оральным способом через заражённую еду либо воду[9]. Часто норовирусную инфекцию называют кишечным или желудочным гриппом.
У переболевшего человека иммунитет вырабатывается обычно не до конца и носит временный характер[10]. Существует врождённая предрасположенность к инфекции. Люди с первой группой крови заболевают чаще[5][11], в то время как третья и четвёртая группа крови менее восприимчивы к возбудителю.
Вспышки болезней, вызываемые вирусами Норуолк, чаще возникают в закрытых либо полузакрытых учреждениях, таких как лечебные учреждения для хронических больных, больницы, тюрьмы, общежития и круизные лайнеры, где однажды вирус появился, и инфекция распространяется очень быстро от человека к человеку либо через заражённую пищу[12]. Во многих случаях норовирус передавался через еду, стоило только одному инфицированному человеку к ней прикоснуться[13].
Вирус Норуолк можно быстро деактивировать нагреванием или при обработке хлоросодержащими дезинфицирующими веществами. Он более устойчив к обработке спиртом и детергентами из-за того, что его частицы не имеют липидной оболочки[14].
Различают несколько геногрупп вируса Норуолк, и большинство поражающих человека классифицированы в геногруппы GI и GII[15].
Вид с момента регистрации называется Norwalk virus по местности Норуолк, Огайо, где в ноябре 1968 года была зарегистрирована вспышка острого гастроэнтерита среди школьников одной начальной школы. В 1972 году в результате иммунноэлектронной микроскопии консервированных проб фекалий был обнаружен вирус, который получил название вирус Норуолк. С тех пор были зарегистрированы многочисленные заболевания с подобными симптомами. Клонирование и секвенирование генома вируса Норуолк показало, что эти вирусы имеют такую же геномную организацию, как и у вирусов семейства Caliciviridae[16]. Название рода Norovirus было утверждено Международным комитетом по таксономии вирусов в 2002 году[17].
К типичным заболеваниям, вызываемым вирусами Норуолк, относят болезни ЖКТ в осенне-зимний период, одним из симптомов которых является тошнота: вирусный гастроэнтерит[18], заболевания, связанные с воспалением желудка.
Для обозначения вируса в разное время использовали и другие названия: SRSVs (мелкие круглые вирусы), вирус типа Саппоро (Sapporo), вирус Снежных гор (Snow Mountain)[19].
Инкубационный период составляет от 10 до 72 часов, в большинстве случаев симптомы проявляются через 1—2 суток. Это, как правило, самоизлечивающаяся болезнь, и её характерные признаками являются тошнота[20], рвота, диарея, а также боли в области живота, в некоторых случаях — потеря вкусовой чувствительности. У детей, как правило, в симптоматике преобладает рвота, у взрослых — диарея. Может наблюдаться сонливость, вялость, мышечная боль и небольшая лихорадка. Симптомы могут наблюдаться несколько дней.
В группу риска входят дети, пожилые люди и пациенты с ослабленной иммунной системой. Если игнорировать симптомы и не бороться с обезвоживанием организма, заболевание чревато опасными для жизни последствиями.
Норовирус, попав в организм человека, реплицируется в тонкой кишке[9].
Обычно норовирус диагностируют при помощи полимеразной цепной реакции (ПЦР) либо по анализам ПЦР в реальном времени, которые показывают результат уже через несколько часов. Данные анализы достаточно чувствительны и могут определять концентрацию до 10 вирусных частиц[21].
Такие тесты как иммуноферментный анализ (ИФА) с использованием антител против разных штаммов норовируса доступны на коммерческой основе, но они обладают недостаточной точностью и чувствительностью[22].
Профилактика и инфекционный контроль[править | править код]
Мытьё рук по-прежнему остаётся одним из наиболее эффективных средств для предотвращения распространения болезнетворных микроорганизмов (в данном случае норовируса). Норовирус может попасть в воздух через рвотные массы больного. Все поверхности в местах, где может присутствовать Норовирус, желательно продезинфицировать[23].
В целях профилактики внутрибольничной инфекции в медицинских учреждениях проводится ряд мероприятий, в том числе ежедневная влажная уборка. В медицинских учреждениях, где распыление хлористых и других едких соединений негативно сказывается на медицинской электронике, применяются NAV-CO2 системы[24].
Компания Ligocyte занималась разработкой вакцины, однако, первая фаза клинических испытаний закончилась неудачно[25].
Вирусы Норуолк передаются при прямом контакте с больным или опосредованно через загрязнённую воду или пищу. В докладе Центра контроля заболеваний (CDC), объектами которого стали 11 вспышек в штате Нью-Йорк, говорится, что предположительно в 7 случаях заболевание передавалось от человека к человеку, в 2 случаях — через пищу, в 1 случае — через воду, а причина ещё одного случая неизвестна. Заражённая вода попадает в организм человека несколькими путями: как водопроводная вода, вода из колодца, вода из открытых общественных водоёмов, бассейнов и вода из автоматов с кубиками льда[26].
Морепродукты и ингредиенты салатов — еда, которая чаще всего влечёт за собой вспышки Норуолка. Употребление сырых или недостаточно обработанных термически моллюсков и устриц также представляет большой риск инфицирования этим вирусом. Другие продукты питания могут быть заражены от больного во время приготовления им пищи[27][23].
В США по количеству зарегистрированных обращений к врачу вирусный гастроэнтерит уступает только обычной простуде. Несмотря на то, что причиной вирусного гастроэнтерита могут быть множество различных вирусов, считается, что около в 1/3 случаев возбудителем заболевания у младенцев от 6 до 24 месяцев были вирусы Норуолк. В развивающихся странах процент людей, у которых развился иммунитет в раннем возрасте, очень высокий. В США процент со временем постепенно увеличивается и достигает отметки 50 % населения старше 18 лет. Тем не менее, постинфекционный иммунитет непродолжителен и не исключает повторное заражение. Согласно современным исследованиям, третья и четвёртая группы крови обладают частичной защитой от симптоматической инфекции[28][29].
Вирус Норуолк вызывает острый гастроэнтерит. Инкубационный период продолжается от 24 до 48 часов, чаще 33—36 часов, заболевание длится 24—60 часов[9]. Осложнения наблюдаются редко: чаще всего пациенты проходят лечение в приёмных отделениях скорой помощи и практически не направляются в обычные больницы. По оценкам специалистов каждый год в США около 300 больных умирают от этой инфекции, прежде всего жертвами становятся дети раннего возраста, люди пожилого возраста и лица с ослабленной иммунной системой.
Стандартные исследования по выявлению вируса Норуолк (РНК-содержащий вирус) в съедобных моллюсках и устрицах по результатам полимеразной цепной реакции с обратной транскриптазой запрашиваются государственными лабораториями, такими как FDA (комиссией по контролю за лекарствами и питательными веществами) в США. При этом стандартные методы определения наличия вируса в продуктах питания не всегда приемлемы из-за неоднородного происхождения разных продуктов, влияющего на концентрацию и экстрагирование вируса, и наличия факторов, которые делают методы анализа ПЦР (полимеразной цепной реакции) неэффективными[30].
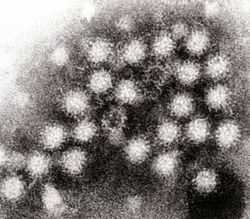 Фотография частиц вируса Норуолк в фекалиях, полученная с помощью трансмиссионного микроскопа
Фотография частиц вируса Норуолк в фекалиях, полученная с помощью трансмиссионного микроскопа Вирус Норуолк — вирус без внешней оболочки из семейства Caliciviridae, геном которых представлен одноцепочечной (+)РНК, различают несколько генетических групп[31]. Согласно Международному комитету по таксономии вирусов род норовирусов имеет одну разновидность — вирус Норуолк (Norwalk virus), сокращенно «NV». Серотипы, штаммы и изоляты включают:
- вирус Пустыни Шилд (Desert Shield virus) [U04469] (Hu/NLV/DSV395/1990/SR)
- вирус Лордсдейл (Lordsdale virus) [X86557] (Hu/NLV/LD/1993/UK)
- вирус Мексико (Mexico virus)[U22498] (Hu/NLV/MX/1989/MX)
- вирус Норуолк (Norwalk virus) [M87661] (Hu/NLV/NV/1968/US)
- вирус Гавайи (Hawaii virus) [U07611] (Hu/NLV/HV/1971/US)
- вирус Снежных гор (Snow Mountain virus)[L23831] (Hu/NLV/SMV/1976/US)
- вирус Саут-хэмптон (Southampton virus) [L07418] (Hu/NLV/SHV/1991/UK).
Во всём мире вирусы Норуолк являются основной причиной острого гастроэнтерита, часто заболевание проявляется групповыми вспышками в учреждениях. Норовирусы крайне заразны, уже 10 вирусных частиц способны вызвать инфекцию. Заболевание передаётся через заражённую пищу или воду и от человека к человеку. Механизм передачи главным образом фекально-оральный, но есть вероятность заразиться и воздушно-капельным путём, когда возбудители попадают в воздух с капельками рвотных масс. Норовирусы подразделяют на 5 геногрупп: геногруппа I (GI) включает вирус Норволк, вирус Пустыни Шилд и вирус Саут-хэмптон, и группа II (GII) — вирус Бристоль, вирус Лордсдейл, вирус Торонто, вирус Мексико, вирус Гавайи и вирус Снежных гор.
Геногруппы подразделяются на разные кластеры или генотипы. Например, геногруппа II, наиболее превалирующая «человеческая» геногруппа, до настоящего времени содержит 19 генотипов. Геногруппы I, II и IV вызывают поражения у человека, а геногруппа III инфицирует рогатый скот. Геногруппа V недавно была обнаружена у мышей[32].
Норовирусы геногруппы II, генотип 4 (сокращённо GII4) являются причиной большинства вспышек гастроэнтерита у взрослых и часто перемещаются по всей планете. Недавние образцы содержат US95/96-US-штамм, который имеет отношение к глобальным вспышкам середины и конца 90-х, вирус Фармингтон Хиллс (Farmington Hills) ассоциируется со вспышками в Европе и Соединённых Штатах в 2002 году, а вирус Хантер (Hunter virus) — со вспышками в Европе, Японии и Австралазии 2004 года. В 2006 году наблюдалась очередная мировая волна норовирусной инфекции[33]. В декабре 2007 была зарегистрирована вспышка в загородном клубе на севере Калифорнии, где были инфицированы от 80 до 100 человек. Два новых варианта GII4 стали причиной около 80 % ассоциированных с вирусом Норуолк вспышек. Они были названы 2006a и 2006b. В недавних отчётах говорится о связи между группой крови и восприимчивостью к норовирусной инфекции[34][35][36].
Учёные медицинского факультета университета Вашингтона в Сент-Луисе предположили, что белок MDA-5 может быть первичным иммунным сенсором, который выявляет наличие вирусов Норуолк в организме[37]. Любопытно, что некоторые люди имеют общие вариации MDA-5-гена, что делает их более восприимчивыми к норовирусной инфекции[38].
Геном вируса Норуолк представляет собой одноцепочечную (+)РНК размером приблизительно 7,5 тыс. нуклеотидов, содержащую 3 открытые рамки считывания, кодирующие неструктурный полипептид, претерпевающий автопротеолиз с образованием 5 активных белков, главный структурный белок (VP1) в пределах 58~60 кДа и минорный капсидный белок (VP2)[39]. При рассмотрении в электронный микроскоп вирусные частицы демонстрируют аморфное строение поверхности; размер вирусных частиц — между 27 и 38 нм[40].
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV).
- ↑ 1 2 Пиневич А. В., Сироткин А. К., Гаврилова О. В., Потехин А. А. Вирусология : учебник. — СПб. : Издательство Санкт-Петербургского университета, 2012. — С. 355. — ISBN 978-5-288-05328-3.
- ↑ 1 2 Сергеев В. А., Непоклонов Е. А., Алипер Т. И. Вирусы и вирусные вакцины. — М. : Библионика, 2007. — С. 462—463. — ISBN 5-98685-012-2.
- ↑ Таксономия вирусов (англ.) на сайте Международного комитета по таксономии вирусов (ICTV). (Проверено 18 апреля 2019).
- ↑ 1 2 Lindesmith L., Moe C., Marionneau S., et al. Human susceptibility and resistance to Norwalk virus infection (англ.) // Nat. Med. : journal. — 2003. — Vol. 9, no. 5. — P. 548—553. — doi:10.1038/nm860. — PMID 12692541.
- ↑ Norovirus: Technical Fact Sheet (неопр.). National Center for Infectious Diseases, CDC. Архивировано 24 марта 2012 года.
- ↑ Ahmed S. M., Hall A. J., Robinson A. E., Verhoef L., Premkumar P., Parashar U. D., Koopmans M., Lopman B. A. Global prevalence of norovirus in cases of gastroenteritis: a systematic review and meta-analysis. (англ.) // The Lancet infectious diseases. — 2014. — Vol. 14, no. 8. — P. 725—730. — doi:10.1016/S1473-3099(14)70767-4. — PMID 24981041. [исправить]
- ↑ Widdowson M. A., Sulka A., Bulens S. N., et al. Norovirus and foodborne disease, United States, 1991-2000 (англ.) // Emerging Infect. Dis. : journal. — 2005. — Vol. 11, no. 1. — P. 95—102. — PMID 15705329.
- ↑ 1 2 3 Goodgame R. Norovirus gastroenteritis (неопр.) // Curr Gastroenterol Rep. — 2006. — Т. 8, № 5. — С. 401—408. — doi:10.1007/s11894-006-0026-4. — PMID 16968608.
- ↑ Lindesmith L., Moe C., Lependu J., Frelinger J. A., Treanor J., Baric R. S. Cellular and humoral immunity following Snow Mountain virus challenge (англ.) // J. Virol. : journal. — 2005. — Vol. 79, no. 5. — P. 2900—2909. — doi:10.1128/JVI.79.5.2900-2909.2005. — PMID 15709009.
- ↑ Hutson A. M., Atmar R. L., Graham D. Y., Estes M. K. Norwalk virus infection and disease is associated with ABO histo-blood group type (англ.) // Journal of Infectious Diseases : journal. — 2003. — July (vol. 188, no. 1). — P. 176—177.
- ↑ Noda M., Fukuda S., Nishio O. Statistical analysis of attack rate in norovirus foodborne outbreaks (англ.) // Int J Food Microbiol : journal. — 2007. — Vol. 122. — P. 216. — doi:10.1016/j.ijfoodmicro.2007.11.073. — PMID 18177970.
- ↑ Koopmans M., Duizer E. Foodborne viruses: an emerging problem (неопр.) // Int. J. Food Microbiol.. — 2004. — Т. 90, № 1. — С. 23—41. — doi:10.1016/S0168-1605(03)00169-7. — PMID 14672828.
- ↑ Jimenez L., Chiang M. Virucidal activity of a quaternary ammonium compound disinfectant against feline calicivirus: a surrogate for norovirus (англ.) // Am J Infect Control : journal. — 2006. — Vol. 34, no. 5. — P. 269—273. — doi:10.1016/j.ajic.2005.11.009. — PMID 16765204.
- ↑ Vinjé J., Green J., Lewis D. C., Gallimore C. I., Brown D. W., Koopmans M. P. Genetic polymorphism across regions of the three open reading frames of "Norwalk-like viruses" (англ.) // Arch. Virol. : journal. — 2000. — Vol. 145, no. 2. — P. 223—241. — PMID 10752550.
- ↑ Kapikian A. Z. Overview of viral gastroenteritis (неопр.) // Arch. Virol. Suppl.. — 1996. — Т. 12. — С. 7—19. — PMID 9015097.
- ↑ ICTVdB Management (2006). 00.012.0.03. Norovirus. In: ICTVdB — The Universal Virus Database, version 4. Büchen-Osmond, C. (Ed), Columbia University, New York, USA
- ↑ Goodgame R. Norovirus gastroenteritis (неопр.) // Curr Gastroenterol Rep. — 2006. — Т. 8, № 5. — С. 401—408. — doi:10.1007/s11894-006-0026-4. — PMID 16968608.
- ↑ Appleton H. Small round viruses: classification and role in food-borne infections (англ.) // Ciba Found. Symp. : journal. — 1987. — Vol. 128. — P. 108—125. — PMID 3036438.
- ↑ В лагере «Зеркальный» дети заразились норовирусом.
- ↑ Marshall J. A., Bruggink L. D. Laboratory diagnosis of norovirus (неопр.) // Clin. Lab.. — 2006. — Т. 52, № 11—12. — С. 571—581. — PMID 17175887.
- ↑ Wilhelmi de Cal I., Revilla A., del Alamo J. M., Román E., Moreno S., Sánchez-Fauquier A. Evaluation of two commercial enzyme immunoassays for the detection of norovirus in faecal samples from hospitalised children with sporadic acute gastroenteritis (англ.) // Clin. Microbiol. Infect. : journal. — 2007. — Vol. 13, no. 3. — P. 341—343. — doi:10.1111/j.1469-0691.2006.01594.x. — PMID 17391396.
- ↑ 1 2 CDC Preventing Norovirus Infection
- ↑ Chadwick P. R., Beards G., Brown D., Caul E. O., Cheesbrough J., Clarke I., Curry A., O'Brien S., Quigley K., Sellwood J., Westmoreland D. Management of hospital outbreaks of gastro-enteritis due to small roundstructured viruses (англ.) // J. Hosp. Infect. : journal. — 2000. — Vol. 45, no. 1. — P. 1—10. — doi:10.1053/jhin.2000.0662. — PMID 10833336.
- ↑ Takeda’s norovirus vaccine misses endpoint in early-phase trial — FierceVaccines.
- ↑ Hedberg C. W., Osterholm M. T. Outbreaks of food-borne and waterborne viral gastroenteritis (англ.) // Microbiology and Molecular Biology Reviews (англ.)русск. : journal. — American Society for Microbiology (англ.)русск., 1993. — Vol. 6, no. 3. — P. 199—210. — PMID 8395330.
- ↑ Parashar U. D., Monroe S. S. "Norwalk-like viruses" as a cause of foodborne disease outbreaks (англ.) // Rev. Med. Virol. : journal. — 2001. — Vol. 11, no. 4. — P. 243—252. — doi:10.1002/rmv.321. — PMID 11479930.
- ↑ Norwalk Virus Infection and Disease Is Associated with ABO Histo-Blood Group Type, The Journal of Infectious Diseases. Дата обращения 5 февраля 2007.
- ↑ Harrington P. R., Lindesmith L., Yount B., Moe C. L., Baric R. S. Binding of Norwalk virus-like particles to ABH histo-blood group antigens is blocked by antisera from infected human volunteers or experimentally vaccinated mice. (англ.) // Journal of virology. — 2002. — Vol. 76, no. 23. — P. 12335—12343. — PMID 12414974. [исправить]
- ↑ Shieh Y., Monroe S. S., Fankhauser R. L., Langlois G. W., Burkhardt W., Baric R. S. Detection of norwalk-like virus in shellfish implicated in illness (англ.) // J. Infect. Dis. : journal. — 2000. — Vol. 181 Suppl 2. — P. S360—S366. — PMID 10804149.
- ↑ Department of Health and Ageing Norovirus laboratory case definition.
- ↑ Ramirez S., Giammanco G. M., De Grazia S., Colomba C., Martella V., Arista S. Genotyping of GII.4 and GIIb norovirus RT-PCR amplicons by RFLP analysis (англ.) // J. Virol. Methods : journal. — 2008. — Vol. 147, no. 2. — P. 250—256. — doi:10.1016/j.jviromet.2007.09.005. — PMID 17953996.
- ↑ Tu E. T., Bull R. A., Greening G. E., Hewitt J., Lyon M. J., Marshall J. A., McIver C. J., Rawlinson W. D., White P. A. Epidemics of gastroenteritis during 2006 were associated with the spread of norovirus GII.4 variants 2006a and 2006b (англ.) // Clin. Infect. Dis. : journal. — 2008. — Vol. 46, no. 3. — P. 413—420. — doi:10.1086/525259. — PMID 18177226.
- ↑ Huang P., Farkas T., Marionneau S., Zhong W., Ruvoën-Clouet N., Morrow A. L., Altaye M., Pickering L. K., Newburg D. S., LePendu J., Jiang X. Noroviruses bind to human ABO, Lewis, and secretor histo-blood group antigens: identification of 4 distinct strain-specific patterns (англ.) // J. Infect. Dis. : journal. — 2003. — Vol. 188, no. 1. — P. 19—31. — doi:10.1086/375742. — PMID 12825167.
- ↑ Huang P., Farkas T., Zhong W., Tan M., Thornton S., Morrow A. L., Jiang X. Norovirus and histo-blood group antigens: demonstration of a wide spectrum of strain specificities and classification of two major binding groups among multiple binding patterns (англ.) // J. Virol. : journal. — 2005. — Vol. 79, no. 11. — P. 6714—6722. — doi:10.1128/JVI.79.11.6714-6722.2005. — PMID 15890909.
- ↑ Rockx B. H., Vennema H., Hoebe C. J., Duizer E., Koopmans M. P. Association of histo-blood group antigens and susceptibility to norovirus infections (англ.) // J. Infect. Dis. : journal. — 2005. — Vol. 191, no. 5. — P. 749—754. — doi:10.1086/427779. — PMID 15688291.
- ↑ McCartney S. A., Thackray L. B., Gitlin L., Gilfillan S., Virgin Iv H. W., Colonna M. MDA-5 recognition of a murine norovirus. (неопр.) // PLoS Pathog. — 2008. — 18 July. — PMID 18636103.
- ↑ Researchers Discover Primary Sensor That Detects Stomach Viruses Newswise, Retrieved on July 20, 2008.
- ↑ Clarke I. N., Lambden P. R. Organization and expression of calicivirus genes (неопр.) // J. Infect. Dis.. — 2000. — Т. 181 Suppl 2. — С. S309—S316. — PMID 10804143.
- ↑ Prasad B. V., Crawford S., Lawton J. A., Pesavento J., Hardy M., Estes M. K. Structural studies on gastroenteritis viruses (неопр.) // Novartis Found. Symp.. — 2001. — Т. 238. — С. 26—37; discussion 37—46. — PMID 11444031.
Астровирус у ребенка что это значит
Астровирусы [2] (лат. Astroviridae ) — семейство вирусов, обнаруженных в 1975 году при помощи электронной микроскопии в стуле человека [3] .
Наряду с Picornavir >Calicivir > [en] , астровирусы являются третьим семейством безоболочечных вирусов с одноцепочечной геномной (+)РНК [4] [5] . Астровирусы человека являются одной из причин гастроэнтеритов у детей раннего периода [4] .
Содержание
Симптомы [ править | править код ]
У детей и взрослых вызывают гастроэнтериты. Ключевые симптомы — диарея, тошнота, рвота, недомогание и боли в животе. Инфицированные не нуждаются в госпитализации так как симптомы заболевания проходят сами собой в течение короткого периода [6] .
Диагностика [ править | править код ]
Электронная микроскопия, ИФА, иммунофлуоресценция, ПЦР позволяют выявить вирусные частицы, антигены или нуклеиновые кислоты в фекалиях инфицированных людей [7] .
Метод ПЦР в реальном времени позволяет обнаружить все генотипы астровирусов человека [8] .
Профилактика [ править | править код ]
Не существует вакцины или противовирусных средств против астровирусной инфекции. Личная гигиена снижает вероятность заболевания.
Вирион [ править | править код ]
Вирионы астровирусов имеют размер около 28—35 нм в диаметре, икосаэдрическую форму, а также звездчатую поверхность, с пятью или шестью отростками. Вирусы не содержат оболочки, геном представлен РНК [9] .
Классификация [ править | править код ]
Семейство астровирусов включает два рода: Mamastrovirus (19 видов), инфицирующие млекопитающих, и Avastrovirus (3 вида), инфицирующие птиц. Виды также разделяются на серовары [10] .
Астровирус является инфекционным агентом, вызывающим гастроэнтерит. Ему подвержены некоторые виды млекопитающих и птиц, включая людей, коров, овец и кур. Название вируса происходит от греческого слова «звезда» — это связано с его формой. Как и другие вирусы, он проникает в клетки организма, чтобы реплицировать себя.
Астровирус впервые был обнаружен в 1975 году, после вспышки диареи, с помощью электронного микроскопа. Астровирус был причислен к новооткрытому семейству вирусов astroviridae. Существует два основных типа астровирусов: мамастровирус, которому подвержены животные, и авастровирус, поражающий птиц. Они, в свою очередь, подразделяются на основании видов, на которые они воздействуют, и их серотипов. Серотип представляет собой незначительное изменение формы основного вируса. Существует семь известных серотипов астровируса человека.
Вирус выглядит как пяти- или шестиконечная звезда, отсюда и это название, размер звезды в диаметре — примерно от 28 до 35 нанометров.
Его капсид, или белковая оболочка, имеет форму икосаэдра в форме и не закрыта. Геном вируса представляет собой одноцепочечную рибонуклеиновую кислоту (РНК). Симптомы астровируса похожи на симптомы гастроэнтерита. Наиболее распространенные из них — диарея, тошнота, рвота и лихорадка. Пациенты могут также испытывать боль в животе. Такие симптомы длятся от трех до четырех дней, а затем естественным образом ослабевают – это связано с тем, что организм начинает производить антитела.
Дети в возрасте до 10 лет, а особенно до 2 лет, подвержены большей опасности развития гастроэнтерита из-за астровирусной инфекции.
В возрасте 5 лет у большинства детей уже сформирован иммунитет к нему, однако известны случаи заболевания у взрослых и пожилых людей. Считается, что астровирус является причиной четверти всех случаев гастроэнтерита у детей, а пик заболевания приходится на зиму и дождливый сезон. Наиболее распространенным астровирусом, которому подвержен человек, является вирус серотипа один. В арсенале докторов имеется ряд научных методов для выявления астровируса. Они включают в себя электронную микроскопию, иммуноферментный и имунофлюоресцентный анализы. Чтобы определить вирусные частицы, антигены и вирусные нуклеиновые кислоты, присутствующие в образцах кала, используются все методы.
Астровирусы, как правило, не вызывают значительных проблем для пациента. Организм обычно производит антитела в течение нескольких дней, таким образом пытаясь устранить проблему. Некоторую опасность вирус представляет для людей со слабой иммунной системой. Ученым пока не удалось разработать вакцину или антивирусное лечение. Лучший способ профилактики вируса – банальное соблюдение правил гигиены. Вирус, как правило, проникает в организм пациентов через рот, руки, пищу или воду. Санитария, чистота и соблюдение мер предосторожности при приготовлении пищи являются существенными факторами для снижения риска заболевания астровирусом.
Название семейства происходит от греч. astron – звезда, которую напоминают вирионы на фотографиях, полученных с помощью электронной микроскопии (рис. 39). До 1 января 2002 года астровирусы относили к семейству Caliciviridae.
Рис. 39. ЭМ-фотография (негативное контрастирование) вирионов в испражнениях.
Семейство Astroviridae включает 2 рода: Avasrovirus, инфицирующие птиц и Mamastrovirus (от лат. mamma – молочная железа), инфицирующие млекопитающих.
Астровирусы были обнаружены в 1975 г. при электронно-микроскопическом исследовании испражнений 120 детей в возрасте до 2-х лет, страдающих гастроэнтеритом.
Структура. Вирионы астровирусов имеют сферическую форму (28-30 нм; в клеточных культурах – до 40 нм), лишены оболочки и имеют звездчатую поверхность. Нуклеокапсид имеет икосаэдрическую симметрию и состоит из трех капсидных белков.
Геном представлен однонитевой РНК позитивной полярности, фланкируемой с обоих концов нетранслируемыми последовательностями.
Репродукция. Вирионная РНК (вРНК) астровирусов является инфекционной и после проникновения вириона в клетку-мишень служит в качестве матрицы для трансляции двух неструктурных белков.
Репликация генома астровирусов происходит путем синтеза полноразмерной минус-цепи РНК, которая служит матрицей для синтеза дочерних вРНК и субгеномной иРНК, служащей открытой рамкой считывания для предшественника структурных белков (VP90). Последний протеолитически расщепляется до VP70, который включается в вирусную частицу. Созревание вирусной частицы и приобретение ею инфекционности требует дальнейшего расщепления VP70.
Культивирование. Астровирусы с трудом культивируются в культурах клеток человека и обезьян без цитопатического эффекта. Астровируы способны к размножению в клетках почек эмбриона человека в присутствии трипсина.
Антигенные свойства малоизучены.
Резистентность. Вирусы обладают высоким уровнем устойчивости в окружающей среде, особенно в воде.
Этиология. Вирусы семейства Astroviridae, рода Mamastrovirus способны вызывать гастроэнтериты людей. На сегодняшний день идентифицировано 8 серотипов астровирусов, из которых только один серотип (HAstV-1) имеет существенное значение в развитии патологии человека.
Эпидемиология. Астровирусы встречаются повсеместно во всем мире, вызывая диарею в основном у детей, и также и у пожилых людей и лиц со сниженным иммунитетом. Передача вируса происходит через зараженную пищу, воду и различные загрязнения. Вклад астровирусов в заболевание диареей варьирует от 2,5 % до 10 %, в зависимости от возраста детей.
Патогенез сходен с патогенезом ротавирусной инфекции.
Клиническая картина. Инкубационный период при астровирусных гастроэнтеритах составляет 1-2 дня. Достаточно часто, даже при установленном инфицировании и обнаружении астровирусов в стуле, у детей отсутствуют клинические признаки заболевания, что свидетельствует о превалировании бессимптомных форм инфекции.
Клинически развитие болезни напоминает ротавирусную инфекцию, хотя протекает более легко с превалированием водянистой диареи.
В последние годы все чаще стали обращать внимание на возрастающее значение астровирусов в развитии диарей у лиц с иммунодефицитами, включая ВИЧ-инфекцию, а также при нозокомиальных инфекциях.
Иммунитет кратковременный, после перенесенного заболевания. Около 65 % детей в возрасте 3-4 лет и 87 % детей 5-10 лет имеют антитела.
Диагностика. Электронная микроскопия, ИФА, иммунофлуоресценция, ПЦР позволяют выявить вирусные частицы, антигены или нуклеиновые кислоты в фекалиях инфицированных людей.
Метод ПЦР в реальном времени позволяет обнаружить все генотипы астровирусов человека.
Лечение симптоматическое.
Профилактика должна быть направлена на улучшение санитарно-гигиенических условий и снабжения качественной питьевой водой.
Ротавирусная инфекция — Википедия
Ротавирусная инфекция — инфекционное заболевание, вызванное ротавирусами[2]. Является наиболее частой причиной диареи у детей[3]. Для этого заболевания свойственно острое начало, умеренно выраженные симптомы гастроэнтерита или энтерита, частое сочетание кишечного и респираторного синдромов в начальном периоде болезни. Ротавирусную инфекцию часто неверно называют «кишечным гриппом», хотя ротавирус не имеет никакого отношения к вирусам гриппа.
Ротавирусы (лат. Rotavirus) — род вирусов из семейства Reoviridae, сходных по морфологии и антигенной структуре. Как и другие представители этого семейства, ротавирусы обладают двунитевой фрагментированной РНК. В геноме вируса 11 фрагментов, которые окружены чётко выраженной трёхслойной белковой оболочкой (капсидом) с икосаэдрической симметрией. Внешний вид частиц напоминает «колесо с широкой ступицей, короткими спицами и чётко очерченным ободком»[4], из-за чего они и получили своё название (лат. rota — «колесо»). Диаметр вирусных частиц от 65 до 75 нм.
Сезонные колебания ротавирусной инфекции в одном из регионов Англии: пик заболеваемости приходится на зимние месяцы.Ротавирус A, на долю которого приходится более 90 % случаев ротавирусной инфекции человека,[5] широко распространён во всём мире. Ежегодно регистрируется до 25 млн случаев заболевания, из них 600—900 тысяч (то есть 2,4-3,6 %) — с летальным исходом[6], особенно это касается людей с ослабленным здоровьем.[7] Каждый год ротавирус вызывает миллионы случаев диареи в развивающихся странах, приводя к почти 2 миллионам госпитализаций,[8] и, по оценкам, к 453 000 случаев смерти детей в возрасте до пяти лет.[9] Это составляет около 40 % всех случаев госпитализации, связанных с диареей у детей до пяти лет во всём мире.[10]
В одних только США до начала программы ротавирусной вакцинации в 2006 году[11], в год происходило 47 000—70 000 госпитализаций детей в возрасте до 5 лет, и 20—60 детей этого возраста умирало в год в результате болезни.[11][12]
К главным возбудителям инфекционной диареи, в т.ч. со смертельным исходом, относят ротавирус, калицивирус (норовирус), энтеропатогенные и энтеротоксигенные Escherichia coli, которые в совокупности ответственны более чем за 50% всех смертей от диареи и ее тяжелых форм у детей младше 5 лет в глобальном масштабе. Среди указанных возбудителей лидирует ротавирус, доля которого составляет 39,4% от общего числа эпизодов диареи, при которых изучали этиологию, а среди этиологически расшифрованных вирусных диарей ротавирус выявляется в 65% случаев, причем 17,8% смертельных диарей связаны с ротавирусом. Таким образом, ежегодно с ротавирусным гастроэнтеритом связано 197 тыс. смертей, т.е. каждый час от этой инфекции погибает 23 ребенка [13]. К пятилетнему возрасту практически все дети в мире переносят ротавирусную инфекцию.[14] Ротавирус — ведущая причина тяжёлой диареи у младенцев и детей (около 20 % всех случаев), на его долю приходится 50 % случаев диареи, требующих госпитализации,[8] 37 % случаев смерти, связанных с диареей, и 5 % всех случаев смерти детей до пяти лет.[9] Мальчики госпитализируются в два раза чаще девочек.[15][16] Число заражений через загрязнённую вирусом еду неизвестно.[17]
Заболевание встречается как спорадически, так и в виде эпидемических вспышек. Очаги часто возникают в детских дошкольных учреждениях, среди госпитализированных детей, в домах престарелых.[18] В 2005 году в Никарагуа произошла самая большая из зарегистрированных эпидемий. Характеризуемая необычно широким охватом и тяжёлым течением болезни, эта вспышка была связана с мутациями в геноме ротавируса, возможно позволившими вирусу избежать существующего у населения иммунитета.[19] Подобная крупная вспышка произошла в Бразилии в 1977 году.[20]
Частота заболеваемости носит чётко выраженный сезонный характер, резко повышаясь в зимние месяцы.[21] В России до 93 %[6] случаев заболевания происходит в холодный период (с ноября по апрель включительно).
Ротавирус B, также называемый ротавирусом диареи взрослых (ADRV — Adult Diarrhoea RotaVirus), явился причиной серьёзных эпидемий тяжёлого гастроэнтерита у тысяч людей всех возрастов в Китае, произошедших в результате загрязнения питьевой воды сточными водами.[22][23] Эпидемия ротавируса B также произошла в Индии в 1998 году; штамм возбудителя был назван CAL. В отличие от ADRV, штамм CAL является эндемическим.[24][25] На сегодняшний день эпидемии ротавируса B ограничены материковой частью Китая.
На территории России ротавирус наиболее распространён на черноморском побережье, в связи с этим рекомендуется привить ребёнка перед поездкой в эту курортную зону[26].
Основной механизм передачи ротавирусов — фекально-оральный: через загрязнённые руки, поверхности и вещи.[27] Возможна также передача аэрогенным путём при тесном контакте с инфицированным.[3] Фекалии заражённого человека могут содержать более 10 триллионов вирусных частиц на грамм[2], при этом менее 100 частиц требуется для передачи инфекции другому человеку.[28]
Вирионы ротавирусов хорошо сохраняются в окружающей среде и обнаруживаются в пробах воды из устьев рек в концентрации 1-5 частиц на галлон (~1 частица на литр).[29] Также хорошо переносят низкие температуры. Санитарные меры, считающиеся достаточными для уничтожения бактериальных и паразитарных агентов, против ротавируса статистически оказываются неэффективными, поскольку уровни заболеваемости в странах с высоким и низким уровнями здравоохранения остаются схожими.[3]
 Электронная микрофотография энтероцита, заражённого ротавирусом (наверху) в сравнении со здоровой клеткой (внизу). Масштабная полоска = примерно 500 нм
Электронная микрофотография энтероцита, заражённого ротавирусом (наверху) в сравнении со здоровой клеткой (внизу). Масштабная полоска = примерно 500 нм Трёхслойная белковая оболочка вирусных частиц делает их устойчивыми к кислой среде желудка и пищеварительным ферментам кишечника.
Ротавирусы реплицируются преимущественно в кишечнике,[30] инфицируя энтероциты ворсинок тонкого кишечника и вызывая в конечном счёте их гибель, что приводит к структурным и функциональным изменениям эпителия.[31]
Сразу несколько вирусных факторов вызывает диарею. Гибель энтероцитов приводит к развитию мальабсорбции. Вирусный белковый токсин NSP4 индуцирует секрецию кальций-зависимых хлоридных каналов, нарушает реабсорбцию воды, опосредованную натрий-глюкозным котранспортёром SGLT1, по-видимому снижает активность дисахаридаз в мембранах микроворсинок, и, возможно, активирует кальций-зависимые секреторные рефлексы энтеральной нервной системы.[32]
Также характерен транзиторный дефицит лактазы (в норме секретируемой энтероцитами в просвет кишечника), сохраняющийся несколько недель.[33][34]
Болезнь носит циклический характер. В одном цикле выделяется инкубационный период (1—5 суток), острый период (3—7 суток, при тяжёлом течении болезни — более 7 суток) и период выздоровления (4—5 суток).
Для ротавирусной инфекции характерно острое начало — рвота, резкое повышение температуры, диарея, зачастую очень характерный стул — на второй, третий день серо-жёлтый и глинообразный. Кроме того, у большинства заболевших появляются насморк, покраснения в горле, они испытывают боли при глотании. В острый период отсутствует аппетит, наблюдается состояние упадка сил. Многолетние наблюдения показали, что наиболее крупные вспышки заболевания возникают во время или в канун эпидемии гриппа, за что оно получило неофициальное название — «кишечный грипп».
Кал и моча очень сходны по признакам с симптомами гепатита (светлый кал, тёмная моча, иногда с хлопьями крови).
Признаки дегидратации являются тревожным симптомом и более характерны для ротавирусной инфекции, чем для большинства бактериальных агентов, к тому же являясь наиболее частой причиной смерти при данном заболевании.
Болезнь считается детской, потому что организмы взрослых людей более защищены от ротавирусов. У взрослого человека выше кислотность желудочного сока и выше количество вырабатываемого секреторного IgA.
С каждым заражением вырабатывается иммунитет к данному типу вируса, и последующие инфекции, вызванные тем же серотипом, протекают легче.[35] У взрослого ротавирусная инфекция может проявляться небольшим кишечным расстройством, поэтому инфицированный человек может не догадываться о том, что он болен. Часто заболевание протекает и вовсе бессимптомно. Обычно, если в семье или в коллективе есть инфицированный, то в течение 3-5 суток поочередно начинают заболевать и остальные.
Наиболее частым клиническим течением заболевания являются энтерит и гастроэнтерит, вторичная лактазная недостаточность. Введение молока в пищевой рацион ребёнка после болезни часто сопровождается лёгким рецидивом диареи вследствие бактериальной ферментации лактозы в кишечнике.[36]
Специфическая диагностика инфекции, вызванной ротавирусом А, производится путём обнаружения вируса в кале ребёнка иммуноферментным анализом. На рынке существует несколько наборов экспресс-тестов, позволящих определить все серотипы ротавируса А.[37] Другие методы, такие как ПЦР и электронная микроскопия, применяются только в исследовательских лабораториях.[38]ОТ-ПЦР позволяет обнаружить и идентифицировать все виды и серотипы ротавирусов, поражающих человека.[39]
Основной целью лечения является борьба с результатами воздействия инфекции на организм: дегидратацией, интоксикацией и связанными с ними нарушениями сердечно-сосудистой и мочевыделительной систем.
В первую очередь при лечении применяется регидратационная терапия, может назначаться прием сорбентов (активированный уголь, смектит диоктаэдрический, аттапулгит)[40]. В достаточно тяжёлых случаях требуется госпитализация с введением жидкости внутривенно или через назогастральный зонд, мониторингом электролитов и сахара крови. Применение антибиотиков не рекомендуется. Эффективных противовирусных препаратов для борьбы с активной ротавирусной инфекцией не существует.
В процессе лечения необходимо скорректировать питание больного. Рекомендуется исключить из рациона острые, жирные, сладкие (включая фруктовые соки), а также молочные продукты (кроме грудного молока при кормлении младенцев), кофеиносодержащие продукты, газированные напитки, цитрусовые и желатин. Следует также ограничить и по возможности прекратить употребление алкоголя и курение. В остальном же, нормальный рацион в обычном для пациента количестве, включающий в себя, например, каши и пюре, бананы, отварное нежирное мясо и рыбу, овощи, крайне приветствуется. Полноценное питание особенно необходимо при болезни у ребёнка, поскольку помимо восполнения питательных веществ и энергии, оно в существенной степени предотвращает дегидратацию. Жидкость, включая регидратанты, следует предлагать частыми малыми порциями. Голодание, BRAT-диета не рекомендуются.[41]
В качестве эффективного средства против ротавирусной инфекции ВОЗ рекомендует проведение профилактической вакцинации.
По мнению Американской гастроэнтерологической ассоциации при лечении диареи, вызванной ротавирусной инфекцией, особенно у маленьких детей и младенцев, могут быть полезны такие пробиотики, как Lactobacillus rhamnosus и Lactobacillus casei[42].
При достаточном уходе и адекватном лечении прогноз хороший.[43] После выздоровления перенесённая болезнь не влечёт никаких долговременных последствий. После первого заболевания (как правило, в детском возрасте) в организме появляется стойкий иммунитет. У взрослых с низким уровнем антител симптомы заболевания могут повториться[2].
Неспецифическая профилактика заключается в соблюдении санитарно-гигиенических норм (мытьё рук, использование для питья только кипячёной воды), очистке и хлорировании водопроводной воды.
Поскольку улучшение санитарных условий не снижает распространённость ротавирусной инфекции, а число госпитализаций остаётся на высоком уровне несмотря на применение пероральных регидратантов, важнейшим направлением здравоохранения является вакцинация.[44] Для специфической профилактики ротавирусной инфекции, вызванной ротавирусом А, на настоящий момент существует две вакцины, прошедшие клинические испытания:[45] Ротарикс (Rotarix) компании GlaxoSmithKline[46] и РотаТек (RotaTeq) компании Мерк и Ко.[47] Обе принимаются орально и содержат ослабленный живой вирус.[45]
Ротавирусные вакцины лицензированы в более чем 100 странах мира, но только 17 стран ввели плановую вакцинацию.[48] После введения плановой вакцинации в США в 2006 году уровень заболеваемости ротавирусным гастроэнтеритом «быстро и значительно» снизился, несмотря на относительно низкий охват в сравнении с детской иммунизацией от других заболеваний.[49] Клинические испытания вакцины Ротарикс в Южной Африке и Малави показали, что вакцина значительно уменьшает тяжесть диареи, вызванной ротавирусом, и способна предотвратить инфицирование.[50] В 2012 году обзор Кокрейновским сотрудничеством 41 клинического испытания, включавших 186 263 участников, подтвердил эффективность вакцин Ротарикс и РотаТек.[51] Также в разработке находятся другие вакцины.[52]Всемирная организация здравоохранения рекомендует включение ротавирусных вакцин в национальные программы иммунизации.[53] В странах, последовавших этой рекомендации, частота и тяжесть ротавирусной инфекции значительно снизилась.[54][45]
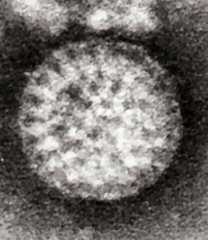 Одна из оригинальных микрофотографий Томаса Генри Флюитта. Вирусная частица напоминает колесо.
Одна из оригинальных микрофотографий Томаса Генри Флюитта. Вирусная частица напоминает колесо. В 1943 году Джейкоб Лайт и Гораций Ходес доказали, что фильтрующийся агент из фекалий детей, заболевших инфекционной диареей, также вызывает диарею у крупного рогатого скота.[55] Тридцать лет спустя в сохранившихся образцах был обнаружен ротавирус.[56] В последующие годы схожий вирус был обнаружен у мышей.[57][58] В 1973 году Рут Бишоп с коллегами описали родственные вирусы, обнаруженные ими у детей с гастроэнтеритом.[59]
В 1974 году Томас Генри Флюитт, после наблюдения вируса через электронный микроскоп, предложил название «ротавирус», заметив, что вирусная частица похожа на колесо (лат. rota — «колесо»).[60][61] Спустя четыре года название было официально признано международным комитетом по таксономии вирусов.[62] В 1976 году родственные вирусы были описаны и у других видов животных,[58] все они вызывали острый гастроэнтерит, и были признаны коллективным патогеном, поражающим людей и животных по всему миру.[60] Серотипы ротавируса впервые были описаны в 1980 году,[63] а в следующем году ротавирус от заражённого человека впервые был культивирован путём добавления необходимого ему для репликации трипсина в среду с культурой клеток, полученных из почек обезьян.[64] Возможность культивирования вируса ускорила темпы исследований, и к середине 1980-х годов были испытаны первые кандидатные вакцины.[65]
В 1998 году вакцина от ротавируса была лицензирована для использования в США. Клинические испытания в Соединённых Штатах, Финляндии и Венесуэле показали её 80 — 100 % эффективность в предотвращении тяжёлой диареи, вызванной ротавирусом А. Исследователи также не обнаружили никаких статистически значимых побочных эффектов.[66][67] Однако производитель снял вакцину с продажи после того, как было обнаружено, что она, возможно, способствовала повышенному риску инвагинации у одного на каждые 12 000 вакцинированных младенцев.[68] Данный случай спровоцировал интенсивные дебаты об относительных рисках и преимуществах ротавирусной вакцины.[69] В 2006 году исследования двух новых вакцин против инфекции ротавируса A показали их безопасность и эффективность среди детей,[70] и в июне 2009 года Всемирная организация здравоохранения рекомендовала включение вакцинации против ротавирусной инфекции во все национальные программы иммунизации для обеспечения защиты населения от данного вируса.[71]
Ротавирусы инфицируют молодых особей многих видов животных и являются основной причиной диареи у диких и домашних животных во всём мире.[72] Как патоген, распространённый среди скота, особенно молодых телят и поросят, ротавирусы вызывают экономические потери для фермеров вследствие затрат на лечение, высоких показателей заболеваемости и смертности.[73] Ротавирусы животных являются потенциальным резервуаром для генетического обмена с ротавирусами человека.[73] Есть свидетельства, что ротавирусы животных могут инфицировать людей — либо путём прямой передачи вируса, либо получением реассортантного вируса путём внесения одного или нескольких сегментов РНК в геном ротавируса человека.[74][75]
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ 1 2 3 Bishop R.F. Natural history of human rotavirus infection (англ.) // Archives of Virology (англ.)русск.. — 1996. — Vol. 12. — P. 119—128. — PMID 9015109.
- ↑ 1 2 3 Dennehy P.H. Transmission of rotavirus and other enteric pathogens in the home (англ.) // Pediatric Infectious Disease Journal (англ.)русск. : journal. — 2000. — Vol. 19, no. 10 Suppl. — P. S103—5. — doi:10.1097/6454-200010001-3. — PMID 11052397.
- ↑ Грачева Н. М., Аваков А. А., Блохина Т. А., Щербаков И. Т. Клинические аспекты ротавирусной инфекции // Лечащий врач. — 1998. — № 3. — ISSN 1560-5175.
- ↑ Leung A.K., Kellner J.D., Davies H.D. Rotavirus gastroenteritis (англ.) // Advances in Therapy (англ.)русск.. — 2005. — Vol. 22, no. 5. — P. 476—487. — doi:10.1007/BF02849868. — PMID 16418157.
- ↑ 1 2 Ферьева Е. Е. Ротавирусная инфекция // Consilium Provisorum. — 2007. — Т. 5, № 1. Архивировано 12 сентября 2010 года.
- ↑ Тихонов, Виктор. Детей-инвалидов убил ротавирус (неопр.). Газета.Ru (1 марта 2010). Дата обращения 19 июля 2011.
- ↑ 1 2 Simpson E., Wittet S., Bonilla J., Gamazina K., Cooley L., Winkler J.L. Use of formative research in developing a knowledge translation approach to rotavirus vaccine introduction in developing countries (англ.) // BMC Public Health : journal. — 2007. — Vol. 7. — P. 281. — doi:10.1186/1471-2458-7-281. — PMID 17919334.
- ↑ 1 2 Tate J.E., Burton A.H., Boschi-Pinto C., Steele A.D., Duque J., Parashar U.D. 2008 estimate of worldwide rotavirus-associated mortality in children younger than 5 years before the introduction of universal rotavirus vaccination programmes: a systematic review and meta-analysis (англ.) // The Lancet : journal. — Elsevier, 2012. — February (vol. 12, no. 2). — P. 136—141. — doi:10.1016/S1473-3099(11)70253-5. — PMID 22030330.
- ↑ UNICEF/WHO (2009) «Diarrhoea: Why children are still dying and what can be done.» Retrieved 23 May 2010
- ↑ 1 2 Centers for Disease Control and Prevention (CDC). Reduction in rotavirus after vaccine introduction—United States, 2000–2009 (англ.) // Morbidity and Mortality Weekly Report (англ.)русск. : journal. — 2009. — October (vol. 58, no. 41). — P. 1146—1149. — PMID 19847149.
- ↑ Fischer T.K., Viboud C., Parashar U., etal. Hospitalizations and deaths from diarrhea and rotavirus among children <5 years of age in the United States, 1993–2003 (англ.) // The Journal of Infectious Diseases : journal. — 2007. — Vol. 195, no. 8. — P. 1117—1125. — doi:10.1086/512863. — PMID 17357047.
- ↑ Claudio F. Lanata, Christa L. Fischer-Walker, Ana C. Olascoaga, Carla X. Torres, Martin J. Aryee. Global Causes of Diarrheal Disease Mortality in Children <5 Years of Age: A Systematic Review (англ.) // PLOS One. — Public Library of Science, 2013-09-04. — Vol. 8, iss. 9. — P. e72788. — ISSN 1932-6203. — doi:10.1371/journal.pone.0072788.
- ↑ Parashar U.D., Gibson C.J., Bresse J.S., Glass R.I. Rotavirus and severe childhood diarrhea (англ.) // Emerging Infectious Diseases (англ.)русск.. — Centers for Disease Control and Prevention, 2006. — Vol. 12, no. 2. — P. 304—306. — doi:10.3201/eid1202.050006. — PMID 16494759.
- ↑ Rheingans R.D., Heylen J., Giaquinto C. Economics of rotavirus gastroenteritis and vaccination in Europe: what makes sense? (англ.) // Pediatric Infectious Disease Journal (англ.)русск. : journal. — 2006. — Vol. 25, no. 1 Suppl. — P. S48—55. — doi:10.1097/01.inf.0000197566.47750.3d. — PMID 16397429.
- ↑ Ryan M.J., Ramsay M., Brown D., Gay N.J., Farrington C.P., Wall P.G. Hospital admissions attributable to rotavirus infection in England and Wales (англ.) // The Journal of Infectious Diseases : journal. — 1996. — Vol. 174 Suppl 1. — P. S12—8. — doi:10.1093/infdis/174.Supplement_1.S12. — PMID 8752285.
- ↑ Koopmans M., Brown D. Seasonality and diversity of Group A rotaviruses in Europe (англ.) // Acta Paediatrica (англ.)русск. : journal. — 1999. — Vol. 88, no. 426. — P. 14—9. — doi:10.1111/j.1651-2227.1999.tb14320.x. — PMID 10088906.
- ↑ Anderson E.J., Weber S.G. Rotavirus infection in adults (англ.) // The Lancet. — Elsevier, 2004. — February (vol. 4, no. 2). — P. 91—9. — doi:10.1016/S1473-3099(04)00928-4. — PMID 14871633.
- ↑ Bucardo F., Karlsson B., Nordgren J., etal. Mutated G4P[8] rotavirus associated with a nationwide outbreak of gastroenteritis in Nicaragua in 2005 (англ.) // Journal of Clinical Microbiology : journal. — 2007. — Vol. 45, no. 3. — P. 990—997. — doi:10.1128/JCM.01992-06. — PMID 17229854.
- ↑ Linhares A.C., Pinheiro F.P., Freitas R.B., Gabbay Y.B., Shirley J.A., Beards G.M. An outbreak of rotavirus diarrhea among a non-immune, isolated South American Indian community (англ.) // American Journal of Epidemiology (англ.)русск. : journal. — 1981. — Vol. 113, no. 6. — P. 703—710. — PMID 6263087.
- ↑ Levy K., Hubbard A.E., Eisenberg J.N. Seasonality of rotavirus disease in the tropics: a systematic review and meta-analysis (англ.) // International Journal of Epidemiology (англ.)русск. : journal. — 2009. — December (vol. 38, no. 6). — P. 1487—1496. — doi:10.1093/ije/dyn260. — PMID 19056806.
- ↑ Hung T., Chen G.M., Wang C.G., etal. Waterborne outbreak of rotavirus diarrhea in adults in China caused by a novel rotavirus (англ.) // The Lancet : journal. — Elsevier, 1984. — Vol. 1, no. 8387. — P. 1139—1142. — doi:10.1016/S0140-6736(84)91391-6. — PMID 6144874.
- ↑ Fang Z.Y., Ye Q., Ho M.S., etal. Investigation of an outbreak of adult diarrhea rotavirus in China (англ.) // The Journal of Infectious Diseases : journal. — 1989. — Vol. 160, no. 6. — P. 948—953. — doi:10.1093/infdis/160.6.948. — PMID 2555422.
- ↑ Kelkar S.D., Zade J.K. Group B rotaviruses similar to strain CAL-1, have been circulating in Western India since 1993 (англ.) // Epidemiology and Infection (англ.)русск. : journal. — 2004. — Vol. 132, no. 4. — P. 745—749. — doi:10.1017/S0950268804002171. — PMID 15310177.
- ↑ Ahmed M.U., Kobayashi N., Wakuda M., Sanekata T., Taniguchi K., Kader A., Naik T.N., Ishino M., Alam M.M., Kojima K., Mise K., Sumi A. Genetic analysis of group B human rotaviruses detected in Bangladesh in 2000 and 2001 (англ.) // Journal of Medical Virology (англ.)русск. : journal. — 2004. — Vol. 72, no. 1. — P. 149—155. — doi:10.1002/jmv.10546. — PMID 14635024.
- ↑ Сага об антибиотиках. Научно-популярная лекция Алексея Водовозова на YouTube, начиная с 1:01:49
- ↑ Butz A.M., Fosarelli P., Dick J., Cusack T., Yolken R. Prevalence of rotavirus on high-risk fomites in day-care facilities (англ.) // Pediatrics (англ.)русск. : journal. — American Academy of Pediatrics (англ.)русск., 1993. — Vol. 92, no. 2. — P. 202—205. — PMID 8393172.
- ↑ Grimwood K., Lambert S.B. Rotavirus vaccines: opportunities and challenges (англ.) // Human Vaccines & Immunotherapeutics (англ.)русск.. — 2009. — February (vol. 5, no. 2). — P. 57—69. — doi:10.4161/hv.5.2.6924. — PMID 18838873.
- ↑ Rao V.C., Seidel K.M., Goyal S.M., Metcalf T.G., Melnick J.L. Isolation of enteroviruses from water, suspended solids, and sediments from Galveston Bay: survival of poliovirus and rotavirus adsorbed to sediments (англ.) // Applied and Environmental Microbiology (англ.)русск. : journal. — 1984. — 1 August (vol. 48, no. 2). — P. 404—409. — PMID 6091548.
- ↑ Greenberg H.B., Estes M.K. Rotaviruses: from pathogenesis to vaccination (неопр.) // Gastroenterology. — 2009. — May (т. 136, № 6). — С. 1939—1951. — doi:10.1053/j.gastro.2009.02.076. — PMID 19457420.
- ↑ Greenberg H.B., Clark H.F., Offit P.A. Rotavirus pathology and pathophysiology (неопр.) // Curr. Top. Microbiol. Immunol.. — 1994. — Т. 185. — С. 255—283. — PMID 8050281.
- ↑ Gregorini, L; Marco, J; Bernies, M; Cassagneau, B; Pomidossi, G; Anguissola, GB; Fajadet, J. The alpha-1 adrenergic blocking agent urapidil counteracts postrotational atherectomy "elastic recoil" where nitrates have failed (англ.) // American Journal of Cardiology (англ.)русск. : journal. — 1997. — 15 April (vol. 79, no. 8). — P. 1100—1103. — doi:10.1016/S0002-9149(97)00053-2. — PMID 9114772.
- ↑ Ouwehand A., Vesterlund S. Health aspects of probiotics (неопр.) // IDrugs. — 2003. — Т. 6, № 6. — С. 573—580. — PMID 12811680.
- ↑ Farnworth E.R. The evidence to support health claims for probiotics (англ.) // Journal of Nutrition (англ.)русск. : journal. — 2008. — June (vol. 138, no. 6). — P. 1250S—4S. — PMID 18492865.
- ↑ Velázquez F.R., Matson D.O., Calva J.J., Guerrero L., Morrow A.L., Carter-Campbell S., Glass R.I., Estes M.K., Pickering L.K., Ruiz-Palacios G.M. Rotavirus infections in infants as protection against subsequent infections (англ.) // The New England Journal of Medicine : journal. — 1996. — Vol. 335, no. 14. — P. 1022—1028. — doi:10.1056/NEJM199610033351404. — PMID 8793926.
- ↑ Arya S.C. Rotaviral infection and intestinal lactase level (неопр.) // J. Infect.Dis.. — 1984. — Т. 150, № 5. — С. 791. — doi:10.1093/infdis/150.5.791. — PMID 6436397.
- ↑ Angel J., Franco M. A., Greenberg H. B. Desk Encyclopedia of Human and Medical Virology (англ.) / Mahy WJ and Van Regenmortel MHV. — Boston: Academic Press, 2009. — P. 278. — ISBN 0-12-375147-0.
- ↑ Goode, Jamie; Chadwick, Derek. Gastroenteritis viruses (неопр.). — New York: Wiley, 2001. — С. 14. — ISBN 0-471-49663-4.
- ↑ Fischer T.K., Gentsch J.R. Rotavirus typing methods and algorithms (неопр.) // Reviews in Medical Virology. — 2004. — Т. 14, № 2. — С. 71—82. — doi:10.1002/rmv.411. — PMID 15027000.
- ↑ АТХ группа — A07B Адсорбирующие кишечные препараты (неопр.). Энциклопедия лекарств и товаров аптечного ассортимента. РЛС Патент. — Инструкция, применение и формула.
- ↑ The Treatment Of Diarrhoea: A manual for physicians and other senior health workers (англ.). World Health Organization (2005). Дата обращения 3 октября 2017.
- ↑ The American Gastroenterological Association. Probiotics: What They Are and What They Can Do for You Архивная копия от 11 июля 2012 на Wayback Machine (англ.). Перевод на русский: Пробиотики. Что это такое и что они могут дать?
- ↑ Ramig R.F. Systemic rotavirus infection (англ.) // Expert Review of Anti-infective Therapy (англ.)русск.. — 2007. — August (vol. 5, no. 4). — P. 591—612. — doi:10.1586/14787210.5.4.591. — PMID 17678424.
- ↑ Bernstein D.I. Rotavirus overview (англ.) // Pediatric Infectious Disease Journal (англ.)русск.. — 2009. — March (vol. 28, no. 3 Suppl). — P. S50—3. — doi:10.1097/INF.0b013e3181967bee. — PMID 19252423.
- ↑ 1 2 3 Jiang V., Jiang B., Tate J., Parashar U.D., Patel M.M. Performance of rotavirus vaccines in developed and developing countries (англ.) // Human Vaccines & Immunotherapeutics (англ.)русск. : journal. — 2010. — July (vol. 6, no. 7). — P. 532—542. — doi:10.4161/hv.6.7.11278. — PMID 20622508.
- ↑ O'Ryan M. Rotarix (RIX4414): an oral human rotavirus vaccine (неопр.) // Expert review of vaccines. — 2007. — Т. 6, № 1. — С. 11—9. — doi:10.1586/14760584.6.1.11. — PMID 17280473.
- ↑ Matson D.O. The pentavalent rotavirus vaccine, RotaTeq (неопр.) // Seminars in paediatric infectious diseases. — 2006. — Т. 17, № 4. — С. 195—199. — doi:10.1053/j.spid.2006.08.005. — PMID 17055370.
- ↑ Widdowson M.A., Steele D., Vojdani J., Wecker J., Parashar U. Global rotavirus surveillance: determining the need and measuring the impact of rotavirus vaccines (англ.) // The Journal of Infectious Diseases : journal. — 2009. — November (vol. 200, no. Suppl 1). — P. S1—8. — doi:10.1086/605061. — PMID 19817589.
- ↑ Tate J.E., Cortese M.M., Payne D.C., Curns A.T., Yen C., Esposito D.H., Cortes J.E., Lopman B.A., Patel M.M., Gentsch J.R., Parashar U.D. Uptake, impact, and effectiveness of rotavirus vaccination in the United States: review of the first 3 years of postlicensure data (англ.) // Pediatric Infectious Disease Journal (англ.)русск. : journal. — 2011. — January (vol. 30, no. 1 Suppl). — P. S56—60. — doi:10.1097/INF.0b013e3181fefdc0. — PMID 21183842.
- ↑ Waggie Z., Hawkridge A., Hussey G.D. Review of rotavirus studies in Africa: 1976–2006 (англ.) // The Journal of Infectious Diseases. — 2010. — September (vol. 202, no. Suppl). — P. S23—33. — doi:10.1086/653554. — PMID 20684708.
- ↑ Soares-Weiser K., Maclehose H., Bergman H., etal. Vaccines for preventing rotavirus diarrhoea: vaccines in use (англ.) // Cochrane Database of Systematic Reviews / Soares-Weiser, Karla. — 2012. — Vol. 11. — P. CD008521. — doi:10.1002/14651858.CD008521.pub3. — PMID 23152260.
- ↑ Ward R.L., Clark H.F., Offit P.A. Influence of potential protective mechanisms on the development of live rotavirus vaccines (англ.) // The Journal of Infectious Diseases : journal. — 2010. — September (vol. 202, no. Suppl). — P. S72—9. — doi:10.1086/653549. — PMID 20684721.
- ↑ Tate J.E., Patel M.M., Steele A.D., Gentsch J.R., Payne D.C., Cortese M.M., Nakagomi O., Cunliffe N.A., Jiang B., Neuzil K.M., de Oliveira L.H., Glass R.I., Parashar U.D. Global impact of rotavirus vaccines (англ.) // Expert Review of Vaccines (англ.)русск.. — 2010. — April (vol. 9, no. 4). — P. 395—407. — doi:10.1586/erv.10.17. — PMID 20370550.
- ↑ Giaquinto C., Dominiak-Felden G., Van Damme P., Myint T.T., Maldonado Y.A., Spoulou V., Mast T.C., Staat M.A. Summary of effectiveness and impact of rotavirus vaccination with the oral pentavalent rotavirus vaccine: a systematic review of the experience in industrialized countries (англ.) // Human Vaccines & Immunotherapeutics (англ.)русск. : journal. — 2011. — July (vol. 7, no. 7). — P. 734—748. — doi:10.4161/hv.7.7.15511. — PMID 21734466.
- ↑ Light J.S., Hodes H.L. Studies on epidemic diarrhea of the new-born: Isolation of a Filtrable Agent Causing Diarrhea in Calves (англ.) // Am. J. Public Health Nations Health : journal. — 1943. — Vol. 33, no. 12. — P. 1451—1454. — doi:10.2