Бактериофаг это что такое
Бактериофаги — Википедия
| Группа вирусов | |
|---|---|
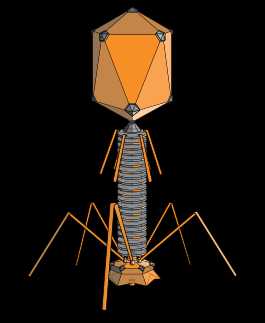 Структура типичного миовируса бактериофага. | |
| Бактериофаги | |
| не определён | |
| Домен Вирусы | |
| Все вирусы, поражающие бактерий | |
Бактериофа́ги, или фа́ги (от др.-греч. φᾰγω «пожираю») — вирусы, избирательно поражающие бактериальные клетки и клетки архей. Чаще всего бактериофаги размножаются внутри бактерий и поэтому вызывают их лизис. Как правило, бактериофаг состоит из белковой оболочки и генетического материала одноцепочечной или двуцепочечной нуклеиновой кислоты (ДНК или, реже, РНК). Общая численность бактериофагов в природе примерно равна общей численности бактерий (1030{\displaystyle 10^{30}} — 1032{\displaystyle 10^{32}} частиц) [1]. Бактериофаги активно участвуют в круговороте химических веществ и энергии, оказывают заметное влияние на эволюцию микробов и бактерий[1].
Английский бактериолог Фредерик Туорт в статье 1915 года описал инфекционную болезнь стафилококков, возбудитель которой проходил через фильтры, и его можно было переносить от одной колонии к другой.
Независимо от Фредерика Туорта французско-канадский микробиолог Феликс Д'Эрелль 3 сентября 1917 года сообщил об открытии бактериофагов.[2] Наряду с этим известно, что российский микробиолог Николай Фёдорович Гамалея ещё в 1897 году впервые наблюдал явление лизиса бактерий (сибиреязвенной палочки) под влиянием перевиваемого агента[3][4].
После открытия явлений бактериофагии Д’Эрелль развил учение о том, что бактериофаги патогенных бактерий, являясь их паразитами, играют большую роль в патогенезе инфекций, обеспечивая выздоровление больного организма, а затем создания специфического иммунитета. Это положение привлекло к явлению бактериофагии внимание многих исследователей, которые предполагали найти в фагах важное средство борьбы с наиболее опасными инфекционными болезнями человека и животных.
Также Феликс Д’Эрелль выдвинул предположение, что бактериофаги имеют корпускулярную природу. Однако только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представления о морфологии и основных особенностях фагов основывались на результатах изучения фагов группы Т — Т1, Т2,…, Т7, которые размножаются на Е. coli штамма B. Однако с каждым годом появлялись новые данные, касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации.
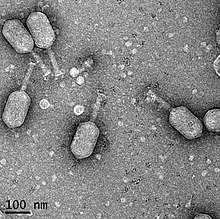 Бактериофаг ϕpp2 патогенных вибрионов V. parahaemolyticus
Бактериофаг ϕpp2 патогенных вибрионов V. parahaemolyticusи V. alginolyticus
Бактериофаги представляют собой наиболее многочисленную, широко распространённую в биосфере и, предположительно, наиболее эволюционно древнюю группу вирусов[5][6]. Приблизительный размер популяции фагов составляет более 1030 фаговых частиц[7].
В природных условиях фаги встречаются в тех местах, где есть чувствительные к ним бактерии. Чем богаче тот или иной субстрат (почва, выделения человека и животных, вода и т. д.) микроорганизмами, тем в большем количестве в нём встречаются соответствующие фаги. Так, фаги, лизирующие клетки всех видов почвенных микроорганизмов, находятся в почвах. Особенно богаты фагами чернозёмы и почвы, в которые вносились органические удобрения.
Бактериофаги выполняют важную роль в контроле численности микробных популяций, в автолизе стареющих клеток, в переносе бактериальных генов, выступая в качестве векторных «систем»[8].
Действительно, бактериофаги представляют собой один из основных подвижных генетических элементов. Посредством трансдукции они привносят в бактериальный геном новые гены. Было подсчитано, что за 1 секунду могут быть инфицированы 1024 бактерий[9]. Это означает, что постоянный перенос генетического материала распределяется между бактериями, обитающими в сходных условиях.
Высокий уровень специализации, долгосрочное существование, способность быстро репродуцироваться в соответствующем хозяине способствует их сохранению в динамичном балансе среди широкого разнообразия видов бактерий в любой природной экосистеме. Когда подходящий хозяин отсутствует, многие фаги могут сохранять способность к инфицированию на протяжении десятилетий, если не будут уничтожены экстремальными веществами либо условиями внешней среды[10].
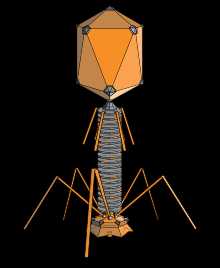
1 — головка, 2 — хвост, 3 — нуклеиновая кислота, 4 — капсид, 5 — «воротничок», 6 — белковый чехол хвоста, 7 — фибрилла хвоста, 8 — шипы, 9 — базальная пластинкаБактериофаги различаются по химической структуре, типу нуклеиновой кислоты, морфологии и характеру взаимодействия с бактериями. По размеру бактериальные вирусы в сотни и тысячи раз меньше микробных клеток.
Типичная фаговая частица (вирион) состоит из головки и хвоста. Длина хвоста обычно в 2—4 раза больше диаметра головки. В головке содержится генетический материал — одноцепочечная или двуцепочечная РНК или ДНК с ферментом транскриптазой в неактивном состоянии, окружённая белковой или липопротеиновой оболочкой — капсидом, сохраняющим геном вне клетки[11].
Нуклеиновая кислота и капсид вместе составляют нуклеокапсид. Бактериофаги могут иметь икосаэдральный капсид, собранный из множества копий одного или двух специфичных белков. Обычно углы состоят из пентамеров белка, а опора каждой стороны из гексамеров того же или сходного белка. Более того, фаги по форме могут быть сферические, лимоновидные или плеоморфные[12].
Хвост, или отросток, представляет собой белковую трубку — продолжение белковой оболочки головки, в основании хвоста имеется АТФаза, которая регенерирует энергию для инъекции генетического материала. Существуют также бактериофаги с коротким отростком, не имеющие отростка и нитевидные[13].
Головка округлой, гексагональной или палочковидной формы диаметром 45—140 нм. Отросток толщиной 10—40 и длиной 100—200 нм. Одни из бактериофагов округлы, другие нитевидны, размером 8×800 нм. Длина нити нуклеиновой кислоты во много раз превышает размер головки, в которой находится в скрученном состоянии, и достигает 60—70 мкм. Отросток имеет вид полой трубки, окружённой чехлом, содержащим сократительные белки, подобные мышечным. У ряда вирусов чехол способен сокращаться, обнажая часть стержня. На конце отростка у многих бактериофагов имеется базальная пластинка, от которой отходят тонкие длинные нити, способствующие прикреплению фага к бактерии. Общее количество белка в частице фага — 50-60%, нуклеиновых кислот — 40-50%.[14]
Фаги, как и все вирусы, являются абсолютными внутриклеточными паразитами. Хотя они содержат всю информацию для запуска собственной репродукции в соответствующем хозяине, у них нет механизмов для выработки энергии и рибосом для синтеза белка. Размер известных фаговых геномов варьирует от нескольких тысяч до 498 тысяч пар оснований (геном фага G, поражающего бацилл)[15][16].
Большое количество выделенных и изученных бактериофагов определяет необходимость их систематизации. Этим занимается Международный комитет по таксономии вирусов (ICTV). В настоящее время, согласно Международной классификации и номенклатуре вирусов, бактериофаги разделяют в зависимости от типа нуклеиновой кислоты и морфологии.
На данный момент выделяют девятнадцать семейств. Из них только два РНК-содержащих и только пять семейств имеют оболочку. Из семейств ДНК-содержащих вирусов только два семейства имеют одноцепочечные геномы. У девяти ДНК-содержащих семейств геном представлен кольцевой ДНК, а у других девяти — линейной. Девять семейств специфичны только для бактерий, остальные девять только для архей, а (Tectiviridae) инфицирует как бактерий, так и архей[17].
| Порядок | Семейство | Морфология | Нуклеиновая кислота | Пример |
|---|---|---|---|---|
| Caudovirales | Myoviridae | Без оболочки, сократительный хвост | Линейная дцДНК | Фаг Т4, фаг μ, PBSX, P1Puna-like, P2, I3, Bcep 1, Bcep 43, Bcep 78 |
| Siphoviridae | Без оболочки, несократительный хвост (длинный) | Линейная дцДНК | Фаг λ, фаг T5, C2, L5, HK97, N15 | |
| Podoviridae | Без оболочки, несократительный хвост (короткий) | Линейная дцДНК | Фаг T7, фаг T3, P22, P37 | |
| Ligamenvirales | Lipothrixviridae | В оболочке, палочкообразные | Линейная дцДНК | Acidianus filamentous virus 1—3, 6—9 |
| Rudiviridae | Без оболочки, палочкообразные | Линейная дцДНК | Sulfolobus islandicus rod-shaped virus 1, 2 | |
| Неизвестен | Ampullaviridae | В оболочке, бутылкообразные | Линейная дцДНК | |
| Bicaudaviridae | Без оболочки, лемонообразные | Кольцевая дцДНК | ||
| Clavaviridae | Без оболочки, палочкообразные | Кольцевая дцДНК | ||
| Corticoviridae | Без оболочки, изометрические | Кольцевая дцДНК | ||
| Cystoviridae | В оболочке, сферические | Сегментированная дцРНК | ||
| Fuselloviridae | Без оболочки, лемонообразные | Кольцевая дцДНК | ||
| Globuloviridae | В оболочке, изометрические | Линейная дцДНК | ||
| Guttaviridae | Без оболочки, яйцевидные | Кольцевая дцДНК | ||
| Inoviridae | Без оболочки, нитевидные | Кольцевая оцДНК | M13 | |
| Leviviridae | Без оболочки, изометрические | Линейная оцРНК | MS2, Qβ | |
| Microviridae | Без оболочки, изометрические | Кольцевая оцДНК | ΦX174 | |
| Plasmaviridae | В оболочке, плеоморфные | Кольцевая дцДНК | ||
| Tectiviridae | Без оболочки, изометрические | Линейная дцДНК |
Взаимодействие бактериофага с бактериальными клетками[править | править код]
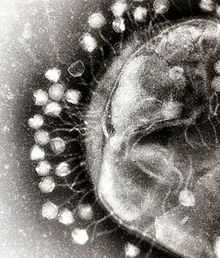 Адсорбция бактериофагов на поверхности бактериальной клетки
Адсорбция бактериофагов на поверхности бактериальной клетки По характеру взаимодействия бактериофага с бактериальной клеткой различают вирулентные и умеренные фаги[13]. Вирулентные фаги могут только увеличиваться в количестве посредством литического цикла[10]. Процесс взаимодействия вирулентного бактериофага с клеткой складывается из нескольких стадий: адсорбции бактериофага на клетке, проникновения в клетку, биосинтеза компонентов фага и их сборки, выхода бактериофагов из клетки[9][19].
Первоначально бактериофаги прикрепляются к фагоспецифическим рецепторам на поверхности бактериальной клетки. Хвост фага с помощью ферментов, находящихся на его конце (в основном лизоцима), локально растворяет оболочку клетки, сокращается и содержащаяся в головке ДНК инъецируется в клетку, при этом белковая оболочка бактериофага остаётся снаружи. Инъецированная ДНК вызывает полную перестройку метаболизма клетки: прекращается синтез бактериальной ДНК, РНК и белков. ДНК бактериофага начинает транскрибироваться с помощью собственного фермента транскриптазы, который после попадания в бактериальную клетку активируется. Синтезируются сначала ранние, а затем поздние иРНК, которые поступают на рибосомы клетки-хозяина, где синтезируются ранние (ДНК-полимеразы, нуклеазы) и поздние (белки капсида и хвостового отростка, ферменты лизоцим, АТФаза и транскриптаза) белки бактериофага. Репликация ДНК бактериофага происходит по полуконсервативному механизму и осуществляется с участием собственных ДНК-полимераз. После синтеза поздних белков и завершения репликации ДНК наступает заключительный процесс — созревание фаговых частиц или соединение фаговой ДНК с белком оболочки и образование зрелых инфекционных фаговых частиц[20].
Продолжительность этого процесса может составлять от нескольких минут до нескольких часов[10]. Затем происходит лизис клетки, и освобождаются новые зрелые бактериофаги[13]. Иногда фаг инициирует литический цикл, что приводит к лизису клетки и освобождению новых фагов. В качестве альтернативы фаг может инициировать лизогенный цикл, при котором он вместо репликации обратимо взаимодействует с генетической системой клетки-хозяина, интегрируясь в хромосому или сохраняясь в виде плазмиды[10]. Таким образом, вирусный геном реплицируется синхронно с ДНК хозяина и делением клетки, а подобное состояние фага называется профагом. Бактерия, содержащая профаг, становится лизогенной до тех пор, пока при определённых условиях или спонтанно профаг не будет стимулирован на осуществление лизирующего цикла репликации. Переход от лизогении к лизису называется лизогенной индукцией или индукцией профага. На индукцию фаг оказывает сильное воздействие состояние клетки хозяина предшествующее индукции, также как наличие питательных веществ и другие условия, имеющие место в момент индукции. Скудные условия для роста способствуют лизогенному пути, тогда как хорошие условия способствуют литической реакции[10][13][20].
Очень важным свойством бактериофагов является их специфичность: бактериофаги лизируют культуры определённого вида, более того, существуют так называемые типовые бактериофаги, лизирующие варианты внутри вида, хотя встречаются поливалентные бактериофаги, которые паразитируют в бактериях разных видов[21][22].
Умеренные и вирулентные бактериофаги на начальных этапах взаимодействия с бактериальной клеткой имеют одинаковый цикл.
- Адсорбция бактериофага на фагоспецифических рецепторах клетки.
- Инъекция фаговой нуклеиновой кислоты в клетку хозяина.
- Совместная репликация фаговой и бактериальной нуклеиновой кислоты.
- Деление клетки.
- Далее бактериофаг может развиваться по двум моделям: лизогенный либо литический путь.
- Умеренные бактериофаги после деления клетки находятся в состоянии профага (лизогенный путь).
- Вирулентные бактериофаги развиваются по литической модели:
- Нуклеиновая кислота фага направляет синтез ферментов фага, используя для этого белоксинтезирующий аппарат бактерии. Фаг тем или иным способом инактивирует ДНК и РНК хозяина, а ферменты фага совсем расщепляют её; РНК фага «подчиняет» себе клеточный аппарат синтеза белка.
- Нуклеиновая кислота фага реплицируется и направляет синтез новых белков оболочки. Образуются новые частицы фага в результате спонтанной самосборки белковой оболочки (капсид) вокруг фаговой нуклеиновой кислоты; под контролем РНК фага синтезируется лизоцим.
- Лизис клетки: клетка лопается под воздействием лизоцима; высвобождается около 200—1000 новых фагов; фаги инфицируют другие бактерии.
В медицине[править | править код]
Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие. В России зарегистрировано и применяется 13 медицинских препаратов на основе фагов[1]. В настоящее время их применяют для лечения бактериальных инфекций, которые не чувствительны к традиционному лечению антибиотиками, особенно в республике Грузия[23][24][25]. Обычно, применение бактериофагов сопровождается большим, чем антибиотики, успехом там, где присутствуют биологические мембраны, покрытые полисахаридами, через которые антибиотики обычно не проникают[26]. В настоящее время терапевтическое применение бактериофагов не получило одобрения на Западе, хотя и применяются фаги для уничтожения бактерий, вызывающих пищевые отравления, таких, как листерии[27].В России терапевтические фаговые препараты делают давно, фагами лечили ещё до антибиотиков. В последние годы фаги широко использовали после наводнений в Крымске[28] и Хабаровске, чтобы предотвратить дизентерию.
В биологии[править | править код]
Бактериофаги применяются в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция).
Фаговые векторы обычно создают на базе умеренного бактериофага λ, содержащего двухцепочечную линейную молекулу ДНК. Левое и правое плечи фага имеют все гены, необходимые для литического цикла (репликации, размножения). Средняя часть генома бактериофага λ (содержит гены, контролирующие лизогению, то есть его интеграцию в ДНК бактериальной клетки) не существенна для его размножения и составляет примерно 25 тысяч пар нуклеотидов. Данная часть может быть заменена на чужеродный фрагмент ДНК. Такие модифицированные фаги проходят литический цикл, но лизогения не происходит. Векторы на основе бактериофага λ используют для клонирования фрагментов ДНК эукариот (то есть более крупных генов) размером до 23 тысяч пар нуклеотидов (т. п. н.). Причём, фаги без вставок — менее 38 т. п. н. или, напротив, со слишком большими вставками — более 52 т. п. н. не развиваются и не поражают бактерии[29].
Бактериофаги M13, фаг Т4, T7 и фаг λ используют для изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий методом фагового дисплея.
Поскольку размножение бактериофага возможно только в живых клетках, бактериофаги могут быть использованы для определения жизнеспособности бактерий. Данное направление имеет большие перспективы, поскольку, одним из основных вопросов при разных биотехнологических процессах является определение жизнеспособности используемых культур. С помощью метода электрооптического анализа клеточных суспензий была показана возможность изучения этапов взаимодействия фаг-микробная клетка[30].
- ↑ 1 2 3 Сергей Головин Бактериофаги: убийцы в роли спасителей // Наука и жизнь. — 2017. — № 6. — С. 26-33
- ↑ Félix d'Hérelles. Sur un microbe invisible antagoniste des bacilles dysentériques (фр.) // Comptes rendus Acad Sci Paris. : magazine. — 1917. — Vol. 165. — P. 373—375. Архивировано 4 декабря 2010 года.
- ↑ Вирусы бактерий
- ↑ Бактериофаг (неопр.) (недоступная ссылка). Дата обращения 24 июня 2011. Архивировано 21 ноября 2013 года.
- ↑ Ackermann H.-W. // Res. Microbiol., 2003. — V. 154. — P. 245—251
- ↑ Hendrix R.W. // Theor. Popul. Biol., 2002. — V. 61. — P. 471—480
- ↑ Suttle C.A. (September 2005), Vuiruses in the sea. Nature 437:356-361.
- ↑ Шестаков С. В. Как происходит и чем лимитируется горизонтальный перенос генов у бактерий. Экологическая генетика 2007. — Т. 5. — № 2. — C. 12-24.
- ↑ 1 2 Tettelin H., Masignani V., Cieslewicz M. J., Donati C., Medini D., Ward N. L., Angiuoli S. V., Crabtree J., Jones A. L., Durkin A. S., Deboy R. T., Davidsen T. M., Mora M., Scarselli M., Margarit y Ros I., Peterson J. D., Hauser C. R., Sundaram J. P., Nelson W. C., Madupu R., Brinkac L. M., Dodson R. J., Rosovitz M. J., Sullivan S. A., Daugherty S. C., Haft D. H., Selengut J., Gwinn M. L., Zhou L., Zafar N., Khouri H., Radune D., Dimitrov G., Watkins K., O’Connor K. J., Smith S., Utterback T. R., White O., Rubens C. E., Grandi G., Madoff L. C., Kasper D. L., Telford J. L.,. Wessels M. R, Rappuoli R., Fraser C. M. Genome analysis of multiple pathogenic isolates of Streptococcus agalactiae: implications for the microbial «pan-genome.» Proc. Natl. Acad. Sci. USA 2005. 102: 13950-13955 (неопр.) (недоступная ссылка). Дата обращения 24 июня 2011. Архивировано 29 декабря 2010 года.
- ↑ 1 2 3 4 5 Guttman B., Raya R., Kutter E. Basic Phage Biology, in Bacteriophages: Biology and Applications, (Kutter E. and Sulakvelidze A., ed.), CRP Press, 2005 FL. — P. 29-66.
- ↑ Ковалёва Е. Н. Создание биопрепарата на основе выделенных и изученных бактериофагов Enterococcus faecalis: Дис. … канд. биол. наук. — Саратов, 2009. — 151 с.
- ↑ Ackermann H.-W. // Res. Microbiol., 2003. — V. 154. — P. 245—251.
- ↑ 1 2 3 4 Ожерельева Н. Г. Краткая Медицинская Энциклопедия, М.: изд-во «Советская Энциклопедия», 1989. — издание второе.
- ↑ Бактериофаги // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ Molecular Medical Microbiology / Yi-Wei Tang, Max Sussman, Dongyou Liu, Ian Poxton, Joseph Schwartzman. — 2 ed. — Academic Press, 2014. — Vol. 1. — P. 579. — 2216 p. — ISBN 9780123977632.
- ↑ Bacillus phage G, complete genome (неопр.). GenBank.
- ↑ Virus Taxonomy. Classification and Nomenclature of Viruses. Seventh Report of the International Committee on Taxonomy of Viruses / Edited by M. H. V. van Regenmontel et al. — San Diego: Academic Press, 2000. — P. 43—53, 64—129.
- ↑ Mc Grath S and van Sinderen D (editors). Bacteriophage: Genetics and Molecular Biology (англ.). — 1st. — Caister Academic Press (англ.)русск., 2007. — ISBN 978-1-904455-14-1.
- ↑ Raya R.R., Hébert E.M. Isolation of phage via induction of lysogens. Bacteriophages: Methods and Protocols, Volume 1: Isolation, Characterization, and Interaction (Martha R.J. Clokie, Andrew M. Kropinski (eds.), 2009. — V. 501. — P. 23-32.
- ↑ 1 2 Микробиология: учеб. пособие / В. В. Лысак. — Минск: БГУ, 2007. — 430 с.
- ↑ Адамс М. Бактериофаги / М. Адамс. — М.: Медгиз, 1961. — 521 с.
- ↑ Гольдфарб Д. М., Бактериофагия / Д. М. Гольдфарб. — М.: Медгиз, 1961. — 299 с.
- ↑ BBC Horizon: Phage - The Virus that Cures 1997-10-09
- ↑ Parfitt T. Georgia: an unlikely stronghold for bacteriophage therapy (англ.) // The Lancet : journal. — Elsevier, 2005. — Vol. 365, no. 9478. — P. 2166—2167. — doi:10.1016/S0140-6736(05)66759-1. — PMID 15986542.
- ↑ Thiel, Karl. Old dogma, new tricks—21st Century phage therapy (англ.) // Nature Biotechnology. — London UK: Nature Publishing Group, 2004. — January (vol. 22, no. 1). — P. 31—36. — doi:10.1038/nbt0104-31. — PMID 14704699.
- ↑ Aguita, Maria. Combatting Bacterial Infection, LabNews.co.uk. Архивировано 28 февраля 2009 года. Дата обращения 5 мая 2009.
- ↑ Pirisi A. Phage therapy—advantages over antibiotics? (англ.) // The Lancet. — Elsevier, 2000. — Vol. 356, no. 9239. — P. 1418. — doi:10.1016/S0140-6736(05)74059-9. — PMID 11052592.
- ↑ Все юные жители Крымска привиты от гепатита A | РИА ФедералПресс
- ↑ Щелкунов С. Н. Генетическая инженерия / С. Н. Щелкунов. — Новосибирск: Сиб. унив. изд-во, 2004. — 496 с.
- ↑ Guliy O.I., Bunin V.D., O’Neil D., Ivnitski D., Ignatov O.V. A new electro-optical approach to rapid assay of cell viability // Biosensors and Bioelectronics. 2007. V. 23. P. 583—587.
Бактериофаги. Все, что вы хотели о них знать
Дорогие друзья, здравствуйте!
Сегодня будем разбирать группу препаратов, которую никак нельзя назвать популярной, потому что о ней редко говорят, ее плохо знают, ее не любят назначать многие врачи...
Я говорю о бактериофагах.
Что такое бактериофаги? Как они работают?
Чем они отличаются от антибиотиков?
В каких случаях бактериофаг — это единственная соломинка?
Как и когда их чаще всего назначают?
О чем нужно помнить, продавая и используя бактериофаги?
О чем нужно предупредить покупателя?
Напомню, что этот блог создан специально для сотрудников аптек, поэтому в своих статьях я обращаюсь к ним.
Если Вы — не сотрудник аптеки:
Информация, которая дается в статьях блога, НЕ ПРЕДНАЗНАЧЕНА для самоназначения и самолечения!
Итак, поехали!
Что такое бактериофаги?
Точнее было бы сформулировать вопрос: «КТО такие бактериофаги?», поскольку это живые существа.
Какие ассоциации возникают у вас, когда вы слышите слово «вирус»?
Наверное, «ОРВИ», «грипп», «болезнь», «простуда», «микроорганизм».
В нашем понимании вирусы – это маленькие злобные создания, которым плохо, когда нам хорошо.
Они живут и размножаются в нашем теле, выделяя токсины и прочие гадости продукты своей жизнедеятельности, от которых повышается температура, пропадает аппетит, появляется слабость, начинает болеть голова и прочее.
С одними вирусами наша иммунная система расправляется за неделю, с другими нам приходится жить всю жизнь бок о бок и периодически терпеть их выходки, т.к. они поселяются в нас навсегда, Например, вирус простого герпеса.
Но в природе существуют не только человеческие вирусы. Есть вирусы, поражающие растения, животных, рыб, птиц, даже насекомых. Одним словом, у всего живого на Земле есть свои вирусы.
Есть они и у бактерий, чтобы регулировать их численность на нашей планете. Вот они-то и называются «бактериофагами», что в переводе означает «пожиратели бактерий».
Если бы не существовало бактериофагов, бактерии давно бы уже покрыли толстым слоем нашу землю-матушку и уничтожили бы все живое.
Итак, бактериофаги – это крошечные вирусы, которые могут жить и размножаться исключительно в бактериальной клетке, причем, только в клетке определенного вида.
Немного истории…
Бактериофаги были обнаружены 100 лет назад. Ученые начали их изучать, и заметили, что иногда фаготерапия дает отличные результаты, а иногда оказывается малоэффективной. Как выяснили позже, первые бактериофаги делали с грубыми нарушениями технологии производства и хранения.
С появлением антибиотиков бактериофаги отошли на второй план, но, тем не менее, они тоже использовались в годы Великой Отечественной войны для лечения ран и предотвращения эпидемий кишечных инфекций.
Откровенно говоря, нам в институте о них рассказывали очень мало и как-то невнятно. Во времена моей врачебной практики на различных конференциях и семинарах о бактериофагах, если и упоминалось, то вскользь. Поэтому мы их не назначали.
Сейчас интерес к ним проснулся. Это связано с тем, что резистентность к антибиотикам приобрела угрожающие масштабы. Даже на стадии разработки очередного антибиотика к нему уже появляются устойчивые штаммы. И часто бывает, что миллионы, потраченные на создание и разработку нового препарата, оказываются выброшенными на ветер. Такие средства даже не выходят на рынок.
Если к первым антибиотикам устойчивость развивалась за 20-30 лет, то сейчас – за 2-3 года.
С каждым новым поколением антибиотиков сокращается период, за который микробы вырабатывают против него защиту.
Кто в этом виноват?
- Врачи, которые необоснованно назначают антибиотик или ведут каналы на ютубе «для всех», где ради повышения своей популярности называют конкретные антибиотики при конкретных заболеваниях.
- Плачевное состояние нашей отечественной медицины с ее катастрофической нехваткой врачей и непродуманной организацией поликлинической помощи. Порой, легче попасть на прием к королеве Великобритании, чем к врачу. Поэтому люди вынуждены идти в интернет и назначать себе лечение самостоятельно, включая антибиотики.
- Интернет, где статьи в большинстве случаев написаны копирайтерами – людьми без медицинского образования, которые не понимают важности и серьезности того, о чем пишут.
- Сотрудники аптек, которые с легкостью рекомендуют антибиотики.
И не говорите мне, что такого нет!
Захожу на днях в группу для сотрудников аптек, и там один мужчина спрашивает, чем лечить уреаплазму (хотя «лечить» нужно не микроб, а заболевание).
Посмотрите, что пишут ваши коллеги:
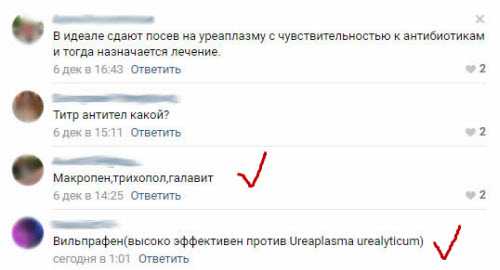
Друзья, это безумие!!!
При таком положении дел пройдет совсем немного времени, и у нас не останется антибиотиков, к которым чувствительны микробы. Смертность вырастет многократно!
Я призываю вас, нет, я УМОЛЯЮ вас: не рекомендуйте антибиотики!
А администраторов групп я призываю хоть иногда включать мозги и УДАЛЯТЬ подобную информацию. Она говорит о НЕПРОФЕССИОНАЛИЗМЕ фармацевтов и провизоров, поскольку они не знают принципов рациональной антибиотикотерапии.
Мы с вами работаем в самой хрупкой сфере человеческой жизни: в сфере здоровья. Давайте всегда помнить главную заповедь медицины «НЕ НАВРЕДИ!»
Как устроен бактериофаг?
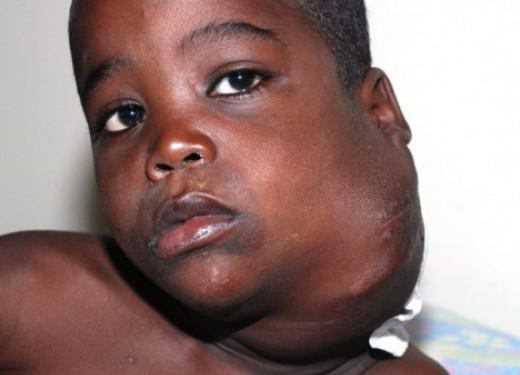
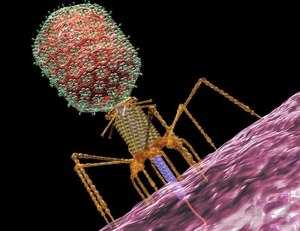
Выглядит бактериофаг, как инопланетянин: большая голова, худенькое тельце, которое специалисты называют «хвостом», и несколько ножек.
Самое главное место бактериофага – голова. Все как у нас. В ней покоится молекула ДНК (или РНК). Она не только хранит всю наследственную информацию о вирусе, но и содержит подробную «инструкцию», как ему расти и крепнуть.
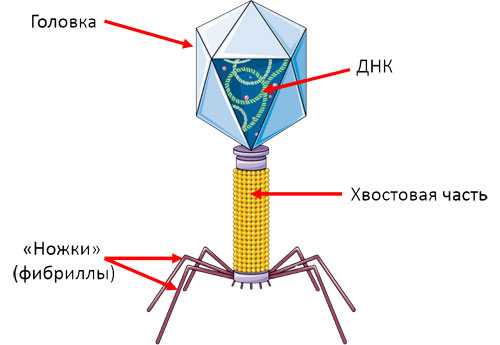
Бактериофаги устроены настолько просто, что даже самостоятельно не умеют размножаться. Для этого им нужна бактериальная клетка.
Как действует бактериофаг?
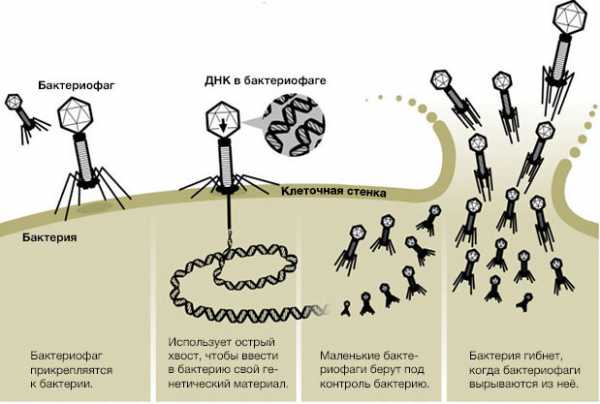
На поверхности бактерии естьсигнальные белки (рецепторы). У разных бактерий и даже штаммов бактерий эти белки разные. Каждый фаг может заметить один-единственный тип сигнального белка. Значит, он способен поразить только определенный штамм бактерий.
Бактериофаг прикрепляется к бактериальной клетке с помощью посадочных ножек и подобно шприцу впрыскивает в нее ДНК из своей головки.
С этого момента бактерия исчезает как личность.
Она перестает питаться, делиться, творить свои темные дела.
Она становится рабыней Изаурой фабрикой по производству маленьких симпатичных вирусят (юных бактериофагов) и с помощью своих ресурсов начинает синтезировать все необходимое для сборки новых вирусных частиц.
В конце концов, их становится так много, а ресурсов у бактерии так мало, что она разрывается, подобно новогодней хлопушке, и новорожденные фаги выходят на свободу на поиск новых жертв.
Посмотрите:
ВАЖНО:
Если бактериофаг не находит свои сигнальные белки, он не будет нападать на бактерию. Он строго специфичен.
Отсюда следует вывод:
Бактериофаги значительно безопаснее антибиотиков, т.к. они действуют только на патогенные бактерии и не действуют на полезные, без которых организм начинает работать неправильно.
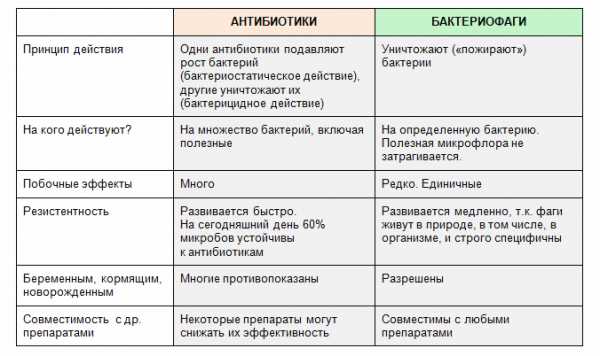
Отличия бактериофагов и антибиотиков
1. Фаг «бьет» точно в цель, как снайпер. Действие антибиотика – это «бомбежка» по местности, где есть свои и чужие.
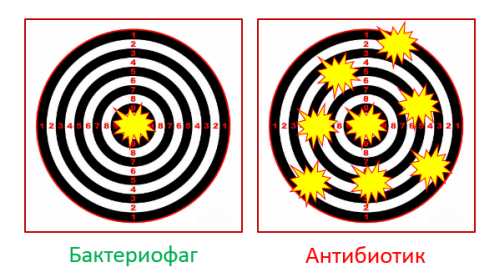
Поэтому антибиотики часто вызывают дисбиоз кишечника. Фаги – нет.
2. Антибиотики обязательно действуют и на другие органы.
Например, так любимый многими докторами Амоксиклав может привести к антибиотико-ассоциированному колиту, гепатиту, интерстициальному нефриту.
Цефалоспорины «сажают» печень, почки, могут вызвать изъязвления слизистой рта.
Сумамед тоже не лучшим образом действует на печень, почки, может давать побочные в виде сердцебиения, головокружения, головной боли, сонливости.
Отличия антибиотиков от бактериофагов я собрала в этой таблице:
Когда назначаются или могут назначаться бактериофаги?
1. При резистентности возбудителя ко всем антибиотикам.
2. При внутрибольничных инфекциях. Это инфекции, возникающие в условиях стационара. Микробы, вызывающие их, за время проживания в больничных покоях выработали устойчивость к большинству антибиотиков. Тысячи больных ежегодно умирают от заболеваний, которые по всем медицинским канонам прекрасно лечатся.
3. При наличии противопоказаний к большинству антибиотиков.
4. При аллергии на все антибиотики.
А также…
1. Беременным, кормящим, новорожденным.
2. При нетяжелых инфекциях, когда можно обойтись без антибиотика, но нельзя без антибактериальной терапии.
3. Пожилым людям с букетом хронических заболеваний.
4. Вместе с антибиотиком, чтобы уменьшить его дозу или повысить его эффективность, поскольку бактериофаг будет действовать и на бактерии, устойчивые к этому антибиотику.
Аргументы в пользу антибиотика
1. Широкий спектр действия. Необязательно знать возбудителя.
2. Не нужны специальные условия хранения и транспортировки.
3. Можно подобрать антибиотик, чтобы курс лечения был недорогим.
Прочитав все, что я написала выше, у вас должен был появиться вопрос:
«Так почему же врачи так редко назначают фаги и травят народ антибиотиками?»
Причины ограниченного использования бактериофагов
Я вижу причины в следующем:
Первое. Незнание, непонимание этой группы средств.
Второе. Чтобы назначить бактериофаг, нужно сделать посев на флору (кала, мочи, мазка из горла, носа и пр.) и чувствительность к бактериофагам, дабы подобрать оптимальный.
Во-первых, этот анализ недешевый, во-вторых, результаты будут готовы через 4-7 дней. В ряде ситуаций оставлять больного на это время без антибактериальной терапии нельзя.
Третье. Нет четких методических рекомендаций для использования бактериофагов при конкретных заболеваниях: куда, как и сколько? Поэтому назначения врачей часто носят эмпирический характер.
Допустим, врач назначил капать Секстафаг в нос по 2 капли 3 раза в день. Результат его не устроил, и он увеличил дозу, к примеру, до 4 капель 3 раза в день. Но самое приятное в работе с фагами — это то, что навредить больному увеличением дозы сложно.
Четвертое. Лечение фагами, как правило, не входит в клинические рекомендации Минздрава по лечению различных заболеваний, потому что клинических исследований, доказавших эффективность бактериофагов, недостаточно. И потому что десятки лет привыкли пользоваться антибиотиками.
Пятое. Длительный курс лечения фагами: 1-2-3 недели, при необходимости больше.
Шестое. Проще выписать антибиотик, чем назначать посев, подбирать дозу фага, расписывать и объяснять, как его использовать.
Седьмое. Курс лечения бактериофагом обходится в кругленькую сумму. Для многих это не по карману.
Какие болезни лечат с помощью фагов?
- Бактериальные инфекции ЛОР-органов: ангина, фарингит, ларингит, ринит, синусит.
- Бактериальные инфекции органов дыхания: трахеит, бронхит, пневмония, плеврит.
- Хирургические инфекции: нагноение ран, ожог, абсцесс, флегмона, трофическая язва, пролежни, фурункул, карбункул, панариций, парапроктит, мастит, остеомиелит и пр.
- Инфекции мочеполовой системы: уретрит, цистит, пиелонефрит, вагинит (кольпит), эндометрит, аднексит и пр.
- Кишечные инфекции.
- Дисбиоз кишечника.
- Инфекционные заболевания глаз (конъюнктивиты, гнойные язвы роговицы и пр.).
- Гнойно-воспалительные заболевания новорожденных: омфалит (воспаление пупочной ранки), пиодермия (гнойнички по телу), конъюнктивит, сепсис и пр.
Кто производит бактериофаги в нашей стране?
Бактериофаги, зарегистрированные в РФ как лекарственные препараты, выпускаются только одним предприятием: научно-производственным объединением Микроген. Его филиалы есть в трех городах: Нижний Новгород, Уфа, Пермь.
Виды бактериофагов
Бактериофаги бывают двух видов:
1. Против разных штаммов одного возбудителя: стафилококковый, стрептококковый, дизентерийный и пр.
2. Против двух и более возбудителей: Секстафаг, Интести-бактериофаг, Пиобактериофаг и пр.
Немного поясню.
В идеале при каждом заболевании нужно выявить возбудителя и определить его чувствительность к бактериофагам.
На практике случается, что ждать времени нет. Поэтому создаются «коктейли» бактериофагов, которые действуют на разные виды бактерий или на различные штаммы одной бактерии.
Это и есть «поливалентные» бактериофаги: Секстафаг, Пиобактериофаг, Бактериофаг клебсиелл поливалентный и пр.
В таком «коктейле» разные бактериофаги чувствуют себя прекрасно, не воюют и не мешают друг другу расправляться со своими бактериями.
На сегодняшний день бактериофагов не так уж и много:
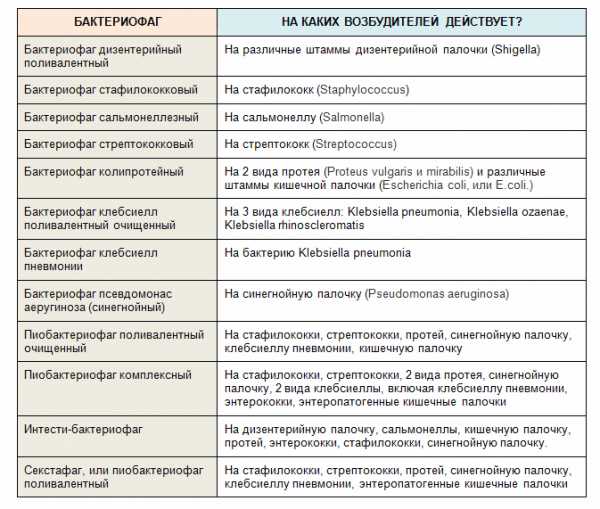
Когда я начала разбираться с этой темой, я написала в «Микроген», наивно полагая, что они ответят на мои вопросы, которых накопилось немало.
Например:
- Почему одни бактериофаги называются поливалентными, а другие комплексными? В чем их разница?
- Почему в названии «Интести-бактериофаг» отсутствует слово «поливалентный», хотя он действует на несколько бактерий?
- Почему в названии одних присутствует слово «очищенный», а в других его нет?
- Чем отличаются Пиобактерифаг поливалентный от Секстафага, если они действуют на одни и те же бактерии?
Но мне ничего не ответили. Может, они испугались, что за одними моими вопросами последуют другие, и они не смогут на них ответить? Я же копаю глубоко.
Более того, я заметила, что после моего письма к ним с сайта исчезла информация о нескольких бактериофагах. Например, о Бактериофаге клебсиелл пневмонии.
Что это значит?
Значит ли это, что он перестал производиться, и его можно заменить на Бактериофаг клебсиелл поливалентный, Пиобактериофаг или Секстафаг, которые тоже действуют на этого возбудителя?
Ну, да Бог с ними.
Вернемся к таблице.
Какой вывод можно отсюда сделать?
Для воздействия на один и тот же возбудитель подойдет несколько бактериофагов.
Недавно в нашей группе вконтакте был вопрос о том, можно ли заменить Бактерифаг клебсиелл пневмонии на Бактериофаг клебсиелл поливалентный очищенный?
По идее можно. Особенно, если у больного не брали анализ на чувствительность к бактериофагу, а просто высеяли возбудителя Klebsiella pneumonia.
Но учитывая, что этот бактериофаг назначил врач, несинонимичную замену делать нельзя.
Что собой представляет препарат бактериофаг?
Это прозрачный раствор желтого цвета, который в зависимости от вида фага и заболевания назначают внутрь, ректально в виде клизм, местно в виде промываний, закапываний, примочек, полосканий, смоченных турунд, введения в плевральную, суставную полость, полость мочевого пузыря, матки, во влагалище.

При необходимости фаги используют в небулайзерах, только не ультразвуковых.
Среди бактериофагов есть особенно популярные. Это Стафилококковый бактериофаг, Пиобактериофаг, Секстафаг.
Секстафаг, к примеру, часто назначают при гайморите, длительных зеленых соплях, ларингите, тонзиллите, гнойном конъюнктивите, отсутствии стула у новорожденного, вздутии живота (если высеваются чувствительные к фагу микробы, например, стафилококк).
Примеры использования бактериофага при различных заболеваниях
Как обычно назначают Секстафаг, или Пиобактериофаг поливалентный?
В нос, в ухо при гнойном отите, в глаза: по 2-3 капли 2-4 раза в день неразведенными. Предварительно согреть в руке!
При прозрачных выделениях из носа на фоне ОРВИ бактериофаги неэффективны, т.к. у них нет точки приложения.
А вот при бактериальном рините, когда сопли становятся «цветными» — он будет кстати.
В ухо второй способ: смачивают ватную турунду – и на час.
Полоскание горла: по 10-20 мл на один раз. Бактериофаг набрали шприцем, подержали его в руке – согрели, вылили в стаканчик, чтобы удобнее было взять в рот. И так 2-3 раза в день. Разводить не надо.
Ингаляции через небулайзер, только не ультразвуковой: при ларингитах, бронхитах, пневмониях – по 5 мл в неразведенном виде 1 раз в день. Раствор стерильный, и при правильном использовании стерильность не нарушается.
При гайморите дополнительно врач промывает бактериофагом придаточную пазуху.
Внутрь: в зависимости от возраста по 5-30 мл 3 раза в день за час до еды (в инструкции есть таблица по возрастам). Для маленьких детей можно развести в воде, хотя на вкус бактериофаг не противный. Бывает, что ребенка от вкусного сиропа рвет, а бактериофаг он пьет прекрасно.
При кишечных инфекциях один пероральный прием врач может заменить введением препарата через «высокую» клизму с помощью газоотводной трубки или катетера: 10-50 мл на один раз в зависимости от возраста.
При циститах принимают внутрь. При хронических циститах бактериофаг может вводиться врачом непосредственно в мочевой пузырь.
При стоматитах, пародонтитах – 10-20 мл бактериофага взять в рот и полоскать. И так 3-4 раза в день.
При трофических язвах, пролежнях, гнойных ранах чаще используют Пиобактериофаг, Секстафаг или Стафилококковый бактериофаг– в случае чувствительности возбудителя. Смачивают марлевую салфетку раствором, накладывают на рану и фиксируют. Перевязки проводят ежедневно или 2 раза в день.
Интести-бактериофагприменяется для лечения различных кишечных инфекций: дизентерия, сальмонеллез, энтероколит, колит, или для коррекции нарушений кишечной микрофлоры. Хотя в последнем случае врач может назначить и Стафилококковый бактериофаг, и Пиобактериофаг, и Секстафаг – опять же в зависимости от возбудителя и его чувствительности к фагу.
Его применяют внутрь в возрастных дозировках (они указаны в инструкции) за 30 минут до еды или в виде клизмы (если у больного рвота на любое средство, принимаемое через рот).
Либо врач назначит 2 раза принимать его внутрь и 1 раз в виде «высокой» клизмы с помощью газоотводки или катетера.
Как правильно использовать бактериофаг?
Фаги – ребята нежные. Любят температуру 2-8 градусов, поэтому должны храниться в холодильнике.
На сегодняшний день они выпускаются в виде раствора во флаконах по 100 мл и во флаконах объемом 20 мл по 4 штуки в упаковке.
Чтобы набрать из флакона необходимое количество фага, нужно вскрыть центральную часть колпачка. Под ним – резиновая пробка.

Обработать ее спиртом и ввести туда иглу одноразового шприца объемом 5-10 мл (объем шприца зависит от разовой дозы).
Набрать нужное количество фага, отсоединить шприц от иглы, подержать его в руке, чтобы согреть.
Далее поместить в чистую емкость и принять внутрь. Или взять нужное количество пипеткой. Или смочить фагом марлевую салфетку. Или взять в рот, чтобы прополоскать горло.
Игла в резиновой пробке остается, пока этот флакон не опустеет.
Для другого флакона берут другой шприц.
Флакон с воткнутой в него иглой хранят в холодильнике.
Впрочем, если бактериофаг назначен для приема внутрь и в клизме, можно не заморачиваться со шприцем, открыть его, взять нужно количество, закрыть резиновой пробкой и поместить в холодильник. Резиновую пробку не класть внутренней стороной на стол и не оставлять флакон открытым.
Перед открытием флакона его нужно встряхнуть и посмотреть, не помутнел ли раствор. Он должен быть прозрачным.
Прозрачный раствор можно использовать в течение всего срока годности.
Ответы на самые частые вопросы
Можно ли передозировать бактериофаг?
Случаи передозировки не описаны. В организме фаг направляется в очаг инфекции, где есть его жертва. Он размножается до тех пор, пока есть ЕГО бактерии. После этого он выводится из организма естественным путем.
Развивается ли устойчивость к фагам?
Как утверждают специалисты НПО «Микроген», устойчивость к ним не развивается. Прежде всего потому, что они сами постоянно эволюционируют. Но в интернете можно найти публикации, где это утверждение оспаривается.
Как часто можно принимать Бактериофаги?
Так часто, как это требуется.
Можно ли принимать фаг совместно с другими препаратами?
Бактериофаги совместимы с любыми препаратами.
Бывают ли побочные эффекты от фагов?
Крайне редко. В составе бактериофага есть консервант, может быть индивидуальная непереносимость его.
Можно ли использовать Бактериофаг без анализа на чувствительность к нему возбудителя?
Можно, если денег не жалко. Этот возбудитель может быть нечувствителен к фагу. Каждая бактерия имеет несколько штаммов (разновидностей), один штамм может быть чувствителен к фагу, а другой нет.
Можно ли рекомендовать бактериофаги покупателям?
Теоретически поливалентные фаги (Секстафаг, Пиобактериофаг) рекомендовать можно, тем более, что эти средства — безрецептурные. Но практически фаг может оказаться неэффективным, если возбудитель к нему нечувствителен.
К кому придут с претензиями?
Правильно! К Вам.
Так что, пусть лучше ответственность за назначение фага берет на себя врач.
Почему фаг может оказаться неэффективным?
1. Не сделан анализ на флору и чувствительность к бактериофагу.
2. Неадекватная дозировка. Или врач выбрал не лучший в данной конкретной ситуации способ введения бактериофага.
3. Не долечились. Средний курс лечения фагом: 7-14 дней. При необходимости врач может его продлить.
4. Были нарушены условия хранения и использования.
5. Некоторые микроорганизмы способны образовывать в органах биопленки. Это конгломераты бактерий, куда не могут проникнуть ни фаги, ни антибиотики.
Как правильно перевозить фаги?
Производитель пишет, что допускается транспортировка при температуре от 9 до 25 градусов не более 1 месяца.
Что такое Отофаг, Фагодент, Фагодерм, Фагогин?
Это косметические гели с бактериофагами для гигиены и нормализации микрофлоры уха, полости рта, интимной сферы, кожи и мягких тканей. Их производит не НПО «Микроген», а другая компания.
Что лучше: использовать фаг вместе с антибиотиком или отдельно?
В каждой конкретной ситуации это решает врач. Мое мнение: если их использовать вместе, все равно это не убережет от негативных последствий применения антибиотика. Поэтому если можно обойтись без антибиотика, лучше использовать один бактериофаг.
Советы по продаже бактериофага
1. Посчитайте вместе с покупателем количество упаковок бактериофага на курс.
2. Для начала отпустите количество упаковок на 1-2 дня, чтобы посмотреть индивидуальную переносимость. Скажите покупателю, чтобы в случае хорошей переносимости он пришел за остальными упаковками, иначе деньги окажутся потраченными зря, и лечение будет неэффективным.
3. Не забудьте предложить разовые шприцы на 5 или 10 мл для забора из флакона нужного количества фага и спирт (салициловый, левомицетиновый, борный) – чтобы протирать резиновую пробку флакона.
4. Предупредите, чтобы хранили бактериофаг в холодильнике.
5. Перед применением, особенно, в виде капель или полоскания, шприц с набранным фагом нужно подержать несколько минут в руке.
6. Скажите, что при помутнении раствора, появлении каких-то включений его использовать нельзя.
На этом у меня все. Надеюсь, что статья была для вас полезной.
Напоминаю, что у нас вконтакте есть группа. Она предназначена ТОЛЬКО для сотрудников аптек. Если Вы — сотрудник аптеки, присоединяйтесь!
Все мои книги для сотрудников аптек собраны здесь.
До новой встречи на блоге «Аптека для Человека»!
С любовью к вам, Марина Кузнецова
Применение бактериофагов
Инфекционные заболевания были бичом человечества до того момента, как начали появляться антибактериальные препараты. Обычно новую эру связывают с именем Флеминга и пенициллином. Однако на десять лет раньше было сделано открытие, которое, возможно, еще пригодится всем нам в будущем.
Убить убийцу
Говорят, война — это всегда огромный скачок в развитии хирургии. На самом деле не только: военные действия нередко способствовали продвижению онкотерапии и терапии инфекционных болезней.
Читайте также:
Медицина в годы ВОВ
Во время 1-й мировой войны канадский врач Феликс Д’Эррель изучал вспышку дизентерии среди солдат-французов. Это неприятное кишечное заболевание вызывается бактериями рода Shigellа, которых легко можно выделить из стула больных.
Врач заинтересовался случаем одного солдата, который полностью выздоровел, причем раньше, чем появилось улучшение у других, кого начали лечить одновременно с ним. Взяв у него пробы стула, Д’Эррель не обнаружил бактерий — что-то загадочное убило их.
Исследователь отфильтровал свой «материал», пропустив его через фильтр с настолько мелкими порами, что через них не могла бы пройти ни одна бактерия или какие-нибудь частицы испражнений. В полученный раствор врач добавил готовую культуру бактерий, взятых от другого больного, высадил все это в чашку Петри и стал ждать.
Читайте также:
Профилактика и лечение острых кишечных инфекций
Через некоторое время начался рост бактериальной культуры, однако колонии были разорванными — словно что-то неведомое разъедало их изнутри. Взяв мазки из «пустых» областей, Д’Эррель добавил их в «хорошие», здоровые колонии шигелл — и в них тоже образовались пустоты.
Практика, обогнавшая теорию

Поскольку к этому моменту наш соотечественник Дмитрий Ивановский уже открыл вирусы, Д’Эррель предположил, что невидимый глазу убийца бактерий относится именно к ним. Понимая важность своего открытия, исследователь дал вирусам, поражающим бактерии, отдельное имя — бактериофаги.
Увидеть фагов удалось только после изобретения электронного микроскопа, а выяснить, чтó именно происходит при их контакте с бактериями, — и того позже. Поэтому в течение многих лет идея Д’Эрреля отвергалась значительной частью ученых, которым было трудно представить себе вирус, поражающий бактерию, но не причиняющий вреда человеку. К тому же опыты канадца удавалось повторить не всем и не всегда.
Однако врач, не дожидаясь никаких теоретических подтверждений своего открытия, перешел к практике. Он не мог, имея в руках лекарство, видеть умирающих людей — и принялся лечить солдат фаговым раствором. Правда, сперва Д’Эррель убедился в его безвредности традиционным для таких энтузиастов способом: сперва пил бактериофаг, затем впрыскивал себе под кожу.
Естественное против искусственного

Выяснив, что для человека бактериофаг совершенно не опасен, Д’Эррель вылечил многих пациентов, что принесло ему известность. Его исследования даже стали основой для художественного романа «Эрроусмит», позднее экранизированного Голливудом. Фаговые лекарства успешно производились и применялись — но уже в 40-х годах энтузиазм начал угасать.
Причиной этого стало открытие Флемингом пенициллина и появление большого числа антибиотиков. Врачи настороженно относились к идее лечения людей с помощью вирусов, а тут у них появилась альтернатива. Антибиотики — химические вещества, полученные искусственно, — не были живыми и казались медикам более надежными. Фармацевтические компании уловили настроения врачебного сообщества и, прекратив выпуск фагов, принялись множить антибиотики.
Бактериофаги сегодня
В наше время, когда антибиотикорезистентность является глобальной и очень опасной проблемой, бактериофаги снова заинтересовали ученых.
У них есть свои недостатки — например, не просто узкий, а суперузкий спектр действия: каждый фаг «умеет» убивать только один штамм бактерий — даже не вид, а штамм. Из-за этого, кстати, и проваливались регулярно попытки повторить эксперименты Д‘Эрреля: дизентерия в двух разных частях армии, идентичная по симптомам и течению, могла быть вызвана разными «вариантами» шигелл.
Однако эту проблему сегодня может решить постепенное распространение такого диагностического метода, как полимеразная цепная реакция (ПЦР), которая точно определит штамм бактерии.
Бактериофаги не могут проникать через стенку клетки, поэтому они пока бессильны против тех возбудителей, которые паразитируют внутриклеточно. «Пока» — потому что активные исследования в этом направлении, возможно, помогут фагам пробираться в самые потаенные места.

А вот среди плюсов бактериофагов с ходу можно выделить два: во-первых, они совершенно безвредны для человека, поскольку вообще никак не взаимодействуют с его организмом — только с бактериями.
И, во-вторых, бактерий они убивают не всех, а значит, не имеют традиционного недостатка применения антибиотиков — возникновения дисбиоза. Так что сегодня бактериофаги стали перспективной областью — и в каком-то смысле новой надеждой человечества.
Лидия Куликова
Фото depositphotos.com
Товар по теме: бактериофаг
Бактериофаги виды и назначение, список препаратов, применение бактериофагов в медицине, лечение комплексными бактериофагами, классификация и строение
Бактериофагами являются специфические вирусы, избирательно атакующие и поражающие микробы. Размножаясь внутри клетки, они разрушают бактерии. При этом патогенная микрофлора уничтожается, а полезная – сохраняется.
Использование этих вирусов было предложено еще в начале века для лечения инфекционных заболеваний. Однако интерес к ним во многих странах мира был утрачен после появления антибиотиков. Сегодня интерес к данным вирусам возвращается.
Вконтакте
Google+
Мой мир
Особенности строения и среда обитания
Что такое бактериофаги ? Это большая группа вирусов, размером в 100 раз меньше клеток бактерий. Структура фагов при многократном увеличении поражает многообразием.
Какие бывают бактериофаги
 Рассмотрим виды микробов и назначение, в зависимости от их типа.
Рассмотрим виды микробов и назначение, в зависимости от их типа.
Существует девятнадцать семейств вирусов, различающихся по типу нуклеиновой кислоты (ДНК или РНК), а также по форме и строению генома.
Бактериофаги в медицине классифицируются в соответствии со скоростью влияния на патогенной бактерии:
- Умеренные бактериофаги медленно и частично разрушают болезнетворные микроорганизмы, вызывая в них необратимые изменения, передающиеся следующему поколению микробов. Это так называемый лизогенный эффект.
- Вирулентные молекулы вируса, попав в клетки микроба, активно и быстро размножаются. Они приводят к гибели бактерии почти мгновенно (литический эффект).
- Умеренный вид микробов применяют как альтернативу для лечения бактериальных инфекций. Они имеют определенные преимущества:
- Удобная форма. Препарат производится для перорального приема как раствор или в виде таблетки.
В отличие от антибиотиков, бактериофаги не имеют побочных действий, они реже вызывают аллергическую реакцию, не имеют вторичных негативных эффектов.
Отсутствует резистентность микробов. Бактериям адаптироваться к вирусам сложнее, а при комплексном воздействии это почти невозможно.
Но есть и свои минусы:
- курс терапии более длительный;
- определенные трудности с выбором правильной группы препаратов;
- геном бактерии переносится от одного микроба к другому.
Виды бактериофагов
В медицине, с учетом специфичности описываемых вирусов, предпочитают применять комплексные и поливалентные бактериофаги, которые содержат несколько разновидностей этих микробов.
Список и описание бактериофагов:
- Дизфак, поливалентный дизентерийный. Он вызывает гибель шигелл Флекснера и Зонне.
- Брюшнотифозный убивает возбудителей брюшного тифа, сальмонелл.
- Клебсиеллезный поливалентный. Представляет собой комплексное средство, уничтожающее клебсиеллы пневмонии, озена, риносклеромы.
- Клебсиелл пневмонии, клебсифаг – отличный помощник в борьбе с урогенитальной, дыхательной, пищеварительной систем, хирургических инфекций, генерализованных септических патологий.
- Колипротеофаг, колипротейный. Предназначается для лечения пиелонефритов, циститов, колитов и других болезней, спровоцированных протеем и кишечными палочками.
- Колифаг, коли. Эффективно действует в терапии инфекций кожи и внутренних органов, спровоцированной энтеропатогенной кишечной палочкой Е. Coli.
- Протеофаг, протейный губительно действует на специфические протейные микробы вульгарис и мирабилис, являющиеся возбудителями гнойных воспалений патологий кишечника.
- Стрептококковы, стрептофаг быстро нейтрализует стафилококки, выделяемые при любых гнойных инфекциях.
- Синегнойный. Рекомендуется для терапии воспалений, который провоцирует синегнойная палочка. Лизирует бактерии псевдомонас аэругиноза.
- Комплексный пиобактериофаг. Является смесью фаголизатов стрептококков, энтерококков, стафилококков, псевдоманус аэругиноза, эшерихий коли, клебсиелл окситока и пневмонии.
- Сектафаг, поливалетный пиобактериофаг. Пагубно действует на эшерихии коли .
- Интенси. Комплексный препарат, лизирующий шигиллы, сальмонеллы, энерококки, стафилококки, псевдоманис протей и аэрунина.
Лечение бактериофагами
 Только врач после обследования и выявления инфекции должен назначать медикаменты. Самостоятельное их применение может быть неэффективным потому, что нельзя определить чувствительность к фагам без специального исследования.
Только врач после обследования и выявления инфекции должен назначать медикаменты. Самостоятельное их применение может быть неэффективным потому, что нельзя определить чувствительность к фагам без специального исследования.
Схема лечения разрабатывается индивидуально для каждого клиента. Чаще всего прибегают к медикаментам для терапии кишечного дисбактериоза. Курс лечения может составлять около пяти дней, но в некоторых случаях – до 15 дней. Повторяют курсы для большей эффективности 2-3 раза.
Пример курса терапии стафилококковой инфекции:
- ребенку до полугода – по 5 мл;
- от полугода до одного года – по 10 мл;
- ребенку от одного года до трех лет – 15 мл;
- от 3-х лет до 8-20 мл;
- ребенку после восьми лет – 30мл.;
- грудничкам дают фаги перорально, каплями в нос, в форме клизмы.
Препараты бактериофагов
 Бактериофаги размножаются внутри бактерий, этим убивая их. В то время как лекарства в процессе лечения расходуются и их количество уменьшается, то количество фагов может, наоборот, возрастать.
Бактериофаги размножаются внутри бактерий, этим убивая их. В то время как лекарства в процессе лечения расходуются и их количество уменьшается, то количество фагов может, наоборот, возрастать.
При исчезновении пищи фагов — вредных бактерий, исчезают и сами фаги.
Препараты бактериофагов применяют при лечении заболеваний у детей:
- ушные инфекции;
- инфекции мочеполовых органов;
- инфекции органов дыхания;
- хирургические инфекции;
- инфекции желудочно-кишечного тракта;
- инфекции глаз и др.
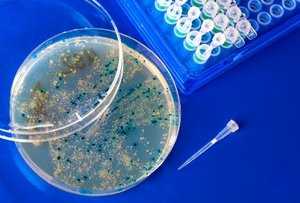
Чтобы вырастить бактериофаги, на питательную среду, которая засеяна определенной культурой бактерий, наносится материал с бактериофагами. В местах их попадания формируется зона разрушенных бактерий, представляющая собой пустое пятно. Данный материал бактериологичной иглой забирается. Его переносят в содержащую бактериальную молодую культуру, суспензию. Эти действия выполняют до 10 раз, чтобы полученная бактериофага была чистой.
Бактериофаги – альтернатива антибиотикам
На основе бактериофагов выпускают препараты в виде свечей, аэрозолей, таблеток, растворов и других форм. В названии медикаментов используют группу бактерий, для борьбы с которыми они предназначается .
Сравнение с антибиотиками
 В отличие от антибиотиков, все виды бактериофагов препаратов не влияют отрицательно на организм человека.
В отличие от антибиотиков, все виды бактериофагов препаратов не влияют отрицательно на организм человека.
Каждый вид избирательно влияет на микроорганизмы, поэтому они не только не вредят микрофлоре, но и применяются при лечении дисбактериоза. Однако эти лекарства используют гораздо реже, чем антибиотики по нескольким причинам:
- Бактериофаги не проникают в кровь. Их применяют только при наличии возможности легко доставить препарат к месту воздействия. Например, прополоскать горло, нанести непосредственно на рану, выпить при кишечной инфекции.
- Для применения бактериофагов важно быть уверенным в диагнозе. Исключением являются комбинированные препараты с бактериофагами против различных возбудителей. Эффективность этих препаратов меньше, а цена больше.
Вконтакте
Google+
Мой мир
Механизм действия бактериофагов, как это работает. Фагочувствительность
открытие пенициллина – первого антибиотика природного происхождения, воспринималось поначалу как шанс раз и навсегда победить инфекционные заболевания, уносившие миллионы жизней. Однако во второй половине прошлого века первоначальная эйфория пошла на убыль: выяснилось, что бактерии благодаря мутациям могут приобретать устойчивость к любому антибиотику и даже обмениваться между собой этими генами. Так началась «гонка вооружений» человека и бактерий.
Между препаратами бактериофагов и химическими антибиотиками существует принципиальное различие: антибиотик, в отличие от фагового препарата, убивает всё на своем пути, включая содружество полезных микроскопических обитателей организма.
Cовместная эволюция бактерий и фагов за последние 3 миллиарда лет привела к тому, что практически для любой болезнетворной бактерии имеется соответствующий вирус-«убийца».

В отличие от обычных антибиотиков, бактериофаги модифицируют свои генетические программы сами, что снимает проблему устойчивости. Результат – высокая избирательность: конкретный бактериофаг обычно эффективен в отношении лишь одного определенного бактериального вида или даже штамма бактерий.
Процесс уничтожения бактериальной клетки бактериофагом включает в себя несколько строго запрограммированных шагов.
Действие бактериофагов
Очень важным является то, что бактериофаги не трогают не «свои» бактерии, поэтому не вызывают гибель «хорошей» микрофлоры и, конечно, абсолютно безопасны для клеток высших организмов, включая человека.
При фаготерапии отсутствуют побочные эффекты, такие как аллергия, дисбактериоз, вторичные инфекции (например, грибковые), что нередко наблюдается при приеме антибиотиков. Бактериофаги могут применяться в комбинированной терапии с любыми лекарственными препаратами, включая антибиотики.

Препараты бактериофагов представляют собой раствор, используют их либо местно (например, на кожу или слизистые), либо принимают внутрь. В организме бактериофаги концентрируются в местах наибольшего поражения и размножаются до тех пор, пока находят бактерии-«мишени». После того, как бактерии-«мишени» закончились, фаги выводятся из организма.
Главная цель фаготерапии – остановить и повернуть вспять инфекционный процесс, чтобы дать иммунной системе организма возможность справиться с болезнью.
С помощью бактериофагов лечат:
В идеальном случае перед началом лечения у конкретного больного следует выделить болезнетворную бактерию в культуру и подобрать бактериофаг из «коллекции» уже известных бактериальных вирусов.
Препараты бактериофагов трудно поддаются стандартизации из-за специфики производства - даже опытный специалист не всегда может заранее предсказать эффективность того или иного препарата у конкретного пациента, так как разные бактериальные штаммы бактерий могут вызывать схожие проявления болезни. Выход – производство «коктейлей» из фагов, способных убивать разные штаммы и даже виды возбудителей. И такие препараты уже существуют: пиобактериофаги поливалентные или комплексные.
6 этапов работы бактериофагов
Условные обозначения
Адсорбция бактериофагов на бактериальных клетках
Специальные элементы фага, расположенные на поверхности в виде фибрилл или шипов связываются со специфичными поверхностными молекулами — рецепторами на своей жертве — бактерии. Пока бактериофаг достаточно плотно не закрепиться на поверхности бактерии следующей стадии не происходит т.к. существует специальная система блокировки.
Инъекция нуклеиновой кислоты бактериофага внутрь клетки
После плотного прикрепления фага (адсорбции) происходит внедрение генетического материала бактериофага в тело бактерии. Для этого в структуре фага природа предусмотрела наличие специальных структур, которые действуют по типу шприца. Именно за счет этого фаг как бы делает инъекцию, растворяет оболочку и…вводит свой генетический материал в бактерию. Для этого у фага есть агрессивный фермент для прокалывания бактерии.
Сборка фаговых частиц
Сборка молодых фагов происходит с упаковывания генетического материала в икосаэдрические белковые оболочки — далее к фагам присоединяется хвост, на головке фага появляются различные, необходимые для его жизнедеятельности белки. Количество молодых фагов внутри бактерии возрастает. Новое поколение готовится к выходу из бактериальной клетки.
Репликация копий нуклеиновой кислоты бактериофага
Когда ДНК фага попадает в бактерию она может раствориться ферментами бактерии. Однако фаг защищает свою ДНК специальными липкими белками, которые замыкают молекулу в кольцо, делая ее неуязвимой. Далее происходит тиражирование генетического материала (ДНК) фага прямо в клетке бактерии.
Синтез белковых и нуклеиновых частиц
После заражения бактерии начинается перестройка клеточного метаболизма под нужды фага: разрушаются некоторые клеточные белки. Далее происходит включение генетического материала фага в метаболизм бактерии и начинается сборка новых, молодых фагов.
Выход зрелых фагов и смерть бактерии
Финал жизненного цикла фага — клеточный лизис. Молодые фаги используют для разрушения бактериальной клетки набор ферментов расщепляющих оболочки бактерий (лизины) и белков, создающих поры во внутренней мембране бактерии и обеспечивающей ускорение действия фермента лизина.
Противопоказания
Только индивидуальная непереносимость.
С клинической точки зрения фаги достаточно безопасны, поскольку люди с рождения встречаться с ними. Фаги – это постоянные спутники организма, они были обнаружены в желудочно кишечном тракте, коже, моче, во рту, где они содержаться в слюне. Бактериофаги являются безопасной альтернативой антибиотикам.
Сравнение профилактического и терапевтического использования фагов и антибиотиков
Воздействие на бактерии
Фаги эффективно убивают чувствительные клетки бактерий (их действие бактерицидное).
Некоторые антибиотики (например, хлорамфеникол) бактериостатические; они скорее ингибируют рост бактерий, чем убивают клетки.
Селективность действия
Высокая селективность бактериофагов позволяет нацеливаться на специфичных патогенов, не затрагивая нормальную бактериальную флору (например, маловероятно, что фаги будут враждебны по отношению к нормофлоре пациентов).
Антибиотики атакуют не только бактерий – возбудителей заболеваний, но также все чувствительные микроорганизмы, включая нормальную – и часто полезную – микрофлору хозяина. Поэтому их неселективное действие нарушает микробный баланс в организме пациента, что может привести к различным побочным эффектам.
Побочные эффекты
Незначительные побочные эффекты при применении лечебных фагов (могут быть вызваны высвобождением эндотоксинов из бактерий, лизированных in vivo фагами).
Для антибиотиков характерно множество побочных эффектов, включая кишечные расстройства, аллергии и вторичные инфекции (например, грибковые инфекции).
Разработка новых препаратов
Естественная коэволюция бактерий и фагов может облегчить получение новых литических фагов против фагоустойчивых бактерий, появляющихся в результате действия других фагов или естественных изменений в бактериальных популяциях.
Создание новых антибиотиков (например, против антибиотикоустойчивых бактерий) требует временных затрат и может занять много лет.
Устойчивость бактерий к действию препарата
Из-за специфичности фагов маловероятно появление устойчивости у других бактериальных видов, не являющимися мишенями терапии.
Из-за широкого спектра активности антибиотики могут приводить к отбору устойчивых мутантов многих видов бактерий, а не только у штаммов мишени.
Применение препарата
Из-за специфичности фагов их успешное использование для предупреждения и лечения бактериальных инфекций требует идентификации этиологического агента и определения его фагочувствительности к препарату in vivo перед началом фагового лечения.
Эмпирически назначенные до идентификации этиологического агента антибиотики с большей вероятностью будут эффективны нежели фаговые препараты.
Бактериофаги - это... Что такое Бактериофаги?
 Структура типичного миовируса бактериофага.
Структура типичного миовируса бактериофага. Бактериофа́ги (фаги) (от др.-греч. φᾰγω — «пожираю») — вирусы, избирательно поражающие бактериальные клетки. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их лизис. Как правило, бактериофаг состоит из белковой оболочки и генетического материала одноцепочечной или двуцепочечной нуклеиновой кислоты (ДНК или, реже, РНК). Размер частиц приблизительно от 20 до 200 нм.
История
Английский бактериолог Туорт, Фредерик в статье 1915 года описал инфекционную болезнь стафилококков, инфицирующий агент проходил через фильтры, и его можно было переносить от одной колонии к другой.
Независимо от Фредерика Туорта французско-канадский микробиолог Д’Эрель, Феликс 3 сентября 1917 год сообщил об открытии бактериофагов. Наряду с этим известно, что российский микробиолог Николай Фёдорович Гамалея ещё в 1898 году, впервые наблюдал явление лизиса бактерий (сибиреязвенной палочки) под влиянием перевиваемого агента[1][2].
После открытия явлений бактериофагии Д’Эрелль развил учение о том, что бактериофаги патогенных бактерий, являясь их паразитами, играют большую роль в патогенезе инфекций, обеспечивая выздоровление больного организма, а затем создания специфического иммунитета. Это положение привлекло к явлению бактериофагии внимание многих исследователей, которые предполагали найти в фагах важное средство борьбы с наиболее опасными инфекционными болезнями человека и животных.
Также Феликс Д’Эрель выдвинул предположение, что бактериофаги имеют корпускулярную природу. Однако только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представления о морфологии и основных особенностях фагов основывались на результатах изучения фагов Т-группы — Т1, Т2,…, Т7, которые размножаются на Е. coli штамма B. Однако с каждым годом появлялись новые данные, касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации.
Роль бактериофагов в биосфере
Бактериофаги представляют собой наиболее многочисленную, широко распространенную в биосфере и, предположительно, наиболее эволюционно древнюю группу вирусов[3][4]. Приблизительный размер популяции фагов составляет более 1030 фаговых частиц[5].
В природных условиях фаги встречаются в тех местах, где есть чувствительные к ним бактерии. Чем богаче тот или иной субстрат (почва, выделения человека и животных, вода и т. д.) микроорганизмами, тем в большем количестве в нём встречаются соответствующие фаги. Так, фаги, лизирующие клетки всех видов почвенных микроорганизмов, находятся в почвах. Особенно богаты фагами черноземы и почвы, в которые вносились органические удобрения.
Бактериофаги выполняют важную роль в контроле численности микробных популяций, в автолизе стареющих клеток, в переносе бактериальных генов, выступая в качестве векторных «систем»[6].
Действительно, бактериофаги представляют собой один из основных подвижных генетических элементов. Посредством трансдукции они привносят в бактериальный геном новые гены. Было подсчитано, что за 1 секунду могут быть инфицированы 1024 бактерий[7]. Это означает, что постоянный перенос генетического материала распределяется между бактериями, обитающими в сходных условиях.
Высокий уровень специализации, долгосрочное существование, способность быстро репродуцироваться в соответствующем хозяине способствует их сохранению в динамичном балансе среди широкого разнообразия видов бактерий в любой природной экосистеме. Когда подходящий хозяин отсутствует, многие фаги могут сохранять способность к инфицированию на протяжении десятилетий, если не будут уничтожены экстремальными веществами либо условиями внешней среды[8].
Строение бактериофагов
1 — головка, 2 — хвост, 3 — нуклеиновая кислота, 4 — капсид, 5 — «воротничок», 6 — белковый чехол хвоста, 7 — фибрилла хвоста, 8 — шипы, 9 — базальная пластинкаБактериофаги различаются по химической структуре, типу нуклеиновой кислоты, морфологии и характеру взаимодействия с бактериями. По размеру бактериальные вирусы в сотни и тысячи раз меньше микробных клеток.
Типичная фаговая частица (вирион) состоит из головки и хвоста. Длина хвоста обычно в 2 — 4 раза больше диаметра головки. В головке содержится генетический материал — одноцепочечная или двуцепочечная РНК или ДНК с ферментом транскриптазой в неактивном состоянии, окруженная белковой или липопротеиновой оболочкой — капсидом, сохраняющим геном вне клетки[9].
Нуклеиновая кислота и капсид вместе составляют нуклеокапсид. Бактериофаги могут иметь икосаэдральный капсид, собранный из множества копий одного или двух специфичных белков. Обычно углы состоят из пентамеров белка, а опора каждой стороны из гексамеров того же или сходного белка. Более того, фаги по форме могут быть сферические, лимоновидные или плеоморфные[10]. Хвост представляет собой белковую трубку — продолжение белковой оболочки головки, в основании хвоста имеется АТФаза, которая регенерирует энергию для инъекции генетического материала. Существуют также бактериофаги с коротким отростком, не имеющие отростка и нитевидные[11].
Фаги, как и все вирусы, являются абсолютными внутриклеточными паразитами. Хотя они переносят всю информацию для запуска собственной репродукции в соответствующем хозяине, у них отсутствуют механизмы для выработки энергии и рибосомы для синтеза белка. У некоторых фагов в геноме содержится несколько тысяч оснований, тогда как фаг G, самый крупный из секвенированных фагов, содержит 480 000 пар оснований — вдвое больше среднего значения для бактерий, хотя всё же недостаточного количества генов для важнейшего бактериального органоида как рибосомы.
Систематика бактериофагов
Большое количество выделенных и изученных бактериофагов определяет необходимость их систематизации. Классификация вирусов бактерий претерпевала изменения: основывалась на характеристике хозяина вируса, учитывались серологические, морфологические свойства, а затем строение и физико-химический состав вириона[12].
В настоящее время согласно Международной классификации и номенклатуре вирусов бактериофаги, в зависимости от типа нуклеиновой кислоты разделяют на ДНК- и РНК- содержащие.
По морфологическим характеристикам ДНК-содержащие фаги выделены в следующие семейства: Myoviridae, Siphoviridae, Podoviridae, Lipothrixviridae, Plasmaviridae, Corticoviridae, Fuselloviridae, Tectiviridae, Microviridae, Inoviridae Plectovirus и Inoviridae Inovirus.
РНК-содержащие: Cystoviridae, Leviviridae[13].
Взаимодействие бактериофага с бактериальными клетками
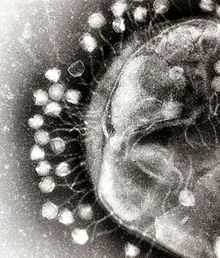 Адсорбция бактериофагов на поверхности бактериальной клетки
Адсорбция бактериофагов на поверхности бактериальной клетки По характеру взаимодействия бактериофага с бактериальной клеткой различают вирулентные и умеренные фаги[11]. Вирулентные фаги могут только увеличиваться в количестве посредством литического цикла[8]. Процесс взаимодействия вирулентного бактериофага с клеткой складывается из нескольких стадий: адсорбции бактериофага на клетке, проникновения в клетку, биосинтеза компонентов фага и их сборки, выхода бактериофагов из клетки[7][14].
Первоначально бактериофаги прикрепляются к фагоспецифическим рецепторам на поверхности бактериальной клетки. Хвост фага с помощью ферментов, находящихся на его конце (в основном лизоцима), локально растворяет оболочку клетки, сокращается и содержащаяся в головке ДНК инъецируется в клетку, при этом белковая оболочка бактериофага остается снаружи. Инъецированная ДНК вызывает полную перестройку метаболизма клетки: прекращается синтез бактериальной ДНК, РНК и белков. ДНК бактериофага начинает транскрибироваться с помощью собственного фермента транскриптазы, который после попадания в бактериальную клетку активируется. Синтезируются сначала ранние, а затем поздние иРНК, которые поступают на рибосомы клетки-хозяина, где синтезируются ранние (ДНК-полимеразы, нуклеазы) и поздние (белки капсида и хвостового отростка, ферменты лизоцим, АТФаза и транскриптаза) белки бактериофага. Репликация ДНК бактериофага происходит по полуконсервативному механизму и осуществляется с участием собственных ДНК-полимераз. После синтеза поздних белков и завершения репликации ДНК наступает заключительный процесс — созревание фаговых частиц или соединение фаговой ДНК с белком оболочки и образование зрелых инфекционных фаговых частиц[15].
Продолжительность этого процесса может составлять от нескольких минут до нескольких часов[8]. Затем происходит лизис клетки, и освобождаются новые зрелые бактериофаги[11]. Иногда фаг инициирует лизирующий цикл, что приводит к лизису клетки и освобождению новых фагов. В качестве альтернативы фаг может инициировать лизогенный цикл, при котором он вместо репликации обратимо взаимодействует с генетической системой клетки-хозяина, интегрируясь в хромосому или сохраняясь в виде плазмиды[8]. Таким образом, вирусный геном реплицируется синхронно с ДНК хозяина и делением клетки, а подобное состояние фага называется профагом. Бактерия, содержащая профаг, становится лизогенной до тех пор, пока при определенных условиях или спонтанно профаг не будет стимулирован на осуществление лизирующего цикла репликации. Переход от лизогении к лизису называется лизогенной индукцией или индукцией профага. На индукцию фага оказывает сильное воздействие состояние клетки хозяина предшествующее индукции, также как наличие питательных веществ и другие условия, имеющие место в момент индукции. Скудные условия для роста способствуют лизогенному пути, тогда как хорошие условия способствуют лизирующей реакции[8][11][15].
Очень важным свойством бактериофагов является их специфичность: бактериофаги лизируют культуры определенного вида, более того, существуют так называемые типовые бактериофаги, лизирующие варианты внутри вида, хотя встречаются поливалентные бактериофаги, которые паразитируют в бактериях разных видов[16][17].
Жизненный цикл
Умеренные и вирулентные бактериофаги на начальных этапах взаимодействия с бактериальной клеткой имеют одинаковый цикл.
- Адсорбция бактериофага на фагоспецифических рецепторах клетки.
- Инъекция фаговой нуклеиновой кислоты в клетку хозяина.
- Совместная репликация фаговой и бактериальной нуклеиновой кислоты.
- Деление клетки.
- Далее бактериофаг может развиваться по двум моделям: лизогенный либо литический путь.
- Умеренные бактериофаги после деления клетки находятся в состоянии профага (Лизогенный путь).
- Вирулентные бактериофаги развиваются по Литической модели:
- Нуклеиновая кислота фага направляет синтез ферментов фага, используя для этого белоксинтезирующий аппарат бактерии. Фаг тем или иным способом инактивирует ДНК и РНК хозяина, а ферменты фага совсем расщепляют её; РНК фага «подчиняет» себе клеточный аппарат синтеза белка.
- Нуклеиновая кислота фага реплицируется, и направляет синтез новых белков оболочки. Образуются новые частицы фага в результате спонтанной самосборки белковой оболочки (капсид) вокруг фаговой нуклеиновой кислоты; под контролем РНК фага синтезируется лизоцим.
- Лизис клетки: клетка лопается под воздействием лизоцима; высвобождается около 200—1000 новых фагов; фаги инфицируют другие бактерии.
Применение
В медицине
Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие.
Бактериофаги применяются также в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция).
Фаговые векторы обычно создают на базе умеренного бактериофага λ, содержащего двухцепочечную линейную молеклул ДНК. Левое и правое плечи фага имеют все гены, необходимые для литического цикла (репликации, размножения). Средняя часть генома бактериофага λ (содержит гены, контролирующие лизогению, то есть его интеграцию в ДНК бактериальной клетки) не существенна для его размножения и составляет примерно 25 тысяч пар нуклеотидов. Данная часть может быть заменена на чужеродный фрагмент ДНК. Такие модифицированные фаги проходят литический цикл, но лизогения не происходит. Векторы на основе бактериофага λ используют для клонирования фрагментов ДНК эукариот (то есть более крупных генов) размером до 23 т.п.н. Причем, фаги без вставок — менее 38 т.п.н или, напротив, со слишком большими вставками — более 52 т.п.н не развиваются и не поражают бактерии[18].
В биологии
Бактериофаги M13, фаг Т4, T7 и фаг λ используют для изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий методом фагового дисплея.
Поскольку размножение бактериофага возможно только в живых клетках бактериофаги могут быть использованы для определения жизнеспособности бактерий. Данное направление имеет большие перспективы, поскольку, одним из основных вопросов при разных биотехнологических процессах является определение жизнеспособности используемых культур. С помощью метода электрооптического анализа клеточных суспензий была показана возможность изучения этапов взаимодействия фаг-микробная клетка[19].
Ссылки
- ↑ Вирусы бактерий
- ↑ Бактериофаг
- ↑ Ackermann H.-W. // Res. Microbiol., 2003. — V. 154. — P. 245—251
- ↑ Hendrix R.W. // Theor. Popul. Biol., 2002. — V. 61. — P. 471—480
- ↑ Suttle C.A. (September 2005), Vuiruses in the sea. Nature 437:356-361.
- ↑ Шестаков С. В. Как происходит и чем лимитируется горизонтальный перенос генов у бактерий. Экологическая генетика 2007. — Т. 5. — № 2. — C. 12-24.
- ↑ 1 2 Tettelin H., Masignani V., Cieslewicz M. J., Donati C., Medini D., Ward N. L., Angiuoli S. V., Crabtree J., Jones A. L., Durkin A. S., Deboy R. T., Davidsen T. M., Mora M., Scarselli M., Margarit y Ros I., Peterson J. D., Hauser C. R., Sundaram J. P., Nelson W. C., Madupu R., Brinkac L. M., Dodson R. J., Rosovitz M. J., Sullivan S. A., Daugherty S. C., Haft D. H., Selengut J., Gwinn M. L., Zhou L., Zafar N., Khouri H., Radune D., Dimitrov G., Watkins K., O’Connor K. J., Smith S., Utterback T. R., White O., Rubens C. E., Grandi G., Madoff L. C., Kasper D. L., Telford J. L.,. Wessels M. R, Rappuoli R., Fraser C. M. Genome analysis of multiple pathogenic isolates of Streptococcus agalactiae: implications for the microbial «pan-genome.» Proc. Natl. Acad. Sci. USA 2005. 102: 13950-13955
- ↑ 1 2 3 4 5 Guttman B., Raya R., Kutter E. Basic Phage Biology, in Bacteriophages: Biology and Applications, (Kutter E. and Sulakvelidze A., ed.), CRP Press, 2005 FL. — Р.29-66.
- ↑ Ковалева Е. Н. Создание биопрепарата на основе выделенных и изученных бактериофагов Enterococcus faecalis: Дис. … канд. биол. наук. — Саратов, 2009. — 151 с
- ↑ Ackermann H.-W. // Res. Microbiol., 2003. — V. 154. — P. 245—251.
- ↑ 1 2 3 4 Ожерельева Н. Г. Краткая Медицинская Энциклопедия, М.: изд-во «Советская Энциклопедия», 1989. — издание второе.
- ↑ Русалеев В. С., Таксономия вирусов бактерий / В. С. Русалеев // Ветеринария. — 1990. — № 12. — C. 25-28.
- ↑ Virus Taxonomy. Classification and Nomenclature of Viruses. Seventh Report of the International Committee on Taxonomy of Viruses / Edited by M.H.V. van Regenmontel et al. — San Diego: Academic Press, 2000. — P. 43-53, 64-129.
- ↑ Raya R.R., Hébert E.M. Isolation of phage via induction of lysogens. Bacteriophages: Methods and Protocols, Volume 1: Isolation, Characterization, and Interaction (Martha R.J. Clokie, Andrew M. Kropinski (eds.), 2009. — V. 501. — P. 23-32.
- ↑ 1 2 Микробиология: учеб. пособие / В. В. Лысак. — Минск : БГУ, 2007. — 430 с.
- ↑ Адамс М., Бактериофаги / М. Адамс. — М.:Медгиз, 1961. — 521 с.
- ↑ Гольдфарб Д. М., Бактериофагия / Д. М. Гольдфарб. — М.: Медгиз, 1961. — 299 с.
- ↑ Щелкунов С. Н. Генетическая инженерия / С. Н. Щелкунов. — Новосибирск : Сиб. унив. изд-во, 2004. — 496 с.
- ↑ Guliy O.I., Bunin V.D., O’Neil D., Ivnitski D., Ignatov O.V. A new electro-optical approach to rapid assay of cell viability // Biosensors and Bioelectronics. 2007. V. 23. P. 583—587.
Бактериофаги – пожиратели бактерий. Является ли это концом эры антибиотиков? :: Инфониак
Вы задумывались, почему бактерии еще не захватили власть над природой и почему их количество в окружающей среде всегда приблизительно одинаковое? Что мешает им размножаться в водоемах и почве? Что защищает планету от избытка бактерий?
Ответы на эти вопросы получили еще в прошлом веке, когда наткнулись на род вирусов, которые заражают не человека или животных, а бактерии. Увидев под микроскопом, как под действием этих вирусов среда очищается от бактерий, французский ученый Феликс Д'Эрелль назвал эти микроорганизмы бактериофагами или "пожирателями бактерий".
© Science Photo Library
Бактериофаги были открыты на 20 лет раньше пенициллина, но, когда появился первый антибиотик, успешно убивающий сразу многие бактерии, о бактериофагах забыли, а исследование приостановили. С началом 21 века человечество встало перед серьезной проблемой – бактерии, вызывающие болезни, приобрели устойчивость к антибиотикам. И доктора, в поисках нового антибактериального средства, вспомнили о хорошо забытых бактериофагах – натуральных киллерах бактерий.
От Ганга до лаборатории
На след бактериофагов ученые вышли еще в 19 веке. В 1896 году английский бактериолог Эрнест Ханкин поехал в Индию, чтобы исследовать свойства воды в реке Ганг. Эта река у индусов священна. Местные жители верят в целебные свойства ее вод. Но там, как известно, царила полная антисанитария. Люди купались в реке, сбрасывали в нее трупы больных холерой, но, тем не менее, эпидемии кишечной инфекции не возникало. Что-то препятствовало размножению возбудителя холеры. Ханкин предположил, что вода индийских рек содержит неизвестную субстанцию, которая оказывает антибактериальный эффект и препятствует распространению бактерий. Этим, тогда еще неопознанным, лечащим объектом были именно бактериофаги! Оказалось, что, благодаря им, возбудитель холеры в реке Ганг гибнет за три часа, в то время как в обычном водоеме разрушение занимает почти двое суток.
Фаги широко распространены в природе и обитают не только в водоемах, но и в почве, в организме человека и животных. Словом, там, где есть бактерии, есть и их вирусы-пожиратели. В чистой природной воде на каждую бактерию приходится как минимум 10 фагов. Пока бактерий в среде мало, шансы на то, что фаг найдет "свою" бактерию, небольшие. Но когда обстоятельства позволяют возбудителям инфекции размножаться, рядом с бактериофагом появляется скопление бактерий, и "киллер и жертва" встречаются.
Бактериофаги как лекарство
"Враг моего врага – мой друг". Этой фразой можно описать принцип фаготерапии. Большинство ученых сходятся во мнении, что именно бактериофагам принадлежит будущее в борьбе с инфекциями. Их активное использование может помочь преодолеть устойчивость к антибиотикам, очистить организм и окружающую среду от многих возбудителей.
Даже если человечество в какой-то момент останется без эффективных антибиотиков, мы все еще сможем бороться с возбудителями с помощью натуральных "пожирателей бактерий". Главная особенность бактериофагов в том, что они атакуют только бактерии, не действуя на человеческие клетки.
Как действует бактериофаг?
Фаги используют бактериальную клетку для создания своего потомства, полностью порабощают бактерию, заставляя ее внутренние органы создавать частицы бактериофага. Такое взаимодействие называют абсолютным внутриклеточным паразитизмом.
Почти 96% бактериофагов внешне выглядят как сперматозоиды. У типичного "пожирателя бактерии" есть головка и хвост. Хвост состоит из основного стержня и жгутиков, напоминающих паучьи ножки. В головке содержится генетическая информация бактериофага и ферменты, а хвост предназначен для прикрепления к поверхности бактерий. Кроме классических "хвостатых" бактериофагов, есть и частицы, которые состоят только из головки без отростка или имеют форму палочки или нити, но без головки.
© ktsimage / Getty Images
Среди бактериофагов есть два вида – вирулентные и умеренные. Первые настроены радикально, они сразу уничтожают бактерию. Вторые заражают целое семейство бактерий, но убивают не всех.
Бактериофаг уничтожает бактерию следующим образом:
- Находит на бактерии нужный белок-мишень или рецептор и "садится" на него своим хвостом.
- С помощью шипов на хвосте он плотно прикрепляется к клеточной стенке.
- Далее вирус выделяет ферменты, растворяющие наружную оболочку бактерии, и высверливает в ее стенке отверстие.
- Через прокол бактериофаг впрыскивает свой геном в бактерию, но оболочка фага остается снаружи бактерии.
- Когда ДНК фага проникает в ядро бактерии, последняя теряет свою индивидуальность и перестает контролировать внутриклеточные процессы.
- Вирус полностью перестраивает обмен веществ внутри клетки и заставляет бактерию синтезировать белки будущих фагов.
- Из белковых молекул собираются новые бактериофаги. Когда их количество становится критичным, бактериальная клетка набухает, а ферменты вируса разрушают ее стенку изнутри. В результате клетка "взрывается", и новое поколение бактериофагов выходит наружу.
Весь цикл длится от нескольких минут до нескольких часов. В среднем бактериофаг воссоздает свое новое поколение за 20 – 40 минут. Это самая высокая скорость размножения, которой обладают живые организмы! За один цикл из одного фага образуется 100 – 300 новых "пожирателей", которые готовы атаковать остальные бактерии в очаге воспаления. Данный цикл бактериофага называют литическим, поскольку инфицированная бактерия подвергается лизису – разрушению.
Но есть еще один вид инфицирования – лизогенный или создающий распад. При нем бактериофаг внедряет свою ДНК в хромосому бактерии, не нарушая функцию клетки. Встроенный в геном бактериофаг еще не собран, а бактерия жива. Незрелая частица вируса, или профаг, после деления бактерии передается по наследству ее потомкам или дочерним клеткам. Из всего потомства профаг может активироваться у нескольких бактерий, не трогая остальных. После активации профаг действует точно так же, как и вирулентный бактериофаг – созревает и разрывает бактериальную клетку. Весь этот цикл называют лизогенным. Он характерен для умеренных, менее агрессивных бактериофагов. В отличие от вирулентных видов, умеренный бактериофаг не уничтожает все бактерии в среде, но подавляет их чрезмерный рост. Таким образом, бактериофаги с умеренной агрессивностью помогают в профилактике болезней, а вирулентные виды – при лечении.
Чем бактериофаги отличаются от антибиотиков?
Антибиотики – это лишь химические соединения, которые в природе выделяют ряд грибов. Бактериофаги являются живыми организмами. По сути, они работают как микроскопические роботы, но запущенные не с помощью нанотехнологий, а самой природой. К бактериофагам чувствительны 70 – 90% штаммов возбудителей различных инфекций. Самые эффективные антибиотики широкого спектра могут подавить 60 – 90% бактерий. То есть по эффективности бактериофаги не уступают антибактериальным препаратам. Но при этом они имеют множество преимуществ.
Преимущества бактериофагов
Первое и самое главное преимущество бактериофагов – отсутствие побочных эффектов. Их прием абсолютно безопасен для человека, но одновременно очень эффективен для борьбы с инфекцией!
© Artem_Egorov / Getty Images
Фаги – самостоятельные борцы против бактериальных инфекций. Состояние иммунной системы человека не влияет на работу фагов. Они действует избирательно только на те бактерии, у которых есть особые "сигнальные" белки на поверхности – рецепторы. При этом на одну бактерию может подействовать только ее "личный" бактериофаг. И этот же фаг не сможет уничтожить другой вид или даже группу бактерий, поэтому, если Вы принимаете бактериофаг, Вам не грозит дисбактериоз кишечника и связанные с ним понос, диарея или грибковая инфекция. Вам не потребуется дополнительный прием противогрибковых средств или пробиотиков, как это бывает при приеме антибиотиков. Таким образом, фаготерапия не только эффективна, безопасна, но еще и позволяет сэкономить на лечении.
Сравним антибактериальное действие бактериофагов и антибиотиков в организме. Когда в очаг воспаления попадает бактериофаг, он размножается и уничтожает все чувствительные к нему бактерии, пока орган не будет очищен полностью. После каждой уничтоженной бактерии в среде образуется несколько сотен бактериофагов, а значит, принимать дополнительно дозу не нужно. Когда все вредные бактерии в зоне уничтожаются, бактериофаг также удаляется из организма, не причиняя ему вреда.
Что же происходит, если мы принимаем антибиотики? Чтобы антибиотик подействовал, его должно быть много. Поэтому врачи назначают таблетки несколько раз в день. Так концентрация препарата во всех тканях организма постепенно возрастает и доходит до терапевтической, то есть дающей лечебный эффект, спустя трое суток. Но врачи продолжают прием антибиотиков до 7 - 10 дней, иначе недобитые бактерии приобретут к нему устойчивость. За это время из-за высокой дозы препарата у больного проявляется ряд побочных эффектов, поскольку антибиотик – это яд не только для бактерий, но и для организма.
Почему бактерии устойчивы к антибиотикам, но не могут устоять перед фагами?
Вторым главным преимуществом бактериофагов является то, что они эффективны, даже когда антибиотики бессильны. Бактерии, вызывающие у нас инфекцию, постепенно находят способы противостоять препаратам. Они эволюционируют, начинают вырабатывать ферменты, которые разрушают антибиотик, и эта способность передается всему поколению выжившей бактерии. Раньше устойчивость к антибиотикам возникала в течение 20 – 30 лет. За это время ученые успевали создавать новое поколение лекарств, и врачи успешно лечили все виды инфекций. Но сейчас всего за 2 – 3 года возбудители становятся невосприимчивы к антибиотикам, причем устоять перед лекарством способны даже те микробы, которые появляются в стерильных условиях больницы.
Чтобы бактерия приобрела устойчивость к фагу, она должна мутировать, поменять свой "белковый код" и строение рецептора на клеточной стенке, к которому фиксируется ее вирус-пожиратель. Но фаги тоже способны к эволюции, поэтому для любой новой группы ли штамма возбудителей обязательно образуется свой "пожиратель".
© Marcin Klapczynski / Getty Images
Эта гонка за выживание происходит постоянно. Пока существуют бактерии, будут существовать и их убийцы-фаги. Поэтому, когда одна культура бактериофагов становится неэффективна, нужно просто выделить новую группу, чтобы вылечить инфекцию. А сделать это можно не за несколько лет и даже не месяцев. Новый бактериофаг получают за 2 – 3 дня или несколько недель.
Все, что нужно для получения новых фагов – выделить их из той же среды, где обитает возбудитель инфекции, например, из каловых масс, почвы, сточных вод и даже из горячих источников или глубин океана. Производство препарата очень простое и экологически чистое. Чтобы отделить вирус от среды, образец пропускают через фильтр, который задерживает бактерии, но пропускает мелкие частицы бактериофагов.
Есть ли недостатки у бактериофагов?
Несмотря на явные преимущества, бактериофаги уступают антибиотикам по нескольким параметрам. Поскольку фаги действуют, как "снайперы", нацеливаясь на конкретных бактерий, врач должен точно знать возбудителя инфекции. Высокая избирательность бактериофагов не позволяет использовать их, если инфекция вызвана сразу несколькими патогенными микробами. В таких случаях назначают антибиотики широкого спектра, действующие на целый ряд бактерий. Но и эта проблема разрешима. Чтобы фагопрепарат мог уничтожить все вредные бактерии в организме, создают "коктейли" из нескольких видов бактериофагов.
Фаготерапия - маленькие помощники при серьезных инфекциях
На первый взгляд кажется странным, что вирус может быть использован для лечения! Но сегодня большое количество серьезных, гнойных и опасных для жизни инфекций лечатся фагами – вирусами, атакующими бактерии.
По спектру действия, фаги бывают:
- моновалентные – поражают бактерии определенного типа;
- типовые – действуют против штаммов или группы бактерий одного вида;
- поливалентные – разрушают бактерии целого рода;
- комбинированные – содержат фаги к нескольким возбудителям, действуют против микробных ассоциаций.
Препараты, содержащие фаги, выпускают в виде мазей, таблеток, суспензий, аэрозолей или свечей. Но чаще всего бактериофаги назначают в жидкой форме. Раствором орошают воспаленную полость органа, смазывают им рану, принимают внутрь или вводят внутривенно.
© Pornprasit / Getty Images
При лечении бактериофагами важен один нюанс. Самостоятельно подобрать препарат Вы не сможете, поскольку каждый "коктейль" из бактериофагов чувствителен только к определенным группам бактерий, штаммам, и абсолютно неэффективен, если у Вас выявили другие варианты того же вида. Если врач решит назначить Вам фаготерапию, то сперва у Вас возьмут анализы, чтобы выявить возбудителя и подобрать к нему "пожирателя".
В зависимости от воспаленного органа, Вам потребуется сдать следующие анализы:
- анализ крови;
- анализ мочи;
- копрологическое исследование;
- исследование мокроты;
- мазок с кожи или слизистой оболочки.
Взятый материал осматривают под микроскопом, а затем делают посев на питательную среду. Когда бактериальная колония начинает расти, лаборант уточняет вид возбудителя, и добавляют в среду фаги. Если среда очистилась от возбудителей, значит фаг подобран верно, а лечение будет эффективным.
С помощью бактериофагов лечат инфекции, вызванные следующими бактериями:
- кишечная палочка;
- стафилококк;
- стрептококк;
- синегнойная палочка или псевдомонада;
- клебсиелла;
- протей;
- энтерококки;
- возбудители дизентерии и сальмонеллеза.
Иногда перед врачами даже не стоит выбор между антибиотиком и бактериофагом. В последние годы регистрируются вспышки кишечных инфекций, при которых ни один из антибиотиков не может помочь.
Например, антибактериальная терапия практически бессильна при псевдомембранозном колите – это воспаление толстой кишки, которое вызывается агрессивной бактерией Clostridium difficile, или клостридией. Из-за нее развивается тяжелая, опасная для жизни диарея. До недавнего времени псевдомембранозный колит можно было вылечить только с помощью пробиотиков. Больному фактически пересаживали новую микрофлору в кишечник. Но оказалось, что бактериофаги могут уничтожить клостридии гораздо быстрее и легче. Эффективность лечения была задокументирована Американским Сообществом Микробиологов в 2016 году. Подробнее об этом читайте, перейдя по ссылке в списке источников литературы.
Еще одной всемирной проблемой медицины являются псевдомонады. Самый распространенный вид псевдомонад – синегнойная палочка. Она часто вызывает внутрибольничную инфекцию или воспаление дыхательных путей, легких, среднего уха, мочевыводящих путей. Палочка устойчива не только к антибиотикам, но и к дезинфицирующим средствам, однако ее успешно уничтожают бактериофаги.
© Science Photo Library
Фаготерапия показана при следующих болезнях:
- кишечная инфекция;
- инфекция дыхательных путей;
- пневмония и воспаление плевры;
- гнойная инфекция кожи;
- гнойная хирургическая инфекция;
- инфицирование послеоперационной раны;
- абсцесс легкого;
- паратонзиллярные гнойники;
- поддиафрагмальный гнойник;
- инфекция среднего уха;
- воспаление околоносовых пазух;
- кишечный дисбактериоз;
- перитонит;
- остеомиелит;
- инфекционно-аллергический ринит, фарингит, дерматит и конъюнктивит;
- инфекция желудочно-кишечного тракта;
- холециститы;
- воспаление спинномозговой оболочки;
- любая гнойная инфекция с высоким риском заражения крови;
- мочеполовая инфекция;
- циститы;
- пиелонефриты;
- ожоги и травмы.
Бактериофаги применяют не только у взрослых, но и у новорожденных при воспалительных болезнях и высоком риске заражения крови.
Можно ли использовать бактериофаги для профилактики?
При первых признаках простуды или когда рядом есть болеющие инфекцией люди, возникает мысль выпить антибиотики и застать врасплох бактерии, предупредив развитие инфекции. На самом деле так мы не только не помогаем организму, но и вредим ему. Антибиотик не в состоянии предупредить инфекцию. Он просто уничтожит все чувствительные к нему бактерии. Но останутся те, которые приобрели устойчивость. В первую очередь, организм станут атаковать выжившие грибки.
© Science Photo Library
Принципиальная разница фаготерапии в том, что ее можно и нужно использовать, если возникла вспышка какой-либо инфекции. В Московском научно-исследовательском институте эпидемиологии и микробиологии создали "коктейль" из бактериофагов, который можно применять в качестве профилактики кишечных инфекций. Препарат прошел испытания. Оказалось, что он способен восстановить кишечную микрофлору и предупредить размножение условно-болезнетворных микробов в кишечнике.
Если Вы вступили в контакт с больным человеком, и к Вам перешли заразные микробы, прием бактериофагов остановит размножение бактерий. Именно это свойство бактериофагов играет важнейшую роль в лечении и профилактике внутрибольничных инфекций, кишечных инфекций в детских садах и школах, при пищевых токсикоинфекциях или заражении питьевой воды.
Материал несёт информационно-справочную функцию! Перед применением любых средств или услуг необходимо проконсультироваться со специалистом!
БАКТЕРИОФАГ - это... Что такое БАКТЕРИОФАГ?
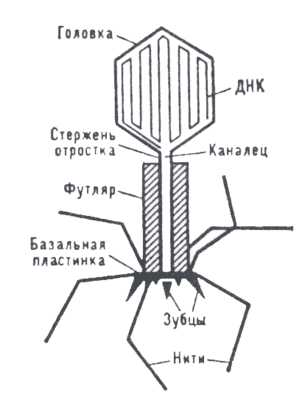
Схема строения частицы бактериофага Т-2 кишечной палочки.
Схема строения частицы бактериофага Т-2 кишечной палочки.
бактериофа́г (от бактерии и греч. phágos пожиратель), фаг, бактериальный вирус, вирус, способный инфицировать бактериальную клетку, размножаться в ней и лизировать её. Фаговая частица состоит из белковой оболочки (капсида) и содержимого, представленного нуклеиновой кислотой. По типу нуклеиновой кислоты Б. подразделяют на ДНК-содержащие (их большинство) и РНК-содержащие. Б. делят также на вирулентные, или литические, и умеренные, или латентные. Вирулентные Б. лизируют бактериальные клетки, умеренные обусловливают лизогенизацию культуры, вследствие чего большинство лизогенных бактерий популяции сохраняют фаг внутриклеточно и передают его из поколения в поколение (см. Лизогения). Форма Б., присутствующая в лизогенной бактерии, называется профагом.
Корпускулы (рис.) у наиболее сложных Б. (например, Т-чётных Б.) имеют головку сферической или гексагональной формы (её диаметр 45140 нм) и прямой или несколько изогнутый отросток (хвост) различной длины (100200 нм). У многих Б. на конце отростка имеется расширение в виде шестигранника, от которого отходят длинные нити, играющие важную роль при взаимодействии Б. с бактериальными клетками. Описаны Б. палочковидной формы и с очень короткими отростками. Б. способен репродуцироваться только внутри бактериальной клетки (вне клетки он не активен). При столкновении частиц Б. с бактериями происходит их необратимая адсорбция. Затем нуклеиновая кислота Б. через отросток, который прокалывает клеточную стенку бактерий, проникает внутрь клетки. Там происходит синтез нуклеиновых кислот и белков фага (в качестве субстратов используются нуклеиновые кислоты бактерий), далее сборка фаговых частиц. Цикл размножения литических Б. заканчивается выходом фаговых частиц потомства из клетки в окружающую среду, который сопровождается лизисом бактериальной клетки. Б. обладают специфическими антигенными свойствами, обусловленными белками капсида. Антигены Б. отличаются от антигенов бактерии-хозяина. Антифаговые сыворотки нейтрализуют только тот Б., против которого они получены; эти сыворотки не активны в отношении бактериальных клеток. Б. широко распространены в природе. Их можно выделить из открытых полостей организма животного и человека, из почвы, водоёмов, растительных остатков и т. д. Описано большое количество Б., паразитирующих в различных аэробных и анаэробных патогенных и сапрофитных микроорганизмах.
Б. можно применять в ветеринарии и медицине для профилактики (фагопрофилактика) инфекционных болезней (дизентерии, брюшного тифа, холеры, стафилококковых и анаэробных инфекций, паратифа и колибактериоза телят и поросят, пуллороза тифа цыплят и др.). Использование Б. в терапевтических целях (фаготерапия) малоэффективно. Б. можно использовать для диагностики инфекционных болезней (например, возбудителя сибирской язвы). Велика роль Б. в изменчивости микроорганизмов. Под влиянием Б. могут возникать расы бактерий с новыми биологическими признаками, ранее им не присущими (см. Трансдукция).
Литература:
Адаме М., Бактериофаги, пер. с англ., М., 1961;
Гольдфарб Д. М., Замчук Л. А., Иммунология нуклеиновых кислот, М. 1968.
Ветеринарный энциклопедический словарь. — М.: "Советская Энциклопедия". Главный редактор В.П. Шишков. 1981.
Фаги - это... Что такое Фаги?
Бактериофа́ги (фаги) (от греч. φάγος — пожирать) — вирусы, избирательно поражающие бактериальные клетки. Чаще всего, бактериофаги размножаются внутри бактерий и вызывают их лизис. Как правило бактериофаг состоит из белковой оболочки и генетического материала -- одноцепочечной или двуцепочечной РНК. Размер частиц приблизительно от 20 до 200 нанометров.
История
Предположение, что бактериофаги имеют корпускулярную природу, было выдвинуто еще Ф. д'Эрелем. Однако, только после изобретения электронного микроскопа удалось увидеть и изучить ультраструктуру фагов. Долгое время представление о морфологии и основные особенности фагов основывались на результатах изучения фагов Т-группы — Т1, Т2,..., Т7, которые размножаются на Е. coli штамма В. Однако, с каждым годом появлялись новые данные касающиеся морфологии и структуры разнообразных фагов, что обусловило необходимость их морфологической классификации.
1 — головка, 2— хвост, 3 — нуклеиновая кислота, 4 — капсид, 5 —"воротничок", 6 — белковый чехол хвоста, 7— фибрилла хвоста, 8 — шипы, 9 — базальная пластинкаЖизненный цикл вирулентных бактериофагов
- Фаг приближается к бактерии, и хвостовые нити связываются с рецепторными участками на поверхности бактериальной клетки.
- Хвостовые нити изгибаются и "заякоривают" шипы и базальную пластинку на поверхности клетки; хвостовой чехол сокращается, заставляя полый стержень входить в клетку; этому способствует фермент лизоцим, который находится в базальной пластинке; таким образом нуклеиновая кислота (ДНК или РНК) вводится внутрь клетки.
- Нуклеиновая кислота фага кодирует синтез ферментов фага, используя для этого белоксинтезирующий аппарат хозяина.
- Фаг тем или иным способом инактивирует ДНК и РНК хозяина, а ферменты фага совсем расщепляют её; РНК фага подчиняет себе клеточный аппарат.
- Нуклеиновая кислота фага реплицируется и кодирует синтез новых белков оболочки.
- Новые частицы фага, образовавшиеся в результате спонтаной самосборки белковой оболочки вокруг фаговой нуклеиновой кислоты; под контролем РНК фага синтезируется лизоцим.
- Лизис клетки: клетка лопается под воздействием лизоцима; высвобождается около 200-1000 новых фагов; фаги инфицируют другие бактерии.
- Стадии 1-7 по времени занимают около 30 минут; этот период называется латентным периодом.
Применение
В медицине
Одной из областей использования бактериофагов является антибактериальная терапия, альтернативная приёму антибиотиков. Например, применяются бактериофаги: стрептококковый, стафилококковый, клебсиеллёзный, дизентерийный поливалентный, пиобактериофаг, коли, протейный и колипротейный и другие.
Бактериофаги применяются также в генной инженерии в качестве векторов, переносящих участки ДНК, возможна также естественная передача генов между бактериями посредством некоторых фагов (трансдукция).
В биологии
Бактериофаги M13, T4, T7 и фаг λ используют для изучения белок-белковых, белок-пептидных и ДНК-белковых взаимодействий методом фагового дисплея.
Ссылки
Wikimedia Foundation. 2010.
Бактериофаги
БАКТЕРИОФАГИ КАК АЛЬТЕРНАТИВА АНТИБИОТИКАМ В ЛЕЧЕНИИ ИНФЕКЦИЙ
Бактериофаги — вирусы бактерий, естественные микроорганизмы, которые, размножаясь внутри бактериальной клетки, ведут к ее быстрой гибели.
Из истории открытия
В 1896 году английский бактериолог Э. Ханкин, исследуя антибактериальное действие воды индийских рек, пришел к выводу о существовании агента, проходящего через бактериальные фильтры и вызывающего лизис холерных вибрионов. Российский микробиолог Н. Ф. Гамалея в 1897 году наблюдал лизис бацилл сибирской язвы. Однако первой научной публикацией о фагах стала статья английского микробиолога Ф. Туорта, в которой он в 1915 году описал инфекционное поражение стафилококков, значительно изменявшее морфологию колоний. В 1917 году канадский бактериолог Ф. Д’Эрелль независимо от Туорта сообщил об открытии вируса, «пожирающего» бактерии — бактериофага.
Интересный факт: при нанесении бактериофага на влажные слизистые он за 20 минут очищает их от определенного вида бактерий, например от стафилококка. Так быстро не работает ни один антибиотик.
Действие бактериофагов отличается от действия антибиотиков:
- Для определенного вида бактерий существует свой определенный бактериофаг. Но стоит отметить, что не ко всем бактериям есть бактериофаги (это основной недостаток этих препаратов). Для решения вопроса, какую терапию выбрать для лечения инфекции, врач должен сначала взять материал для посева на флору с точным определением вида возбудителя и только после получения анализа на чувствительность микроорганизма к бактериофагам выбрать препарат.
- Бактериофаги не действуют на нормофлору (нормальные бактерии), поэтому лечение бактериофагами экологично и не требует коррекции нормофлоры.
- Бактериофаги не влияют на организм человека, поскольку не способны проникнуть в клетки человека. Поэтому бактериофаги не токсичны и не вызывают побочных эффектов.
- После уничтожения патогена элиминируются (самовыводятся) из организма.
- Бактериофаги просты в применении: большинство их производится в жидком виде. Доступно наружное орошение при местном применении, полоскании, в виде микроклизм при кишечных инфекциях. Но действуют бактериофаги только местно, то есть именно там, где вы их применяете при полоскании, орошении и закапывании. В отличие от антибиотиков, которые при приеме внутрь распределяются по организму и действуют во всех органах и тканях.
- Бактериофаги стимулируют местный иммунитет, так как частицы уничтоженных бактерий побуждают иммунную систему к выработке специфических антител. Из-за этого свойства бактериофаги являются препаратом выбора в лечении бактерионосительства (например, стафилококконосительства) и хронических форм бактериальных инфекций.
- Сочетаются с другими препаратами, в том числе с антибиотиками. Их совместное применение ведет к быстрому выздоровлению от бактериальной инфекции.
- По совокупности описанных свойств бактериофаги применимы как основной препарат для лечения бактериальных инфекций у беременных, детей с рождения и людей пожилого возраста, а также в тех случаях, когда имеется полирезистентность микроорганизма к антибиотикам.
В лаборатории KDL предлагается 2 варианта посевов на флору с определением чувствительности выделенной культуры микроорганизма к препаратам бактериофагов и разным наборам антибиотиков в зависимости от ситуации пациента (выбирает врач), например:
Посев на микрофлору отделяемого урогенитального тракта женщины с определением чувствительности к основному спектру антибиотиков и бактериофагам, в т.ч. Кандида
Посев на микрофлору отделяемого урогенитального тракта женщины с определением чувствительности к расширенному спектру антибиотиков и бактериофагам, в т.ч. Кандида
Какие инфекции можно лечить бактериофагами:
- кожные, ожоговые и раневые инфекции;
- инфекции ЛОР органов;
- инфекции урогенитального тракта;
- отдельные инфекции желудочно-кишечного тракта.
Возбудителями этих инфекций могут быть такие бактерии, как золотистый стафилококк, синегнойная палочка, патогенные формы кишечной палочки, сальмонеллы, стрептококки.
В Новосибирском научном центре технологии персонализированного лечения бактериофагами в большой коллекции бактериофагов есть уникальные штаммы, способные бороться с недавно появившимися и уже получившими широкое распространение возбудителями больничных инфекций, такими как грамотрицательные бактерии Acinetobacter baumanii, Stenotrophomonas maltophilia и др.
Последние годы ознаменовались широкими исследованиями бактериофагов из-за нарастающей проблемы антибиотикорезистентности микроорганизмов, которые находят всё новые применения не только в терапии и профилактике, но и в биотехнологиях. Их очевидным практическим результатом должно стать возникновение нового мощного направления персонализированной медицины, а также создание целого спектра технологий в пищевой промышленности, ветеринарии, сельском хозяйстве и в производстве современных материалов. Мы ждем, что второе столетие исследований бактериофагов принесет не меньше открытий, чем первое.
Поделиться статьей:
Остались вопросы?