Бактериофаги что это такое
О Бактериофагах
Что такое бактериофаги?
xорошо известно, что бактериофаги умеют адаптироваться к новым условиям благодаря мутациям, но из признаков «живого» им присущи только способность к размножению и передаче потомкам наследственной информации. Именно эти свойства позволили человеку использовать их как альтернативу антибиотикам для борьбы с инфекциями и уничтожения болезнетворных бактерий.
Бактериофаги - это вирусы, мельчайшие природные структуры, похожие на молекулярные кристаллы. Но, в отличие от большинства известных человечеству вирусов, они поражают не высшие организмы (например - человека), а только низшие - одноклеточные, недаром «бактериофаг» буквально переводится как «пожиратель бактерий». Бактериофаги устроены настолько просто, что даже не могут размножаться самостоятельно – для этого им, как и другим вирусам, нужна «чужая» живая клетка.
Из чего состоит бактериофаг
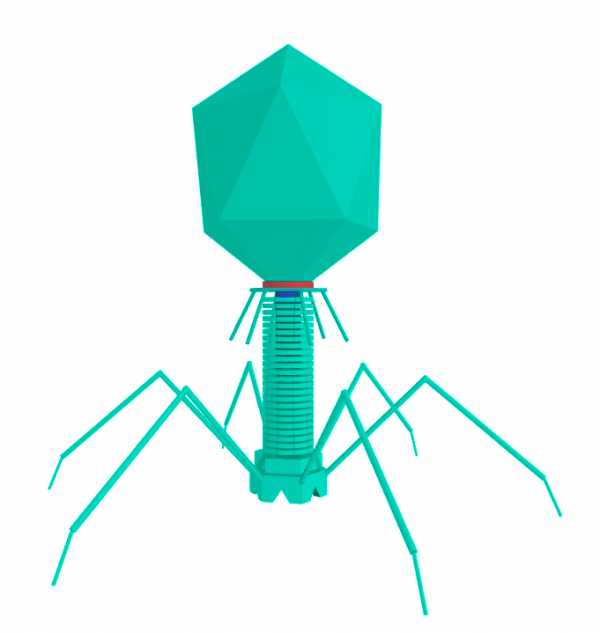 Типичный фаг состоит из «головы» с плотно упакованной генетической программой, состоящей из нуклеиновых кислот (ДНК или РНК), и «хвоста», с помощью которого «впрыскивает» свои гены в клетку бактерии. Зараженная бактерия начинает с помощью собственных внутриклеточных систем и ресурсов синтезировать белки и нуклеиновые кислоты, необходимые для сборки новых вирусных частиц. Зрелые фаги выходят на поиски новой добычи, а «родительская» бактериальная клетка погибает.
Типичный фаг состоит из «головы» с плотно упакованной генетической программой, состоящей из нуклеиновых кислот (ДНК или РНК), и «хвоста», с помощью которого «впрыскивает» свои гены в клетку бактерии. Зараженная бактерия начинает с помощью собственных внутриклеточных систем и ресурсов синтезировать белки и нуклеиновые кислоты, необходимые для сборки новых вирусных частиц. Зрелые фаги выходят на поиски новой добычи, а «родительская» бактериальная клетка погибает.
 Благодаря последним исследованиям стало понятно, что бактериофаги играют важную для поддержания глобального «микробного баланса» роль в биосфере: каждые двое суток они уничтожают половину мировой популяции бактерий и тем самым препятствуют этим быстро размножающимся организмам покрыть толстым слоем земную поверхность.
Благодаря последним исследованиям стало понятно, что бактериофаги играют важную для поддержания глобального «микробного баланса» роль в биосфере: каждые двое суток они уничтожают половину мировой популяции бактерий и тем самым препятствуют этим быстро размножающимся организмам покрыть толстым слоем земную поверхность.
Бактериофаги появляются везде, где живут бактерии: на суше и в океанах, в почве и в воде, в растениях и животных. Даже в желудочно-кишечном тракте человека содержится около 1012 бактериофагов – на порядок больше, чем звезд в нашей Галактике! И хотя размер фаговых частиц не превышает 0,0001 мм, биомасса фагов на планете достигает фантастической цифры – 1 млрд тонн. Поэтому эти невидимые глазом, но вездесущие создания называют иногда «темной материей» биосферы.
Преимущества бактериофагов
| | |
| | |
| | |
Применение бактериофагов
Сразу после открытия сто лет назад вирусов бактерий, фаговые препараты стали использовать для борьбы с инфекционными болезнями человека. Однако благодаря открытию антибиотиков и недостатку знаний об объекте лечебный потенциал фагов не был реализован.
 Полстолетия спустя бактериофагами заинтересовались молекулярные биологи: и выяснили, что эти простые «наноустройства» с короткими генетическими программами являются удобными объектами для экспериментальных исследований по изучению устройства и работы генома. Дальнейшее изучение фагов и механизмов, с помощью которых бактерии защищаются от врагов, открыло науке один из самых эффективных инструментов редактирования генома – CRISPR-CAS, основанный на системе «бактериального иммунитета».
Полстолетия спустя бактериофагами заинтересовались молекулярные биологи: и выяснили, что эти простые «наноустройства» с короткими генетическими программами являются удобными объектами для экспериментальных исследований по изучению устройства и работы генома. Дальнейшее изучение фагов и механизмов, с помощью которых бактерии защищаются от врагов, открыло науке один из самых эффективных инструментов редактирования генома – CRISPR-CAS, основанный на системе «бактериального иммунитета».
Фаги нашли применение в разных сферах человеческой деятельности, включая био- и нанотехнологии. Например, как простые системы для наработки белков с заданными свойствами или как основа для создания материалов с заданной архитектурой в каталитической химии.
 В качестве «умных» молекулярных устройств их используют для транспорта лекарств в организме и как диагностические сенсоры – например, для выявления патогенных бактерий в продуктах питания. Препараты фагов применяются для дезинфекции в сельском хозяйстве и в пищевой промышленности - это увеличивает экологическую чистоту.
В качестве «умных» молекулярных устройств их используют для транспорта лекарств в организме и как диагностические сенсоры – например, для выявления патогенных бактерий в продуктах питания. Препараты фагов применяются для дезинфекции в сельском хозяйстве и в пищевой промышленности - это увеличивает экологическую чистоту.
Но все-таки медицина, как и столетие назад, остается главной областью применения этих врагов бактерий. С ростом лекарственной устойчивости бактерий к химическим антибиотикам возросло значение фаготерапии для профилактики и лечения инфекционных болезней человека.
Бактериофаги — Студопедия
Бактериофаги (от «бактерия» и греч. phagos – пожиратель) – вирусы бактерий, обладающие способностью специфически проникать в бактериальные клетки, репродуцироваться в них и вызывать их растворение (лизис).
История открытия бактериофагов связана с именем канадского исследователя Ф. д’Эрелля (1917), который обнаружил эффект лизиса бактерий, выделенных из испражнений больного дизентерией. Такие явления наблюдали и другие микробиологи [Гамалея Н. Ф., 1898; Туорт Ф., 1915], но лишь Ф. д'Эрелль, предположив, что имеет дело с вирусом, выделил этот «литический фактор» с помощью бактериальных фильтров и назвал его бактериофагом.
В дальнейшем выяснилось, что бактериофаги широко распространены в природе. Их обнаружили в воде, почве, пищевых продуктах, различных выделениях из организма людей и животных, т.е. там, где встречаются бактерии. В настоящее время эти вирусы выявлены у большинства бактерий, как болезнетворных, так и неболезнетворных, а также ряда других микроорганизмов (например, грибов). Поэтому в широком смысле их стали называть просто фагами.
Фаги различаются по форме, структурной организации, типу нуклеиновой кислоты и характеру взаимодействия с микробной клеткой.
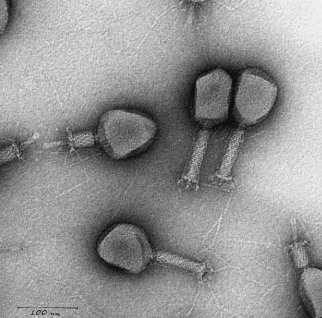
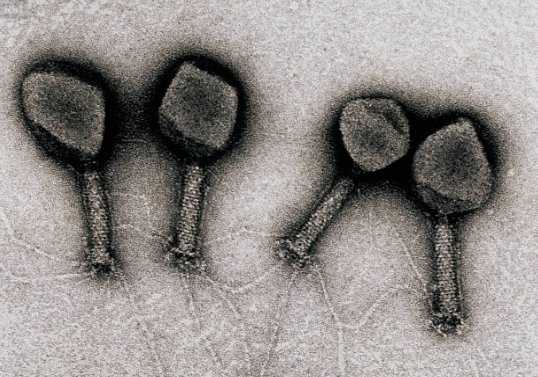
Морфология. Большинство фагов под электронным микроскопом имеют форму головастика или сперматозоида, некоторые – кубическую и нитевидную формы. Размеры фагов колеблются от 20 до 800 нм у нитевидных фагов. Наиболее полно изучены крупные бактериофаги, имеющие форму сперматозоида. Они состоят из вытянутой икосаэдричес-кой головки размером 65.100 нм и хвостового отростка длиной более 100 нм. Внутри хвостового отростка имеется полый цилиндрический стержень, сообщающийся отверстием с головкой, снаружи – чехол, способный к сокращению наподобие мышцы. Хвостовой отросток заканчивается шестиугольной базальной пластинкой с короткими шипами, от которых отходят нитевидные структуры – фибриллы.
Существуют также фаги, имеющие длинный отросток, чехол которого не способен сокращаться, фага с короткими отростками, аналогами отростков, без отростка.
Химический состав. Фаги состоят из двух основных химических компонентов – нуклеиновой кислоты (ДНК или РНК) и белка. У фагов, имеющих форму сперматозоида, двунитчатая ДНК плотно упакована в виде спирали внутри головки.Белки входят в состав оболочки (капсида), окружающей нуклеиновую кислоту, и во все структурные элементы хвостового отростка. Структурные белки фага различаются по составу полипептидов и представлены в виде множества идентичных субъединиц, уложенных по спиральному или кубическому типу симметрии. Кроме структурных белков, у некоторых фагов обнаружены внутренние (геномные) белки, связанные с нуклеиновой кислотой, и белки-ферменты (лизоцим, АТФ-аза), участвующие во взаимодействии фага с клеткой.
Резистентность. Фаги более устойчивы к действию химических и физических факторов, чем бактерии. Ряд дезинфицирующих веществ (фенол, этиловый спирт, эфир и хлороформ) не оказывают существенного влияния на фаги. Высокочувствительны фаги к формалину и кислотам. Инактивация большинства фагов наступает при температуре 65-70ºС. Длительное время они сохраняются при высушивании в запаянных ампулах, замораживании при температуре -185ºС в глицерине.
Взаимодействие фага с бактериальной клеткой. По механизму взаимодействия различают вирулентные и умеренные фаги. Вирулентные фаги, проникнув в бактериальную клетку, автономно репродуцируются в ней и вызывают лизис бактерий. Процесс взаимодействия вирулентного фага с бактерией протекает в виде нескольких стадий и весьма схож с процессом взаимодействия вирусов человека и животных с клеткой хозяина (см. 3-5.1). Однако для фагов, имеющих хвостовой отросток с сокращающимся чехлом, он имеет особенности. Эти фаги адсорбируются на поверхности бактериальной клетки с помощью фибрилл хвостового отростка. В результате активации фагового фермента АТФазы происходит сокращение чехла хвостового отростка и внедрение стержня в клетку. В процессе «прокалывания» клеточной стенки бактерии принимает участие фермент лизоцим, находящийся на конце хвостового отростка. Вслед за этим ДНК фага, содержащаяся в головке, проходит через полость хвостового стержня и активно впрыскивается в цитоплазму клетки. Остальные структурные элементы фага (капсид и отросток) остаются вне клетки. После биосинтеза фаговых компонентов и их самосборки в бактериальной клетке накапливается до 200 новых фаговых частиц. Под действием фагового лизоцима и внутриклеточного осмотического давления происходит разрушение клеточной стенки, выход фагового потомства в окружающую среду и лизис бактерии. Один литический цикл (от момента адсорбции фагов До их выхода из клетки) продолжается 30-40 мин. Процесс бактериофагии проходит несколько циклов, пока не будут ли-зированы все чувствительные к данному фагу бактерии.
Взаимодействие фагов с бактериальной клеткой характеризуется определенной степенью специфичности. По специфичности действия различают поливалентные фаги, способные взаимодействовать с родственными видами бактерий, моновалентные фаги, взаимодействующие с бактериями определенного вида, и типовые фаги, взаимодействующие с отдельными вариантами (типами) данного вида бактерий.
Умеренные фаги лизируют не все клетки в популяции, с частью из них они вступают в симбиоз, в результате чего ДНК фага встраивается в хромосому бактерии. В таком случае геномом фага называют профаг. Профаг, ставший частью хромосомы клетки, при ее размножении реплицируется синхронно с геном бактерии, не вызывая ее лизиса, и передается по наследству от клетки к клетке неограниченному числу потомков. Биологическое явление симбиоза микробной клетки с умеренным фагом (профагом) называется лизогенией, а культура бактерий, содержащая профаг, получила название лизогенной. Это название (от греч. lysis – разложение, genea – происхождение) отражает способность профага самопроизвольно или под действием ряда физических и химических факторов исключаться из хромосомы клетки и переходить в цитоплазму, т. е. вести себя как вирулентный фаг, лизирующий бактерии. Лизогенные культуры по своим основным свойствам не отличаются от исходных, но они невосприимчивы к повторному заражению гомологичным или близкородственным фагом и, кроме того, приобретают дополнительные свойства, которые находятся под контролем генов профага. Изменение свойств микроорганизмов под влиянием профага получило название фаговой конверсии. Последняя имеет место у многих видов микроорганизмов и касается различных их свойств: культуральных, биохимических, токсигенных, антигенных, чувствительности к антибиотикам и др. Кроме того, переходя из интегрированного состояния в вирулентную форму, умеренный фаг может захватить часть хромосомы клетки и при лизисе последней переносит эту часть хромосомы в другую клетку. Если микробная клетка станет лизогенной, она приобретает новые свойства (см. главу 5). Таким образом, умеренные фаги являются мощным фактором изменчивости микроорганизмов.
Умеренные фаги могут нанести вред микробиологическому производству. Так, если микроорганизмы, используемые в качестве продуцентов вакцин, антибиотиков и других биологических веществ, оказываются лизогенными, существует опасность перехода умеренного фага в вирулентную форму, что неминуемо приведет к лизису производственного штамма.
Практическое использование фагов. Применение фагов основано на их строгой специфичности действия. Фаги используют в диагностике инфекционных болезней: с помощью известных (диагностических) фагов проводят идентификацию выделенных культур микроорганизмов. Вследствие высокой специфичности фагов можно определить вид возбудителя или варианты (типы) внутри вида. Фаготипирование имеет большое эпидемиологическое значение, так как позволяет установить источник и пути распространения инфекции; – с помощью тест-культуры можно определить неизвестный фаг в исследуемом материале, что указывает на присутствие в нем соответствующих возбудителей.
Фаги применяют для лечения и профилактики инфекционных болезней. Производят брюшнотифозный, дизентерийный, синегной-ный, стафилококковый фаги и комбинированные препараты. Способы введения в организм: местно, энтерально или парентерально. Умеренные фаги используют в генетической инженерии и биотехнологии в качестве векторов для получения рекомбинан-тных ДНК (см. главу 6).
Все о бактериофагах - публикации в СМИ
20.12.2013 | Новая аптека No. 6
Летом, в сезон дачного отдыха и дальних путешествий, опасность подхватить острую кишечную инфекцию (ОКИ) возрастает многократно. Чаще всего, несмотря на возможные побочные эффекты, для лечения подобных заболеваний используют антибиотики. о рисках антибиотикотерапии и альтернативных подходах к лечению ОКИ рассказывает терапевт Рябова Н.П.Обоснованы ли опасения, связанные с приемом антибиотиков при ОКИ?
Терапия антибиотиками, как и многими другими рецептурными лекарственными препаратами, таит вполне реальные опасности для здоровья. По сути, назначая пациенту антибиотик, врач каждый раз ищет компромисс между ожидаемым лечебным эффектом и риском развития аллергических, токсических и других побочных действий. А если учесть, что устойчивость патогенных микроорганизмов к различным антибактериальным препаратам постоянно растет, то достойная альтернатива антибиотикам приобретает все большую актуальность.
Как быстро и без побочных эффектов избавиться от ОКИ?
В качестве альтернативы «классическим» антибактериальным лекарственным средствам (ЛС) фармацевтическая промышленность предлагает препараты бактериофагов – безрецептурных и безопасных антибактериальных препаратов. Бактериофаги – это особые вирусы, которые используют бактериальные клетки для своего размножения. В результате микробная клетка гибнет, а на ее «обломках» появляются десятки или сотни новых фагов. Неудивительно, что название этих вирусов переводится с греческого языка как «пожиратели бактерий». Действие их строго специфично. Каждый вид поражает определенные бактерии, например, стрептококки, стафилококки и др. Что касается ОКИ, то существуют бактериофаги против шигелл, сальмонелл, энтеропатогенных штаммов кишечной палочки.
Бактериофаги способны полностью уничтожить определенные виды бактерий в организме?
Бактериофаги – естественные ограничители популяции патогенных микроорганизмов, их численность зависит от количества бактерий-мишеней. В том случае, когда вирусы не находят специфичные бактерии-мишени, они просто погибают.
Но не станет ли их применение причиной дисбактериоза?
«Пожиратели бактерий» не влияют на жизнеспособность нормальной микрофлоры человека, не нарушают нормобиоценоз организма и не могут стать причиной дисбактериоза. В этом состоит одно из основных их преимуществ по сравнению с антибиотиками. Кроме того, лечение препаратами бактериофагов пациентов с ОКИ и явлениями дисбиоза приводит не только к подавлению болезнетворных бактерий, но и к нормализации кишечной микрофлоры. Ведь бактериофаги играют важную роль в конкурентной борьбе различных видов микроорганизмов в ходе формирования биоценоза организма человека.
Каковы преимущества применения бактериофагов вместо антибиотиков?
В отличие от антибиотиков, которые в той или иной степени оказывают токсическое действие на все без исключения клетки организма, эффект бактериофагов распространяется только на патогенные микроорганизмы. Дополнительным преимуществом такой избирательности является отсутствие негативного влияния на иммунитет. Бактериофаги также можно использовать для профилактики бактериальных инфекций.
Развивается ли привыкание или устойчивость к таким препаратам?
Привыкания и снижения чувствительности к бактериофагам не развивается. Прежде всего потому, что они постоянно эволюционируют. Это тот редкий случай, когда высокая изменчивость вирусов работает на благо человека. Такие качества бактериофагов имеют особое значение в современных условиях, когда резистентность к антибиотикам развивается быстрее, чем мировая фармацевтическая промышленность разрабатывает и внедряет в клиническую практику новые препараты. Разрушающие бактерии вирусы – бактериофаги – позволяют бороться с резистентными микробными штаммами. Кроме того, бактериофаги – это решение многих проблем для пациентов с непереносимостью антибиотиков или аллергией на них.
Можно ли применять бактериофаги совместно с другими ЛС?
Их можно сочетать с любыми другими ЛС, в том числе антибиотиками и пробиотиками. Бактериофаги могут потенцировать действие антибиотиков и повышать чувствительность к ним микроорганизмов, что особенно важно сейчас, когда антибиотикорезистентность нарастает.
Какова безопасность фаготерапии?
Такие препараты абсолютно безвредны для человека. Их можно применять беременным женщинам и детям (даже новорожденным). Поскольку эти вирусы действуют только на клетки определенных видов бактерий, они не могут причинить никакого вреда организму. Таким образом, фаготерапия – это эффективный и безопасный метод патогенетического лечения.
Так, может, совсем отказаться от антибиотиков?
Многие инфекционисты считают, что лечение бактериофагами – это прорыв в борьбе с инфекционными заболеваниями. Но надо учитывать, что далеко не для всех возбудителей бактериальных инфекций существуют избирательные «пожиратели». Кроме того, при лечении пациентов с тяжелыми инфекционными заболеваниями усилий полезных вирусов может оказаться недостаточно. Тем не менее, в большинстве случаев не нужно торопиться с применением антибиотиков, а стоит дать возможность поработать пожирателям бактерий. К сожалению, антибиотики для лечения ОКИ по-прежнему применяются очень широко, часто бесцельно и бесконтрольно. Это способствует не только развитию резистентности к ним и появлению дисбиоза, но и замедлению репарации слизистой оболочки кишечника после завершения лечения. И все это на фоне признания ведущими российскими учеными и специалистами в области здравоохранения эффективности препаратов бактериофагов и рекомендаций более широко применять их для лечения бактериальных инфекций!
Существуют ли специальные препараты бактериофагов для лечения ОКИ?
Такие препараты существуют. Один из них – Интести-бактериофаг, производства НПО «Микроген» Минздрава России, крупнейшего предприятия отечественной фармацевтической промышленности, лидера в разработке и производстве медицинских иммунобиологических препаратов, диагностических и лекарственных средств.
Интести-бактериофаг выпускается в жидкой лекарственной форме, во флаконах объемом 100 и 20 мл, и представляет собой смесь фаголизатов наиболее распространенных видов шигелл, сальмонелл, энтеропатогенных штаммов кишечной палочки, протея, стафилококков, энтерококков, синегнойной палочки. Препарат предназначен для лечения таких инфекций желудочно-кишечного тракта, как диспепсии, энтероколиты, колиты, дизентерия, сальмонеллез, а также для коррекции дисбиоза.
Принимать его рекомендуется внутрь, начиная сразу после появления симптомов заболевания, в течение 5–6-ти дней. При необходимости длительность курса лечения можно увеличить еще на 2–3 дня. Детям в возрасте до года Интести-бактериофаг назначают по 5 мл, от 3-х до 8-ми лет – 20 мл, детям старше 8-ми лет и взрослым – по 30–40 мл на прием 3–4 раза в сутки.
Противопоказаний к применению "Интести-бактериофага" нет. Он может назначаться даже грудным детям и беременным женщинам. При его приеме отсутствует риск развития побочных эффектов.
Интести-бактериофаг можно и нужно всегда иметь под рукой. И не только дома, но и на даче, и в путешествии по экзотическим странам. Эффективное антибактериальное средство, не нарушающее нормобиоценоз, станет надежным помощником в трудную минуту.
Противопоказания
Только индивидуальная непереносимость.С клинической точки зрения фаги достаточно безопасны, поскольку люди с рождения встречаться с ними. Фаги – это постоянные спутники организма, они были обнаружены в желудочно кишечном тракте, коже, моче, во рту, где они содержаться в слюне. Бактериофаги являются безопасной альтернативой антибиотикам.
Сравнение профилактического и терапевтического использования фагов и антибиотиков
Воздействие на бактерии
Фаги эффективно убивают чувствительные клетки бактерий (их действие бактерицидное).
Некоторые антибиотики (например, хлорамфеникол) бактериостатические; они скорее ингибируют рост бактерий, чем убивают клетки.
Селективность действия
Высокая селективность бактериофагов позволяет нацеливаться на специфичных патогенов, не затрагивая нормальную бактериальную флору (например, маловероятно, что фаги будут враждебны по отношению к нормофлоре пациентов).
Антибиотики атакуют не только бактерий – возбудителей заболеваний, но также все чувствительные микроорганизмы, включая нормальную – и часто полезную – микрофлору хозяина. Поэтому их неселективное действие нарушает микробный баланс в организме пациента, что может привести к различным побочным эффектам.
Побочные эффекты
Незначительные побочные эффекты при применении лечебных фагов (могут быть вызваны высвобождением эндотоксинов из бактерий, лизированных in vivo фагами).
Для антибиотиков характерно множество побочных эффектов, включая кишечные расстройства, аллергии и вторичные инфекции (например, грибковые инфекции).
Разработка новых препаратов
Естественная коэволюция бактерий и фагов может облегчить получение новых литических фагов против фагоустойчивых бактерий, появляющихся в результате действия других фагов или естественных изменений в бактериальных популяциях.
Создание новых антибиотиков (например, против антибиотикоустойчивых бактерий) требует временных затрат и может занять много лет.
Устойчивость бактерий к действию препарата
Из-за специфичности фагов маловероятно появление устойчивости у других бактериальных видов, не являющимися мишенями терапии.
Из-за широкого спектра активности антибиотики могут приводить к отбору устойчивых мутантов многих видов бактерий, а не только у штаммов мишени.
Применение препарата
Из-за специфичности фагов их успешное использование для предупреждения и лечения бактериальных инфекций требует идентификации этиологического агента и определения его чувствительности к фаговому препарату in vivo перед началом фагового лечения.
Эмпирически назначенные до идентификации этиологического агента антибиотики с большей вероятностью будут эффективны нежели фаговые препараты.
Бактериофаги: Что? Как? Когда?
Тема конференции заинтересовала многих, и это понятно: с заболеваниями уха, горла и носа время от времени сталкивается каждый из нас. И все мы заинтересованы в поисках наилучшего способа лечения. Именно о нем и шла речь в рамках нашей конференции.
Вопросов мы получили много, действительно много, что лишний раз подтвердило: когда речь идет о здоровье – своем и близких, – мы готовы докапываться до сути, искать самые лучшие, безопасные и эффективные средства. И конечно, многие заинтересовались тем, что же такое «бактериофаги», о которых было заявлено в теме конференции. Спасибо всем, кто участвовал в нашем разговоре.
Вирусы или бактерии?
Мы обратили внимание на то, что нашему эксперту пришлось несколько раз подчеркивать, что ЛОР-заболевания могут иметь разную природу – бактериальную или вирусную. В зависимости от этого лечение будет разным. Хочется еще раз остановиться на этом важном моменте, чтобы в дальнейшем все мы могли избежать ошибок при выборе препаратов.
Вирусы – это живая форма, которая проникает в организм, размножается и повреждает клетки. За счет этого развивается вирусная инфекция. Вирусы вызывают такие распространенные заболевания, как грипп и ОРВИ. Сначала начинаются катаральные явления, затем очень быстро присоединяются температура и общие недомогания. Для лечения заболеваний применяются противовирусные препараты.
Бактерии бывают вредными (патогенными) и полезными (например, бактерии, обеспечивающие процесс пищеварения). Патогенные бактерии становятся причиной таких болезней, как ангина, бронхит, пневмония, синусит, воспаление уха.
Бактериальные инфекции часто возникают как осложнение после вирусного заболевания. Это связано с тем, что иммунитет человека, который перенес ОРВИ, ослаблен, поэтому организм быстрее сдается под натиском бактерий. Основной способ справиться с бактериальным заболеванием – это использование антибиотиков, которые бессильны против вирусов. Или же применение бактериофагов.
Бактериофаги действуют против бактерий
Отвечая на вопросы читателей, эксперт неоднократно подчеркивал – для лечения бактериальных (а не вирусных!) заболеваний врачи рекомендуют использовать препараты бактериофагов, которые отличаются высокой эффективностью и безопасностью.
Бактериофаги: Что? Как? Когда?
«Бактериофаги абсолютно безвредны для человека и уничтожают только бактерии, в том числе возбудителей различных ЛОР-заболеваний (стафилококков, стрептококков и др.). Препараты бактериофагов можно использовать для профилактики бактериальных осложнений (синуситы, риносинуситы, фарингиты, тонзиллиты, отиты), часто возникающих после вирусных инфекций», – отметил он.
В чем же преимущество бактериофагов, в том числе и перед антибиотиками? Их несколько. Во-первых, безопасность, что особенно подчеркивал эксперт. Во-вторых, возможность использовать их для профилактики осложнений после вирусных инфекций. В-третьих, бактериофаги можно принимать беременным и кормящим женщинам, а также их можно давать грудным младенцам. В случае приема антибиотиков для этих категорий пациентов существует множество оговорок, а вот при приеме бактериофагов – нет. И в-четвертых, бактериофаги можно применять множеством разных способов: их действенность от этого не меняется. «Препаратами бактериофагов можно полоскать горло, закапывать их в нос», – отметил эксперт.
Современные технологии позволяют изготавливать препараты, содержащие несколько бактериофагов. Они оказываются более эффективными в борьбе с инфекциями, так как действуют сразу в нескольких направлениях. Например, «Секстафаг®», который производит российская компания ФГУП «НПО «Микроген» Минздрава России, содержит шесть активных компонентов. Благодаря сложному составу, «Секстафаг®» предотвращает или эффективно лечит воспалительные заболевания уха, горла, носа, дыхательных путей. А стимулирование местного иммунитета помогает избежать повторной атаки бактерий на организм.
Необходима консультация специалиста
Реклама
Как действует бактериофаг | Журнал Популярная Механика
У всех существ, обитающих на земле, есть микроскопические паразиты — вирусы. Есть свои вирусы и у бактерий. Цикл размножения бактериальных вирусов неизбежно заканчивается гибелью микроба. Чтобы подчеркнуть такую особенность, один из первооткрывателей этого эффекта, Феликс Д’Эрель, придумал специальное название — «бактериофаги», в переводе с греческого — «пожиратели бактерий».
В конце ХХ века стало ясно, что бактерии безусловно доминируют в биосфере Земли, составляя более 90% ее биомассы. У каждого вида имеется множество специализированных типов вирусов. По предварительным оценкам, число видов бактериофагов составляет около 1015. Чтобы понять масштаб этой цифры, можно сказать, что если каждый человек на Земле будет каждый день открывать по одному новому бактериофагу, то на описание всех их понадобится 30 лет. Таким образом, бактериофаги — самые малоизученные существа в нашей биосфере. Большинство известных сегодня бактериофагов принадлежит к отряду Caudovirales — хвостатые вирусы. Их частицы имеют размер от 50 до 200 нм. Хвост разной длины и формы обеспечивает присоединение вируса к поверхности бактерии-хозяина, головка (капсид) служит хранилищем для генома. Геномная ДНК кодирует структурные белки, формирующие «тело» бактериофага, и белки, которые обеспечивают размножение фага внутри клетки в процессе инфекции. Можно сказать, что бактериофаг — это природный высокотехнологичный нанообъект. Например, хвосты фагов представляют собой «молекулярный шприц», который протыкает стенку бактерии и, сокращаясь, впрыскивает свою ДНК внутрь клетки.
Как действует бактериофаг Бактериофаги для размножения используют аппарат бактериальной клетки, «перепрограммируя» его на производство новых копий вирусов. Последний этап этого процесса — лизис, уничтожение бактерии и освобождение новых бактериофагов.
С этого момента начинается инфекционный цикл. Его дальнейшие этапы состоят из переключения механизмов жизнедеятельности бактерии на обслуживание бактериофага, размножение его генома, построение множества копий вирусных оболочек, упаковки в них ДНК вируса и, наконец, разрушение (лизис) хозяйской клетки. У каждого этапа существует множество нюансов, имеющих глубокий эволюционный и экологический смысл. Ведь бактерии и их вирусные паразиты сосуществуют сотни миллионов, если не миллиарды лет. И эта борьба за выживание не закончилась ни тотальным уничтожением одноклеточных, ни приобретением тотальной устойчивости к фагам и бесконтрольным размножением бактерий. Помимо постоянного эволюционного соревнования механизмов защиты у бактерий и нападения у вирусов, причиной сложившегося равновесия можно считать и то, что бактериофаги специализировались по своему инфекционному действию. Если имеется крупная колония бактерий, где своих жертв найдут и следующие поколения фагов, то уничтожение бактерий литическими (убивающими, дословно — растворяющими) фагами идет быстро и непрерывно. Если потенциальных жертв маловато или внешние условия не слишком подходят для эффективного размножения фагов, то преимущество получают фаги с лизогенным циклом развития. В этом случае после внедрения внутрь бактерии ДНК фага не сразу запускает механизм инфекции, а до поры до времени существует внутри клетки в пассивном состоянии, зачастую внедряясь в бактериальный геном. В таком состоянии профага вирус может существовать долго, проходя вместе с хромосомой бактерии циклы деления клетки. И лишь когда бактерия попадает в благоприятную для размножения среду, активируется литический цикл инфекции. При этом, когда ДНК фага освобождается из бактериальной хромосомы, часто захватываются и соседние участки бактериального генома, а их содержимое в дальнейшем может перенестись в следующую бактерию, которую заразит бактериофаг. Этот процесс (трансдукция генов) считается важнейшим средством переноса информации между прокариотами — организмами без клеточных ядер.
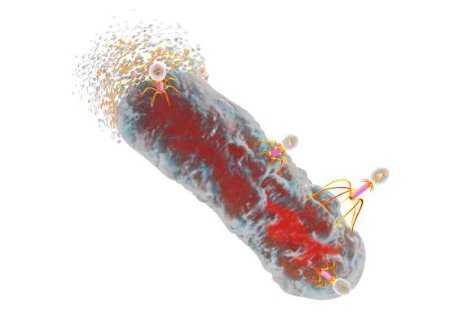
Фотография, сделанная с помощью электронного микроскопа, показывает процесс закрепления бактериофагов (колифагов T1) на поверхности бактерии E. coli.
Все эти молекулярные тонкости не были известны во втором десятилетии ХХ века, когда были открыты «невидимые инфекционные агенты, уничтожающие бактерий». Но и без электронного микроскопа, с помощью которого в конце 1940-х впервые удалось получить изображения бактериофагов, было понятно, что они способны уничтожать бактерии, в том числе и болезнетворные. Это свойство было незамедлительно востребовано медициной. Первые попытки лечения фагами дизентерии, раневых инфекций, холеры, тифа и даже чумы были проведены достаточно аккуратно, и успех выглядел вполне убедительно. Но после начала массового выпуска и использования фаговых препаратов эйфория сменилась разочарованием. О том, что такое бактериофаги, как производить, очищать и применять их лекарственные формы, было известно еще очень мало. Достаточно сказать, что по результатам предпринятой в США в конце 1920-х годов проверки во многих промышленных фагопрепаратах собственно бактериофагов вообще не оказалось.
Вирусная атака
Проблема с антибиотиками
Вторую половину ХХ века в медицине можно назвать «эрой антибиотиков». Однако еще первооткрыватель пенициллина Александр Флеминг в своей нобелевской лекции предупреждал, что устойчивость микробов к пенициллину возникает довольно быстро. До поры до времени антибиотикоустойчивость компенсировалась разработкой новых типов противомикробных лекарств. Но с 1990-х годов стало ясно, что человечество проигрывает «гонку вооружений» против микробов. Виновато прежде всего бесконтрольное применение антибиотиков не только в лечебных, но и в профилактических целях, причем не только в медицине, но и в сельском хозяйстве, пищевой промышленности и быту. В результате устойчивость к этим препаратам начала вырабатываться не только у болезнетворных бактерий, но и у самых обычных микроорганизмов, живущих в почве и воде, делая из них «условных патогенов». Такие бактерии комфортно существуют в медицинских учреждениях, заселяя сантехнику, мебель, медицинскую аппаратуру, порой даже дезинфицирующие растворы. У людей с ослабленным иммунитетом, каких в больницах большинство, они вызывают тяжелейшие осложнения.
Бактериофаг — не живое существо, а молекулярный наномеханизм, созданный природой. Хвост бактериофага — это шприц, который протыкает стенку бактерии и впрыскивает вирусную ДНК, которая хранится в головке (капсиде) внутрь клетки.
Неудивительно, что медицинское сообщество бьет тревогу. В прошедшем, 2012 году гендиректор ВОЗ Маргарет Чен выступила с заявлением, предсказывающим конец эры антибиотиков и беззащитность человечества перед инфекционными заболеваниями. Впрочем, практические возможности комбинаторной химии — основы фармакологической науки — далеко не исчерпаны. Другое дело, что разработка противомикробных средств — очень дорогой процесс, не приносящий таких прибылей, как многие другие лекарства. Так что страшилки о «супербактериях» — это скорее предостережение, побуждающее людей к поискам альтернативных решений.
На медицинской службе
Вполне логичным выглядит возрождение интереса к использованию бактериофагов — естественных врагов бактерий — для лечения инфекций. Действительно, за десятилетия «эры антибиотиков» бактериофаги активно служили науке, но не медицине, а фундаментальной молекулярной биологии. Достаточно упомянуть расшифровку «триплетов» генетического кода и процесса рекомбинации ДНК. Сейчас о бактериофагах известно достаточно, чтобы обоснованно выбирать фаги, подходящие для терапевтических целей.
Достоинств у бактериофагов как потенциальных лекарств множество. Прежде всего — это их несметное количество. Хотя изменять генетический аппарат бактериофага тоже намного проще, чем у бактерии, и тем более — у высших организмов, в этом нет необходимости. Всегда можно подобрать что-то подходящее в природе. Речь идет скорее о селекции, закреплении востребованных свойств и размножении нужных бактериофагов. Это можно сравнить с выведением пород собак — ездовых, сторожевых, охотничьих, гончих, бойцовых, декоративных… Все они при этом остаются собаками, но оптимизированы под определенный вид действий, нужных человеку. Во‑вторых, бактериофаги строго специфичны, то есть они уничтожают только определенный вид микробов, не угнетая при этом нормальную микрофлору человека. В-третьих, когда бактериофаг находит бактерию, которую должен уничтожить, он в процессе своего жизненного цикла начинает размножаться. Таким образом, не столь острым становится вопрос дозировки. В-четвертых, бактериофаги не вызывают побочных эффектов. Все случаи аллергических реакций при использовании терапевтических бактериофагов были вызваны либо примесями, от которых препарат был недостаточно очищен, либо токсинами, выделяющимися при массовой гибели бактерий. Последнее явление, «эффект Герксхаймера», нередко наблюдается и при применении антибиотиков.
Две стороны медали
К сожалению, недостатков у медицинских бактериофагов тоже немало. Самая главная проблема проистекает из достоинства — высокой специфичности фагов. Каждый бактериофаг инфицирует строго определенный тип бактерий, даже не таксономический вид, а ряд более узких разновидностей, штаммов. Условно говоря, как если бы сторожевая собака начинала лаять только на одетых в черные плащи громил двухметрового роста, а на лезущего в дом подростка в шортах никак не реагировала. Поэтому для нынешних фаговых препаратов нередки случаи неэффективного применения. Препарат, сделанный против определенного набора штаммов и прекрасно лечащий стрептококковую ангину в Смоленске, может оказаться бессильным против по всем признакам такой же ангины в Кемерове. Болезнь та же, вызывается тем же микробом, а штаммы стрептококка в разных регионах оказываются различными.
От автора
Поскольку бактериофагов в природе несметное количество и они постоянно попадают в организм человека с водой, воздухом, пищей, то иммунитет их просто игнорирует. Более того, существует гипотеза о симбиозе бактериофагов в кишечнике, регулирующем кишечную микрофлору. Добиться какой-то иммунной реакции можно только при длительном введении в организм больших доз фагов. Но таким образом можно добиться аллергии на почти любые вещества. И наконец, очень важно то, что бактериофаги недороги. Разработка и производство препарата, состоящего из точно подобранных бактериофагов с полностью расшифрованными геномами, культивированных по современным биотехнологическим стандартам на определенных штаммах бактерий в химически чистых средах и прошедших высокую очистку, на порядки дешевле, чем для современных сложных антибиотиков. Это позволяет быстро приспосабливать фаготерапевтические препараты к меняющимся наборам патогенных бактерий, а также применять бактериофаги в ветеринарии, где дорогие лекарства экономически не оправданы.
Для максимально эффективного применения бактериофага необходима точная диагностика патогенного микроба, вплоть до штамма. Самый распространенный сейчас метод диагностики — культуральный посев — занимает много времени и требуемой точности не дает. Быстрые методы — типирование с помощью полимеразной цепной реакции или масс-спектрометрии — внедряются медленно из-за дороговизны аппаратуры и более высоких требований к квалификации лаборантов. В идеале подбор фагов-компонентов лекарственного препарата можно было бы делать против инфекции каждого конкретного пациента, но это дорого и на практике неприемлемо.
Другой важный недостаток фагов — их биологическая природа. Кроме того, что бактериофаги для поддержания инфекционности требуют особых условий хранения и транспортировки, такой метод лечения открывает простор для множества спекуляций на тему «посторонней ДНК в человеке». И хотя известно, что бактериофаг в принципе не может заразить человеческую клетку и внедрить в нее свою ДНК, поменять общественное мнение непросто. Из биологической природы и довольно большого, по сравнению с низкомолекулярными лекарствами (теми же антибиотиками), размера вытекает третье ограничение — проблема доставки бактериофага в организм. Если микробная инфекция развивается там, куда бактериофаг можно приложить напрямую в виде капель, спрея или клизмы, — на коже, открытых ранах, ожогах, слизистых оболочках носоглотки, ушей, глаз, толстого кишечника — то проблем не возникает.
Но если заражение происходит во внутренних органах, ситуация сложнее. Случаи успешного излечения инфекций почек или селезенки при обычном пероральном приеме препарата бактериофага известны. Но сам механизм проникновения относительно крупных (100 нм) фаговых частиц из желудка в кровоток и во внутренние органы изучен плохо и сильно разнится от пациента к пациенту. Бактериофаги бессильны и против тех микробов, которые развиваются внутри клеток, например возбудителей туберкулеза и проказы. Через стенку человеческой клетки бактериофаг пробраться не может.
Нужно отметить, что противопоставлять применение бактериофагов и антибиотиков в медицинских целях не следует. При совместном их действии наблюдается взаимное усиление противобактериального эффекта. Это позволяет, например, снизить дозы антибиотиков до значений, не вызывающих выраженных побочных эффектов. Соответственно, и механизм выработки у бактерий устойчивости к обоим компонентам комбинированного лекарства почти невозможен. Расширение арсенала противомикробных препаратов дает больше степеней свободы в выборе методики лечения. Таким образом, научно обоснованное развитие концепции применения бактериофагов в противомикробной терапии — перспективное направление. Бактериофаги служат не столько альтернативой, сколько дополнением и усилением в борьбе с инфекциями.
Статья «Пожиратели бактерий» опубликована в журнале «Популярная механика» (№10, Октябрь 2013).