Бертолетова соль что это такое
Хлорат калия — Википедия
Материал из Википедии — свободной энциклопедии
| Хлорат калия | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Систематическое наименование | Хлорат калия | ||
| Традиционные названия | Бертолетова соль | ||
| Хим. формула | KClO3 | ||
| Состояние | Бесцветные кристаллы | ||
| Молярная масса | 122.55 г/моль | ||
| Плотность | 2,32 г/см³ | ||
| Температура | |||
| • плавления | 356 °C | ||
| • разложения | ~ 400 | ||
| Энтальпия | |||
| • образования | -391,204 кДж/моль | ||
| Растворимость | |||
| • в воде при 0°C | 3,25 г/100 мл | ||
| • в воде при 20°C | 7,3 г/100 мл | ||
| • в воде при 100°C | 56,2 г/100 мл | ||
| • в воде при 104,2°C | 61,5 г/100 мл | ||
| Рег. номер CAS | [3811-04-9] | ||
| PubChem | 6426889 | ||
| Рег. номер EINECS | 223-289-7 | ||
| SMILES | |||
| InChI | |||
| RTECS | FO0350000 | ||
| Номер ООН | 1485 | ||
| ChemSpider | 18512 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Хлорат калия (бертолетова соль[1], калий хлорноватокислый) — калиевая соль хлорноватой кислоты.
Впервые получен Клодом Бертолле (отсюда название бертолетова либо бертоллетова соль) в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия:
- 6KOH+3Cl2→KClO3+5KCl+3h3O{\displaystyle {\mathsf {6KOH+3Cl_{2}\rightarrow KClO_{3}+5KCl+3H_{2}O}}}
Промышленное получение хлоратов вообще (и хлората калия в частности) основано на реакции диспропорционирования гипохлоритов, в свою очередь получаемых взаимодействием хлора с растворами щелочей:
- Cl2+2OH−→ClO−+Cl−+h3O{\displaystyle {\mathsf {Cl_{2}+2OH^{-}\rightarrow ClO^{-}+Cl^{-}+H_{2}O}}}
- 3ClO−→ClO3−+2Cl−{\displaystyle {\mathsf {3ClO^{-}\rightarrow ClO_{3}^{-}+2Cl^{-}}}}
Технологическое оформление процесса может быть различно: поскольку наиболее многотоннажным продуктом является гипохлорит кальция (входящий в состав хлорной извести), то наиболее распространённым процессом является проведение реакции обмена между хлоратом кальция (получающимся из гипохлорита кальция при нагреве) и хлоридом калия, который, в силу относительно низкой растворимости, кристаллизуется из маточного раствора.
Также хлорат калия получают модифицированным методом Бертолле при бездиафрагменном электролизе хлорида калия, образующийся при электролизе хлор вступает во взаимодействие in situ (в момент выделения, «на месте») с гидроксидом калия с образованием гипохлорита калия, который далее диспропорционирует на хлорат калия и исходный хлорид калия. При использовании графитовых анодов более удобным методом является электролиз хлорида натрия с получением хлората натрия и обменная реакция с хлоридом калия. Это позволяет очищать от анодного шлама раствор хлората натрия, который имеет значительно большую растворимость, чем хлорат калия, и, таким образом, удобнее для фильтрации.
- 4KClO3→400oC3KClO4+KCl{\displaystyle {\mathsf {4KClO_{3}{\xrightarrow[{}]{400^{o}C}}3KClO_{4}+KCl}}}
- KClO4→550−620oCKCl+2O2{\displaystyle {\mathsf {KClO_{4}{\xrightarrow[{}]{550-620^{o}C}}KCl+2O_{2}}}}
- В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до ~ 200 °C).
- 2KClO3→150−300o2KCl+3O2{\displaystyle {\mathsf {2KClO_{3}{\xrightarrow[{}]{150-300^{o}}}2KCl+3O_{2}}}}
- (Nh5)2SO4+2KClO3→2Nh5ClO3+K2SO4{\displaystyle {\mathsf {(NH_{4})_{2}SO_{4}+2KClO_{3}\rightarrow 2NH_{4}ClO_{3}+K_{2}SO_{4}}}}
Взрывчатые вещества[править | править код]
Смеси хлората калия с восстановителями (фосфором, серой, алюминием, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония.
Из-за высокой чувствительности составов с бертолетовой солью, они практически не применяются для производства промышленных и военных взрывчатых веществ.
Иногда используется в пиротехнике как источник хлора для цветнопламенных составов, входит в состав горючего вещества спичечной головки, и крайне редко в качестве инициирующих взрывчатых веществ (хлоратный порох — «сосис», детонирующий шнур, тёрочный состав ручных гранат вермахта).
В медицине[править | править код]
Некоторое время растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Для получения кислорода[править | править код]
В начале XX века использовалась для лабораторного получения кислорода, но из-за малой доступности его перестали применять.
Для получения диоксида хлора[править | править код]
Реакция восстановления хлората калия щавелевой кислотой при добавлении серной кислоты используется для получения диоксида хлора в лабораторных условиях:
- 2KClO3+h3C2O4+h3SO4→K2SO4+2ClO2+2CO2+2h3O{\displaystyle {\mathsf {2KClO_{3}+H_{2}C_{2}O_{4}+H_{2}SO_{4}\rightarrow K_{2}SO_{4}+2ClO_{2}+2CO_{2}+2H_{2}O}}}
Хлорат калия может реагировать со щавелевой кислотой без присутствия серной кислоты, но эта реакция не применяется для препаративного получения диоксида хлора:
- 2KClO3+h3C2O4→K2CO3+CO2+2ClO2+h3O{\displaystyle {\mathsf {2KClO_{3}+H_{2}C_{2}O_{4}\rightarrow K_{2}CO_{3}+CO_{2}+2ClO_{2}+H_{2}O}}}
Токсичен. Смертельная доза хлората калия составляет 1 г/кг[2].
химические свойства, получение и применение :: SYL.ru
 Введение
ВведениеИзучая по химии кислород, вы дошли до раздела "Получение кислорода в лаборатории путем разложения неорганических веществ". "Разложение воды, марганцовки, перекиси водорода, оксидов тяжелых и нитратов активных металлов... так, вроде бы все понятно. Получение кислорода из бертолетовой соли? Это еще что за зверь?!" - стандартный ход мыслей каждого учащегося, просматривающего этот параграф в учебнике. В школе бертолетову соль не учат, так что приходится наводить справки о ней самостоятельно. Сегодня в этой статье я попытаюсь как можно подробнее ответить на вопрос о том, что такое бертолетова соль.
Происхождение названия
Сначала поговорим о ее названии. Соль - это отдельный класс неорганических веществ, в химической формуле которых такая схема расположения элементов: Ме-n- кисл.ост., где Ме - металл, кисл.ост - кислотный остаток, n - число атомов (может не присутствовать, если валентность металла и кислотного остатка одинакова). Кислотный остаток берут из какой-либо неорганической кислоты. Химическая формула этой соли - KClO3. Металл, который в ней присутствует, - калий, значит, она является калиевой. Источник остатка ClO3 - хлорноватая кислота HClO3. Итого, бертолетова соль является калиевой солью хлорноватой кислоты. Также ее еще называют хлоратом калия, а прилагательное "бертолетова" к ней приписывают из-за имени ее первооткрывателя.
История открытия
Впервые была получена в 1786 году французским химиком Клодом Бертолле. Он пропустил хлор сквозь горячий концентрированный раствор гидроксида калия (фото).
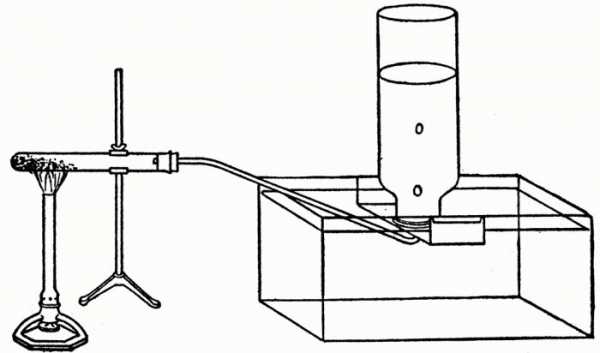
Бертолетова соль: получение
Получение хлоратов промышленным способом (в том числе и бертолетовой соли) основывается на реакции диспропорционирования гипохлоритов, которые получаются при взаимодействии хлора с растворами щелочей. Оформление процесса может быть разным: из-за того что самый многотоннажный продукт - гипохлорит кальция, из которого состоит хлорная известь, наиболее распространенным процессом является осуществление реакции обмена между хлоратом кальция (он получается при нагревании гипохлорита кальция) и хлоридом калия (он кристаллизуется из маточного раствора). Еще хлорат калия можно получить благодаря модифицированному методу Бертолле бездиафрагменным электролизом хлорида калия. Образующиеся хлор и гидроксид калия тут же взаимодействуют. Продутом их реакции является гипохлорит калия, который далее диспропорционирует на исходный хлорид калия и хлорат калия.
Химические свойства

Если температура нагревания достигает 400 оС, происходит разложение бертолетовой соли, при котором выделяется кислород и промежуточно образуется перхлорат калия. С катализаторами (оксид марганца (4), оксид железа (3), оксид меди и т.п.) температура, при которой происходит этот процесс, становится гораздо меньшей. Бертолетова соль и сульфат аммония могут реагировать в водно-спиртовом растворе и образовывать при этом хлорат аммония.
Применение
Смеси восстановителей (фосфора, серы, органических соединений) и хлората калия являются взрывчатыми и чувствительными к ударам и трению (фото выше). Чувствительность увеличивается, если присутствуют броматы и соли аммония. Из-за высокой чувствительности составы, в которых присутствует бертолетова соль, почти не применяются в производстве военных и промышленных взрывчатых веществ. Иногда ее используют в пиротехнике в качестве источника хлора для составов с цветным пламенем.
 Также она содержится в спичечных головках и очень редко может являться инициирующим взрывчатым веществом (хлоратный порох детонировал шнур и был терочным составом ручных гранат вермахта). Да и в СССР хлорат калия входит в состав запала коктейля Молотова, приготовленного по особой рецептуре. Растворы бертолетовой соли раньше иногда использовались как слабый антисептик, наружное лекарственное средство для полоскания горла. В начале ХХ века бертолетову соль использовали для получения кислорода в лаборатории. Однако по причине высокой опасности ее перестали применять. Также при помощи нее в лабораторных условиях получают диоксид хлора (проводят реакцию восстановления хлората калия щавелевой и добавляют серную кислоту).
Также она содержится в спичечных головках и очень редко может являться инициирующим взрывчатым веществом (хлоратный порох детонировал шнур и был терочным составом ручных гранат вермахта). Да и в СССР хлорат калия входит в состав запала коктейля Молотова, приготовленного по особой рецептуре. Растворы бертолетовой соли раньше иногда использовались как слабый антисептик, наружное лекарственное средство для полоскания горла. В начале ХХ века бертолетову соль использовали для получения кислорода в лаборатории. Однако по причине высокой опасности ее перестали применять. Также при помощи нее в лабораторных условиях получают диоксид хлора (проводят реакцию восстановления хлората калия щавелевой и добавляют серную кислоту).Заключение
Теперь вы знаете про бертолетову соль всё. Она может быть как полезной, так и чрезвычайно опасной для человека. Если вы имеете дома спички, то каждый день наблюдаете одну из отраслей применения бертолетовой соли в быту.
бертолетова соль в домашних условиях
Бертолетова соль собственными руками.
Данная заметка будет интересна тем читателям, которые хотят изготовить или получить бертолетову соль самостоятельно дома. В этой процедуре нет ничего сложного, кроме того, что необходимо строго соблюдать предписания инструкции.
Материалы, нужные для самостоятельного приготовления соли
Перед приготовлением желаемого продукта нужно приготовить все необходимое для его производства в домашних условиях. Вот список необходимых компонентов:
1) десять коробочек спичек, рекомендуется использовать спички «Плитспичпрома», так как они подходят по своим составляющим больше всего;
2) одна чашка Петри, или иная химическая колба, или, на крайний случай, ненужный стакан и блюдце, которые впоследствии не жалко будет выбросить на мусорку;
3) клубок ниток и тонкая резинка;
4) ацетон.
Поэтапная инструкция изготовления данной соли
Вынимаем все спички из коробочек, аккуратненько и ровненько складываем их головками в одном направлении, а затем обтягиваем плотно нитками или надеваем на них резинку, неважно, лишь бы плотно держались спички вместе. Получившуюся связку спичек опускаем серной стороной в стакан и топим в жидкости, по температуре приближенной к ста градусам, да так, чтобы спички целиком оказались под водой. Это приблизительно до семи сантиметров в высоту.
Стакан с помещенными спичками и горячей водой ставим в какой-то теплый угол на промежуток времени длительностью до четырех часов. Через пройденное время воду из стакана сливаем в чашку Петри. А далее применяем один из двух методов, какой больше приглянулся и подошел.
Первый метод
Нужно дать изобретенному раствору немного постоять, давая возможность немного улетучиться, но наши кристаллы хлората калия пока не приступили к своему формированию. Затем сию жидкость слегка пропитываем ацетоном, чтобы она в чашке побледнела, а затем опять раствору даем немного времени, чтобы он постоял. Спустя некоторое время вы увидите, что раствор приобрел желтый оттенок, припрячьте его в холодное место до того момента, пока в растворе не начнут образовываться бесцветные кристаллы, которые и являются нашим долгожданным веществом. Вынимайте их оттуда постепенно, и пусть обсыхают.
Второй метод
Следующий метод предполагает добычу большого количества соли собственноручно дома. Необходимо перелить жидкость в чашку Петри для просыхания и ожидать появления необходимого количества подсохшего вещества, залить его h3O и далее действовать согласно принципу первого метода.
Если использовать десяток коробков спичек, то получится 9,5 г готовой бертолетовой соли. Пробуйте, и у вас обязательно все выйдет.
Post Views: 2 293
Бертолетова соль
Что такое хлорат калия?
Калиевую соль хлорноватой кислоты (одна из четырех кислородсодержащих кислот, образованных хлором: хлорноватистая — HClO, хлористая — HClO2, хлорноватая — HClO3 и хлорная — HClO4) принято называть хлорат калия, его формула — KClO3. Эта соль по внешнему виду представляет собой кристаллы (бесцветные), которые слабо растворяются в воде (при 20 ºС в 100 см3 воды растворяется всего 7,3 г соли), но с повышением температуры растворимость растет. Другое ее известное название — бертолетова соль. Молекулярная масса вещества составляет 122,55 атомных единиц массы, плотность - 2,32 г/см3. Соль плавится при 356 ºС, разлагается примерно при 400 ºС.
Открытие бертолетовой соли
Впервые (в 1786 году) хлорат калия получил французский химик Клод Бертолле. Он пропускал хлор через концентрированный горячий раствор гидроокиси калия. Уравнение реакции, по которому была получена соль, выглядит следующим образом: 3Cl2 + 6KOH → 5KCl + KClO3 + 3h3O. В результате этой реакции хлорат калия выпадает в виде белого осадка. Так как он слабо растворяется в холодной воде, то легко отделяется от остальных солей при охлаждении раствора. С момента своего открытия бертолетова соль являлся наиболее распространенным и полезным продуктом из всех хлоратов. В настоящее время KClO3 выпускается в промышленных масштабах.
Химические свойства
Бертолетова соль — сильный окислитель. При взаимодействии ее с концентрированной соляной кислотой (HCl) выделяется свободный хлор. Этот процесс описывается уравнением химической реакции: 6HCl + KClO3 → 3Cl↑ + KCl + 3 h3O. Как и все хлораты, это вещество сильно ядовито. В расплавленном виде KClO3 энергично поддерживает горение. В смеси с легко окисляющимися веществами (восстановителями), такими как сера, фосфор, сахар и другие органические вещества хлорат калия взрывается от удара или трения. Чувствительность к этим воздействиям усиливается в присутствии солей аммония и броматов. При осторожном (нагревание до 60 ºС) окислении калия хлората с кислотой щавелевой получают двуокись хлора, процесс протекает по уравнению реакции: 2KClO3 + h3C2O4 → K2CO3 + CO2 + h3O + 2ClO2. Окись хлора находит применение при отбеливании и стерилизации различных материалов (бумажной массы, муки и прочее), а также может быть использована для обесфеноливания сточных вод химических заводов.
Применение калия хлората
Из всех хлоратов бертолетова соль находит самое широкое применение. Она используется в производстве красителей, спичек (делают горючее вещество спичечной головки, сырьем является увлажненный хлорат калия по ТУ 6-18-24-84), фейерверков, дезинфицирующих средств, диоксида хлора. Из-за высокой опасности составов с хлоратом калия они практически не применяются в производстве взрывчатых веществ для промышленных и военных целей. Очень редко хлорат калия применяется в качестве инициирующего взрывчатого вещества. Иногда используется в пиротехнике, в результате получают цветнопламенные составы. Раньше соль применяли в медицине: слабые растворы этого вещества (KClO3) некоторое время применялись как антисептик для наружного полоскания горла. Соль в начале 20 века использовали для получения кислорода в лабораторных условиях, но из-за опасности экспериментов они были прекращены.
Получение калия хлората
Одним из следующих способов: хлорированием гидроокиси калия, в результате обменной реакции хлоратов с другими солями, электрохимическим окислением в водных растворах хлоридов металлов — может быть получена бертолетова соль. Получение ее в промышленных масштабах чаще осуществляют по реакции диспропорционирования гипохлоритов (солей хлорноватистой кислоты). Технологически процесс оформляют по-разному. Чаще в его основе лежит реакция между хлоратом кальция и хлоридом калия: Ca(ClO3)2 + 2KCl → 2KClO3 + CaCl2. Затем образовавшаяся бертолетова соль из маточного раствора выделяется методом кристаллизации. Также хлорат калия получают по модифицированному методу Бертолле при электролизе хлорида калия: образующийся при электролизе хлор взаимодействует с калия гидроксидом, образовавшийся гипохлорит калия KClO диспропорционирует затем на калия хлорат KClO3 и исходный калия хлорид KCl.
Разложение хлората калия
При температуре примерно 400 ºС происходит разложение бертолетовой соли. В результате выделяется кислород и перхлорат калия: 4KClO3 → KCl + 3KClO4. Следующая стадия разложения протекает при температуре от 550 до 620 ºС: KClO4 → 2O2↑ + KCl. На катализаторах (ими могут быть оксид меди CuO, оксид железа (III) Fe2O3 или оксид марганца (IV) MnO2) разложение протекает при более низкой температуре (от 150 до 300 ºС) и в одну стадию: 2KClO3 → 2KCl + 3O2.
Меры безопасности
Бертолетова соль является неустойчивым взрывоопасным химическим веществом, которое может взорваться при перемешивании, хранении (например, рядом с восстановителями на одной полке в лаборатории или в одном складском помещении), измельчении или других операциях. В результате взрыва может наступить увечье или даже последовать летальный исход. Поэтому при получении, использовании, хранении или транспортировке хлората калия должны соблюдаться требования ФЗ 116. Объекты, на которых организованы эти процессы, относятся к опасным производственным объектам.
Полезна нашему здоровью смесь серы с солью Бертолле
Какие ассоциации приходят вам на ум от словосочетания «хлорат калия»? Если вы не химик, то, скорее всего – никаких. А словосочетание «бертолетова соль»? Уже ближе? Не знаю как для вас, а для меня бертолетка или же бертолетова соль была одним из самых любимых веществ, несмотря на предупреждения:
Так что, на самом-то деле я не советовал бы никому заниматься подобными вещами самостоятельно, без наставников. Вряд ли найдется человек, которому не были дороги собственные пальцы, так что учтите, что бертолетова соль и другие взрывчатые составы отнюдь не игрушки.
Однако когда же началась история этого замечательного вещества? Впервые его получил французский химик Луи Бертолле. В 1786 году он пропустил хлор через горячий концентрированный раствор гидроксида калия: 6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O и получил белый осадок хлората калия (бертолетова соль растворяется в воде гораздо хуже других солей калия). Открытие Бертолле существенно изменило подход к созданию фейерверков, впервые добавив ярких красок в «развлекательные» взрывы, которые до бертолетовой соли были, прямо скажем, скучноваты. «Переворот» в деле организации фейерверков стал возможен благодаря тому, что бертолетова соль стала первым окислителем, который стали добавлять в пиротехнические составы.
При нагревании бертолетова соль разлагается с выделением кислорода. Выделяющийся кислород обеспечивает горение топлива фейерверка, при этом такое пламя оказывается гораздо более горячим, чем пламя, которым горит пиротехнический состав на обычном воздухе. Дополнительная энергия способствует возбуждению электронов атомов, входящих в состав пиротехнической смеси и образованию красивого сочетания цветов.
До Бертолле цвет всех фейерверков был скучно-желтоватый (цвет горячего пороха), зато сейчас, создавая фейерверки, специалисты подбирают такие химические компоненты, которые при вспышке дают определенные цвета. Смесь бария, например, окрашивает пламя в зеленые цвета, соли меди - в зеленые и голубые, соли натрия - в желтые. Литий дает красные тона, магний при горении выделяет сверкающий белый цвет, а стронций - искрящийся красный.
Так или иначе, в наши дни роль бертолетовой соли в создании пиротехнических составов практически сошла на нет по соображениям безопасности – она чересчур реакционноспособна. Например, смесь бертолетовой соли с серой уже небезопасна свойе экстраординарной чувствительностью к трению, и такая смесь была запрещена в Британии еще в 19 веке. В настоящее время окислителем для пиротехники является более стабильный и, следовательно, менее опасный перхлорат калия KClO4.
Еще одна область применения бертолетовой соли, сошедшая на нет, опять же благодаря проблемам, связанным с безопасностью – ее применение при изготовлении взрывчатых составов военного назначения, где она опять же использовалась в качестве окислителя. Так, одним из первых примеров пластиковой взрывчатки, который использовался еще во время Первой Мировой войны, была смесь пластификатора (например воска) и бертолетовой соли.
Тем не менее, бертолетова соль до сих пор используется в качестве взрывчатого вещества, но там, где ее количества настолько малы, что нет необходимости думать о технике безопасности – в пистонах для детских игрушек. Пистоны содержат смесь песка, красного фосфора и хлората калия. Когда боек игрушечного пистолета лупит по песку, в результате трения песчинок друг от друга выделяется достаточно энергии для поджога красного фосфора. Горящий фосфор, в свою очередь, инициирует разложение бертолетовой соли, а кислород, который выделяется при таком разложении, способствует дальнейшему (и более быстрому) горению красного фосфора, в результате чего звучит желанное «БУХ!»
Головки спичек также содержат небольшие количества бертолетовой соли, которая опять же применяется как окислитель. В составе спичечных головок также присутствует и топливо – сера (или сульфид сурьмы) и костяной клей, а также стеклянный порошок. На боках спичечного коробка опять же содержится стекло и красный фосфор. Когда мы чиркаем спичкой по коробку, по сути, повторяется процесс, описанный выше для химии пистона – первоначальный поджог фосфора из-за трения активирует распад бертолетовой соли, кислород ускоряет горение топлива в спичечной головке, после чего огонь перекидывается уже на дерево, из которого изготовлена спичка.В течение определенного времени способность бертолетовой соли (или ее аналога – хлората лития LiClO3, который, хоть и стоит дороже, но из-за меньшей атомной массы лития может выделять больший объем кислорода на один килограмм препарата) высвобождать кислород позволяла применять это соединение в качестве химического «аккумулятора» кислорода. Для получения кислорода, там, где он был необходим – в больницах, на космических кораблях, подводных лодках или самолетах иногда применяли нагревание хлоратов. Такой подход позволял экономить массу и объемы – контейнер с хлоратом занимает меньше места и меньше весит, чем баллон со сжатым кислородом (да, кстати, несмотря на реакционную способность бертолетовой соли, и безопаснее баллона с кислородом).
Таков он – хлорат калия или бертолетова соль – мечта юных химиков. Сейчас он применяется не так часто, как после открытия Луи Бертолле, но до сих пор его можно встретить не только в детских пистолетах, спичках, но и в аккумуляторах кислорода космических кораблей и других аппаратов, рассчитанных на автономные путешествия.
Что такое бертолетовая соль 🚩 доктор ру бертолетовая железа 🚩 Естественные науки
Бертолетовая соль относится к группе кислородсодержащих кислот, образованных хлором. По-другому она называется хлорат калия и ее формула – KClO3. Это ядовитое и взрывоопасное вещество, имеющее самое широкое применение в различных отраслях производства.Своим названием бертолетовая соль обязана французскому химику Клоду Бертолле, который в 1786 году пропустил хлор через горячий концентрированный щелочной раствор (формула реакции 3Cl2 + 6KOH → 5KCl + KClO3 + 3h3O) и получил хлорат калия в виде белого осадка. В настоящее время существуют и другие способы получения бертолетовой соли, например в результате реакции между хлоратом кальция и хлоридом калия (бертолетовая соль здесь выделяется методом кристаллизации) или электрохимическим окислением хлоридов металлов в водных растворах. Хлорат калия выделяется, если пропустить газообразный хлор через 45%-ный раствор K2CO3 или через 30%-ный раствор гидроксида калия (KOH). В домашних условиях бертолетовую соль легко и без специального оборудования можно получить из обычных спичечных головок (выход продукта составляет примерно 9,5 г из 10 коробков спичек) или бытового отбеливателя.
Химические свойства и особенности.
Бертолетовая соль – это бесцветные или белые, солоноватые на вкус кристаллы (ядовитые), растворимые в воде (в 100 см3 воды при температуре 20оС можно растворить около 7,3 г соли), при повышении температуры растворимость увеличивается. Плотность вещества составляет 2,32 г/см3, молекулярная масса - 122,55 атомных единиц массы, температура плавления – 356оС, разложение соли начинается при температуре от 400оС. Хлорат калия при нагревании легко отдает кислород – уравнение реакции 2KClO3=2KCl+3O2.
Поскольку бертолетовая соль является сильным окислителем, чрезвычайно опасно смешивать ее с легко окисляющимися веществами (которые по своим свойствам являются восстановителями) – такими как сахар, крахмал, сера, красный фосфор, сурьма, сажа. Бертолетовая соль легко детонирует при ударе, нагревании, трении (что мы легко можем заметить, используя спички), особенно опасно ее смешение в сухом виде с органическими веществами. Если смесь содержит бромат калия (KBrO3), то возможность взрыва намного возрастает. Это происходит потому, что в присутствии броматов и солей аммония чувствительность бертолетовой соли в смеси с органическими веществами значительно усиливается. При работе с бертолетовой солью будьте очень осторожны! Это крайне неустойчивое взрывоопасное вещество, которое может легко сдетонировать даже при неправильном хранении, размельчении или перемешивании и привести к смерти или инвалидности.
Воздействие на организм человека.
Хлорат калия (как и все хлораты) – ядовитое вещество, при приеме внутрь вызывает тяжелое общее отравление или смерть. Это происходит потому, что под воздействием бертолетовой соли гемоглобин переходит в метгемоглобин, а затем в плазму, и эритроциты больше не могут поглощать кислород. Содержание кислорода в крови опускается до критического, и в течение нескольких часов может наступить смерть от задушения. Если принята меньшая доза бертолетовой соли, то смерть может наступить через несколько дней: эритроциты превращаются в студенистую массу, которая закупоривает капилляры, вызывает расстройство мочеотделения, а также тромбозы и закупорку сосудов. Токсическая доза — 8-10 г, смертельная — 10-30 г.
Лечение отравления бертолетовой солью заключается в насыщении крови кислородом и введением внутривенно щелочного физраствора, а также большого количества мочегонных средств. После того, как кровь будет разведена, под кожу вводят раствор пилокарпина для выведения яда со слюной. При коллапсе назначается камфора. При отравлении хлоратом калия строго противопоказаны спирт, его препараты, а также кислые напитки.
Где применяют бертолетовую соль.
Спектр применения хлората калия очень широк. Бертолетовая соль используется для получения спичек, различных красителей, дезинфицирующих веществ, цветнопламенных составов (фейерверки), диоксида хлора, в СССР она входила в состав запала коктейля Молотова, приготовленного особым способом.
Несмотря на то, что бертолетовая соль при смешении с органическими веществами легко детонирует, как взрывчатое вещество ее используют крайне редко – слишком велика опасность неконтролируемого взрыва. Именно поэтому для военных целей составы с хлоратом калия почти не используются.
Раньше соль в слабых растворах применялась в медицине как легкое наружное дезинфицирующее средство для полоскания горла. Сейчас, ввиду большой ядовитости соли, от этого отказались в пользу других средств.
Какой состав у бертолетовой соли
Научное название бертолетовой соли - хлорат калия. Это вещество имеет формулу KClO3. Впервые хлорат калия получил французский химик Клод Луи Бертолле в 1786 году. Бертолле решил пропускать хлор в нагретый раствор щелочи. Когда раствор остыл - на дно колбы выпали кристаллы хлората калия.Бертолетова соль представляет собой бесцветные кристаллы, которые разлагаются при нагревании. Сначала хлорат калия разлагается на перхлорат и хлорид калия, а при более сильном нагревании перхлорат калия разлагается на хлорид калия и кислород.
Примечательно, что добавление к бертолетовой соли катализаторов (оксиды марганца, меди, железа) в несколько раз снижает температуру ее разложения.
На реакции разложения хлората калия основано ее использование в составе порохов, пиротехнических смесей и взрывчатых веществ. В смеси с некоторыми веществами бертолетова соль становится настолько чувствительной, что взрывается от небольшого удара.
Самое обычное место, где можно встретить бертолетову соль - это наша кухня. Хлорат калия входит в состав спичечных головок. Иногда хлорат калия используется в качестве антисептического средства и в химии для лабораторного получения кислорода.
Сейчас бертолетову соль в промышленных масштабах получают из гипохлорита кальция. Его нагревают, пока он не превращается в хлорат кальция, а затем смешивают с хлоридом калия. Происходит реакция обмена, в результате которой получается смесь бертолетовой соли и хлорида кальция.
Еще один промышленный способ получения бертолетовой соли состоит в электролизе водных растворов хлорида калия. На электродах сначала образуется смесь гидроксида калия и хлора, затем из них образуется гипохлорит калия, из которого, в конце концов и получается бертолетова соль.
Изобретатель хлората калия Клод Бертолле был врачом и аптекарем. В свободное от работы время он занимался химическими опытами. Клод достиг больших научных успехов - в 1794 году его сделали профессором двух высших парижских школ.
Бертолле стал первым химиком, которому удалось установить состав аммиака, сероводорода, болотного газа и синильной кислоты. Он придумал гремучее серебро и процесс хлорного отбеливания.
Позже Бертолле занимался вопросами национальной обороны и служил советником у Наполеона. По окончании службы Клод основал научный кружок, в который вошли такие известные французские ученые, как Гей-Люссак, Лаплас и Гумбольдт.
описание, формула, свойства :: SYL.ru
Калиевая соль хлорноватой кислоты, или хлорат калия, представляет собой неорганическое соединение, обладающее взрывчатыми свойствами. Высокая чувствительность к трению и реакционная способность ограничивают область его применения в промышленности.
Общее описание
Хлорат калия – твердое вещество в виде кристаллического мелкого порошка белого цвета, не имеющего запаха. Кристаллы обладают пластинчатой, игольчатой или призматической формой. Другое название этого соединения – бертолетова соль. Оно присвоено по имени французского химика Клода Луи Бертолле. Этот ученый впервые синтезировал данное вещество в 1786 году с помощью пропускания хлора через раствор калиевого щелока. Тогда же были открыты и его взрывчатые свойства.
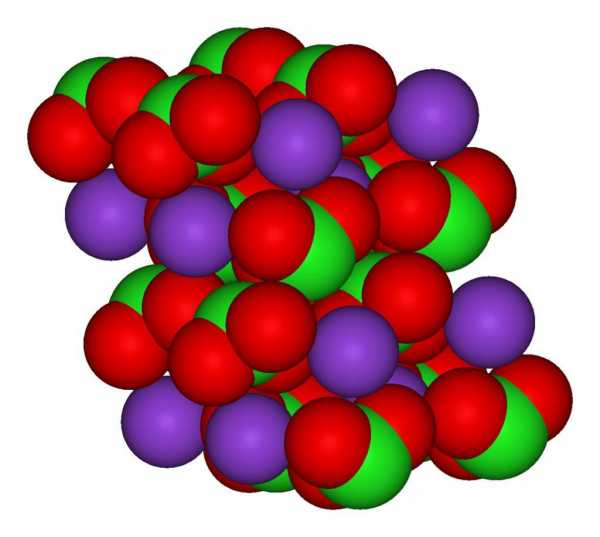
Эмпирическая формула хлората калия имеет вид: ClKO₃.
Структурно вещество представлено на рисунке ниже. Три атома кислорода связаны с атомом хлора посредством ковалентной связи, а взаимодействие атома калия и хлора носит ионный характер.
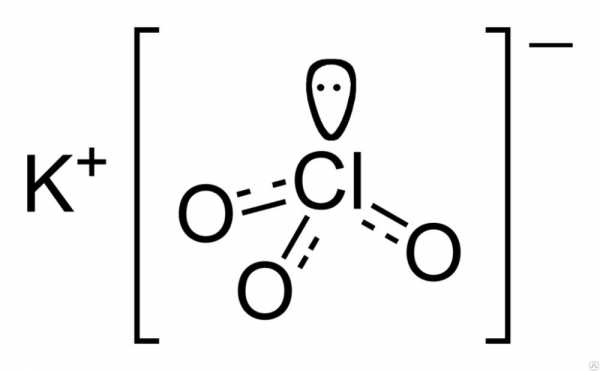
По химическому составу компоненты распределяются таким образом:
- К – 31,92 %;
- Cl – 28,92 %;
- О – 39,16 %.
Химические свойства
Хлорат калия является сильным окислителем. Это свойство использовалось для получения пороха. Данное соединение может «поджечь» многие вещества, поэтому при работе с ним требуется аккуратность.

Данное соединение характеризуется следующими основными химическими свойствами:
- При нагреве до 400 °С происходит его разложение с выделением кислорода и образованием перхлората калия.
- При дальнейшем нагреве происходит выделение О2 и KCl.
- В реакции с сернокислым аммонием в водно-спиртовом растворе наблюдается образование высокобризантного (имеющего большую способность к разрушению) и чувствительного вещества – хлората аммония (NH₄ClO₃).
Интересной особенностью является то, что разложение хлората калия протекает с выделением теплоты, а перхлората – с поглощением ее. У перхлоратов также выше температура воспламенения. Данный факт является преимуществом в обращении с ClKO₄.
Физические свойства
Если в порошке присутствуют примеси Mn, CuO, Fe2O3 Cr2O3 и другие оксиды, то температура разложения сильно снижается (до 200 °C).
Основные физические свойства хлората калия перечислены ниже:
- температура плавления – 356 °C;
- температура кипения – 400 °C;
- гравиметрическая плотность – 2100-2250 кг/м³;
- кристаллическая плотность – 2340 кг/м³;
- молярная масса – 122,594 г/моль;
- растворимость в воде – хорошая (69,9 г /л при температуре 20 °C).
Получение
В химической промышленности синтез хлората калия производится при помощи дисмутации солей хлорноватистой кислоты HClO (реакция самоокисления-самовосстановления). Наиболее распространенным способом является обмен между Ca(ClO₃)₂ и KCl.
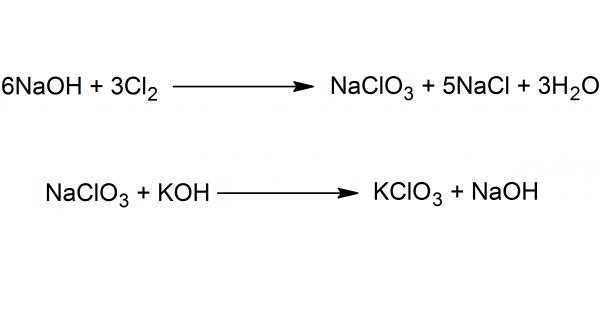
На рисунке ниже представлена схема получения вещества в два этапа - пропусканием хлора через раствор едкого натра с последующей обменной реакцией между хлоратом натрия и каустическим поташем.
Существуют и другие методы – термическое разложение гипохлорита калия, электрохимический метод (электролиз водных растворов хлоридов).
Влияние на живые организмы
Хлорат калия является токсичным веществом. Отравление этим соединением приводит к появлению следующих симптомов:
- при попадании в ЖКТ: боль в эпигастрии, тошнота, рвота;
- при поражении глаз или кожи: раздражение, покраснение;
- при попадании в органы дыхания: кашель, болезненные ощущения, затрудненное дыхание.
Смертельная доза – 1г/кг. Вещество токсично для флоры и фауны природных водоемов.
В качестве первой помощи пострадавшему необходимо предпринять следующие меры:
- вывести на свежий воздух;
- промыть кожу (глаза) чистой водой;
- прополоскать рот водой;
- снять загрязненную одежду.
Меры безопасности
При хранении вещество необходимо беречь от источников тепла и открытого огня. В помещении нельзя курить. Не допускается смешивать соединение с горючими материалами, так как это может привести к взрыву.
При воспламенении хлората калия огонь тушат песком, углекислотой в порошковых огнетушителях. Если произошло возгорание большого количества вещества, то необходимо покинуть опасную зону.
Изготовление взрывчатых веществ
В конце XIX – начале XX века хлорат калия использовался в качестве взрывчатого вещества. На его основе изготавливался так называемый «порох Бертолле», состав которого включал 75 % бертолетовой соли и по 12,5 % серы и угля. В отличие от обычного черного пороха, сделанного из калиевой селитры, данная химическая композиция имеет очень высокую чувствительность к механическому воздействию. От трения или удара порох Бертолле может загореться или взорваться. И хотя по мощности он превосходил все известные виды взрывчатых веществ в то время, химическая неустойчивость предопределила его ограниченное применение. В Швейцарии для повышения безопасности взрывчатых веществ, используемых при строительстве шахт, хлоратные соединения желатинировали.
Во время Первой мировой войны хлорат калия использовался в составе других видов взрывчатых веществ. Так, в Германии успешно применялась «силезия» (80 % ClKO₃ и 20 % смолы, обработанной азотной кислотой). В Австрии такие составы включали ClKO₃ и антраценовое масло. Постепенно хлорат калия, как составной элемент взрывчатых смесей, был вытеснен хлоратом натрия. В 1941-1945 гг. данное соединение входило в терочный состав немецких ручных гранат.
Другие области применения
В настоящее время хлорат калия иногда используется в качестве источника хлора в пиротехнических составах для получения цветного огня. Благодаря ему фейерверк горит интенсивнее и не ослабевает под давлением воздуха. Поэтому данное соединение применяют для ракет-форсов.

Бертолетова соль имеется также в составе спичечных головок. Если соскоблить вещество, собрать его в виде горки на твердом основании и стукнуть молотком, то можно наблюдать явление микровзрыва. Этот пример наглядно иллюстрирует исключительную чувствительность и опасность использования хлората калия.
Данное вещество применялось также некоторое время в качестве антисептического средства для полоскания рта и горла. После того, как были выявлены его токсические свойства, его перестали использовать в медицинских целях.
бертолетова соль — Викисловарь
Тип и синтаксические свойства сочетания[править]
бер-то-ле́-то-ва соль
Устойчивое сочетание (термин). Используется в качестве именной группы.
Произношение[править]
- МФА: [bʲɪrtɐˈlʲetəvə solʲ]
Семантические свойства[править]
Бертолетова сольЗначение[править]
- хим. то же, что хлорат калия, KClO3; сильный окислитель, применяется в пиротехнике ◆ Ему дали груз бертолетовой соли в бочонках из Англии в Архангельск. При выгрузке у пристани от удара эта соль воспламенилась в трюме. Бертолетова соль выделяет кислород ― это раз, так что поддаёт силы пожару. А второе ― она взрывает. Получше пороха. Б. С. Житков, «Храбрость», 1928 г. (цитата из Национального корпуса русского языка, см. Список литературы)
Синонимы[править]
- хлорат калия
Антонимы[править]
- —
Гиперонимы[править]
- хлорат, соль
Гипонимы[править]
- —
Этимология[править]
Происходит от собств. франц. Berthollet (Бертолле, в старинной транскрипции Бертолет), впервые получившего данное вещество.
Перевод[править]
Библиография[править]
Получение хлората калия, бертолетовой соли из отбеливателя
Получение перхлората калия из отбеливателя. Хлорнокислый калий(перхлорат калия) - очень сильное взрывоопасное вещество и
использовалось в прошлом в гранатах, минах во Франции и Германии.
Обычный отбеливатель содержит небольшое количество хлорнокислого калия,
который можно извлечь, следуя инструкции, которая будет изложена далее.
Для приготовления понадобятся следующие вещи
1. Нагреватель (печь, и т.п..)
2. Гидрометр.
3. Эмалированный (или нержавеющий) стальной сосуд (контейнер).
4. Хлористый калий (который можно купить в аптеке, как заменитель пищевой соли, или в хозяйственном магазине, как удобрение).
Возьмите 3 литра отбеливателя, налейте его в сосуд (контейнер) и
нагрейте его. Пока он нагревается, отвесьте 63 грамма хлористого калия и
высыпьте его в нагретый отбеливатель. Постоянно проверяйте смесь
гидрометром, и продолжайте её кипятить до тех пор, пока не получите на
гидрометре значение 1,3.
Полученную смесь охладите в
холодильнике от комнатной температуры до 0 градусов Цельсия.
Отфильтруйте полученные кристаллы и сохраните их. Снова кипятите смесь и
снова охладите ее как прежде. Фильтруйте смесь и сохраните кристаллы.
Продолжайте выполнять последние пункты до тех пор, пока кристаллы
перестанут выпадать.
Возьмите полученные кристаллы, и смешайте
их с дистиллированной водой в пропорции 56 граммов кристаллов на 100
миллилитров дистиллированной воды. Нагрейте эту смесь до кипения и
охладите ее. Профильтруйте смесь и сохраните кристаллы, образовавшиеся
при охлаждении. В результате должен получиться сравнительно чистый
перхлорат калия.
Измельчите кристаллы до состояния косметической
пудры. Теперь расплавьте пять частей вазелина с пятью частями воска
(парафина, стеарина). Растворите это в чистом бензине и влейте эту
жидкость в 90 частей хлорнокислого калия (поверх измельченных
кристаллов) в пластиковую чашку. Перемешивайте эту жидкость до намокания
смеси. Далее испарите бензин (просто выставьте смесь на улицу). После
испарения бензина произойдет пластификация вещества и оно будет готово.
Полученное вещество легко формируется в любую желаемую форму, затем его
следует окунуть в расплавленный воск для гидроизоляции. Для взрыва
вещества используют детонаторы, но можно просто поджечь его при помощи
бикфордова шнура.
[c]
[spoiler=Открыть видео]
[video]http://youtu.be/yafdhulZM_A[/video]
[/spoiler]
[/c]
Ссылка на источник: Получение хлората калия, бертолетовой соли из отбеливателя
СОЛЬ БЕРТОЛЕТОВА - это... Что такое СОЛЬ БЕРТОЛЕТОВА?
- СОЛЬ БЕРТОЛЕТОВА
- — хлорноват-кислыйкалий. Изобретен французским химиком К. Бертолле в 1788 г. Бертолетовасоль стала первым ударным составом, используемым для воспламенения заряда .
Энциклопедия вооружений. 2014.
- СОЛА СУПЕР
- СОНАЗ
Смотреть что такое "СОЛЬ БЕРТОЛЕТОВА" в других словарях:
Соль - получить на Академике действующий промокод Косметика Проф или выгодно соль купить со скидкой на распродаже в Косметика Проф
Соль Бертолетова — см. Хлорноватые соли, Калий, Хлор … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
соль — сущ., ж., употр. сравн. часто 1. Солью называется белое кристаллическое вещество, употребляемое как приправа к пище. Крупная, мелкая соль. | Поваренная, столовая, йодированная соль. | Пачка соли. 2. Голая соль! Одна соль! говорят о чём либо… … Толковый словарь Дмитриева
бертолетова — Berthollet. Кристаллический белый порошок, применяемый в химической промышленности, спичечном производстве, пиротехнике; хлорат калия. БАС 2. Начало темнеть, и темнело сверху слоями. Сыпалось что то вроде бертолетовой соли. В. Башкин Белая смерть … Исторический словарь галлицизмов русского языка
СОЛЬ — 1. СОЛЬ1, соли, мн. соли, солей, жен. 1. Химическое соединение, вещество, представляющее собою продукт полного или частичного замещения водорода кислоты металлом (хим.). Основные соли. Двойные соли. Отложение солей в суставах (при подагре).… … Толковый словарь Ушакова
СОЛЬ — 1. СОЛЬ1, соли, мн. соли, солей, жен. 1. Химическое соединение, вещество, представляющее собою продукт полного или частичного замещения водорода кислоты металлом (хим.). Основные соли. Двойные соли. Отложение солей в суставах (при подагре).… … Толковый словарь Ушакова
СОЛЬ — 1. СОЛЬ1, соли, мн. соли, солей, жен. 1. Химическое соединение, вещество, представляющее собою продукт полного или частичного замещения водорода кислоты металлом (хим.). Основные соли. Двойные соли. Отложение солей в суставах (при подагре).… … Толковый словарь Ушакова
БЕРТОЛЕТОВА СОЛЬ — то же, что калия хлорат … Большой Энциклопедический словарь
БЕРТОЛЕТОВА — и БЕРТОЛЕТОВАЯ соль. см. соль. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
БЕРТОЛЕТОВА — и БЕРТОЛЕТОВАЯ соль. см. соль. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
БЕРТОЛЕТОВА — и БЕРТОЛЕТОВАЯ соль. см. соль. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова