Что это такое фолдинг
Фолдинг. Биологическая химия
Фолдинг белков – процесс сворачивания полипептидной цепи в правильную пространственную структуру. При этом происходит сближение удаленных аминокислотных остатков полипептидной цепи, приводящее к формированию нативной структуры. Эта структура обладает уникальной биологической активностью. Поэтому фолдинг является важной стадией преобразования генетической информации в механизмы функционирования клетки.
Структура и функциональная роль шаперонов в фолдинге белков
В процессе синтеза полипептидных цепей, транспорта их через мембраны, при сборке олигомерных белков возникают промежуточные нестабильные конформации, склонные к агрегации. На вновь синтезированном полипептиде имеется множество гидрофобных радикалов, которые в трёхмерной структуре спрятаны внутри молекулы. Поэтому на время формирования нативной конформации реакционноспособные аминокислотные остатки одних белков должны быть отделены от таких же групп других белков.
Во всех известных организмах от прокариотов до высших эукариотов обнаружены белки, способные связываться с белками, находящимися в неустойчивом, склонном к агрегации состоянии. Они способны стабилизировать их конформацию, обеспечивая фолдинг белков. Эти белки получили название шаперонов.
Классификация шаперонов (Ш)
В соответствии с молекулярной массой все шапероны можно разделить на 6 основных групп:
1. высокомолекулярные, с молекулярной массой от 100 до 110 кДа;
2. Ш-90 – с молекулярной массой от 83 до 90 кДа;
3. Ш-70 – с молекулярной массой от 66 до 78 кДа;
4. Ш-60;
5. Ш-40;
6. Низкомолекулярные шапероны с молекулярной массой от 15 до 30 кДа.
Среди шаперонов различают: конститутивные белки (высокий базальный синтез которых не зависит от стрессовых воздействий на клетки организма), и индуцибельные, синтез которых в нормальных условиях идёт слабо, но при стрессовых воздействиях на клетку резко увеличивается. Индуцибельные шапероны относятся к «белкам теплового шока», быстрый синтез которых отмечают практически во всех клетках, которые подвергаются любым стрессовым воздействиям. Название «белки теплового шока» возникло в результате того, что впервые эти белки были обнаружены в клетках, которые подвергались воздействию высокой температуры.
Роль шаперонов в фолдинге белков
При синтезе белков N-концевая область полипептида синтезируется раньше, чем С-концевая область. Для формирования конформации белка нужна его полная аминокислотная последовательность. Поэтому в период синтеза белка на рибосоме защиту реакционно-способных радикалов (особенно гидрофобных) осуществляют Ш-70.
Ш-70 – высококонсервативный класс белков, который присутствует во всех отделах клетки: цитоплазме, ядре, митохондриях.
Фолдинг многих высокомолекулярных белков, имеющих сложную конформацию (например, доменное строение), осуществляется в специальном пространстве, сформированном Ш-60. Ш-60 функционируют в виде олигомерного комплекса, состоящего из 14 субъединиц.
Шапероновый комплекс имеет высокое сродство к белкам, на поверхности которых есть элементы, характерные для несвёрнутых молекул (прежде всего участки, обогащённые гидрофобными радикалами). Попадая в полость шаперонового комплекса, белок связывается с гидрофобными радикалами апикальных участков Ш-60. В специфической среде этой полости, в изоляции от других молекул клетки происходит выбор возможных конформаций белка, пока не будет найдена единственная, энергетически наиболее выгодная конформация.
Высвобождение белка со сформированной нативной конформацией сопровождается гидролизом АТФ в экваториальном домене. Если белок не приобрёл нативной конформации, то он вступает в повторную связь с шапероновым комплексом. Такой шаперонзависимый фолдинг белков требует затрат большего количества энергии.
Таким образом, синтез и фолдинг белков протекает при участии разных групп шаперонов, препятствующих нежелательным взаимодействиям белков с другими молекулами клетки и сопровождающих их до окончательного формирования нативной структуры.
Роль шаперонов в защите белков клеток от денатурирующих стрессовых воздействий
Шапероны, участвующие в защите клеточных белков от денатурирующих воздействий, как уже говорилось выше, относят к белкам теплового шока (БТШ) и в литературе часто обозначают как HSP (англ. heat shock protein).
При действии различных стрессовых факторов (высокая температура, гипоксия, инфекция, УФО, изменение рН среды, изменение молярности среды, действие токсичных химических веществ, тяжёлых металлов и т.д.) в клетках усиливается синтез БТШ. Имея высокое сродство к гидрофобным участкам частично денатурированных белков, они могут препятствовать их полной денатурации и восстанавливать нативную конформацию белков.
Установлено, что кратковременные стрессовые воздействия увеличивают выработку БТШ и повышают устойчивость организма к длительным стрессовым воздействиям. Так, кратковременная ишемия сердечной мышцы в период бега при умеренных тренировках значительно повышает устойчивость миокарда к длительной ишемии. В настоящее время перспективными исследованиями в медицине считают поиски фармакологических и молекулярно-биологических способов активации синтеза БТШ в клетках.
Болезни, связанные с нарушением фолдинга белков
Расчёты показали, что лишь небольшая часть теоретически возможных вариантов полипептидных цепей может принимать одну стабильную пространственную структуру. Большинство же таких белков может принимать множество конформаций с примерно одинаковой энергией Гиббса, но с различными свойствами. Первичная структура большинства известных белков, отобранных эволюцией, обеспечивает исключительную стабильность одной конформации.
Однако некоторые растворимые в воде белки при изменении условий могут приобретать конформацию плохо растворимых, способных к агрегации молекул, образующих в клетках фибриллярные отложения, именуемые амилоидом (от лат. аmylum – крахмал). Так же, как и крахмал, амилоидные отложения выявляют при окраске ткани йодом.
Это может происходить:
1. при гиперпродукции некоторых белков, в результате чего увеличивается их концентрация в клетке;
2. при попадании в клетки или образовании в них белков, способных влиять на конформацию других молекул белка;
3. при активации протеолиза нормальных белков организма, с образованием нерастворимых, склонных к агрегации фрагментов;
4. в результате точечных мутаций в структуре белка.
В результате отложения амилоида в органах и тканях нарушаются структура и функция клеток, наблюдаются их дегенеративные изменения и разрастание соединительнотканных клеток. Развиваются болезни, называемые амилоидозами. Для каждого вида амилоидоза характерен определённый тип амилоида. В настоящее время описано более 15 таких болезней.
Данный текст является ознакомительным фрагментом.Читать книгу целиком
Поделитесь на страничкеФолдинг «воочию»
Фолдинг — физический процесс пространственной укладки биополимеров — одна из наиболее актуальных проблем современной физико-химической биологии. До сих пор никому ещё не удавалось проследить за сворачиванием одной-единственной молекулы в реальном времени. И вот, исследователи из Стэнфорда сконструировали оригинальный молекулярный манипулятор, позволивший им «растянуть» молекулу мРНК, содержащую аденин-чувствительный рибоселектор (riboswitch), и дать ей свернуться вновь. Анализ «профилей сил», возникающих при таком растягивании, позволил впервые «увидеть» последовательные стадии фолдинга молекулы и даже отследить событие связывания аденина этой мРНК.
Процесс сворачивания биомакромолекул в уникальную, только им свойственную форму, часто называют фолдингом (от англ. to fold — сворачивать, складывать). Физические явления, лежащие в основе фолдинга (а значит, и всей физики белка), до сих пор до конца не поняты. Вследствие этого, теоретическое предсказание пространственной структуры белков или нуклеиновых кислот — в общем случае неразрешённая задача, где лишь на отдельных примерах удаётся достигнуть определённого успеха. С другой стороны, экспериментально полученные структуры биологических молекул дают нам уже результат фолдинга и мало что говорят о процессах, управляющих пространственной укладкой. Судить же о самом процессе сворачивания до сих пор можно было лишь по косвенным биохимическим или микрокалориметрическим данным, не позволяющим понять детали этого явления.
Исследователи из Стэндорда под началом Стивена Блока (Steven Block) докладывают о весьма значимом результате: им впервые удалось в реальном времени проследить за сворачиванием достаточно сложной единичной молекулы [2]. Такое наблюдение удалось проделать с помощью оригинального молекулярного манипулятора, позволяющего «вытягивать» молекулу из «нативного» (полностью свёрнутого) в полностью распрямлённое состояние и фиксировать степень «вытянутости» в зависимости от приложенной силы («силовой профиль вытягивания»). Анализ этих профилей позволил судить и о стадиях фолдинга и о промежуточных состояниях, в которых одни структурные элементы уже «расплелись», а другие ещё нет, и даже о связывании низкомолекулярных соединений, влияющих на энергетику молекулы наравне с образованием элементов вторичной структуры.
Молекулой, для которой впервые пронаблюдали последовательные стадии сворачивания, стала матричная РНК (мРНК), содержащая в 5′-нетранслируемой области аденин-чувствительный рибоселектор (riboswitch) — особым образом упакованный участок молекулы РНК, способный, подобно рецептору, связывать низкомолекулярные соединения (в этом случае — аденин). Связывание происходит в «ядре» рибоселектора — аптамере, меняющем при этом взаимодействии конформацию, что влияет на интенсивность трансляции всей мРНК и, следовательно, активность соответствующего гена. Например, если среда богата аденином, активность гена, содержащего адениновый рибоселектор, снижается — так, в частности, регулируется метаболизм нуклеотидов. (По аналогии с природными аптамерами с помощью in vitro-селекции можно получать искусственные ДНК или РНК, связывающие малые молекулы, но это уже совсем другая история.)
Прибор, с помощью которого производились манипуляции с РНК и измерялись силы, образно называется «лазерным пинцетом» — из-за его способности перемещать субмикронные объекты с помощью сфокусированного лазерного луча. В области фокусировки образуется своеобразная «оптическая ловушка» — из-за действующих на «пойманный» объект сил, порождаемых рассеянием света. Перемещая луч, можно заставить двигаться и объект в «ловушке», одновременно по динамике изменения положения рассчитывая действующие на него силы. «Пинцет» позволяет развивать (и, соответственно, измерять) усилия порядка пиканьютон (пН) — характерных значений «тяги» молекулярных машин, таких как кинезин, перемещающийся по микротрубочкам или РНК-полимераза, продвигающаяся по ДНК (кстати, эти объекты тоже исследуются в лаборатории Блока).
Поскольку синтез и сворачивание биополимеров неразделимы, изучение фолдинга мРНК проводилось котранскрипционно (рис. 1). Отдельная молекула РНК-полимеразы (РНК-Пол) из E. coli, синтезировавшая in situ по подготовленному ДНК-шаблону (рис. 1а) молекулу мРНК, была прикреплена к пластиковой бусине, находящейся в одной из «оптических ловушек» экспериментальной установки (рис. 1б). Первичный РНК-транскрипт, появляющийся с РНК-полимеразы, комплементарен «липкому концу» 3-кб двуцепочечной ДНК, противоположным концом присоединённой к другой бусине, зафиксированной во второй «оптической ловушке». Таким образом получается фигура, напоминающая гантелю, ДНК-«рукоятка» которой служит для того, чтобы увеличить расстояние между бусинами, без неё бывшее бы слишком маленьким. Управляя положением бусин в «ловушках», исследователи могли увеличивать расстояние между молекулой РНК-Пол и 5′-концом мРНК, заставляя молекулу «расплетаться», а потом сворачиваться вновь. Записываемые при этом «профили растяжения» являлись основным источником информации, на основании которой делали выводы о последовательностях событий, сопровождающих фолдинг/дефолдинг. (Другими словами, исследователи, конечно, не могли «видеть», как сворачивается и разворачивается отдельная молекула — они судили об этом, наблюдая в микроскоп за движением микронного размера шариков, управляемых лазером.)
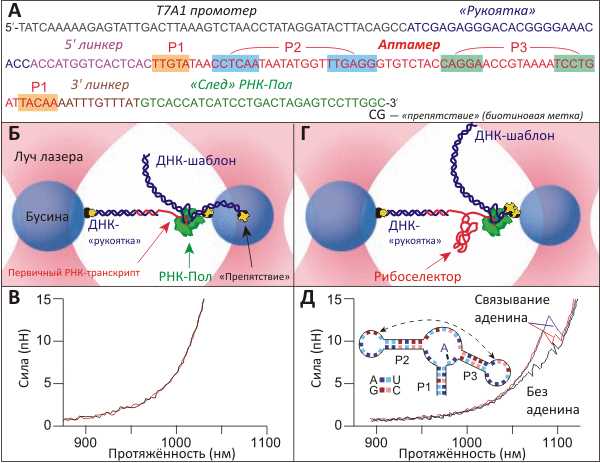
Рисунок 1. Изучение стадий и характеристик сворачивания аденинового рибоселектора. А. ДНК-шаблон, с которого происходит транскрипция изучаемой мРНК. Показаны: нетранскрибируемый промотер, 25-остаточный участок, гибридизующийся с ДНК-«рукояткой» (см. Б), pbuE рибоселекторный аптамер из Bacillus subtilis (спаривающиеся остатки подсвечены) с парой линкеров с обоих концов. Б. Эксперимент проводился в паре «оптических ловушек», созданных сфокусированными лучами лазера. Левая бусина заключена в более «тугую» ловушку и может считаться неподвижной; к ней прикреплена ДНК-«рукоятка», служащая для увеличения расстояния между двумя бусинами, суммарный радиус которых намного превышает размер изучаемой молекулы РНК. Свободный конец ДНК гибридизуется с 5′-последовательностью мРНК, синтезируемой РНК-полимеразой (РНК-Пол) по ДНК-матрице. В. Два «силовых профиля», полученных при «растягивании» мРНК на стадии, пока транскрибируемый аптамер ещё не образовал выраженных вторичной и третичной структуры. Г. На этой стадии эксперимента ДНК-шаблон полностью транскрибирован, и РНК-полимераза блокирована молекулой стрептавидина, связанного биотиновой меткой-«препятствием». Транскрипт представляет собой полностью уложенный рибоселектор. Д. «Силовые профили растяжения» полностью синтезированной и упакованной молекулы рибоселектора указывают на определённую последовательность событий при дефолдинге аптамера. Без добавления аденина в среду на профиле (чёрная кривая) заметно два события — расплетение «шпилек» P2 и P3 (структура аптамера дана на врезке). Аденин, связываемый аптамером, изменяет картину дефолдинга (красная и синяя кривые).
«Силовой профиль растяжения», характеризующий распрямление молекулы в зависимости от приложенной силы (когда «ловушки» разводятся в разные стороны с постоянной скоростью), показал, что первичный транскрипт, представляющий собой лишь часть аптамера, неструктурирован (рис. 1в). В то же время, на профиле, записанном сразу после окончания транскрипции аптамера, заметны характерные пики (рис. 1д), говорящие о том, что мРНК образовала определённые элементы вторичной структуры. В отсутствие аденина профиль искажают два маленьких пика, положение которых позволяет заключить, что они относятся к расплетению «шпилек» P3 и P2 (на рис. 1д показаны соответствующие профили и схема строения аптамера). Если же эксперимент проводили с добавлением аденина, который связывался аптамером, профиль искажался значительно сильнее, свидетельствуя о стабилизации структуры аптамера.
Детальный анализ 800 «профилей растяжения» молекулы позволил рассчитать спектр сил, действующих при фолдинге/дефолдинге аптамера и выявить четыре стадии этого процесса (рис. 2). Как видно из реконструированного «ландшафта» фолдинга, связывание аденина существенно стабилизирует аптамер, увеличивая энергетический разрыв между новым стабилизированным состоянием и промежуточными формами.
Рисунок 2. Состояния аптамера и их энергетические характеристики, изученные в процессе дефолдинга под действием постоянной силы. Энергетический «ландшафт» фолдинга аптамера, получен на основе анализа «профиля растяжения», записанного при 6,5 пН в присутствии (красная кривая) или в отсутствии (чёрная кривая) аденина. Схематично показаны пять вероятных состояний аптамера.
«В чём мы действительно заинтересованы, так это в фундаментальном понимании того, как сворачиваются биомолекулы, и как они выполняют свойственные им функции. Никому ещё не удавалось подробно описать процесс формирования третичной структуры. А ведь аптамерные РНК, в отличие от тех, что просто кодируют информацию, обязательно обладают довольно сложной третичной структурой!» — поясняет свою работу Блок [3].
Используя силу «лазерного пинцета», Блок и коллеги не просто описали энергию, заключающуюся в каждой «складке» мРНК, но и энергию, необходимую для перехода из одного состояния в другое, а также частоту образования/расплетения отдельных элементовструктуры в реальном времени. Учёные, пронаблюдав под микроскопом за движением крохотных пластиковых бусин, напоминающих пару жемчужин в мантии фантастического моллюска, приблизились к пониманию того, как молекула, обладающая уникальным трёхмерным строением, ведёт себя «в жизни». «Взять настоящую молекулу и крутить её как хочешь — это просто клёво», — подводит итог Блок.
- Alexander Serganov, Yu-Ren Yuan, Olga Pikovskaya, Anna Polonskaia, Lucy Malinina, et. al.. (2004). Structural Basis for Discriminative Regulation of Gene Expression by Adenine- and Guanine-Sensing mRNAs. Chemistry & Biology. 11, 1729-1741;
- W. J. Greenleaf, K. L. Frieda, D. A. N. Foster, M. T. Woodside, S. M. Block. (2008). Direct Observation of Hierarchical Folding in Single Riboswitch Aptamers. Science. 319, 630-633;
- First direct observation of 3D molecule folding in real time. (2008). ScienceDaily.
Фолдинг белка - это... Что такое Фолдинг белка?
В биохимии и молекулярной биологии фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура).
Переход первичной структуры полипептида (слева) в третичную структуру (справа).Каждая молекула белка начинает формироваться как полипептид, транслируемый из последовательности мРНК в виде линейной цепочки аминокислот. У полипептида нет устойчивой трёхмерной структуры (пример в левой части изображения). Однако все аминокислоты в цепочке имеют определённые химические свойства: гидрофобность, гидрофильность, электрический заряд. При взаимодействии аминокислот друг с другом и клеточным окружением получается хорошо определённая трёхмерная структура — конформация. В результате на внешней поверхности белковой глобулы формируются полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и с биологическими мембранами.
В редких случаях нативными могут быть сразу две конформации белка (т. н. конформеры). Они могут сильно различаться, и даже выполнять различные функции. Для этого необходимо, чтобы в разных областях фазового пространства белковой молекулы существовали два примерно равных по энергии состояния, каждое из которых будет встречаться в нативной форме с соответствующей вероятностью.
Для стабилизации третичной структуры многие белки в клетке подвергаются посттрансляционной модификации. Весьма часто встречаются дисульфидные мостики между пространственно близкими участками полипептидной цепи.
Для корректной работы белков весьма важна правильная трёхмерная структура. Ошибки сворачивания обычно приводят к образованию неактивного белка с отличающимися свойствами (более подробно это описано в статье Прионы). Считается, что некоторые болезни происходят от накопления в клетках неправильно свёрнутых белков.[1]
В фолдинге участвуют белки-шапероны. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Механизм сворачивания белков до конца не изучен. Экспериментальное определение трёхмерной структуры белка часто очень сложно и дорого. Однако аминокислотная последовательность белка обычно известна. Поэтому учёные пытаются использовать различные биофизические методы, чтобы предсказать пространственную структуру белка из его первичной аминокислотной последовательности.[2]
См. также
Примечания
Ссылки
Фолдинг белков: 1. Физическая основа жизни
Всё состоит из атомов, — и живые существа здесь не исключение. То, что мы воспринимаем (и ощущаем в себе!) как жизнь, сводится в конечном итоге к последовательности огромного числа параллельно протекающих процессов с участием молекул, атомов, электронов.
В этом сюжете мы не будем стремиться охватить все биофизические процессы, идущие в живых организмах, а разберем только один очень наглядный пример — поведение, «жизнь» белковых молекул. У этой «жизни» есть свои этапы. Когда белок синтезируется в клетке, он появляется в виде длинной и тонкой молекулярной цепочки, а затем сворачивается в свою естественную (нативную) форму. Этот процесс называется фолдинг, т. е. укладка белка. Поскольку белковые молекулы сложные, фолдинг протекает не одномоментно, а тоже разбит на отдельные стадии. Упаковавшийся белок уже готов к выполнению своей функции, однако поскольку он продолжает активно двигаться в среде, он иногда слегка расплетается и снова упаковывается.
Некоторые из этих этапов очень быстрые, другие помедленнее, а иные требуют целую вечность с точки зрения атомного движения. Однако эти временные масштабы можно почувствовать, связать друг с другом, понять их происхождение — и вот об этом мы постараемся рассказать.
Первый важнейший масштаб времен для биофизических процессов — время, на котором молекулы начинают шевелиться. В пикосекундном сюжете мы рассказывали о том, как получить оценку этого масштаба, но нелишне будет повторить ее и здесь. Мы берем на вооружение нашу руководящую идею о том, как оценивать времена: типичные расстояния поделить на типичную скорость. Расстояние между атомами в жидкости или твердом теле — несколько атомных размеров, т. е. несколько ангстрем. Типичные скорости движения — это обычные тепловые скорости, которые того же порядка, что и скорость звука в воздухе. Эта простая оценка дает опорный масштаб:
| t ~ | несколько атомных размеров | ~ | 3 Å | = 1 пс. |
| скорость звука в воздухе | 300 м/с |
Это уже почти нужный ответ. Надо еще не забыть одну тонкость: чем легче молекула или атом, тем больше его тепловая скорость. В биологических молекулах есть много атомов водорода, самого легкого из элементов. А значит, самые быстрое атомное движение в биологических молекулах — это колебания атомов водорода, торчащих «ежиком» из всех биологических молекул. Исследования показывают, что типичные периоды колебаний боковых цепочек в аминокислотах, из которых состоят белки, — 15–30 фс. Итак,
| десятки фемтосекунд — элементарный шаг атомного движения в биологических молекулах. |
Это число, образно говоря, задает «тактовую частоту» жизни — этакий временной масштаб мельчайших изменений, из которых потом будет складываться движение белковой молекулы, а дальше и вся жизнь. Конечно, эти слова не надо воспринимать слишком буквально. Мир — не компьютер, и движение молекул вовсе не пошаговое, а плавно развивающееся во времени. Но они должны дать ощущение временного масштаба, начиная с которого уже можно говорить о движении молекулы.
Полученная оценка говорит еще вот о чём. Если мы хотим промоделировать на компьютере атомное движение в молекуле в надежде «просчитать фолдинг», то нам придется сделать шаг по времени существенно меньше этого масштаба. Типичный шаг в таких расчетах — 1 фс, и благодаря этому даже протонные колебания удается представить в виде плавного движения.
Фолдинг белка — лекции на ПостНауке
Важно знать, как сворачиваются белки, потому что они образуют молекулы определенных форм, поверхности, на них есть некое распределение зарядов, затем идут каскады и различные сложные системы взаимодействия между белками, и на этом построена жизнь, когда одни белки взаимодействуют с другими, потом меняют партнеров. Похоже на жизнь людей.
Возможно, задача неправильно поставлена, потому что далеко не каждая молекула белка может свернуться. Оказывается, что все молекулы белка, которые есть у нас с вами, отобраны эволюцией и они сворачиваются. Эти белковые последовательности напоминают мне борхесовские библиотеки, где есть все возможные тексты, которые только есть в природе. Далеко не все последовательности, по-видимому, сворачиваются. Эволюция отобрала те гены, которые кодируют только белки, которые могут во что-то свернуться и выполнить определенную функцию.
Белки находятся на пороге нестабильности. Разрушение структуры белка называется денатурацией. Денатурация — это переход молекулы из сформированной формы в беспорядочный клубок. Мы все существуем на грани термодинамической катастрофы. Наши белки могут почти в любой момент денатурировать, потому что ее вызывают самые разные воздействия внешней среды. Повышение температуры в ходе болезни вызывает денатурацию наших белков. Если болезнь вызвана вирусом, то денатурируют и белки вируса, и наши белки. А температура у нас повышается, потому что мы пытаемся денатурировать белки вируса. Выясняется, что наши белки чуть более стабильны к денатурации, чем белки вируса, поэтому нам с вами плохо, но вирусу еще хуже. Потребление спирта приводит к эффектам такого же рода. И вообще почти все, что с нами происходит, отражается на наших белках, причем не самым лучшим образом — именно потому, что они находятся на грани денатурации. И для клетки это очень большая проблема — собрать белки правильным образом.
Чтобы понять, насколько важно для жизни было решить проблему правильной свертки белков и предотвратить их разворачивание или денатурацию в тех условиях, когда это не должно происходить, можно воспользоваться филогенетическим подходом, то есть посмотреть на все это в истории. Жизнь произошла из единого корня. Было такое существо по имени LUCA, являющееся общим предком для всех форм жизни, которые есть сейчас на Земле, — от человека до бактерий. Про самые биологически важные гены для жизни, про самые важные белки говорят, что они консервативны. Это означает, что они уже были. Неудивительно, что-то, что у нас есть общего со всеми остальными формами жизни, то, чем обладал наш общий предок, — это ферменты или гены, которые кодируют ферменты, необходимые для репликации нашей ДНК. Потому что для разделения клетка должна передать свою ДНК потомкам — гены, продукты, необходимые для транскрипции, чтобы наши гены работали. Гены, продукты которых необходимы для синтеза белка. Это все то, без чего современная жизнь невозможна.
Но одна из групп генов, которая является абсолютно консервативной, — это шапероны. Раньше их называли белками. Одна из групп генов, продукты которых абсолютно консервативны и являются общими в каком-то смысле для всей жизни, — это гены, кодирующие шапероны или белки теплового шока. Это специальные машины в клетке, вся функция которых состоит в том, чтобы неправильно свернутые белки сворачивать обратно. Некоторые из них работают замечательным образом. Это такая большая молекулярно-белковая бочка с отверстием внутри. И количество таких бочек в клетке резко увеличивается, когда, например, у вас повышается температура. Это означает, что у вас происходит тепловой шок. А дальше происходит вот что: все белки, структура которых чуть-чуть нарушилась и стала не такой, какая нужна, идут на починку, все загружаются внутрь этой бочки, и там они как-то проходят через нее. На это тратится энергия, а для клетки это не бесплатно. Наружу из бочки выходит белок, свернутый обратно как надо, — похоже на сказку Ершова про Ивана-дурачка.
Для клетки очень важно сделать так, чтобы белки были правильно собраны. Эта задача непростая потому, что, несмотря на то что белки знают, в какую структуру им нужно собраться, часто внешние условия этому не благоприятствуют, для этого нужна специальная машинерия. И эта машинерия очень-очень древняя. Еще на самой заре жизни было придумано молекулярное устройство, которое позволяло белкам собираться и в то же время быть на грани нестабильности.
Самое удивительное в том, что важно знать про стабильность белков или правильность и неправильность их сворачивания, потому что вещи, связанные с болезнью Альцгеймера или болезнью Крейтцфельдта — Якоба, зависят от болезни свертывания белков. Очень много болезней вызываются просто неправильной сверткой белков.
Я упомянул о том, что белки умеют сворачиваться, а ученые пока что не очень хорошо могут это предсказать. Под предсказанием предполагается, что вы с помощью компьютерного моделирования и каких-то общих принципов хотите придумать алгоритм, который позволял бы вам правильно сворачивать белки. По-видимому, это тот редкий случай, когда новые формы можно назвать научной деятельностью — такой краудсорсинг помогает решить проблему, которую ученые сами по себе решить не могут. Дело в том, что каким-то образом (мы сами не знаем почему) человеческий мозг умеет очень хорошо — по крайней мере, лучше, чем ученые, — решать задачи в духе тетриса, складывать вещи таким образом, чтобы упаковка объектов в трехмерном пространстве была наиболее плотной. А белки сворачиваются до некоторой степени таким же образом. Они пытаются создать самое маленькое пространство.
Несколько лет назад появилась компьютерная игра, а год назад — статьи в престижных научных журналах, авторами которых были странные люди — школьники или, например, американский водитель-дальнобойщик большого грузовика. Почему? Потому что была придумана программа под названием Foldit («Сложи это»). И в этой программе есть правила, которые научны, но цель программы — свернуть последовательность белка наилучшим образом.
Мы уже уходим из предсказания, когда пытаемся из первых принципов решить задачу сворачивания. Мы входим в режим игры, когда вы пытаетесь это делать по-разному. И есть некая система скоринга, которая позволяет сказать, хорошо вы это сложили или плохо. И удивительным образом выясняется, что не нужно обладать кандидатской степенью, для того чтобы сделать это правильно. Белки же тоже не обладают кандидатской степенью. Человеческий мозг может это сделать. Мы просто не можем сами себе объяснить, как мы это делаем. И сейчас проводятся соревнования по всему миру. Есть некоторое количество команд, люди делают это вместе, как я уже сказал, и там иногда очень странные люди с точки зрения их профессий, но делают они благое дело.
Foldit — Википедия
Материал из Википедии — свободной энциклопедии
Фолдит — онлайн-головоломка о фолдинге белка. Игра является частью исследовательского проекта и разработана в Вашингтонском университете. Предмет игры — наилучшим образом свернуть структуру выбранных протеинов; лучшие пользовательские решения анализируются учёными, которые могут с их помощью найти решение реальных научных проблем, связанных с поиском вакцин и биологическими инновациями. Много технических терминов в игре заменены на более понятные для людей без соответствующей подготовки, для того чтобы сделать её доступной для всех. Большинство из лучших игроков «Фолдита» не имеют биохимического образования[2].
История игры началась с проекта распределённых вычислений «Rosetta@home»; некоторые пользователи отметили, что в процессе расчёта видят пути решения, но не могут взаимодействовать с программой для того, чтобы показать их. Основными разработчиками игры стали учёные Дэвид Бэйкер, Дэвид Салесин и Зоран Попович[3][4]; впрочем, в её разработке принимали участие многие пользователи проекта Rosetta. Публичный выпуск бета-версии состоялся в мае 2008 года[5]; с тех пор было зарегистрировано более 240 000 игроков[6].
В 2011 году игроки помогли расшифровать структуру кристалла обезьяньего вируса, ретровирусной протеазы (M-PMV), вызывающей СПИД у обезьян. Головоломка была доступна для игры всего три недели, но расшифровка была произведена уже на десятый день, при этом данная проблема ставила учёных в тупик на протяжении 15 лет[7][8].
В январе 2012 года «Scientific American» сообщил, что игроки завершили первый краудсорсинговый проект по изменению структуры белка, служащего катализатором в реакции Дильса — Альдера, причём новая структура более чем в 18 раз более активна, нежели оригинал[6][9].
Кроме предсказания структуры известных белков и создания новых, которые должны подходить для заданных целей, разработчики «Фолдита» предложили игрокам помочь в создании алгоритмов для автоматизированного выполнения этих задач. Такие «рецепты» создаются или на специальном языке скриптов, или с помощью графического интерфейса. Каждый игрок имеет свою «поваренную книгу» с алгоритмами[10]. Игроки могут делиться «рецептами» друг с другом, совершенствовать и комбинировать алгоритмы других, так, как это происходит в сообществе, занимающемся разработкой свободного программного обеспечения, хотя, при желании, автор может сделать свой рецепт недоступным для других. Возможность редактировать скрипты друг друга создаёт условия для их эволюционирования. По состоянию на август 2010 года наиболее успешными «рецептами» были «Синий предохранитель», который произошёл от «Кислотного твикера v0.5» (за три с половиной месяца исследования разные пользователи использовали его более 24 тысяч раз), и «Землетрясение», использованное около 8 тысяч раз. Выяснилось, что «Синий предохранитель» имеет много общего с неопубликованным «Быстрым расслаблением», над которым работали учёные в лаборатории Бейкера. Сравнение этих двух стратегий между собой и с «Классическим расслаблением» — алгоритмом, который использовался ранее, показало, что они обе эффективнее старого алгоритма. «Быстрое расслабление» всё же давало несколько лучшие результаты чем «Синий предохранитель», что частично связано с тем, что игроки, в отличие от учёных, не имеют доступа ко всем функциям оптимизации «Розетта». Если применить такие же ограничения алгоритма учёных, то он все равно может обеспечить достижение более низких значений энергии, но пользовательский алгоритм быстрее справляется с задачами[10].
Цель головоломки состоит в поиске трёхмерной структуры определённого белка с самым низким уровнем свободной энергии. Каждое задание публикуется на сайте на определённый срок, в течение которого пользователи соревнуются между собой. Существует также набор постоянно доступных головоломок, разработанный для ознакомления новых пользователей с особенностями «Фолдита». Во время игры игроки интерактивно манипулируют молекулой, меняя форму основного каркаса и положение боковых групп, они могут также вращать α-спирали вокруг свои оси, изменять сообщение цепей в β-структурах, накладывать слабые ограничения в определённых участках («rubber bands») или «замораживать» их[2]. Также пользователям предоставляется панель инструментов для выполнения автоматизированных задач, например, команда «wiggle» позволяет локально минимизировать энергию[11]. Пользователь получает информацию о том, насколько хорошо ему удается сворачивать белок, в форме баллов, которые начисляются, в частности, за образование новых водородных связей, сокрытие гидрофобных остатков внутрь молекулы и т. д. Также программа даёт игрокам подсказки, например подсвечивает участки, в которых определенные группы сталкиваются и их следует развести, открытые гидрофобные участки, которые следует скрыть, полости, которые необходимо заполнить[2]. Сайт позволяет пользователям делиться друг с другом вариантами решений, обсуждать их, а также вносить вклад в вики, посвященную «Фолдит»[11].
- ↑ Foldit Standalone | Express Licensing | UW C4C (неопр.) (недоступная ссылка). Дата обращения 18 ноября 2012. Архивировано 19 мая 2012 года.
- ↑ 1 2 3 Cooper S., Khatib F., Treuille A., Barbero J., Lee J., Beenen M., Leaver-Fay A., Baker D., Popović Z., Players F. Predicting protein structures with a multiplayer online game (англ.) // Nature : journal. — 2010. — Vol. 466. — P. 756—760. — doi:10.1038/nature09304. — PMID 20686574.
- ↑ Bourzac, Katherine. «Biologists Enlist Online Gamers» Technology Review, May 8, 2008
- ↑ Bohannon, John. «Gamers Unravel the Secret Life of Protein» Wired (magazine), April 20, 2009
- ↑ Hickey, Hannah. «Computer game’s high score could earn the Nobel Prize in medicine» University of Washington, May 8, 2008
- ↑ 1 2 Marshall, Jessica. Online Gamers Achieve First Crowd-Sourced Redesign of Protein (неопр.). Scientific America (22 января 2012). Дата обращения 22 февраля 2012. Архивировано 9 января 2013 года.
- ↑ Khatib, F.; Dimaio, F.; Cooper, S.; Kazmierczyk, M.; Gilski, M.; Krzywda, S.; Zabranska, H.; Pichova, I.; Thompson, J. Crystal structure of a monomeric retroviral protease solved by protein folding game players (англ.) // Nature Structural & Molecular Biology : journal. — 2011. — Vol. 18, no. 10. — P. 1175. — doi:10.1038/nsmb.2119.
- ↑ Praetorius, Dean. «Gamers Decode AIDS Protein That Stumped Researchers For 15 Years In Just 3 Weeks» The Huffington Post, September 19, 2011
- ↑ Christopher; Eiben; Siegel, Justin; Bale, Jacob; Cooper, Seth; Khatib, Firas; Shen, Betty; Players, Foldit; Stoddard, Barry; Popovic, Zoran; Baker, David. Increased Diels-Alderase activity through backbone remodeling guided by Foldit players (англ.) // Nature Biotechnology : journal. — 2012. — Vol. 30, no. 2. — P. 190—192. — doi:10.1038/nbt.2109. — PMID 22267011.
- ↑ 1 2 Khatib F., Cooper S., Tyka M.D., Xu K., Makedon I., Popovic Z., Baker D., Players F. Algorithm discovery by protein folding game players (англ.) // Proc Natl Acad Sci USA : journal. — 2011. — Vol. 108. — P. 18949—18953. — doi:10.1073/pnas.1115898108. — PMID 22065763.
- ↑ 1 2 Good B.M., Su A.I. Games with a scientific purpose (неизв.) // Genome Biol.. — 2011. — Т. 12. — С. 135. — doi:10.1186/gb-2011-12-12-135. — PMID 22204700.
- fold.it — официальный сайт Foldit
- русскоязычные:
- англоязычные:
фолдинг — Викисловарь
Морфологические и синтаксические свойства[править]
| падеж | ед. ч. | мн. ч. |
|---|---|---|
| Им. | фо́лдинг | фо́лдинги |
| Р. | фо́лдинга | фо́лдингов |
| Д. | фо́лдингу | фо́лдингам |
| В. | фо́лдинг | фо́лдинги |
| Тв. | фо́лдингом | фо́лдингами |
| Пр. | фо́лдинге | фо́лдингах |
фо́л-динг
Существительное, неодушевлённое, мужской род, 2-е склонение (тип склонения 3a по классификации А. А. Зализняка).
Корень: --.
Произношение[править]
- МФА: ед. ч. [ˈfoɫdʲɪnk], мн. ч. []
Семантические свойства[править]
Значение[править]
- процесс формирования пространственной структуры белка ◆ Байесовская сеть может моделировать отдельный аспект функционирования клеток, например регуляцию генов или фолдинг белка, но только логика может сложить фрагменты в связную картину. Педро Домингос, «Верховный алгоритм», 2016 г.
Синонимы[править]
Антонимы[править]
Гиперонимы[править]
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
От ??
Фразеологизмы и устойчивые сочетания[править]
Перевод[править]
| Список переводов | |
Библиография[править]
Фолдинг белка • Игорь Иванов • Научно-популярные задачи на «Элементах» • Физика, Биология
Энергия абсолютно прямой цепочки равна нулю. Для того чтобы понизить ее, некоторые звенья должны слипнуться. Но для этого цепочка должна организовать петлю, и наличие петли повышает энергию. Если петля слишком длинная, то большое количество звеньев, которые могли бы связаться друг с другом, остаются без связи. Эти звенья можно соединить, словно на застежке-молнии, укоротив тем самым петлю, но от этого увеличится ее энергия упругости. Поэтому надо найти такую оптимальную длину петли, при которой силы упругости, расширяющие петлю, и силы связи, ее «застегивающие», сбалансированы.
Энергия петли
Пусть имеется петля из m несклеенных звеньев (рис. 2). Характерный угол между соседними звеньями в ней — примерно 2π/m. (На самом деле, этот угол меняется от звена к звену, поскольку наиболее выгодная форма петли вовсе не круговая, но для приближенного исследования наша оценка вполне пойдет.) Таких соединений имеется m штук, поэтому петля обладает энергией 2π2A/m. Застегнем ее еще на одно звено. Тогда петля станет короче на два звена, а энергия всей цепочки изменится на величину
Если же, наоборот, разорвать одну связь, то энергия цепочки изменится на
Петля из m звеньев является оптимальной, когда оба эти изменения энергии положительны, то есть с энергетической точки зрения петлю невыгодно ни удлинять, ни укорачивать. Поскольку B много меньше A, ясно, что величина m получится значительно больше единицы. Поэтому для примерной оценки оптимального m эти два неравенства можно заменить одним равенством:
Таким образом, оптимальная длина петли примерно равна
Во всех последующих формулах под буквой m будет подразумеваться именно оптимальная длина петли. Наконец, полезно найти энергию упругости такой оптимизированной петли; она получается равной
Это выражение (энергия петли в m/2 раз больше величины B) очень удобно для дальнейших вычислений.
Когда появляется петля?
Теперь легко выяснить, при цепочке какой длины будет выгоднее не оставаться прямой, а свернуться в петлю с «двойным хвостиком» длины n. Для этого нужно, чтобы полная энергия такой конфигурации была отрицательна:
Таким образом, если длина цепочки N > m + 2(m/2) = 2m, то ей выгоднее образовать петлю.
Когда появляется вторая петля?
«Двойной хвостик» — это не максимально удобная конфигурация, поскольку в каждом звене «работает» только один из контактных участков, а хотелось бы, чтоб работали оба, хотя бы у некоторых звеньев. Это можно устроить, образовав вторую петлю (рис. 3).
Для того, чтобы сосчитать, когда переход к двум петлям энергетически выгоден, возьмем цепочку длины N и сосчитаем ее энергию для одной петли и для двух петель:
Условие для перехода к двумя петлям, E1 > E2, тогда даст N > 8m.
Очень длинная цепочка
Когда цепочка становится очень длинной, ее удобно сворачивать так, чтобы как можно большее количество звеньев было склеено обоими своими контактными участками. Таким образом мы получаем конфигурацию, напоминающую обрамленное петельками полотно. Если закрыть глаза на то, что соседние петли мешают друг другу, можно провести аналогичное вычисление и найти наиболее выгодное количество петель для заданного N (оно растет пропорционально квадратному корню из N). Если же учесть, что петли мешают друг другу, то вычисления резко усложнятся. Однако общая структура останется той же: наиболее выгодным будет плоское полотно некоторой формы, обрамленное по краям петельками. Желающие могут попробовать найти оптимальную форму полотна с помощью компьютерного моделирования, а также поразмышлять над аналогичной задачей в трехмерном пространстве.
Фолдинг белков превратили в компьютерную игру / Habr
Потрясающую игру разработали учёные из Вашингтонского университета (США). Программа под названием Fold.it представляет собой модель сворачивания белков в трёхмерные конструкции. Геймер должен попытаться сделать это наиболее удачным образом. В программу будут загружаться реальные данные о настоящих, только что изобретённых протеинах, которые непонятно как сворачиваются. Результаты отправятся через интернет в центр обработки, где их проверят на суперкомпьютере (это будет с осени, а пока что в программу заложены уже решённые загадки, так что сейчас она выполняет роль тренажёра).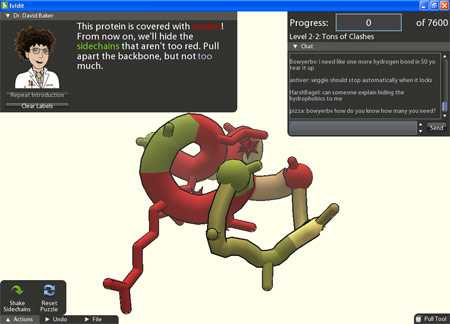
В самом деле, все геймеры нашего мира тратят миллиарды человеко-часов на бесполезные для человечества игры типа WoW, Counter-Strike или пасьянса «Косынка». В то же время они могли бы использовать интеллект более эффективно: например, сворачивая белки на экране своего монитора. Это ведь тоже по-своему интересно.
Один из разработчиков игры, профессор биохимии Дэвид Бейкер, искренне верит, что где-то в мире живут таланты, у которых есть врождённая способность просчитывать в уме 3D-модели протеинов. Какой-нибудь 12-летний мальчик из Индонезии увидит игру и сможет решить задачи, которые не под силу даже суперкомпьютеру. Кто знает, может, такие люди действительно есть?
Каждый протеин (в человеческом теле их более 100 000 видов) представляет собой длинную молекулу. Предсказать, в какую замысловатую форму свернётся эта молекула в тех или иных условиях (и способна ли она вообще свернуться в какую-либо устойчивую форму) — задача высшей степени сложности. Компьютерное моделирование представляет собой ресурсоёмкий процесс, но в то же время критически важный в фармацевтике. Ведь не зная формы белка невозможно смоделировать его свойства. Если же эти свойства являются полезными, то протеины можно синтезировать и на их базе сделать новые эффективные препараты, например, для лечения рака или СПИДа (Нобелевская премия гарантирована в обоих случаях).
В настоящее время над обсчитыванием модели каждой новой молекулы белка трудятся сотни тысяч компьютеров в распределённой вычислительной сети, однако ученые из Вашингтонского университета предлагают другой способ: не тупой перебор всех вариантов, а интеллектуальный мозговой штурм через компьютерную игру. Количество вариантов сокращается на порядок, а суперкомпьютер гораздо быстрее найдёт правильные параметры фолдинга.
В трёхмерную «развлекалку» Fold.it могут играть все: даже дети и секретарши, которые понятия не имеют о молекулярной биологии. Разработчики постарались сделать такую игру, чтобы она была интересна каждому. А результат игры вполне может стать основой для Нобелевской премии и спасти жизни тысяч людей.
Программа выпущена в версиях под Win и Mac. Дистрибутив размером 53 МБ можно скачать после регистрации.
что это такое? Схемы и шаблоны, техники и мастер-классы изготовления открыток, самые интересные поделки
Новогодние поделки
Оригинальный стиль любого интерьера предполагает не только необычный дизайн, но также и интересный декор. Очень эффектно выглядят предметы, созданные своими руками — благодаря присущей им уникальности и продуманности они гармонично вписываются в любое помещение.
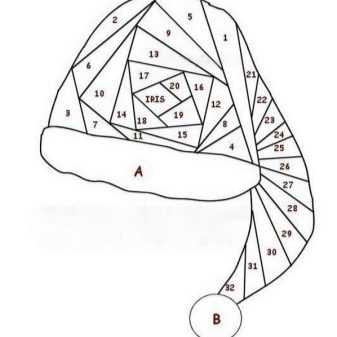
Одной из самых востребованных в наши дни техник при создании предметов декора для комнат стала аппликация, получившая название айрис фолдинг. При помощи этого метода можно создавать небольшие картины, а также довольно внушительные панно.

Что это такое?
Наименование техники предполагает так называемое радужное складывание — разноцветные полосы бумаги особым образом размещают друг за другом в форме закручивающейся спирали под небольшим углом относительно друг друга.
Каждый мастер-класс по айрис фолдингу включает в себя несколько этапов работы. Для начала на картоне обозначают узор, который затем вырезают по контуру. После этого формируют специальные шаблоны, форма которых должна совпадать с моделью завершённой работы. Все элементы шаблона обозначают числами — это нужно для того, чтобы была понятна очередность наклеивания разноцветных полосок.


Далее вырезают требуемое число цветных фрагментов — это надо делать с тем расчётом, что лист придётся складывать несколько раз для придания изображению объемности и необходимой прочности. Бумажные полоски фиксируют по сторонам рисунка таким образом, чтобы каждая последующая слегка прикрывала предыдущую.
Несмотря на всю кажущуюся сложность, на практике освоение техники не представляет никаких проблем даже для начинающих рукодельниц, а опытные мастерицы могут создавать этим способом настоящие шедевры.
Изначально картины в технике айрис фолдинг создавались из обычной цветной бумаги, однако с течением времени методика совершенствовалась, и сегодня, кроме бумаги, мастера часто используют атласные ленты и картон. Элементы в технике айрис фолдинг встречаются в виде декора на картинах, панно, а также коллажах и открытках. Впрочем, они могут создаваться и как самостоятельная композиция.
История возникновения
Родиной техники айрис фолдинг являются Нидерланды – голландские мастера из картона и разноцветной бумаги изготавливали большие объёмные картины со спиральным принтом. Получившиеся шедевры чем-то напоминали диафрагмы популярных в то время фотоаппаратов, а также были визуально похожи на радужку глаз.
Техника довольно быстро набрала популярность среди голландских мастеров, а вскоре пришла и в другие страны Старого Света. Секрет успеха айрис фолдинг объясняется легкостью изучения принципов методики, доступностью и низкой стоимостью расходных материалов, а также возможностью самостоятельного составления трафаретов и схем.


Поделки в направлении айрис фолдинг привлекают своим видом и буквально мотивируют на творчество. Самые простые варианты доступны для работы детям дошкольного возраста, с усложненными моделями они знакомятся уже в более взрослом возрасте.
Данная техника очень нравится молодым мамам и становится постоянным хобби для девушек и женщин, сфера интересов которых связана с развитием детей. Кроме того, она является источником вдохновения для мастериц, находящихся в поисках нетрадиционных техник и отработки методов совмещения уже изученных.

Техники
Существует два базовых направления айрис фолдинг в зависимости от метода формирования рисунка.
В первом исполнении спиралька прокручивается так, чтобы в сердцевине образовалось пустое место в виде небольшой фигуры. Этот незанятый участок обычно заклеивают фрагментом картона, материей либо кусочком бумаги. В соответствии со вторым методом работы, полоски размещают так, чтобы середина в конце работы полностью заполнилась — эта технология востребована для изготовления блокнотов, открыток и фотоальбомов.

При желании каждая мастерица может с легкостью дополнить айрис фолдинг любой другой популярной техникой рукоделия.
Материалы и инструменты
Прежде чем начать работу, необходимо определиться с её тематикой. Например, вы можете сделать открытки на Новый год, именины или на День святого Валентина.
Для того чтобы работать над проектом без отрыва, следует заблаговременно приготовить комплект необходимых материалов и инструментов. Вам понадобятся:
- односторонняя цветная бумага 4-5 тонов;
- твердый картон, который можно использовать в качестве основы;
- линейка;
- острые ножницы;
- обычные скрепки;
- карандаш;
- скотч либо клеевой карандаш;
- острый нож.

Дополнительно потребуется плотная база, защищающая стол от царапин и сколов при вырезании.
Схемы и шаблоны
Любая работа, выполняемая мастерицей в айрис-фолдинг, предполагает использование рабочего шаблона или совмещенной композиции из двух-трех шаблонов. Простейшие трафареты накладываются на заранее составленный тематический рисунок. Основными шаблонами для малоопытных рукодельниц служат простейшие геометрические фигуры — треугольник, квадрат или круг. Базовым элементом голландской техники является прямоугольник либо треугольник.
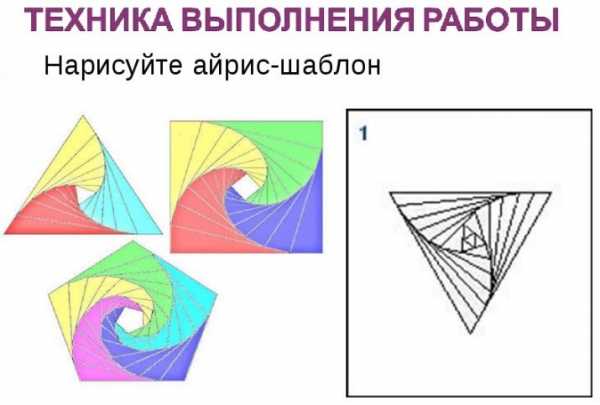
Для оформления рисунка следует приготовить необходимое число элементов, которые должны отличаться между собой по размерам, форме и цвету. Дальше происходит процесс их размещения на подготовленном шаблоне, а также подгонка и финишная фиксация.
Существует большое число готовых шаблонов. Направление айрис фолдинг имеет свои базовые правила — благодаря существующему разнообразию трафаретов форма готового изделия ограничивается только полетом фантазии художника и богатством расходных материалов.


При наличии некоторых навыков работы вы всегда можете создать свой шаблон так, чтобы он идеально соответствовал габаритам поделки. Для этого вам потребуется:
- листок бумаги в клетку;
- простой карандаш;
- ластик.

Прежде чем начать работать, необходимо подобрать основную форму — это может быть круг, треугольник или квадрат. Опытные мастера могут использовать более замысловатые фигуры.
Остановимся подробнее на схеме формирования трафарета на базе квадрата:
- нарисуйте на листке бумаги в клетку квадрат со стороной 14 см;
- на каждой стороне по направлению налево от углов отметьте по 10 мм;
- в результате у вас получится 4 точки, которые нужно соединить между собой – таким образом, получится «квадрат в квадрате»;
- во втором квадрате снова отметьте точки слева на удалении 10 мм, их также надо соединить и сформировать третий квадрат.
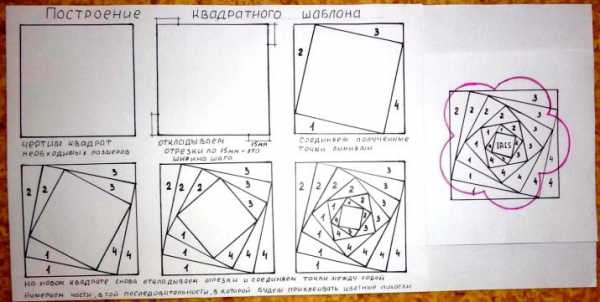
Все манипуляции повторяют до того момента, пока в центральной части не останется маленький квадрат.
Аналогичным образом создаются рабочие шаблоны на базе треугольника. Обращаем внимание на то, что совсем не обязательно делать шаг шириной 10-15мм — он может быть любым в диапазоне от 7 до 25 мм в зависимости от идеи мастера.
На сложных трафаретах обычно проставляют нумерацию — она показывает, какой должна быть последовательность выкладки приготовленных разноцветных полосок в ярких оттеночных схемах. Шаблоны дополнительно маркируют с учётом цветовых пожеланий.
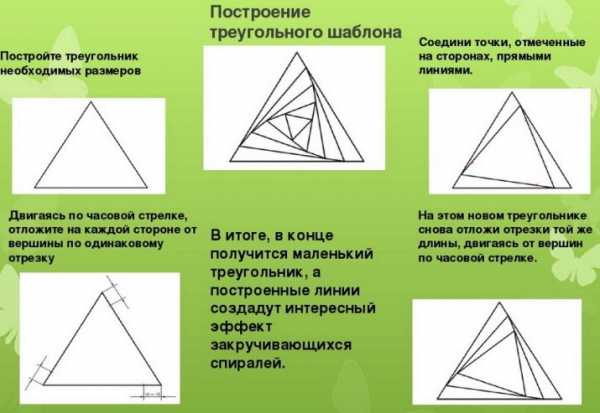
Как сделать поделки?
В зависимости от того, какой именно принт вы планируете делать, айрис фолдинг включает несколько последовательных шагов.
- Для начала необходимо выбрать рисунок, который в дальнейшем вы будете раскладывать.
- Рисунок переносится на картонку либо лист твердой бумаги. Его необходимо обвести, а затем вырезать так, чтобы образовалось окошко — в нем вы будете размещать радужные ленты.
- Далее подбирают шаблон, соответствующий рисунку.
- Лист бумаги с вырезанным на нём контуром рисунка размещается на трафарете тыльной стороной вверх. Затем вся конструкция фиксируется канцелярскими скрепками либо скотчем, чтобы в ходе работы шаблон не смещался.
- Далее необходимо сделать бумажные полоски всех оттенков, из которых вы планируете выкладывать узор.
- Полоски складываются вдвое по длине так, чтобы не были заметны места среза.
- В точном соответствии с используемым шаблоном полосы приклеиваются к бумаге до тех пор, пока все участки не будут полностью заполнены. Полоски необходимо фиксировать внахлёст, то есть с лёгким наслоением, накладывая одну на другую.
- Далее листок бумаги с выложенным принтом снимают с шаблона и проклеивают изнаночную часть картоном.

На этом рисунок закончен — можете переворачивать свою работу и любоваться ею.
К Новому году
В стиле айрис фолдинг можно с лёгкостью сделать новогоднюю елочку, она получится даже у малоопытных рукодельниц или маленьких детей. Оформление подобной открытки включает несколько последовательных шагов.
- Цветную бумагу нескольких оттенков аккуратно нарезают полосками в 4-5 см шириной. Изначально следует сделать не менее 10 полос каждого колера, а их конечное количество может быть скорректировано в процессе дальнейшей работы. Каждую полоску нужно сложить вдвое.
- На листке картона прорисовывают ёлку и осторожно вырезают по контуру ножницами.
- Подбирают подходящий шаблон, потом вырезают и помещают на картонку с тыльной стороны, плотно прикрепляя скрепками.
- Сначала выкладывают ствол, для этого полоски помещают одна на другую и закрепляют клеем.
- Полоски-ветки крепят точно по шаблону, раскладывают их максимально аккуратно. Центральную часть оформляют оттенком, чуть отличающимся от всей остальной оттеночной палитры.
- Готовую поделку переворачивают на наружную сторону заготовки и оформляют по своему вкусу, тыльную сторону закрывают однотонной бумагой. Чаще всего рождественские ёлки отделывают искусственным снегом, глиттером, а также контрастными бусинками.
В качестве праздничной открытки для учеников начальных классов или даже воспитанников старшей группы детского сада можно предложить изготовить колпак Санта Клауса. Расчертить подобную заготовку совсем нетрудно — манипуляции надо начинать от середины шапки перед местом сгиба.
- Линии должны расходиться в разные стороны по аналогии с солнечными лучами.
- Разноцветные полосы нарезаются в прямоугольной форме, при этом каждая складывается вдвое по длинной стороне.
- Накладывание полос выполняют сверху вниз, используя схему с чередованием разноцветных и однотонных деталей.
- Когда весь модуль будет полностью заклеен, работу переворачивают и поверх накладывают листок картона с вырезанным отверстием нужной формы.
- Поделку декорируют ватой и помпоном, а пустоты украшают снежинками либо звёздочками, вырезанными из фольги.

К 8 Марта
- Для создания этой необычной открытки в виде женского силуэта можно вместо бумаги взять тесьму или ленты двух колеров.
- Нарисовав очертания платья, следует расчертить схему размещения тонких полосок материи, начиная от бретелек и зоны лифа.
- После этого расчерчивают линии в диагональном направлении, двигаясь от верхней части лифа к средней части подола.
- При наклеивании атласной ленты действовать надо по той же схеме — начинают крепление сверху, сначала выкладывают лиф, а оформлением нижней части занимаются в самую последнюю очередь.
- В участке соединения лучиков прикрепляют бантик.
- Вырезая по контуру поделку, на картоне белого цвета внизу желательно сделать волнистые линии.
Это простая поделка, а если вы будете чередовать ленты разного цвета, то смотреться она будет довольно эффектно.
Ко Дню святого Валентина
Для малоопытных мастериц лучше воспользоваться готовыми шаблонами поделки — их всегда можно отыскать в интернете либо нарисовать самим.
- Шаблон укладывают на твердый картон, обводят карандашом и вырезают сердце по центру.
- Получившийся шаблон крепят к картону скрепками.
- Далее потребуется бумага трех расцветок, её разрезают полосками толщиной 4 см, каждый из них складывают по длине — таким образом, вы готовите заготовки для вашей валентинки.
- Разноцветные полоски выкладывают по очереди в соответствии с цветовой схемой, фиксируя их при помощи клея либо скотча.
- После того как все заготовки закончатся, серединку выкладывают любым колером, подходящим по оттеночной гамме.
- Открытка почти готова — вам останется только перевернуть её, украсить лицевую часть по собственному вкусу, а изнаночную заклеить любой одноцветной бумагой.
При желании такое сердечко можно сделать однотонным, не добавляя никаких иных расцветок. Для придания большей декоративности вместо обычной бумаги можно взять гофрированную либо атласную.
К 23 Февраля
В качестве подарка на 23 февраля часто изготавливают звезду в стиле айрис фолдинг. Пошаговая инструкция предполагают выполнение следующих действий.
- Для начала надо скопировать шаблон и перенести его на половину листа формата А4.
- После этого измеряют максимальное расстояние между отдельными секциями звезды, а к полученному значению прибавляют ещё пару-тройку миллиметров — они пойдут на поправки и зазоры. Полученное значение будет соответствовать ширине разноцветных полос.
- Затем необходимо взять бумагу 3-х разных оттенков и нарезать на одинаковые полосы в соответствии с рассчитанными ранее параметрами ширины.
- Наклейку начинают от углов, двигаясь последовательно по направлению к центру.
На выходе должна получиться нарядная праздничная звездочка.
При создании картинок в технике айрис-фолдинг нужно иметь в виду следующие нюансы:
- обязательно учитывайте месторасположение вашей будущей поделки с тем, чтобы правильно продумать все возможные способы маскировки тыльной части изделия;
- по окончании полного заполнения трафарета разноцветными полосками с тыльной стороны можно прикрепить лоскут ткани, а также бархатную бумагу;
- лицевую часть обычно украшают наклейками, бусинками или лентой.


Весьма креативно смотрятся элементы декора собственного изготовления, сделанные в технике валяния из шерсти либо скрапбукинга. Все объемные элементы желательно клеить при помощи горячего термопистолета. Для оформления кружевных элементов можно воспользоваться декоративными дыроколами.


Красивые примеры
Техника айрис фолдинг весьма увлекательна. Кроме того, она формирует терпение, а также усидчивость, скрупулезность и аккуратность — это особенно актуально, если речь идет о детях дошкольного, а также младшего школьного возраста. Айрис фолдинг помогает раскрыть скрытые творческие возможности, работа позволяет расслабиться и в полной мере насладиться творчеством — можно сказать, что процесс создания картины по методу радужного складывания доставляет мастерицам настоящее моральное удовлетворение.
- Особенно красивым в данной технике получается сердце.

- А малышам наверняка придется по душе идея сложить из бумаги лебедя, кошку, сову или яблоко.
- В направлении айрис фолдинг даже изготавливают интересные вазы.


Созданные в этом стиле открытки, панно, коллажи, а также обложки для книжек и фотоальбомов станут хорошим презентом для близких людей от детей, а для взрослых мастериц будут толчком к расширению круга общения, разработке уникальных мастер-классов и участию в творческих мероприятиях.
О том, как сделать аппликацию в технике айрис фолдинг, смотрите в следующем видео.
Фолдинг белка - это... Что такое Фолдинг белка?
В биохимии и молекулярной биологии фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура).
Переход первичной структуры полипептида (слева) в третичную структуру (справа).Каждая молекула белка начинает формироваться как полипептид, транслируемый из последовательности мРНК в виде линейной цепочки аминокислот. У полипептида нет устойчивой трёхмерной структуры (пример в левой части изображения). Однако все аминокислоты в цепочке имеют определённые химические свойства: гидрофобность, гидрофильность, электрический заряд. При взаимодействии аминокислот друг с другом и клеточным окружением получается хорошо определённая трёхмерная структура — конформация. В результате на внешней поверхности белковой глобулы формируются полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и с биологическими мембранами.
В редких случаях нативными могут быть сразу две конформации белка (т. н. конформеры). Они могут сильно различаться, и даже выполнять различные функции. Для этого необходимо, чтобы в разных областях фазового пространства белковой молекулы существовали два примерно равных по энергии состояния, каждое из которых будет встречаться в нативной форме с соответствующей вероятностью.
Для стабилизации третичной структуры многие белки в клетке подвергаются посттрансляционной модификации. Весьма часто встречаются дисульфидные мостики между пространственно близкими участками полипептидной цепи.
Для корректной работы белков весьма важна правильная трёхмерная структура. Ошибки сворачивания обычно приводят к образованию неактивного белка с отличающимися свойствами (более подробно это описано в статье Прионы). Считается, что некоторые болезни происходят от накопления в клетках неправильно свёрнутых белков.[1]
В фолдинге участвуют белки-шапероны. И хотя большинство только что синтезированных белков могут сворачиваться и при отсутствии шаперонов, некоторому меньшинству обязательно требуется их присутствие.
Механизм сворачивания белков до конца не изучен. Экспериментальное определение трёхмерной структуры белка часто очень сложно и дорого. Однако аминокислотная последовательность белка обычно известна. Поэтому учёные пытаются использовать различные биофизические методы, чтобы предсказать пространственную структуру белка из его первичной аминокислотной последовательности.[2]