Дейтерий что это такое
Дейтерий — Википедия
Дейте́рий (лат. deuterium, от греч. δεύτερος «второй»), тяжёлый водород, обозначается символами D и 2H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона.
Открыт в 1932 году американским физико-химиком Гарольдом Юри. Природное содержание — 0,0115 ± 0,0070[2] %.
Изотопные модификации соединений водорода[править | править код]
Соединения изотопов водорода практически не различаются по химическим свойствам, но обладают довольно различными физическими свойствами (температура плавления, кипения, вес)[3]. Молекула D2, состоит из двух атомов дейтерия. Вещество имеет следующие физические свойства:
- Температура плавления −254,5 °C (19,15 K).
- Температура кипения −249,5 °C (23,57K).
- Межъядерное расстояние 0,07416 нм[4].
- Энергия диссоциации (при 0K) 439,68 кДж/моль[4].
Содержание дейтерия в природном водороде — 0,011…0,016 ат.%[5]. Так, в морской воде у берегов соотношение атомных концентраций [D]/[Н] составляет (1,55÷1,56)·10−4 (один атом дейтерия на 6410÷6450 атомов протия), в околоповерхностных водах — (1,32÷1,51)·10−4 (1:6600÷7600), в природном газе — (1,10÷1,34)·10−4 (1:7500÷9100)[5].
По своим химическим свойствам соединения дейтерия имеют определенные особенности. Так, например, углерод-дейтериевые связи оказываются более «прочными», чем углерод-протиевые, из-за чего химические реакции с участием атомов дейтерия идут в несколько раз медленнее. Этим, в частности, обусловлена токсичность тяжёлой воды (вода состава D2O называется тяжёлой водой из-за большой разницы в массе протия и дейтерия).
Мировое производство дейтерия — десятки тысяч тонн в год. Крупнейшими производителями тяжёлой воды в мире являются Индия, Китай и Иран[6]. В промышленности для получения тяжелой воды (обогащения воды дейтерием) в своей основе служат процессы ионного обмена, в особенности Girdler Sulfide process, использующий изотопный обмен между водой и сероводородом или между водородом и аммиаком. Также используется многоступенчатый электролиз воды, ректификация жидкого водорода.[4] При электролизе 100 л воды выделяется 7,5 мл 60-процентного D 2O[7].
Содержание дейтерия в природной воде в 1,03 раза больше, чем в паре (это коэффициент разделения для данной смеси). Поэтому если после кипячения не всю воду выливать, а подливать к остатку природной воды и снова кипятить, то в воде чайника постепенно будет происходить накопление тяжелой воды. Однако очень медленное, поэтому даже при большом количестве повторений этого процесса содержание тяжелой воды не станет опасным для здоровья, вопреки предположению В. В. Похлебкина в книге «Чай. Его типы, свойства, употребление», вышедшей в 1968 году[8]. Академик Игорь Васильевич Петрянов-Соколов как-то подсчитал, сколько воды должно испариться из чайника, чтобы в остатке заметно повысилось содержание дейтерия. Оказалось, что для получения 1 литра воды, в которой концентрация дейтерия равна 0,15 %, то есть всего в 10 раз превышает природную, в чайник надо долить в общей сложности 2,1⋅1030 тонн воды, что в 300 млн раз превышает массу Земли[9].
Дейтерий был открыт в 1932 году Гарольдом Юри и его коллегами спектральным методом.
Резерфорд, недовольный предложенным открывателями названием «дейтон»[10], предложил вариант названия — «диплоген», а ядро, соответственно, — «диплон».
Учёные высказывали гипотезу о существовании стабильных изотопов лёгких элементов ещё в 1913 году при изучении неона. Существование этих изотопов было доказано в 1920 году методом масс-спектрометрии. Правда, в то время преобладала теория, согласно которой изотопы различались числом «внутриядерных электронов» различных атомов элемента (нейтрон был открыт позже — в 1932 году). Измерения относительной атомной массы водорода дали значение, близкое к 1 а. е. м., которое равно массе протона. Поэтому предполагалось, что водород не может содержать внутриядерный электрон, иначе он скомпенсирует заряд ядра. Таким образом, считалось, что у водорода нет тяжёлых изотопов.
Дейтерий впервые был открыт химиком Гарольдом Юри, работавшим в Колумбийском университете в конце 1931 года. Фердинанд Брикведде, который помогал Юри, провёл дистилляцию пяти литров жидкого водорода, полученного в криогенном цикле. Брикведде работал в новой лаборатории низких температур, открытой в Национальном бюро стандартов и весов США (NIST). В результате объём жидкости составил 1 мл. Ранее такая же методика использовалась для наработки тяжелых изотопов неона. Техника испарения жидкого водорода позволила увеличить долю изотопа водорода с массой 2 до такой степени, чтобы его можно было надежно зарегистрировать методами спектроскопии [11].
15 июня 1933 года Юри, Мерфи и Брикведде направили письмо редактору научного журнала «The Journal of Chemical Physics», в котором предложили названия для изотопов водорода — протий (англ. protium), дейтерий (англ. deuterium) и тритий (англ. tritium; в случае его открытия, поскольку на тот момент тритий ещё не был открыт), в письме они отмечали, что произвели первые два названия от греческих слов «protos» («первый») и «deuteros» («второй»)[12][13]. В 1934 году Юри была присуждена Нобелевская премия по химии за открытие дейтерия.
Наибольшие количества дейтерия применяются в атомной энергетике[6]. Он обладает лучшими свойствами замедления нейтронов. В смеси с тритием или в соединении с литием-6 (гидрид лития 6LiD) применяют для термоядерной реакции в водородных бомбах. При взрыве происходят реакции: D (d, γ) 4He, D (t, n) 4He Также применяется в качестве меченого стабильного индикатора в химических, биологических и других лабораторных исследованиях и технике[6]. Перспективным также представляется применение дейтерия (в смеси с тритием) для получения высокотемпературной плазмы, необходимой для осуществления управляемого термоядерного синтеза (см. проект ITER) [6].
С некоторых пор дейтерий используется в медицине компаниями, разрабатывающими лекарства, которые с его помощью пытаются увеличить время метаболизма лекарства, то есть замедлить его вывод из организма, это замедление в модифицированных дейтерием лекарствах наблюдается благодаря первичному дейтериевому изотопному эффекту — уменьшению скорости реакции разрыва углерод-дейтериевых связей по сравнению с углерод-протиевыми[14][15].
Также дейтерий используется в нейтронных генераторах[6].
- ↑ 1 2 3 Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — doi:10.1016/j.nuclphysa.2003.11.003. — Bibcode: 2003NuPhA.729..337A.
- ↑ 1 2 3 4 Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729....3A.
- ↑ Кузьменко, 2007, с. 298.
- ↑ 1 2 3 Бердоносов С. С. Дейтерий // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга — Робертсона — Стримеры. — 704 с. — 40 000 экз. — ISBN 5-85270-087-8.
- ↑ 1 2 Дейтерий / В кн.: Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ↑ 1 2 3 4 5 Александр Семёнов. Дейтерий и тритий: водород, да не тот (рус.) // Наука и жизнь. — 2018. — № 8. — С. 45—51.
- ↑ Кузьменко, 2007, с. 299.
- ↑ Дейтерий — в чайнике? // Химия и жизнь. — 1969. — № 2. — С. 24—25.
- ↑ Илья Леенсон. Тяжелая вода (неопр.). Энциклопедия Кругосвет.
- ↑ М. Олифант. Дни Кембриджа // Rutherford. Recollections of the Cambridge days". Elsevier, Amsterdam, 1972. (рус.)
- ↑ Urey H., Brickwedde F., Murphy G. A Hydrogen Isotope of Mass 2 (англ.) // Physical Review. — 1932. — Vol. 39. — P. 164—165. — doi:10.1103/PhysRev.39.164. — Bibcode: 1932PhRv…39..164U.
- ↑ Urey H. C., Murphy G. M., Brickwedde F. G. A Name and Symbol for H2* (англ.) // Journal of Chemical Physics : journal. — 1933. — Vol. 1. — P. 512—513. — doi:10.1063/1.1749325.
- ↑ Dan O'Leary. The deeds to deuterium (англ.) // Nature Chemistry : journal. — 2012. — Vol. 4. — P. 236. — doi:10.1038/nchem.1273.
- ↑ Michael J. Barratt, Donald E. Frail. Drug Repositioning: Bringing New Life to Shelved Assets and Existing Drugs (англ.). — John Wiley & Sons, 2012. — P. 319.
- ↑ Graham L. Patrick. An Introduction to Drug Synthesis (англ.). — Oxford University Press, 2015. — P. 380.
- Кузьменко Н. Е., Ерёмин В. В., Попков В. А. Начала химии. — М.: Изд-во Экзамен, 2007. — Т. 1. — С. 299.
Дейтерий - это... Что такое Дейтерий?
Дейте́рий (лат. deuterium, от др.-греч. δεύτερος «второй»), тяжёлый водород, обозначается символами D и 2H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона.
Открыт в 1932 г. американским физико-химиком Г. Юри. Природное содержание — 0,0115 ± 0,0070[2] %.
Изотопные модификации соединений водорода
Соединения изотопов водорода практически не различаются по химическим свойствам, но обладают довольно различными физическими свойствами (температура плавления, кипения, вес)[3]. Молекула D2, состоит из двух атомов дейтерия. Вещество имеет следующие физические свойства:
- Температура плавления −254,5 °C
- Температура кипения −249,5 °C
Содержание дейтерия в природном водороде — 0,0011-0,0016 ат.% [4].
По своим химическим свойствам соединения дейтерия имеют определенные особенности. Так, например, углерод-дейтериевые связи оказываются более «прочными», чем углерод-протиевые, из-за чего химические реакции с участием атомов дейтерия идут в несколько раз медленнее. Этим, в частности, обусловлена токсичность тяжёлой воды (вода состава D2O называется тяжёлой водой из-за большой разницы в массе протия и дейтерия).
Получение
Мировое производство дейтерия — десятки тысяч тонн в год. Основные методы получения: многоступенчатый электролиз воды, ректификация воды, ионный обмен, ректификация аммиака. При электролизе 100л воды выделяется 7,5 мл 60%-ного D2O[5].
При длительном кипячении природной воды концентрация тяжёлой воды в ней повышается очень незначительно — в пределах 1 %[источник не указан 1070 дней]. Среди населения бытует миф о том, что это якобы может вредно сказаться на здоровье. В действительности же повышение концентрации тяжёлой воды при кипячении ничтожно, гораздо сильнее ощущается повышение концентрации растворённых солей.
Применение
Дейтерий широко используется в атомной энергетике как замедлитель нейтронов в атомных реакторах; в смеси с тритием или в соединении с литием-6 применяют для термоядерной реакции в водородных бомбах, применяется в качестве меченого стабильного индикатора в лабораторных исследованиях и технике. Перспективным также представляется применение дейтерия (в смеси с тритием) для получения высокотемпературной плазмы, необходимой для осуществления управляемого термоядерного синтеза (см. проект ITER).
Примечания
- ↑ 1 2 3 G. Audi, A.H. Wapstra, and C. Thibault (2003). «The AME2003 atomic mass evaluation (II). Tables, graphs, and references.». Nuclear Physics A 729: 337—676. DOI:10.1016/j.nuclphysa.2003.11.003.
- ↑ 1 2 3 4 G. Audi, O. Bersillon, J. Blachot and A. H. Wapstra (2003). «The NUBASE evaluation of nuclear and decay properties». Nuclear Physics A 729: 3–128. DOI:10.1016/j.nuclphysa.2003.11.001.
- ↑ Н. Е. Кузьменко, В. В. Ерёмин, В. А. Попков Начала химии (том 1) 2007.— М.: Изд-во Экзамен, С.298
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ↑ Н. Е. Кузьменко, В. В. Ерёмин, В. А. Попков Начала химии (том 1) 2007.— М.: Изд-во Экзамен, С.299
Литература
- Н. Е. Кузьменко, В. В. Ерёмин, В. А. Попков Начала химии (том 1) 2007.— М.: Изд-во Экзамен, С.298-299
- Физическая энциклопедия. / Гл. ред. Прохоров А. М. — М.: Советская энциклопедия, 1988. — Т. 1.— 704 с., ил. — 100 000 экз.
Дейтерий - это... Определение, применение, свойства
Все элементы имеют атомы в качестве своей основной единицы, а атом содержит три фундаментальные частицы, которые являются отрицательно заряженными электронами, положительно заряженными протонами и нейтронами нейтральных частиц. Количество протонов и нейтронов, присутствующих в ядре, называется массовым числом элементов, а число протонов - атомным номером. Те же самые элементы, атомы которых содержат одинаковое количество протонов, но различное количество нейтронов, называются изотопами. В качестве примера можно взять водород, который имеет три изотопа. Это водород с нулевыми нейтронами, дейтерий, содержащий один нейтрон, и тритий - он содержит два нейтрона. В этой статье речь пойдет об изотопе водорода, который называется дейтерием, известном так же, как тяжелый водород.
Что такое дейтерий?
Дейтерий – это изотоп водорода, который отличается от водорода одним нейтроном. Обычно водород имеет только один протон, а дейтерий - один протон и один нейтрон. Он широко применяется в реакциях деления.
Дейтерий (химический символ D или ²H) является стабильным изотопом водорода, встречающимся в природе в чрезвычайно небольших количествах. Ядро дейтерия, называемое дейтроном, содержит один протон и один нейтрон, тогда как гораздо более распространенное ядро водорода содержит только один протон и не содержит нейтронов. Следовательно, каждый атом дейтерия имеет массу, которая примерно вдвое больше массы обычного атома водорода, и дейтерий также называют тяжелым водородом. Вода, в которой обычные атомы водорода заменены атомами дейтерия, называется тяжелой водой.
Основные характеристики
Изотопная масса дейтерия - 2,014102 ед. Дейтерий имеет стабильный период полураспада, поскольку он является стабильным изотопом.
Избыточная энергия дейтерия составляет 13 135,720 ± 0,001 кэВ. Энергия связывания для ядра дейтерия - 2224,52 ± 0,20 кэВ. Дейтерий соединяется с кислородом с образованием D2O (2Н2О), так же известном, как тяжелая вода. Дейтерий – это не радиоактивный изотоп.
Дейтерий не опасен для здоровья, но может быть использован для создания ядерного оружия. Дейтерий не производится искусственно, так как он естественным образом в большом количестве присутствует в океанской воде и может служить многим поколениям людей. Его извлекают из океана, используя процесс центрифугирования.
Тяжелый водород
Тяжелый водород - это название любого из высших изотопов водорода, таких как дейтерий и тритий. Но чаще оно используется для дейтерия. Его атомная масса составляет около 2, и в его ядре содержится 1 протон и 1 нейтрон. Таким образом, его масса в два раза больше массы нормального водорода. Дополнительный нейтрон в дейтерии делает его тяжелее нормального водорода, поэтому его называют тяжелым водородом.
Тяжелый водород был обнаружен Гарольдом Юри в 1931 году - это открытие было удостоено Нобелевской премии по химии в 1934 году. Юри предсказал разницу между давлением пара молекулярного водорода (h3) и соответствующей молекулы с одним атомом водорода, замененным дейтерием (HD), и, таким образом, возможность разделения этих веществ путем перегонки жидкого водорода. Дейтерий был обнаружен в остатке от перегонки жидкого водорода. Он был приготовлен в чистом виде Г.Н. Льюисом с помощью электролитического метода концентрации. Когда вода электризуется, образуется газообразный водород, который содержит небольшое количество дейтерия, поэтому дейтерий концентрируется в воде. Когда количество воды уменьшается до примерно ста тысячных от ее первоначального объема в результате продолжающегося электролиза, обеспечивается почти чистый оксид дейтерия, известный как тяжелая вода. Этот метод приготовления тяжелой воды был использован во время Второй мировой войны.
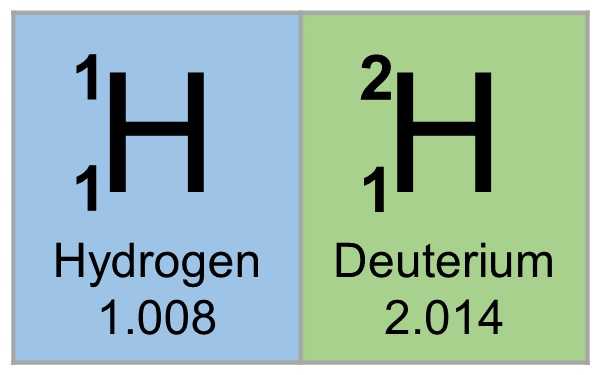
Этимология и химический символ
Название "дейтерий" происходит от греческого слова deuteros, что означает "второй". Это указывает на то, что с атомным ядром, состоящим из двух частиц, дейтерий – это второй изотоп после обычного (или легкого) водорода.
Дейтерий часто обозначается химическим символом D. Как изотоп водорода с массовым числом 2, он также представлен как H. Формула дейтерия - 2Н. Международный союз теоретической и прикладной химии (IUPAC) допускает использование как D, так и H, хотя предпочтительным является H.
Как получить дейтерий из воды?
Традиционный метод концентрирования дейтерия в воде использует изотопный обмен в газообразном сероводороде, хотя в настоящее время разрабатываются более совершенные методы. Разделение различных изотопов водорода также можно проводить с помощью газовой хроматографии и криогенной дистилляции, которые используют различия в физических свойствах для разделения изотопов.
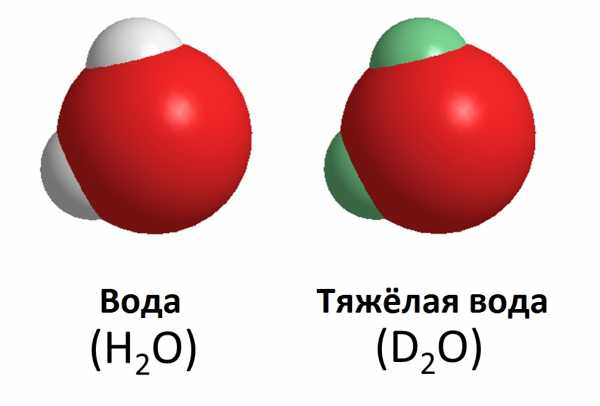
Дейтериевая вода
Вода дейтерия, так же известная, как тяжелая вода, похожа на обычную воду. Она образована комбинацией дейтерия и кислорода и обозначается как 2Н2O. Дейтериевая вода более вязкая, чем обычная. Тяжелая вода плотнее обычной на 10,6%, поэтому лед тяжелой воды тонет в обычной воде. Для некоторых животных дейтериевая вода является токсичной, в то время как другие способны выжить в тяжелой воде, но развиваться в ней они будут медленнее, чем в нормальной. Дейтериевая вода не радиоактивна. Организм человека содержит около 5 граммов дейтерия, и он безвреден. Если тяжелая вода попадает в организм в больших количествах (например, около 50% воды в организме становится тяжелой), это может привести к дисфункции клеток, и в конечном итоге - к смерти.
Отличия тяжелой воды:
- Температура замерзания составляет 3,82 °С.
- Температура кипения составляет 101,4 °С.
- Плотность тяжелой воды составляет 1,1056 г/мл (нормальной воды - 0,9982 г/мл).
- pH тяжелой воды составляет 7,43 (обычной воды - 6,9996).
- Существует небольшая разница во вкусе и запахе простой и тяжелой воды.
Применение дейтерия
Ученые разработали множество вариантов использования для дейтерия и его соединений. Например, дейтерий - это нерадиоактивный изотопный индикатор для изучения химических реакций и метаболических путей. Кроме того, он полезен для изучения макромолекул с помощью рассеивания нейтронов. Дейтерированные растворители (как тяжелая вода) обычно используются в спектроскопии ядерного магнитного резонанса (ЯМР), поскольку эти растворители не влияют на спектры ЯМР исследуемых соединений. Дейтерированные соединения также полезны для фемтосекундной инфракрасной спектроскопии. Дейтерий также является топливом для реакций ядерного синтеза, которые когда-нибудь могут быть использованы для производства электроэнергии в промышленных масштабах.
Дейтерий и тритий: водород, да не тот
Прошло более 85 лет с момента открытия тяжёлых изотопов водорода, тем не менее интерес к ним с каждым годом возрастает. Они дают надежду на выход из энергетического кризиса, но вместе с тем могут поставить под угрозу существование всего живого на нашей планете. Эту опасность человечество ощутило ещё полвека назад.Натурные макеты атомной и водородной (на переднем плане) бомб в Музее ядерного оружия (г. Саров). Фото Александра Семёнова.
Соотношение тяжёлой и лёгкой воды в природной смеси. Фото Александра Семёнова.
Студент РХТУ Борис Иванов (слева) проходит практику в тритиевом отделе АО «ВНИИНМ». Справа — автор статьи. Фото: АО «ВНИИНМ».
Стеклянный баллон вакуумной установки, потемневший от многолетнего воздействия бета-излучения трития. Фото: АО «ВНИИНМ».
Радиолюминограмма образца нержавеющей стали, экспонированного в тритии. Разным цветом показаны участки, содержащие различное количество этого изотопа. Фото: АО «ВНИИНМ».
‹
›
В 1931—1932 годах американский физикохимик Гарольд Юри и его коллеги сумели выделить из обыкновенного, всем известного водорода необычную фракцию. Водород из этой фракции имел большие атомный вес и плотность, давал в эмиссионном спектре ранее незнакомые линии, напоминающие классические линии спектра водорода, но в то же время немного смещённые. Это означало, что в природном водороде присутствуют атомы нескольких сортов, отличные по своим свойствам. Так был открыт первый из тяжёлых изотопов водорода — дейтерий. Вскоре в чистом виде была получена «тяжёлая вода» — оксид дейтерия. Она имела на 10% бóльшую плотность, более высокие температуры плавления и кипения, чем вода обычная, сложнее разлагалась электрическим током, что вскоре легло в основу одного из первых способов её получения. Длительный, многоступенчатый электролиз воды позволял сконцентрировать дейтерий и очистить его от лёгкого изотопа водорода.
Другой тяжёлый изотоп, тритий, открыли двумя годами позже в Кембриджском университете физики Эрнест Резерфорд, Марк Олифант и физикохимик Пауль Хартек при бомбардировке ядрами дейтерия мишеней из дейтерийсодержащих соединений. При этом исследователи впервые столкнулись с ядерным синтезом — искусственным превращением одних ядер в другие. Как оказалось, третий изотоп водорода сильно радиоактивен (период полураспада 12,32 года) и поэтому не может накапливаться в природе в сколько-нибудь значимых количествах.
За открытие дейтерия Г. Юри в 1934 году был награждён Нобелевской премией по химии.
Поначалу дейтерий производили электролитическим методом, что требовало больших затрат электроэнергии и обходилось недёшево. А реакторная наработка весовых количеств трития даже по самым скромным подсчётам должна была стоить баснословных денег. Кто бы мог тогда подумать, что через два десятка лет после их открытия в нескольких государствах мира будут работать крупномасштабные производства и дейтерия и трития! Причина такой популярности тяжёлых изотопов водорода заключалась в том, что они стали основой самого мощного из всех существовавших когда-либо видов оружия. Это оружие получило название термоядерного или водородного.
Вспоминая эпоху «холодной войны», в которую довелось родиться автору этой статьи, стоит заметить, что зловещее и практически забытое сейчас выражение «водородная бомба» долгое время было у всех на слуху и вызывало неприятный холодок в душе жителя Советского Союза. Все жили под дамокловым мечом ядерной войны, которая, как казалось, могла начаться в любой момент. В политических карикатурах журнала «Крокодил» недобрый «дядя Сэм», как правило, доставал из-за пазухи или держал в руке выразительную чёрную бомбу с эмблемой «Н», что означало «водородная», или с эмблемой «N», что означало бомбу нейтронную, представляющую более современный тип бомбы водородной. Не все понимали, что идёт речь не о самом водороде, а только о его тяжёлых изотопах, составляющих термоядерный заряд. Изобилие карикатур на эту тему привело к тому, что атомные и водородные бомбы часто попадали в детские рисунки и были причиной многих детских страхов.
В чём же секрет небывалой мощи, скрытой в тяжёлых изотопах водорода? Он заключён в высоком энергетическом эффекте реакции слияния ядер дейтерия и трития и в рекордно малой величине энергетического барьера, который необходимо преодолеть, чтобы их ядра слились. Если обычный урановый или плутониевый ядерный заряд использовать для поджигания термоядерной реакции, то его энергию можно усилить в 600 раз и более. Большое достоинство такого заряда состоит в том, что дейтерий и тритий при слиянии не только не дают долгоживущих радиоактивных продуктов, но и способствуют более полному сгоранию самого ядерного запала. И значит, термоядерное оружие при его использовании наносит значительно меньший экологический урон, оставляя меньшее радиоактивное заражение местности, чем ядерное оружие той же мощности. Это открывало не только военные, но и мирные перспективы его использования — при сооружении подземных ёмкостей-хранилищ газа, при тушении пожаров на нефтяных скважинах, а также для быстрого и относительно безопасного создания искусственных котлованов и каналов серией небольших термоядерных взрывов.
Абсолютным рекордсменом среди всех видов взрывных устройств, когда-либо созданных человеком, следует назвать советскую водородную бомбу АН602, которая была испытана 30 октября 1961 года на ядерном полигоне «Сухой Нос» архипелага Новая Земля. С лёгкой руки Генерального секретаря Компартии СССР Н. С. Хрущёва эта бомба вошла во Всемирную историю под названием «Кузькина мать». Кроме того, по аналогии с Царь-пушкой и Царь-колоколом этот заряд часто называют «Царь-бомбой». Разработана она была под руководством академика АН СССР И. В. Курчатова. Её измеренная мощность в тротиловом эквиваленте составила 58,6 мегатонны.
Сколько же тяжёлых изотопов водорода в природе? Дейтерия в природе не так уж и мало. Его концентрация относительно протия составляет около 0,016% ат., но, учитывая широкую распространённость самого водорода, запасы дейтерия можно считать неисчерпаемыми. Наибольшие его количества находятся в Мировом океане; концентрация дейтерия в океанической воде также заметно выше, чем в водах рек, вследствие фракционирования изотопов воды в атмосферном водяном цикле (см. «Наука и жизнь» № 5, 2011 г., статья «Изотопная «дактилоскопия» для Шерлока Холмса»). Дейтерия в водах Мирового океана содержится даже больше, чем таких химических элементов, как фтор и йод. Природные вариации соотношения изотопов дейтерия и протия изменяются в диапазоне от 5500 до 11 000 атомов лёгкого водорода на один атом тяжёлого — это своеобразный рекорд среди природных вариаций всех стабильных изотопов. Наименьшие концентрации дейтерия наблюдаются в ледниках Антарктики, а наибольшие — в закрытых водоёмах пустыни Сахара.
Трития в природе в десятки и сотни триллионов раз меньше, чем дейтерия. Из-за радиоактивного распада тритий практически отсутствует в объектах, изолированных от атмосферы, например в углеводородах нефти и природного газа. Естественная наработка трития на Земле постоянно происходит при воздействии космических лучей на ядра азота и кислорода в верхних слоях атмосферы, поэтому наиболее богаты природным тритием осадки: дождь и снег. Такая естественная наработка трития находится в равновесии с его распадом и составляет не более 7 кг на весь земной шар.
Во второй половине ХХ века количество трития в природе многократно возрастало в период интенсивных испытаний термоядерного оружия. Так, при взрыве водородной бомбы мощностью одна мегатонна образуется и попадает в окружающую среду до 2 кг трития. За всё время наземных и воздушных испытаний термоядерного оружия в атмосфере накапливались сотни килограммов трития. После их запрета количество трития в земной атмосфере заметно снизилось за счёт его радиоактивного распада и сейчас не превышает десятков килограммов. Важный источник поступления трития в окружающую среду — атомные электростанции, которые ежегодно вырабатывают килограммы трития (сопоставимо с его природной наработкой). Из этого количества в окружающую среду попадает не более одной седьмой части.
Как разделить изотопы водорода? Известный учёный и публицист академик И. В. Петрянов-Соколов в конце 1960-х годов, проведя несложные математические выкладки, показал, насколько утопичен миф о «накоплении тяжёлой воды» в чайнике при длительном кипячении. Чтобы получить хотя бы литр воды с обогащением по дейтерию всего в 10 раз больше природного, пришлось бы испарить такое её количество, масса которого во много раз превышает массу всей Солнечной системы. Причина — близость физико-химических свойств обычной и дейтериевой воды, малая величина коэффициента разделения этих изотопов при дистилляции. Эффективность разделения может быть значительно повышена, если использовать многоступенчатые противоточные процессы. Наиболее освоены и промышленно реализованы такие методы получения дейтерия, как ректификация жидкого водорода, двухтемпературный сероводородный метод, и метод, основанный на химическом обмене в системе «вода—водород». При получении концентрированного трития приходится считаться с его радиоактивностью. В этом случае могут быть применены лишь те методы, в которых водород присутствует в молекулярном виде, так как и вода и сероводород, содержащие тритий, сильно разлагаются вследствие авторадиолиза. При получении дейтерия в качестве исходного сырья используют природную воду. Тритий может быть получен только в реакторах, при облучении нейтронами одного из изотопов лития.
Приятно отметить, что наше предприятие, АО «ВНИИНМ» им. академика А. А. Бочвара, которое ранее называлось НИИ-9, стоит у истоков создания всех отечественных тритиевых технологий. И реакторная наработка трития, и его очистка от сопутствующих примесей, и проблемы безопасности обращения с ним — все эти вопросы были в своё время успешно решены.
С самого начала Атомного проекта СССР проблема получения трития была по значимости на втором месте после изготовления ядерного заряда. Тритий предстояло нарабатывать реакторным путём из лёгкого изотопа лития — 6Li. Решение этой задачи было поручено коллективу НИИ-9, состоявшему из специалистов разных направлений. С их помощью в Советском Союзе создали тритиевое производство и ныне действующее на ФГУП «ПО «Маяк» (г. Озёрск).
Процессы разделения изотопов водорода в нашей стране большей частью разработаны в МХТИ (ныне — РХТУ им. Д. И. Менделеева). Там же в 1934 году А. И. Бродский получил первую советскую тяжёлую воду на специально разработанной лабораторной установке. Ежегодно кафедра технологии изотопов РХТУ даёт образование десяткам специалистов в этой области.
Наибольшее количество дейтерия в нашей стране, по-видимому, наработано методом низкотемпературной ректификации*, хотя на первом этапе для этого активно использовали очень энергозатратный способ получения тяжёлой воды электролизом. Производства дейтерия были распределены по всей стране, при этом ориентировались на наличие свободной электроэнергии и на возможность использования отходящего водорода, в частности на азотно-туковых заводах**. Одно из наиболее крупных производств дейтерия существовало в городе Чирчик; тяжёлую воду производили также в Днепродзержинске, Сталиногорске, Ленинграде, Норильске, Каменке, Березниках, Горловке и во многих других городах СССР. Меньшее распространение у нас получил двухтемпературный сероводородный метод производства тяжёлой воды, реализованный в городе Алексине, в то время как в мировом масштабе это один из основных методов её получения.
Исторически первой страной, производившей тяжёлую воду в крупнотоннажных масштабах, была Норвегия. Это связано с наличием в ней большого количества избыточной электроэнергии, необходимой для электролитического производства D2O. Принято считать, что если бы гитлеровская Германия получила в своё распоряжение запасы норвежской тяжёлой воды, то вполне могла бы успеть создать до своего разгрома собственное ядерное оружие. К счастью, этого не произошло благодаря проведённой спецоперации: парóм с норвежской тяжёлой водой, предназначенной для переправки в Германию, был уничтожен. На сегодня крупнейшие производители тяжёлой воды в мире — это Индия, Китай и Иран, активно развивающие тяжеловодное направление своей атомной энергетики. Огромными запасами тяжёлой воды владеют Канада и США, которым пришлось даже остановить ряд своих предприятий из-за перепроизводства и экологических проблем. При эксплуатации тяжеловодных АЭС Канаде приходится периодически очищать теплоноситель как от протия (он мешает ядерной реакции), так и от нарабатываемого трития (повышает радиационную нагрузку на персонал). При этом Канада попутно получает до 2 кг трития в год как ценный побочный продукт эксплуатации своих тяжеловодных АЭС. Собственное тяжеловодное производство имеет Румыния.
В нашей стране тяжёлую воду и дейтерий в настоящее время производит единственное предприятие — ПИЯФ им. Б. П. Константинова в Гатчине. В качестве исходного сырья используют запасы, накопленные в СССР. Из природного сырья дейтерий у нас в стране сейчас не выделяют.
Говоря об отечественных тритиевых технологиях, нельзя не упомянуть РФЯЦ-ВНИИЭФ (г. Саров), специалисты которого многие годы занимаются этим вопросом как в рамках оборонных задач, так и для нужд фундаментальной науки. В частности, они разработали тритиевую криомишень для получения сверхтяжёлых изотопов лёгких элементов, используемую в ОИЯИ (г. Дубна) на установке АКУЛИНА***, позволившую получить пятый изотоп водорода и до сих пор востребованную в фундаментальных исследованиях.
Где же применяют тритий и дейтерий? Так уж получилось, что открытые человеком колоссальные источники энергии деления и слияния ядер изначально предполагалось использовать для разрушения, и лишь потом было освоено их мирное использование. Кроме того, есть немало сфер применения этих изотопов, вообще не связанных с реакцией термоядерного синтеза.
Один из основных отечественных потребителей трития и производителей тритиевой продукции — ФГУП «ВНИИА им. Н. Л. Духова». На этом предприятии разрабатывают и производят нейтронные генераторы — ускорительные устройства, в которых ядра дейтерия, ударяясь в мишень, вступают в ядерную реакцию с содержащимся в ней тритием. При этом выделяющиеся нейтроны имеют постоянную энергию 14,1 МэВ, а само устройство очень удобно в эксплуатации. При отсутствии ускоряющего напряжения нейтроны не излучаются (в отличие от радиоизотопных нейтронных источников), а радиоактивный тритий находится внутри нейтронной трубки и в таком виде практически безопасен (его мягкое бета-излучение не способно пробить даже лист бумаги).
Нейтронные генераторы используются везде, где требуются компактные автономные источники нейтронов. Очень востребованы они у геологов, которые используют их при гео-физическом исследовании скважин методом нейтронного каротажа. (Слово «каротаж» происходит от французского слова «carotte» — морковь, что объясняется сходством формы керна, извлекаемого из земли, с морковью.) Метод нейтронной активации при этом позволяет оперативно получить полную информацию о химическом составе всех горных пород по глубине скважины, просто опустив в неё нейтронный зонд с детектором. Нейтронный генератор, изготовленный во ВНИИА, есть даже на марсоходе «Curiosity» («Кьюриосити»; в переводе с английского означает «любопытство»), в составе прибора ДАН (Детектора альбедных нейтронов), созданного в ИКИ РАН. Главная задача этого прибора — поиск воды на Марсе под толщей грунта, и уже имеются первые положительные результаты. ВНИИНМ внёс свой вклад в этот международный проект, поставив для ВНИИА мишени, насыщенные тритием.
То, что тритий является мягким бета-излучателем с высокой радиоактивностью, обусловливает его использование в радиоизотопных источниках света и электроэнергии. Во многих часах и приборах со светящимися стрелками применяют люминофоры, активированные тритием. Тритиевая подсветка на оружейных прицелах существенно повышает точность стрельбы в ночное время.
Сейчас АО «ВНИИНМ» по заказу Роскосмоса и под руководством ООО «Солар-Си» принимает участие в разработке отечественного бета-вольтаического источника питания на основе трития — «тритиевой батарейки». Этот источник питания нужен в тех ответственных узлах, где требуется стабильное бесперебойное электроснабжение в течение многих лет. Его создание решит актуальный вопрос импортозамещения, поскольку аналогичных источников электропитания Россия в настоящее время не производит.
Наибольшие количества дейтерия потребляются атомной энергетикой. Содержащая его тяжёлая вода — один из наилучших замедлителей нейтронов, настолько эффективный, что позволяет «зажечь» реакцию деления ядер даже в уране с природным обогащением по изотопу U-235, тогда как все остальные типы ядерных реакторов требуют обогащённого урана. Использование тяжёлой воды в качестве замедлителя позволяет повысить и степень выгорания ядерного топлива. По этому пути пошла атомная энергетика Канады, которая производит для себя и строит по всему миру на заказ тяжеловодные реакторы CANDU.
И дейтерий и тритий активно применяют при производстве меченых соединений. В этой продукции заинтересованы в первую очередь биологи и медики, которые с помощью изотопной метки определяют механизмы биохимических реакций. У нас меченные тритием соединения традиционно производят в Институте молекулярной генетики РАН.
Самая заманчивая перспектива использования дейтерия и трития — создание управляемой термоядерной реакции. Если это удастся, человечество будет иметь в своём распоряжении неисчерпаемый источник энергии. К сожалению, эта задача оказалась чрезвычайно сложной. Более полувека в мире ведутся разработки в этой области, но всё равно мы очень далеки от создания такого термоядерного реактора, который производил бы энергии больше, чем потреблял. В настоящее время весь мир с надеждой смотрит на международный термоядерный реактор ИТЭР, создаваемый в городе Кадараш на юге Франции. С его помощью физики надеются приблизиться к созданию энергетики, использующей энергию слияния ядер трития и дейтерия, а в перспективе перейти к использованию одного дейтерия, чьи ядра могут взаимодействовать между собой.
В своё время на нашем предприятии пересказывали забавную историю, как один из вновь назначенных чиновников, проходя по территории ВНИИНМ, потребовал, чтобы ему «показали тритий», и был очень возмущён тем, что этого не сделали. Ему объясняли, что тритий — это газ, который прозрачен и потому невидим, тем не менее новый босс сурово резюмировал: «Что-то у вас здесь нечисто!». Давайте попытаемся понять, можно ли изотопы водорода «увидеть»?
Что касается трития, то, несомненно, да — можно, и без всяких дополнительных устройств. В концентрированном виде этот изотоп водорода даёт голубое свечение вследствие самоионизации. Поток бета-излучения трития способен при длительном контакте изменить цвет стекла, он вызывает потемнение эмульсии фотопластинок, на чём основан классический метод авторадиографического анализа, в котором по интенсивности потемнения фотоэмульсии определяют концентрацию радиоактивного изотопа. В последнее время приобретает популярность новый метод анализа трития, позволяющий визуализировать его распределение по поверхности образцов, — радиолюминография. Метод основан на образовании скрытого изображения в некоторых люминофорах под воздействием радиации. Это изображение считывается специальным лазерным сканером, причём интенсивность люминесценции пропорциональна активности образца. Концентрация трития с помощью радиолюминографии может быть представлена довольно наглядно и красочно. Радиоактивность трития даёт возможность определять даже ничтожные его количества методом жидкостной сцинтилляции, в котором определяют интенсивность свечения некоторых жидкостей, пропорциональную содержанию в них радиоактивного изотопа, и газовыми ионизационными методами, использующими свойство газовых смесей менять свои вольт-амперные характеристики при воздействии на них ионизирующего излучения. Кроме того, и дейтерий и тритий, так же как самый лёгкий из изотопов водорода протий, можно без труда «увидеть», используя современные методы атомно-эмиссионной, ИК- и масс-спектрометрии.
Не стоит забывать и об опасности, которую несут тяжёлые изотопы водорода. Самая грозная и зловещая из них скрыта в термоядерном оружии, произведённом за десятилетия «холодной войны». В своё время в прессе звучали сообщения, что мощности накопленного вооружения достаточно, чтобы неоднократно уничтожить всё живое на нашей планете. Даже малая его часть в случае использования способна вызвать глобальную экологическую катастрофу, известную под названием «ядерная зима». Несомненно, важнейшая задача всего человечества — не допустить развития такого сценария в мировой истории.
Но даже тот тритий, который не используется в вооружении, представляет для человека существенную опасность, так как является высокотоксичным радиоактивным изотопом. Риск облучения персонала, контактирующего с тритием, очень высок в связи с тем, что этот изотоп не удерживается современными фильтрующими системами защиты органов дыхания и способен проникать через кожу. При этом в форме тритированной воды тритий в 10 000 раз токсичнее, чем в виде молекулярного водорода, так как пары тритированной воды уже при комнатной температуре практически мгновенно обменивают изотопы водорода, моментально попадая за счёт этого в организм человека. Значительная часть трития при переработке радиоактивных отходов сбрасывается в атмосферу или попадает в Мировой океан. И обращение с отходами, содержащими тритий (особенно с низкоактивными, которых очень много), до сих пор представляет собой серьёзную проблему, ожидающую своего решения.
***
Кто бы мог предугадать 100 лет назад, что самый первый и самый простой из химических элементов — водород преподнесёт нам столько сюрпризов, столько радости и страхов, надежд и разочарований? Сегодня хочется верить, что все знания, полученные человечеством, будут направлены только на созидание, а не на разрушение, а изотопы водорода со своими удивительными свой-ствами помогут нам ещё не раз заглянуть в сокровенные тайники Природы и сделать немало интересных и полезных открытий.
Автор выражает благодарность Г. М. Тер-Акопьяну (ОИЯИ), А. А. Юхимчуку (РФЯЦ-ВНИИЭФ), Л. А. Ривкису, М. И. Белякову, А. Н. Букину, А. С. Аникину, Н. Е. Забировой, А. В. Лизунову и всему тритиевому отделу АО «ВНИИНМ» им. академика А. А. Бочвара, а также специалистам кафедры технологии изотопов РХТУ им. Д. И. Менделеева, особенно М. Б. Розенкевичу и Ю. С. Паку, которые оказали помощь при подготовке материала.
***
Не только тяжёлые изотопы водорода имеют собственные красивые имена. Привычный нам самый лёгкий и распространённый изотоп водорода тоже имеет специальное обозначение — протий. Все три названия этих изотопов появились ещё до открытия трития, когда Г. Юри, Д. Мерфи и Ф. Брикведде 5 июня 1933 года предложили их в письме редактору научного журнала «The Journal of Chemical Physics». Названия изотопов водорода происходят от греческих слов «protos» (первый), «deuteros» (второй) и «tritos» (третий). Интересно отметить, что название «протий» менее известно широкой общественности, чем имена тяжёлых и намного более редких его «собратьев». В последнее время в интернете появились такие названия, как «квадий», «пентий», «гексий» и «септий», отнесённые к чрезвычайно короткоживущим изотопам водорода массой от 4 до 7 и с периодами полураспада 10–22 — 10–23 с. Однако, по-видимому, эти названия не имеют под собой основы и являются одним из «фейков» интернета. В частности, профессор Г. М. Тер-Акопьян, который с коллективом ОИЯИ (г. Дубна) впервые получил в 2001 году ядра пятого изотопа водорода, названия «пентий» ему не давал и никогда не слышал упоминания такого термина в научных публикациях и на конференциях.
Комментарии к статье
* Ректификация — разделение жидких смесей на практически чистые компоненты, отличающиеся температурами кипения, путём многократных испарений жидкости и конденсации паров. Разделение сжиженных газовых смесей ректификацией проводят при очень низких температурах под избыточным давлением.
** На азотно-туковых заводах из природного газа получают дешёвые азотные удобрения.
*** Название АКУЛИНА происходит от английского «accurate line» — аккуратная (прецизионная) линия.
Разница между Протием и Дейтерием
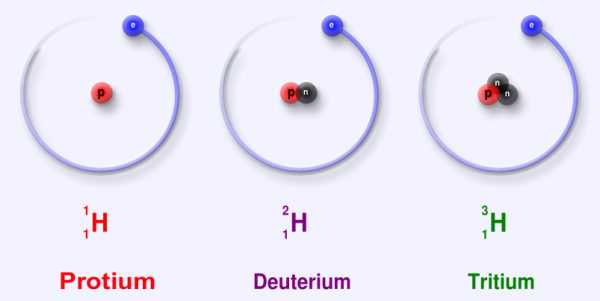
Ключевое различие между Протием и Дейтерием состоит в том, что у Протия нет нейтронов в его атомном ядре, тогда как у Дейтерия есть один нейтрон.
Протий и Дейтерий являются изотопами водорода. Они отличаются друг от друга по количеству нейтронов, присутствующих в их атомном ядре. Водород содержит один протон в атомном ядре: таким образом, атомный номер водорода равен 1. Существует три изотопа водорода и все три изотопа содержат один протон, а количество нейтронов у них разное. Называются они Протий, Дейтерий и Тритий, а обозначают их 1H, 2H и 3H. Значения в верхнем индексе являются атомными массами этих элементов.
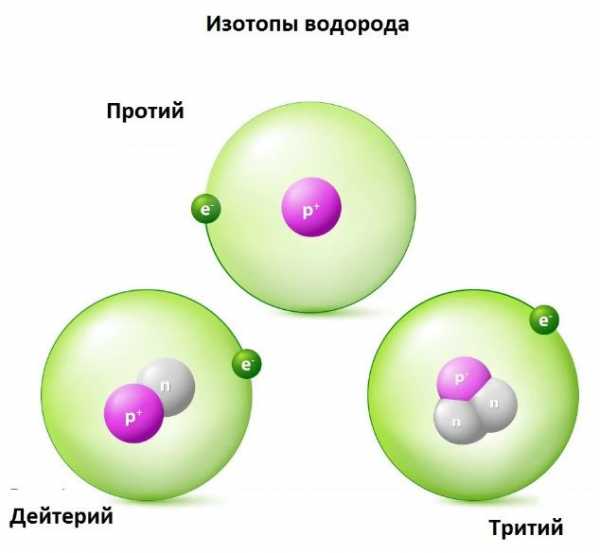 Три изотопа водорода — Протий, Дейтерий и Тритий
Три изотопа водорода — Протий, Дейтерий и ТритийСодержание
- Обзор и основные отличия
- Что такое Протий
- Что такое Дейтерий
- В чем разница между Протием и Дейтерием
- Заключение
Что такое Протий?
Протий — это изотоп водорода, который содержит один протон и один электрон. У него нет никаких нейтронов в атомном ядре. У него в ядре присутствует только один протон.
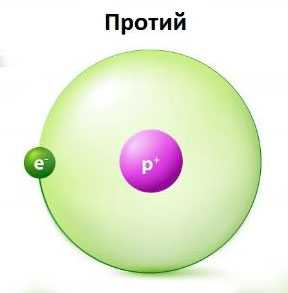 Протий — изотоп водорода
Протий — изотоп водородаЭтот изотоп назван так из-за присутствия этого единственного протона. Обозначается он как 1Н или водород-1, где 1 — атомная масса протия.
Протий является наиболее распространенным изотопом водорода. Количество его составляет около 99% всего водорода. Он является стабильным изотопом, так как протон в этом атоме никогда не подвергался распаду. Однако, согласно теориям, он подвергается распаду с очень большим периодом полураспада, из-за этого увидеть этот распад не представляется возможным.
Что такое Дейтерий?
Дейтерий — это изотоп водорода, имеющий протон, нейтрон и электрон. В отличие от протия, этот изотоп имеет протон и нейтрон вместе в атомном ядре. Следовательно, атомная масса этого изотопа равна 2. Дейтерий ещё называют водород-2 или 2Н. Он, также является стабильным изотопом водорода. Количество дейтерия очень мало по сравнению с протием и оно колеблется в пределах от 0,0026 до 0,0184%. В отличие от трития, дейтерий не является радиоактивным веществом и не является токсичным.
 Дейтерий — изотоп водорода
Дейтерий — изотоп водородаВода обычно содержит водород-1 в сочетании с атомами кислорода. Но в ней может быть водород-2 в сочетании с кислородом, который образует воду. Эта вода называется — тяжелой водой. Химическая формула тяжелой воды — D2O, где D — это дейтерий, а O — кислород. Дейтерий и его соединения часто используются в химических экспериментах. Например, они применяются в качестве нерадиоактивных меток в экспериментах, таких как растворители, используемые в ЯМР-спектроскопии. Кроме того, тяжелую воду используют в качестве замедлителя нейтронов и теплоносителя для ядерных реакторов. Также, дейтерий является топливом для ядерного деления, и используют его в промышленности.
В чем разница между Протием и Дейтерием?
Существует три изотопа водорода: Протий, Дейтерий и Тритий. Ключевое различие между Протием и Дейтерием состоит в том, что у Протия нет нейтронов в его атомном ядре, тогда как у Дейтерия есть один нейтрон. Поэтому эти три изотопа отличаются друг от друга по количеству нейтронов, присутствующих в их атомном ядре. Кроме того, атомная масса протия равна 1, а атомная масса дейтерия равна 2.
Кроме того, изотоп водорода — Протий обозначается еще, как водород-1 или 1H, а дейтерий — как водород-2 или 2H. Протий является наиболее распространенным изотопом водорода, и его содержание составляет около 99% всего водорода. Тогда как Дейтерий сравнительно менее распространен (около 0,002%). Тем не менее, он также стабилен как Протий.
Заключение — Протий против Дейтерия
Существует три изотопа водорода: Протий, Дейтерий и Тритий. Эти три изотопа отличаются друг от друга в зависимости от атомной массы, которая является числом протонов и нейтронов в атомном ядре. Ключевое различие между Протием и Дейтерием заключается в том, что у Протия нет нейтронов в его атомном ядре, тогда как у Дейтерия есть один нейтрон.
Дейтерий — Википедия. Что такое Дейтерий
Дейте́рий (лат. deuterium, от греч. δεύτερος «второй»), тяжёлый водород, обозначается символами D и 2H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона.
Открыт в 1932 г. американским физико-химиком Г. Юри. Природное содержание — 0,0115 ± 0,0070[2] %.
Изотопные модификации соединений водорода
Соединения изотопов водорода практически не различаются по химическим свойствам, но обладают довольно различными физическими свойствами (температура плавления, кипения, вес)[3]. Молекула D2, состоит из двух атомов дейтерия. Вещество имеет следующие физические свойства:
- Температура плавления −254,5 °C.
- Температура кипения −249,5 °C (23,57K).
- Межъядерное расстояние 0,07416 нм[4].
- Энергия диссоциации (при 0K) 439,68 кДж/моль[4].
Содержание дейтерия в природном водороде — 0,011…0,016 ат.%[5]. Так, в морской воде у берегов соотношение атомных концентраций [D]/[Н] составляет (1,55÷1,56)·10−4 (один атом дейтерия на 6410÷6450 атомов протия), в околоповерхностных водах — (1,32÷1,51)·10−4 (1:6600÷7600), в природном газе — (1,10÷1,34)·10−4 (1:7500÷9100)[5].
По своим химическим свойствам соединения дейтерия имеют определенные особенности. Так, например, углерод-дейтериевые связи оказываются более «прочными», чем углерод-протиевые, из-за чего химические реакции с участием атомов дейтерия идут в несколько раз медленнее. Этим, в частности, обусловлена токсичность тяжёлой воды (вода состава D2O называется тяжёлой водой из-за большой разницы в массе протия и дейтерия).
Получение
Мировое производство дейтерия — десятки тысяч тонн в год. Крупнейшими производителями тяжёлой воды в мире являются Индия, Китай и Иран[6]. В промышленности для получения тяжелой воды (обогащения воды дейтерием) в своей основе служат процессы ионного обмена, в особенности Girdler Sulfide process, использующий изотопный обмен между водой и сероводородом. Также используется многоступенчатый электролиз воды, ректификация воды, аммиака, жидкого водорода и т. д.[4] При электролизе 100 л воды выделяется 7,5 мл 60-процентного D2O[7].
Содержание дейтерия в природной воде в 1,03 раза больше, чем в паре (это коэффициент разделения для данной смеси). Поэтому если после кипячения не всю воду выливать, а подливать к остатку природной воды и снова кипятить, то в воде чайника постепенно будет происходить накопление тяжелой воды. Однако очень медленное, поэтому даже при большом количестве повторений этого процесса содержание тяжелой воды не станет опасным для здоровья, вопреки предположению В. В. Похлебкина в книге «Чай. Его типы, свойства, употребление», вышедшей в 1968 году[8].
История открытия и изучения
Дейтерий был открыт в 1932 году Гарольдом Юри и его сотрудниками спектральным методом.
Резерфорд, недовольный предложенным открывателями названием «дейтон»[9], предложил вариант названия — «диплоген», а ядро, соответственно, — «диплон».
Учёные высказывали гипотезу о существовании стабильных изотопов лёгких элементов ещё в 1913 году при изучении неона. Существование этих изотопов было доказано в 1920 году методом масс-спектрометрии. Правда, в то время преобладала теория, согласно которой изотопы различались числом «внутриядерных электронов» различных атомов элемента (нейтрон был открыт позже — в 1932 году). Измерения относительной атомной массы водорода дали значение, близкое к 1 а. е. м., которое равно массе протона. Поэтому предполагалось, что водород не может содержать внутриядерный электрон, иначе он скомпенсирует заряд ядра. Таким образом, считалось, что у водорода нет тяжёлых изотопов.
Дейтерий впервые был открыт химиком Гарольдом Юри, работавшим в Колумбийском университете в конце 1931 года. Фердинанд Брикведде, который помогал Юри, провёл дистилляцию пяти литров жидкого водорода, полученного в криогенном цикле. Брикведде работал в новой лаборатории низких температур, открытой в Национальном бюро стандартов и весов США (NIST). В результате объём жидкости составил 1 мл. Ранее такая же методика использовалась для наработки тяжелых изотопов неона. Техника испарения жидкого водорода позволила увеличить долю изотопа водорода с массой 2 до такой степени, чтобы его можно было надежно зарегистрировать методами спектроскопии[10].
15 июня 1933 года Юри, Мерфи и Брикведде направили письмо редактору научного журнала «The Journal of Chemical Physics», в котором предложили названия для изотопов водорода — протий (англ. protium), дейтерий (англ. deuterium) и тритий (англ. tritium; в случае его открытия, поскольку на тот момент тритий ещё не был открыт), в письме они отмечали, что произвели первые два названия от греческих слов «protos» («первый») и «deuteros» («второй»)[11][12]. В 1934 году Юри была присуждена Нобелевская премия по химии за открытие дейтерия.
Применение
Наибольшие количества дейтерия применяются в атомной энергетике[6]. Он обладает самыми лучшими свойствами замедления нейтронов. В смеси с тритием или в соединении с литием-6 (гидрид лития 6LiD) применяют для термоядерной реакции в водородных бомбах. При взрыве происходят реакции: D (d, γ) 4He, D (t, n) 4He Также применяется в качестве меченого стабильного индикатора в химических, биологических и других лабораторных исследованиях и технике[6]. Перспективным также представляется применение дейтерия (в смеси с тритием) для получения высокотемпературной плазмы, необходимой для осуществления управляемого термоядерного синтеза (см. проект ITER)[6].
С некоторых пор дейтерий используется в медицине компаниями, разрабатывающими лекарства, которые с его помощью пытаются увеличить время метаболизма лекарства, то есть замедлить его вывод из организма, это замедление в модифицированных дейтерием лекарствах наблюдается благодаря первичному дейтериевому изотопному эффекту — уменьшению скорости реакции разрыва углерод-дейтериевых связей по сравнению с углерод-протиевыми[13][14].
Также дейтерий используется в нейтронных генераторах[6].
Примечания
- ↑ 1 2 3 Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — DOI:10.1016/j.nuclphysa.2003.11.003. — Bibcode: 2003NuPhA.729..337A.
- ↑ 1 2 3 4 Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — DOI:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729....3A.
- ↑ Кузьменко, 2007, с. 298.
- ↑ 1 2 3 Бердоносов С. С. Дейтерий // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга — Робертсона — Стримеры. — 704 с. — 40 000 экз. — ISBN 5-85270-087-8.
- ↑ 1 2 Дейтерий / В кн.: Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ↑ 1 2 3 4 5 Александр Семёнов. Дейтерий и тритий: водород, да не тот // Наука и жизнь. — 2018. — № 8. — С. 45-51.
- ↑ Кузьменко, 2007, с. 299.
- ↑ Дейтерий — в чайнике? // Химия и жизнь. — 1969. — № 2. — С. 24—25.
- ↑ М. Олифант. Дни Кембриджа // Rutherford. Recollections of the Cambridge days". Elsevier, Amsterdam, 1972. (рус.)
- ↑ Urey H., Brickwedde F., Murphy G. A Hydrogen Isotope of Mass 2 (англ.) // Physical Review. — 1932. — Vol. 39. — P. 164—165. — DOI:10.1103/PhysRev.39.164. — Bibcode: 1932PhRv…39..164U.
- ↑ Urey H. C., Murphy G. M., Brickwedde F. G. (1933). «A Name and Symbol for H2*». The Journal of Chemical Physics 1: 512-513. DOI:10.1063/1.1749325.
- ↑ Dan O'Leary (2012). «The deeds to deuterium». Nature Chemistry 4: 236. DOI:10.1038/nchem.1273.
- ↑ Michael J. Barratt, Donald E. Frail. Drug Repositioning: Bringing New Life to Shelved Assets and Existing Drugs. — John Wiley & Sons, 2012. — P. 319.
- ↑ Graham L. Patrick. An Introduction to Drug Synthesis. — Oxford University Press, 2015. — P. 380.
Литература
- Кузьменко Н. Е., Ерёмин В. В., Попков В. А. Начала химии. — М.: Изд-во Экзамен, 2007. — Т. 1. — С. 299.
ДЕЙТЕРИЙ - это... Что такое ДЕЙТЕРИЙ?
(от греч. deuteros-второй; лат. Deuterium), D или 2H,- тяжёлый стабильный изотоп водорода с массовым числом 2; содержание в природном водороде 0,0156% (по массе). Масса 2,0141018 а. е. м. Ядро Д.- дейтрон - состоит из 1 протона и 1 нейтрона. Д. открыт в 1932 Г. Юри (H. Urey) совм. с сотрудниками спектральным методом.
Большое различие масс Д. и протия (1H) обусловливает различие их свойств (изотопные эффекты).
Так, t кип вещества, состоящего из молекул D2, -23,57К, межъядерное расстояние в молекуле D2-0,07416 нм, энергия диссоциации D2 (при OK) 439,68 кДж/моль (ср. с соответствующими значениями для H2 в ст. Водород). Скорости химических реакций с участием веществ, содержащих Д., могут быть в 5-10 раз выше или ниже, чем с участием таких же веществ, содержащих протий.
Д. выделяют на основе различий свойств протия и Д. Так, используют особенность изотопного обмена в системе вода - сероводород, применяют ректификацию жидкого водорода, многоступенчатый электролиз водных растворов и т. д.
Д. служит меченым стабильным индикатором при проведении разл. хим., биохим. и др. исследований. Тяжёлая вода D2O представляет собой лучший из известных замедлителей нейтронов. В водородных бомбах используется гидрид лития 6LiD; при взрыве водородной бомбы протекают термоядерные реакции:
В будущем Д., возможно, станет основным ядерным топливом. С. С. Бердоносов.
Физическая энциклопедия. В 5-ти томах. — М.: Советская энциклопедия. Главный редактор А. М. Прохоров. 1988.
ДЕЙТЕРИЙ - это... Что такое ДЕЙТЕРИЙ?
Дейтерий — Таблица нуклидов … Википедия
ДЕЙТЕРИЙ — (тяжелый водород), D, стабильный изотоп водорода, атомная масса 2,01416, газ. Ядро атома дейтерия называется дейтрон. Дейтерий замедлитель нейтронов (в виде тяжелой воды) в ядерных реакторах, изотопный индикатор. Дейтерий открыт американским… … Современная энциклопедия
дейтерий — изотоп, водород Словарь русских синонимов. дейтерий сущ., кол во синонимов: 2 • водород (10) • изотоп … Словарь синонимов
ДЕЙТЕРИЙ — (лат. deuterium от греч. deuteros второй), D, 2Н, тяжелый водород, стабильный изотоп водорода с массовым числом 2. Ядро атома (дейтрон) состоит из протона и нейтрона. С кислородом образует тяжелую воду. Открыт Г. Юри в 1932 … Большой Энциклопедический словарь
ДЕЙТЕРИЙ — [дэ, тэ ], я, муж. Тяжёлый водород, стабильный изотоп водорода. | прил. дейтериевый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ДЕЙТЕРИЙ — (от греч. deuteros второй; лат. Deuterium), D или 2H, тяжёлый стабильный изотоп водорода с массовым числом 2; содержание в природном водороде 0,0156% (по массе). Масса 2,0141018 а. е. м. Ядро Д. дейтрон состоит из 1 протона и 1 нейтрона. Д.… … Физическая энциклопедия
ДЕЙТЕРИЙ — тяжелый изотоп водорода с массовым числом 2. Отношение Н1/Н2 в космосе равно 1017, на Земле 6,41∙103; причины такого расхождения, вероятно, вызваны гравитационной дифференциацией и преимущественной потерей Землей более легкого изотопа.… … Геологическая энциклопедия
Дейтерий — Deuterium «тяжелый» изотоп водорода с атомной массой 2. Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
дейтерий — дейтерий. Произносится [дэйтэрий] … Словарь трудностей произношения и ударения в современном русском языке
дейтерий — Тяжелый изотоп водорода с атомной массой 2. [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN deuterium … Справочник технического переводчика
Дейтрон — Википедия
Материал из Википедии — свободной энциклопедии
Дейтро́н (дейто́н) — ядро изотопа водорода — дейтерия — с массовым числом A=2. Обозначается 2H, D или d.
Дейтрон состоит из 1 протона и 1 нейтрона. Стабилен. Не имеет возбуждённых состояний. Дейтрон является очень слабосвязанным ядром, его энергия связи равна лишь 2,22457 МэВ. Это единственное известное ядро, состоящее из двух нуклонов; дипротон и динейтрон не являются связанными системами. Масса дейтрона равна 3,343 583 20(17)⋅10−27кг, или 1875,612 793(47) МэВ[1].
Спин дейтрона равен 1, чётность положительна, сечение радиоактивного захвата тепловых нейтронов дейтроном (с образованием тритона — ядра трития) равно 0,52 миллибарн. Магнитный дипольный момент ядра равен +0,8574382329(92) ядерных магнетонов, электрический квадрупольный момент +0,2860(15) фм².
Дейтроны постоянно образуются в природе при захвате тепловых нейтронов свободными протонами в водородсодержащих средах:
- p+n→d+γ+2,22MэB{\displaystyle {}\mathrm {p} \;+{}\mathrm {n} \to {}\mathrm {d} +\gamma +2,22\;{\text{MэB}}}
Однако бо́льшая часть всех дейтронов во Вселенной образовалась (в основном по этой же реакции) во время первичного нуклеосинтеза в первые несколько минут после Большого Взрыва.
Дейтрон используется как бомбардирующая частица в ускорителях заряженных частиц. Малое сечение захвата нейтронов при одновременной эффективности их замедления (ввиду небольшой массы дейтронов нейтрон быстро теряет энергию при соударениях с ними) позволяет использовать дейтроны (обычно в виде тяжёлой воды, молекула которой содержит два дейтрона) для замедления нейтронов деления в ядерных реакторах.
Дейтроны при прочих равных условиях имеют более высокое, по сравнению с протонами, сечение взаимодействия во многих термоядерных реакциях. В результате дейтерий является гораздо более эффективным термоядерным горючим по сравнению с лёгким водородом; хотя тритий ещё более эффективен, но дейтерий стабилен и более дёшев. В термоядерном оружии дейтроны используются, как правило, в виде дейтерида лития-6.
М. Олифант, ученик Резерфорда, пишет об истории названия:
Берклиевская группа ион дейтерия назвала «дейтон». Резерфорду ужасно это название не нравилось, он считал его чересчур похожим на нейтрон и «ублюдочным словом». Он консультировался со своими коллегами-классиками из Тринити-колледж по поводу какого-либо другого названия и, насколько знаю, писал об этом ряду лиц. В результате он предложил для тяжелого изотопа водорода название «диплоген», а для его ядра — «диплон». Мы опубликовали несколько работ, в которых применяли эти названия, но попытки изменить американскую терминологию оказались безуспешными. Единственная уступка, сделанная в результате его кампании, — это понимание возможной путаницы дейтона с нейтроном, и в результате получилось — дейтрон. В конце концов Резерфорд, который ввел в науку названия частиц и излучения, испускаемых радиоактивными веществами, и создал слово «протон», согласился с этим решением. Он к этому вопросу не возвращался.
[1]
Тем не менее термин «дейтон» продолжает применяться до настоящего времени наряду с более распространённым вариантом «дейтрон».
Тритий — Википедия
Три́тий (др.-греч. τρίτος «третий») — радиоактивный изотоп водорода. Обозначается T или 3H. Ядро трития состоит из протона и двух нейтронов, его называют тритоном.
В природе тритий образуется в верхних слоях атмосферы при соударении частиц космического излучения с ядрами атомов, например, азота[3]. В процессе распада тритий превращается в 3He с испусканием электрона и антинейтрино (бета-распад), период полураспада — 12,32 года. Доступная энергия распада очень мала (18,59 кэВ), средняя энергия электронов 5,7 кэВ.
Тритий открыт английскими учёными Эрнестом Резерфордом, Маркусом Олифантом и Паулем Хартеком в 1934 году. Название для этого изотопа было предложено на случай открытия ещё до него, 15 июня 1933 года, Юри, Мерфи и Брикведде в том же письме редактору научного журнала «The Journal of Chemical Physics», где они предложили названия для двух известных изотопов водорода — протия и дейтерия[4][5]. Используется в биологии и химии как радиоактивная метка, в экспериментах по исследованию свойств нейтрино, в термоядерном оружии как источник нейтронов и одновременно термоядерное горючее, в геологии для датирования природных вод. Промышленный тритий получают облучением лития-6 нейтронами в ядерных реакторах по следующей реакции:
36Li+n→13H+24He{\displaystyle {}\mathrm {{}_{3}^{6}Li} +\mathrm {n} \rightarrow \mathrm {{}_{1}^{3}H} +\mathrm {{}_{2}^{4}He} }.
Тритий имеет период полураспада (12,32 ± 0,02) года[2]. Реакция распада трития имеет следующий вид:
13H→23He1++e−+ν¯e{\displaystyle {}\mathrm {{}_{1}^{3}H} \rightarrow \mathrm {{}_{2}^{3}He^{1+}} +e^{-}+{\bar {\nu }}_{e}}.
При этом выделяется 18,59 кэВ энергии, из них на электрон (бета-частицу) приходится в среднем 5,7 кэВ, а на электронное антинейтрино — оставшаяся часть. Образовавшиеся бета-частицы распространяются в воздухе всего на 6,0 мм и не могут преодолеть даже верхний слой кожи человека[6].
В силу малой энергии распада трития испускаемые электроны хорошо задерживаются даже простейшими преградами типа одежды или резиновых хирургических перчаток. Тем не менее, этот изотоп представляет радиационную опасность при вдыхании, поглощении с пищей, впитывании через кожу. Единичный случай употребления тритиевой воды не приводит к длительному накоплению трития в организме, так как его период полувыведения — от 7 до 14 дней[7][8].
По данным отчета Institute for Energy and Environmental Research (англ.)русск. 1996 года, в США с 1955 года было произведено около 225 кг трития[9]. В конце XX — начале XXI века наработка ведется на Watts Bar-1 путём облучения TPBAR (англ. tritium-producing burnable absorber rods), планируется также использование АЭС Секвойя. Переработку и выделение трития проводят на Tritium Extraction Facility, Саванна-Ривер[10].
В СССР и России тритий производился на реакторах АИ, АВ-3, ОК-180, ОК-190, РУСЛАН, Л-2; изотоп выделяется на заводе РТ-1 (ПО «Маяк»)[11][12].
Значительные количества трития (до 2,5—3,5 кг) для гражданских применений производит Канада на 21 тяжеловодном реакторе. Выделение изотопа — компания «Онтарио Хайдро», Дарлингтон[13].
Мировая коммерческая потребность в тритии на 1995 год составляет ежегодно около 400 г, и ещё порядка 2 кг требовалось для поддержания ядерного арсенала США[14] (7 кг для всех мировых военных потребителей). Около 4 кг трития в год образуется на АЭС, но не извлекается[15].
Большие количества трития потребуются для термоядерной энергетики: например, для запуска ITER потребуется как минимум около 3 кг трития, для запуска DEMO понадобится 4—10 кг[16]. Гипотетический тритиевый реактор потреблял бы 56 кг трития на производство 1 ГВт·года электроэнергии, тогда как всемирные запасы трития на 2003 год составляли всего 18 кг[16].
По словам Яна Беранека из организации «Гринпис», в 2010 году производство одного килограмма трития обходилось в 30 млн долларов[17].
Тритиевый брелок, свечение в темноте (снимок с длительной экспозицией).В 2012 году канадская фирма City Labs представила радиоизотопные генераторы электричества сверхмалой мощности на базе трития, способные питать различные микроэлектронные устройства, таких как RFID-метки, автономных датчиков, медицинские имплантаты. При цене порядка 1000 долларов срок службы генератора составляет около 20 лет[18].
Тритий используется в источниках подсветки в военных и гражданских приборах.
- ↑ 1 2 3 4 Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — doi:10.1016/j.nuclphysa.2003.11.003. — Bibcode: 2003NuPhA.729..337A.
- ↑ 1 2 3 Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729....3A.
- ↑ Архивированная копия (неопр.) (недоступная ссылка). Дата обращения 23 ноября 2014. Архивировано 29 ноября 2014 года.
- ↑ Urey H. C., Murphy G. M., Brickwedde F. G. A Name and Symbol for H2* (англ.) // Journal of Chemical Physics : journal. — 1933. — Vol. 1. — P. 512—513. — doi:10.1063/1.1749325.
- ↑ Dan O'Leary. The deeds to deuterium (англ.) // Nature Chemistry : journal. — 2012. — Vol. 4. — P. 236. — doi:10.1038/nchem.1273.
- ↑ Nuclide safety data sheet: Hydrogen-3 (неопр.) (недоступная ссылка). ehso.emory.edu. Дата обращения 12 июля 2014. Архивировано 20 мая 2013 года.
- ↑ Backgrounder on Tritium, Radiation Protection Limits, and Drinking Water Standards (англ.). U.S.NRC (February 2011). Дата обращения 5 октября 2012. Архивировано 14 октября 2012 года.
- ↑ R. V. Osborne. Review of the Greenpeace report: «Tritium Hazard Report: Pollution and Radiation Risk from Canadian Nuclear Facilities» (англ.) (pdf). Canadian Nuclear Association (August 2007). Дата обращения 5 октября 2012. Архивировано 14 октября 2012 года.
- ↑ Hisham Zerriffi. Tritium: The environmental, health, budgetary, and strategic effects of the Department of Energy's decision to produce tritium (англ.). Institute for Energy and Environmental Research (англ.)русск. (January 1996). Дата обращения 15 сентября 2010. полный текст Архивная копия от 13 ноября 2013 на Wayback Machine
- ↑ Михаил Сторожевой. Третируемый тритий (неопр.). ATOMINFO.RU (28 октября 2010). Дата обращения 13 ноября 2013.
- ↑ Производство плутония и трития для ядерного оружия (неопр.). Стратегическое ядерное вооружение СССР и России. Дата обращения 13 ноября 2013.
- ↑ Бекман. 6. РЕАКТОРЫ ДЛЯ НАРАБОТКИ ТРИТИЯ (неопр.). Дата обращения 13 ноября 2013.
- ↑ Martin В. Kalinowski, Lars С. Colschen International Control of Tritium to Prevent Horizontal Proliferation and to Foster Nuclear Disarmament // Science & Global Security, 1994, vol. 5, рр. 131—203
- ↑ Hisham Zerriffi. Tritium: The environmental, health, budgetary, and strategic effects of the Department of Energy’s decision to produce tritium (англ.). Institute for Energy and Environmental Research (1996). Дата обращения 13 ноября 2013.
- ↑ International Control of Tritium for Nuclear Nonproliferation and Disarmament, CRC Press, 2004, page 15
- ↑ 1 2 Tritium Supply Considerations, LANL, 2003. «ITER startup inventory estimated to be ~3 Kg»
- ↑ Alasdair Cros. Is fusion power really viable? (англ.) (5 March 2010). Дата обращения 19 января 2019.BBC News — Is fusion power really viable?
- ↑ Незаменимые батарейки: Сила трития (неопр.). Журнал «Популярная Механика» (27 августа 2012). — «Размерами с фалангу пальца, они используют радиоактивный распад для производства электричества – в небольших количествах, зато непрерывно в течение минимум лет двадцати. ... цена остается пока на уровне 1000 долларов». Дата обращения 13 ноября 2013.
ДЕЙТЕРИЙ - это... Что такое ДЕЙТЕРИЙ?
Дейтерий — Таблица нуклидов … Википедия
ДЕЙТЕРИЙ — ДЕЙТЕРИЙ, изотоп (D, или 2Н) водорода, ядра которого (ДЕЙТРОНЫ) помимо протона содержат также нейтрон. На каждый миллион атомов водорода, существующего в природе, приходится около 156 атомов дейтерия. Дейтерий находится также в воде (D2O, или… … Научно-технический энциклопедический словарь
дейтерий — изотоп, водород Словарь русских синонимов. дейтерий сущ., кол во синонимов: 2 • водород (10) • изотоп … Словарь синонимов
ДЕЙТЕРИЙ — (лат. deuterium от греч. deuteros второй), D, 2Н, тяжелый водород, стабильный изотоп водорода с массовым числом 2. Ядро атома (дейтрон) состоит из протона и нейтрона. С кислородом образует тяжелую воду. Открыт Г. Юри в 1932 … Большой Энциклопедический словарь
ДЕЙТЕРИЙ — [дэ, тэ ], я, муж. Тяжёлый водород, стабильный изотоп водорода. | прил. дейтериевый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ДЕЙТЕРИЙ — (от греч. deuteros второй; лат. Deuterium), D или 2H, тяжёлый стабильный изотоп водорода с массовым числом 2; содержание в природном водороде 0,0156% (по массе). Масса 2,0141018 а. е. м. Ядро Д. дейтрон состоит из 1 протона и 1 нейтрона. Д.… … Физическая энциклопедия
ДЕЙТЕРИЙ — тяжелый изотоп водорода с массовым числом 2. Отношение Н1/Н2 в космосе равно 1017, на Земле 6,41∙103; причины такого расхождения, вероятно, вызваны гравитационной дифференциацией и преимущественной потерей Землей более легкого изотопа.… … Геологическая энциклопедия
Дейтерий — Deuterium «тяжелый» изотоп водорода с атомной массой 2. Термины атомной энергетики. Концерн Росэнергоатом, 2010 … Термины атомной энергетики
дейтерий — дейтерий. Произносится [дэйтэрий] … Словарь трудностей произношения и ударения в современном русском языке
дейтерий — Тяжелый изотоп водорода с атомной массой 2. [http://pripyat.forumbb.ru/viewtopic.php?id=25] Тематики атомная энергетика в целом EN deuterium … Справочник технического переводчика