Электролит это что такое
Электролит - это... Что такое Электролит?
Электроли́т — вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Степень диссоциации
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации[1].
Классификация
Исходя из степени диссоциации все электролиты делятся на две группы
- Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
- Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Использование термина
В естественных науках
Термин электролит широко используется в биологии и медицине. Чаще всего подразумевают водный раствор, содержащий те или иные ионы (напр., «всасывание электролитов» в кишечнике).
В технике
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
В электрохимии
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например, электролит золочения).
В источниках тока
Электролиты являются важной частью химических источников тока: гальванических элементов и аккумуляторов.[2] Электролит участвует в химических реакциях окисления и восстановления с электродами, благодаря чему возникает ЭДС. В источниках тока электролит может находиться в жидком состоянии (обычно это — водный раствор), или загущённым до состояния геля.
Электролитический конденсатор
В электролитических конденсаторах в качестве одной из обкладок используется электролит. В качестве второй обкладки - металлическая фольга (алюминий), или пористый, спечённый из металлических порошков блок (тантал, ниобий). Диэлектриком в таких кондесаторах служит слой оксида самого металла, формируемый химическими методами на поверхности металлической обкладки.
Конденсаторы данного типа, в отличие от других типов, обладают несколькими отличительными особенностями:
- Высокая объемная и весовая удельная ёмкость.
- Требование к полярности подключения в цепях постоянного напряжения. Несоблюдение полярности вызывает бурное вскипание электролита, приводящее к механическому разрушению корпуса конденсатора (взрыву).
- Значительные утечки и зависимость электрической ёмкости от температуры.
- Ограниченный сверху диапазон рабочих частот (типовые значения сотни кГц … десятки МГц в зависимости от номинальной ёмкости и технологии).
Примечания
- ↑ Степень диссоциации (α) — отношение числа молекул, диссоциировавших на ионы к общему числу молекул растворенного электролита.
- ↑ ГОСТ 15596-82 Источники тока химические. Термины и определения
| B05A |
| ||
|---|---|---|---|
| B05B |
| ||
| B05C |
| ||
| B05D |
| ||
| B05X |
| ||
| B05Z |
Что такое электролит для аккумуляторов и как его приготовить?

Электролит – одна из основных составляющих аккумуляторных батарей, которые дают возможность запуска автомобиля. Он бывает нескольких видов, различающихся по своему составу. Своевременный контроль за количеством и качеством электролита в аккумуляторе позволит избежать преждевременный выход аккумулятора из строя и сэкономить на покупке нового устройства.
Содержание статьи
Виды, состав и особенности
На данный момент различают три вида электролитов для аккумуляторов, для щелочных аккумуляторов — щелочной, а для кислотных — кислотный, но так же выделяют и корректирующий электролит, необходимый при обслуживании батарей.
Как определить кислотный аккумулятор или щелочной? Проще всего это сделать по маркировке корпуса и по материалу, из которого он сделан. Корпус кислотных АКБ всегда изготавливается из специального пластика, тогда как щелочные батареи могут быть сделаны из металла. Так же можно определить протестировав каплю электролита из аккумулятора: кислотный электролит вступит в реакцию с содой или мелом.
Кислотный
Представляет собой смесь серной кислоты, составляющей тридцать пять процентов всего состава, и дистиллированной воды, которая занимает оставшиеся шестьдесят пять.  Данный состав в аккумуляторе находится в емкости со свинцовыми пластинами, при контакте этих элементов и происходит выработка тока.
Данный состав в аккумуляторе находится в емкости со свинцовыми пластинами, при контакте этих элементов и происходит выработка тока.
Преимущества кислотного электролита:
- Высокий уровень КПД
- Слабая потеря заряда при бездействии
- Выдача высокого стартового тока
- Невысокая стоимость
Недостатки:
- Чувствительность к перепадам температур
- Неэкологичность
- Необходимость регулярного контроля плотности состава
Следует отметить, что кислотный электролит используется в большинстве моделей аккумуляторных батарей для автомобилей, так как только он способен давать достаточное количество тока для запуска двигателя. При этом аккумуляторы, изготовленные с использованием данного раствора, делятся на две группы:
- Обслуживаемые
- Необслуживаемые
Первый вид обеспечивает легкий доступ к содержимому банок. В них можно замерять плотность электролита, при необходимости заливать дистиллированную воду и электролит, просто открутив крышки с банок.
В случае с необслуживаемыми моделями провести подобные действия также возможно, однако для этого нужно самостоятельно вскрыть устройство, провести нужные действия, а затем герметично их закрыть. В подобных случаях могут быть использованы дрель и сварочный аппарат.
Проводить замену электролита в необслуживаемых моделях стоит только в тех случаях, когда их гарантийный срок истек. Часто это производится исключительно для получения опыта проведения подобных операций.
Щелочной
Щелочной электролит состоит из гидроокиси калия, натрия, лития или всех этих составляющих в комплексе, разведенных в воде.
К достоинствам данного вида относятся:
- Длительный период службы
- Способность сохранять свойства при значительных перепадах температуры
- Гораздо меньшее выделение вредных газов в атмосферу
- Способность выдерживать встряски
- Неприхотливость в обслуживании

Недостатки:
- Меньшая величина электродвижущей силы по сравнению с кислотными
- Отсутствие способности подачи стартового тока для запуска двигателя
- Более высокая стоимость
Несмотря на долгий срок службы, неприхотливость и другие преимущества применение данного вида электролита в автомобильной промышленности ограничено. Виной тому неспособность выработки достаточного уровня стартового тока, необходимого для запуска двигателя. К минусам также относятся их внушительные габариты.
Однако устройства на щелочном электролите успешно применяются в обеспечении током тяговых и локомотивных составов.
Важно! Перед осуществлением замены следует убедиться, что аккумулятор именно щелочной. В противном случае АКБ можно полностью вывести из строя.
Корректирующий
Данный электролит является специальным составом с высоким содержанием активных веществ, используемый для повышения плотности электролита аккумулятора. Он предназначен для повышения концентрации активных веществ в батарее. 
В продаже можно встретить следующие виды корректирующего электролита:
- Твердый калиево-литиевый
- Жидкий калиево-литиевый с различной плотностью
- Жидкий кислотный
Корректирующий электролит можно изготовить самостоятельно, имея под рукой необходимые для этого составы, однако зачастую его проще купить, так как стоимость его более чем доступна.
Как пользоваться корректирующим электролитом:
- Удалить из банок немного электролита
- Долить в них такое же количество корректирующей жидкости
- Установить АКБ на заряд номинальным током для запуска процесса смешивания полученного состава на полчаса
- Оставить батарею на остывание на пару часов
- Произвести замер плотности и при необходимости отрегулировать его снова
При повторной коррекции количество заменяемого электролита следует уменьшить.
Как приготовить самостоятельно
Перед тем, как самостоятельно заменить электролит для аккумулятора, необходимо принять соответствующие меры безопасности и приготовить предметы индивидуальной защиты:

- Перчатки
- Фартук
- Защитные очки
- Раствор соды на случай попадания средства на кожу или предметы одежды
- Уксус или лимонную кислоту – для нейтрализации щелочи
Проводить действия следует в хорошо проветриваемом помещении с температурой воздуха не выше +25 C°. Следует заранее знать, какой объем готового электролита потребуется для заполнения батарей. В среднем, в современных АКБ количество раствора составляет от 2,6 до 3,7 литра. Поэтому стоит сразу ориентироваться на максимальное количество. За основу можно взять 4 литра конечного раствора.
Для приготовления электролита необходимо заранее приготовить следующие предметы:
- Посуду достаточной емкости, изготовленную из материала, устойчивого к воздействию кислоты и щелочи
- Небольшую палочку для перемешивания электролита
- Инструменты для проведения замеров плотности, температуры и уровня раствора
- Для кислотного электролита – серную жидкость, для щелочного – щелочь в твердом или жидком виде, литий или силикагель
Важно! Все используемые материалы должны быть химически нейтральными для исключения возникновения ненужных реакций при их соприкосновении. В качестве емкости вполне подойдут обычные стеклянные банки.
Процесс приготовления щелочного электролита
Ингредиенты для приготовления данного состава могут быть как в жидком виде, так и в твердом. Если с первым все понятно, то перед тем как залить, щелочной электролит из твердого вещества потребуется развести в дистиллированной воде.
Требуемая плотность указывается на сайте производителя аккумулятора, также информацию можно найти в прилагаемой инструкции по эксплуатации. Твердый электролит берется пропорционально нужному количеству окончательного жидкого раствора и составляет:
- 1/5 – для получения раствора плотностью 1,17-1,19 г/м³
- 1/3 – для раствора плотностью 1,19-1,21 г/м³
- 1/2 — для раствора плотностью 1,25-1,27 г/м³
Процесс приготовления состоит из следующих шагов:
- Налить в посуду дистиллированную воду
- Добавить нужное количество щелочи
- Перемешать раствор
- Плотно закрыть крышкой
- Настаивать в течение 6 часов
После того, как процесс настаивания будет завершен, необходимо слить светлый раствор. Если часть состава выпадает в осадок, нужно его регулярно перемешивать. При заливке нужно следить, чтобы он остался на дне, не попав в аккумулятор, в противном случае это грозит выходом АКБ из строя.
Приготовление раствора для свинцовых аккумуляторов
Перед тем, как разбавить кислотный электролит, необходимо определить нужные пропорции. Они зависят от климатических условий, в которых планируется эксплуатация устройства.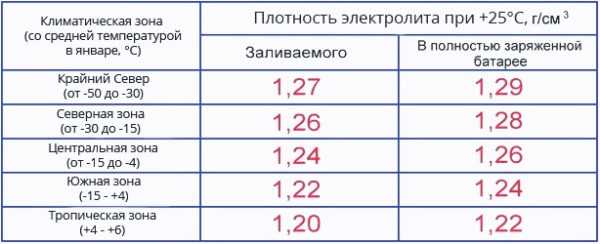
Для получения электролита плотностью 1,28 г/м³, что приемлемо для средних климатических условий, потребуется в один литр дистиллированной воды влить 0,36 л серной кислоты. Для жарких регионов количество серной кислоты уменьшается до 0,33 л на то же количество воды.
Как разводить аккумуляторную кислоту:
- Налить в подготовленную емкость дистиллированную воду
- Аккуратно тонкой струйкой влить в нее кислоту
- Измерить плотность полученного раствора
- Оставить раствор настаиваться на 12 часов
Важно! Нельзя вливать воду в кислоту! Правильно — вливать кислоту в воду. Не следует торопиться, вливая кислоту, давайте возможность ей постепенно раствориться в воде.
Инструкция по замене
Замена электролита производится в следующих случаях:
- Электролит в банках изменил цвет, стал мутным. Причиной тому может быть использование не дистиллированной воды для добавки, а обычно. Она может содержать примеси, вступающие в химическую реакцию с электролитом и образовывая твердые соединения, выпадающие в осадок
- После зарядки аккумулятора невозможно добиться нужной плотности
- Электролит вытек по неосторожности
- Новый аккумулятор быстро разряжается. Причиной тому может быть замерзание раствора

Замена электролита, независимо от того, является он щелочным или кислотным, производится в несколько шагов:
- Демонтаж аккумулятора из транспортного средства
- Очистка АКБ от загрязнений
- Выкачивание имеющейся жидкости с помощью груши или шприца
- Промывка банок дистиллированной водой
- Заливка электролита с помощью груши или аналогичных приспособлений
Уровень заливки определяется метками внутри банок. Если они отсутствуют, нужно руководствоваться правилом – электролит должен быть на уровне выше пластин на 5-7 миллиметров. При этом от его уровня до крышек банок должно оставаться не менее двух сантиметров.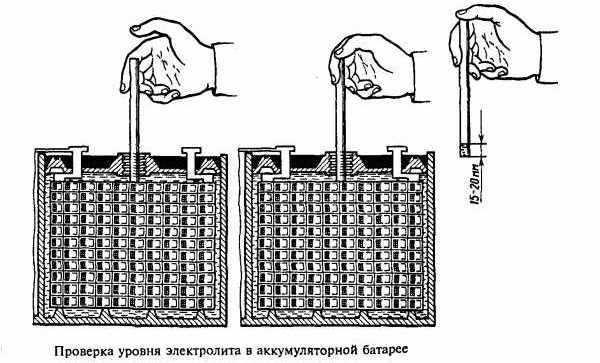
Очень важно при сливе электролита не наклонять его в сторону и тем более не переворачивать. На дне сосудов могут оказаться твердые частицы, которые застрянут в пластинах, полностью выведя их из строя. Допускается легкое покачивание воды из стороны в сторону при промывании, такие же действия можно производить после заливки электролита в аккумулятор.
После этого АКБ устанавливается на зарядку, после чего следует проверить получившуюся плотность. Замеры должны производиться не арене, чем через пару часов после снятия устройства с зарядки, так как существует риск получить завышенные показания. Если плотность недостаточно высокая или, напротив, имеет излишние значения, ее следует отрегулировать добавлением кислоты, щелочи или дистиллированной воды.
Полезное видео
Видео инструкция о замене электролита
Заключение
Независимо от типа электролита, используемого в эксплуатируемой АКБ, можно самостоятельно произвести его полную замену, проверку плотности и других показателей. Однако стоит помнить о технике безопасности, так как электролит – опасный химический состав, способный значительно повредить кожные покровы и глаза.
Электролиты: свойства и классификации
Электролиты – растворы, имеющие в своем составе заряженные частицы, которые принимают участие в переносе зарядов между электродом и катодом. Могут быть сильными и слабыми. Процесс распада молекул на ионы называется электролитической диссоциацией. Неэлектролиты – водные растворы, в которые вещество перешло в виде молекул с сохранением первоначальной структуры. Все молекулы вещества в таких растворах окружены гидратными оболочками (молекулами воды) и не могут переносить электрический заряд.
Растворение кристалла поваренной соли
Как протекает электролитическая диссоциация
Вещества-электролиты устроены за счет ионных или ковалентных полярных связей.
Во время растворения происходит химическое воздействие вещества с молекулами воды, в результате чего оно распадается на электроны. Молекулы воды – активные диполи с двумя полюсами: положительным и отрицательным. Атомы водорода располагаются под углом 104,5°, за счет этого молекула воды приобретает угловую форму.
Вещества, имеющие ионную кристаллическую решетку, намного легче диссоциируют, они уже состоят из активных ионов, а диполи воды во время растворения только ориентируют их. Между диполями воды и ионами электролита возникают усилия взаимного притяжения, связи кристаллической решетки ослабевают и ионы покидают кристалл.
Последовательность процессов при диссоциации растворов с ионной связью
На первом этапе молекулы вещества ориентируются около диполей воды, далее происходит гидратация, а на завершающем этапе диссоциация.
Похожим образом диссоциируют электролиты, у которых молекулы строятся за счет ковалентных связей. Разница только в том, что диполи воды превращают ковалентные связи в ионные. При этом наблюдается такая последовательность процессов:
Электролитическая диссоциация полярной молекулы хлороводорода на гидратированные ионы
В растворах происходит хаотическое движение гидратированных ионов, они могут сталкиваться между собой и опять образовывать отдельные связи. Такой процесс называется ассоциацией.
Классификация электролитов
Все электролиты кроме ионов содержат молекулярные структуры, неспособные переносить разряд. Процентное содержание этих элементов оказывает прямое влияние на возможность проводить ток, параметр обозначается α и определяется по формуле:
Для вычисления берется отношение количества частиц, распавшихся на ионы к общему числу растворенных частиц. Степень распада определяется опытным путем, если она равняется нулю, то диссоциация полностью отсутствует, если равняется единице, то все вещества в электролите распались на ионы. С учетом химического состава электролиты имеют неодинаковую степень диссоциации, параметр зависит от природы и концентрации раствора, чем ниже концентрация, тем выше диссоциация. Согласно данным определениям все электролиты делятся на две группы.
- Слабые электролиты. Имеют очень незначительную степень диссоциации, химические элементы почти не распадаются на ионы. К таким электролитам относится большинство неорганических и некоторые органические кислоты. Слабые электролиты расщепляются на ионы обратимо, процессы диссоциации и ассоциации по интенсивности могут сравниваться, раствор очень плохо проводит электрический ток.
Способность к диссоциации зависит от нескольких факторов, слабые электролиты во многом определяются химическими и физическими особенностями вещества. Важное значение имеет химический состав растворителя.
- Сильные электролиты. Эти растворы в водных растворах интенсивно диссоциируют на ионы, сильные электролиты могут иметь степень диссоциации равную единице. К ним относятся почти весь перечень солей и многие кислоты неорганического происхождения. Сильные электролиты диссоциируют необратимо:
От каких факторов зависит степень диссоциации
- Природа растворителя. Степень диссоциации веществ увеличивается прямо пропорционально полярности. Чем больше полярность, тем выше активность имеют сильные электролиты.
- Температура во время подготовки раствора. Повышение температуры растворителя увеличивает активность ионов и их количество. Правда, при этом есть вероятность одновременного повышения ассимиляции. Процесс растворения веществ в растворителе должен непрерывно контролироваться, при обнаружении отклонений от заданных параметров немедленно вносятся корректировки.
- Концентрация химических веществ. Чем выше концентрация, тем больше вероятность, что после растворения образуются слабые электролиты.
График зависимости константы диссоциации от концентрации
Главные положения теории электролитической диссоциацииСогласно существующей теории, электролитическая диссоциация позволяет растворам проводить электрический ток. В зависимости от этой способности они делятся на электролиты и неэлектролиты. Процесс распада веществ на ионы называется диссоциацией, положительно заряженные двигаются к катоду и называются катионами, негативно заряженные двигаются к аноду и называются анионами. Состав электролитов оказывает влияние на способность к диссоциации, технические нормы позволяют определять эту зависимость количественно.
С учетом получаемых после диссоциации ионов изменяется свойство электролитов. Вне зависимости от химического характера образуемых после диссоциации ионов, электролиты подразделяются на три большие классы:
1.Кислоты. В результате распада образуются анионы кислотного остатка и катионы водорода. Кислоты многоосновные могут преобразовываться по первой степени:
2. Основания. Электролиты, дисоциирующие на анионы гидроксогрупп и катионы металла.
3. Соли. Электролиты диссоциируют на анионы кислотного остатка и катионы металлов. Процесс происходит в одну ступень.
Химические свойства электролитов описываются при помощи химических уравнений и определяются свойствами образованных ионов. Для удаления вредных химических соединений, выделяемых в воздух во время диссоциации, используются химически нейтральные пластиковые воздуховоды.
Перспективы развития теории диссоциацииНа современном этапе развития теории ученые предпринимают попытки описать динамические и термодинамические свойства электролитов учитывая концепцию ионно-молекулярной структуры. Классическая теория считается примитивной, в ней ионы представляются как заряженные жесткие сферы. Главный недостаток традиционной теории – невозможность объяснить локальное снижение диэлектрической проницательности в первом приближении. Ряд растворителей поддается описанию физических свойств ступенчатой зависимостью, но протонные водные растворители имеют намного сложнее процессы релаксации.
Непримитивные модели, рассматривающие ионы в одинаковом масштабе, делятся на две группы:
- Первая. Жидкие фазы рассматриваются как максимально разупорядочные кристаллы, размеры не более пяти молекулярных диаметров.
- Вторая. Жидкости описываются как сильно неидеальные газы. Молекулы растворителя являются точными или обыкновенными диполями.
Зависимость диэлектрической проницаемости от расстояния между ионами
Неравновесные явления в растворах электролитов
Неравновесный распад объясняется несколькими физическими процессами.
- Миграцией и диффузией ионов. Обуславливается сравнительно большим количеством ионных перескоков за единицу времени в сравнении с иными направлениями.
Контакт двух растворов с различными показателями концентрации
- Эквивалентной и удельной электропроводностью. Электропроводность обеспечивается миграцией ионов, замеры выполняются таким способом, чтобы исключалось влияние градиента химического потенциала.
Принципиальная схема моста переменного тока во время измерения электропроводности
- Числом переноса. Определяется суммой электрической проворности аниона и катиона. Доля тока называется электрическим числом переноса.
Схема определения числа переноса
Перемещение ионов в среде электрического поля по статистике является усредненным процессом, ионы делают беспорядочные перескоки, а элегическое поле оказывает только определенное влияние, точно рассчитать силу и вероятность влияния невозможно. В связи с этим, аналогия диссоциации с обыкновенным поступательным движением твердых тел весьма приближенная, но она позволяет принимать правильные качественные выводы.
ЭЛЕКТРОЛИТ - это... Что такое ЭЛЕКТРОЛИТ?
электролит — электролит … Орфографический словарь-справочник
ЭЛЕКТРОЛИТ — (греч.). Жидкое тело, разлагаемое при помощи электрического (гальванического) тока. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЭЛЕКТРОЛИТ Жидкость, подверженная разложению посредством гальванического тока.… … Словарь иностранных слов русского языка
электролит — а, м. électrolyte m. < électro + гр. lytos разлагаемый. спец. Химическое вещество (в расплаве или растворе), способное разлагаться на составные части при прохождении через него электрического тока. Электролит аккумулятора. БАС 1. Швыряло… … Исторический словарь галлицизмов русского языка
электролит — Раствор, в котором при прохождении через него электрического тока происходит разложение вещества, которое приводит к появлению электрического тока. Электролит является основой аккумуляторов и батарей. [Гипертекстовый энциклопедический словарь по… … Справочник технического переводчика
ЭЛЕКТРОЛИТ — ЭЛЕКТРОЛИТ, электролита, муж. (от слова электрический и греч. lytos растворенный) (физ.). Раствор какого нибудь вещества, способного разлагаться на составные части при электролизе. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
электролит — сущ., кол во синонимов: 1 • католит (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Электролит — Электролитами называют вещества, растворы и сплавыкоторых с другими веществами электролитически проводят гальваническийток. Признаком электролитической проводимости в отличие от металлическойдолжно считать возможность наблюдать химическое… … Энциклопедия Брокгауза и Ефрона
электролит — – вещество, водный раствор или расплав которого проводит электрический ток. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ЭЛЕКТРОЛИТ — вещество, водный раствор или расплав которого проводит электрический ток (см.), образующимися в результате электролитической (см.). Этим Э., называемые также (см.) второго рода, отличаются от металлов (проводников первого рода), в которых перенос … Большая политехническая энциклопедия
Электролит — Электролит вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.… … Википедия
Электролиты - это... Что такое Электролиты?
Электроли́т — химический термин, обозначающий вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Степень диссоциации
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации[1].
Классификация
Исходя из степени диссоциации все электролиты делятся на две группы
- Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты.
- Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот, основания p-, d-, и f-элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Использование термина "Электролит"
В естественных науках
Термин электролит широко используется в биологии и медицине. Чаще всего подразумевают водный раствор, содержащий те или иные ионы (напр., "всасывание электролитов" в кишечнике).
Электролиты в технике
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
Электролит в электрохимии
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например, электролит золочения).
Электролит аккумуляторный
Обиходное название раствора серной кислоты для свинцовых аккумуляторов
Электролитический конденсатор
относящийся к типу «Электролитический», в котором в качестве одной из обкладок используется электролит. Конденсаторы данного типа, в отличии от других типов, обладают несколькими отличительными особенностями
- при очень маленьких габаритных размерах обладают на несколько порядков большей ёмкостью
- при проектировании электрических схем и при монтаже электролитов необходимо соблюдать полярность подключения, в противном случае они обязательно взрываются (в худшем случае) или просто вздуваются и вытекают (в лучшем)[2]
- работают на существенно низких частотах, в пределах всего лишь нескольких десятков кГц, конденсаторы большинства других типов могут работать на частотах до десятков, сотен, тысяч мГц и выше.
Примечания
- ↑ Степень дисссоциации (α) — отношение числа молекул, диссоциировавших на ионы к общему числу молекул растворенного электролита.
- ↑ Исключением являются специальные неполярные электролитические конденсаторы, которые представляют из себя два электролитических конденсатора в одном корпусе, включённые последовательно и обязательно встречной друг другу полярностью (плюс к плюсу или минус к минусу)
См. также
Wikimedia Foundation. 2010.
Электролит (химия) - это... Что такое Электролит (химия)?
- Электролит (химия)
-
Электроли́т — химический термин, обозначающий вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов и обладающие вследствие этого ионной проводимостью.
Степень диссоциации
В растворах некоторых электролитов диссоциирует лишь часть молекул. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации[1].
Классификация
Исходя из степени диссоциации все электролиты делятся на две группы
- Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты.
- Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот, основания p-, d-, и f-элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Использование термина "Электролит"
В естественных науках
Термин электролит широко используется в биологии и медицине. Чаще всего подразумевают водный раствор, содержащий те или иные ионы (напр., "всасывание электролитов" в кишечнике).
Электролиты в технике
Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл.
Электролит в электрохимии
Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например, электролит золочения).
Электролит аккумуляторный
Обиходное название раствора серной кислоты для свинцовых аккумуляторов
Электролитический конденсатор
относящийся к типу «Электролитический», в котором в качестве одной из обкладок используется электролит. Конденсаторы данного типа, в отличии от других типов, обладают несколькими отличительными особенностями
- при очень маленьких габаритных размерах обладают на несколько порядков большей ёмкостью
- при проектировании электрических схем и при монтаже электролитов необходимо соблюдать полярность подключения, в противном случае они обязательно взрываются (в худшем случае) или просто вздуваются и вытекают (в лучшем)[2]
- работают на существенно низких частотах, в пределах всего лишь нескольких десятков кГц, конденсаторы большинства других типов могут работать на частотах до десятков, сотен, тысяч мГц и выше.
Примечания
- ↑ Степень дисссоциации (α) — отношение числа молекул, диссоциировавших на ионы к общему числу молекул растворенного электролита.
- ↑ Исключением являются специальные неполярные электролитические конденсаторы, которые представляют из себя два электролитических конденсатора в одном корпусе, включённые последовательно и обязательно встречной друг другу полярностью (плюс к плюсу или минус к минусу)
См. также
Wikimedia Foundation. 2010.
- Электролиния Экибастуз-Кокчетав
- Электролиты
Смотреть что такое "Электролит (химия)" в других словарях:
электролит — – вещество, водный раствор или расплав которого проводит электрический ток. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
Электролит — Электролит вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.… … Википедия
Наводороживание ПТК при катодной поляризации (i=1500 А/м2, электролит: 250±5 г/л K2CO3 +35±3 г/л) — Толщина платинового покрытия, мкм Длительность катодной поляризации, ч Температура, °С Содержание h3, мл/100 г металла 2,7 45 … Химический справочник
Числа переноса катионов в водных растворах при 25 °С — Электролит Эквивалентная концентрация, моль/л 0 0,01 0,02 0,05 0,1 0,2 … Химический справочник
Электрофоретическое поведение ионов CrO42-, Cu(II), Al(III), Fe(III), Cr(III) в 0,5 М растворах сульфатов — Электролит Движение, мм CrO42 Cu(II) Al(III) Fe(III) Cr(III) Na2SO4 … Химический справочник
Электрохимия — Электрохимия раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и… … Википедия
КОЛЛОИДЫ — КОЛЛОИДЫ, КОЛЛОИДНАЯ ХИМИЯ. Коллоиды (от греч. ко 11а клей, желатина), название, данное Грэмом (Graham) группе веществ, типичными представителями которых являются желатина или гум ми арабик. Коллоидная химия является наиболее молодой хим.… … Большая медицинская энциклопедия
Тетрахлороаурат(III) водорода — Общие Т … Википедия
Цезий — 55 Ксенон ← Цезий → Барий … Википедия
Литий — Запрос «Lithium» перенаправляется сюда; см. также другие значения. Эта статья о химическом элементе. О применении в медицине см. Препараты лития. 3 Гелий ← Литий … Википедия
Книги
- Неорганическая химия. Часть I. Поверхностные явления на границе оксид/электролит в кислых средах, Горичев Игорь Георгиевич, Атанасян Т. К., Якушева Е. А.. В данном пособии детально рассматриваются особенности кинетики растворения оксидов кобальта в кислых средах, адсорбция оксидов кобальта, причины возникновения двойного электрического слоя на… Подробнее Купить за 483 грн (только Украина)
- Неорганическая химия. Часть I. Поверхностные явления на границе оксид/электролит в кислых средах, Горичев Игорь Георгиевич, Атанасян Т. К., Якушева Е. А.. В данном пособии детально рассматриваются особенности кинетики растворения оксидов кобальта в кислых средах, адсорбция оксидов кобальта, причины возникновения двойного электрического слоя на… Подробнее Купить за 377 руб
- Неорганическая химия Часть I Поверхностные явления на границе оксид электролит в кислых средах Учебное пособие, Атанасян Т., Гричев И., Якушева Е.. В данном пособии детально рассматриваются особенности кинетики растворения оксидов кобальта в кислых средах, адсорбция оксидов кобальта, причины возникновения двойного электрического слоя на… Подробнее Купить за 262 руб
Электролит - это... Что такое Электролит?
Электролитами называют вещества, растворы и сплавы которых с другими веществами электролитически проводят гальванический ток. Признаком электролитической проводимости в отличие от металлической должно считать возможность наблюдать химическое разложение данного вещества при более или менее продолжительном прохождении тока. В химически чистом состоянии Э. обыкновенно обладают ничтожно малой электропроводностью. Термин Э. введен в науку Фарадеем. К. Э. до самого последнего времени относили типичные соли, кислоты и щелочи, а также воду. Исследования неводных растворов, а также исследования при очень высоких температурах значительно расширили эту область. И. А. Каблуков, Кади, Карара, П. И. Вальден и др. показали, что не только водные и спиртовые растворы заметно проводят ток, но также растворы в целом ряде других веществ, как, например, в жидком аммиаке, жидком сернистом ангидриде и т. п. Найдено также, что многие вещества и смеси их превосходные изоляторы при обыкновенной температуре, как, например, безводные окислы металлов (окись кальция, магния и др.), при повышении температуры становятся электролитическими проводниками. Известная лампа накаливания Нернста, принцип которой был открыт гениальным Яблочковым, представляет превосходную иллюстрацию этих фактов. Смесь окислов — "тельце для накаливания" в лампе Нернста, не проводящая при обыкновенной темпер., при 700° делается превосходным и притом сохраняющим твердое состояние электролитическим проводником. Можно предположить, что большинство сложных веществ, изучаемых в неорганической химии, при соответствующих растворителях или при достаточно высокой температуре могут приобрести свойства Э., за исключением, конечно, металлов и их сплавов и тех сложных веществ, для которых будет доказана металлическая проводимость. В настоящий момент указания на металлическую проводимость расплавленного йодистого серебра и др. нужно считать еще недостаточно обоснованными. Иное должно сказать о большинстве веществ, содержащих углерод, т. е. изучаемых в органической химии. Вряд ли найдутся растворители, которые сделают углеводороды или их смеси (парафин, керосин, бензин и др.) проводниками тока. Однако и в органической химии мы имеем постепенный переход от типичных Э. к типичным неэлектролитам: начиная с органических кислот к фенолам, содержащим в своем составе нитрогруппу, к фенолам, не содержащим такой группы, к спиртам, водные растворы которых принадлежат к изоляторам при небольших электровозбудительных силах и, наконец, к углеводородам — типичным изоляторам. Для многих органических, а также отчасти и некоторых неорганических соединений, трудно ожидать, чтобы повышение температуры сделало их Э., так как эти вещества раньше разлагаются от действия теплоты.
В таком неопределенном состоянии находился вопрос о том, что такое Э., до тех пор, пока не привлечена для решения его теория электролитической диссоциации (см. соответствующую статью). Относительным числом электролитически диссоциированных молекул к не распавшимся молекулам и определяется, имеем ли мы дело с типичным Э. или с типичным неэлектролитом, или с каким-либо переходным случаем. Если число этих ионов настолько мало, что ни состав их, ни относительное число не поддается никаким измерительным методам, тогда перед нами случай типичного неэлекролита. Переходные случаи — это случаи, лежащие на границе наших измерительных методов, как чисто физических, так и применяемых при химическом анализе.
Интересный вопрос возник в самое последнее время: может ли быть простое тело Э.? П. И. Вальден нашел, что растворы брома в жидком сернистом ангидриде, растворы йода в эфире и треххлористом мышьяке заметно проводят ток. Должно ли признать, что молекула йода J2 распадается на ионы электроположительный катион J. и J' — электроотрицательный анион. Однако, уже П. И. Вальден указывает на малую вероятность такого явления и предполагает, что бром и йод дают с растворителем определенные химические соединения, которые уже, в свою очередь, распадаются на ионы.
В заключение должно упомянуть об определении Э., данном маститым Гитторфом пятьдесят лет тому назад: "Э. — это соли". Этим определением Гитторф частью предвосхитил современную теорию электролитической диссоциации, указав на то, что типичное свойство солей, которое мы теперь определяем как способность к электролитической диссоциации, должно быть признаком всякого Э. (см. Электролитическая диссоциация).
Вл. Кистяковский.
ЭЛЕКТРОЛИТ - это... Что такое ЭЛЕКТРОЛИТ?
электролит — электролит … Орфографический словарь-справочник
электролит — а, м. électrolyte m. < électro + гр. lytos разлагаемый. спец. Химическое вещество (в расплаве или растворе), способное разлагаться на составные части при прохождении через него электрического тока. Электролит аккумулятора. БАС 1. Швыряло… … Исторический словарь галлицизмов русского языка
электролит — Раствор, в котором при прохождении через него электрического тока происходит разложение вещества, которое приводит к появлению электрического тока. Электролит является основой аккумуляторов и батарей. [Гипертекстовый энциклопедический словарь по… … Справочник технического переводчика
ЭЛЕКТРОЛИТ — ЭЛЕКТРОЛИТ, раствор или расплав солей, способный проводить электрический ток и используемый для ЭЛЕКТРОЛИЗА (в ходе которого он разлагается). Ток в электролитах проводится заряженными частицами ИОНАМИ, а не электронами. Например, в свинцово… … Научно-технический энциклопедический словарь
ЭЛЕКТРОЛИТ — ЭЛЕКТРОЛИТ, электролита, муж. (от слова электрический и греч. lytos растворенный) (физ.). Раствор какого нибудь вещества, способного разлагаться на составные части при электролизе. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
электролит — сущ., кол во синонимов: 1 • католит (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Электролит — Электролитами называют вещества, растворы и сплавыкоторых с другими веществами электролитически проводят гальваническийток. Признаком электролитической проводимости в отличие от металлическойдолжно считать возможность наблюдать химическое… … Энциклопедия Брокгауза и Ефрона
электролит — – вещество, водный раствор или расплав которого проводит электрический ток. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ЭЛЕКТРОЛИТ — вещество, водный раствор или расплав которого проводит электрический ток (см.), образующимися в результате электролитической (см.). Этим Э., называемые также (см.) второго рода, отличаются от металлов (проводников первого рода), в которых перенос … Большая политехническая энциклопедия
Электролит — Электролит вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы, однако само вещество электрический ток не проводит. Примерами электролитов могут служить растворы кислот, солей и оснований.… … Википедия
Электролиты: понятие и свойства
Электролиты — растворы, содержащие большую концентрацию ионов, обеспечивающих прохождение электрического тока. Как правило, это водные растворы солей, кислот и щелочей.
Это интересно
В организме человека и животных электролиты играют важную роль: к примеру, электролиты крови с ионами железа транспортируют кислород в ткани; электролиты с ионами калия и натрия регулируют водно-солевой баланс организма, работу кишечника и сердца.
Свойства
Чистая вода, безводные соли, кислоты, щелочи ток не проводят. В растворах же вещества распадаются на ионы и проводят ток. Именно поэтому электролиты называют проводниками второго порядка (в отличие от металлов). Электролитами могут быть также расплавы и некоторые кристаллы, в частности диоксид циркония и иодид серебра.
Главное свойство электролитов — способность к электролитической диссоциации, то есть к распаду молекул при взаимодействии с молекулами воды (или других растворителей) на заряженные ионы.
По типу ионов, образующихся в растворе, различают электролит щелочной (электропроводимость обусловлена ионами металлов и ОН-), солевой и кислотный (с ионами Н+ и остатками основания кислоты).
Для количественной характеристики способности электролита к диссоциации введен параметр «степень диссоциации». Эта величина отражает процент молекул, подвергшихся распаду. Она зависит от: • самого вещества;
• самого вещества;
• растворителя;
• концентрации вещества;
• температуры.
Электролиты делят на сильные и слабые. Чем лучше реагент растворяется (распадается на ионы), тем сильнее электролит, тем лучше он проводит ток. К сильным электролитам относятся щелочи, сильные кислоты и растворимые соли.
Для электролитов, использующихся в аккумуляторах, очень важен такой параметр, как плотность. От нее зависят условия эксплуатации аккумулятора, его емкость и срок службы. Определяют плотность с помощью ареометров.
Меры предосторожности при работе с электролитами
Самые популярные электролиты, это раствор концентрированной серной кислоты и щелочи — чаще всего гидроксиды калия, натрия, лития. Все они вызывают химические ожоги кожи и слизистых, очень опасные ожоги глаз. Именно поэтому все работы с такими электролитами нужно производить в отдельном, хорошо вентилируемом помещении, используя средства защиты: одежду, маски, очки, резиновые перчатки.
• Рядом с помещением, где проводятся работы с электролитами, должна храниться аптечка с набором нейтрализующих средств и кран с водой.
• Кислотные ожоги нейтрализуются раствором соды (1 ч.л. на 1 ст. воды).
• Ожоги щелочью нейтрализуют раствором борной кислоты (1 ч.л. на 1 ст. воды).
• Для промывания глаз нейтрализующие растворы должны быть в два раза слабее.
• Поврежденные участки кожи сначала промывают нейтрализатором, а потом мылом и водой.
• Если электролит пролили, его собирают опилками, потом промывают нейтрализатором и вытирают насухо.
При работе с электролитом следует выполнять  все требования техники безопасности. Например, кислоту наливают в воду (а не наоборот!) не вручную, а с помощью приспособлений. Куски твердой щелочи в воду опускают не руками, а щипцами или ложками. Нельзя работать в одном помещении с аккумуляторами на разнотипных электролитах, и хранить их вместе тоже запрещается.
все требования техники безопасности. Например, кислоту наливают в воду (а не наоборот!) не вручную, а с помощью приспособлений. Куски твердой щелочи в воду опускают не руками, а щипцами или ложками. Нельзя работать в одном помещении с аккумуляторами на разнотипных электролитах, и хранить их вместе тоже запрещается.
Некоторые работы требуют «кипения» электролита. При этом выделяется водород — горючий и взрывоопасный газ. В таких помещениях должна использоваться взрывобезопасная электропроводка и электроприборы, запрещается курение и любые работы с открытым огнем.
Хранят электролиты в пластиковых емкостях. Для работы подходит стеклянная, керамическая, фарфоровая посуда и инструменты.
В следующей статье расскажем подробнее о видах и применении электролита.
Электролиты - это... Что такое Электролиты?
жидкие или твёрдые вещества и системы, в которых присутствуют в сколько-нибудь заметной концентрации ионы, обусловливающие прохождение электрического тока. В узком смысле Э. называются вещества, растворы которых проводят электрический ток ионами, образующимися в результате электролитической диссоциации (См. Электролитическая диссоциация). Э. в растворах подразделяют на сильные и слабые. Сильные Э. практически полностью диссоциированы на ионы в разбавленных растворах. К ним относятся многие неорганические соли и некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.). Молекулы слабых Э. в растворах лишь частично диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым Э. относится большинство органических кислот и многие органические основания в водных и неводных растворах. Деление Э. на сильные и слабые в некоторой степени условно, т. к. оно отражает не свойства самих Э., а их состояние в растворе. Последнее зависит от концентрации, природы растворителя, температуры, давления и др.По количеству ионов, на которые диссоциирует в растворе одна молекула, различают бинарные, или одно-одновалентные, Э. (обозначаются 1-1 Э., например КС1), одно-двухвалентные Э. (обозначаются 1-2 Э., например CaCl2) и т. д. Э. типа 1-1, 2-2, 3-3 и т. п. называются симметричными, типа 1-2, 1-3 и т. п. — несимметричными.
Свойства разбавленных растворов слабых Э. удовлетворительно описываются классической теорией электролитической диссоциации. Для не слишком разбавленных растворов слабых Э., а также для растворов сильных Э. эта теория неприменима, поскольку они являются сложными системами, состоящими из ионов, недиссоциированных молекул или ионных пар, а также более крупных агрегатов. Свойства таких растворов определяются характером взаимодействий ион-ион, ион-растворитель, а также изменением свойств и структуры растворителя под влиянием растворённых частиц. Современные статистические теории сильных Э. удовлетворительно описывают свойства лишь очень разбавленных (моль/л) растворов.
Э. чрезвычайно важны в науке и технике. Все жидкие системы в живых организмах содержат Э. Важный класс Э. — Полиэлектролиты. Э. являются средой для проведения многих химических синтезов и процессов электрохимических производств. При этом всё большую роль играют неводные растворы Э. Изучение свойств растворов Э. важно для создания новых химических источников тока (См. Химические источники тока) и совершенствования технологических процессов разделения веществ — экстракции (См. Экстракция) из растворов и ионного обмена (См. Ионный обмен).А. И. Мишустин.
Электролит, понятие, свойства и виды
Электролит, понятие, свойства и виды.
Электролит – вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или вследствие движения ионов в кристаллических решётках твёрдых электролитов.
Электролит (определение и понятие)
Электролитическая диссоциация (ионизация)
Виды электролитов: сильные и слабые электролиты
Электролит (определение и понятие):
Электролит – вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или вследствие движения ионов в кристаллических решётках твёрдых электролитов.
Электролиты – вещества, расплавы или растворы которых проводят электрический ток.
Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения ионов. Таким образом, движение электрического тока в электролитах обусловлено ионной проводимостью.
Электролиты – это проводники второго рода, вещества, электропроводность которых обусловлена подвижностью положительно или отрицательно заряженных ионов.
К электролитам относятся вещества с ионной или сильнополярной ковалентной связью. К электролитам относятся растворы солей, оснований и кислот, а также вода. Кроме того, некоторые газы ведут себя как электролиты в условиях высокой температуры или низкого давления. Некоторые кристаллы (например, иодид серебра, диоксид циркония) также являются твердыми электролитами.
Соответственно неэлектролиты – вещества, расплавы и водные растворы которых не проводят электрический ток. К неэлектролитам относятся вещества с неполярной и малополярной ковалентной связью. К неэлектролитам относятся газы (двухатомные газы, благородные газы и др.), твердые вещества и органические вещества (спирты, эфиры, бензол, бензин, сахарозу и пр.).
Способность растворов или расплавов электролитов проводить электрический ток объясняется тем, что молекулы электролитов при растворении в воде или других растворителях (например, этаноле, жидком аммиаке, жидком сернистом ангидриде) либо при расплавлении распадаются на электрически положительно и отрицательно заряженные частицы — ионы. Величина заряда иона численно равна валентности атома или группы атомов, образующих ион.
Положительно заряженные ионы называют катионами, отрицательно заряженные – анионами. Катионы образуют атомы водорода Н+, металлов: К+, Na+, Са2+, Fe3+ и некоторые группы атомов, например группа аммония NH4+. Анионы образуют атомы и группы атомов, являющиеся кислотными остатками, например Cl—, NO3—, SO42—, CO32—.
Ионы могут состоять из одного атома – тогда они именуются простыми ионами (Na+, Mg2+, Аl3+ и т.д.) или из нескольких атомов – тогда они именуются сложными ионами (NО3—, SO42— , РО43— и т.д.).
Электролитическая диссоциация (ионизация):
Процесс распада молекул в растворе или расплаве электролита на ионы называется электролитической диссоциацией (или ионизацией). Процесс диссоциации носит обратимый характер. Одновременно с процессами диссоциации в растворах или расплавах электролита протекают и процессы ассоциации ионов в молекулы. При неизменных внешних условиях (температура, концентрация и др.) устанавливается динамическое равновесие между диссоциациями (распадами) и ассоциациями. Это означает, что определенное количество молекул электролита распадается на ионы и такое же количество молекул образуется вновь из ионов. Поэтому в растворах или расплавах электролита всегда диссоциирована определённая доля молекул вещества.
Уравнение диссоциации молекулы электролита (КA) на катион (К+) и анион (А—) в общем виде записывается так:
КА ↔ K+ + A—.
Для конкретных химических соединений уравнение диссоциации выглядит следующим образом:
H ↔ H+ + NO3—,
Ba(OH)2 ↔ Ba2+ + 2OH—,
Na(NO3)2 ↔ Na2+ + 2NO3—.
Число положительных и отрицательных ионов электролита в растворе или расплаве может быть разным, но суммарный заряд катионов всегда равен суммарному заряду анионов, поэтому раствор (или расплав) в целом электрически нейтрален.
Процесс диссоциации электролитов в воде легче всего происходит у соединений с ионной связью (солей, щелочей), которые при растворении образуют гидратированные ионы. Как правило, соединения с ионной связью (соли и щелочи) диссоциируют полностью. Соединения с сильнополярной ковалентной связью диссоциируют частично. При растворении вещества с сильнополярной ковалентной связью (например, хлороводород HCl) диполи воды ориентируются у соответствующих полюсов растворяемой молекулы, поляризую связь и превращая ее в ионную с последующей гидратацией ионов.
Гидратированные ионы устойчивы. Они беспорядочно передвигаются в растворе. Однако под действием электрического тока их движение приобретает направленный характер.
Растворы электролитов обладают способностью проводить электрический ток вследствие движения ионов. Если в раствор или расплав электролита опустить электроды и на электроды подать электрический ток, то под действием электрического тока ионы приобретут направленное движение: положительно заряженные ионы (катионы) будут двигаться к катоду (отрицательному электроду), отрицательно заряженные (анионы) – к аноду (положительному электроду). Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами. Направленное движение катионов и анионов в растворе или расплаве электролита в противоположных направлениях равносильно электрическому току.
Для измерения количественной характеристики электролитической диссоциации введено понятие степень диссоциации.
Степень диссоциации (α) — это отношение числа молекул, диссоциировавших на ионы (n), к общему числу молекул (N) в растворе электролита.
α = n / N.
Степень диссоциации выражается в долях или процентах.
Степень диссоциации (т.е. полнота диссоциации) электролита зависит от многих факторов: от природы электролита, температуры, концентрации и вида растворителя. Так, один и тот же электролит при разной температуре или при одинаковой температуре, но в разных растворителях, будет диссоциирован в разной степени. Так, диссоциация происходит только в полярном растворителе, в частности, в воде. Соли и щелочи диссоциируются полностью. С увеличением концентрации ионизация электролита идет труднее, и наоборот. Повышение температуры способствует повышению степени диссоциации, и наоборот.
Мерой способности электролитов распадаться на ионы в растворах может служить константа электролитической диссоциации (константа ионизации) (Кд).
Константа диссоциации (Кд) – это отношение произведения концентрации диссоциированных ионов к концентрации недиссоциированных молекул электролита.
Константу диссоциации можно выразить уравнением:
Кд = (K+ ∙ A−) / KA.
где:
KA – концентрация недиссоциированного соединения в растворе;
K+ – концентрация катионов в растворе;
A− – концентрация анионов в растворе.
Константа диссоциации (Кд) показывает во сколько раз скорость диссоциации больше скорости ассоциации. Чем больше константа диссоциации, тем сильнее электролит. Константа диссоциации зависит от природы электролита и растворителя, температуры и не зависит от концентрации раствора.
Виды электролитов: сильные и слабые электролиты, солевые, кислотные и щелочные электролиты и пр.:
Исходя из степени диссоциации все электролиты делятся на две группы: сильные электролиты и слабые электролиты.
Сильные электролиты – электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как HCl, HBr, HI, HNO3, H2SO4).
Слабые электролиты – электролиты, степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты, такие как HF, HNO2, HCO3, HPO4, почти все органические кислоты), основания p-, d- и f-элементов, почти все малорастворимые в воде соли.
Необходимо иметь в виду, что между двумя указанными группами не существует чёткой границы: одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом – слабого.
В зависимости от вида ионов, на которые распадается вещество при растворении в воде, различаются:
– электролиты без ионов Н+ и ОН— (солевые электролиты),
– электролиты с обилием ионов Н+ (кислотные электролиты),
– и электролиты с преобладанием ионов ОН— (щелочные электролиты).
В зависимости от вида растворителя электролиты делятся на водные электролиты и неводные электролиты. Отдельно выделяется особый вид электролитов – полиэлектролиты.
В зависимости от того, какое количество ионов образуется при диссоциации молекул электролита, электролиты подразделяются на:
– симметричные электролиты. Симметричные электролиты – электролиты, при диссоциации молекул которого образуется равное число положительных и отрицательных ионов. Симметричными электролитами являются NaCl – 1,1-валентный электролит, HCl – 1,1-валентный электролит и CaSO4 – 2,2-валентный электролит;
– несимметричные электролиты. Несимметричные электролиты – электролиты при диссоциации молекул которого образуется неравное число положительных и отрицательных ионов. Несимметричным электролитом является, например, H2SO4 – 1,2-валентный электролит.
В зависимости от природы электролита выделяются:
– соли. Соли, как электролиты, диссоциируют в водном растворе с образованием иона металла в качестве катиона и иона кислотного остатка в качестве аниона. Соли диссоциируют полностью.
Например, Na(NO3)2 ↔ Na2+ + 2NO3—.
– кислоты. Кислоты, как электролиты, диссоциируют в водном растворе с образованием иона водорода H+ в качестве катиона и иона кислотного остатка в качестве аниона. Многоосновные кислоты диссоциируют ступенчато. Причем каждая последующая ступень диссоциирует сложнее, т.к. образующиеся ионы кислотных остатков являются более слабыми электролитами.
Например, фосфорная кислота диссоциирует в три ступени, потому, что имеет 3 атома водорода:
H3РО4 ↔ H+ + H2РО4—,
H2РО4— ↔ H+ + HРО42—,
HРО42— ↔ H+ + РО43—.
Общая формула диссоциация для фосфорной кислоты будет выглядеть так:
H3РО4 ↔ H+ + H2РО43—.
– основания. Основания, как электролиты, диссоциируют в водном растворе с образованием гидроксид-иона ОН— в качестве аниона и иона металла в качестве катиона.
Например, NaOH ↔ Na+ + OH—. Основания диссоциируют полностью.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
Коэффициент востребованности 237