Фасеточный синдром что это такое
Синдром фасеточных суставов — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 июня 2019; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 июня 2019; проверки требуют 2 правки.Фасеточный синдром — синдром, при котором дугоотростчатые суставы (позвонков от C2 до S1) вызывают боли в спине.[1] 55% случаев фасеточного синдрома происходят с позвонками в шейном отделе позвоночника и 31% в поясничном отделе. Фасеточный синдром может развиться до спинного остеоартрита, который известен как спондилёз. Патология сегмента C1-C2, самого подвижного из всего позвоночника, составляет 4% от общего числа случаев спондилёза. [2] Среди лиц пожилого возраста заболеваемость фасет-синдромом достигает 85–90%. [3]
Морфологической основой фасет-синдрома является деформирующий спондилоартроз. По мнению большинства авторов, термины «спондилоартроз» и «фасеточный синдром» – синонимы. Однако некоторые исследователи утверждают, что термин «спондилоартроз» имеет более общее значение, т. к. дегенеративный процесс, как правило, захватывает фасетки, капсулу межпозвонковых суставов, желтую связку и другие параартикулярные ткани. Термин «фасеточный синдром» подразумевает более конкретную клиническую симптоматику от определенного сустава.[4]
Место в Международной классификации болезней[править | править код]
Фасеточный синдром не имеет собственного кода по ICD-10, но может быть обозначен в рамках кода M53.8 — прочие определённые дорсопатии.[5]
Заболевание наиболее распространено в поясничном отделе позвоночника, так как на него приходится основная нагрузка вышележащего тела и в той части позвоночника высокая подвижность, что приводит к более быстрому началу износа суставов. Типичным симптомом является боль в затронутых синдромом суставах и немного ниже них, иррадирующая в направлении ног. Как правило, боль усугубляется стрессом фасеточных суставов и отражается в их полую заднюю стенку (ретрофлексия) или в боковой сгиб, а также при длительном стоянии на месте или при ходьбе.
В общем случае первоначально назначаются противовоспалительные препараты. Их приём, как правило, сопровождается физиотерапией для развития мышца спины и живота. Таким образом, позвоночник может быть стабилизирован и нагрузка на него уменьшена. [6] Если подобные консервативные меры не приводят к улучшению, могут быть применены минимальные инвазивные процедуры, такие как фасеточная инфильтрация. При этой процедуре непосредственно в сустав вводится местный анестетик, обычно в сочетании с препаратом кортизона (кортикостероидами).[7]
Фасеточный синдром - Причины, Симптомы, Лечение и Диагностика
Фасеточный синдром является достаточно распространенным заболеванием. Именно с ним связывают половину всех болей, возникающих в области поясницы. Но проблема заключается не только в боли, так как она является только симптомом. Проблема кроется глубже. Это заболевание может значительно ухудшить качество жизни. Именно поэтому важно знать основные признаки болезни и методы лечения.
Что представляет собой фасеточный синдром
Суть фасеточного синдрома заключается в том, что в позвоночнике нарушаются отдельные суставы по своей структуре и расположению. В результате изменения жизненных циклов происходит обезвоживание хрящевых структур. Они становятся более хрупкими и менее упругими. Позвонки смещаются и сдвигаются, сближаясь между собой. Этот процесс весьма деструктивен, так как патология затрагивает саму хрящевую ткань, которая начинает разрушаться. При этом фасеточные суставы позвоночника в области капсулы растягиваются. Что в результате приводит к подвывиху сустава.
Как только процесс дошел до того, что фасеточная капсула разрушена, у человека возникают яркие побочные синдромы и нарушения в опорно-двигательном аппарате. Появляется боль, из-за того, что нервные корешки повреждаются сместившимися суставами.
Но и это еще не все. Помимо зажатия нервов и появления болей начинаются воспалительные процессы в тканях, находящихся в непосредственной близости с пораженными участками. Возникают различного рода нарушения.
Анатомия
Зачастую фасеточный синдром сопровождается такими состояниями, как артроз, люмбаго, остеоартрит, спондилоартроз, подвывих суставов между позвонками.
Для того чтобы лучше понять все дегенеративные процессы, происходящее в позвоночном столбе, необходимо представлять его структуру.
Фасеточный сустав – это отростки в виде дуги, которые соединяются позвонки в области заднего сегмента.
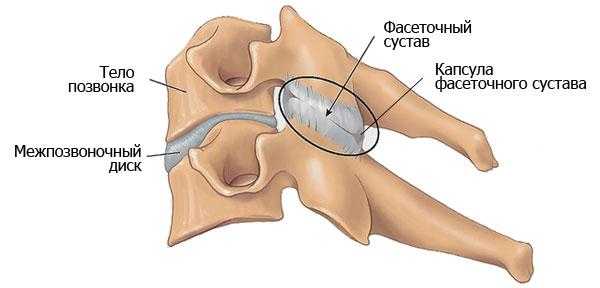
Структура у них достаточно проста. А вот принцип функциональной нагрузки и работы весьма интересен. Фасеточный сустав это сочленение, которое характеризуется следующими параметрами и особенностями:
-
на отростках соседних позвонков имеются небольшие площадки, которые покрыты хрящевой тканью именно они и контактирую между собой и частично обеспечивают подвижность позвоночного столба;
-
капсула фасеточного сустава маленькая по размеру, она прикрепляется к краю поверхности сустава;
-
интенсивности и плотности сочленения способствуют сухожилия и мышечная ткань;
-
тип сустава отличается в зависимости от отдела – в верхней части в области шеи капсула фасеточного сустава плоская, тогда как в поясничном, она остановится цилиндрической и более массивной по своим размерам;
-
суть движения фасеточного сустава заключается в скользящем перемещении по плоскости контакта междупозвоночными отростками.
Причины
Любое механическое повреждение в спине в области позвоночника, даже самое незначительное, может привести к появлению изменений в суставах. То же самое касается и разнообразных воспалительных процессов, протекающих в тканях. Скорость развития фасеточного синдрома и его тяжесть обусловлены интенсивностью негативных процессов:
-
спондилит;
-
спондилоартрит;
-
подагра;
-
псевдоподагра;
-
ожирение;
-
нарушение обменных процессов в организме;
-
артрит по ревматоидному типу;
-
воспалительные процессы в тканях и суставах;
-
травмы различной степени тяжести в области поясничного отдела спины.
Очень важно при занятиях спортом или других физических нагрузках не совершать резкие движения спиной. Так как такие неловкие движения могут легко спровоцировать пережатие капсулы сустава. А это, в свою очередь, является спусковым механизмом для начала развития фасеточного синдрома. Также негативно влияет и поднятие тяжестей.
Симптомы

Синдром фасеточных суставов вызывает следующие симптомы:
-
Возникают яркие болевые ощущения с локализацией в разных участках спины. Но несмотря на это, чаще всего, боль возникает именно в поясничном отделе.
-
Изменения также сопровождаются воспалительными процессами – их обнаруживают только при диагностировании. Воспаление сначала развивается в месте нарушения фасеточной капсулы. Но постепенно распространяется на соседние области и вовлекает все больший объем мышц.
-
В области, где наблюдается воспалительный процесс, происходит напряжение мышц. Таким образом, возникают контрактурные установки.
-
При движениях возникает характерный хруст, свидетельствующие об истончении хряща.
-
Лордоз в области поясницы становится более сглаженным, спина принимает неестественное положение, но это возникает только в случае, если заболевание носит хронический характер.
-
При пальпации области, в которой произошли изменения, чувствуется точечная болезненность или такая, которая расширяется на соседние участки спины.
-
В отдельных случаях фасеточный синдром может не сопровождаться никакими симптомами, а развиваться в скрытой форме. Это самый негативный вариант, так как именно таким образом легко запустить заболевание, пропустив острую стадию и переведя его в хроническую форму.
-
Синдрому свойственна периодичность появления симптомов.
-
Если не принимать никаких мер к устранению такого состояния, то может развиться межфасеточный фронтальный стеноз позвоночного канала.
Особенности проявления болевого симптома
Боль начинает усиливаться по мере увеличения амплитуды движения. Чем более глубокие и резкие движения, тем сильней она проявляется.
Также боль носит прогрессирующий характер. В начале заболевания, когда сочленение позвонков, а точнее, капсула фасеточного сустава разрушена не сильно, боль может носить слабовыраженный характер и не казаться сильной. Но по мере истирания хрящевого материала она проявляется все сильнее и приносит страдающему человеку большой дискомфорт. Вплоть до полного обездвиживания.
Иногда фасеточный болевой синдром начинает сразу проявляться очень ярко. Но иногда может вообще не сопровождать заболевание, что очень негативно сказывается на состоянии пациента, так как пропускается начальная стадия заболевания. А на него обращают внимание только тогда, когда фасеточная капсула очень сильно разрушена и движения становятся затрудненными.
Главное, что синдром фасеточных суставов начинается с некоторой ограниченности движения, к которой подключаются сначала легкие дискомфортные ощущения. На это надо обращать самое пристальное внимание. Так как это начало болезни. И лишь потом подключается боль и дискомфорт.
Также стоит обратить внимание на то, что боль накапливается в течение дня, постепенно нарастая. Это вызвано увеличением нагрузки на мышцы, спину и суставы в течение рабочего дня.
Диагностика
Диагностировать синдром фасеточных суставов достаточно сложно. Это вызвано тем, что симптоматика схожа с другими заболеваниями опорно-двигательного аппарата.
Поэтому очень важно при малейших признаках проявления болезни сразу обращаться к специалистам. Доктор должен:
-
собрать анамнез в виде жалоб пациента;
-
провести пальпацию участка, на которой указывают жалобы;
-
при необходимости назначить рентген, КТ или МРТ.
Патология
При патологических изменениях в суставном сочленении наблюдаются:
-
отверстия между позвонками могут уменьшаться или искажаться, то есть деформироваться, что приводит к развитию других сопутствующих заболеваний и появлению болевого синдрома, так как ущемляется корешки нервных окончаний;
-
возникает реактивный синовит;
-
появление болевых ощущений на поясничном уровне;
-
также происходит блокада механической природы синовиальной оболочкой самого сустава;
-
в результате дегенеративных изменений в фасеточном суставе происходит компрессия корешков нервов, которая может быть как динамической, так и статической.
Острая форма
В острой форме происходит резкое блокирование корешков, в результате чего происходит невозможность совершать движения.
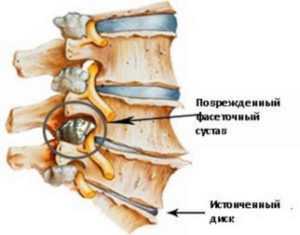
Острое состояние может быть вызвано повреждениями и микротравмами самих позвонков. В этом случае основная нагрузка, которая несется позвоночным столбом, переходит на межпозвонковые диски и суставы. В них возникают изменения из-за несоответствия механики движения и распределения нагрузочных масс. Поэтому происходит растягивание капсулы и изменения в суставном хряще.
Хроническая форма
Фасеточная артропатия может принимать хроническую форму. При ней происходит изменение, которое не проявляет себя в течение длительного периода времени или выражается в неярких симптомах. В результате чего пациент не обращает на это внимание и заболевание переходит в хроническую форму. В этом состоянии болевые синдромы и другие дискомфортные ощущения могут возникать периодически. Они то становятся ярче, то затухают, практически исчезая.
Лечение
Лечение этого состояния необходимо начинать сразу, как только появились первые симптомы. И очень важно помнить – так как лечить симптоматику абсолютно бесполезно, нужно устранять причины, вызывающие ее. То есть устранение ощущении боли – это вызовет исключительно облегчение физических страданий больного. Но никак не поможет избавиться от болезни.
Тогда, как обнаружение пострадавшего участка и устранение в нем проблемы – решит на более длительный промежуток времени данную проблему.
И очень важно понимать, что правильная физическая нагрузка будет способствовать укреплению мышечного каркаса. А он, в свою очередь, будет поддерживать позвоночный столб в правильном положении, не допуская пережатия или патологических деформаций.
Только в этом случае можно добиться стойких положительных результатов.
Воздействовать на состояние пациента можно либо консервативными методами, либо хирургическим вмешательством.
Консервативное лечение
При консервативном лечении необходимо применять комплексный подход, который включает в себя следующие составляющие:
-
прием противовоспалительных нестероидных препаратов, которые может прописать исключительно лечащий врач;
-
методы мануальной терапии;
-
плавание;
-
массажи;
-
лечебная физкультура.
Физиопроцедуры, назначаемые врачом в каждом конкретном случае, в зависимости от состояния пациента и степени заболевания.
Очень важно соблюдать правильный режим рабочего дня и жизненного цикла. При лечении не нагружать спину. Соблюдать гигиену труда и стараться не принимать надолго сидячее положение или хотя бы разбавлять его легкими разминками.
Хирургическое лечение
Если пациенту было проведено длительное классическое консервативное лечение, но оно не дало видимых результатов, то придется прибегает к более серьезным методам. Это хирургическое вмешательство. Этот вид терапии представляется такими манипуляциями, как:
-
Радиочастотная денервация в области фасеточных суставов – этот способ позволяет разрушить нервные окончания около сустава, разрушенного дегенеративными изменениями. Это фактически денервация фасеточных суставов на поясничном уровне.
-
Наполнение около суставного пространства необходимой жидкостью.
-
Коагулирование окончаний нервных корешков.
Радиочастотная денервация фасеточных суставов – описание
Радиочастотная денервация фасеточных суставов является по факту оперативным вмешательством в позвоночник.
Вся суть заключается в том, чтобы разрушить нервную ткань, которая находится рядом с пораженной зоной и непосредственно в ней. В результате нервные импульсы, сигнализирующие о боли, перестают поступать в головной мозг. То есть, фактически устраняется болевой синдром.
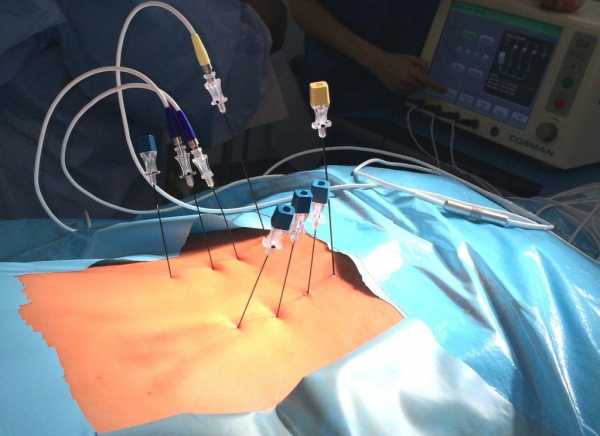
Принцип воздействия заключается в пропускании тока высокой частоты в нервные окончания пораженной части. При этом они разрушаются. Положительная сторона этого влияния заключается в том, что проводить его можно даже тем пациентам, у которых существует высокий операционный риск.
Показания к денервации
Основными показаниями к проведению высокочастотной денервации фасеточных суставов являются ситуации, когда:
-
традиционный метод лечения не дал эффективных результатов, и пациент продолжает испытывать дискомфорт при движении, сопровождаемый болями;
-
при межреберной невралгии – когда такое состояние сопровождается длительными болями и невозможностью наклониться или повернуться в боковом направлении;
-
когда болевой синдром продолжается на протяжении более 6 месяцев;
-
при артрозе суставов между позвонками, сопровождающимся сильными болевыми ощущениями.
Противопоказания к операции
Но, несмотря на свою малоинвазивноть, высокочастотная денервация имеет и ряд определенных противопоказаний. К основным относятся:
-
локальный или генерализованные воспалительные процессы в организме любой этиологии, причем абсолютно не важно, на каком участке они располагаются;
-
неврологические заболевания, носящие выраженный и стойкий характер;
-
повреждение в спинном мозге и дефекты в спинномозговом канале;
-
различные онкологические заболевания.
Как проводится операция
Перед операцией проводят комплекс необходимых обследований. Для этого сдают и проводят:
-
общий анализ крови и анализ на RW, ВИЧ и гепатит;
-
обследование и заключение врача невропатолога;
-
проведенная МРТ;
-
снятие показаний кардиограммы;
-
рентген грудной клетки;
-
анализ мочи.
Радиочастотная денервация фасеточных суставов проводится исключительно в отделении нейрохирургии. Перед вмешательством пациенту запрещается принимать пищу на протяжении 10 часов. После вмешательства пациент находится в палате, где за ним следят и мониторят все показатели состояния здоровья. А также выполняют контрольный рентген.
Денервация фасеточных суставов проводится в несколько этапов:
-
Сбоку от позвоночника вводят иглу, которая должна быть направлена в меж дисковое пространство – это называется фасеточной ризотомией;
-
как только игла устанавливается в нужное место к ней подключают электроды и после этого подводят ток высокой частоты, который может колебаться в интервале от 2 герц до 100 герц;
-
за счет этого происходит нагревание иглы и в результате чего разрушается нерв с одновременным прижиганием — нервные импульсы перестают поступать.
Манипуляцию РЧД проводят под местной анестезией. Очень важно, чтобы пациент соблюдал неподвижность, лежа во время процедуры на животе, чтобы игла была установлена точно в пораженное место. Иначе операция может не увенчаться успехом.
При такой манипуляции фасеточный сустав в позвоночнике лишается определенной части нервных окончаний. То есть фактически происходит исключение попадания информация о боли в головной мозг из пораженного участка.
Основным преимуществом этого оперативного вмешательства является его малоинвазивность. Поэтому любые осложнения сведены к минимуму.
Результат
Радиочастотная абляция фасеточных суставов имеет следующие положительные эффекты и плюсы:
-
боль либо уходит полностью, либо интенсивность ее появления значительно снижается;
-
у человека после того, как проведена блокада фасеточных суставов, вновь возвращается свобода движений в нормальной амплитуде;
-
на протяжении длительного времени будет сохраняться положительный эффект от оперативного вмешательства – проявление симптомов повторно может возникнуть вновь только через несколько месяцев, а возможно и несколько лет.
Восстановительный период
Блокада фасеточных суставов в пояснице, несмотря на то, что проводится под местной анестезией и довольно легко переноситься пациентами, все же требует полного контроля врача. Он должен сделать повторный снимок и убедиться в том, что процесс идет в нужном направлении.
На протяжении нескольких месяцев, по наблюдению и рекомендациям врача, пациенту будет предложено соблюдать определенный режим.
После него необходимо, чтобы были предприняты меры по устранению и приостановлению развития заболевания. Для этого выполняют лечебную физкультуру, плавание, вводят правильный рацион питания, гигиену труда и распорядок дня.
Поделиться ссылкой:
Фасет-синдром | Подымова И.Г., Данилов А.Б.
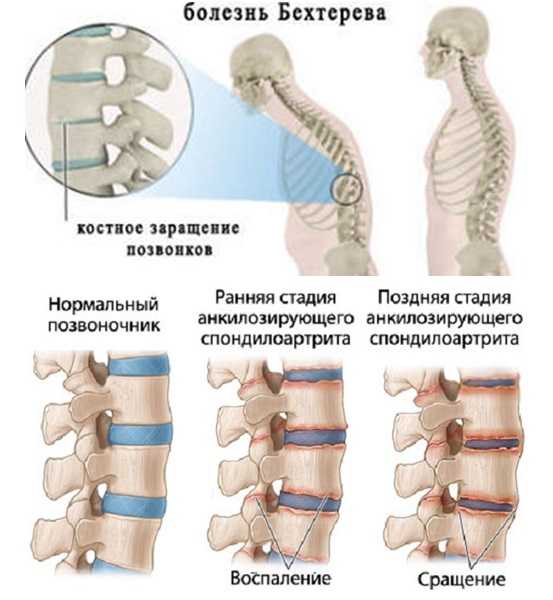
Фасет-синдром (facet joint syndrome) – заболевание, связанное с дегенерацией и поражением фасеточных (межпозвонковых) суставов, проявляющееся болью в спине, как правило, без неврологических нарушений.
Артрозные изменения в позвоночнике могут развиваться уже после 25–30 лет, чему способствуют врожденные аномалии позвоночника (люмбализация, сакрализация), гипермобильность позвоночных сегментов и травматизация. Среди лиц пожилого возраста заболеваемость фасет-синдромом достигает 85–90% [2].Этиология и патогенез
Морфологической основой фасет-синдрома является деформирующий спондилоартроз.
По мнению большинства авторов, термины «спондилоартроз» и «фасеточный синдром» – синонимы. Однако некоторые исследователи утверждают, что термин «спондилоартроз» имеет более общее значение, т. к. дегенеративный процесс, как правило, захватывает фасетки, капсулу межпозвонковых суставов, желтую связку и другие параартикулярные ткани. Термин «фасеточный синдром» подразумевает более конкретную клиническую симптоматику от определенного сустава.
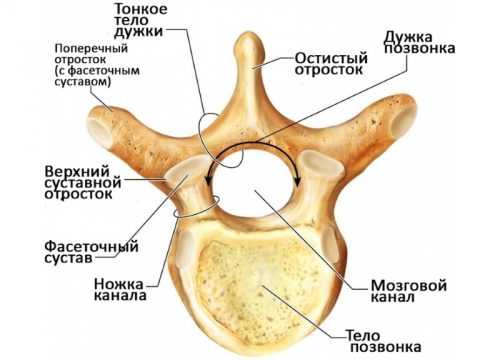
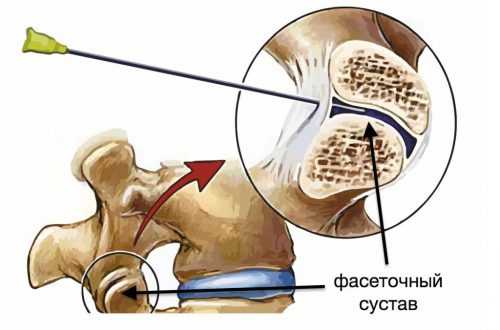
Анатомия фасеточного сустава. Фасетки (синонимы: дугоотростчатые суставы, суставные отростки) отходят от позвоночной пластинки и участвуют в формировании фасеточных суставов (рис. 1). Два соседних позвонка соединены двумя фасеточными суставами, расположенными с двух сторон дужки, симметрично относительно средней линии тела. Дугоотросчатые отростки соседних позвонков направлены друг к другу, а окончания их покрыты суставным хрящом. Концы суставных отростков заключены в суставную сумку. Благодаря наличию фасеточных суставов между позвонками возможны разнообразные движения, а позвоночник является гибкой подвижной структурой [1].
Анатомическое строение позвоночного столба подчеркивает предназначение его передних отделов (передняя продольная связка, тела позвонков, межпозвоночные диски) главным образом для сопротивления силам тяжести (компрессии), а задних отделов (межпозвонковые суставы, ножки, поперечные и остистые отростки, пластинка) – для защиты от аксиальных ротаторных и смещающих в переднезаднем и боковых направлениях сил. Распределение сил тяжести в нормальном позвоночном двигательном сегменте, включающем в себя 3-суставной комплекс, происходит следующим образом: от 70 до 88% приходится на его передние отделы, а от 12 до 30% – на задние, главным образом межпозвонковые (фасеточные) суставы, хотя оба отдела позвоночника испытывают на себе нагрузку при воздействии любых сил. При поражении дисков, с которых чаще всего начинаются дегенеративные изменения в позвоночнике, весовая нагрузка постепенно переходит на межпозвонковые суставы, достигая от 47 до 70%. Такая перегрузка суставов ведет к последовательным изменениям в них: синовииту с накоплением синовиальной жидкости между фасетками; дегенерации суставного хряща; растягиванию капсулы суставов и подвывихам в них. Продолжающаяся дегенерация вследствие повторных микротравм, весовых и ротаторных перегрузок ведет к периартикулярному фиброзу и формированию субпериостальных остеофитов, увеличивающих размеры верхних и нижних фасеток, которые приобретают грушевидную форму. В конце концов суставы резко дегенерируют, почти полностью теряют хрящ. Довольно часто этот процесс дегенерации проходит асимметрично, что проявляется неравномерностью нагрузок на фасеточные суставы. Сочетание изменений в диске и фасеточных суставах приводит к резкому ограничению движений в соответствующем двигательном сегменте позвоночника.
В состав позвоночного сегмента входят не только хрящевой диск между смежными позвонками и дугоотростчатые суставы, но и соединяющие их связки и мышцы: межпоперечные, межостистые и мышцы-вращатели. Эти мышцы под влиянием импульсов из пораженного позвоночного сегмента, особенно из задней продольной связки, рефлекторно напрягаются, формируется мышечно-тонический синдром [3].
Немаловажную роль в формировании фасет-синдрома играет нарушение суставного тропизма, т. е. асимметричное расположение дугоотросчатых суставов. Линейное расположение фасеточных суставов заслуживает особого внимания. В шейном отделе фасетки расположены горизонтально (поперечно), с небольшим задненижним отклонением. В грудном отделе фасеточные суставы располагаются на более низком уровне (по отношению к телу позвонка) и могут сравниваться с расположением нервного корешка (горизонтального – на шее и направляющегося вниз – на грудном отделе позвоночника). В поясничном отделе фасеточные суставы расположены сагиттально у первого и второго позвонков и почти коронарно (т. е. параллельно венечному шву или перпендикулярно к боковой поверхности тела позвонка) – у 3–5-го позвонков. Иногда фасеточный сустав с одной стороны располагается в сагиттальной плоскости, а с другой стороны – в коронарной. Такие аномалии тропизма встречаются у многих людей и считаются предрасполагающим фактором дополнительной ротационной нагрузки на них [2].
Клиническая картина
Особенности анатомического строения фасеточных суставов обусловливают наиболее частое их поражение в шейном (55%) и поясничном (31%) отделах позвоночника. При фасет-синдроме боль усиливается при разгибании и уменьшается при сгибании. Боль может иррадиировать паравертебрально, в плечо, ягодицу. Исходящая из межпозвонковых суставов отраженная боль носит латерализованный, диффузный, трудно локализуемый, склеротомный характер распространения. Иногда боль иррадиирует в конечность, но не распространяется ниже локтевого сгиба или подколенной ямки. Фасеточная боль может быть более или менее схваткообразной. Характерны появление кратковременной утренней скованности, длящейся 30–60 мин, и нарастание боли к концу дня. Боль усиливается от длительного стояния, разгибания, особенно если оно сочетается с наклоном или ротацией в больную сторону, при перемене положения тела из лежачего в сидячее и наоборот. Разгрузка позвоночника – его легкое сгибание, принятие сидячего положения, использование опоры (стойка, перила) уменьшает боль [3].
Характерные признаки болевого синдрома, обусловленного фасет-синдромом:
– начало боли связано с ротацией и разгибанием позвоночника;
– боль имеет латерализованный диффузный характер;
– иррадиация боли не распространяется далеко от зоны поражения;
– характерна утренняя скованность;
– боль усиливается в статичных положениях;
– разминка, разгрузка позвоночника уменьшают боль.
Диагностика
Патогномоничных симптомов, характерных для поражения фасеточных суставов, не существует.
При осмотре обнаруживаются сглаженность шейного и/или поясничного лордоза, ротация или искривление позвоночника в шейно-грудинном или пояснично-крестцовом отделах. Напряжение паравертебральных мышц, квадратной мышцы спины выявляется на больной стороне. Можно обнаружить локальную болезненность над пораженным суставом. Пальпаторно определяется напряжение мышц вокруг межпозвонкового сустава. В отличие от корешкового синдрома симптомы выпадения не характерны. Иногда, в хронических случаях выявляется некоторая слабость выпрямителей позвоночника и мышц подколенной ямки.
Таким образом, клинической особенностью, имеющей диагностическое значение, является боль в позвоночнике, усиливающаяся при экстензии и ротации с локализованной болезненностью в проекции дугоотростчатого сустава [4].
При рентгенологическом исследовании и компьютерной томографии выявляют гипертрофию межпозвонковых суставов, наличие на них остеофитов. При активном артрозе с помощью радионуклидной сцинтиграфии обнаруживают накопление изотопа в межпозвонковых суставах.
Окончательный диагноз фасеточного синдрома устанавливается после положительного эффекта параартикулярной блокады местным анестетиком подозрительного межпозвонкового сустава.
Лечение
В лечении боли при фасет-синдроме рациональным является использование нестероидных противовоспалительных препаратов (НПВП), которые обладают хорошим обезболивающим и выраженным противовоспалительным действием. Механизм действия НПВП заключается в подавлении активности фермента циклооксигеназы (ЦОГ), который играет ведущую роль в синтезе простагландинов, усиливающих воспалительный процесс и непосредственно участвующих в формировании болевых ощущений.
Одним из наиболее проверенных на практике НПВП является Ксефокам (лорноксикам). Ксефокам – неселективный НПВП, относящийся к группе производных оксикама. Благодаря сбалансированному ингибированию ЦОГ-1/ЦОГ-2 Ксефокам сочетает выраженную анальгетическую и противовоспалительную активность с низким риском возникновения нежелательных явлений (НЯ) [8].
Ксефокам обладает более коротким периодом полувыведения (3–4 ч), чем другие оксикамы. Установлено, что более длительный период полураспада НПВП в плазме крови связан с повышенным риском возникновения НЯ. Следовательно, быстрое выведение Ксефокама из организма способствует снижению частоты возникновения НЯ, особенно со стороны ЖКТ [9]. Особенностью Ксефокама является стимуляция выработки эндогенного динорфина и эндорфина, что свидетельствует о возможности препарата оказывать влияние на центральные звенья патогенеза болевого синдрома. Двойной путь экскреции препарата (через почки и ЖКТ, минуя энтеропеченочную циркуляцию) снижает нагрузку на органы и улучшает переносимость, поэтому при легкой и умеренной степени печеночной и/или почечной недостаточности коррекции его дозы не требуется [5]. Таким образом, Ксефокам обладает хорошей переносимостью по сравнению с другими НПВП.
Поскольку фасет-синдром в большей степени встречается среди лиц пожилого возраста, то хорошая переносимость Ксефокама становится приоритетным фактором при выборе НПВП.
На фармацевтическом рынке Ксефокам представлен в виде следующих лекарственных форм:
– Ксефокам – стандартные таблетки 4 и 8 мг;
– Ксефокам лиофилизат – для приготовления раствора для в/м и в/в инъекций, в 1 флаконе 8 мг лорноксикама;
– Ксефокам Рапид – быстро абсорбируемые таблетки 8 мг.
Рекомендуемая доза для однократного приема Ксефокама составляет от 4 до 8 мг, максимальная суточная доза – 16 мг с интервалами между приемами 8–12 ч. Обезболивающий эффект развивается в течение 45–60 мин при использовании стандартных таблеток и продолжается 8 ч [7]. Особенностью формы Ксефокам Рапид является скорость наступления анальгетического эффекта – через 30 мин после приема, что достигается благодаря быстрому всасыванию препарата уже в желудке [6].
При развитии рефлекторного мышечно-тонического синдрома показано назначение миорелаксантов. Миорлаксанты, устраняя мышечное напряжение, прерывают порочный круг «боль – мышечный спазм – боль». Лечение миорелаксантами начинают с обычной терапевтической дозы и продолжают в период сохранения болевого синдрома; как правило, курс лечения составляет несколько недель.
С учетом ведущей патогенетической роли в развитии фасет-синдрома дегенеративно-дистрофических процессов межпозвонковых суставов, оправданно использование структурно-модифицирующей терапии (хондроитина сульфат и глюкозамин) – препаратов, способствующих замедлению дегенерации хрящевой ткани. Применение хондропротекторов рекомендуется уже на ранних этапах развития данной патологии [2].
С целью уменьшения болевых ощущений помимо медикаментозных препаратов используются магнитотерапия, синусоидально-модулированные токи, ионогальванизация с обезболивающими средствами (прокаин или лидокаин), фонофорез с гидрокортизоном для снятия отека и воспаления, массаж и лечебная гимнастика.
При неэффективности консервативной терапии применяют хирургическое лечение. Наиболее эффективным методом лечения, признанным во всем мире, является радиочастотная денервация (деструкция), при которой патологический процесс устраняется путем воздействия электромагнитного поля волновой частоты в непосредственной близости от пораженного сустава. При этой методике возможно воздействие сразу на несколько больных сегментов позвоночника. Эта процедура при эффективности в 80% случаев не требует применения общего наркоза, разреза на коже, длится около 30 мин, после чего пациент примерно через 1 ч самостоятельно покидает клинику. Радиочастотная деструкция медиальных ветвей задних корешков спинномозговых нервов (фасеточная ризотомия) эффективно денервирует фасеточные сочленения и обеспечивает длительное высококачественное обезболивание. Удачная фасеточная ризотомия, как правило, обеспечивает обезболивание более чем на год.
Профилактика
Поскольку рано или поздно с проявлениями фасет-синдрома сталкивается до 80% популяции, отсрочить их наступление поможет сохранение активного образа жизни. Ежедневные физические упражнения, дозированная ходьба, посещение плавательного бассейна обеспечивают формирование правильной биомеханики позвоночного столба, поддержание полноценного кровообращения в межпозвонковых суставах, укрепление мышечного каркаса. Это позволяет сохранить функциональную подвижность позвоночника на долгие годы.
Литература
1. Путилина М.В. Дорсопатия грудного отдела позвоночного столба. Пособие для врачей. М., 2009. 104 с.
2. Горбачева Ф.Е. Спондилоартроз позвоночника: диагностика и лечение. М., 2007. 12 с.
3. Горбачева Ф.Е. Что скрывается под маской остеохондроза позвоночника? М., 2008. 12 с.
4. Яхно Н.Н. Боль. Руководство для врачей и студентов. М., 2009. 304 с.
5. Гришаева Т.П., Балабанова Р.М. Применение Ксефокама (лорноксикама) для купирования острого и хронического болевого синдрома // РМЖ. 2005. Т. 15. С. 1009–1011.
6. Данилов А.Б., Гак С.Е. Ксефокам (лорноксикам): возможности применения для лечения болевых синдромов // РМЖ. Болевой синдром. 2011. С. 37–39.
7. Nycomed. Xefocam Монография // medi.ru – 2008.03.
8. Hamza Yel-S., Aburahma M.H. Design and in vitro Evaluation of novel sustained-release double-layer tablets of Lornoxicam: Utility of cyclodextrin and xanthan gum combination // AAPS Pharm Sci Tech. 2009. Vol. 10. P. 1357–1366.
9. Jiao H., Кут F. Pretreatment with lornoxicam, a cyclooxygenase inhibitor, relieves postoperative immuno-suppression after total abdominal hysterectomy // Tohoku J. Exp. Med. 2009. Vol. 219. № 4. P. 289–294.
Фасеточный синдром поясничного отдела: причины и лечение
Фасеточный синдром позвоночника – очень распространенная патология и большинство случаев болей в спине приходятся именно на нее. По мере прогрессирования она способна оказывать нарастающее негативное влияние на организм и значительно ухудшать качество жизни пациента. В данной статье мы рассмотрим, как проявляют себя фасеточные суставы позвоночника, какую клиническую картину формируют и насколько эффективно их лечение.
Определение
Фасеточный синдром – это заболевание суставной ткани позвоночника. Оно локализуется в том или ином отделе и поражает сразу несколько позвонков. Патогенез состоит в том, что ткань межпозвоночных дисков обезвоживается, в результате чего они истончаются, и расстояние между позвонками значительно уменьшается. Со временем хрящевая ткань разрушается вовсе, а капсулы фасеточных суставов сильно вытягиваются в длину. Это ведет к развитию подвывиха каждого пораженного сустава.
Поврежденные суставы и вовлечение в процесс нервных корешков (их защемление) ведут к появлению болевого синдрома и другим проблемам с опорно-двигательным аппаратом. По мере вовлечения в процесс все большего объема нервной ткани, может развиваться и более серьезная симптоматика, такая как параличи, парезы, онемения и т. д.
Иногда артрозы, снодилоартриты, остеоартриты, люмбальный синдром и подвывихи межпозвоночных суставов различной природы также причисляют к фасеточному синдрому.
Речь идет именно о синдроме, а не о самостоятельном заболевании. То есть, такие изменения в межпозвоночных дисках, вызывающие соответствующую симптоматику, развиваются на фоне того или иного основного патологического процесса. Сам по себе же такой синдром в качестве первичного заболевания проявиться не может.
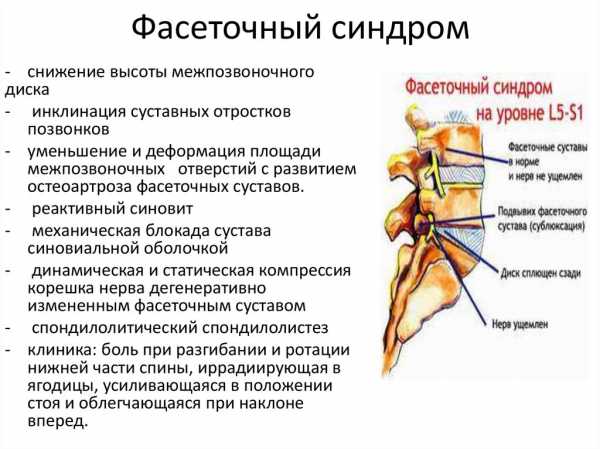
Причины
Этот синдром может вызываться большим количеством причин, как серьезных, так и относительно не слишком опасных. В большинстве случаев это хронические заболевания позвоночника, связанные с изменениями в суставной и/или костной тканях, произошедшими по тем или иным причинам. Чаще всего фасеточный артроз позвоночника вызывают такие состояния:
- Подагра и псевдоподагра;
- Ревматоидный артрит;
- Туберкулезный спондилит;
- Спондилоартрит.
Но также изменения могут происходить в результате нарушения питания суставной ткани по причине каких-либо сосудистых заболеваний. Микротравмы того или иного отдела позвоночника могут приводить к формированию фасеточного синдрома.
к содержанию ↑Локализация и % случаев из всех
Синдром поражает, обычно, сразу несколько позвонков, но в пределах одного и того же отдела позвоночника. Статистически выявлено, что частота возникновения патологии в том или ином отделе позвоночника у пациентов неодинакова.
- Шейный отдел больше других подвержен такой патологии – именно на него приходится 50% всех случаев возникновения данного синдрома;
- На втором месте поясница – на нее приходится 30% всех случаев;
- Плечевой, грудной и крестцовый отделы поражаются наиболее редко – они делят между собой оставшиеся 20% случаев.
Мужчины и женщины подвержены патологии в одинаковой степени. Но у детей синдром встречается гораздо реже, так как среди них мало распространены соответствующие заболевания позвоночника. У пожилых пациентов такое состояние развивается наиболее часто, так как они больше подвержены заболеваниям, вызывающим синдром, а также потому, что в их организме происходят сбои и изменения, способные вызвать его самостоятельно (нарушение питания суставов позвоночника и т. д.).
к содержанию ↑Симптомы и признаки
В зависимости от того, в каком отделе позвоночника локализуется поражение, его симптоматика может существенно отличаться. При локализации в пояснице наблюдаются:
- Боли в пояснице, усиливающиеся при наклонах, долгой ходьбе или долгом стоянии, сидении;
- Постепенное уменьшение подвижности поясницы;
- Быстрое онемение ног, покалывание в них;
- Боли ноющего характера, эродирующие в бедро;
- Парезы и параличи нижних конечностей в запущенных случаях.
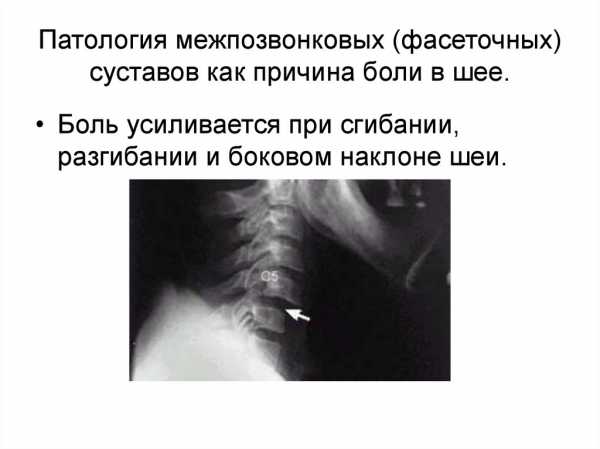
При локализации в шее симптоматика иная:
- Боли при длительном письме, либо работе за компьютером, резких поворотах головы;
- Разлитая ноющая боль, которая может эродировать в руки;
- Чувство онемения в шее;
- Напряжение и спазм мышц шеи;
- Головные боли, связанные с сосудистым спазмом.
При крестцовой локализации симптомы схожи с признаками поражения в поясничной зоне. Но могут также прибавляться проблемы с кишечником и мочевым пузырем. При поражении межпозвоночных дисков в грудном и плечевом отделах также возникает ноющая боль, усиливающаяся при резких движениях, эродирующая в руки. Может возникать слабость рук, их онемение, покалывание в них, парезы и параличи в запущенных случаях.
Диагностика
Состояние диагностируется с помощью следующих методов:
- Сбор анамнеза и анализ симптомов;
- Осмотр пациента, проверка чувствительности в определенных точках;
- Рентгенография с контрастом;
- Электронейрография;
- КТ и МРТ (при необходимости).
Методы помогают точно установить локализацию, степень развития, а также причину патологии.
к содержанию ↑Лечение
Лечение артроза фасеточных суставов позвоночника ведется комплексно, с применением разных подходов и методов. Основной метод – консервативный, с применением медикаментозных препаратов, но могут задействоваться и хирургические методы в ряде случаев.
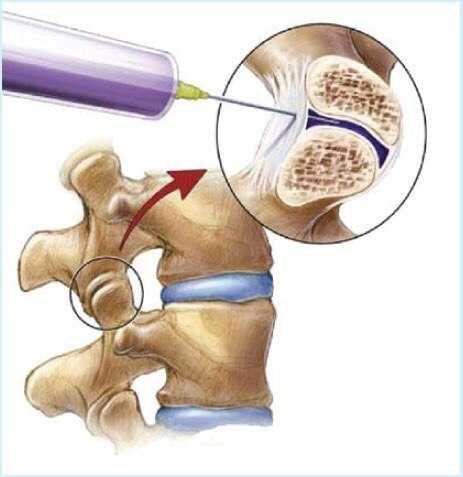
к содержанию ↑Анестезирующие вещества и кортикостероиды
С помощью таких препаратов купируются сильные болевые приступы. Иногда больным делается новокаиновая блокада. Она приносит достаточно длительное облегчение, но рано или поздно боли все равно возвращаются. Кортикостероиды применяются также при значительных болях. Такие препараты, как Преднизолон, Гидрокортизон также эффективно снимают воспаление и боль. Стероидный крем Адвантан назначается для нанесения 2-3 раза в день.
к содержанию ↑Анальгетические лекарственные средства и нестероидные противовоспалительные препараты
Нестероидные противовоспалительные препараты назначаются для снятия не слишком интенсивной боли и воспаления.
- Ибупрофен или Нурофен принимаются по 1 таблетке три раза в день на протяжении 10 дней;
- Диклофенак в инъекциях вводится по 1 уколу один раз в день, в дозировке, зависящей от веса пациента;
- Вольтарен – крем наносится 3-4 раза в день по 2-3 грамма.
Также для обезболивания могут применяться анальгетики (Анальгин и т. п.).
Лечебная физкультура
Имеет важное значение, так как укрепляет мышечный каркас и нормализует кровообращения. Комплексы должны назначаться врачом. Самый распространенный из них включает такие упражнения:
- Лежа на спине, колени согнуты, руки перед собой. Коленями тянутся вправо, ладонями влево. Затем – наоборот. Повторить 6 раз в каждую сторону;
- Лежа на спине, колени согнуты. Разводить колени в стороны, к полу. Повторить 5 раз;
- Лежа на спине, колени согнуты, ноги расставлены. На выдохе опускать поочередно колени внутрь. Повторить 5-6 раз каждой ногой;
- Лежа на спине, колени согнуты. Подтягивать колени к груди поочередно, по 5 раз каждой ногой;
- То же, что в прошлом упражнении, но после подтягивания ногу выпрямлять;
- Стоя в упоре на коленях и ладонях. Покачивать туловище вперед и назад по пять раз в каждом направлении.
В период обострений ЛФК противопоказана.
к содержанию ↑Физиотерапия
Физиотерапия снимает воспаление, нормализует кровообращение. Применяются следующие процедуры: СВЧ, УВЧ, электрофорез с различными препаратами. Может применяться только в периоды ремиссий и только по назначению врача, в качестве дополнения к другим методам лечения. Сама по себе методом лечения не является.
к содержанию ↑Мануальная терапия
В эту группу входят различные методы ручного воздействия, от массажей до иглоукалывания. Такие методы помогают укрепить мышечный каркас, повысить тонус мышц, снять их спазм. Они нормализуют кровоснабжение суставов. Благодаря массажам восстанавливается гибкость и подвижность поврежденных отделов, уменьшаются болевые ощущения.
к содержанию ↑Ортопедия
В период обострения очень важно снизить нагрузку на пораженную область. Для этого могут быть использованы ортопедические корсеты при локализации процесса в плечевом или грудном отделах, пояса при локализации в крестце или пояснице, воротники, если диагностирован фасеточный синдром шейного отдела. Также рекомендуется спать на ортопедических матрасах и подушках. Это помогает ускорить лечение и не провоцировать новых обострений.
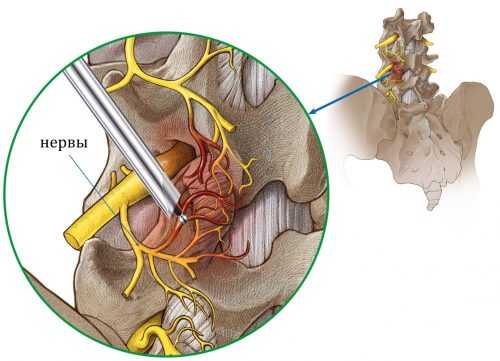
к содержанию ↑Ризотомия
Это блокада нервных окончаний фасеточных соединений. Эта процедура проводится при очень сильных болях и дает достаточно длительный обезболивающий эффект. Проводится под контролем рентгена.
к содержанию ↑Ботокс
Инъекции ботокса способствуют парализации некоторых локальных мышц опорно-двигательного аппарата. Благодаря этому удается нормализовать тонус мышц и избежать спастических проявлений, которые и ведут, в большинстве случаев, к возникновению выраженного болевого синдрома.
к содержанию ↑Хирургическое вмешательство
Проводится в случаях, когда консервативное лечение не дает устойчивого результата. Проводятся следующие виды манипуляций:
- Принудительное восполнение суставных жидкостей;
- Прижигание нервных окончаний для устранения болевой симптоматики;
- Радиочастотное удаление нервных окончаний в зоне защемления с той же целью.
Меры принимаются в комплексе или по-отдельности. Хирургическое вмешательство используется крайне редко.
к содержанию ↑Прогноз
При слабой степени выраженности консервативное лечение дает достаточно хороший, устойчивый результат. При своевременном лечении причины синдрома возможно добиться полного избавления от болей. Хирургическое вмешательство также дает почти полную гарантию избавления от боли.
к содержанию ↑Осложнения и последствия
При отсутствии лечения обезвоживание приводит к тому, что межпозвоночные диски разрушаются полностью. Это ведет к потере гибкости и подвижности отдела позвоночника, соскальзыванию позвонков. По мере вовлечения в процесс нервной ткани возникает хронический болевой синдром, может развиваться онемение конечностей и нарушение работы некоторых органов (различных, в зависимости от локализации процесса). Возможны парезы и параличи.
к содержанию ↑Профилактика
Специфическая профилактика заключается в поддержании эндокринной системы в здоровом состоянии. Также важно вести умеренно активный образ жизни, избегать гиподинамии. Но не менее важно избегать и перегрузок позвоночника, его травм. При появлении какой либо негативной симптоматики со стороны опорно-двигательного аппарата своевременно обращаться к врачу для назначения лечения.
к содержанию ↑Вывод
Фасеточный синдром – признак развития более серьезной болезни. Но и сам по себе он способен доставлять существенный дискомфорт. Потому важно обратиться к врачу за помощью своевременно.
что такое, почему возникает и как лечить
Фасеточный синдром — это распространенная патология позвоночника, характеризующаяся нарушением функции межпозвоночных суставов. В большинстве случаев патология развивается на фоне артроза, при котором наблюдается поражение не только межпозвоночных дисков, но и располагающихся рядом тканей. В группу риска входят люди старше 50 лет. У этой категории лиц фасет–синдром диагностируется примерно в 90% случаев. Мужчины страдают этим патологическим состоянием чаще, чем женщины.
Причины возникновения заболевания
Нагрузки на структуры позвоночного столба распределяются неравномерно. Примерно 80% приходится на межпозвоночные диски и позвонки, а еще около 20% нагрузки переносится на фасеточные суставы. Развитие фасеточного синдрома в большинстве случаев наблюдается на фоне других заболеваний, сопровождающихся поражением тканей межпозвоночных дисков и уменьшением их высоты. В этом случае повышается нагрузка на фасеточные суставы, что способствует их быстрому износу.
Главной причиной появления изменений в структуре позвоночника и дальнейшего повреждения фасеточных суставов считаются возрастные изменения. По мере старения организма в структуре межпозвоночных дисков и других элементах позвоночного столба нарастают дегенеративно—дистрофические изменения, вызванные снижением насыщения тканей кислородом, водой и питательными веществами.
Наибольшей подвижностью отличаются структуры поясничного отдела, а также шейного отдела, поэтому элементы, формирующие данные участки позвоночника, быстрее изнашиваются, что создает условия для появления признаков патологии. В грудном отделе реже наблюдаются признаки данного нарушения работы межпозвоночных суставов, так как эта часть позвоночника менее подвижна.
Поспособствовать развитию патологии могут нарушения структуры межпозвоночных дисков и позвонков, а также повреждение мышц и связок, окружающих позвоночник, на фоне травм различной степени тяжести. Опасность представляют не только свежие травмы, но и застарелые ушибы, микропереломы, подвывихи и разрывы хрящей и капсул. Помимо всего прочего, появление признаков поражения фасеточных суставов может наблюдаться на фоне таких патологических состояний, как:
- подагра;
- туберкулезный спондилит;
- спондилоартроз;
- псевдоподагра.
Выше риск развития этой патологии у людей, профессионально занимающихся спортом. Кроме того, нередко данное патологическое состояние выявляется у пациентов, чья работа связана с поднятием тяжестей.
Создать условия для появления нарушения могут различные заболевания эндокринной системы. На их фоне наблюдается нарастающее ухудшение питания тканей межпозвоночных дисков. Кроме того, в этом случае страдают мышечные ткани, связки, позвонки и другие структуры, формирующие позвоночный столб.
Повышен риск развития фасеточного синдрома у людей, имеющих повышенную массу тела, особенно если лишний вес является результатом систематического неправильного питания.
Характерные признаки
Главным симптоматическим проявлением фасеточного синдрома является боль. Неприятные ощущения возникают в результате развития воспалительного процесса в пораженной области. Степень выраженности болевого синдрома может различаться.
Воспалительный процесс пораженных фасеточных суставов постепенно распространяется на окружающие ткани, что приводит к усугублению клинической картины. Неприятные ощущения могут усиливаться при наклонах назад и в сторону. Еще на развитие данного патологического состояния могут указывать такие симптоматические проявления, как:
- сглаживания поясничного изгиба позвоночника;
- хруст при любых движениях;
- болевые прострелы в шее и пояснице;
- спазм мышц спины.
По мере прогрессирования воспалительного процесса наблюдается постепенное ослабевание мышц и связок, поддерживающих позвоночный столб. При тяжелом течении патологического состояния клинические проявления фасеточного синдрома становятся более выраженными. Болевой синдром и дискомфорт начинают беспокоить пациента не только после физических нагрузок и при неудачных движениях, но и при длительном нахождении в сидячем положении.
Прогрессирование данной патологии приводит к ухудшению качества жизни пациента.
Диагностика
Поставить точный диагноз, выявив поражение фасеточных суставов, может только специалист. Пациенту нередко требуется консультация у вертебролога, невролога, травматолога и ортопеда. Сначала врач собирает анамнез, проводит осмотр и пальпацию позвоночного столба.
После этого назначается проведение общего и биохимического исследования крови. Данные анализы позволяют уточнить наличие в организме пациента воспалительного процесса и патологий, способных негативно отразиться на состоянии структур позвоночного столба. Для оценки состояния позвоночника выполняются такие исследования, как:
- рентгенография;
- КТ;
- МРТ.
После проведения комплексной диагностики и выявления характера повреждения фасеточных суставов может быть назначено адекватное лечение.
Методы терапии
 Терапия фасеточного синдрома в большинстве случаев проводится консервативными методами, но при тяжелом течении может потребоваться хирургическое вмешательство.
Терапия фасеточного синдрома в большинстве случаев проводится консервативными методами, но при тяжелом течении может потребоваться хирургическое вмешательство.
В первую очередь подбираются медикаменты, позволяющие устранить воспаление и болевой синдром. Часто применяются нестероидные противовоспалительные средства:
- Ибупрофен;
- Диклофенак;
- Нурофен;
- Ортофен.
Для облегчения симптомов заболевания рекомендуется использовать мази и гели с разогревающим или охлаждающим действием. При интенсивном болевом синдроме могут быть показаны новокаиновые блокады. В редких случаях назначаются наркотические анальгетики. Для запуска регенерации поврежденных суставных поверхностей в схему лечения могут вводиться хондропротекторы и поливитамины.
При консервативном подходе к лечению данного патологического состояния могут назначаться следующие процедуры:
- электрофорез;
- парафиновые аппликации;
- иглорефлексотерапия;
- бальнеотерапия.
Помимо всего прочего, пациентам назначается лечебный массаж, позволяющий устранить спазм мышц спины. После устранения острых симптоматических проявлений заболевания пациенту назначается ЛФК. Упражнения подбираются индивидуально. Они должны способствовать восстановлению нормальной осанки и укреплению мышечного корсета.
В тяжелых случаях, когда консервативное лечение не позволяет добиться положительного эффекта, могут применяться хирургические методы. Наиболее часто выполняется процедура радиочастотной денервации. Этот метод предполагает воздействие на больные суставы электромагнитного излучения высокой частоты. Хирургическое вмешательство требует выполнения общего наркоза. Для получения доступа выполняются небольшие разрезы мягких тканей. Длительность операции в большинстве случаев составляет 25-40 минут.
Кроме того, при лечении фасеточного синдрома может быть показано применение фасетопластики. Это малоинвазивный метод терапии, предполагающий введение в поврежденное сочленение небольшого количества синовиальной жидкости.
Заключение
При фасеточном синдроме прогноз в большинстве случаев благоприятный. Комплексная терапия позволяет устранить симптомы этого патологического состояния и приостановить дальнейшее разрушение фасеточных суставов.
Для снижения риска дальнейшего усугубления патологического процесса рекомендуется регулярно выполнять комплекс ЛФК, придерживаться щадящей диеты и поддерживать вес в норме. При малейших признаках ухудшения состояния требуется дополнительное обследование и проведение направленного лечения.
Фасеточный синдром: причины, симптомы, диагностика, лечение
Фасеточный синдром – это боль, исходящая из тканей сустава или суставов позвоночника: капсула, связки, места прикрепления мышц, субхондральные (подхрящевые) пластины и прочие структуры сустава.
Процессы в сегменте позвоночника, такие как остеохондроз, спондилез, спондилоартроз, спондилоартрит, подвывихи (смещения) или травмы суставов позвоночника, ущемление синовиальной оболочки капсулы сустава, механическое травмирование элементов капсулы сустава, артропатия сустава сопровождаются раздражением нервных окончаний и ощущением боли. Возбуждение передается по нервным стволикам, которые иннервируют сустав. Это, так называемый, нерв Люшка (возвратная менингеальная ветвь). К каждому суставу подходит до 30 нервных стволиков (суставов в позвоночнике). При фасеточном синдроме при наличии воспалительного компонента боль в суставах позвоночника ноющая, тупая, меняющаяся при смене погоды. Это обусловлено тем, что суставы позвоночника иннервируются вегетативными (безмиелиновыми) волокнами, что и определяет характер боли.
Следует отметить, что каждый позвоночный двигательный сегмент имеет суставной комплекс из двух парных дугоотростчатых суставов. Суставы – это, как и межпозвонковый диск, нагружаемая структура сегмента позвоночника. Но суставы нагружаются меньше, чем межпозвонковый диск. Нагрузка на диск позвоночного сегмента до 60–70%. Нагрузка, которая приходится на суставы позвоночника – 15-40%. Но даже при такой относительно небольшой нагрузке суставы легко травмируются, например, при резком разгибании назад, при ротационном движении туловища в сочетании с подъемом тяжести и при некоторых иных видах движений.
Фасеточный синдром встречается достаточно часто. Иногда, не разобравшись, его путают с грыжами диска, особенно, если на уровне боли при МРТ исследовании обнаруживается протрузия или грыжа диска. Поэтому доктор всегда должен анализировать и учитывать набор клинических данных и сопоставлять их с результатами аппаратных исследований.
Диагностика фасеточного синдрома
Диагноз устанавливается при помощи опроса, осмотра больного, проведении двигательных проб, рентгенографии позвоночника, МРТ соответствующего отдела позвоночника. В ряде случаев полезны лабораторные исследования.
Лечение фасеточного синдрома
Тактика лечения зависит от причины, которая вызывает боль в суставах. Если это остеохондроз с грыжей диска, необходимо отдиференцировать клинику фасеточного синдрома от признаков грыжевого выпячивания с тем, чтобы не пойти ложным путем и не начать удалять или лечить грыжу. Если фасеточный синдром вызван смещением в суставах – можно использовать мануальную терапию. Если же имеет место артропатия суставов – лечить основное заболевание. Если причина в артрите – необходимо найти фактор, вызвавший этот артрит. Если артроз – порой достаточно физиотерапии или локальной инъекционной терапии. При рефлекторном мышечно-тоническом синдроме – медикаменты, блокады, мобилизация или мануальная терапия.
Использование радиочастотной денервации сустава имеют ограниченные показания, поскольку разрушая нервные образования вокруг сустава, сустав лишается естественной регуляции. Например, вегетативная денервация сустава может вызвать так называемый синдром Зудека, или – нарушение трофики (питания) сустава с быстрым развитием дегенеративного процесса в самом суставе и его хряще. После радиочастотной денервации может быть утеряно мышечное (двигательное) обеспечение сустава, что также приведет к быстрому развитию артроза и, возможно, к усилению боли в будущем. Таким образом, лечение фасеточного синдрома должно быть взвешенным, выверенным, проводиться с учетом конкретной патологии, которая вызывает боль в суставе (или суставах) позвоночного двигательного сегмента.
Эффективным лечение может быть только при верном диагнозе. Диагностика и лечение фасеточного синдрома проводится в Центре «Меддиагностика».
Фасеточный синдром на поясничном уровне у пожилых пациентов: диагностика и лечение | #04/16
Хронические боли в спине являются важной проблемой в медицинском и социальном плане в связи с упорным течением, нередким отсутствием значимого эффекта от проводимой терапии и высокими затратами, связанными с лечением. Актуальность проблемы обусловлена и тем обстоятельством, что, как любой хронический болевой синдром, боли в спине способствуют избыточной стимуляции симпатоадреналовой системы, значимо повышающей риск кардиоваскулярных катастроф, и негативно влияют не только на качество жизни, но и на ее продолжительность. В современных исследованиях показано, что уменьшение продолжительности жизни у пожилых людей в большей степени зависит от наличия хронической боли, чем от наличия или отсутствия жизнеугрожающих заболеваний [1].
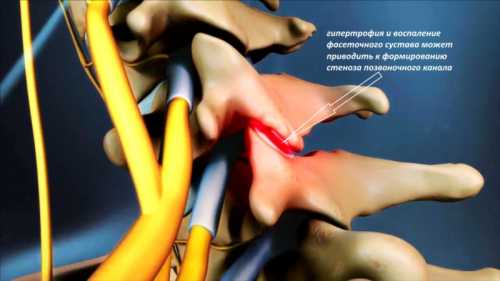
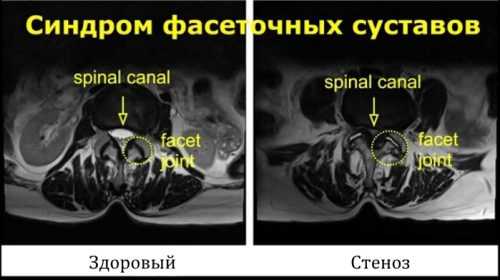
Наиболее частым источником хронических болей в спине, особенно у пожилых пациентов, являются фасеточные суставы. Фасеточные суставы (синонимы — дугоотростчатые, межпозвонковые суставы, articulationes zygapophysiales) формируются при соединении нижнего и верхнего суставных отростков позвонков и имеют типичное строение: суставные отростки, покрытые слоем гиалинового хряща, синовиальная оболочка, синовиальная жидкость и капсула, укрепленная волокнами многораздельной мышцы. Ориентация суставных полостей в шейном отделе приближается к горизонтальной плоскости, в грудном — к фронтальной и в поясничном отделе — к сагиттальной плоскости. Фасеточные суставы имеют сложную и обширную ноцицептивную и проприоцептивную иннервацию: каждый сустав иннервируется из 2–3 сегментов спинного мозга, что обеспечивает «перекрытие» зон распространения боли. Выделены 4 механизма ирритации нервных окончаний в двигательном сегменте: 1) механический или дисфиксационный — за счет смещения тел позвонков и суставных отростков по отношению друг к другу; 2) компрессионный — экзостозами, при ущемлении капсулы сустава, менискоидов или свободных хрящевых сегментов в суставе; 3) дисгемический — за счет отека периартикулярных тканей, нарушения микроциркуляции, венозного стаза; 4) воспалительный — за счет асептического (реактивного) воспаления в тканях двигательного сегмента [2].
Частота дегенеративных изменений фасеточных суставов в популяции широко варьирует (от 40% до 85%) из-за использования разными авторами различных критериев диагностики и увеличивается с возрастом. При хронических болях в спине, согласно результатам исследований, проводившихся с использованием диагностических блокад, поражение фасеточных суставов является причиной болевого синдрома на поясничном уровне в 30–60% случаев, на шейном — в 49–60%, на грудном — в 42–48% случаев [3].
Под фасеточным синдромом, как правило, подразумевают болевые проявления спондилоартроза, при которых нет компрессии корешка спинномозгового нерва или других нервно-сосудистых образований элементами патологически измененного двигательного сегмента. Вместо термина «фасеточный синдром» используются также «синдром спондилоартралгии», «синдром воспаления мелких суставов позвоночника» или «механический нижнепоясничный синдром». Многими авторами термины «фасеточный синдром» и «спондилоартроз» рассматриваются как синонимы. Спондилоартроз, являющийся морфологической основой фасеточного синдрома, — частная форма остеоартроза, представляющего собой гетерогенную форму заболеваний, различных по клинической картине и исходам, в основе которых лежит поражение всех составляющих элементов фасеточных суставов — хряща, субхондральной кости, связок, капсулы и периартикулярных мышц. При поясничном спондилоартрозе обнаружено резкое уменьшение толщины суставного хряща вплоть до полного его исчезновения на отдельных участках, в которых отмечалось разрастание костной ткани. Спондилоартроз может развиваться изолированно, но значительно чаще он формируется на фоне дегенерации межпозвонковых дисков, приводящей к повышению нагрузки на фасеточные суставы и их хронической травматизации. Как и поражение дисков, спондилоартроз чаще наблюдается у пожилых пациентов, но может развиваться и у лиц молодого возраста, чему способствуют наследственная предрасположенность, врожденные аномалии, травмы позвоночника, гипермобильность позвоночно-двигательных сегментов (ПДС), избыточная масса тела. При травмах (по типу «хлыста», тракции, ротации) фасеточный синдром может развиваться остро.
Развитие спондилоартроза связано с нарушениями функциональной анатомии позвоночного столба, передние отделы которого (к ним относятся межпозвонковые диски) предназначены, главным образом, для сопротивления силам тяжести (компрессии), а задние отделы (в т. ч. фасеточные суставы) — для стабилизации позвоночника при ротации и смещении позвонков в переднезаднем направлении. В норме 70–88% осевой компрессионной нагрузки приходится на передние отделы и лишь 12–30% — на задние. При развитии дегенеративных изменений в дисках снижается их высота, нарушается амортизирующая функция, и доля осевой компрессионной нагрузки, приходящейся на фасеточные суставы, постепенно увеличивается. Перегрузка суставов на фоне формирующейся нестабильности ПДС ведет вначале к воспалительным изменениям (синовиту), а затем — к дегенерации суставного хряща, деформации капсул суставов и подвывихам в них. Этот патологический процесс носит асимметричный характер, что может быть связано с неравномерностью нагрузки на парные фасеточные суставы. Повторные микротравмы, компрессионные и ротаторные перегрузки ведут к прогрессированию дегенеративных изменений хряща вплоть до практически полной его утраты, развитию периартикулярного фиброза и формированию остеофитов, что приводит к увеличению размеров верхних и нижних фасеток, приобретающих грушевидную форму. Под влиянием импульсации из пораженного ПДС, в особенности из задней продольной связки, возникает рефлекторное напряжение межпоперечных, межостистых мышц и мышц-вращателей, что в случае асимметричного их вовлечения вызывает формирование сколиоза. Сочетание изменений в диске, фасеточных суставах и мышечно-тонических нарушений приводит к резкому ограничению движений в соответствующем ПДС.
Болевые ощущения, возникающие при фасеточном синдроме, являются примером ноцицептивной боли, связанной с явлениями синовита, прямым механическим раздражением ноцицепторов суставной капсулы на фоне явлений нестабильности и мышечно-тонических нарушений. Наиболее часто спондилоартроз развивается в поясничном отделе позвоночника, преимущественно в ПДС L4-L5 и L5-S1, испытывающих наибольшие перегрузки. Максимальный риск травматизации фасеточных суставов возникает при резких скручивающих движениях в пояснице. Дополнительным фактором, способствующим развитию спондилоартроза, является слабость брюшной стенки, сопровождающаяся увеличением выраженности поясничного лордоза и компрессионной нагрузки на фасеточные суставы. Значительно реже поражение фасеточных суставов наблюдается в шейном (преимущественно на уровнях С2-С3 и С5-С6) и грудном отделах позвоночника. Для фасеточного синдрома характерно рецидивирующее течение, постепенное развитие и медленный регресс каждого болевого эпизода и тенденция к удлинению и утяжелению каждого последующего обострения [4].
Основным компонентом сустава, подвергающимся дегенерации при остеоартрозе, является хрящ, состоящий из матрикса и хондроцитов, в которых происходит чрезмерное местное высвобождение протеолитических ферментов и прогрессивное замедление репарации хряща. Это приводит к дисбалансу между синтезом и деградацией внеклеточного матрикса. Матрикс содержит гликозамины (протеогликаны) и коллаген. При деградации матрикса идет потеря гликозаминов, сопротивление матрикса хряща воздействию физической нагрузки уменьшается, и поверхность хряща становится чувствительной к повреждению. Кроме того, на хондральном уровне синтезируется широкий спектр биоактивных молекул: провоспалительные цитокины, свободные радикалы, фактор роста, простагландин Е2, лейкотриен B4. Этот воспалительный компонент усиливает дегенеративные механизмы. Воспаление развивается в первую очередь в синовиальной оболочке, приводит к нарушению фильтрации через мембрану гиалуроновой кислоты, ее вымыванию из полости сустава и прогрессированию дегенерации хряща. Провоспалительные цитокины синтезируются в синовиальной оболочке, а затем диффундируют в суставной хрящ через синовиальную жидкость, отвечают за повышенный синтез и экспрессию матриксных металлопротеиназ, разрушающих суставной хрящ [5]. Синовиальное воспаление напрямую связывается с возникновением и развитием остеоартроза. Неконтролируемый ангиогенез — важная составляющая часть синовиального воспаления, и два этих взаимозависимых процесса — ангиогенез и воспаление — вносят серьезный вклад в развитие остеоартроза [6]. Таким образом, к патофизиологическим механизмам развития остеоартроза относят не только механическое поражение сустава и дегенеративный процесс, но и сопутствующее хроническое воспаление, способствующее разрушению гиалинового хряща. В патологический процесс вовлекаются и структуры центральной нервной системы, связанные с формированием хронического болевого синдрома. Поэтому ведущими направлениями патогенетического лечения остеоартроза являются модуляция воспаления, регуляция метаболизма хондроцитов и стимуляция синтеза хряща [7].
Особенности клинической картины фасеточного синдрома на поясничном уровне детально описаны [8]. Боль, как правило, умеренной интенсивности, носит диффузный характер, плохо локализуется, описывается пациентами как «глубокая», «ноющая», «давящая», «скручивающая», «сжимающая». Характерны феномен «утренней скованности» и максимальная выраженность боли в утренние часы (признаки, отражающие воспалительный компонент), а также после нагрузки в конце дня (что обусловлено явлениями нестабильности и дисфиксации в области пораженного ПДС). Боли локализуются паравертебрально, могут быть двусторонними или латерализованными. Боль, исходящая из фасеточных суставов нижнепоясничного уровня (L4-L5, L5-S1), может отражаться по склеротомам в ягодичную область, область копчика, тазобедренного сустава, паха, в бедро (по задней поверхности) и, как правило, не «спускается» ниже колена. Боль от суставов верхнепоясничного уровня (L1-L2, L2-L3, L3-L4) может распространяться в область груди, боковой поверхности живота. Боли при фасеточном синдроме на шейном уровне могут отражаться в область надплечий и/или верхнюю часть спины и значительно реже — в плечо, предплечье, кисть (более характерно для дискогенных радикулопатий). От обострения к обострению паттерн боли (ее локализация, характер и интенсивность) может меняться. Характерной особенностью фасеточного болевого синдрома на поясничном уровне является появление или усиление болевых ощущений при разгибании и ротации поясничного отдела позвоночника, возникающих при переходе из положения сидя в положение стоя, при длительном стоянии, «скручивании» в пояснице. При этом сгибание и наклон в поясничном отделе могут приводить к уменьшению болевых ощущений. Боли уменьшаются на фоне «разгрузки» позвоночника — лежа либо при сгибании позвоночника с опорой на руки (стойка, перила). В отличие от болевого синдрома при радикулопатии, отраженная боль при фасеточном синдроме не достигает пальцев, плохо локализуется, не несет в себе паттерны нейропатического болевого синдрома (ощущения «электрического тока», жжения, парестезии и др.), усиливается при экстензии (а не флексии) позвоночника, не сопровождается появлением выраженных симптомов натяжения (Ласега, Мацкевича, Вассермана), а также симптомов выпадения в двигательной, чувствительной и рефлекторной сферах. При неврологическом осмотре выявляются сглаженность поясничного лордоза, сколиоз в грудном и поясничном отделах, локальная боль в пробе Кемпа, локальная болезненность при пальпации в проекции «проблемного» фасеточного сустава, напряжение паравертебральных мышц и квадратной мышцы спины на больной стороне, дискомфорт и ограничение объема движений при наклонах назад. Пальпаторно определяется напряжение мышц вокруг межпозвонкового сустава. Как правило, не бывает каких-либо неврологических чувствительных, двигательных и рефлекторных расстройств. В отличие от корешкового синдрома симптомы «натяжения» не характерны, также как нет ограничения движений в ногах.
Рентгенологическое исследование обладает достаточной информативностью, но обнаружение дегенеративных изменений фасеточных суставов не означает, что именно данные изменения являются причиной болевого синдрома. В асимптомной популяции дистрофические изменения фасеточных суставов выявляются в 8–12% случаев [9].
Общепризнанным стандартом и единственным доказательным методом для подтверждения связи болевого синдрома с патологией фасеточных суставов является исчезновение (или значительное уменьшение) боли через несколько минут после проведения блокады медиальной ветви задней первичной ветви спинномозгового нерва под визуализационным контролем [10]. Но диагностические блокады медиальной ветви не являются широко используемым методом в рутинной клинической практике.
Основной терапией фасеточного синдрома является использование обезболивающих и нестероидных противовоспалительных средств (НПВС), при этом вопрос безопасности лечения имеет особую актуальность. Это обусловлено хроническим рецидивирующим характером болевого синдрома, требующим проведения повторных, зачастую длительных курсов терапии, а также тем обстоятельством, что большинство пациентов — люди пожилого и старческого возраста, что значительно увеличивает риск развития гастроинтестинальных и кардиоваскулярных побочных эффектов. Согласно существующим рекомендациям, больным с риском развития таких явлений со стороны желудочно-кишечного тракта (ЖКТ) должны назначаться неселективные НПВС совместно с гастропротекторами (блокаторами протонной помпы) или селективные НПВС. Пациентам с высоким риском развития кардиоваскулярных побочных эффектов рекомендуется параллельное назначение низких доз ацетилсалициловой кислоты. Кроме того, пожилые пациенты часто страдают заболеваниями, требующими применения непрямых антикоагулянтов (мерцательная аритмия, рецидивирующий тромботический синдром), что, как правило, несовместимо с приемом НПВС. Также необходимо учитывать, что не все препараты группы НПВС можно применять при остеоартрозе — выявлено неблагоприятное влияние на хрящевую ткань таких НПВС, как индометацин, пироксикам, напроксен.
Участие суставного компонента в формировании боли в спине предполагает включение в терапию препаратов, оказывающих симптом-модифицирующий (хондропротективный) эффект, — симптоматических препаратов замедленного действия (Symptomatic slow acting drugs for osteoarthritis — SYSADOA). Вне обострения рекомендуется монотерапия SYSADOA. При обострении процесса и выраженном болевом синдроме рекомендуется комбинирование SYSADOA с НПВС, анальгетическое действие которых развивается гораздо быстрее. Совместное применение позволяет снизить дозу НПВС и тем самым предотвратить ряд нежелательных лекарственных реакций. Препараты группы SYSADOA — это биологически активные вещества, состоящие из компонентов хрящевой ткани, необходимых для построения и обновления суставного хряща. SYSADOA способны влиять на метаболизм костной и хрящевой ткани и стимулировать ее регенерацию, обладают умеренным обезболивающим и противовоспалительным действием и лишены характерных для НПВС побочных эффектов, поскольку механизм их действия не связан с подавлением синтеза простагландинов и блокированием циклооксигеназы, а основан на угнетении ядерного фактора kВ, стимулирующего распад хрящевой ткани в организме. Среди препаратов, относящихся к этому классу, только родственные хрящевой ткани компоненты — глюкозамин (ГА) и хондроитина сульфат (ХС) — имеют высокий уровень доказательности (1А) эффективности над плацебо, а также обладают высокой биодоступностью и хорошей переносимостью (EULAR, 2003). ГА и ХС являются естественными метаболитами хрящевой ткани. ГА является аминомоносахаридом, в организме он используется хондроцитами как исходный материал для синтеза протеогликанов, глюкозаминогликанов и гиалуроновой кислоты. ХС — это ключевой компонент внеклеточного матрикса хрящевой ткани, ответственный за сохранение ее эластичности и сопротивление нагрузкам. Антивоспалительные свойства ХС хорошо исследованы [11], но об его влиянии на ангиогенез известно немного. ХС влияет на выработку синовиальными фибробластами про- и антиангиогенных факторов в пораженной остеоартрозом синовиальной мембране и способен восстанавливать баланс между ними. Так как в развитии остеоартроза одним из ключевых процессов является ангиогенез, благотворное воздействие ХС может быть объяснено именно антиангиогенными свойствами этого вещества [12].
Исследования показали сопоставимую с НПВС и даже более выраженную противовоспалительную активность ГА и ХС [13]. ХС, ГА, их комбинация продемонстрировали структурно-модифицирующий эффект [14, 15]. При одновременном приеме ХС и ГА происходит синергизм их действия, поскольку оба препарата обладают противовоспалительной активностью, а также оказывают анаболический эффект на метаболизм хрящевой ткани и тормозят в ней катаболические процессы, моделируют важнейшие функции хондроцитов в поврежденном хряще. Однако существуют некоторые особенности механизмов действия этих двух солей. Так, ХС оптимизирует состав синовиальной жидкости, а ГА самостоятельно стимулирует выработку ХС [16]. В связи с этим наибольшую популярность приобрели комбинированные препараты, содержащие как ХС, так и ГА. Наиболее изученным, безусловно, является Терафлекс. Преимущество Терафлекса заключается в сочетании двух активных ингредиентов: хондроитина сульфата (400 мг) и глюкозамина гидрохлорида (500 мг) в одной капсуле. Существует другая форма выпуска препарата для перорального приема: Терафлекс Адванс, в котором содержится хондроитина сульфата 200 мг, глюкозамина сульфата 250 мг и ибупрофена 100 мг. Ибупрофен является безопасным стандартом НПВС с коротким периодом полураспада (меньше 6 часов), который не кумулируется и приводит к быстрому анальгетическому эффекту [17]. Эффект комбинации с ибупрофеном признан синергическим, причем анальгезирующий эффект данной комбинации обеспечивает в 2,4 раза меньшая доза ибупрофена [18]. Механизм действия Терафлекса связан с активацией синтеза протеогликанов, угнетением действия ферментов, разрушающих гиалиновый хрящ, увеличением выработки синовиальной жидкости, уменьшением вымывания кальция из костей и улучшением фосфорно-кальциевого обмена. Показанием для назначения Терафлекса является патология опорно-двигательного аппарата, связанная с дегенеративными изменениями в хрящевой ткани. Лечение рекомендуется начинать с препарата Терафлекс Адванс, по 2 капсулы 3 раза в сутки, длительность приема — до 3 недель, а затем перейти на прием базового препарата Терафлекс, не содержащего НПВС (по 2–3 капсулы в сутки, курс 3 месяца), для продления обезболивающего эффекта и защиты хряща. Нами проведено собственное клиническое наблюдение влияния препарата на хронический болевой синдром в нижней части спины.
Цель исследования: изучить эффективность и переносимость Терафлекс Адванс при фасеточном синдроме в амбулаторных условиях у пожилых пациентов.
Материалы и методы исследования
Обследовано 40 пациентов (12 мужчин и 28 женщин), страдающих хронической болью в спине, в возрасте от 60 до 75 лет (пожилой возраст по классификации ВОЗ). Критерием отбора явилось наличие хронического болевого синдрома в нижней части спины в стадии обострения, причиной которого являлся артроз фасеточных суставов. Диагноз был подтвержден комплексным обследованием пациентов. Оценивался неврологический и нейроортопедический статус пациентов с выявлением клинических проявлений фасеточного синдрома. Интенсивность болевого синдрома оценивалась по визуальной аналоговой шкале — ВАШ (Association for the Study of Pain, 1986). Результаты лечения оценивали по изменению симптоматики и по освестровскому опроснику нарушения жизнедеятельности при боли в спине [19], до применения препарата и на 21-й день исследования. Оценивались обзорные рентгенограммы поясничного отдела позвоночника для исключения специфического поражения позвоночника. Для уточнения патологических изменений костных структур позвоночника и изучения структурных изменений в межпозвонковых дисках, спинном мозге проводилась магнитно-резонансная томография (МРТ). С диагностической целью были выполнены блокады с 0,5% новокаином в область поражения дугоотростчатого сустава (паравертебрально). Критериями исключения явились: наличие органических заболеваний нервной системы, психических заболеваний, наличие травм позвоночника в анамнезе, соматические заболевания в стадии декомпенсации. Дополнительные критерии исключения: секвестрированные грыжи и грыжи дисков более 8 мм; выраженная гипермобильность, спондилолистезы более 5 мм; наличие деструктивных изменений в телах позвонков. Больные были разделены на две группы: основную (n = 16) и контрольную (n = 14). Группы пациентов были сопоставимы по полу, возрасту, давности и выраженности хронического болевого синдрома (по шкале ВАШ). При рентгенологическом исследовании у всех пациентов в зоне поражения было выявлено снижение высоты межпозвоночных дисков, субхондральный склероз позвонков, сужение суставной щели, неконгруэнтность суставных поверхностей, формирование остеофитов. Всем пациентам была назначена общепринятая медикаментозная терапия, которая включала миорелаксанты, витамины группы В, ЛФК, массаж, рекомендован оптимальный двигательный режим. Пациентам основной группы был назначен Терафлекс Адванс по 2 капсулы 3 раза в сутки. Пациенты контрольной группы получали диклофенак в кишечно-растворимой оболочке по 50 мг 2 раза в сутки и ингибитор протонной помпы омепразол 20 мг в сутки. Учитывая, что побочные эффекты, среди которых в первую очередь следует опасаться ульцерации слизистой ЖКТ, развиваются чаще у лиц старше 65 лет, суточная доза диклофенака не превышала 100 мг. Курс лечения в обеих группах составил 3 недели. Критерием эффективности лечения служило отсутствие боли или изменение ее интенсивности.
Результаты и обсуждение
На фоне проводимой терапии у пациентов обеих групп был достигнут хороший анальгетический эффект: пациенты отметили уменьшение болей по ходу позвоночника, уменьшение утренней скованности и увеличение подвижности.
Выраженность болевого синдрома по шкале ВАШ у пациентов 1-й группы уменьшилась с 4,3 ± 0,9 балла до 1,7 ± 0,6 балла, у пациентов 2-й группы — с 4,2 ± 0,8 балла до 1,8 ± 0,8 балла. У пациентов обеих групп наибольшая динамика по опроснику Освестри отмечалась по шкалам «интенсивность боли», «возможность ходить», «возможность сидеть», «самообслуживание» и «возможность осуществлять поездки», что связано со снижением болевого синдрома, в меньшей степени затрагивался «сон» и «возможность поднимания предметов». Достоверных различий анальгетического эффекта в группах не отмечено. В ходе исследования установлена хорошая переносимость препарата Терафлекс Адванс, у пациентов каких-либо побочных эффектов отмечено не было. У больных 2-й группы нежелательные явления наблюдались значительно чаще, при этом диклофенак был отменен у 5 пациентов: у 1 больного развилась тошнота, у 2 — боли в эпигастральной области, у 2 больных, страдающих гипертонической болезнью и получающих гипотензивные препараты, — повышение артериального давления, что потребовало отмены диклофенака.
Полученные результаты сопоставимы с проведенными исследованиями клинической эффективности хондропротекторов у пациентов при неспецифических болях в нижней части спины. Впервые ХС при вертеброгенной патологии использовал K. D. Christensen и соавт. в 1989 г. [20]. Многие авторы показали целесообразность применения хондропротекторов в комплексной терапии пациентов с неспецифической болью в спине [21, 22]. При длительном курсовом лечении ХС отмечено уменьшение фрагментации фиброзного кольца верхних межпозвонковых дисков поясничного отдела [23], описан случай регенерации межпозвонкового диска у пациента, страдающего болью в спине, ассоциированной с дегенеративной болезнью диска [24], доказано не только симптом-модифицирующее, но и структурно-модифицирующее действие ХС при дегенеративно-дистрофической патологии позвоночника. Изучена безопасность ХС у пациентов с сопутствующей патологией сердечно-сосудистой системы, не было отмечено возникновения ангинозных болей, аритмий, выраженности хронической сердечной недостаточности и констатировано снижение артериального давления у пациентов с артериальной гипертензией, что позволило уменьшить среднесуточную дозу антигипертензивных препаратов [25]. Учитывая синергизм в действии ГА и ХС, ряд исследователей рекомендует назначать при дорсопатиях комбинацию этих препаратов [26, 27]. Оптимальный синергичный эффект достигается при использовании ГА и ХС в соотношении 5:4; именно в такой пропорции эти вещества содержатся в препарате Терафлекс. Согласно прогностической модели, максимальный эффект Терафлекса следует ожидать на начальных этапах дегенеративно-дистрофического поражения позвоночника; клинически это означает применение препарата после первого рецидива неспецифической боли в спине, особенно при наличии симптомов спондилоартроза. В этом случае курсовое лечение обладает профилактическим эффектом в отношении хронизации боли. Имеются данные [28] об эффективности Терафлекса у пациентов молодого возраста с дегенеративно-дистрофическими заболеваниями шейного, грудного и поясничного отдела позвоночника с острыми и хроническими болями разной интенсивности как в комплексе с НПВС, так и в виде монотерапии. Однако препарат может быть полезен и при развернутой картине спондилоартроза; в этом случае можно ожидать стабилизации состояния и замедления прогрессирования процесса [26].
Выводы
Таким образом, комбинация хондроитин сульфата, глюкозамина и ибупрофена (Терафлекс Адванс) эффективна при лечении фасеточного синдрома поясничного отдела позвоночника в стадии обострения у пожилых пациентов. Терафлекс Адванс оказывает достоверное симптом-модифицирующее действие (уменьшение боли, уменьшение скованности, улучшение двигательной активности). Терафлекс Адванс хорошо переносится пациентами, что способствует улучшению приверженности пациентов к лечению и позволяет рекомендовать переход на прием Терафлекса для долгосрочного симптом-модифицирующего эффекта.
Литература
- Breivik H., Collett B., Ventafridda V. et al. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment // Eur. J. Pain. 2006. Vol. 10, № 4. P. 287–333.
- Луцик А. А. Патогенез клинических проявлений спондилоартроза // Международный неврологический журнал. 2009. № 3 (25). С. 130–135.
- Brummett C. M., Cohen S. P. Facet joint pain in Benzon: Raj’s Practical Management of pain. 4 th ed. Mosby, 2008.
- Cohen S., Raia S. Pathogenesis, diagnosis, and treatment of lumbar zygapophysial (facet joint pain // Anesthesiol. 2007. Vol. 106. P. 591–614.
- Туровская Е. Ф., Филатова Е. Г., Алексеева Л. И. Дисфункциональные механизмы хронического болевого синдрома у пациентов с остеоартрозом // Лечение заболеваний нервной системы. 2013. № 1. С. 21–28.
- Bonnet C. S., Walsh D. A. Osteoarthritis, angiogenesis and inflammation // Rheumatology (Oxford). 2005. Vol. 44, № 1. P. 7–16.
- Hassanali S. H., Oyoo G. O. Osteoarthritis: a look at pathophysiology and approach to new treatments: a review // East African Orthopaedic Journal. 2011. Vol. 5. Р. 51–57.
- Helbig Т., Lee C. K. The lumbar facet syndrome // Spine. 1988. Vol. 13. P. 61–64.
- Wiesel S. W., Tsourmas N., Feffer H. L. et al. A study of computer-asssted tomography. The inci?dence of positive CATscans in an asymptomatic group of patient // Spine. 1984. Vol. 9. P. 549–551.
- Dreyfuss P. H., Dreyer S. J. Lumbar zygapophysial (facet) joint injections // Spine J. 2003. Vol. 3. P. 505–595.
- Hochberg M. C. Structure-modifying effects of chondroitin sulfate in knee osteoarthritis: an updated meta-analysis of randomized placebo-controlled trials of 2-year duration // Osteoarthritis Cartilage. 2010. Vol. 18, Suppl. 1. P. S28-S31.
- Lambert C., Mathy-Hartert M., Dubuc J.-E. et al. Characterization of synovial angiogenesis in osteoarthritis patients and its modulation by chondroitin sulfate // Arthritis Research & Therapy. 2012. Vol. 14, № 2. P. R58.
- Hochberg M. C., Martel-Pelletier J., Monfort J. et al. Randomized, double-blind, multicenter, non inferiority cli nical trial with combined glucosamine and chondroitin sulfate vs celecoxib for painful knee osteoarthritis // Osteoarthritis and cartilage. 2014. Vol. 22, Suppl. P. S7-S56.
- Martel-Pelletier J., Roubille C., Raynauld J.-P. et al. The long-term effects of SYSADOA treatment on knee osteoarthritis symptoms and progression of structural changes: participants from the osteoarthritis initiative progression cohort // Osteoarthritis and cartilage. 2013. Vol. 21. S249.
- Fransen М., Agaliotis M., Nairn L. et al. Glucosamine and chondroitin for knee osteoarthritis: a double-blind randomised placebo-controlled clinical trial evaluating single and combination regimens // Ann. Rheum. Dis. Vol. 74, № 5. P. 851–858. DOI: 10.1136/annrheumdis-2013–203954.
- Glucosamine for osteoarthritis. Systematic review // Evidence-Based Healhcare & Public Health. 2005. № 9. P. 322–331.
- Castellsague J., Riera-Guardia N., Calingaert B. et al. Individual NSAIDs and upper gastrointestinal complications: a systematic review and meta-analysis of observational studies (the SOS project) // Drug Saf. 2012. Vol. 12. Р. 1127–1146.
- Tallarida R. J., Cowan A., Raffa R. B. Antinociceptive synergy, additivity, and subadditivity with combinations of oral glucosamine plus nonopioid analgesics in mice // J. Pharmacol. Exp. Ther. 2003. Vol. 307, № 2. P. 699–704.
- Fairbank J., Mbaot J. C., Davies J. B., O`Brien J. P. The Oswestry Low Back Pain Disability Questionnaire // Physiotherapy. 1980. Vol. 66, N 8. P. 271–274.
- Christensen K. D., Bucci L. R. Comparison of nutritional supplement effects on functional assessments of lower back patients measured by an objective computer-assisted tester // Second Symposium on Nutrition and Chiropractic. Davenport: Palmer College of Chiropractic, 1989. P. 19–22.
- Гориславец В. А. Структурно-модифицирующая терапия неврологических проявлений остеохондроза позвоночника // Consilium Medicum. 2010. № 9. С. 62–67.
- Шостак Н. А., Правдюк Н. Г., Швырева Н. М., Егорова В. А. Дорсопатии — подходы к диагностике и лечению // Трудный пациент. 2010. № 11. С. 22–25.
- Чернышева Т. В., Багирова Г. Г. Двухлетний опыт применения хондролона при остеохондрозе позвоночника // Казанский медицинский журнал. 2009. № 3. С. 347–354.
- Van Blitterswijk W. J., van de Nes J. C., Wuisman P. I. Glucosamine and chondroitin sulfate supplementation to treat symptomatic disc degeneration: biochemical rationale and case report // BMC Complement Altern Med. 2003. Vol. 3. URL: http://www.biomedcentral.com/1472–6882/3/2 (дата обращения: 11.03.2014).
- Мазуров В. И., Беляева И. Б. Применение структума в комплексном лечении синдрома болей в нижней части спины // Терапевтический архив. 2004. № 8. С. 68–71.
- Манвелов Л. С., Тюрников В. М. Поясничные боли (этиология, клиника, диагностика и лечение) // Российский медицинский журнал. 2009. № 20. С. 1290–1294.
- Воробьева О. В. Роль суставного аппарата позвоночника в формировании хронического болевого синдрома. Вопросы терапии и профилактики // Российский медицинский журнал. 2010. № 16. С. 1008–1013.
- Чичасова Н. В. Лечение боли у больных остеоартрозом различной локализации // Лечащий Врач. 2014. № 7. С. 44–50.
Т. Л. Визило*, 1, доктор медицинских наук, профессор
А. Д. Визило*
М. В. Трубицина**
А. Г. Чеченин*, доктор медицинских наук, профессор
Е. А. Полукарова*, кандидат медицинских наук
* ГБОУ ДПО «Новокузнецкий ГИУВ» МЗ РФ, Новокузнецк
** ГАУЗ КО ОКЦ ОЗШ, Новокузнецк
1 Контактная информация: [email protected]
Купить номер с этой статьей в pdf
Проблема хронической боли в спине: фасеточный синдром | Спирин Н.Н., Киселев Д.В.
В современном обществе боли в спине приобрели характер «неинфекционной эпидемии» и встречаются у 84% взрослого населения индустриально развитых стран мира [1]. При этом основной проблемой в медицинском и социальном плане являются не острые, а хронические боли в спине, которые характеризуются упорным течением, нередким отсутствием значимого эффекта от проводимой терапии и высокими затратами, связанными с лечением. Актуальность проблемы обусловлена еще и тем обстоятельством, что как любой хронический болевой синдром, боли в спине способствуют формированию тревоги, депрессии, нарушений сна, а также избыточной стимуляции симпатоадреналовой системы, значимо повышающей риск кардиоваскулярных катастроф, и, таким образом, негативно влияют не только на качество жизни, но и на ее продолжительность [2, 3].Согласно существующим в альгологии представлениям, для любой боли (в т. ч. и для боли в спине) «… наиболее приемлемым сроком для оценки ее как хронической считается продолжительность более 3 мес.» [Merskey H.M., Bogduk N., 1994]. Особенности течения хронических болей в спине были описаны одним из основоположников отечественной вертеброневрологии Я.Ю. Попелянским, который выделял эпизодический, хронически-рецидивирующий с редкими обострениями, хронически-рецидивирующий с частыми и/или более длительными обострениями, рецидивирующе-прогредиентный и перманентный типы течения болевого синдрома [4].
Несмотря на то, что в подавляющем большинстве случаев боли в спине имеют неспецифический (скелетно-мышечный) характер, любой случай хронизации болевого синдрома прежде всего требует исключения «специфических» причин его развития (онкопатология, спондилиты, спондилоартриты, переломы тел позвонков на фоне остеопороза, заболевания внутренних органов с отраженной болью). Отсутствие «красных флажков» (клинических и анамнестических признаков, позволяющих заподозрить «специфическую» патологию), а при необходимости – проведение рентгенологического или нейровизуализационного исследования (компьютерной и/или магнитно-резонансной томографии) в большинстве случаев позволяют клиницисту уже при первичном обследовании пациента исключить воспалительные и/или деструктивные изменения позвоночника в качестве причины болевого синдрома [5].
Возникновение неспецифических (скелетно-мышечных) болей в спине, как правило, связывается с дегенеративно-дистрофическими изменениями структур позвоночного столба и/или с неблагоприятными статодинамическими нагрузками на позвоночник. В качестве потенциальных источников неспецифических болей в спине могут выступать межпозвонковые диски, фасеточные суставы, крестцово-подвздошные сочленения, а также мышцы и фасции. Считается, что острые боли в спине у большинства пациентов регрессируют в течение 4–6 нед., однако в 15–20% случаев они приобретают хронический характер [6].
Среди отдельных структур позвоночно-двигательного сегмента наиболее частым источником хронических болей в спине, в особенности у пожилых пациентов, являются фасеточные суставы (фасеточный синдром). Данные о распространенности фасеточного синдрома при острых болях в спине широко варьируют из-за использования разными авторами различных критериев диагностики. При хронических болях в спине, согласно результатам исследований, проводившихся с использованием диагностических блокад, поражение фасеточных суставов является причиной болевого синдрома на поясничном уровне в 30–60% случаев, на шейном – в 49–60%, на грудном уровне – в 42–48% случаев [7].
Следует отметить, что помимо «морфологических» предпосылок к хронизации болевого синдрома (нарушения биомеханики позвоночника, регионарные нейродистрофические изменения мышц, связок, суставных капсул) хронизации болей в спине могут способствовать наследственная предрасположенность, присоединение нейропатического компонента боли, а также личностные особенности пациента, нарушения в психоэмоциональной сфере и использование неадекватных копинг-стратегий. В реальной клинической практике у пациента, как правило, имеет место целый комплекс причин, обусловливающих хроническое течение болевого синдрома [8].
Фасеточные суставы (синонимы – дугоотростчатые, межпозвонковые суставы, articulationes zygapophysiales) формируются при соединении нижнего и верхнего суставных отростков позвонков и имеют типичное строение: суставные отростки, покрытые слоем гиалинового хряща, синовиальная оболочка, синовиальная жидкость и капсула, укрепленная волокнами многораздельной мышцы. Ориентация суставных полостей в шейном отделе приближается к горизонтальной плоскости, в грудном – к фронтальной и в поясничном отделе – к сагиттальной плоскости. У 20–40% лиц в популяции имеют место так называемые аномалии тропизма (врожденная асимметрия ориентации суставных поверхностей на одном уровне), клиническое значение которых в настоящее время остается предметом дискуссий. Симметричные фасеточные суставы являются комбинированными сочленениями, в которых движение в одном суставе обязательно влечет за собой смещение в другом. В функциональном отношении они представляют собой группу малоподвижных суставов ввиду небольшого объема совершаемых движений, преимущественно в сагиттальной, в меньшей степени – во фронтальной и горизонтальной плоскостях [9]. Следует отметить, что фасеточные суставы (прежде всего суставные капсулы, связки, перикапсулярная ткань) имеют достаточно сложную и обширную ноцицептивную и проприоцептивную иннервацию. При этом каждый сустав иннервируется из 2–3 сегментов спинного мозга, что обеспечивает «перекрытие» зон распространения боли при поражении суставов соседних позвонков [10].
Болевой синдром, связанный с повреждением фасеточных суставов, может наблюдаться при ряде патологических состояний, таких как спондилоартриты (псориатический, болезнь Бехтерева), ревматоидный артрит, метаболические расстройства (подагра), а также подвывихи, микропереломы, разрывы капсулы и хряща суставов при травмах. Однако в подавляющем большинстве случаев причиной поражения фасеточных суставов являются дегенеративно-дистрофические процессы (спондилоартроз). Считается, что частота дегенеративных изменений фасеточных суставов в популяции варьирует от 40 до 85% и увеличивается с возрастом [11]. Описания болевого синдрома, связанного с поражением фасеточных суставов, появились еще в 30–х гг. прошлого века [12], а сам термин «фасеточный синдром», под которым понимается боль, исходящая из структур фасеточных суставов (капсулы, связки, перикапсулярные ткани, субхондральные пластины), был введен V. Mooney и J. Robertson в 1976 г. [13]. Многими авторами термины «фасеточный синдром» и «спондилоартроз» рассматриваются как синонимы.
Спондилоартроз, являющийся морфологической основой фасеточного синдрома, представляет собой частную форму остеоартроза и характеризуется поражением всех составляющих элементов фасеточных суставов – хряща, субхондральной кости, связок, капсулы и периартикулярных мышц. Спондилоартроз может развиваться изолированно, но значительно чаще он формируется на фоне дегенерации межпозвонковых дисков, приводящей к повышению нагрузки на фасеточные суставы и их хронической травматизации. Очевидно, что, как и поражение дисков, спондилоартроз чаще наблюдается у пожилых пациентов. Однако при определенных условиях он может развиваться и у лиц молодого возраста, чему способствуют наследственная предрасположенность, врожденные аномалии, травмы позвоночника, гипермобильность позвоночно-двигательных сегментов, избыточная масса тела. В отдельных случаях при травмах (по типу «хлыста», тракции, ротации) фасеточный синдром может развиваться остро.
Развитие спондилоартроза связано с нарушениями функциональной анатомии позвоночного столба, передние отделы которого (к ним относятся межпозвонковые диски) предназначены, главным образом, для сопротивления силам тяжести (компрессии), а задние отделы (в т. ч. фасеточные суставы) – для стабилизации позвоночника при ротации и смещении позвонков в переднезаднем направлении. В норме 70–88% осевой компрессионной нагрузки приходится на передние отделы и лишь 12–30% – на задние. При развитии дегенеративных изменений в дисках снижается их высота, нарушается амортизирующая функция, и доля осевой компрессионной нагрузки, приходящейся на фасеточные суставы, постепенно увеличивается, достигая 47–70%. Такая перегрузка суставов на фоне формирующейся нестабильности позвоночно-двигательного сегмента ведет вначале к воспалительным изменениям (синовиту), а затем – к дегенерации суставного хряща, деформации капсул суставов и подвывихам в них. Довольно часто этот патологический процесс носит асимметричный характер, что может быть связано с неравномерностью нагрузки на парные фасеточные суставы. Повторные микротравмы, компрессионные и ротаторные перегрузки ведут к прогрессированию дегенеративных изменений хряща вплоть до практически полной его утраты, развитию периартикулярного фиброза и формированию остеофитов, что приводит к увеличению размеров верхних и нижних фасеток, приобретающих грушевидную форму. Под влиянием импульсации из пораженного позвоночно-двигательного сегмента, в особенности из задней продольной связки, возникает рефлекторное напряжение межпоперечных, межостистых мышц и мышц-вращателей, что в случае асимметричного их вовлечения вызывает формирование сколиоза. Сочетание изменений в диске, фасеточных суставах и мышечно-тонических нарушений приводит к резкому ограничению движений в соответствующем позвоночно-двигательном сегменте.
Болевые ощущения, возникающие при фасеточном синдроме, являются примером ноцицептивной боли, связанной с явлениями синовита, прямым механическим раздражением ноцицепторов суставной капсулы на фоне явлений нестабильности и мышечно-тонических нарушений. Наиболее часто спондилоартроз развивается в поясничном отделе позвоночника, преимущественно в позвоночно-двигательных сегментах L4-L5 и L5-S1, испытывающих наибольшие перегрузки. Максимальный риск травматизации фасеточных суставов возникает при резких скручивающих движениях в пояснице. Дополнительным фактором, способствующим развитию спондилоартроза, является слабость брюшной стенки, сопровождающаяся увеличением выраженности поясничного лордоза и компрессионной нагрузки на фасеточные суставы. Значительно реже поражение фасеточных суставов наблюдается в шейном (преимущественно на уровнях С2-С3 и С5-С6) и грудном отделах позвоночника.
Для фасеточного синдрома характерно рецидивирующее течение, при котором трудно прогнозировать как частоту обострений, так и характер, интенсивность и продолжительность болевого синдрома. Но в целом, характерными являются постепенное развитие и медленный регресс каждого болевого эпизода и тенденция к удлинению и утяжелению каждого последующего обострения [14, 15].
Особенности клинической картины фасеточного синдрома на поясничном уровне были детально описаны T. Helbig и C. Lee в 1988 г. [16]. Боль, как правило, умеренной интенсивности, носит диффузный характер, плохо локализуется, нередко описывается пациентами как «глубокая», «ноющая», «давящая», «скручивающая», «сжимающая». Характерны феномен «утренней скованности» и максимальная выраженность болевых ощущений в утренние часы (признаки, отражающие воспалительный компонент боли), а также после нагрузки в конце дня (что обусловлено явлениями нестабильности и дисфиксации в области пораженного позвоночно-двигательного сегмента). Болевые ощущения локализуются паравертебрально, могут быть двусторонними или латерализованными. Боль, исходящая из фасеточных суставов нижнепоясничного уровня (L4-L5, L5-S1), может отражаться по склеротомам в ягодичную область, область копчика, тазобедренного сустава, паха, в бедро (по задней поверхности) и, как правило, не «спускается» ниже колена. Боль от суставов верхнепоясничного уровня (L1-L2, L2-L3, L3-L4) может распространяется в область груди, боковой поверхности живота. Боли при фасеточном синдроме на шейном уровне чаще имеют более локальный характер, могут отражаться в область надплечий и/или верхнюю часть спины и значительно реже – в плечо, предплечье, кисть (более характерно для дискогенных радикулопатий). Важно отметить, что от обострения к обострению паттерн боли (ее локализация, характер и интенсивность) может меняться.
Характерной особенностью фасеточного болевого синдрома на поясничном уровне является появление или усиление болевых ощущений при разгибании и ротации поясничного отдела позвоночника, возникающих при переходе из положения сидя в положение стоя, при длительном стоянии, «скручивании» в пояснице. При этом сгибание и наклон в поясничном отделе могут приводить к уменьшению болевых ощущений. Многие пациенты отмечают уменьшение боли на фоне «разгрузки» позвоночника – при принятии положения лежа либо при сгибании позвоночника с опорой на руки (стойка, перила).
Важно отметить, что в отличие от болевого синдрома при радикулопатии отраженная боль при фасеточном синдроме не достигает пальцев, плохо локализуется, не несет в себе паттерны нейропатического болевого синдрома (ощущения «электрического тока», жжения, парестезии и др.), усиливается при экстензии (а не флексии) позвоночника, не сопровождается появлением выраженных симптомов натяжения (Ласега, Мацкевича, Вассермана), а также симптомов выпадения в двигательной, чувствительной и рефлекторной сферах.
При неврологическом осмотре, как правило, выявляются сглаженность поясничного лордоза, сколиоз в грудном и поясничном отделах, локальная боль в пробе Кемпа, локальная болезненность при пальпации в проекции «проблемного» фасеточного сустава, напряжение паравертебральных мышц и квадратной мышцы спины на больной стороне, дискомфорт и ограничение объема движений, возникающие главным образом при наклонах назад, а не вперед.
Следует отметить, что, несмотря на достаточно характерную и узнаваемую клиническую картину, при фасеточном синдроме отсутствуют патогномоничные клинические признаки, позволяющие надежно дифференцировать его от болей дискогенного и мышечного генеза, что значительно затрудняет диагностику данной патологии [7]. Примечательно, что даже углубленное нейроортопедическое обследование при выявлении фасеточного синдрома хотя и демонстрирует высокую чувствительность (88%), обнаруживает низкую специфичность (39%) по сравнению с результатами диагностических блокад под рентген-контролем [17].
Очевидно, что рентгенологическое исследование и компьютерная томография обладают достаточно высокой информативностью в отношении выявления признаков спондилоартроза. При этом факт обнаружения дегенеративных изменений фасеточных суставов не означает, что именно данные изменения являются причиной испытываемого пациентом болевого синдрома. Не получено убедительных данных о связи между изменениями фасеточных суставов при нейровизуализации и клиническими проявлениями фасеточного синдрома [7]. Известно, что в асимптомной популяции дистрофические изменения фасеточных суставов выявляются в 8–12% случаев [18]. C учетом того, что также не были выявлены корреляции между данными нейровизуализации и результатами диагностических блокад [19], а также эффективностью радиочастотной денервации фасеточных суставов [20], рутинное использование методов нейровизуализации для диагностики фасеточного синдрома, по всей видимости, следует признать нецелесообразным [8].
В настоящее время общепризнанным стандартом и единственным доказательным методом для подтверждения связи болевого синдрома с патологией фасеточных суставов является исчезновение (или значительное уменьшение) боли через несколько минут после проведения блокады медиальной ветви задней первичной ветви спинномозгового нерва под визуализационным (рентгеновская компьютерная томография) контролем [21–23]. В то же время очевидно, что диагностические блокады медиальной ветви не являются широко используемым методом в рутинной клинической практике.
Подобные диагностические сложности в отношении верификации фасеточных суставов как источника боли, очевидно, явились одной из причин того, что в МКБ-10 диагноз «фасеточный синдром», равно как и диагноз «спондилоартроз», отсутствует. Как правило, фасеточный синдром кодируется в рамках спондилеза – рубрика М47.8 «Другой спондилез (без миелопатии и радикулопатии)» [8].
Лечение фасеточного синдрома включает в себя купирование боли в острой стадии и комплекс мер по профилактике последующих обострений. Терапия обострений фасеточного синдрома проводится в соответствии с общими принципами лечения неспецифических болей в спине и имеет своей целью максимально быстрое и полное обезболивание с последующим ранним проведением реабилитационных мероприятий. Существующие Европейские рекомендации по лечению неспецифических болей в спине (low back pain) носят универсальный характер вне зависимости от источника болевых ощущений (диск, фасеточные суставы, мышцы и др.). Во многом это обусловлено тем, что патогномоничные симтомы, характерные для дискогенных, фасеточных или мышечных болей, отсутствуют, а характер и интенсивность болевого синдрома в значительной степени зависят от когнитивных установок и состояния психоэмоциональной сферы пациента. Кроме того, в клинической практике нередки случаи одновременного наличия у пациентов дископатии, спондилоартроза, дисфункции крестцово-подвздошного сочленения и миофасциального болевого синдрома в различных сочетаниях. Все это чрезвычайно затрудняет достоверное определение источника боли, и, по мнению многих авторов, существующие методы исследования не позволяют достоверно выявлять причину боли в пояснице в 70–80% случаев.
Согласно существующим Европейским рекомендациям по лечению острых неспецифических болей в спине [van Tulder М. et al., 2006], наивысшим уровнем доказательности обладают: нестероидные противовоспалительные препараты (НПВП), миорелаксанты, а также комбинации НПВП с миорелаксантами или традиционными анальгетиками (парацетамол). Кроме того, рекомендуется сохранение повседневной двигательной активности, в то время как соблюдение постельного режима рассматривается в качестве фактора риска хронизации болей в спине. Важное значение придается информированию пациента о природе заболевания, его прогнозе и методах лечения. Показано, что объяснение пациенту в доступной форме причин развития болевого синдрома с акцентом на доброкачественность данного состояния и хороший прогноз способствует снятию стресса, значимо улучшает результаты терапии и делает участие пациента в реабилитационных программах более активным [24]. При хронических неспецифических болях в спине, в соответствии с Европейскими рекомендациями [Airaksinen O. et al., 2006], наивысшим уровнем доказательности обладают НПВП (на период обострений или короткими курсами – до 3 мес.), бензодиазепиновые миорелаксанты, антидепрессанты, опиоидные анальгетики, занятия ЛФК и когнитивно-поведенческой психотерапией, капсаицин местно и мультидисциплинарный подход [25].
Обращает на себя внимание, что в рекомендациях по лечению как острых, так и хронических болей в спине в качестве препаратов первой линии, имеющих самую большую доказательную базу, выступают НПВП. Очевидно, это объясняется их патогенетически обусловленным обезболивающим эффектом на основе противовоспалительного действия. Быстрота наступления и выраженность анальгезии, разнообразие лекарственных форм, простота использования и относительная доступность превратили НПВП в одну из наиболее широко применяемых в современной медицине групп лекарственных средств. К недостаткам НПВП, существенно ограничивающим их применение в клинической практике, прежде всего следует отнести побочные эффекты терапии (гастроинтестинальные, кардиоваскулярные осложнения, нарушения функции печени, почек), частота и спектр которых различаются у отдельных препаратов и определяются особенностями фармакокинетики и фармакодинамики. Серьезность возможных осложнений терапии послужила причиной выработки современных подходов к назначению НПВП, согласно которым основным фактором, определяющим выбор препарата в конкретной клинической ситуации, является не его терапевтическая эффективность (считается, что все препараты группы НПВП в этом отношении сопоставимы [26]), а риск развития побочных эффектов у данного пациента с учетом его возраста, сопутствующей патологии, получаемой лекарственной терапии [8, 27].
Следует отметить, что при фасеточном синдроме вопрос безопасности НПВП-терапии имеет особую актуальность. Это обусловлено хроническим рецидивирующим характером болевого синдрома, требующим проведения повторных, зачастую длительных курсов НПВП-терапии, а также тем обстоятельством, что большинство пациентов – люди пожилого возраста, нередко с тяжелой сопутствующей патологией, для которых риск развития побочных эффектов максимален [27].
В России одним из наиболее популярных препаратов из группы НПВП является нимесулид (Найз), широко применяющийся в т. ч. и при патологии опорно-двигательного аппарата, как при остром болевом синдроме, так и при заболеваниях, требующих длительной терапии (ревматоидный артрит, анкилозирующий спондилит, остеоартроз). Как и все НПВП, нимесулид, блокируя в очаге воспаления и тканевого повреждения фермент ЦОГ-2, подавляет продукцию простагландинов – медиаторов воспаления и ноцицептивной боли и за счет этого оказывает противовоспалительный и анальгетический эффекты, по выраженности которых он не уступает, а по некоторым данным [28], несколько превосходит многие препараты данной группы. При этом благодаря минимальному влиянию на ЦОГ-1 (нимесулид относится к препаратам, преимущественно действующим на ЦОГ-2) он характеризуется благоприятным профилем безопасности, в особенности в отношении риска гастроинтестинальных осложнений НПВП-терапии [29, 45].
Кроме того, нимесулид обладает рядом фармакологических эффектов, имеющих значение для клинической практики и не связанных напрямую с влиянием на активность ЦОГ-2. В частности, он способен подавлять синтез ИЛ-6 и урокиназы, а также снижать активность металлопротеиназ, разрушающих протеогликаны и коллаген, что позитивно влияет на сохранение структуры хрящевой ткани и субхондральной кости [30–32]. Очевидно, этот эффект нимесулида может быть особенно значим у пациентов с заболеваниями позвоночника и суставов, связанных с дегенеративными изменениями хрящевой ткани, в т. ч. фасеточным синдромом.
В последние годы широко обсуждается вопрос о центральных механизмах обезболивающего действия НПВП. Считается, что ингибирование синтеза простагландинов в центральной нервной системе способно препятствовать формированию феномена центральной сенситизации и, следовательно, уменьшать риск присоединения нейропатического компонента боли и ее хронизации. Наличие «центральных» анальгетических эффектов у нимесулида подтверждается данными экспериментальных исследований [33, 34].
Существующие рандомизированные клинические исследования демонстрируют высокую эффективность нимесулида при лечении боли в спине. Так, в исследовании T. Pohjolainen et al. (2000) у 104 пациентов с острой неспецифической болью в нижней части спины терапия нимесулидом (200 мг/сут) сопровождалась большим эффектом по сравнению с терапией ибупрофеном (1800 мг/сут) как по выраженности анальгетического действия, так и в отношении восстановления функции позвоночника. При этом нимесулид почти в 2 раза реже по сравнению с ибупрофеном (7% и 13% соответственно) вызывал побочные эффекты со стороны желудочно-кишечного тракта (ЖКТ) [35].
В работе L. Konstantinovic et al. (2010) была продемонстрирована эффективность нимесулида в дозе 200 мг/сут при лечении 546 пациентов с вертеброгенной радикулопатией (т. е. при болевом синдроме смешанного – ноцицептивного и нейропатического характера) при хорошей переносимости терапии [36].
В исследовании K. Ilic et al. (2009) у пациентов с болью в нижней части спины и гонартрозом, получавших нимесулид в дозе 200 мг/сут в течение 3 нед., отмечали достоверное уменьшение выраженности локального болевого синдрома, нарастание объема активных движений в пораженных суставных группах, уменьшение выраженности мышечно-тонических нарушений и симптомов «натяжения» нервных стволов; переносимость терапии была расценена как хорошая [37].
Учитывая, что фасеточный синдром является по сути своей патологией суставов, определенный интерес представляют результаты рандомизированных исследований по применению нимесулида у пациентов с остеоартрозом. Так, в исследовании P. Lucker et al. (1994) у 199 пациентов терапия нимесулидом 200 мг/сут в течение 3 мес. оказалась более эффективной, чем применение этодолака 600 мг/сут при сопоставимой частоте побочных эффектов [38]. В работе E. Huskisson et al. (1999) у 279 пациентов с остеоартрозом эффективность терапии нимесулидом (200 мг/сут) и диклофенаком (150 мг/сут) в течение 6 мес. была практически одинаковой, однако переносимость нимесулида была значительно лучше (ЖКТ-осложнения были отмечены у 36% больных, получавших нимесулид, и у 47% – принимавших диклофенак) [39]. В наиболее масштабном и продолжительном исследовании W. Kriegel et al. (2001), изучавших эффективность и безопасность терапии нимесулидом (200 мг/сут) и напроксеном (750 мг/сут) у 370 больных остеоартрозом в течение 12 мес., эффективность и безопасность терапии были несколько выше при приеме нимесулида [40].
Одним из наиболее важных достоинств нимесулида является относительно низкая частота развития класс-специфических для НПВП осложнений со стороны ЖКТ, во многом определяющих соотношение риск/польза при лечении препаратами этой группы. Данные, свидетельствующие о благоприятной переносимости нимесулида в отношении ЖКТ, получены в ряде крупных эпидемиологических исследований.
Так, A. Conforti et al. (2001) проанализировали 10 608 сообщений о серьезных побочных эффектах, связанных с приемом различных НПВП. Согласно полученным данным, количество ЖКТ-осложнений на прием нимесулида составило 10,4% от их общего числа. При этом диклофенак был причиной осложнений в 21,2% случаев, кетопрофен – в 21,7%, а пироксикам – в 18,6% [41]. В масштабном эпидемиологическом исследовании J. Laporte et al. (2004) оценивался риск развития ЖКТ-кровотечений на фоне приема различных НПВП по результатам анализа причин 2813 опасных ЖКТ-кровотечений. Нимесулид показал большую безопасность, чем многие другие НПВП, популярные в Европе: относительный риск кровотечения для нимесулида составил 3,2, для диклофенака –3,7, мелоксикама – 5,7, а рофекоксиба – 7,2 [42].
При наличии факторов риска развития НПВП-индуцированных гастропатий (пожилой возраст, язвенная болезнь в анамнезе, прием кортикостероидов, дезагрегантов и антикоагулянтов) на протяжении всего курса НПВП для защиты ЖКТ целесообразно назначать ингибиторы протонной помпы (Омез 20 мг/сут). Следует помнить, что хотя при парентеральном и ректальном применении НПВП диспепсия возникает реже, чем при приеме таблетированных форм, риск развития язв и эрозий ЖКТ практически не зависит от пути введения препарата [27].
Оценка влияния нимесулида на риск сердечно-сосудистых катастроф проводилась в крупном эпидемиологическом исследовании, выполненном A. Helin-Salmivaara et al. (2006) на основе анализа 33 309 эпизодов инфаркта миокарда. Показатель относительного риска инфаркта для нимесулида составил 1,69 и был сопоставим с аналогичными показателями для мелоксикама, этодолака и неселективных НПВП [43].
В последние годы активно обсуждается безопасность нимесулида в контексте риска развития довольно редкого лекарственного осложнения – НПВП-гепатопатии, представляющей собой проявление метаболической идиосинкразии. Объективный анализ имеющихся литературных данных показывает, что гепатотоксичность нимесулида не выше, чем у многих других представителей класса НПВП [44].
Таким образом, нимесулид (Найз) обладает выраженным анальгетическим и противовоспалительном действием, благоприятным профилем безопасности терапии, прежде всего в отношении риска развития НПВП-индуцированных гастропатий, и может быть с успехом использован при лечении неспецифических болей в спине, как острых, так и хронических, в т. ч. обусловленных фасеточным синдромом.
Наряду с консервативной терапией (НПВП, миорелаксанты, антидепрессанты) в лечении фасеточного синдрома могут быть использованы специфические малоинвазивные вмешательства на суставах. В частности, у пациентов с положительным эффектом от диагностических блокад и отсутствием противопоказаний к применению глюкокортикоидов выполняют интра- и периартикулярные лечебные блокады с местными анестетиками и гормонами (дексаметазон 4 мг, бетаметазон 2–4 мг, метилпреднизолон 40 мг). Данные об эффективности блокад противоречивы. Считается, что наиболее отчетливый и продолжительный (до 3 мес.) эффект они могут давать у пациентов с выраженным воспалительным процессом на фоне дегенеративных изменений [46, 47], а также у пациентов с положительным эффектом от предшествующих диагностических блокад [7].
В настоящее время достоверные данные в пользу или против применения физиотерапевтических методов лечения при обострениях фасеточного синдрома отсутствуют [24], однако многими авторами рекомендуется использование магнитотерапии, синусоидально-модулированных токов, фонофореза с гидрокортизоном для снятия отека и воспаления в фасеточных суставах. Считается, что применение методов мануальной терапии при обострении фасеточного синдрома может приводить к восстановлению мобильности в фасеточных суставах и снятию болевого синдрома [24]. Учитывая ведущую патогенетическую роль дегенерации ткани хряща в развитии фасеточного синдрома, широко обсуждается возможность использования в терапии и профилактике спондилоартроза хондропротекторов в качестве структурно- и симптом-модифицирующей терапии, однако рандомизированные клинические исследования, подтверждающие их эффективность именно при фасеточном синдроме, отсутствуют.
При частых и тяжелых обострениях фасеточного синдрома, неэффективности медикаментозной терапии, лечебных блокад применяются методы оперативного лечения, среди которых наиболее эффективным и широко используемым во всем мире является радиочастотная денервация (деструкция, аблация) фасеточных суставов (РЧД). РЧД – миниинвазивная нейрохирургическая операция, которая может быть проведена под местной анестезией в амбулаторных условиях. При РЧД пункционным способом под интраоперационным рентген-контролем периартикулярно вводятся специальные электроды, через которые производится коагуляция нервных окончаний, находящихся в капсуле фасеточных суставов. Следует отметить, что РЧД не влияет на состояние фасеточных суставов, а лишь оказывает симптоматический эффект, приводя к регрессу болевого синдрома. В многочисленных неконтролируемых исследованиях эффективности РЧД при фасеточном синдроме на поясничном уровне положительный эффект отмечается у 50–80% пациентов [20, 48]. Результаты плацебо-контролируемых исследований не столь многочисленны и не столь оптимистичны [49–51]. В систематическом обзоре эффективности РЧД отмечено, что эффективность метода зависит от тщательности отбора пациентов, прежде всего от точности установления источника боли [52].
Проведение РЧД фасеточных суставов оправданно при отсутствии эффекта от медикаментозной терапии (или наличии противопоказаний к ее проведению), при частых (чаще, чем 1 раз в 3–4 мес.) обострениях, отсутствии противопоказаний к РЧД (возраст старше 80 лет, выраженная депрессия, зависимость от анальгетических или психотропных препаратов) и положительном результате диагностической периартикулярной блокады [8].
Основным преимуществом метода РЧД является быстрое купирование болевого синдрома и восстановление двигательной активности. Осложнения и побочные эффекты процедуры наблюдаются редко. Спустя 6–12 мес. после операции практически облигатно возникает рецидив болевого синдрома вследствие спонтанной реиннервации фасеточных суставов, что может потребовать выполнения повторной РЧД. Среди других методов оперативного лечения можно отметить операцию артродеза фасеточных суставов [53, 54], а также перспективные методики пульсовой РЧД [56] и криодеструкции [56].
Профилактика обострений фасеточного синдрома в период ремиссии включает в себя прежде всего занятия кинезиотерапией, плаванием, направленные на укрепление мышечного корсета (в особенности мышц нижнегрудного и поясничного отделов), связочного аппарата, восстановление нарушенной биомеханики позвоночного столба, правильной осанки. Определенную пользу может принести использование ортопедических подушек, шейного воротника, ортопедического матраса. Снятию мышечного спазма, явлений отека, воспаления в суставах могут способствовать применение рефлексотерапии, физиотерапии, массажа, курсовой прием хондропротекторов и витаминов. Как и при хронической боли любой локализации, обязательным этапом обследования пациента является диагностика нарушений в эмоциональной сфере и их коррекция с помощью психотерапии и приема антидепрессантов [2, 7, 8].
Литература
1. Walker B.F. The Prevalence of Low Back Pain: A Systematic Review of the Literature from 1966 to 1998 // J. Spinal Disorders. 2000. Vol.13. Р. 205–217.
2. Breivik H., Collett B., Ventafridda V. et al. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment // Eur. J. Pain. 2006. Vol.10(4). P. 287–333.
3. Woolf A., Pfleger B. Burden of major musculoskeletal conditions // Bull World Health Organ. 2003. Vol. 81(9).
4. Попелянский Я.Ю. Ортопедическая неврология. Казань, 1997. Т. 1, 2.
5. Harwood M.I. Low back pain: a primary care approach // Clin. Fam. Pract. 2005. Vol.7(2). P. 279–303.
6. Hestbaek L., Leboeuf-Yde C., Manniche C. Low back pain: what is the long-term course? A review of studies of general patient populations // Eur. Spine J. 2003. Vol.12. P.149–165.
7. Brummett C.M., Cohen S.P. Facet joint pain in Benzon: Raj’s Practical Management of pain, 4th ed. Mosby, 2008.
8. Подчуфарова Е.В., Яхно Н.Н. Боль в спине. М.: ГЭОТАР-Медиа, 2010. 368 с.
9. Horwitz T., Smith R.M. An anatomical, pathological and roentgenological study of the intervertebral joints of the lumbar spine and of the sacroiliac joints // Am. J. Roentgenol. 1940. Vol. 43. P.173–186.
10. Giles L.G.F. Innervation of spinal structures // Clinical anatomy and management of low back pain / Ed. Giles L.G.F. Oxford: Butterworth–Heinemann, 1997. P.219–231.
11. Weishaupt D., Zanetti M., Hodler J. et al. MR imaging of the lumbar spine: prevalence of intervertebral disk extrusion and sequestration, nerve root compression, end plate abnormalities, and osteoarthritis of the facet joints in asymptomatic volunteers // Radiol. 1988. Vol. 209. P. 661–666.
12. Lange M. Die Wirbelgelenke. Stuttgart, 1936. 341 p.
13. Mooney V., Robertson J. The facet syndrome // Clin.Orthop. Relat. Res.1976. Vol.115. P.149–156.
14. Giles L.G.F. Zygapophysial (facet) joints // Clinical anatomy and management of low back pain / Ed. By Giles L.G.F., Singer K. Oxford: Butterworth-Heinemann, 1997. P. 72–97.
15. Cohen S., Raia S. Pathogenesis, diagnosis, and treatment of lumbar zygapophysial (facet joint pain // Anesthesiol. 2007. Vol. 106. P. 591–614.
16. Helbig T., Lee C.K. The lumbar facet syndrome // Spine. 1988. Vol.13. P. 61–64.
17. King W., Lau P., Lees R., Bogduk N. The validity of manual examination in assessing patients with neck pain // Spine J. 2007. Vol. 7. P. 22–26.
18. Wiesel S.W., Tsourmas N., Feffer H.L. et al. A study of computer-assisted tomography. The incidence of positive CAT scans in an asymptomatic group of patient // Spine. 1984. Vol. 9. P. 549–551.
19. Jackson R.P., Jacobs R.R., Montesano P.X. 1988 Volvo award in clinical sciences. Facet joint injection in low-back pain: a prospective statistical study // Spine.1988. Vol. 13. P. 966–971.
20. Cohen S.P., Hurley R.W., Christo P.J. et al. Clinical predictors of success and failure for lumbar facet radiofrequency denervation // Clin. J. Pain. 2007. Vol. 23. P. 45–52.
21. Marks R.C., Houston T., Thulbourne T. Facet joint ihjection and facet nerve block: a randomized comparision in 86 patients with chronic low back pain // Pain. 1992. Vol. 49. P. 325–328.
22. Nash T.P. Facet joints – Intraarticular steroids or nerve block? // Pain Clin. 1990. Vol. 3. P. 77–82.
23. Dreyfuss P.H., Dreyer S.J. Lumbar zygapophysial (facet) joint injections // Spine J. 2003. Vol. 3. P. 505–595.
24. Tulder M., Becker A., Bekkering T. et al. European guidelines for the management of acute nonspecific low back pain in primary care // Eur. Spine J. 2006. Vol. 15 (Suppl. 2). P. 169–191.
25. Airaksinen O., Brox J.I., Cedraschi C. et al. European guidelines for the management of chronic nonspecific low back pain // Eur. Spine J. 2006. Vol. 15. (Suppl. 2). P.192–300.
26. Watson M., Brookes S.T., Faulkner A., Kirwan J. WITHDRAWN: Non-aspirin, non-steroidal anti-inflammatory drugs for treating osteoarthritis of the knee // Cochrane Database Syst. Rev. 2007;(1):CD000142.
27. Каратеев А.Е., Яхно Н.Н., Лазебник Л.Б. и др. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. М.: ИМА–ПРЕСС, 2009. 167 с.
28. Каратеев А.Е. Возможность применения нимесулиды при неспецифической боли в нижней части спины // Неврология, нейропсихиатрия, психосоматика. 2010. №1. C. 61–66.
29. Shah A.A., Thjodleifsson B., Murray F.E. et al. Selective inhibition
Лечение фасеточного синдрома (фасетопластика, радиочастотная денервация)
Фасеточный синдром
Когда при заболеваниях или травмах изменяются межпозвонковые диски, на фасеточные суставы приходится повышенная нагрузка. В результате в этих суставах возникает воспаление (спондилоартрит), а далее развивается дегенеративный процесс (спондилоартроз). Сопровождающий их болевой синдром носит название фасеточного.
В зависимости от наиболее страдающего отдела позвоночника он проявляется болями в шее, спине и в конечностях. Самой частой формой является фасеточный синдром поясничного отдела, симптомы и лечение которого также освещены в этой статье. Считается, что подобной патологией страдают в пожилом возрасте до 80% людей, а боли в спине и шее испытывают до 40% взрослых вообще.
Часто симптомы заболевания появляются, когда фасеточные суставы уже серьезно изменены. Так что хирургическое вмешательство порой является практически единственным способом достижения стойкого обезболивания. Во всяком случае, они дают в 5-6 раз более длительную ремиссию заболевания, чем консервативные методы лечения.
ФАСЕТОПЛАСТИКА
Малоинвазивная инновационная технология введения в полость сустава протеза синовиальной жидкости ВискоПлюс называется фасетопластикой. Основной компонент сложной жидкости — гиалуроновая кислота.
Процедура способствует восстановлению нормальной структуры пораженного сустава, «привлекает» (сорбирует) дополнительные молекулы воды и удерживает их в суставной полости. В результате операции восстанавливается нормальный объем сустава, уменьшается боль и ограничение движения. Есть данные о стимулировании регенерации хрящевых поверхностей.
К сожалению, введение ViscoPlus и других аналогичных препаратов возможно только в тех случаях, когда нет признаков нарушения формы сустава, костных разрастаний. Практически фасетопластика в лечении позвоночника применяется для пациентов средней возрастной группы до 60 лет.
Блокада фасеточных суставов
Эффективно снимает боль введение обезболивающих препаратов местного анестезирующего действия в сочетании с глюкокортикоидным гормональным средством непосредственно в полость фасеточного сустава, либо в зону прохождения чувствительного нерва. Анестетик на время блокирует передачу импульсов по нерву, мгновенно купируя боль, в то время как глюкокортикоидный гормон, обладая выраженным противовоспалительным действием, быстро устраняет воспалительный процесс, отёчность и сдавление тканей (основные причины боли), тем самым продлевая эффект блокады.
РАДИОЧАСТОТНАЯ ДЕНЕРВАЦИЯ ПОЗВОНОЧНЫХ СУСТАВОВ
В тех случаях, когда фасеточные суставы изменены, окружены костными выростами (остеофитами), наиболее подходящий малоинвазивный метод хирургического вмешательствадля стойкого избавления от боли — денервация. Применяются различные методы воздействия на собственный нерв сустава — механическое, термическое его разрушение. Самой передовой методикой, обеспечивающей минимальное повреждение при максимальной эффективности и предсказуемости, является радиочастотный метод.
При радиочастотной денервации происходит термокоагуляция тканей под воздействием электрического тока ультравысокой частоты. К нервам больного сустава подводятся специальные иглы и пропускается электрический ток, вызывающий разогрев тканей до 70 градусов. Нервы фактически прижигаются, блокируя ход болевых импульсов. В Клиническом госпитале на Яузе денервацию позвоночных суставов проводят с помощью радиочастотного генератора Stryker.
Метод может быть применен во всех случаях кроме тех, когда сужен позвоночный канал или сильно деформирован сустав. Он применяется для лечения пациентов в пожилом и даже в преклонном возрасте. Осложнений практически не наблюдается, продолжительность обезболивания более года.
ХОД МАЛОИНВАЗИВНЫХ ОПЕРАЦИЙ ПРИ СИНДРОМЕ ФАСЕТОЧНЫХ СУСТАВОВ
- Для визуального контроля за операциями на суставах позвоночника в Клиническом госпитале на Яузе применяется комплекс интраоперационного контроля С-дуга производства фирмы Philips.
- И фасетопластика и денервация фасеточных суставов — практически амбулаторные процедуры. Они длятся менее часа и не требуют госпитализации.
- Анестезия применяется как местная, так и общая. Последняя необходима для иммобилизации, обеспечения неподвижности пациента. Этого требует точность манипуляций.
- Операцию проводят обычно на нескольких уровнях (сегментах), часто с обеих сторон.
- Послеоперационный период — до 2 суток. Из них 1-2 часа постельного режима, затем, в тот же день пациент может вернуться домой, а через пару дней — к обычному образу жизни. Правда, сразу после операции не стоит садиться за руль, а пожилым пациентам желательна помощь сопровождающего в дороге домой. Иногда рекомендуют ношение полужесткого корсета в течение недели.
Наши специалисты:
Специалисты Клинического госпиталя на Яузе с помощью современной диагностической аппаратуры быстро и точно выяснят причину болей в спине, проведут адекватное, щадящее оперативное вмешательство, которое надолго избавит от боли.
Записаться на консультацию к специалистам Центра вертебрологии и эндоскопической хирургии позвоночника Клинического госпиталя на Яузе можно через специальную форму на сайте или позвонив по указанному на этой странице номеру телефона.
ПОЧЕМУ МЫ
- Опытные врачи. Лечение проводят спинальные хирурги с большим опытом успешной работы в России и за рубежом, доктора медицинских наук. В Клиническом госпитале на Яузе консультируют ортопеды с мировым именем, в том числе доктора из Германии, Израиля и других стран.
- Диагностика. Высокая точность диагностики обеспечивается высокой квалификацией докторов и применением передового оборудования (цифровых томографов Philips, снижающих лучевую нагрузку и повышающих точность обследования на 45-50%). Результаты нашей лучевой диагностики принимаются во всех клиниках мира.
- Высокие технологии. В лечебном процессе доктора применяют самые современные и эффективные технологии, делая доступными нашим пациентам последние достижения медицинской науки.
- Экспертное оборудование. Все вмешательства выполняются в высокотехнологичном операционном блоке, оборудованном по стандартам лучших европейских клиник (оснащение от мировых лидеров в производстве медтехники — «Karl Storz», «DePuy Synthes», «Joimax », «Medtronic», «Stryker», «Zimmer»).
- Международные стандарты. Лечение проводится со строгим соблюдением медицинских протоколов и соответствует высоким требованиям мировых стандартов и Минздрава РФ.
- Мы ценим ваше время. К вашим услугам — комфортные условия госпиталя премиум-класса в центре Москвы. Лучшие специалисты и технологии избавления от боли в спине без необходимости выезда за рубеж.
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
Фасеточный синдром. Вопросы терапии и профилактики | Воробьева О.В.
Боль в спине могут испытывать как совсем молодые люди, так и люди преклонного возраста. Согласно эпидемиологическим исследованиям, у пожилых людей чаще наблюдаются эпизоды тяжелой боли в спине по сравнению с лицами среднего возраста [1]. Также с увеличением возраста нарастает степень персистирования боли [2]. Одно из последних эпидемиологических исследований, выполненное на когорте из 7799 человек, показало, что в возрасте 40–45 лет рецидивирующей болью в спине страдает более трети людей. Риск рецидива боли увеличивается с каждым перенесенным ее эпизодом [3]. Наше собственное проспективное исследование оценки факторов риска неблагоприятного (хроническая боль) исхода острых эпизодов боли в спине показало, что старший возраст пациента и транзиторные эпизоды боли в анамнезе являются негативными предикторами персистирования боли [4]. Пациенты, у которых боли после острого эпизода сохранялись свыше 3 мес., были более старшего возраста (44,6±8,44 против 38,4±9,5, р=0,03) по сравнению с группой пациентов с успешным регрессом боли. Средний возраст пациентов в группе с хронизацией боли превышал 43 года. Среди анамнестических характеристик значимую роль в поддержании болевого синдрома играли следующие факторы: физическая активность, травматизация, частота болевых эпизодов. Пациенты, имевшие в анамнезе больше двух госпитализаций по поводу боли, составили большинство группы с персистирующей болью (2,16±1,54 против 1,29±0,57, р=0,001). Также в группе с персистирующим болевым синдромом превалировали пациенты, имевшие более 3-х болевых эпизодов в анамнезе (3,9±2,72 против 2,19±1,32, р=0,009).
Приведенные в эпидемиологических и проспективных исследованиях факты предполагают, что в фокусе особого внимания клинициста должны находиться лица среднего возраста, поскольку именно этот возрастной срез наиболее уязвим в отношении дебюта боли в спине. Адекватное лечение первых эпизодов боли и последующая коррекция двигательной активности у лиц среднего возраста с высокой долей вероятности могут снизить риски персистирования и хронизации боли в дальнейшем. С возрастом наблюдается превалирование болевых синдромов, связанных с дегенеративным поражением хрящевой ткани межпозвонкового сегмента (межпозвонковых дисков и фасеточных суставов).В последнее время появляется все больше доказательных факторов ассоциации хронической мышечно-скелетной боли с клинически значимой патологией суставного аппарата позвоночника. Так, в одном из самых крупных проспективных исследований пациентов с хронической болью в нижней половине спины без радикулопатии было показано, что 40% имеют фасеточный болевой синдром, 26% – дискогенную боль, 2% – боль, связанную с сакроилиальным сочленением, 13% – за счет раздражения сегментарных дуральных нервов. У 19% причина боли не была идентифицирована [5].
Спондилоартроз (фасеточный синдром) является частной формой остеоартроза, представляющего собой гетерогенную форму заболеваний, различных по клинической картине и исходам, в основе которых лежит поражение всех составляющих элементов сустава – хряща, субхондральной кости, связок, капсулы и периартикулярных мышц. Термин фасеточный синдром был предложен в 1933 г. Ghormley и в настоящее время продолжает широко использоваться.
Дегенеративные изменения
позвоночника и межпозвонковые
(фасеточные) суставы
Подвижность позвоночного столба обеспечивается с помощью различного рода соединений позвонков между собой, главными из которых являются межпозвонковые диски. Суставные отростки выше- и нижележащего позвонков сочленены между собой дугоотросчатыми (межпозвоночными) суставами, а остистые и поперечные – связками.
Дугоотросчатые (фасеточные; от французского facette – фасет, малая поверхность) суставы являются обычными синовиальными и покрыты гиалиновым хрящом, имеют вертикальное расположение суставных поверхностей, фиксируются в основном капсулой и связками, которые удерживают суставы при компрессии в физиологическом положении относительно друг друга. Анатомические исследования показали, что синовиальная выстилка суставов имеет складки, которые, наподобие менисков, выступают в суставную щель и при определенных обстоятельствах могут ущемляться там. Структуры фасеточных суставов богато иннервированы. Суставная капсула, синовиальная оболочка и надкостница фасеток межпозвонкового сустава снабжены как инкапсулированными нервными (тельца Фатера-Пачини), так и свободными окончаниями.
Передние отделы позвоночного столба (передняя продольная связка, тела позвонков, межпозвоночные диски) несут, главным образом, нагрузку по сопротивлению силам тяжести (компрессии), а задние отделы (межпозвонковые суставы, ножки, поперечные и остистые отростки, пластинка) служат для защиты от аксиальных ротаторных и смещающих в переднезаднем и боковых направлениях сил [6]. Распределение сил тяжести в нормальном позвоночном двигательном сегменте, включающем в себя трехсуставной комплекс, происходит следующим образом: от 70 до 88% приходится на его передние отделы, а от 12 до 30% – на задние, главным образом, межпозвонковые (фасеточные) суставы, хотя оба отдела позвоночника испытывают на себе нагрузку при воздействии любых сил. В норме хрящевые поверхности и капсулы межпозвонковых суставов допускают движения лишь в определенных направлениях и с определенной экскурсией (амплитудой). Причем границы возможных движений в межпозвонковом суставе заданы межпозвонковым диском. Уменьшение высоты и объема диска в силу дегенеративных процессов изменяет нейтральное положение соответствующих межпозвонковых суставов. Вследствие этих процессов обычные движения позвоночника перестают укладываться в физиологический объем экскурсии суставов и могут приводить к натяжению суставных капсул сверх физиологического предела, вызывая боль.
Изменение положения суставных фасеток приводит к перераспределению сил тяжести внутри позвоночного двигательного сегмента с увеличением механической нагрузки на хрящевые поверхности. При поражении дисков весовая нагрузка постепенно переходит на межпозвонковые суставы, достигая от 47 до 70%. Такая перегрузка суставов ведет к последовательным изменениям в них: синовиту с накоплением синовиальной жидкости между фасетками; эрозии суставного хряща; растягиванию капсулы суставов и подвывихам в них. Продолжающаяся дегенерация, благодаря повторным микротравмам, весовым и ротаторным перегрузкам, ведет к периартикулярному фиброзу и формированию субпериостальных остеофитов, увеличивающих размеры верхних и нижних фасеток, которые приобретают грушевидную форму. В конце концов суставы резко дегенерируют, почти полностью теряют хрящ. Довольно часто этот процесс дегенерации проходит асимметрично, что проявляется неравномерностью нагрузок на фасеточные суставы. Богато обеспеченные чувствительными рецепторами межпозвонковые суставы являются важным источником боли.
Клиника фасеточного синдрома
Клинические характеристики болевого синдрома имеют общие проявления, характерные для суставной патологии в целом, а также специфичные проявления, связанные с особенностью иннервации фасеточных суставов. Каждый фасеточный сустав и околосуставное пространство иннервируется из двух или трех прилежащих друг к другу уровней – обеспечивает взаимное перекрытие распространения боли от соседних поясничных фасеточных суставов.
Локализация и характер боли. Боль при фасеточном синдроме латерализована. Она может ограничиваться пояснично-крестцовой областью над пораженным суставом, распространяясь на ягодицы, паховую область, нижнюю часть живота и иногда на мошонку. Но чаще боль иррадиирует в верхнюю часть бедра, имитируя радикулярный болевой синдром. Боли в области поясницы, иррадиирующие в ногу, составляют 25–57% от всех болей, локализованных в поясничной области, значительная часть из которых обусловлена поражением суставов. В отличие от истинного радикулярного синдрома боль, исходящая из межпозвонковых суставов, никогда не распространяется ниже подколенной ямки. Фасеточная боль тупая, монотонная, пациенты описывают ее как разлитую. Но у некоторых пациентов она может быть более или менее схваткообразной. При тяжелом фасеточном синдроме на пике боли характеристики болевого синдрома могут имитировать дискогенные боли (псевдорадикулярный синдром). Характерна динамика боли в течение дня. Типично появление кратковременной утренней боли, уменьшающейся после двигательной активности (расхаживание), но обычно снова усиливающейся после дневной активности в конце дня.
Связь с движением. Дебют боли обычно связан с резкой ротацией или разгибанием позвоночника. В дальнейшем характерно усиление боли при длительном стоянии и уменьшение ее при ходьбе и сидении. Боль усиливается при разгибании позвоночника, особенно если оно сочетается с наклоном или ротацией в больную сторону, при перемене положения тела из лежачего в сидячее и наоборот. Известно, что сильное натяжение суставной капсулы возникает в основном при нагрузке на фоне усиления поясничного лордоза (разгибание, ротация). Кроме того, при таком движении уменьшается объем сустава и суставные поверхности соприкасаются теснее. Боль может быть вызвана или усилена при усугублении поясничного гиперлордоза, например в результате спуска по склону или при выполнении действий с предметами, расположенными выше головы.
Напротив, разгрузка позвоночника – легкое его сгибание, принятие сидячего положения, использование опоры (стойка, перила) – уменьшает боль. Боль исчезает, когда пациент лежит на ровной поверхности, слегка согнув ноги в коленных и тазобедренных суставах. Таким образом, боль усиливается при разгибании и статических нагрузках, а уменьшается при сгибании, разминке, разгрузке позвоночника.
Поскольку боль при фасеточном синдроме связана с нагрузкой, симптоматика нарастает в течение дня. Суставная боль провоцируется определенными позами (длительное сидение, стояние) и исчезает при смене положения. Люмбаго, напротив, возникает внезапно и не купируется изменением позы.
В период болевого эпизода и по мере прогрессирования заболевания подвижность позвоночника уменьшается. Отдельные пациенты сообщают об ощущении хруста в позвоночнике при движении.
Течение болевого синдрома. Боль при фасеточном синдроме не постоянная, но склонная к рецидивированию. Обычно боль возникает несколько раз в году, и ее эпизоды с каждым обострением имеют тенденцию к удлинению. Болевой эпизод развивается постепенно и медленно регрессирует. У 2/3 (66–75%) пациентов после купирования острого болевого эпизода еще приблизительно в течение 1–3 мес. сохраняются незначительные боли, что является основой формирования рецидивирующей боли. С течением времени боль становится постоянной.
Объективные симптомы. При осмотре обнаруживаются сглаженность поясничного лордоза, ротация или искривление позвоночника в грудинно-поясничном или пояснично-крестцовом отделах, напряжение паравертебральных мышц и квадратной мышцы спины на больной стороне, мышц подколенной ямки, ротаторов бедра. При перкуссии можно обнаружить локальную болезненность над пораженным суставом. Пальпаторно определяется напряжение мышц вокруг межпозвонкового сустава. Не все межпозвонковые суставы поражаются в равной степени, поэтому диагностическая оценка должна включать посегментное обследование с проверкой болевых ощущений при ротации, сгибании и разгибании поясничного отдела позвоночника. Как правило, не бывает каких-либо неврологических чувствительных, двигательных и рефлекторных расстройств. В отличие от корешкового синдрома симптомы «натяжения» не характерны, так же как и нет ограничения движений в ногах. При рентгенологическом исследовании и компьютерной томографии выявляют гипертрофию межпозвонковых суставов, наличие на них остеофитов. Окончательный диагноз фасеточного синдрома устанавливается после параартикулярной блокады местным анестетиком подозрительного межпозвонкового сустава.
Присоединение вторичной боли. При фасеточном синдроме первичная боль, возникающая в самом двигательном сегменте (поражение суставных капсул), сопровождается вторичной болью, возникающей в скелетной мускулатуре вне сегмента за счет рефлекторного повышения мышечного тонуса. Перенос веса на одну ногу приводит к искривлению туловища и асимметричному положению таза с последующим развитием боли в крестцово-поясничных суставах и мышцах, обеспечивающих движения в этих суставах. Вторичная боль может стать хронической и существовать сама по себе даже после устранения первоначальной причины.
Страдание пациента от боли включает как физический, так и поведенческий компоненты. Боль – выраженная отрицательная эмоция, которая может привести к появлению депрессивных симптомов. В свою очередь депрессия приводит к усилению восприятия боли и изменению психосоциального состояния пациента. В конечном итоге вторичные боли и депрессивные симптомы способствуют хронизации фасеточного синдрома.
Терапевтические подходы к лечению
Рациональная противоболевая терапия основана на анализе механизмов компонентов боли и воздействия на соответствующие ее составляющие. Особенно важен данный подход при хронической боли, опосредованной ноцицепторами, нейрогенной составляющей, а также поведенческим компонентом.
Одним из условий успешной терапии является купирование болевого синдрома начиная с первого дня острого периода. Имеются строгие доказательства полезности НПВП для лечения острой боли и эпизодов усиления хронической боли. Эффективность НПВП в лечении острой боли в спине без корешкового синдрома и хронической боли в спине документально подтверждена в масштабных плацебо-контролируемых исследованиях, что позволило рассматривать НПВП как «золотой стандарт» для лечения большинства болевых мышечно-скелетных синдромов. НПВП следует включать в программу лечения как можно раньше, в 1–2-й день от начала заболевания. Длительность применения и доза НПВП зависят от интенсивности болевого синдрома. Средние сроки лечения составляют 3–4 нед. В то же время дозозависимые побочные эффекты НПВП лимитируют сроки использования этого класса препаратов.
Общую дозу препарата можно уменьшить благодаря мультимодальной терапии с одновременным назначением анальгетиков, противовоспалительных средств, антиконвульсантов и миорелаксантов. Миорелаксанты следует добавить на короткое время, если мышечный спазм значителен. Появляется все больше доказательств эффективности антиконвульсантов (карбамазепин или более современные габапептиноиды) в лечении острых и хронических корешковых синдромов. В отношении других типов мышечно-скелетной боли доказательная база эффективности антиконвульсантов менее разработанной.
Наиболее перспективным, но недостаточно разработанным аспектом лечения боли в спине остаются методы, направленные на устранение причин спондилогенной боли. К сожалению, пока не существует препаратов, способных воздействовать на причины дегенеративных процессов суставного аппарата позвоночника. В то же время в артрологии хорошо себя зарекомендовали препараты, структурно модифицирующие хрящ. Эти препараты обладают обезболивающим и противовоспалительным действием. Данные эффекты обеспечиваются за счет подавления активности лизосомальных ферментов и ингибиции супероксидных радикалов.
Использование препаратов этой группы позволяет значительно уменьшить дозировки применяемых НПВП, что существенно снижает риск развития побочных эффектов. В последнее время наблюдается тенденция использования симптоматических препаратов медленного действия также и при нарушении функции суставов позвоночника. К симптоматическим препаратам медленного действия относятся лекарства, принадлежащие к различным по химической структуре субстанциям, например глюкозамин, хондроитин сульфат и Диафлекс (диацереин) [7]. Начало действия этих лекарств развивается медленно, в течение 4–6 нед., но, что представляется крайне важным, сохраняется на протяжении 2-х и более месяцев после окончания лечения [8].
Среди многих препаратов, имеющих в своей основе протеогликаны, выделяется комплексный препарат Алфлутоп, состав которого сходен с матриксом гиалинового хряща. Основным эффектом Алфлутопа является восполнение матрикса гиалинового хряща, повышение его гидрофильности и, соответственно, сохранение его функции и амортизационных свойств. Дополнительным противовоспалительным эффектом препарата является ингибирование активности металлопротеиназ. Инъекционная форма препарата позволяет использовать его внутрисуставно в случае ограниченного поражения фасеточных суставов, но чаще его используют в/м (паравертебрально) при лечении болевых синдромов, ассоциированных с дегенеративно-дистрофическими изменениями позвоночника. Отдельные проспективные исследования показали противорецидивирующие эффекты Алфлутопа [Левин О.С., 2007].
Диафлекс (диацереин) – новый современный представитель медленных симптом-модифицирующих препаратов, рекомендованных для применения при суставной патологии. Диафлекс представляет собой полусинтетический дериват растительного происхождения. Он является прямым ингибитором синтеза интерлейкина-1 (ИЛ-1), благодаря чему реализует свой модифицирующий эффект на воспалительные внутрисуставные процессы. ИЛ-1 играет фундаментальную роль в поражении хряща. Во-первых, ИЛ-1 способствует экспрессии индуцируемой формы синтетазы оксида азота, которая в свою очередь повышает выделение простагландина E2, ИЛ-6, ИЛ-8 в пораженных хондроцитах, что усугубляет дегенеративные процессы в суставах [9]. Во-вторых, ИЛ-1 повышает продукцию энзимов, разрушающих хрящ, в частности TGFBETA-1 and TGFBETA-2. Кроме того, Диафлекс ингибирует продукцию супероксидов, влияет на миграцию фагоцитов и макрофагов [10].
Наконец, Диафлекс обладает протективным эффектом в отношении гидроксипролина и протеогликанов суставного хряща [8]. В отличие от НПВП Диафлекс не влияет на синтез простагландинов, поэтому лишен присущей НПВП гастродуоденальной токсичности. В целом Диафлекс имеет благоприятный профиль переносимости и не вызывает ренальной и кардиоваскулярной токсичности. Важным преимуществом Диафлекса является наличие у него эффекта последействия, сохраняющегося как минимум на протяжении 4–6 мес. [11].
Механизм действия Диафлекса и его благоприятный профиль переносимости позволяют рассматривать данный препарат как многообещающий для лечения боли в спине, ассоциированной с суставным аппаратом позвоночника, и ограничения прогрессирования заболевания. Оптимальной суточной дозой Диафлекса является 100 мг/сут. (по 1 капсуле 50 мг 2 р./сут.).
Основываясь на механизме действия симптом- и структурно-модифицирующих препаратов, следует рекомендовать их назначение в комплексе с НПВП для лечения острых эпизодов боли. После купирования интенсивной боли и отмены НПВП следует продолжить курс Диафлекса для купирования «остаточной» боли и профилактики возможных болевых рецидивов.
Литература
1. Dionne C.E., Kunn K.M., Croft P.R. Does back pain prevalence really decrease with increasing age? A systematic review // Age Ageing. 2006. Vol. 35. P. 229–234.
2. Leboeuf-Yde C., Nielsen J., Kyvik K.O. et al. Pain in the lumbar, thoracic or cervical regions: do age and gender matter? A population-based study of 34,902 Danish twins 20-71 years of age // BMC Musculoskelet. Disord. 2009. Vol. 20. P. 39.
3. Воробьева О.В., Вауличева А.Л. Хронизация боли в спине у мужчин трудоспособного возраста // Врач. 2010. № 9. C. 47–50.
4. Kolb E., Canjuga M., Bauer G.F., Laubli T. Course of back pain across 5 years: a retrospective cohort study in the general population of Switzerland // Spine. 2011. Vol. 36(4). P. E 268–273.
5. Manchikanti L., Singh V., Pampati V. et al. Evaluationof the relative contributions of variousstructures in chronic low back pain // Pain Physician. 2001. Vol. 4. P. 308–316.
6. Попелянский Я.Ю., Штульман Д.Р. Болезни нервной системы / Под ред. Н.Н. Яхно, Д.Р. Штульмана. – М: Медицина, 2001. C. 293–316.
7. Verbruggen G. Chondroprotective drugs in degenerative joint diseases // Rheumatol. (Oxford). 2006. Vol. 45(2). P. 129–138.
8. Hochberg M.C., Dougados M. Pharmacological therapy of osteoarthritis // Best. Pract. Res. Clin. Rheumatol.2001. Vol. 15(15). P. 583–593.
9. Solignac M. Mechanisms of action of diacerene the first inhibitor of interleukin-1 in Osteoarthritis // Presse Med. 2004. Vol. 33. S. 10–12.
10. Solignac M. Mechanisms of action of diacerene the first inhibitor of interleukin-1 in Osteoarthritis // Presse Med. 2004. Vol. 33. S. 10–12.
11. LequesneV., Berdah L., Gurentes I. Efficacy and tolerability of Diacerhein in the treatment of knee and hip osteoarthritis // Rev. Prat. 1998. Vol. 48 (Suppl. 17). S. 31–35.
Механизм острой фазы болевого фасеточного синдрома на примере грудного отдела позвоночника
Боль в спине занимает ощутимый сегмент в неврологической практике. Нередко боль сопровождается сопутствующей патологией периферической нервной системы, миелопатией, сосудистыми расстройствами. Попытки объяснить причины этих явлений и тактика лечения, часто, к сожалению, сводится к рассмотрению вопроса патологии межпозвонковых дисков. Межпозвонковый диск – важная анатомическая структура в позвоночном двигательном сегменте (ПДС). Вместе с тем, с точки зрения неврологии, ПДС имеет иные, более значимые, структурные компоненты, изменения в которых могут приводить к боли и развитию неврологической патологии. Одна из таких структур — это суставной комплекс.
В рамках определения иных причин боли, обратившись к зарубежной литературе, можно выделить широко используемую нозологическую единицу – «фасеточный синдром» (ФС) или «болевой фасеточный синдром». Проблема ФС дискутируется более 100 лет, начиная с сообщения J.E.Goldwaith опубликованного в 1911 году . Автор описал хроническую боль в пояснице, увязав ее с патологией суставов позвоночника. С того времени многочисленные попытки выяснить механизмы боли при ФС не имели успеха ввиду отсутствия достаточной доказательной базы, которая могла бы объяснить это явление. Рассматривались возрастная или травматическая дегенерация межпозвонкового диска, спондилоартроз, травма мышечной ткани или связочного аппарата и многое другое. Результаты многолетних исследований посвященных проблеме ФС не объясняют механизмы возникновения боли при ФС, в том числе – в грудном отделе позвоночника.
Вместе с тем, относительно эффективными в лечении ФС оказались медикаментозные блокады и так называемая радиочастотная абляция. Суть этих методов заключается в денервации суставов. Получаемый положительный эффект доказывает наличие афферентной импульсации из суставов при ФС. При этом не определены конкретные анатомические структуры области суставов позвоночника, которые служат источником ноцицептивной импульсации при ФС. Существует еще один метод лечения ФС – использование манипуляционных методик лечения позвоночника, которые нередко дают положительный лечебный эффект. Возникает вопрос – почему?
Проведенные нами клинические исследования на пациентах с дорсалгией (боль в грудном отделе позвоночника) показали диспропорцию в распространении биомеханических и дегеранеративных процессах в позвоночнике. Оказалось, что при болях в спине более значимы биомеханические изменения, нежели привычные рентгенологические признаки дегенеративных состояний тканей позвоночника. Более того, находящиеся на слуху остеохондроз, дископатия, спондилез и прочие дегенеративные процессы встречались с равной частотой на уровне боли и в ПДС, со стороны которых больные жалоб не предъявляли. Следует отметить, что в эти исследования были включены больные с дорсалгией при условии отсутствия у них каких-либо иных возможных причин боли воспалительного, врожденного, дискогенного, опухолевого характера, остеопороза, последствий травмы с рентгенологическими признаками повреждения костной ткани позвонков. Нами были определены несколько закономерно определяемых рентгенологических признаков патологии ПДС: асимметрия межпозвонковой щели на рентгенограммах в прямой проекции, минимальное боковое смещение тела грудного позвонка с его боковым наклоном и боковое смещение остистого отростка. Перечисленные признаки были расценены, как фиксированное смещение позвонка ротационного характера несколько превышающее физиологический объем движений ПДС. Выявленные на уровне дорсалгии биомеханические изменения в ПДС приблизили нас к пониманию причины ФС, но не ответили на основной вопрос: какие структуры в суставах позвоночника являются источником болевой импульсации при фасеточном синдроме.
Цель исследования – уточнить структуры межпозвонковых суставов, которые могут быть источником ноцицептивной афферентации при биомеханически обусловленном болевом фасеточном синдроме.
Материалы и методы
Экспериментальные исследования проведены на 42 животных (кролики). Экспериментальный протокол одобрен этической комиссией Национального медицинского университета имени академика А.А.Богомольца. Использована модель смещения грудного позвонка , которая повторяла биомеханические изменения в ПДС, выявленные на рентгенграммах у пациентов на уровне боли (Рис 1).
Рисунок 1. Рентгенограмма грудного отдела позвоночника кролика в прямой и боковой проекциях. Левая рентгенограмма: боковая проекция; видно каудальное смещение остистого отростка Т3 позвонка (стрелка) и его приведение к остистому отростку Th5. Рентгенограмма справа: смещение остистого отростка Тh4 вправо (смещенный отросток обозначен прямой стрелкой), которое свидетельствует о ротационном смещении второго грудного позвонка (показано закругленной стрелкой).
35 животных были пропорционально разделены на 7 групп по 5 животных в каждой. 7 животных составили контрольную группу (по 1 кролику на каждый срок эксперимента). Были выдержаны строго унифицированные условия для всех животных: одна генетическая линия кроликов (шиншилла), одинаковый возраст животных – 4-5 месяцев, один вес – 2.5-3 кг. Животные содержались в одинаковых условиях до- и после оперативного вмешательства.
Была проведена минимальная по объему операция в пределах верхушек остистых отростков. По травматичности операция сравнима с амбулаторной. Использована общая внутривенная анестезия: кетамин 2 мг/кг, диазепам 0,5 г/кг и дроперидол 1 мг/кг. Продолжительность операции не превышала 10 минут: проводился разрез кожи и подкожной клетчатки, верхушка третьего грудного позвонка отводилась несколько вправо и приводилась к верхушке нижележащего четвертого грудного позвонка. В таком положении обе вершины остистых отростков фиксировались лигатурой.
Животные выводились из эксперимента в сроки 7, 14, 28, 42, 56, 84 и 168 суток после операции (7 групп) внутривенным введением в краевую вену уха тиопентала натрия (2 мл 10% раствора). Введение препарата дозировалось таким образом, чтобы в момент забора материала для микроскопического исследования сохранялось сердцебиение животного на грани фибрилляции. Это обеспечивало сохранность нейронов на период до последующей химической фиксации препаратов спинного мозга (время от начала вычленения участка позвоночника до погружения спинного мозга в фиксирующий раствор занимало от 60 до 90 секунд).
Отдел позвоночника от Т2 до Т5 вычленялся вместе с прилежащими фрагментами ребер (Рис. 1) и спинным мозгом.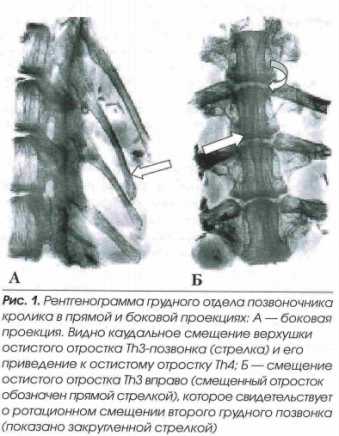
Спинной мозг извлекался из позвоночного канала немедленно и фиксировался в 12% нейтральном формалине. Далее спинной мозг обезвоживали в этаноле возрастающей концентрации, проводили через промежуточную среду, заливали в целлоидин. На санном микротоме изготавливали поперечные срезы стабильной толщины – 10 мкм. Из гистологических методик были выбраны лишь те, которые давали информацию о состоянии нервных клеток и ядер глиоцитов (окраска тионином), а также – информацию о компактности нервной ткани (окраска гемотоксилином и эозином). Дегидратация срезов проводилась в этаноле возрастающей концентрации, срезы просветляли в ксилоле и заливали в канадский бальзам. Параллельное исследование нейронов желатинозной субстанции Rolando (II и III зоны по Rexed) и интермедиолатерльных ядер спинного мозга было мотивировано необходимостью доказать наличие болевой реакции при ФС биомеханического генеза. Микроскопические препараты изучались под объективами 40, 90 и окуляром 10.
Фрагмент позвоночника с прилегающими структурами помещался на 3 суток в 10% раствор фармалина, далее дегидратировался в 5% растворе азотной кислоты в формалине. После декальцинации препарат проводился через спирты возрастающей концентрации, в смеси 960 спирта и эфира в соотношении 1:1, через целлоидин различной плотности и заливались в виде блоков. Изготавливались ступенчатосерийные срезы толщиной 7-10 мкм, которые обезвоживались спиртом, просветлялись ксилолом и заключались в бальзам. Микроскопические препараты изучались под объективами 10, 20, 40, 60, 90 и окулярами 7, 10, 15.
Результаты и их обсуждение
При гистологическом исследовании тканей позвоночного сегмента на уровне сформированного смещения позвонка, наиболее значимые изменения были выявлены в срок 7 суток в межпозвонковых суставах, в частности – в их синовиальной оболочке. Свободно расположенный вырост синовии был отечен. Он плотно вклинивался между несколько смещенными суставными поверхностями (Рис. 2).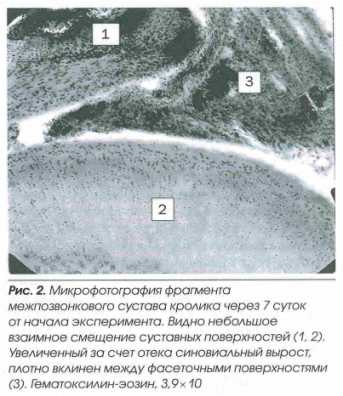
Рисунок 2. Микрофотография фрагмента межпозвонкового сустава кролика через 7 суток после начала эксперимента. Видно небольшое взаимное смещение суставных поверхностей («2» и «3»). «1» — увеличенный за счет отека синовиальный вырост, плотно вклиненный между фасеточными поверхностями.
Гематоксилин и эозин, 3.9*10
Для сравнения на рис.3 приведен неизмененный синовиальный вырост.
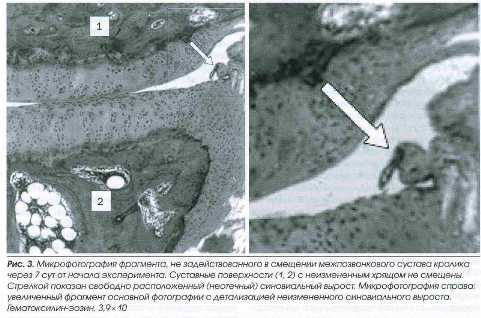 Рисунок 3. Микрофотография фрагмента не задействованного в смещении межпозвонкового сустава кролика через 7 дней после начала эксперимента. Суставные поверхности («1» и «2») с неизмененным хрящом не смещены. Стрелкой показан свободно расположенный (не отечный) синовиальный вырост. Микрофотография справа: увеличенный фрагмент основной фотографии с детализацией неизмененного синовиального выроста.
Рисунок 3. Микрофотография фрагмента не задействованного в смещении межпозвонкового сустава кролика через 7 дней после начала эксперимента. Суставные поверхности («1» и «2») с неизмененным хрящом не смещены. Стрелкой показан свободно расположенный (не отечный) синовиальный вырост. Микрофотография справа: увеличенный фрагмент основной фотографии с детализацией неизмененного синовиального выроста.
Гематоксилин и эозин, 3.9*10
На 14-й день эксперимента наблюдался аналогичный (как и в срок в 7 дней) отек синовиального выроста. При этом у некоторых животных отечность синовиального выроста несколько уменьшилась. Менее отечный синовиальный вырост располагался в суставной щели не так плотно (рис. 3). Приведенная морфологическая картина может соответствовать подострой фазе фасеточного болевого синдрома. Такая динамика процесса свидетельствует о возможности некоторого регресса процесса даже без восстановления топографии в суставе.
Рисунок. 4. Микрофотография фрагмента межпозвонкового сустава кролика через 14 дней после начала эксперимента. Видно небольшое взаимное смещение суставных поверхностей. Отечность синовиального выроста сохраняется, но она менее выражена. Синовиальный вырост менее плотно расположен между фасеточными поверхностями.
Подострая стадия фасеточного болевого синдрома.
Гематоксилин-эозин, 3.9*10
Исследование клеток желатинозной субстанции Rolando серого вещества спинного мозга на уровне сформированного смещения выявило характерные изменения нейронов, свидетельствующие о повышении их функциональной активности: тела нейронов несколько округлялись, хроматофильное вещество слабо окрашивалось, местами наблюдался частичный хроматолиз. В отдельных клетках имело место смещение ядрышка на периферию кариоплазмы. В контрольной группе животных подобные изменения найдены не были. Признаки повышенной функциональной активности были найдены и в отдельных нейронах боковых рогов серого вещества спинного мозга (интермедиолатеральные ядра). Известно, что желатинозная субстанция Rolando контролирует поток болевых импульсов на их входе в спинной мозг. Признаки повышения функциональной активности нейронов этой зоны подтверждало наличие болевого синдрома при биомеханически обусловленном ФС. Реакция нейронов боковых рогов спинного мозга доказывала участие вегетативных сегментарных образований в ФС, обеспечивая известный в клинике вегетативный компонент вертеброгенной боли.
Рассматривая реакцию сегментарных нейронных аппаратов при фасеточном болевом синдроме, нельзя не остановиться на пусковом биомеханическом аспекте вопроса. Биомеханика грудного ПДС не простая. Существует несколько базовых движений в грудном ПДС: флексия с экстензией в сагиттальной плоскости, ротация в горизонтальной плоскости и минимальный боковой наклон позвонка во фронтальной плоскости. Физиологический объем движений в каждом ПДС минимальный. Движения же во всем грудном отделе позвоночника – это сумма мелких движений каждого ПДС. Объем и направление движений в ПДС регламентирует суставной комплекс. Мягкие ткани позвоночника в значительной степени ограничивают подвижность сегмента. При этом, невзирая на обильную иннервацию межпозвонковых суставов, описанные движения в физиологическом объеме безболезненны. Капсулы суставов снабжены мощным рецепторным аппаратом, который контролирует движения. При избыточной (превышающем физиологическое) амплитуде движений либо срабатывают рефлеторные охранные системы, либо происходит банальная микротравма мягких тканей суставного комплекса с развитием отека синовии и включением вторичного болевого синдрома. Это обусловлено наличием собственных мощных рецепторных полей, наиболее значимые из которых: а) II вид рецепторов, расположенных на разделе синовии и капсулы, и б) обширная группа высокопороговых и неадаптируемых рецепторов IV типа, которая обеспечивает болевую чувствительность и вегетативную иннервацию синовии. Последние переходят в слабомиелинизированные или безмиелиновые (вегетативные) волокна, расположенные вдоль мелких кровеносных сосудов. Отек обильно иннервированной синовии является одним из источников боли при фасеточном синдроме. Причем, исходя из характеристик рецепторов IV типа и их волокон, отек синовии и ирритация рецепторных полей могут протекать одновременно.
Суставы позвоночника являются синовиальными. Описанный синовиальный вырост существует, как физиологическое образование. Следует отметить, что этот вырост – своего рода «свободное тело», которое расположено в полости сустава и никоим образом не влияет на движения в ПДС в физиологическом объеме. Он не соприкасается с хрящом суставных поверхностей. Судя по размерам синовиального выроста, его механическое ущемление без предварительного увеличения в размерах маловероятно. Для чего он нужен?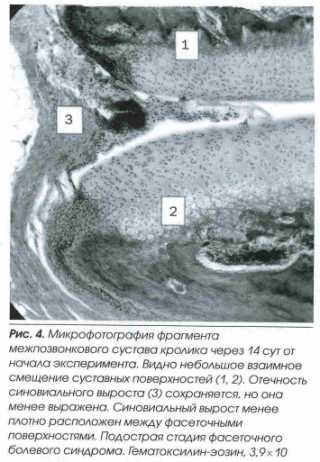
Вырост имеет несколько функций. Первое – это синтез синовиальной жидкости без возможности быть травмированным при условии физиологического объема движений. Второе – вырост синовии в состоянии быстро отекать. Это естествення реакция, которая, судя по полученным данным, направлена на механическое предотвращение дальнейшего смещения в суставе при его травме (чаще бытовой). Синовия суставов позвоночника обильно васкуляризирована и иннервирована, что обеспечивает ее быструю воспалительную и болевую реакцию на нефизиологическое смещение фасеток.
В 40-х годах Kos J. и Wolf J. было высказано предположение о функциональных блокированиях межпозвонковых суставов т.н. менискоидами. Эта теория пыталась объяснить положительный лечебный эффект манипуляции на позвоночнике при болевом фасеточном синдроме. Следует признать, что приведенное исследование подтвердили правомочность этой теории с той разницей, что «менискоидами» авторы называли стабильные в своих размерах внутрисуставные образования невыясненной природы.
Патогенез блокирования суставов оказался много более сложным. Его суть не только в механическом блокировании сустава позвоночника отекшей синовиальной оболочкой, но и в сопутствующих мышечных, сегментарных вегетативных и сосудистых реакциях. Иными совами, речь идет о каскаде сложных нейрогенных механизмов обеспечения функции и защиты позвоночного двигательного сегмента от повреждения.
Выводы
Одним из важнейших механизмов развития фасеточного болевого синдрома в острой фазе является воспалительная реакция синовиального выроста и его ущемление вследствие избыточного смещения в межпозвонковом суставе.
Развитие быстрого отека синовиального выроста межпозвонкового сустава определено обильной васкуляризацией синовии. Поток ноцицептивной импульсации обеспечивает мощное рецепторное поле воспаленного и ущемленного синовиального выроста.
Фасеточный синдром сопряжен с включением нейронных реакций спинного мозга, которые участвуют в возникновении боли с выраженным вегетативным компонентом.
Оригинал статьи в pdf
В.В.Гонгальский. Механизм острой фазы болевого фасеточного синдрома на примере грудного отдела позвоночника// Український неврологічний журнал.-2014.-№2.-С.87-92.
Gongalsky V.V. (2014) Facet pain syndrome. Underlaying mechanisms of acute stage with thoracic spinal unit example. Ukrainian Medical Journal 5(103): 91-93.
доктор медицинских наук, профессор НМУ
В.В.Гонгальский