Гликоделин что это такое
|
Еще в 1910 г. было установлено, что основной функцией эндометрия является подготовка к мидации оплодотворенного ооцита [1], проявляющаяся в гормонально-зависимой структурной и функциональной перестройке ткани. Взаимодействие эмбриона и эндометрия может начаться лишь тогда, когда и эмбрион, и эндометрий достигают определенной критической стадии развития, так называемого "временного окна", вне которого имплантация произойти не может. У человека имплантационное окно ограничено, как правило, 16-19-м днем 28-дневного менструального цикла, способность эндометрия к рецепции бластоцисты полностью исчезает на 22-й день [2]. Десинхронизация процессов дифференцировки эндометрия и эмбриогенеза приводит к отсутствию или дефекту имплантации, что, в свою очередь, обуславливает бесплодие или раннюю потерю беременности [3].
Эндометрий является основной тканью-мишенью для стероидных гормонов яичника - эстрадиола, стимулирующего пролиферацию стромальных и железистых клеток в фолликулиновой фазе менструального цикла, и прогестерона, вызывающего секреторную трансформацию эндометрия в лютеиновой фазе. Отсутствие циклической перестройки эндометрия характерно для ановуляторного цикла, а задержка дифференцировки наблюдается у женщин с недостаточностью лютеиновой фазы (НЛФ) и у 20-40% женщин с неустановленной причиной бесплодия. НЛФ - дисфункция яичников, характеризующаяся уменьшением активности желтого тела. Дефицит синтеза прогестерона ведет к неполноценной секреторной трансформации эндометрия и нарушению имплантации, что клинически проявляется бесплодием или спонтанным выкидышем в I триместре беременности. Частота НЛФ среди причин бесплодия составляет до 25,2%. При определении содержания прогестерона в крови и исследовании биопсийного материала может быть обнаружено явное несоответствие между уровнем гормона и выраженностью секреторных изменений эндометрия. Нормальная концентрация прогестерона во второй фазе цикла не является гарантией полноценной фазы секреции, так как может нарушаться рецепция гормона тканью. Поэтому для постановки диагноза НЛФ необходима биопсия эндометрия, проводимая за 2-3 дня до начала менструации [4]. Возможно лечение НЛФ препаратами, стимулирующими овуляцию, или прогестероном. Однако для оценки эффективности лечения необходимо последующее проведение биопсии. К сожалению, это не всегда оказывается возможным, поскольку из-за дискомфорта, связанного со взятием образца ткани, женщины часто избегают повторной процедуры. В связи с этим вполне оправдан поиск адекватных биохимических показателей функционального состояния эндометрия, которые можно было бы определять многократно в динамике во время менструального цикла и/или беременности. В ряде работ, выполненных с использованием методов гистохимии, иммуногистохимии и морфометрии, показано, что при бесплодии уменьшается секреторная активность эндометриальных желез (5, 6 и др.). Очевидно, это должно проявляться в изменении содержания растворимых продуктов эндометрия в биологических жидкостях, что и определяет сферу поиска маркера функциональной активности ткани. Реальным кандидатом на эту роль является специфический белок репродуктивной системы человека, один из основных секреторных белков эндометрия - a2-микроглобулин фертильности (АМГФ). АМГФ - димерный гликопротеин, молекулярная масса которого варьирует, по данным разных авторов, от 42 до 56 кД в зависимости от источника и способа выделения, углеводы составляют около 20% молекулярной массы белка. В отечественной литературе АМГФ известен под разными названиями. Впервые выделенный и идентифицированный Д.Д. Петруниным и соавт. [7] как новый антиген плаценты, белок был назван хорионическим *2-микроглобулином. Затем, по мере накопления данных о локализации и свойствах белка, его наименование изменялось на плацентарный *2-микроглобулин, *2-микроглобулин фертильности (АМГФ) и, наконец, специфический *2-микроглобулин. В 80-х годах за рубежом белок был выделен и охарактеризован несколькими независимыми группами исследователей как плацентарный протеин 14 (РР14) [8], ассоциированный с беременностью эндометриальный *2-глобулин (*2-PEG) [9], эндометриальный протеин 15 [10], прогестагензависимый эндометриальный белок [11], *-маточный белок [12]. Чтобы избежать терминологической путаницы, A.Dell и соавт. предложили новое обозначение белка "гликоделин", отражающее его уникальную особенность - зависимое от пола гликозилирование [13]. Сравнительные иммунохимические исследования и анализ N-концевых последовательностей показали, что АМГФ и его аналоги антигенно идентичны, хотя между некоторыми формами (РР14 и *2-PEG) существуют минорные различия в первичной структуре [14, 15]. Первичная аминокислотная последовательность АМГФ в высокой степени гомологична структуре лактоглобулинов различных видов млекопитающих (до 59% идентичности), ретинолсвязывающих белков (23%), билинсвязывающего белка (26%), некоторых белков-переносчиков у насекомых и амфибий. Это позволяет отнести АМГФ к семейству белков, участвующих в транспорте низкомолекулярных гидрофобных лигандов, в частности, стероидов и простагландинов [16]. Однако лиганд для АМГФ до сих пор не найден. Методами иммунодиффузионного и иммуногистохимического анализа показано, что АМГФ присутствует в эпителии маточных труб, секреторном эндометрии, децидуальной оболочке плаценты и семенных пузырьках. Белок не выявлялся в нормальных тканях яичника, миометрия, молочной железы, предстательной железы, яичка, эпидидимуса, семявыносящих протоков. АМГФ не был обнаружен также в не относящихся к репродуктивному тракту органах плодов и взрослых [7, 17]. Это позволило рассматривать АМГФ как специфический белок репродуктивной системы человека [18, 19]. Несмотря на более чем 20-летнюю историю исследований белка, его биологические функции до сих пор не установлены [19]. Известно лишь, что АМГФ обладает мощной иммуносупрессорной активностью [20]. По-видимому, АМГФ является одним из факторов, обеспечивающих локальное подавление иммунного ответа матери на развивающийся эмбрион [13, 20, 21]. Эксперименты с органными культурами эндометрия, взятого на разных стадиях цикла, и измерение количества АМГФ в гомогенатах ткани показали, что белок не продуцируется пролиферирующим эндометрием, а синтезируется только в секреторной фазе цикла [18, 22]. Тканевая концентрация АМГФ последовательно возрастает с 0,2-0,5 мг на 1 г общего белка на 4-5-й постовуляторный день до 12-24 мг на 1 г белка на 12-14-й день после овуляции [23]. T.Fay и соавт. [24], получив многослойные культуры эндометрия, установили, что АМГФ синтезируется и секретируется только эпителием желез, но не стромальными клетками эндометрия. Определение тканевой локализации АМГФ методом иммунопероксидазного окрашивания подтвердило четкую временную регуляцию экспрессии белка. АМГФ выявляли в глубоких базальных железах эндометрия только в первые 5 дней менструального цикла, в пролиферативной фазе белок в ткани не обнаруживался. АМГФ появлялся в отдельных железах лишь на 5-й день после овуляции, на 10-й постовуляторный день интенсивное окрашивание на АМГФ давали уже все железы эндометрия. В эпителии поверхностных слоев эндометрия АМГФ также экспрессировался только в секреторную фазу цикла [23, 25, 26]. Таким образом, иммуноморфологические и иммунохимические исследования показали, что АМГФ появляется в ткани эндометрия за несколько дней до возможной имплантации, количество его возрастает во время имплантационного окна и сохраняется высоким до наступления менструации и в течение первых дней следующего цикла, после чего экспрессия белка в эндометрии временно прекращается. В случае наступления беременности синтез АМГФ продолжается, и содержание его в децидуальной ткани в I триместре достигает 4-10% общего белка [27]. Иммуногистохимическое исследование локализации АМГФ во время беременности показало, что наиболее интенсивно окрашиваются эпителий и содержимое желез decidua spongiosa и decidua compacta в I триместре. По мере прогрессирования беременности количество желез в децидуальной ткани уменьшается, интенсивность окрашивания снижается, причем не все эпителиальные клетки содержат АМГФ, что свидетельствует об уменьшении продукции белка [28]. Таким образом, экспериментальные, иммунохимические и морфологические данные показывают, что синтез АМГФ в эндометрии, минимальный в периовуляторном периоде, резко усиливается в периимплантационный период и сохраняется на высоком уровне в случае наступления беременности. Особенно интересно отметить, что начало синтеза и секреции АМГФ в полость матки совпадает со временем попадания туда бластоцисты - 5-6-й день после овуляции. Это подтверждает гипотезу, согласно которой АМГФ играет важную роль в имплантации эмбриона, защищая, как локальный иммуносупрессор, развивающийся полусингенный зародыш от иммунного ответа материнского организма [20]. Кроме того, важной функцией АМГФ в начале беременности, когда плацента только формируется и отсутствует плацентарная циркуляция, может быть транспорт гидрофобных молекул, необходимых для эмбрионального развития, из тканевого окружения [29]. Таким образом, процесс подготовки эндометрия к имплантации и развитию оплодотворенной яйцеклетки включает активацию синтеза иммуносупрессорного белка АМГФ, который можно рассматривать как один из маркеров рецептивности репродуктивной ткани [28]. Уровень АМГФ в периферической крови во время менструального цикла и беременности отражает динамику синтеза белка в эндометрии и децидуальной ткани плаценты. В нормальных овуляторных циклах содержание АМГФ в сыворотке проявляет выраженные циклические колебания. Уровень АМГФ очень низок в периовуляторном периоде, увеличение концентрации белка начинается во время последней недели лютеиновой фазы и достигает пика во время менструации. Высокий уровень АМГФ сохраняется в течение первых дней следующего цикла [24, 30]. По данным T. Fay и соавт., у практически здоровых женщин без нарушений цикла нет существенных различий в средней концентрации АМГФ во время лютеиновой и менструальной фазы. Однако средние уровни белка в сыворотке во время менструации достоверно различаются у женщин с высокой и низкой продукцией прогестерона. Авторы делают вывод, что количество АМГФ, определяемое в периферической крови во время менструации, зависит от степени функциональной реакции эндометрия на продукты секреции желтого тела яичников [24]. При патологии репродукции нарушения структурной перестройки эндометрия могут проявляться в снижении образования АМГФ. L. Klentzeris и соавт. исследовали биопсийный материал эндометрия и измеряли количество АМГФ в сыворотке у 24 женщин с неустановленной причиной бесплодия на 4, 7, 10 и 13-й дни после овуляции [31]. На срезах эндометрия методом иммунопероксидазного окрашивания полуколичественно определяли содержание белка в железах. Установлено, что у женщин с задержкой циклической перестройки эндометрия количество АМГФ в ткани и сыворотке крови достоверно меньше, чем у женщин с нормально дифференцирующимся эндометрием. Эти данные свидетельствуют о наличии существенных функциональных различий, проявляющихся в интенсивности синтеза АМГФ, между эндометрием с полноценной и задерживающейся циклической трансформацией [31]. Однако морфологически нормальная секреторная перестройка эндометрия не всегда свидетельствует о функциональной полноценности ткани. Именно функциональная недостаточность эндометрия может неблагоприятно отражаться на рецептивности матки во время имплантации и ранней плацентации. Это предположение подтверждается данными M. Tulppala и соавт. [32], показавшими, что у 50 женщин с привычным невынашиванием беременности сывороточный уровень АМГФ в лютеиновую фазу цикла был почти в 2 раза меньше такового у нормальных фертильных женщин, несмотря на то, что 40 женщин имели нормальный менструальный цикл и только 10 - НЛФ. У женщин с НЛФ продукция АМГФ была ниже, чем у женщин с нормальным циклом, но эти различия были статистически недостоверны [32]. Субнормальную сывороточную концентрацию АМГФ у женщин с НЛФ обнаружили также [33]. Введение микронизированного прогестерона в лютеиновую фазу при НЛФ повышало уровень АМГФ в периферической крови [34]. Напротив, однократный постовуляторный прием антипрогестинов (мифепристон, онапристон) задерживал развитие секреторных изменений эндометрия. При этом концентрация АМГФ в сыворотке на 12-й день после овуляции была значительно ниже, чем в предыдущем цикле. Следовательно, антагонисты прогестерона отрицательно влияют на эндометриальные факторы, потенциально важные для имплантации [35]. По данным P. Bishoff [36], 83% женщин с низким уровнем АМГФ в лютеиновой фазе имеют асинхронность овариального и эндометриального циклов. В то же время T.Li и соавт. [5] не отметили корреляции между уровнем АМГФ в сыворотке и морфологическим статусом эндометрия у женщин с неустановленной причиной бесплодия и привычным невынашиванием беременности, а также не обнаружили статистически достоверных различий в средних концентрациях АМГФ в середине лютеиновой фазы у женщин с нормальной и задерживающейся дифференцировкой эндометрия. По данным ряда авторов, в ановуляторных циклах, при которых отсутствует циклическая трансформация эндометрия, АМГФ в сыворотке периферической крови в пределах чувствительности методов РИА и ИФА не выявляется [24, 30, 37], что свидетельствует о необходимости овуляции для экспрессии АМГФ. При наступлении и нормальном течении беременности содержание АМГФ в сыворотке увеличиваясь вдвое каждые 2,5 дня и достигает максимума на 4-6-й неделе беременности. Уровень АМГФ остается высоким до 12-16 нед, затем начинает уменьшаться? образуя плато после 24 нед [27]. Снижение концентрации белка во II триместре, по-видимому, обусловлено морфологическими изменениями плаценты - прогрессирующей децидуализацией на фоне инволюции желез decidua spongiosa [28]. Роль полноценно функционирующих яичников в контроле продукции АМГФ была подтверждена в работе H. Critchley и соавт. [38], которые исследовали динамику содержания АМГФ в сыворотке 12 женщин с дисгенезией гонад (в том числе 5 - с синдромом Тернера), которым удалось забеременеть после гормональной заместительной терапии и переноса полученных эмбрионов и донорских ооцитов (программа IVF-OD). На всех сроках исследования (14-16 нед) уровень АМГФ у пациенток после IVF-OD был намного ниже, чем при физиологически протекающей беременности. В то же время средние концентрации другого эндометриального белка? связывающего инсулиноподобный фактор роста-1, синтезируемого стромальными клетками, не различались в обеих группах. Авторы предполагают, что в начале беременности яичники либо сами синтезируют АМГФ, либо продуцируют факторы, стимулирующие продукцию белка. Одним из таких факторов может быть релаксин [38, 39]. К сожалению, несмотря на установленную рядом исследователей корреляцию между динамикой содержания АМГФ в сыворотке и морфологическими изменениями эндометрия, определение концентрации белка в лютеиновую фазу менструального цикла не позволяет оценить вероятность наступления беременности и прогнозировать ее течение. J. Check и соавт. [40] ретроспективно проанализировали содержание АМГФ в сыворотке женщин, прошедших курс лечения бесплодия, обусловленного НЛФ. В исследуемую группу были включены только те женщины (76), у которых удалось восстановить нормальную циклическую трансформацию эндометрия. Образцы сыворотки брали во время проведения биопсии и в позднюю лютеиновую фазу цикла, следующего за тем, в котором повторная биопсия эндометрия подтвердила его нормализацию. В течение 6 мес после лечения 33 из 76 женщин забеременели, хотя у 9 (27%) из них беременность закончилась самопроизвольным выкидышем. Авторы не нашли статистически достоверных различий в средних сывороточных концентрациях АМГФ в предшествующих зачатию циклах у забеременевших и незабеременевших женщин. Различий в уровнях АМГФ у женщин с прогрессировавшей или прервавшейся беременностью также не обнаружили. У 12 забеременевших женщин содержание АМГФ определяли в нескольких циклах, в том числе в цикле зачатия. Средняя концентрация АМГФ в циклах зачатия была выше, чем в предшествующих циклах (43,9±31,4 и 31,0±21,5 ЕД/мл соответственно), но эти различия не были статистически достоверными. Тем не менее более высокий уровень АМГФ в цикле зачатия по сравнению с таковым в предыдущих циклах был отмечен у 10 (87,3%) из 12 беременных, следовательно, существует, по крайней мере, тенденция к усилению продукции белка в циклах зачатия [40]. Учитывая, что содержание АМГФ в ткани эндометрия и периферической крови растет почти экспоненциально в такое критическое время, как периимплантационный период, особый интерес приобретает количественное определение белка для прогнозирования и ранней диагностики беременности в программах вспомогательных репродуктивных технологий (ВРТ), все чаще используемых для решения проблемы супружеского бесплодия. По мнению M. Seppala и соавт. [30], сывороточный уровень АМГФ сам по себе не может быть показателем готовности эндометрия к имплантации. Этот вывод был основан на том, что, исследуя серийные образцы сывороток, полученные у пациенток программы ЭКО-ПЭ в течение периимплантационного периода, авторы не обнаружили различий в количестве АМГФ между стимулированными циклами, завершившимися или незавершившимися беременностью. В то же время по данным J. Check и соавт. [40], в успешных циклах лечения бесплодия методом ЭКО-ПЭ уровень АМГФ в поздней лютеиновой фазе цикла был достоверно выше, чем в неудачных циклах. Следовательно, тенденция, отмеченная в естественных циклах, прослеживается и в стимулированных циклах у пациенток программы ВРТ. Позже появились работы, свидетельствующие о целесообразности определения АМГФ для ранней диагностики беременности. Так, L. Nylund и соавт. [41] показали, что в циклах ЭКО-ПЭ без гормональной поддержки лютеиновой фазы уровень АМГФ у беременных и небеременных женщин не различаются в течение первых 8 дней после получения ооцитов. Но затем в случае наступления беременности начинается быстрый рост концентрации АМГФ в сыворотке, и уже на 15-й день после пункции ооцитов различия в содержании АМГФ между клинической беременностью, биохимической беременностью и отсутствием беременности становятся явно выраженными - в среднем 109, 34 и 48 нг/мл соответственно. L. Arthur и соавт. [29], ретроспективно оценивая сывороточный уровень АМГФ у женщин, участвующих в различных программах ВРТ (ЭКО-ПЭ n=55, перенос донорских эмбрионов в естественном менструальном цикле n=13, перенос донорских эмбрионов на фоне подавления функций гипофиза и гормональной поддержки беременности n=23), установили, что на 12-й день после переноса эмбрионов количество АМГФ может быть показателем наступившей беременности. F. Olajide и T. Chard [37], исследуя в динамике образцы сыворотки 148 пациенток ЭКО-ПЭ, также отмечали резкое повышение уровня АМГФ на 12-й день после переноса эмбрионов в случаях успешной имплантации зародыша. Подобные результаты получили F.Anthony и соавт. [42], определявшие уровень АМГФ в сыворотке пациенток программы ЭКО-ПЭ, составивших две группы - без гормональной поддержки беременности (n=13, количество беременностей 5) и с введением чХГ в лютеиновую фазу (n=18, количество беременностей 13). В обеих группах значительное увеличение концентрации АМГФ у забеременевших отмечено уже на 8-й день после переноса эмбрионов в отличие от неудачных попыток лечения, при которых увеличения содержания белка не происходило. Уровень АМГФ был несколько выше в сыворотке беременных, получавших гормональную поддержку, но различия между группами не были статистически достоверными. Это позволило авторам заключить, что чХГ не участвует в контроле функции АМГФ [42]. Количественное определение АМГФ в программах ВРТ может иметь существенное значение еще и потому, что в циклах ЭКО-ПЭ, в отличие от естественного зачатия, бывает трудно идентифицировать очень раннюю беременность по эмбриональной продукции чХГ из-за перекрестной реакции с экзогенным чХГ, используемым для стимуляции овуляции или поддержки беременности [37]. Таким образом, в программах ВРТ выявление положительной динамики АМГФ в сыворотке крови позволяет диагностировать беременность уже на 8-12-й день после переноса эмбрионов, т.е. на 5-10 дней раньше, чем при использовании УЗИ [42]. Обобщая представленную информацию, можно заключить следующее: ряд фактов свидетельствует о том, что нарушения имплантации и/или плацентации, ведущие к ранней потере беременности, связаны с дефицитом продукции АМГФ в эндометрии. Однако это не всегда проявляется уменьшением сывороточного уровня белка. К тому же значительная индивидуальная вариабельность и перекрывание показателей АМГФ в норме и при патологических состояниях пока не позволяют использовать определение АМГФ в периферической крови в качестве надежного клинического теста. Гораздо более информативным и практически значимым может оказаться измерение количества АМГФ в других биологических жидкостях. Наиболее доступным и адекватным для оценки функций эндометрия объектом исследования представляется менструальная кровь, куда АМГФ попадает непосредственно из отторгающейся ткани. Образец для анализа может самостоятельно получить каждая женщина репродуктивного возраста, причем день цикла будет точно определен по началу менструального кровотечения. В серии работ, выполненных Д.Д. Петруниным и соавт. [18, 22, 43], показано, что количество АМГФ в сыворотке менструальной крови значительно больше, чем в сыворотке периферической крови (4-16 и 8-40 нг/мл соответственно). АМГФ всегда присутствует в менструальной крови фертильных женщин и бесплодных женщин с сохраненной овуляцией [44]. В пределах чувствительности метода иммунодиффузии (1-2 мкг/мл) АМГФ не выявляется в менструальной крови женщин с первичным бесплодием (СПКЯ), ановуляторными циклами, в кровяных выделениях при ациклических маточных кровотечениях. АМГФ исчезает или обнаруживается в очень низких концентрациях в менструальной крови женщин, использующих гормональные контрацептивы. Учитывая тот факт, что трансформация эндометрия в децидуальную ткань при наступлении беременности сопровождается резким повышением продукции АМГФ [18], естественно было бы предположить, что количество АМГФ в кровяных выделениях при начавшемся аборте в ранние сроки беременности должно значительно превышать количество АМГФ в нормальных менструальных выделениях. Действительно, в работе О.П. Шевченко и соавт. [44] установлено, что у пациенток с начавшимся клиническим абортом содержание белка в кровяных маточных выделениях соизмеримо с уровнем АМГФ в ткани плаценты (128-512 мкг/мл). Определение АМГФ в менструальной крови может быть основным способом диагностики особой формы женского бесплодия - привычного субклинического невынашивания при сроке беременности 2-4 нед. Эта форма бесплодия, выявление которой требует специальных методов исследования, часто не учитывается вообще, если беременность прерывается через 2 нед после зачатия, либо расценивается как дисфункция яичников, проявляющаяся в задержке менструации, если субклинический аборт происходит в течение 4 нед после овуляции [45, 46]. В случаях ранних не-диагностированных абортов концентрация АМГФ в кровяных выделениях в 50-100 раз превышает концентрацию белка в нормальной менструальной крови, достигая 0,5-1,0 мг/мл, что явно указывает на состоявшуюся в цикле беременность [47]. Появление реальной возможности диагностики абортов очень ранних сроков позволяет определить истинную частоту невынашивания беременности в разных клинических группах. Так, определение количества АМГФ в менструальной крови женщин с первичным бесплодием выявило циклы с зачатием в 6,9% случаев, что позволило отнести этих женщин к группе ложно-бесплодных и изменить план обследования и реабилитации [46]. Анализ взаимосвязи характера менструального цикла, функциональных изменений эндометрия и содержания АМГФ в менструальной крови, проведенный Л.В. Посисеевой и соавт., послужил основой диагностики нормального цикла, НЛФ и состоявшейся беременности. Установлено, что при нормальной функции яичников концентрация АМГФ в менструальной крови составляет 16-64 мкг/мл, при НЛФ - 2-12 мкг/мл, ановуляции - менее 2 мкг/мл (предел чувствительности метода иммунодиффузии), после прервавшейся субклинической беременности - 123 мкг/мл и более. Определение содержания АМГФ в менструальной крови женщин с нормальной репродуктивной функцией показало, что у большинства из них (у 56,7%) циклы имеют правильный овуляторный характер, но бывают также циклы с НЛФ (у 16,7%), ановуляцией (у 16,6%), зачатиями и субклиническими выкидышами (у 10%). Именно субклинические аборты, вероятно, определяют появление у фертильных женщин ановуляторных циклов и циклов с НЛФ, следующих за нераспознанной прервавшейся беременностью [46]. Исследование содержания АМГФ в менструальной крови и определение гормонального статуса женщин, имевших в анамнезе перинатальные потери доношенных и недоношенных детей как следствие хронической гипоксии плода и врожденных пороков развития (n±190), показало, что средняя концентрация АМГФ у обследованных женщин в 3 раза ниже, чем в контрольной группе. Корреляционный анализ выявил прямую зависимость между количеством АМГФ в менструальной крови и уровнем прогестерона во вторую фазу цикла и ЛГ в периовуляторном периоде и обратную зависимость между концентрацией АМГФ и уровнем пролактина [48]. Таким образом, тест на содержание АМГФ в менструальной крови может быть широко использован в клинической практике для дифференциальной диагностики женского бесплодия: отсутствие белка свидетельствует об ановуляторном цикле, а резкое увеличение концентрации - о раннем субклиническом аборте [18, 46, 47]. Низкие по сравнению с нормой количества АМГФ указывают на гормональные нарушения (дефицит прогестерона и/или гиперпролактинемия) и являются основанием для углубленного клинического обследования женщин. М.Н. Болтовская, Г.Д. Попов, Е.А. Калинина, Т.А. Старостина
Литература 1. Grosser O. The development of the egg membranes and placenta: menstruation. In: Manual of Human Embryology. Eds. Keibel J., Mall P. Philadelphia 1910; 91-179.
|
Данная страница не существует!
Цикл общероссийских школ «Интенсив по эндокринной гинекологии: от основ к высотам мастерства», 2019 год, Москва
New! Школа юридической самообороны врача
Календарь мероприятий StatusPraesens на 2020 год
Научно-практическая школа «Трудный диагноз в педиатрии»
NEW! Интенсив «АNTI-AGEING: здоровье, эстетика, сексуальность. От системной терапии к эстетическому результату и активному долголетию», Москва
Календарь конференций и научно-практических школ StatusPraesens 2020 для неонатологов и педиатров
Цикл однодневных семинаров StatusPraesens в регионах России
Научно-практическая школа «Неонатология: инновации с позиций доказательной медицины»
Тренинги мануальных навыков в акушерстве (hands-on)
Научно-практическая школа «Бесплодный брак и ВРТ: амбулаторно-поликлиническая помощь», Москва
Календарь мероприятий StatusPraesens на 2019 год
Межрегиональные научно-практические конференции «Здоровье женщины — здоровье нации»
Календарь конференций и научно-практических школ StatusPraesens 2019 для неонатологов и педиатров
V Общероссийская конференция «Контраверсии неонатальной медицины и педиатрии раннего возраста», 8–11 сентября 2018 года, гранд-отель «Жемчужина», Сочи
Общероссийский информационно-образовательный проект «Актуальные вопросы онкологии: клинические и организационные аспекты»
XII Общероссийский научно-практический семинар «Репродуктивный потенциал России: версии и контраверсии», 7–10 сентября 2019 года, Зимний театр, гранд-отель «Жемчужина», Сочи
X Всероссийская научно-практическая конференция и выставка «Главврач XXI века», 8–9 сентября 2019 года, гранд-отель «Жемчужина», Сочи
III Общероссийский научно-практический семинар «Репродуктивный потенциал России: донские сезоны», 18–19 октября 2019 года, конгресс-отель Don-Plaza, Ростов-на-Дону
VI Общероссийская конференция «Инфекции и инфекционный контроль в акушерстве и гинекологии», 14–16 ноября 2019 года, гостиница «Рэдиссон Славянская», Москва
Общероссийская научно-практическая конференция для акушеров-гинекологов «Оттовские чтения», 26–27 ноября 2019 года, Санкт-Петербург
NEW! Журнал «StatusPraesens. Педиатрия и неонатология». Подписка и выпуски
Подписка на журнал «StatusPraesens. Гинекология, акушерство, бесплодный брак»
Выпуски журнала «StatusPraesens. Гинекология, акушерство, бесплодный брак»
Подарочные сертификаты на годовую подписку на журналы StatusPraesens
Акция «Счастливый подписчик»
Дайджест журнала StatusPraesens
Рекламодателям
Видеоприложения к статьям
Публикация авторских материалов
StatusPraesens — самый читаемый!
New! «Кольпоскопия. Атлас», Т.Н. Бебнева, С.И. Петренко, под ред. В.Е. Радзинского
New! «Анемии и репродуктивное здоровье», под ред. В.Е. Радзинского
«Бесплодие и эндометриоз. Версии и контраверсии», под ред. В.Е. Радзинского, М.Р. Оразова
«Кавитированные растворы в репродуктивной медицине», под ред. В.Е. Радзинского и Е.Ю. Глухова
«Акушерская агрессия v. 2.0», В.Е. Радзинский
«Беременность ранних сроков. От прегравидарной подготовки к здоровой гестации» под ред. В.Е. Радзинского и А.А. Оразмурадова
«Радиоволна и аргоновая плазма в практике акушера-гинеколога» под ред. В.Е. Радзинского и Е.Ю. Глухова
«Шейка матки, влагалище, вульва. Физиология, патология, кольпоскопия, эстетическая коррекция»
«Медицина молочной железы и гинекологические болезни» под ред. В.Е. Радзинского
Репродуктивный менеджмент. Тем, у кого уже есть дети: краткий курс для умных женщин
Я и мои будущие дети. Тем, у кого пока нет детей: руководство для умных женщин. Краткий курс
Пути преодоления привычного невынашивания. Саногенез эндометрия в профилактике рецидива выкидыша: возможности системной энзимотерапии
Информационное письмо МАРС по клиническим рекомендациям «Истмико-цервикальная недостаточность»
Для зачатия нужны двое... Что должен знать акушер-гинеколог о диагностике мужского бесплодия
О чём молчат женщины? Диспареуния и репродуктивное здоровье
Застёжка-молния для биотопа. Механизмы адгезии лактобацилл к эпителию влагалища
Всё включено. Нутрициология и репродуктивное здоровье
Новые реалии — новые возможности. Излечение рецидивирующего и хронического кандидозного вульвовагинита. Возможно ли это?
Правила протокола. Препараты прогестерона в клинических рекомендациях
Дисплазия шейки матки. Новые перспективы. Современные возможности коррекции цервикальных неопластических изменений
НМЦ: что мы под этим понимаем? Пролактиновый шторм. Систематизация нарушений менструального цикла
Минимально достаточный — максимально эффективный. Проблемы и перспективы онкогинекологического скрининга
В первой линии терапии? Назначение КОК женщинам репродуктивного возраста с эндометриозом
Стоп, предрак! Обзор российских клинических рекомендаций 2017 года «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака». Полная версия
Менопауза до менопаузы? Терапевтические и профилактические возможности микродозированных КОК для оздоровления женщин позднего репродуктивного возраста
Не дави на меня! Артериальная гипертензия у беременных: междисциплинарный подход к профилактике и лечению
На приёме подросток: жалобы, страхи, потребности. Особенности контрацепции в пубертатном возрасте
Иммунные контраверсии. Иммуномодуляторы в гинекологической практике: польза или необоснованные расходы?
Никаких контактов! Ведение беременных с бессимптомной бактериурией: эффективность растительных уроантисептиков
Основной инстинкт. Контрацептивный выбор молодых женщин: парадокс или эволюционная закономерность?
Особенным женщинам — особое внимание. Коррекция латентных форм дефицита железа и фолатов у пациенток с метаболическим синдромом при подготовке и во время беременности
Без иллюзий и предубеждения. Репродуктивное здоровье молодых женщин: проблемы, перспективы и пути решения
Пролонгированный приём КОК как новый инструмент работы акушера-гинеколога
Коррекция рациона беременных: доказательные данные
Комплаентность женщин как проблема системы родовспоможения
ВПЧ-инфекция: комбинированная терапия
Урогенитальные инфекции у беременных в вопросах и ответах
Железодефицит и головной мозг: о чём необходимо знать гинекологу?
Алгоритм выбора метода контрацепции
Хронический эндометрит и фертильность: новые ответы
Заменимы ли незаменимые жирные кислоты? Зачем необходимы полиненасыщенные жирные кислоты беременной, плоду и ребёнку
Эстрогендефицитные состояния у молодых женщин: что мы можем? Эстрогены в амбулаторном лечении женщин репродуктивного возраста
Фитоэстрогены и онкопрофилактика. Протективное действие изофлавонов на молочную железу
Неоплазии шейки матки: краткий курс для практикующего врача
Урогенитальные расстройства: актуальные подходы к диагностике и лечению
Прегравидарная подготовка: клинический протокол Междисциплинарной ассоциации специалистов репродуктивной медицины (МАРС)
Время понятной консультации
Доброкачественные дисплазии молочных желёз: патогенетический вектор лечения
Контрацепция в старшем репродуктивном возрасте
Время понятной контрацепции. Оптимизация врачебного выбора гормональной контрацепции как путь сохранения здоровья женщин на популяционном уровне
Хронический тазовый болевой синдром. От нового в понимании этиопа- тогенеза к новому в диагностике и терапии
Нарушения менструального цикла в молодом возрасте: новые цели — проверенные средства
ВПР выявлен. Что дальше? Подготовка к беременности женщин с врождённым пороком плода в анамнезе
Мочевая инфекция у беременных: насколько эффективна фитотерапия? Фитоуросептические средства при гестационном пиелонефрите и других мочевых инфекциях у беременных
Управление менструальным циклом: новые возможности. Инновации в контрацепции — гибкий пролонгированный режим и цифровые технологии дозирования
Железодефицитные состояния в акушерско-гинекологической практике
Смешанные вагинальные инфекции: новая идеология
Контрацепция и тромбозы. Пути снижения тромботического риска у женщин, применяющих КОК.
СПКЯ: от пересмотра представлений к новым терапевтическим стратегиям. Современные научные данные и клинические рекомендации МЗ РФ 2015 года
Генитоуринарный менопаузальный синдром. Новые возможности патогенетически оправданной местной терапии.
Женская мочевая инконтиненция. Нехирургическое лечение
Пост-релиз и материалы научной программы V Общероссийской конференции «Контраверсии неонатальной медицины и педиатрии раннего возраста» (Сочи, 8–11 сентября 2018 года)
Репродуктивный потенциал России: версии и контраверсии. Пост-релиз и материалы научной программы XI Общероссийского научно-практического семинара (Сочи, 8–11 cентября 2018 года)
Пост-релиз и материалы научной программы III Общероссийского семинара «Репродуктивный потенциал России: версии и контраверсии. Весенние чтения» (Москва, 29–31 марта 2018 года)
Пост-релиз и материалы научной программы Общероссийской конференции с международным участием Flores vitae. Неонатология и педиатрия раннего возраста.
Пост-релиз и материалы научной программы IV Общероссийской конференции с международным участием «Перинатальная медицина: от прегравидарной подготовки к здоровому материнству и детству» (Санкт-Петербург, 8–10 февраля 2018 года)
Пост-релиз и материалы научной программы X Общероссийского научно-практического семинара «Репродуктивный потенциал России: версии и контраверсии»(Сочи, 9–12 сентября 2017 года)
Пост-релиз и материалы научной программы II Общероссийского семинара «Репродуктивный потенциал России версии и контраверсии. Московские чтения» (Москва, 13–15 апреля 2017 года)
Пост-релиз и материалы научной программы III Общероссийской конференции «Перинатальная медицина: от прегравидарной подготовки к здоровому материнству и детству» (Санкт-Петербург, 9–11 февраля 2017 года)
Пост-релиз и материалы научной программы I Национального конгресса «Онкология репродуктивных органов: от профилактики и раннего выявления к эффективному лечению» (Москва, 19–21 мая 2016 года)
Пост-релиз и материалы научной программы IX Общероссийского научно-практического семинара «Репродуктивный потенциал России: версии и контраверсии». Часть II (Сочи, 10–13 сентября 2016 года)
Пост-релиз и материалы научной программы IX Общероссийского научно-практического семинара «Репродуктивный потенциал России: версии и контраверсии». Часть I (Сочи, 10–13 сентября 2016 года)
Пост-релиз и материалы научной программы IV Междисциплинарного форума «Медицина молочной железы» (Москва, 19–21 мая 2016 года)
Пост-релиз и материалы научной программы Общероссийского семинара «Репродуктивный потенциал России: версии и контраверсии. Московские чтения» (Москва, 14–16 апреля 2016 года)
Пост-релиз и материалы научной программы II Общероссийской конференции с международным участием «Перинатальная медицина: от прегравидарной подготовки к здоровому материнству и детству» (Санкт-Петербург, 18–20 февраля 2016 года)
Пост-релиз и материалы научной программы VIII Общероссийского научно-практического семинара «Репродуктивный потенциал России: версии и контраверсии» (Сочи, 5–8 сентября 2015 года)
Пост-релиз и материалы научной программы V Конгресса с международным участием «Ранние сроки беременности: от прегравидарной подготовки к здоровой гестации. Проблемы ВРТ», (Москва, 21–23 мая 2015 года)
Пост-релиз и материалы научной программы I Общероссийской конференции с международным участием (Санкт-Петербург, 9–11 декабря 2014 года)
Пост-релиз и материалы научной программы VII Общероссийского научно-практического семинара «Репродуктивный потенциал России: версии и контраверсии» (Сочи, 6–9 сентября 2014 года). Выпуск 1.
Пост-релиз и материалы научной программы III Междисциплинарного форума «Медицина молочной железы» (Москва, 23–24 мая 2014 года).
Пост-релиз и материалы научной программы II Междисциплинарного форума с международным участием «Шейка матки и вульвовагинальные болезни» (Москва, 27, 28 февраля — 1 марта 2014 года)
Пост-релиз и материалы научной программы VII Общероссийского научно-практического семинара «Репродуктивный потенциал России: версии и контраверсии» (Сочи, 6–9 сентября 2014 года). Выпуск 2.
Пост-релиз и материалы научной программы III конференции с международным участием «Инфекции и инфекционный контроль в акушерстве и гинекологии», Москва, ноябрь 2013 года
Пост-релиз и материалы научной программы VI Общероссийского научно-практического семинара "Репродуктивный потенциал России:версии и контраверсии", Сочи, 7-10 сентября 2013 года
Пост-релиз и материалы научной программы IV конгресса с международным участием "Ранние сроки беременности: проблемы, пути решения, перспективы"
Пост-релиз и материалы научной программы VI Общероссийского научно-практического семинара "Репродуктивный потенциал России:версии и контраверсии", Сочи, 7-10 сентября 2013 года: выпуск 2. Эндокринная гинекология.
Пост-релиз и материалы научной программы Общероссийского научно-образовательного семинара "Репродуктивный потенциал России: Уральские чтения. Контраверсии повседневной жизни"
Пост-релиз III Общероссийского семинара «Репродуктивный потенциал России: здоровье женщины — здоровье нации. Казанские чтения», 27 февраля – 1 марта, Korston Hotel&Moll, г. Казань
Приказ Министерства здравоохранения и социального развития Российской Федерации (Минздравсоцразвития России) от 12 февраля 2007 г. N 110 г. Москва
Пост-релиз Международного междисциплинарного форума "Шейка матки и вульвовагинальные болезни"
Пост-релиз V Общероссийского семинара "Репродуктивный потенциал России: версии и контраверсии", сентябрь 2012, Сочи
Пост-релиз научно-образовательной конференции "Преподавание акушерства и гинекологии", 3 апреля 2012 г., Новосибирск
Пост-релиз конференции "Инфекции и инфекционный контроль в акушерстве и гинекологии" Москва, май 2012 г.
Пост-релиз II Междисциплинарного форума «Медицина молочной железы: на стыке специальностей», 24–25 февраля 2012 года, Москва
Пост-релиз «Контрацепция и здоровье: звенья одной цепи»
Пост-релиз II Общероссийского семинара "Репродуктивный потенциал России: казанские чтения"
Пост-релиз IV Общероссийского семинара "Репродуктивный потенциал России: версии и контраверсии", 3-6 сентября 2011, Сочи
Проект протокола "Коррекция нарушений биоценоза влагалища"
Клинические протоколы
Интерактивная обучающая медиасистема «Аускультация сердца и легких»
Информационно-образовательный проект №1
Информационно-образовательный проект №1 «НЕОНАТОЛОГИЯ И ПЕДИАТРИЯ РАННЕГО ВОЗРАСТА»
Кодекс врача, назначающего антибиотик
Правила маммологического скрининга
«Правила интимной гигиены», информационно-обучающий анимационный видеоролик
Шкала факторов перинатального риска
Кулинарная книга ко Дню медработника 2015
Включение медикаментозного аборта в программу ОМС: результаты МАРС, 2018
Гликотимолин – лекарство от экземы и псориаза
Гликотимолин – современный французский препарат в виде раствора, который помогает нормализовать кишечный кислотно-щелочной баланс, что особенно полезно для больных псориазом. Данное средство появилось на отечественном рынке сравнительно недавно, но отзывы о нем преимущественно положительные.
Когда следует принимать его
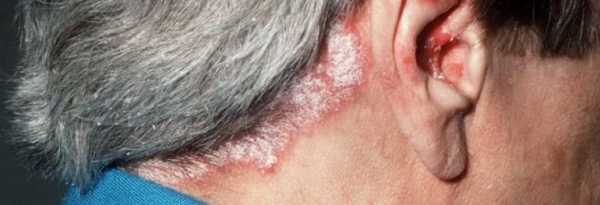
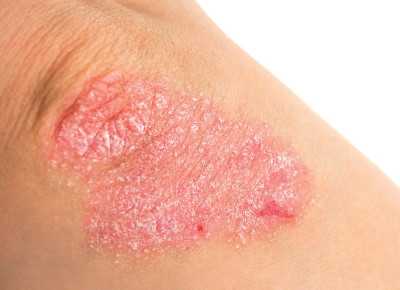
Псориаз – достаточно распространенное и опасное кожное заболевание, которое, к тому же, очень плохо поддается лечению.
Больные этим недугом страдают не только от внутренних, но и внешних проявлений. Если с высыпаниями на коже все понятно, то разрушительное воздействие заболевания на ткани человеческого организма известно далеко не всем.
Псориаз провоцирует постепенное изменение кислотно-щелочного баланса в тканях. Это непосредственным образом влияет на течение заболевания, а также на тяжесть проявления его симптомов. Вследствие этого в организме накапливаются токсины, развивается токсемия. Ее длительное воздействие приводит к тяжелым последствиям.
Важно понимать, что отравление токсинами для больных псориазом недопустимо, поскольку это провоцирует дальнейшее прогрессирование недуга и ухудшает состояние здоровья. Поэтому с данным явлением нужно обязательно бороться. Необходимо поддерживать кислотно-щелочной баланс на должном уровне, придерживаясь диеты и назначенного лечения.
Именно здесь и требуется данный препарат. И вот почему.
Действие раствора
Гликотимолин представляет собой щелочной кишечный антисептик. Благодаря своему уникальному составу, он эффективно поддерживает необходимый кислотный уровень, попутно очищая желудочно-кишечный тракт от накопившихся в нем токсинов. Вследствие этого существенно уменьшается токсемия, что приводит к улучшению состояния больного. Лечить псориаз становится намного проще.
Состав препарата:
- эссенция сосны;
- эссенция березы;
- эвкалиптол;
- натрий салицилат;
- натрий бензоат;
- натрий бикарбонат;
- глицерин;
- натрий борат;
- тимол;
- ментол.

Лечение псориаза и последствий токсемии – не единственное предназначение этого средства. Оно также эффективно при ангине, насморке, фарингите, легких ожогах. Препарат активно используется в гинекологии, дерматологии и проктологии. Он может применяться как местное средство, так и в качестве раствора для приема внутрь.
Свойства
Прием средства внутрь актуально для больных псориазом, экземой, в том числе и мокнущей, а также псориатическим артритом. Активные вещества препарата очищают желудочно-кишечный тракт пациента от токсинов и стабилизируют кислотно-щелочной баланс.
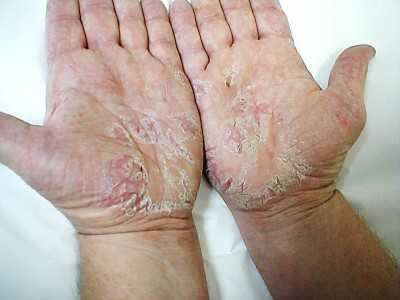
Препарат можно использовать и наружным способом. Нанесение на пораженные недугом участки кожного покрова приводит к тому, что степень выраженности зуда существенно снижается. Для больных псориазом это очень важно, так как желание чесаться иногда становится нестерпимым, а делать это категорически запрещается.
Как правильно применять
Что это такое – препарат Гликотимолин? В случае с псориазом, его принимают вовнутрь. Для этого 3-5 капель средства необходимо развести в стакане холодной воды. Пить этот раствор рекомендуется на протяжении пяти дней, непосредственно перед сном. Каждый курс лечения должен чередоваться с перерывами, примерно по одной или две недели.
Пить раствор нужно залпом. Вкус достаточно специфический, даже если учесть незначительную концентрацию в стакане воды. Тем не менее, никаких существенных неприятных ощущений данный процесс не вызывает. Лечение актуально для взрослых. Перед применением средства в обязательном порядке необходимо проконсультироваться с лечащим врачом. Принимать средство необходимо регулярно – только тогда можно будет рассчитывать на получение оптимального результата.
Категорически запрещено прибегать к самолечению, тем более такого опасного недуга, как псориаз, и вызываемого им токсического отравления тканей организма. На данный момент препарат продается без рецепта. Однако это не значит, что можно игнорировать необходимость получения предварительного разрешения от врача. Только тогда вы сможете избежать любых неприятностей, что может быть очень опасно для больных псориазом.
инструкция по применению, аналоги, состав, показания
Фармакодинамика
Холина альфосцерат представляет собой транспортную форму холина и предшественник фосфатидилхолина, который потенциально способен предотвращать повреждение мембран, как один из факторов патогенеза психоорганического инволюционного синдрома, характеризующегося уменьшением холинергической синаптической трансмиссии и повреждением фосфолипидного состава мембран нейронов.
Химическая структура холина альфосцерата (содержащего 40,5% холина) и связанные с ней физико-химические свойства молекулы обеспечивают проникновение части холина через гематоэнцефалический барьер. Результаты доклинических и клинических исследований подтверждают способность холина альфосцерата оказывать влияние преимущественно на когнитивно-мнестические функции, а также на эмоциональную и поведенческую активность, нарушенные при инволюционной патологии головного мозга.
Фармакокинетика
Фармакокинетические характеристики радиоактивно меченого препарата при его введении были сходны у разных видов животных (крысы, собаки, обезьяны) и дали следующие результаты: быстрое и полное всасывание в желудочно-кишечном тракте, распределение холина и его метаболитов в различных органах и тканях, включая головной мозг, почечная экскреция составила около 10% введенной дозы через 96 часов; содержание препарата в тканях головного мозга выше по сравнению с холином, меченым тритием.
Психоорганический синдром вследствие инволюционных и дегенеративных процессов в головном мозге, последствия цереброваскулярной недостаточности, такие как, первичные и вторичные когнитивные нарушения у лиц пожилого возраста, характеризующиеся нарушением памяти, спутанностью сознания, дезориентацией, снижением мотивации, инициативности, способности к концентрации внимания.
Нарушения поведения и аффективной сферы в старческом возрасте: эмоциональная лабильность, повышенная раздражительность, снижение интереса.
Произведено:
“Италфармако С.п.А.”, Италия / “Italfarmaco S.p.A”, Italy,
Виале Фульвио Тести, 330 - 20126 Милан (MI) - Италия
Viale Fulvio Testi, 330 - 20126 Milan (MI) - Italy
Организация, представляющая интересы производителя на территории РБ:
220131, г. Минск, ул. Гало, 148/3
ОДО «Везуна», тел. +3475 17 280 25 83
Что такое гликация, ее влияние на кожу, и методы борьбы
Многие хотят знать ответ на вопрос от чего же зависит процесс старения в организме человека. Существует ли уловка, с помощью которой можно прекратить этот процесс? Какое отношение к старению имеет гликация? Ответы на эти вопросы интересны каждому.

Гликация или гликолизация что это такое?
Организм человека стареет далеко не по одной причине — это могут быть как внутренние, так и внешние проявления. К ним относятся: генетика, существенные изменения гормонального баланса, старение из-за отрицательного влияния солнца, неправильное питание, токсическое влияние (табака, наркотиков, алкогольных напитков). Но одной из основных причин старения организма является гликация т.е. процесс выработки сахара.

Сладости, газированные напитки, мучные продукты, избыток белков и жиров в организме — все это в конечном итоге метаболизируют в глюкозу в крови т.е. в сахар.
Гликация — это химический процесс при котором происходит взаимодействие белков и сахара, в результате чего появляются гликолизированные продукты.
Гликация, гликолизация, гликирование — это реакция между углеводами ( фруктозой, глюкозой ) и свободными аминогруппами белков, нуклеиновых кислот, липидов, которая происходит без участия ферментов. Неферментированный процесс гликолизации белков является одним из ключевых процессов в живом организме, который приводит к повреждению тканей. В результате данного процесса возникают так называемые гликолизированные продукты, которые носят название продвинутые или конечные продукты гликации — AGE продукты. Они и являются главной причиной старения кожи т.к. имеют свойственную черту накапливаться в организме и нести разрушающую силу на весь организм.
AGE продукты(Advanced Glycation Endproducts) или конечные продукты гликирования подвергают ткани более быстрому разрушению за счет склеивания с эластином и коллагеном, которые можно наблюдать в виде тонких морщин в верхнем слое дермы.
AGE продукты делают наши сосуды не эластичными, вызывают воспаление, ускоряют процессы старения, вызывают дряблость кожи, приводит к гипертрофии внеклеточного матрикса и гладких сосудистых мышц, ухудшают циркуляцию.
Влияние гликации на кожу
Гликация – это тяжелый невозвратимый процесс, он приводит к твердому состоянию соединительную ткань, вследствие чего нити коллагена становятся плотнее, морщины приобретают более четкие черты, слой, находящийся под кожей, теряет влагу. Вместе с тем из-за процесса гликации появляются продукты с повышенным гликолизированием.
Продукты гликолизирования постоянно накапливаются в тканях организма. Поначалу они нарушают процесс обмена веществ, вследствие чего организм голодает из-за отсутствия кислорода. Это приводит к разрушениям клеток и полного отравления организма. Разрушение белковых волокон, не единственное отрицательное последствие гликации. Продукты гликации разрушают прозрачный вид самого верхнего слоя кожи, вследствие чего у него появляется темно-желтый цвет.
Анализ показывает, что есть полное соответствие между количеством продуктов гликолизирования в организме и возрастом человека. Если сравнить человека с возрастом 20 и 80 лет, то у второго человека содержание продуктов гликолизирования будет больше в 7 раз.

К проблемам в результате которых возникают продукты гликации, можно отнести слабый иммунитет, диабет, проблемы, связанные с сердечно-сосудистой системой, проблемы с почками, болезнь Альцгеймера, плохое зрение. Гликация проявляет себя как замедление восстановительных процессов в организме, разрушение белковых волокон.
Фруктоза и глюкоза ускоряют старение организма и приводят к образованию гликолизированых продуктов. Фруктоза помогает накоплению жира вокруг внутренних органов, повышает уровень инсулина в крови, понижает чувствительность к гормонам, и как итог — преждевременное старение, риск появления заболеваний, связанных с сердечной функцией.
Гликация — приостановить нельзя, замедлить – можно!
Даже с настолько развитыми технологиями как сейчас остановить процесс гликации нельзя, но можно сократить количество выработки гликолизированых продуктов. То есть замедлить процесс старения можно, перейдя на правильное питание, начать вести здоровый образ жизни, побольше активности, употреблять витамины группы В, в частности, В1.

Теория Майлорда подвела базу под всем известным правилом “поменьше сладкого”.
Как бороться с гликацией?
Простые углеводы приходят с пищей, которая поступает в организм. Они же и являются возбудителем гликации, а значит и источником гликолизированых продуктов.
Занятно, что заранее сформированные гликолизированые продукты производятся после экзогенного синтеза при приготовлении пищи. Пища значительно повышает количество гликолизированых продуктов, если ее готовить таким образом:
- Жарить на сковородке
- Жарить на гриле
- Жарка с большим количеством масла
Более безопасный способ приготовления – варка!
Самый лучший способ замедления процесса гликации – есть меньше сахара и пищи содержащей жиры.
Анализы показывают, есть специи, помогающие замедлять процесс гликации. К ним относятся:
- Корица

- Чеснок
- Орегано
- Гвоздика
- Карнитин
- Цинк
- Магний
- Таурин
- Карнозин
- Катехины зеленого чая
- Антиоксиданты
- Рибофлавин
- Ниациномид
- Бенфотиамин
Также помогут приостановить процесс гликации:
- Антиоксиданты. Они содержатся в достаточном количестве в белом и зеленом чае.
- Овощи красного цвета (болгарский перец, томат).
- Куркума.
- Мелиса, розмарин, душица.
Внешний уход за кожей
Зеленая маска;
- Необходимо смешать огурцы, базилик и добавить немного мелисы. Эта маска доступна каждому и отлично справляется с задачей увлажнения кожи. Содержание базилика будет замедлять гликацию.
Тоник:
- Пара столовых ложек базилика хорошо порезать до состояния каши. Полученное заливают кипятком и оставляют на пол часа. Перед нанесением процедить.
Этот тоник хорошо увлажняет и освежает кожу, активируется обмен веществ в клетках кожи, а также хорошо справляется с покраснениями.
Маска с листьями базилика:
- Кожа после использования этой маски витаминизируется и придет в тонус. Нужно измельчить листья базилика до состояния каши и залить пару ложками чистой воды.
Пользуясь салфеткой, нанести маску на лицо. Держать 15-20 минут и смыть теплой водой.
Вывод
Старение неизбежный процесс, и одно из ее проявлений это гликация, но проводить борьбу с ней необходим. Для этого нужно есть как можно меньше сладкого и жареного.
Поделиться новостью в соцсетях
« Предыдущая запись Следующая запись »
полезные свойства и обзор средств с гликолевой кислотой
Выберите тип кожи- Сухая
- Жирная
- Нормальная
- Комбинированная
- Показать все
- Сухая
- Жирная
- Нормальная
- Комбинированная
- Показать все
- Подберите уход
- наши эксперты
- Действуйте
- Диагностика кожи
- Конкурсы
- Те
что это такое, где содержится, полезные свойства

В чесноке содержится большое количество полезных компонентов, которые делают его незаменимым продуктом в лечении некоторых заболеваний. Одним из них является аллицин – соединение, образующееся при механическом повреждении луковиц растения.
Что такое аллицин?
Это органическое соединение, которое изначально не присутствует в чесноке. Оно образуется, когда дольки растения подвергаются механическому разрушению (их разрезают, давят, измельчают другим способом).
Вещество представляет собой жидкость без цвета, маслянистой структуры. Именно оно придает продукту тот самый резкий запах и специфический острый вкус. Компонент растворяется в воде, разлагается щелочами. При комнатной температуре он разрушается очень медленно, но при термической обработке – практически мгновенно.
В каких растениях содержится

Основной продукт, в котором образуется действующий компонент – это чеснок. Однако он содержится и в головках лука. При этом его активность будет намного ниже.
В чесноке изначально присутствуют два вещества – аллиин и фермент аллициназа. В тот момент, когда дольки растения подвергают механическому разрушению, эти соединения начинают взаимодействовать друг с другом. В результате этого процесса и образуется аллицин.
Попадая в человеческий организм, вещество вступает в реакцию с эритроцитами. Благодаря этому взаимодействию формируется сероводород, который, в свою очередь, снимает напряжение со стенок сосудов. Это способствует облегчению состояния при скачках давления, улучшает работу сердца, а также головного мозга. Положительный эффект связан и с повышением защитных сил организма.
Полезные свойства
Активное вещество, входящее в состав чеснока, оказывает противовоспалительный, антибактериальный эффект. Оно демонстрирует положительные результаты против разных типов бактерий, вирусов, а также прочих патогенных микроорганизмов. Средство обеззараживает, повышает защитные силы организма. Во многом именно благодаря аллицину чеснок помогает укрепить иммунитет и быстрее вылечить многие простудные заболевания.
Однако помощь в борьбе с простудными болезнями – не единственное положительное свойство органического соединения. Оно приносит следующий эффект:
- снижает уровень «вредного» холестерина. За счет чего уменьшает вероятность появления бляшек в сосудах, риск развития атеросклероза и прочих опасных сердечно-сосудистых заболеваний;
- стабилизируются показатели давления. Снижается его уровень, поэтому средство эффективно для профилактики болезней, связанных с превышением кровяного давления. Для этого необходимо регулярно принимать повышенные дозы активного компонента;
- уменьшается вероятность развития злокачественных новообразований. Действующий компонент является мощным антиоксидантом и препятствует высвобождению свободных радикалов. Снижается риск раковых заболеваний, а при уже существующей болезни замедляется размножение патогенных клеток. К тому же, антиоксидантный эффект позволяет замедлить процессы старения, происходящие в организме.
Средство эффективно для представителей обоих полов. При его употреблении улучшается половая функция у мужчин. Кроме того, биодобавка может использоваться, как средство для профилактики сердечно-сосудистых заболеваний.
Женщины могут принимать БАД в период климакса. Препарат способствует увеличению количества эстрогена и предотвращает развитие остеопороза. Также он уменьшает уровень тестостерона, при котором развивается женское бесплодие.
Allimax, Капсулы с порошком 100%-ного аллицина, 180 мг



Смотреть цену на iHerb
Специалисты компании стабилизировали экстракт вещества, чтобы получить его в максимальной концентрации. Процесс производства 100%-ного соединения запатентован и позволяет сохранить все полезные свойства продукта. В 1 порции препарата содержится 180 мг чистого экстракта, а капсула состоит из воды и гипромеллозы.
Вегетарианское средство не содержит продуктов животного происхождения, потенциальных аллергенов.
Суточная доза – 1 капсула. Другой график приема может назначить только лечащий врач. При использовании иных медикаментов или наличии заболеваний следует предварительно проконсультироваться со специалистом.
Показания к применению
Средство показано к использованию при лечении большого количества заболеваний, а также для профилактики патологий:
- образование холестериновых бляшек, повышенный риск их появления;
- нарушения липидного обмена;
- избыточный вес, при котором наблюдаются проблемы с сердечно-сосудистой сферой;
- снижение иммунитета, частые простудные заболевания. Добавку можно использовать в качестве средства профилактики в период обострения ОРВИ и гриппа;
- нарушения половой функции у мужчин. БАД положительно влияет на состояние сосудов, в том числе в половых органах;
- повышенный риск развития заболеваний сердечно-сосудистой системы;
- сахарный диабет, а также его профилактика (помогает стабилизировать уровень сахара).
Влияние на уровень тестостерона
Изначально считалось, что чеснок необходим для поддержания мужского здоровья, поскольку способствует повышению уровня тестостерона. Но более поздние исследования доказали обратное. Действующее вещество, которое содержится в растении, способствует снижению уровня этого важного гормона.
Именно поэтому биодобавки, в состав которых входит аллицин, рекомендуют принимать женщинам с повышенными показателями тестостерона. Превышение гормона провоцирует бесплодие, проблемы с менструальным циклом и репродуктивной системой. Кроме того, высокий уровень тестостерона вызывает чрезмерный рост волос на теле и лице и прочие неприятные косметические дефекты.
Ученые доказали, что чеснок может повышать показатели гормона (что важно для мужчин), но только в виде сухого порошка. Это связано с тем, что свежий и высушенный продукт содержат разные действующие соединения, поэтому и оказывают разное влияние на организм человека.
Allimax, Аллицин AlliUltra в капсулах



Смотреть цену на iHerb
Еще один препарат компании содержит стабилизированный экстракт соединения, выпускающийся в соответствии с запатентованным процессом. В одной капсуле содержится 360 мг чистого вещества. Капсульная оболочка производится только из растительных компонентов, поэтому продукцию могут принимать вегетарианцы.
Производитель рекомендует принимать по 1 капсуле в день, если иной график приема не предложил лечащий врач.
Средство не предназначено для употребления маленькими детьми, поэтому его нужно держать в месте, где они не смогут до него добраться.
Как принимать?
Перед началом приема следует изучить инструкцию, которую все производители прилагают к конкретному средству. Специалисты говорят о том, что ежедневно человек без опасений может получать 400 – 600 мг действующего компонента. Этого количества достаточно для общего улучшения самочувствия, стабилизации показателей холестерина. Лучше всего разбить суточную дозу на 2 – 3 приема.
Биодобавки на основе чеснока можно принимать на регулярной основе. Это натуральные препараты, которые не наносят вреда организму при отсутствии противопоказаний. Но тем пациентам, которые используют БАД для нормализации давления или уровня холестерина, врачи рекомендуют отслеживать состояние. Если после нескольких месяцев приема ситуация не улучшается, следует провести дополнительное обследование.
Jarrow Formulas, Чеснок и Имбирь, 700 мг



Смотреть цену на iHerb
Производитель разработал БАД, в котором сочетаются полезные свойства чеснока и имбиря. В состав порции входит 500 мг чеснока и 200 мг чистого концентрата корня имбиря. Продукцию получают методом естественного высушивания. Растения не подвергаются термической обработке, благодаря чему сохраняют все полезные компоненты.
Необходимо принимать по 1 – 2 капсулы один или два раза в сутки вместе с едой. Производитель рекомендует получить предварительную врачебную консультацию женщинам в положении, в период грудного вскармливания, несовершеннолетним и лицам, страдающим от некоторых заболеваний.
Побочный эффект от приема

В большинстве случаев добавка не вызывает побочных эффектов, поскольку безопасна в использовании. Это натуральный продукт, однако в редких ситуациях может спровоцировать аллергические реакции. Это может произойти, если человек значительно превысит рекомендованную дозировку. Кроме того, высокие дозы БАД могут разжижать кровь, поэтому следует быть осторожнее с его применением.
Противопоказания
Главное противопоказание к использованию средства – это индивидуальная непереносимость действующего вещества. Оно может спровоцировать аллергическую реакцию. Кроме того, есть некоторые ограничения к его применению в следующих случаях:
- проблемы со свертываемостью крови. Соединение увеличивает вероятность развития кровотечений, поскольку разжижает кровь. Особенно опасно употреблять его одновременно с антикоагулянтами и прочими медикаментами аналогичного действия. Нельзя принимать биодобавку перед запланированным хирургическим вмешательством;
- при язве желудка и 12-перстной кишки следует быть осторожнее, особенно в стадии обострения. Чеснок может спровоцировать ухудшение состояния;
- в период вынашивания ребенка и лактации следует отказаться от применения препарата или заранее проконсультироваться с лечащим врачом.
Аллицин – органическое соединение, которое производители научились выделять из чеснока. Вещество оказывает мощное противовоспалительное и антибактериальное действие и помогает в лечении многих заболеваний.
Подписывайтесь на наш канал YouTube!
Распаковки посылок, обзоры товаров iHerb, скидки и личный опыт!