Химозин что это такое вред и польза
что это такое и чем заменить в домашних условиях — вреден ли химозин как молокосвертывающий фермент животного происхождения — список сыра без сычуга
Сычужный фермент: что это такое и чем заменить в домашних условиях — вреден ли химозин как молокосвертывающий фермент животного происхождения — список сыра без сычуга- Статьи
- Сычужный фермент: что это такое и чем можно замени…
×
Одноклассники:Я уже подписан на сообщество «Молоко в Черноземье»
×
Вступай в сообщество «Молоко в Черноземье»!
| ВКонтакте: | |
| Facebook: | |
| Одноклассники: |
Я уже подписан на сообщество «Молоко в Черноземье»
Мы используем cookie-файлы для наилучшего представления нашего сайта. Продолжая использовать этот сайт, вы соглашаетесь с политикой конфиденциальности.
Политика конфиденциальности
Пепсин и химозин, Пепсин
С давних времен для производства сыра традиционно используется сычужный фермент (СФ) из слизистой оболочки четвертого отдела (сычуга) желудка теленка . В состав СФ входят два основных молокосвертывающих фермента – химозин и пепсин.
Относительное содержание этих ферментов в желудочном соке варьирует в широкой степени, в зависимости от возраста животного и кормового рациона. СФ телят-молокопоек (легких телят) содержит 80- 95% химозина, тогда как аналогичные препараты, выделенные из сычугов телят, получавших грубые корма (тяжелых телят), содержат от 70 до 100% пепсина [6]. Важно отметить, что препараты натурального СФ всегда содержат примесь пепсина, который начинает синтезироваться в сычуге теленка в пренатальном периоде [4].
Пепсин, и химозин обладают специфической и неспецифической протеолитической активностью (ПА) [2, 5, 6]. Специфическая ПА или молокосвертывающая активность – это способность пепсина и химозина гидролизовать ключевую пептидную связь 105 (Phe) – 106 (Met) в молекуле каппа-казеина. Гидролиз этой связи приводит к дестабилизации мицелл казеина и запускает процесс образования молочного сгустка. При неспецифичном протеолизе происходит гидролиз не только связи 105 (Phe) – 106 (Met) в молекуле каппа- казеина, но и других пептидных связей в альфа-, бэтта- и каппа- казеинах. Неспецифическая протеолитическая активность пепсина в диаппазоне рН от 2 до 6 намного выше, чем у химозина [5], что сказывается на выходе и качестве сыров. Химозин синтезируется для обеспечения свертывания молока и поэтому гидролизует, в основном, ключевую пептидную связь. Напротив, пепсин, синтезируемый с целью обеспечить распад белков, атакует большое количество пептидных связей, как в казеине, так и в белках, поступающих с твердыми кормами. Химозин расщепляет казеин с образованием крупных фрагментов, которые впоследствии становятся субстратами для протеаз молочнокислых бактерий [2, 4]. Пепсин, обладающий гораздо более высокой протеолитической активностью, гидролизует белки с образованием коротких пептидов, которые могут вызвать появление горечи в сыре [2, 4].
Сегодня сыродельным предприятиям предлагается большой ассортимент молокосвертывающих ферментов как отечественного, так и зарубежного производства. Основные из них, это отечественные препараты, разработанные ВНИИ маслодельной и сыродельной промышленности, а также рядом вновь созданных производителей. Из импортных ферментов рынок представлен, в основном, препаратами производства фирмы Hr. Hansen (Дания), препаратами голландской фирмы «DSM-Food Specialties» (DSM-FS), Caglificio Clerici SPA (Италия) и др.
В связи с дефицитом натурального сычужного порошка в сыроделии начали широко применять другие препараты, которые можно разделить на две группы: пепсины – желудочные протеазы жвачных и некоторых других животных – и кислые протеазы микробиального происхождения. Из первой группы наибольшее распространение получили говяжий и свиной пепсины. Пепсины чаще всего используют в виде смесей с сычужным порошком [1].
Широкий ассортимент молокосвертывающих препаратов, отсутствие объективной информации об их составе и свойствах порой ставит в тупик мастеров сыродельных предприятий и они, зачастую, делают выбор препарата, руководствуясь только его ценой, а не качеством. При этом мало кто подбирает ферментный препарат с учетом ассортимента вырабатываемых сыров. Для сыродельной промышленности специализированные предприятия поставляют молокосвертывающие ферментные препараты с установленным соотношением химозина и пепсина [4]. Целью проведенной работы являлось определение соответствия заявленным производителями критериям, а именно: молокосвертывающей активности и соотношения двух основных ферментных компонентов: говяжьего пепсина и химозина. Были исследованы молокосвертывающие ферментные препараты, пользующиеся наибольшим спросом на сыродельных предприятиях Алтайского края, а именно: пепсин пищевой говяжий по ОСТ 10-023- 94, дата выработки 24.03.05 года, сычужный фермент (СФ) и сычужно- говяжий фермент (ВНИИМС СГ-50) по ОСТ 10-288-2001, дата выработки 29.03.06 ; а также молокосвертывающие сычужные препараты Clerici 96/4 (дата выработки 05/2006 года, номер партии 604 141 174), Clerici 70/30 (дата выработки 06/2005 года, номер партии 506 164 550), Clerici 50/50 (дата выработки 05/2006 года, номер партии 605 084 530) производства фирмы «Caglificio Clerici SPA», Италия. Для определения соотношения говяжьего пепсина и химозина при исследовании молокосвертывающих ферментных препаратов использовался метод определения доли активности говяжьего пепсина от общей молокосвертывающей активности препарата по ОСТ 10 288- 2001 [7].
Для определения молокосвертывающей активности 5 мл субстрата наливали в тонкостенные стеклянные пробирки, подогревали на водяной бане при 35 0С и выдерживали в течение трех минут, затем добавляли 0,1 мл исследуемого ферментного препарата, немедленно включали секундомер, а содержимое пробирки сразу же перемешивали. Начало реакции коагуляции определяли по образованию хлопьев в капле молока, наносимой на стенки пробирки стеклянной палочкой. После определения начала свертывания, секундомер сразу же выключали. Молокосвертывающая активность (МА) рассчитывалась по формуле: МА = А*Т1/Т2, где: А – аттестованная активность ОКО СФ; Т1 – время свертывания с ОКО СФ; Т2 — время свертывания с исследуемым образцом. При подготовке молокосвертывающих препаратов 1 г исследуемого образца ферментного препарата растворяли в 80,0 см3 дистиллированной воды с температурой 35 0С, перемешивали в течение 30 мин, доводили общий объем до 100,0 см3 и настаивали в водяной бане при температуре 35 0С в течение 15 мин. Подготовку отраслевого контрольного образца (ОКО) говяжьего пепсина проводили аналогичным образом. В качестве субстрата при определении доли активности говяжьего пепсина и молокосвертывающей активности служило сборное молоко. Приготовление субстрата проводили следующим образом: сырое сборное непастеризованное молоко нагревали на водяной бане до температуры 72 0С, инкубировали при этой температуре в течение 10 минут и быстро охлаждали под проточной водопроводной водой до 20-25 0С. В охлажденное молоко вносили хлористый кальций до конечной концентрации 30 мМ. При необходимости активную кислотность молока доводили до 6,5 ед. рН раствором 1,0 М НСl. Подготовленное таким образом молоко использовали для дальнейших исследований. Результаты проведенной работы представлены в таблице 1.
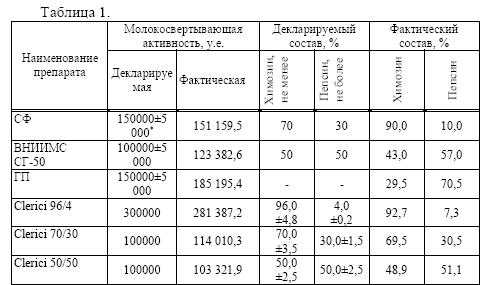
* — согласно ОСТ 10 288 [п.8.2.2.6, с.19] ошибка используемого метода составляет 5000 усл.ед. от общей молокосвертывающей активности препарата
При оценке пригодности молокосвертывающих препаратов для производства сыра необходимо учитывать молокосвертывающую активность. Оптимальная молокосвертывающая активность – одна из основных характеристик, влияющих на качество сгустка при выработке сыра. Как видно из таблицы 1 молокосвертывающая активность ВНИИМС СГ-50, ГП и Clerici 70/30 несколько выше декларируемой. Наличие данной информации на предприятиях сыродельной промышленности могут способствовать более оптимальному расходу препаратов.
Действие сычужного фермента в процессе коагуляции молока определяется прежде всего действием химозина и в меньшей степени – пепсина. Увеличение в СФ относительного содержания пепсина, приводит к образованию более рыхлого сгустка при свертывании молока, что сопровождается снижением выхода сыра за счет потерь белка и жира с сывороткой. Как видно из таблицы 1, в СФ содержится незначительное количество пепсина. При использовании СФ, содержащего преимущественно химозин, получают сыры наилучшего качества, с максимальным выходом продукции [1].
Классический сычужный фермент нашел широкое применение в сыродельной промышленности. Сведения об использовании пепсина в сыроделии и главным образом для выработки отдельных видов сыров различны. Особенно успешными были опыты по производству сыров с использованием смеси 50% химозина и 50% пепсина. Применение этой смеси позволяет получить результаты, намного лучшие, чем при использовании чистого пепсина [4]. Из приведенных в таблице 1 данных видно, что в препаратах ВНИИМС СГ-50 и Clerici 50/50 относительное содержание пепсина несколько выше декларируемого.
В молокосвертывающем ферментном препарате и Clerici 70/3 соотношение химозина и говяжьего пепсина соответствует декларируемому. В препарате Clerici 96/4 относительное содержание пепсина несколько выше декларируемого. Более высокая доля молокосвертывающей активности говяжьего пепсина от общей молокосвертывающей активности препарата может быть обусловлена рядом факторов. Одним из них может быть нарушение условий хранения. Производитель «Caglificio Clerici SPA» (Италия) гарантирует потерю активности не более 4% в течение двух лет хранения в прохладном месте при температуре от 4 до 8 0С.
Молокосвертывающие ферментные препараты необходимо хранить в упакованном виде в сухом защищенном от света помещении, при температуре не выше 10 0С и относительной влажности воздуха не более 75% [ОСТ 10 288, п.9.2.1, с.44]. Данные температурные режимы могли быть нарушены при транспортировке либо хранении товара на складе. Вторым фактором может являться ошибка используемого метода, при которой границы допускаемого значения абсолютной погрешности измерений составляют 5% по доле активности говяжьего пепсина от общей молокосвертывающей активности препарата [ОСТ 10 288, п.8.3.5, с.26].
Таким образом, сыродельным предприятиям, останавливая свой выбор на том или ином препарате, необходимо учитывать его особенности и контролировать, в первую очередь, выход сыра и его качество.
Источник: edu.secna.ru
Вам так же может быть интересно:
Реннин — Википедия
Эта статья — о желудочном ферменте. О ферменте, вырабатываемом в почках, см. Ренин.Реннин (химозин) — фермент из класса гидролаз, который вырабатывается в желудочных железах некоторых млекопитающих. У жвачных животных вырабатывается железами сычуга (4-го отдела желудка), отсюда одно из его тривиальных названий — сычужный фермент. Это первый фермент, выделенный химически: датский учёный Кристиан Хансен (дат. Christian Ditlev Ammentorp Hansen) выделил его путём экстракции солевым раствором из высушенного желудка телёнка[1] (золотая медаль в 1874 году[2]).
В сыре присутствует комплексный набор ферментов, где основным ферментом является реннин (химозин). Кроме реннина сыр содержит другие важные ферменты, например пепсин, липазу.
Молекула реннина состоит из полипептидной цепи с преобладанием кислых аминокислотных остатков.
Вырабатывается главными клетками желудка в форме неактивного профермента прореннина (прохимозина). Активируется катионами водорода (соляной кислотой желудочного сока) в присутствии ионов кальция при pH менее 5 с отщеплением 42-членного пептида. В кислой среде относительно стабилен, при pH более 7 теряет активность. Оптимальная кислотность среды для природного реннина — 3—4, для синтетического — 4—5.
Первоначальный субстрат реннина — белок молока казеиноген, который под действием фермента гидролизуется и расщепляется до нерастворимого белка казеина. В результате основной белок молока остаётся в желудке длительное время и медленно расщепляется пепсином.
Сычужный фермент также может использоваться для разделения молока на твердые калье и жидкую сыворотку.
Молекулярная масса бычьего реннина — около 34 kДа
Ингибируется пепстатином, продуцируемым стрептомицетами.
Вытяжка из сычугов — традиционный продукт для створаживания молока, наиболее употребимый в сыроделании.
Кристиан Хансен, первым выделивший реннин, в 1874 году основал фирму Chr-Hansen по производству реннина; в настоящее время это — одна из крупнейших компаний на рынке биопродукции.
Основной источник природного реннина — перетертые желудки молочных телят, возраст таких телят обычно не более 10 дней. В более позднем возрасте наряду с реннином начинает вырабатываться значительное количество пепсина, который ухудшает качество сыра.
Заменители животного реннина[править | править код]
В Италии, кроме сычужного реннина, используются другие энзимы, вырабатываемые миндалинами телят и ягнят, что придаёт специфический пикантный вкус итальянским сырам.
В 1960-е были выделены штаммы грибов Mucor pusilus и Mucor miehei, синтезирующих подходящие ферменты, но с меньшей активностью. Позднее были разработаны способы получения ферментов из Pseudomonas mixoides, Bacillus licheniformis, Edothea parasitica и др.
Многие растения содержат ферменты пригодные для свертывания молока и используемые с древних времен. Гомер писал в Илиаде, что древние греки использовали сок листьев инжира чтобы свертывать молоко.[3] Данный способ, как и использование энзимов из Артишока семейства Астровые (Asteraceae), используется до сих пор в странах Средиземноморья; близкородственные растения в России — Расторопша и Чертополох. Также могут быть использованы ферменты таких растений как Крапива, Мальва, Будра плющевидная (сорные), сок Подмаренника[4]:172.
С начала 1990-х годов для производства сыров в результате достижений генной биотехнологии начали использовать реннин, произведённый бактериями, имеющими копии гена реннина телёнка.
Компания Genencor International[5] разработала и выпустила на рынок продукт биотехнологий Chymogen®, обладающий большей чистотой, активностью и стабильностью, чем природный реннин. Сообщается[6], что более 60 % твёрдых сыров производятся с его использованием.
Компания Pfizer разработала, а компания Chr-Hansen[7] поставляет на рынок продукт ChyMax® для замены природного реннина. Этот продукт используется, например, в производстве сыра сорта «Ламбер».
- ↑ History of Enzymes, Industrial Enzyme History, Textile Enzyme, Leather Bating, Detergent Enzymes
- ↑ History — Chr. Hansen (неопр.) (недоступная ссылка). Дата обращения 11 декабря 2007. Архивировано 17 декабря 2007 года.
- ↑ P. F. Fox, Paul McSweeney, Timothy M. Cogan, Timothy P. Guinee. Cheese: Major cheese groups (неопр.). — Academic Press, 2004. — С. 2. — ISBN 978-0-12-263652-3.
- ↑ Меньшикова З. А., Меньшикова И. Б., Попова В. Б. Лекарственные растения в каждом доме / к. м. н. рецензент С. Е. Фурсов. — М.: Внешторгиздат, 1991. — 377 с.
- ↑ Agricultural Biotech Products on the Market (неопр.) (недоступная ссылка). BIO.org. Дата обращения 11 декабря 2007. Архивировано 16 декабря 2007 года.
- ↑ Архивированная копия (неопр.) (недоступная ссылка). Дата обращения 11 декабря 2007. Архивировано 12 марта 2007 года.
- ↑ http://www.mychr-hansen.com/webapp/wcs/stores/servlet/CategoryDisplay?storeId=10001&langId=-101&catalogId=10101&categoryId=10352&path=10251,10272,10352 (недоступная ссылка)
Химозин - это... Что такое Химозин?
- Не путать с ренином.
Реннин (химозин) — фермент из класса гидролаз, который вырабатывается в желудочных железах млекопитающих, в том числе человека. У жвачных животных вырабатывается железами сычуга (4-го отдела желудка), отсюда одно из его тривиальных названий сычужный фермент. Это первый фермент, выделенный химически датским учёным Кристианом Хансеном (Christian Ditlev Ammentorp Hansen) экстракцией солевым раствором из высушенного желудка телёнка [1] (золотая медаль в 1874 [2]).
Свойства
Молекула реннина состоит из полипептидной цепи с преобладанием кислых аминокислотных остатков.
Вырабатывается главными клетками желудка в форме неактивного профермента прореннина (прохимозина). Активируется катионами водорода (соляной кислотой желудочного сока) в присутствии ионов кальция при pH менее 5 с отщеплением 42-членного пептида. В кислой среде относительно стабилен, при pH более 7 теряет активность. Оптимальная кислотность среды для природного реннина 3—4, для синтетического 4—5.
Первоначальный субстрат реннина — белок молока казеиноген, который под действием фермента гидролизуется и расщепляется до нерастворимого белка казеина. В результате основной белок молока остаётся в желудке длительное время и медленно расщепляется пепсином.
Молекулярная масса бычьего реннина около 34 000 а.е.м.
Ингибируется пепстатином, продуцируемым стрептомицетами.
Использование в промышленности
Вытяжка из сычугов — традиционный продукт для створаживания молока, наиболее употребимый в сыроделании.
Кристиан Хансен, первым выделивший реннин, в 1874 году основал фирму Chr-Hansen по производству реннина, в настоящее время это одна из крупнейших компаний на рынке биопродукции.
Основной источник природного реннина — желудки молочных телят, возраст таких телят обычно не более 10 дней. В более позднем возрасте наряду с реннином начинает вырабатываться знанчительное количество пепсина, который ухудшает качество сыра.
Заменители животного реннина
В Италии кроме сычужного реннина, используются другие энзимы, вырабатываемые миндалинами телят и ягнят, что придаёт спецфический пикантный вкус итальянским сырам.
В 1960-е были выделены штаммы грибов Mucor pusilus и Мucor miehei, синтезирующих подходящие ферменты, но с меньшей активностью. Позднее были разработаны способы получения ферментов из Pseudomonas mixoides, Bacillus licheniformis, Edothea parasitica и др.
С начала 1990-х годов для производства сыров в результате достижений генной биотехнологии начали использовать реннин, произведённый бактериями, имеющими копии гена реннина теленка.
Компания Genencor International [3] разработала и выпустила на рынок продукт биотехнологий Chymogen®, обладающий большей чистотой, активностью и стабильностью, чем природный реннин. Сообщается [4], что более 60 % твёрдых сыров производятся с его использованием.
Компания Chr-Hansen [5] поставляет на рынок продукт ChyMax® для замены природного реннина. Этот продукт используется, например, в производстве сыра сорта Ламбер
Смотри также
Ссылки
Примечания
- ↑ http://www.mapsenzymes.com/History_of_Enzymes.asp
- ↑ http://www.chr-hansen.com/about_us/history.html
- ↑ http://www.bio.org/speeches/pubs/er/agri_products.asp
- ↑ http://www.technology.gov/Reports/biotechnology/cd93a.pdf
- ↑ http://www.mychr-hansen.com/webapp/wcs/stores/servlet/CategoryDisplay?storeId=10001&langId=-101&catalogId=10101&categoryId=10352&path=10251,10272,10352
Wikimedia Foundation. 2010.
Сычужный фермент - свойства и применение. Какое влияние он имеет на организм человека
Сычужный фермент представляет собой сложное органическое вещество, которое вырабатывается в желудке телят, ягнят и другого новорожденного рогатого скота. Как известно, такое вещество способствует расщеплению, а также переработке молока матери, которое употребляет детеныш. Следует особо отметить, что данный фермент невозможно получить искусственным путем. В связи с этим он является достаточно дорогим, но очень эффективным в приготовлении молочных продуктов.

Самостоятельное извлечение и сушка фермента
Если вы хотите приготовить домашний сыр или творог с применением такого продукта, то его можно приобрести в аптеке. Как правило, представленный ингредиент продают в виде светло-серого или белого порошка, который не имеет ни запаха, ни цвета. Следует также заметить, что в аптечных сетях он продается крайне редко. Таким образом, при отсутствии продукта фабричного производства можно приготовить сычужный фермент в домашних условиях. Для этого извлеченный сычуг после убоя теленка или ягненка следует очистить, а концы отверстий завязать, надуть воздухом и оставить на несколько дней в тени или в теплом помещении (при 18-20 градусах). Далее высушенный продукт следует завернуть в темную бумагу и хранить до непосредственного употребления. Для приготовления сыра или творога такой фермент желательно использовать по прошествии 2-4 месяцев после сушки, ведь от свежего ингредиента в используемом растворе может появиться слизь.
Какую роль сычужный фермент играет в производстве сыра и других молочных продуктов?

Сычужный фермент довольно часто используют для приготовления сыров. Ведь во время производства данного продукта требуется быстрое отделение белковых компонентов свежего молочного напитка от сыворотки. Как известно, такое вещество животного происхождения состоит из двух элементов: пепсина и химозина. И благодаря этим составляющим сычужный фермент выступает в роли своеобразного катализатора в процессе приготовления вкусного и нежного сыра. Ведь именно его добавление быстро створаживает молоко путем отделения белковых компонентов от молочной сыворотки.
Выгоден ли производителям?
Несмотря на то, что такой компонент является дорогостоящим, он активно используется производителями молочных продуктов. Ведь сыр без сычужного фермента получается менее вкусным и нежным. Кроме того, процесс створаживания молока с использованием данного вещества происходит намного быстрей, что позволяет производить гораздо больше продукции.

Также следует отметить, что сычужный фермент не оказывает абсолютно никакого влияния на органолептические свойства конечного продукта. Другими словами, сыр, сделанный с применением данного вещества, не меняется в цвете, во вкусе и остается по-прежнему ароматным. Кстати, по внешнему виду молочного продукта совершенно невозможно понять, был он изготовлен с использованием фермента или нет.
Как производят сыры?
После того как сычужный фермент добавляется в молоко, он преобразуется в плотный сгусток. При этом сыворотка отделяется от белкового компонента. Если на этом этапе производство остановить, то у вас получится очень вкусный творог. Если же требуется сделать твердый и ароматный сыр, то зерно, достигшее определенного процента влажности, следует уложить в форму с отверстиями для стекания сыворотки, а затем спрессовать и отправить на засолку. В рассоле сформированные бруски должны находиться около 10-ти дней, после чего их требуется выложить на полки для полного созревания (примерно 3 недели).
Сычужный фермент: вреден ли для организма?
 Как было сказано выше, довольно сложно определить, изготовлен ли тот или иной сыр при помощи данного вещества. Ведь в составе продукта такой фермент вы никогда не обнаружите. Это связано с тем, что сычуг не содержится в сыре или твороге, так как он используется лишь для створаживания молока. Однако следует отметить, что виду трудоемкости его извлечения из желудков молодых телят, ягнят и козлят, с начала 1990-ых годов стали производить аналогичный фермент (реннин) в результате генной биотехнологии. Его принцип изготовления примерно таков: из животного извлекается его ген, который копируется миллионы раз. После этого их помещают в бактериальную среду, где они искусственно выращиваются. В настоящий момент остается невыясненным воздействие на организм продуктов, которые были получены путем генной инженерии. В связи с этим довольно сложно сказать, вреден ли такой фермент или нет.
Как было сказано выше, довольно сложно определить, изготовлен ли тот или иной сыр при помощи данного вещества. Ведь в составе продукта такой фермент вы никогда не обнаружите. Это связано с тем, что сычуг не содержится в сыре или твороге, так как он используется лишь для створаживания молока. Однако следует отметить, что виду трудоемкости его извлечения из желудков молодых телят, ягнят и козлят, с начала 1990-ых годов стали производить аналогичный фермент (реннин) в результате генной биотехнологии. Его принцип изготовления примерно таков: из животного извлекается его ген, который копируется миллионы раз. После этого их помещают в бактериальную среду, где они искусственно выращиваются. В настоящий момент остается невыясненным воздействие на организм продуктов, которые были получены путем генной инженерии. В связи с этим довольно сложно сказать, вреден ли такой фермент или нет.Чем заменить сычужный фермент?
В настоящее время существует несколько заменителей сычужного фермента, которые активно применяются для приготовления различных сыров и творога. Их использование также популярно среди производителей молочных продуктов. Например, в Италии, помимо сычужного реннина, для создания ароматных сыров применяются и другие энзимы, которые вырабатываются миндалинами ягнят, козлят или телят. Такие вещества придают продукту специфический пикантный вкус, высоко оцениваемый гурманами.
 Стоит также отметить, что использование неживотных веществ во время приготовления сыров позволяет их употреблять и приверженцам вегетарианства. Так, в 1960-ые годы учеными были выделены штаммы грибов Mucor miehei и Mucor pusilus, которые синтезировали подходящие ферменты, но с малой активностью. Чуть позже были разработаны методы получения аналогичных веществ из Bacillus licheniformis, Pseudomonas mixoides, Edothea parasitica и пр. Через три десятилетия, с развитием генной биотехнологии, для производства сыров стали активно использовать реннин, который был произведен бактериями-копиями гена молодого теленка. Как известно, он обладает большей чистотой, стабильностью и активностью, нежели природный сычуг. В настоящее время с помощью такого компонента производится более 60% твердых сыров.
Стоит также отметить, что использование неживотных веществ во время приготовления сыров позволяет их употреблять и приверженцам вегетарианства. Так, в 1960-ые годы учеными были выделены штаммы грибов Mucor miehei и Mucor pusilus, которые синтезировали подходящие ферменты, но с малой активностью. Чуть позже были разработаны методы получения аналогичных веществ из Bacillus licheniformis, Pseudomonas mixoides, Edothea parasitica и пр. Через три десятилетия, с развитием генной биотехнологии, для производства сыров стали активно использовать реннин, который был произведен бактериями-копиями гена молодого теленка. Как известно, он обладает большей чистотой, стабильностью и активностью, нежели природный сычуг. В настоящее время с помощью такого компонента производится более 60% твердых сыров.Помимо всего прочего, сегодня существуют и растительные заменители сычужного фермента. Так, вместо него используют сок инжира или заквасочную траву. Однако в масштабном производстве молочных продуктов такие ферменты применяются крайне редко.
Сыр — продукт насилия, ради него убивают (о сычуге, реннине, химозине, пепсине) « Этичный образ жизни
Для створаживания молока и приготовления сыров используется сычужный фермент, состоящий из двух основных компонентов — реннина (он же химозин) и пепсина. Это пищеварительные ферменты животного происхождения, которые выделяют из четвёртого отдела желудков телят после убийства (т.н. убоя). Возраст таких телят обычно не более 10 дней.
Под свертыванием молока понимаются процессы коагуляции основного его белка — казеина и образования молочного геля. Строение казеина таково, что за ферментативное свертывание «ответственна» только одна пептидная связь в белковой молекуле. Разрыв белковой молекулы по этой ключевой связи и приводит к свертыванию молока.
Химозин является тем ферментом, который по своей природе обеспечивает разрыв данной связи, при этом мало затрагивая другие. Пепсин затрагивает более широкий спектр пептидных связей в казеине. Химозин, не являясь сильным протеолитом (разрывает незначительное число пептидных связей казеина), выполняет подготовительную работу для деятельности протеаз молочнокислой микрофлоры. Под действием химозина и пепсина расщепление полипептидных цепей казеина идет по пептидной связи между 105—106 аминокислотами (фенилаланин-метионин) с отщеплением в сыворотку участка со 106 по 169 аминокислоту — гидрофильного гликомакропептида, при этом максимальное количество белка остается в сгустке.
Для приготовления многих «элитных» видов сыров применяют сычужный фермент, содержащий 90-95% химозина и 5-10% пепсина. Но, для некоторых других сыров (сулугуни, брынза) допускается использование пепсина в чистом виде. В «народных» рецептах приготовления сыров обычно используют пепсиносодержащие лекарственные препараты.
Существуют так называемые «этичные сыры» без применения сычужного фермента, на бактериальной закваске, продукте Chymax, мукорпепсине (из грибов Mucor pusilus и Мucor miehei). Но данное обстоятельство не может отменить правды о добыче молока.
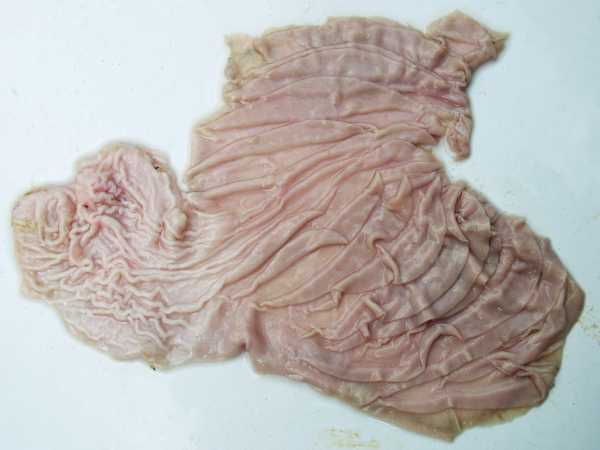

Химозин и пепсин — сычужные ферменты
>Статьи>Сычужные ферменты: химозин и пепсинПервым ферментом, который выделен в лаборатории химическим путем является химозин (также известен под названием ренин), вырабатываемый желудочными железами многих млекопитающих. Он относится к классу гидролаз.
Свое применение сычужный фермент химозин нашел прежде всего в сыроделии, где он используется благодаря свойству свертывания молока и образования сырного сгустка. В большинстве случаев применение данного ферментного вещества в чистом виде не является целесообразным: гораздо более эффективно сворачивание молока проходит при использовании смеси химозина и пепсина.
Следует обратить внимание, что продукция, произведенная с применением данного фермента, не подходит потребителям-вегетарианцам: для изготовления сыров для этой категории следует применять другие составы, например, искусственно созданные вещества, входящие в состав препарата MARZYME, разработанного компанией Даниско.
В случае же, если речь идет о приготовлении различных сортов сыра с использованием животных ферментов, целесообразно использование препарата CARLINA® 1650.
Химозин и пепсин: в чем удобство их совместного использования
В препарат CARLINA® 1650 входит смесь ферментов в следующей пропорции: химозин: пепсин – 9:1. Именно такая комбинация обеспечивает быстрое и качественное сворачивание молока вне зависимости от показателей исходной продукции, а также позволяет сформировать требуемый сырный сгусток.
Обратившись в «АРОМА ФУД», вы сможете заказать этот препарат, а также другие разработки компании Даниско для сыроделия, в том числе, и содержащие штаммы Lactococcus lactis.
Рекомендуем ознакомиться с другими нашими предложениями для пищевой промышленности:
Чистые культуры лактококков
Термофильные культуры
Культуры для производства кефира
Как распознать сыр без сычужного фермента?
Как распознать сыр без сычужного фермента?
Реннин (химозин) - фермент из класса гидролаз, который вырабатывается в желудочных железах млекопитающих, в том числе человека. У жвачных животных вырабатывается железами сычуга (4-го отдела желудка), отсюда одно из его тривиальных названий - сычужный фермент. Практически ВСЕ сыры производятся с использованием сычужного фермента. Как правило, сычужный фермент извлекается из желудков телят, козлят или ягнят.
Многие начинающие молоковегетарианцы зачастую не знают, что не любой творог и сыр можно есть. Дело в том, что в производстве сыров а иногда творога может использоваться сычужный фермент, который добывается из желудков телят.
Для того что бы достать этот фермент, телёнка убивают, поэтому сыр приготовленный с использованием сычужного фермента животного происхождения не может считаться вегетарианским, т.к. в этом продукте используется продукт убийства.

Как производят сыр
Сыр получают из плотных хлопьеобразных частиц, которые появляются в молоке по мере его созревания. Таким образом, для того, чтобы приготовить сыр, вначале необходимо отделить твердую фракцию от сыворотки – этот процесс называется свертыванием молока. По типу свертывания молока сыры делятся на сычужные и кисломолочные.
Сычужные сыры
Для быстрого отделения белковых компонентов молока от сыворотки часто используют сычужный фермент.Сычужный фермент – это сложное органическое соединение, состоящее из двух компонентов:химозина и пепсина. В процессе приготовления сыра сычужный фермент выступает в роли катализатора процесса створаживания молока – в его присутствии белковые компоненты активнее отделяются от молочной сыворотки.
Использование сычужного фермента довольно выгодно для производителя. Судите сами: процесс сычужного створаживания молока сокращается до считанных минут! Кроме того, сычужный фермент не оказывает никакого влияния на органолептические качества продукта – не меняются ни его цвет, ни запах, ни вкус. По внешнему виду вы никак не сможете определить, как был изготовлен сыр – с использованием сычужного фермента или без него.
Спустя некоторое время после добавления сычужного фермента образуется плотный сгусток, который тщательно дробится. Отделяется сыворотка, в которой находится равномерно распределенное перемешиванием «сырное зерно».
Примечательный факт. Кстати, если на этом этапе остановить производство, то получится... творог. Так чтотворог промышленного производства запросто может оказаться изготовленным с использованием сычужного фермента.
Когда зерно достигает определенного процента влажности, настает пора придавать сыру форму – зерно укладывают в
Напишу более подробно, чтобы не оставалось сомнений на будущее.…
Напишу более подробно, чтобы не оставалось сомнений на будущее.
Итак, «Сыр - это повзрослевшее молоко».
Сыр образуется из плотных частиц, которые появляются в молоке по мере его созревания. Это созревание быстрое, о чём свидетельствует скорость, с которой прокисает свежее молоко.
Сыроварение - это способ контролирования и изменения процесса с целью получения продукта, способного к созреванию вместо простого гниения.
Сыр – это самый многовариантный продукт из всего спектра молочных продуктов.
Сыр получают из коровьего, козьего, овечьего и буйвольного молока путем свертывания и обработки.
Сыр получают свертыванием молока сычужным ферментом или молочной кислотой с последующей обработкой и созреванием сырной массы.
В сыроделии используют четыре типа свертывания молока: сычужное, кислотное, сычужно-кислотное и термокислотное.
Далее про технологии, классификацию и ассортимент сыров можно подробно прочитать здесь http://www.5ka.ru/81/26701/3.html. Это не так интересно.
А интересно вот что:
вегетарианские сыры изготавливают без сычуга, с помощью микробиотики, например микробиологический заменитель сычужного фермента Milase, который производится посредством ферментации Rhizomucor miehei (не генетически модифицированные грибы). Milase содержит молокосвертывающие ферментные системы , представляющие собой специфические протеазы, по своему аминокислотному составу сравнимые с телячьим ферментом. Еще существуют растительные заменители сычуга - например, сок инжира, заквасочная трава, но используют их крайне редко...
Для справки: сычужный фермент играет важную роль в производстве сыра, он являлся одним из первых ферментов, которые начали использоваться в пищевой промышленности, около 100 лет он был единственным коагулянтом, известным в молочной промышленности. Сычужный фермент осуществляет две функции в производстве сыра, он разрушает k-казеин, тем самым начиная коагуляцию молока, инициирует каскад реакций, приводящих к гидролизу молочного белка и развитию вкуса в сыре.
Натуральный сычужный фермент приготовлен экстракцией из желудков телят (возрастом 26 недель), которые питались только молоком матери. Экстракт фермента очищается фильтрацией от механических и микробиальных загрязнений, все процессы проводятся в асептических условиях. Сычужный фермент имеет два активных компонента: химозин и пепсин, соотношение между ними обеспечивается качеством телячьих желудков.
Далее подробный пост coursetopositiv .
Оттуда:
Не есть:
- реннин — животный химозин — сычужный фермент
- натуральный сычужный фермент
- "сладкомолочные" сыры — так называются сыры, созданные с помощью сычужного фермента
- абомин — тот же сычужный фермент, продается в аптеках, может использоваться частными производителями сыра (бабками на рынке)
Есть:
- химозин неживотного происхождения
- микробиологический фермент
- кисломолочные сыры
- milase — микробиологический заменитель сычужного фермента
В Европе многие уже перешли на микробиологические ферменты, а вот в России и СНГ наоборот.
Даже когда переводят состав импортного сыра, могут микробиологические, не животные ферменты перевести как сычужный фермент.
Ссылки!
Реннин (химозин )
Заменители животного реннина:
В Италии кроме сычужного реннина, используются другие энзимы, вырабатываемые миндалинами телят и ягнят, что придаёт спецфический пикантный вкус итальянским сырам.
В 1960-е были выделены штаммы грибов Mucor pusilus и Мucor miehei, синтезирующих подходящие ферменты, но с меньшей активностью. Позднее были разработаны способы получения ферментов из Pseudomonas mixoides, Bacillus licheniformis, Edothea parasitica и др.
С начала 1990-х годов для производства сыров в результате достижений генной биотехнологии начали использовать реннин, произведенный бактериями, имеющими копии гена реннина теленка.
Компания Genencor International разработала и выпустила на рынок продукт биотехнологий Chymogen®, обладающий большей чистотой, активностью и стабильностью, чем природный реннин. Сообщается, что более 60 % твёрдых сыров производятся с его использованием.
Компания Pfizer разработала, а компания Chr-Hansen поставляет на рынок продукт ChyMax® для замены природного реннина. Этот продукт используется, например, в производстве сыра сорта Ламбер.
Пепсин
МукорпепсинМукорпепсин (англ. mucorpepsin) — протеолитический фермент класса гидролаз. Шифр КФ 3.4.23.23. Мукорпепсин получается из грибов Mucor pusilus и Мucor miehei. Применяется в пищевой промышленности в качестве заменителя сычужных ферментов животного происхождения.
На российском рынке встречается, как «Пепсин, микробиальный ренин, фермент для приготовления мягких и рассольных сыров» «растительного происхождения», японского производства, в котором в качестве молокосвёртывающего фермента используется мукорпепсин.
Какой фермент для сыра выбрать?
26.09.2019| Recepty-syrov|
Какой фермент для сыра выбрать?

Каждый начинающий сыровар задавался вопросами: Чем же отличаются ферменты для сыра? Какой лучше? Из чего делают ферменты? Какой фермент натуральный? А также какой фермент выбрать для творога?
В этой статье представлена сравнительная характеристика основных молокосвертывающих ферментов, используемых в молочной промышленности и домашнем сыроделии. Рассмотрены преимущества и недостатки молокосвертывающих ферментов различного происхождения (сычужные, микробиальные, растительные, рекомбинантные, иммобилизованные и т.д.).
Ключевые слова: молокосвертывающие ферменты, ренин, пепсин, закваска, микробиальные ферменты, растительные коагулянты молока, ферментативная коагуляция молока, иммобилизованные ферменты.
1. Молокосвертывающие препараты животного происхождения

Наиболее известным ферментом, традиционно используемым для коагуляции (свертывания) молока, является сычужный фермент ренин или химозин (1). Фермент относится к классу аспартатных протеиназ, находится в соке четвертого отдела желудка телят (сычуга). Как и пепсин (2), он образуется в главных клетках желудка из зимогена (прореннина) и активируется катионами водорода (рН< 7) в присутствие ионов кальция с отщеплением 42-членного пептида.
Самыми распространенными препаратами животного происхождения являются: Пепсин говяжий, Традиция, Экстра, Нормаль, Энзи Микс (Россия), Ceska-Lase (Kalase) (Нидерланды), NATUREN Extra (Дания), CAGLIO CLERICI, CALZA CLEMENTE (Италия)
Экстракт, полученный из желудка теленка молочного возраста, содержит 88 – 94 % химозина и 6 – 12 % пепсина. Экстракт из желудка более взрослого животного, получающего обычный корм, содержит 90 – 94 % пепсина и всего 10 % химозина.
Химозин играет важную роль в пищеварении млекопитающих, способствует более медленному прохождению молока по пищеварительному тракту и более полному его усвоению.
Химозин, полученный из желудка молочного теленка, наиболее активен при рН 6,2 – 6,4, а активность пепсина располагается в области повышенной кислотности при рН 1,7 – 2,3, поэтому эти ферменты дополняют друг друга, и их смеси нашли широкое применение в сыроделии.
Сычужный фермент в виде сухого порошка выпускают в смеси с солью, содержание которой в сычужных препаратах составляет от 70 до 90%. Такая смесь может храниться в темном месте при комнатной температуре в течение длительного времени. В водных растворах фермент быстро разрушается (инактивируется).
Количество молокосвертывающего препарата, для свертывания молока, должно быть минимальным, но при этом обеспечить образование сгустка в заданное время (15-40 минут)
Если проба на свертываемость показала, что у молока пониженные свойства к свертыванию, то следует увеличить дозу внесения хлористого кальция, бактериальной закваски, а также увеличить температуру свертывания, при этом увеличение дозы молокосвертывающего фермента выше нормативной, не рекомендуется.
Доза фермента зависит от кислотности молока, от фракционного состава белков, и других факторов и изменяется в течение года.
Количество вносимого препарата больше влияет на время свертывания, нежели на плотность самого сгустка. Так повышенная доза препарата может вызвать ускоренное развитие технологического процесса, нарушение нормальной обсушки зерна, а некоторые препараты, содержащие в составе больше пепсина, могут даже вызвать появление горечи во вкусе готового продукта.
При недостаточном внесении или неравномерном распределении молокосвертывающего препарата, увеличивается время свертывания и обработки зерна, увеличиваются потери белка и жира.
Недостатки: высокая себестоимость
2. Препараты микробного происхождения

Распространенными источниками ферментов микробного происхождения являются штаммы микроорганизмов Klueveromyces Lactis (Renifer), Rhizomucor miehei (Milasa), Aspergillus niger var. Awamori, Mucor miehei, Endothia parasitica.
Широко известны такие препараты как: Meito (Меито, Япония), Renifer ( Ренифер, Испания), Milase (Милаза, Нидерланды), Fromase (Фромаза, Франция), Reniplus (Рениплюс, Испания).
Протеазы, содержащиеся в составе данных препаратов, разрушают определенные пептидные связи: фен-вал, лей-тир, фен-фен или фен-тир. Разрушение казеина без образования горечи в сыре протекает при рН 5,5 – 7,0.
Преимущества: низкая себестоимость, высокая активность, неприхотливы – в температурном диапазоне +20…+40 °С и при рН от 6,0 до 9,0.
Недостатки: низкий выход продукта, более короткий срок хранения по сравнению с сычужными сырами и снижение качества производимых сыров.
3. Препараты растительного происхождения
Наряду с ферментными препаратами животного и микробного происхождения для сквашивания молока используются также препараты растительного происхождения.
Экстракты растений, которые традиционно считались ферментными коагулянтами молока, такими не являются, так как они имеют другой механизм действия или, возможно, они содержат микробы, обладающие способностью к свертыванию молока.
Одним из давно известных растительных коагулянтов является сок фигового дерева (Fісus саrіса), используемый в районах его произрастания. Многие экстракты растительного происхождения способны свертывать молоко, но некоторые из них имеют слишком высокую протеолитическую активность (например, папаин из азимины (Саrіса рарауа), бромелин из ананаса (Ananassatiа) и рицин из семян клещевины (Ricinus communis)). Примером использования растительного экстракта может служить выработка португальского сыра Sena da Estrela из овечьего молока с помощью водной вытяжки цветков кардона.
Преимущества: низкая себестоимость, высокая активность, менее чувствительны к изменениям в составе молочного сырья
Недостатки: низкий выход продукта, более короткий срок хранения по сравнению с сычужными сырами и снижение качества производимых сыров.
Установлено так же, что экстракты некоторых растений ядовиты, например, гемлок (Conium maculatum) и рицин семян клещевины (Ricinus communis) вызывают комбинированное свертывание с помощью кислоты и фермента, используемое, в основном, для выработки сыров с мягким тестом.
4. Препараты рекомбинантные (биотехнологические)

Широкое применение в промышленности нашли молокосвертывающие ферментные препараты на основе рекомбинантного химозина, например CHY-MAX M (Чи – макс М, Дания). Структура рекомбинантного химозина почти идентична структуре традиционного телячьего.
Бактериям вводят ген, который отвечает за синтез химозина — основного составляющего сычужного фермента. Таким образом, получают чистый химозин, который вроде бы и не является ГМО, а только продуктом жизнедеятельности ГМО и не содержит бактериальную ДНК.
На основе данной разработки получен ферментный препарат CHY-Max, однако, исследования, проведенные М.В. Полковниковой и Л.Н. Азолкиной, показали, что в сгустках, полученных с использованием препаратов животного происхождения, сыворотка отделяется равномернее, чем из сгустка, полученного с применением рекомбинированного препарата.
Микробиальные и рекомбинированные препараты образуют более мягкий сгусток по сравнению с ферментными препаратами животного происхождения.
Известно, что использование ферментов, как сычужного, так и микробиального происхождения, производится однократно. Натуральным сычугом можно свернуть молоко повторно, но не более одного раза, а стоит он не дешево. В связи с этим, является актуальным использование и разработка приемов позволяющих многократно использовать ферменты. Одним из таких приемов является иммобилизация, т.е. включение молекул фермента в какую-либо изолированную фазу, которая отделена от фазы свободного раствора, но способна обмениваться с находящимися в ней молекулами субстрата, эффектора или ингибитора.
5. Иммобилизованные ферменты
Данные ферменты имеют ряд преимуществ. Прежде всего, такие ферменты, представляя собой гетерогенные катализаторы, легко отделяются от реакционной среды, могут использоваться многократно и обеспечивают непрерывность каталитического процесса. Кроме того, иммобилизация ведет к изменению свойств фермента: субстратной специфичности, устойчивости, зависимости активности от параметров среды. Иммобилизованные ферменты долговечны и в тысячи и десятки тысяч раз стабильнее свободных энзимов. В настоящее время преимущества использования иммобилизованных ферментов очевидны, поэтому их применение ежегодно расширяется. Несмотря на широкий выбор носителей, и методов иммобилизации, проблема поиска, разработки и исследования новых способов и носителей для иммобилизации ферментов является одной из актуальных задач фундаментальной химической науки. При этом наиболее перспективны методы иммобилизации, позволяющие максимально сохранять каталитическую активность ферментов в процессе иммобилизации и повышающие стабильность иммобилизованных препаратов при последующем использовании.
К таким ферментам можно отнести и натуральные сушеные сычуги козлят, телят и ягнят. Отборные желудки сушат в специальной камере. Перед использованием сухие сычуги вымачивают в специальном растворе (в свежей сыворотке). Используют сычужную вытяжку.
Примечания
1. Ренин (химозин) – фермент из класса гидролаз, который вырабатывается в желудочных железах млекопитающих
2. Пепсин – протеолитический фермент класса гидролаз. Образуется из своего предшественника пепсиногена, вырабатываемого главными клетками слизистой оболочки желудка, и осуществляет расщепление белков пищи до пептидов.
3. Каогулянты (от лат. coagulo — вызываю свёртывание, сгущение) – вещества, введение которых в жидкую среду, содержащую мелкие частицы какого-либо тела, вызывает коагуляцию, т. е. слипание этих частиц.
4. Закваска – микробиологический состав, вызывающий брожение. Используется для сквашивания молока с целью получения кисломолочных продуктов.
Список используемой литературы:
Цикуниб А.Д., Гончарова С.А.
Лаборатория нутрициологии и экологии НИИ комплексных проблем АГУ
МОЛОКОСВЕРТЫВАЮЩИЕ ФЕРМЕНТЫ: СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА
Навигация по записям
Большая Энциклопедия Нефти и Газа, статья, страница 1
Химозин
Cтраница 1
Химозин А - ферментный препарат, получаемый из генетически модифицированного штамма Escherichia coli К-12. [1]
Химозин, специфичность ферментативного действия которого ограничена упомянутым превращением казеина в параказеин ( коагулазное действие), образуется в значительных количествах слизистой сычуга телят, чем и вызвано название его сычужный фермент. Однако, коагулирующее действие проявляет не только химозин - оно присуще всем животным и растительным про-теазам: пепсину, химотрипоину, папаину и другим. [2]
РЕННЙН ( химозин, сычужный фермент), пи-щеварит. Издавна используется в сыроварении. [3]
Гаммарстеном был получен препарат химозина, или сычужного фермента ( 2б), выделить который тщетно пытались в течение 30 лет. Дешан ( 27), но успеха не достиг. Гаммарстен фракционировал кислую водную вытяжку сычуга углекислым магнием или раствором свинцового сахара. [4]
Идентичность клонированного и природного генов химозина была подтверждена рестрикционным картированием, ДНК-гибридизацией и секвенированием ДНК. Более того, было показано, что рекомбинантный химозин обладал такой же молекулярной массой, что и природный очищенный химозин теленка, и одинаковой с ним биологической активностью. [5]
Далее, необходимо было показать, что рекомбинантный химозин безопасен для применения. Компания представила данные, подтверждающие, что конечный препарат, экстрагированный из бактериальных телец включения и прошедший все необходимые этапы очистки, не загрязнен целыми бактериальными клетками, клеточным дебрисом и другими примесями, в том числе нуклеиновыми кислотами. К-12 нетоксичен и непатогенен для человека. Результаты тестирования на животных не выявили никаких побочных эффектов препарата, что свидетельствовало об отсутствии в нем токсинов. После изучения всей полученной информации FDA пришла к выводу, что рекомбинантный химозин может быть разрешен для коммерческого использования. [6]
При скисании молока или свертывании его под действием химозина образуется сгусток, состоящий в случае скисания молока из казеиногена и жира молока, а в случае свертывания под действием химозина ( лабфер-мента) - из казеината кальция и жира. [7]
Эти ферменты нельзя рассматривать как изолированные чистые ферменты; и химозин и пепсин состоят из группы ферментов. В сычуге телячьего желудка, из которого получают химозин, обнаруживаю. [8]
Про-химозин при кислотности большей чем рН 5 0 превращается в химозин - фермент, вызывающий свертывание молока. Это свертывание представляет собой конечный результат ферментативного расщепления белка молока - казеина - - на параказеин, и сывороточную альбумозу. Образовавшийся параказеин в присутствии ионов кальция превращается в нерастворимую кальциевую соль, которая и выпадает ъ виде осадка. [9]
После удаления продуктов клеточного распада, проводимого путем фильтрации, фильтрат, содержащий химозин В, дополнительно очищали с помощью нескольких циклов клеточной фильтрации и концентрировали путем ультрацентрифугирования. Ферментный препарат обрабатывали материалами, обычно применяющимися в сыроварении. [10]
В эту группу входят, в частности, такие ферментные препараты, как а-амилазы, химозин А, химозин В. [11]
В эту группу входят, в частности, такие ферментные препараты, как а-амилазы, химозин А, химозин В. [12]
В данном случае отсутствовал также ген, кодирующий аспергил-лопепсин А - экстрацеллюлярную аспараги-новую протеиназу, которая вызывает расщепление химозина и является причиной неприятного запаха сыра. [13]
Готовый продукт был выделен из бактериальных клеток, и в FDA направлена просьба дать разрешение на коммерческое использование рекомбинантного химозина для промышленного производства сыров. [14]
Важнейшие представители используемых животных протеи-наз - пепсин, трипсин, а-химотрипсин и сычужный фермент, иногда называемый реннином или химозином. Пепсин образуется из пепсиногена слизистой оболочки желудка, рН - оптимум его действия на белки - 1 7 - 2 2; он расщепляет их, как и пептиды, по связям, которые образованы с участием аминной группы тирозина или фенил-аланина. Трипсин образуется из трипсиногена поджелудочной железы, его действие наиболее интенсивно при рН 7 6 - 9 0; специфичность четко выражена: он гидролизует связи, сформированные с участием СООН-группы положительно заряженных аминокислот, аргинина и лизина. Химотрипсин близок по ряду свойств трипсину, а специфичность его подобна пепсину с тем отличием, что он разрывает связи, в которые ароматические аминокислоты входят не аминными, а карбоксильными группами. Реннин образуется из прореннина в сычуге молодых жвачных животных. Это - протеолитический фермент, специально настроенный на створаживание молока. [15]
Страницы: 1 2 3 4