Хлорное железо что это такое
Хлорное железо - это... Что такое Хлорное железо?
- Хлорное железо
-
Хлорид железа(III), хлорное железо FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
Физические свойства
Мерцающие, слегка зеленоватые листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6Н2О — гигроскопичные жёлтые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на жлезные опилки газообразным хлором. При этом, в отличии от действия соляной кислоты, образуется соль трёхвалентного железа:
- 2Fe + 3Cl2 → 2FeCl3
- Также трихлорид получается при окислении хлором хлорида железа(II):
- 2FeCl2 + Cl2 → 2FeCl3
- 4FeCl2 + SO2 + 4HCl → 4FeCl3 + S + 2H2O
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления, начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
- 2FeCl3 → 2FeCl2 + Cl2↑
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комлексные соли тетрахлорожелезной кислоты:
- FeCl3 + Cl− → [FeCl4]−
- FeCl3 + Fe2O3 → 3FeOCl
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окислет металлическую медь, переводя её в растворимые хлориды:
- FeCl3 + Cu → FeCl2 + CuCl
- FeCl3 + CuCl → FeCl2 + CuCl2
Применение
Хлорид железа(III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса- Хлорид железа(III) применятеся для травлении печатных плат.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств, широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
См. также
Wikimedia Foundation. 2010.
- Хлоропирамина гидрохлорид
- Хлоропласты
Смотреть что такое "Хлорное железо" в других словарях:
Железо - получить на Академике рабочий купон на скидку Ашан или выгодно железо купить с бесплатной доставкой на распродаже в Ашан
ЖЕЛЕЗО — см. ЖЕЛЕЗО (Fe). В поверхностных водах содержание железа колеблется в широких пределах. В подземных водоисточниках и водах болот его концентрация достигает десятков мг/л. Резкое повышение железа в водоемах происходит при загрязнении их сточными… … Болезни рыб: Справочник
Железо — (Ferrum) Металл железо, свойства металла, получение и применение Информация о металле железо, физические и химические свойства металла, добыча и применение железа Содержание Содержание Определение термина Этимология История железа Происхождение… … Энциклопедия инвестора
Железо — 26 Марганец ← Железо → Кобальт … Википедия
ЖЕЛЕЗО — ЖЕЛЕЗО, Ferrum (Fe), тяжелый металл, относящийся к VIII группе периодической системы Менделеева. Ат. в. 55,84(0=16), при чем известны два изотопа с ат. в. в 56 и 54. Чистое Ж. обладает серебристо белым цветом; уд. в. 7,88; оно мягче и более… … Большая медицинская энциклопедия
Железо — (техн.) Ж. есть наиболее распространенный и наиболее употребительный из металлов. Ж. было известно еще египтянам во время постройки пирамид; у греков упоминается о нем в Илиаде Гомера, причем о нем говорится, как о трудно обрабатываемом металле,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Ferric chloride — Хлорное железо, FeCl3 … Краткий толковый словарь по полиграфии
Амальгамация — так называется горнозаводский способ извлечения серебра и золота из руд и заводских продуктов при помощи ртути. Есть два способа: американский, или амальгамация в кучах, и европейский, или амальгамация в бочках. Первый введен в Мексике Бартоломе… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Гидролиз — (хим.). Г., или, неправильно, гидролитической диссоциацией , называется реакция разложения (ср. Вытеснение) водой тела, в ней растворенного (система, называемая обыкновенно гомогенной) или же находящегося в соприкосновении с водным раствором… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Физиология растений — Содержание: Предмет Ф. Ф. питания. Ф. роста. Ф. формы растений. Ф. размножения. Литература. Ф. растения изучает процессы, совершающиеся в растениях. Эта часть обширной науки о растениях ботаники отличается от ее остальных частей систематики,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
БЕСТУЖЕВА КАПЛИ — БЕСТУЖЕВА КАПЛИ, Tinct. ferri chlo rati aetherea, Spiritus aethereus ferratus (Ф VII), Tinct. nervina Bestuscheffi, предложены в 1725 г. графом А. П. Бестужевым Рюминым, Б. к. представляют спиртно эфир ный раствор хлорного железа, подвергнутый… … Большая медицинская энциклопедия
Хлорное железо — реактив, полезный для промышленности и радиолюбителей
Хлорное железо — неорганическое вещество, соль соляной кислоты и железа (III). Правильное название — хлорид железа (III), трихлорид железа с формулой FeCl3.
Получают соединение различными способами, в том числе экономически дешевым методом — из отходов при производстве хлорида титана и хлорида алюминия.
Свойства
Темные кристаллы с красновато-коричневым металлическим блеском, которые на воздухе быстро приобретают ржаво-коричневый цвет. Очень гигроскопичные, легко растворяются в воде, образуют несколько видов кристаллогидратов. Самый востребованный из них — железо хлорное 6-водное FeCl3 ∙ 6h3O. Растворение в воде сопровождается выделением тепла. Реактив растворяется в спиртах, ацетоне. При нагревании теряет часть хлора, превращаясь в хлорид двухвалентного железа.
Трихлорид железа обладает окислительными свойствами, вступает в реакции с медью и другими металлами, йодоводородом, оксидом железа (III), некоторыми хлоридами металлов. Качественной реакцией на реагент является реакция с фенолом. Несколько капель FeCl3 окрашивают раствор фенола в фиолетовый цвет.
Меры предосторожности
Хлорид железа (III) не горит и не взрывается. В тоже время он опасен для кожи, органов дыхания, глаз, вызывает прижигание слизистой желудочно-кишечного тракта. При работе следует использовать респираторы, очки, резиновые перчатки. Если работать с реактивом без перчаток, то он въедается в кожу и очень плохо смывается. При чувствительной коже или склонности к аллергическим реакциям контакт может вызвать зуд, раздражение и даже химический ожог.
Попадание брызг в глаза приводит к химическому ожогу. Если это произошло, следует немедленно их промыть и обратиться к врачу. Очень опасно проглатывание хлорного железа. Рабочее место должно быть оборудовано вентиляцией, так как вдыхать пары опасно.
Перевозить реактив можно любым видом транспорта. Хранят его в прохладных складах без отопления, без доступа солнечных лучей, в герметичной таре, защищающей от контакта с воздухом.
Раствор трихлорида железа коррозионно активен, поэтому его хранят в стойких к коррозии емкостях.
Применение
- Для быстрого осаждения части растворимых и большинства нерастворимых органических и неорганических примесей из производственных и бытовых сточных вод.
- Для осветления и умягчения воды в водоподготовке.
- В нефтедобыче для нейтрализации сероводорода при ремонте скважин; в нефтеперерабатывающей отрасли в качестве катализатора при производстве термостойких смол и битумов.
- В химпроме — катализатор при производстве органических веществ и материалов.
- В радиоэлектронике, промышленной и любительской, для травления плат, деталей, медной фольги.
- В печатном деле (цинкография, офорт) для изготовления печатных форм.
- В текстильной индустрии (относится к «мягким» протравам, не разрушающим волокна ткани).
- Для замены азотной кислоты в тех случаях, когда в результате реакции выделяется ядовитый оксид азота NO2.
- В качестве хлорирующего агента при извлечении нужных элементов из рудного сырья.
- Для удаления масла из сточных вод масложиркомбинатов; хрома из сточных вод кожевенных предприятий.
- В быту — для удаления гальванических покрытий на основе хрома и меди.
- В строительной индустрии добавляют в портландцемент для ускорения схватываемости и увеличения прочности бетона.
- В косметической, пищевой, пивоваренной, фармацевтической индустрии и ювелирном деле.
В продажу хлорное железо поступает в виде твердого вещества и в виде раствора. В магазине «ПраймКемикалсГрупп» вы можете купить 6-водное хлорное железо в виде кусков или кристаллов, оптом и в розницу. Есть скидки, возможность самовывоза и доставка.
Хлористое железо - это... Что такое Хлористое железо?
- Хлористое железо
-
Хлорид железа(II) (хлористое железо) — FeCl2 — соль.
Свойства
Бесцветные кристаллы плотностью 3,162 г/см³, желтеющие на воздухе. Плавится при 677 °C, кипит — при 1026 °C. Хорошо растворим в воде, этаноле, ацетоне. Не растворяется в диэтиловом эфире. При растворении в воде слабо гидролизуется. Из водных растворов при температуре ниже 12,3 °C выкристаллизовывается FeCl2·6H2O; от 12,3 °C до 76,5 °C — FeCl2·4H2O; выше 76,5 °C — FeCl2·2H2O, переходящий при температурах более 120 °C в FeCl2·H2O.
Сухой хлорид железа(II) при нагревании на воздухе легко окисляется до хлорида железа(III).
Получение
Получают растворением железа в соляной кислоте (в частности, при травлении стальных изделий).
Применение
Хлорид железа(II) применяют для получения хлорида железа(III). Также применяется в ювелирном деле.
См. также
Wikimedia Foundation. 2010.
- Хлорис
- Хлоридная кислота
Смотреть что такое "Хлористое железо" в других словарях:
Железо - получить на Академике рабочий купон на скидку Ашан или выгодно железо купить с бесплатной доставкой на распродаже в Ашан
хлористое железо(II) — двухлористое железо … Cловарь химических синонимов I
хлористое железо(III) — трёххлористое железо, хлорид железа(III) … Cловарь химических синонимов I
ЖЕЛЕЗО ВОССТАНОВЛЕННОЕ — Ferrum reductum. Свойства. Мелкий от серого до темно серого цвета блестящий или матовый порошок. Притягивается магнитом, содержит не менее 99 % железа. При накаливании тлеет и переходит в черную закись окись железа. В воде нерастворимо, растворя … Отечественные ветеринарные препараты
ЖЕЛЕЗО — ЖЕЛЕЗО, Ferrum (Fe), тяжелый металл, относящийся к VIII группе периодической системы Менделеева. Ат. в. 55,84(0=16), при чем известны два изотопа с ат. в. в 56 и 54. Чистое Ж. обладает серебристо белым цветом; уд. в. 7,88; оно мягче и более… … Большая медицинская энциклопедия
Железо — (техн.) Ж. есть наиболее распространенный и наиболее употребительный из металлов. Ж. было известно еще египтянам во время постройки пирамид; у греков упоминается о нем в Илиаде Гомера, причем о нем говорится, как о трудно обрабатываемом металле,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
двухлористое железо — хлористое железо(II) … Cловарь химических синонимов I
трёххлористое железо — хлорид железа(III), хлористое железо(III) … Cловарь химических синонимов I
Золото — Au (хим.). Физические свойства. Чистое З. в слитках имеет характерный желтый цвет, при получении же в виде тонкого порошка (из растворов солей при помощи различных восстановителей) цвет его меняется от темно фиолетового до красного. В тонких… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Золото, в технике — Способ нахождения и геологическое положение золота. З. почти всегда встречается в металлическом состоянии с большей или меньшей примесью серебра и небольших количеств меди, железа, иногда и других более редких металлов. Состав самородного. З., из … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Номенклатура химическая — система рациональных названий химически индивидуальных веществ. Первая такая система была выработана в 1787 Комиссией французских химиков под председательством А. Л. Лавуазье. До этого названия веществ давались произвольно: по случайным… … Большая советская энциклопедия
Хлорид железа - основные свойства и способы применения
Меры предосторожности
Железо хлорид является токсичным веществом и требует к себе мер безопасности при его использовании. В ходе работы необходимо иметь резиновые перчатки, средства защиты дыхательных путей, а также иметь укрытие всего кожаного покрова. При попадании на кожу вызывает жжение и зуд, если это произошло требуется немедленно промыть место поражение мыльной водой. В случае взаимодействия с глазами, вызывает обильное покраснение с характерным выделение слезного покрова, в случае попадания требуется промыть глаза теплой водой до полного смытия реагента. Особым отличием хлорного железа является его ввысокое коррозийное свойство, при попадании на одежду оставляет обильные следы ржавчины, которые в свою очередь практически невозможно отстирать.
Транспортировка хлорида железа
Перевозка и хранение должно осуществляться по правилам транспортировки опасных грузов класса 8. Опасные грузы — это вещества и предметы, которые из-за присущих им свойств несут угрозу жизни и здоровью человека, состоянию окружающей среды и т.д. К ним относятся: топливо, кислоты, краски, аэрозоли, огнетушители, растворители, клеи, медицинские препараты.
Хлорное железо должно храниться в гуммированных, титановых или полиэтиленовых емкостях.
Перевозят реактив в стальных гуммированных железнодорожных или автомобильных цистернах, а также в специальных контейнерах.
В холодное время года, хранение продукта производится в закрытых складских помещениях с соблюдением температурного режима.
Гарантийный срок хранения — один год со дня изготовления.
Не требует к себе обязательной сертификации.
Где купить железо хлорное?
Идеальным местом чтобы купить хлорное железо, является наш интернет магазин, в нем вы можете быстро оформить доставку до необходимого адреса.
Хлорное железо — порошок ярко-оранжевого или черного цвета, данная субстанция представляет собой кристаллическую массу с выраженным запахом металла. Самой популярной основой в производстве, является трехвалетное железо и соляная кислота, выделяется ядовито бурый дым. Безводная соль в свою очередь служит осушителем, при контакте с водой выделяет большую температуру.
Химические свойства хлорного железа
Делиться на два вида, это шести водное и безводное хлорное железо. Основным отличием от двух этих видов является кол-во молекул воды в составе, а также валентность железа при производстве. В случае достижения температуры плавления, начинается образование дихлорида и молекулярного хлора.
Применение железо хлорида в быту и промышленности
Широкое распространение хлорид железа нашел в электронике, автомастерских, водоснабжении, кузнечном деле и т.д.
Основные направления применения трёхвалентного железа:
- Травление печатных плат
- Удаление олова с печатных плат
- Снятие хрома с деталей автомобилей
- Очистка сточных вод (в виде коагулянта)
- Проявление рисунка на металлических ножах
- Крашение и протравка тканей
- Применяется как самый распространенный коагулянт в органическом синтезе
Хлорное железо является довольно-таки разносторонним реактивом, он используется в самых разных и неожиданных областях промышленности и быта.
Хлорное железо
Синонимы: Хлорид железа (раствор хлорида железа), железо хлорное.
Описание: Раствор хлорного железа представляет собой едкую нелетучую буро-коричневую жидкость. Продукт соответствует требованиям СТО 00203275-228-2009
Химические характеристики хлорного железа
| № п/п | Наименование показателей | Значение | |
| 2 сорт | 1 сорт | ||
| 1 | Внешний вид | Жидкость буровато-коричневого цвета | |
| 2 | Массовая доля хлорного железа, % не менее | 30 | 40 |
| 3 | Массовая доля хлористого железа, % не более | 1 | 1 |
| 4 | Массовая доля нерастворимых в воде веществ, % не более | 2 | 2 |
| 5 | Массовая доля соляной кислоты, % не более | 2 | 1,5 |
| 6 | Плотность раствора при 20 оС, г/см3, не менее | 1,29 | 1,41 |
В зависимости от времени года, температуры воздуха, хлорное железо выпускается 1 либо 2 сорта.
Физические характеристики хлорного железа
Молекулярная масса: 162,21 г/моль
Температура кипения колеблется в диапазоне: 100-106°С.
Значение рН ориентировочно равен от 1 до 2.
При травлении меди в растворе хлорида желез максимальная способность растворения 100 г./1 л. Скорость травления при 50–55°С равна 4,3 – 5 мкм/мин.
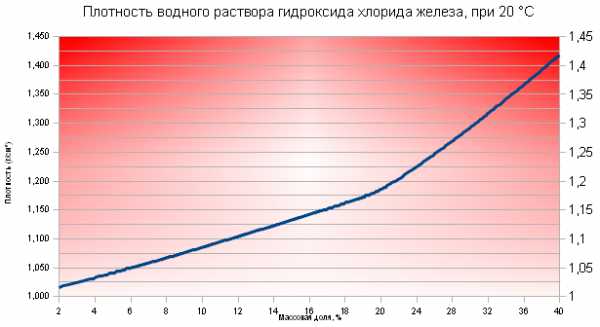
Плотности водных растворов хлорида железа представлены на Рис.1:
Область применения хлорного железа
Хлорное железо применяется в таких отраслях промышленности, как: очистные сооружения, водоканалы, металлообработка, химическая, пищевая, пивоваренная, кожевенная, нефтяная и т.д.
Основное применение раствора хлорида железа приходится на очистку промышленных и сточных вод, в качестве первичного коагулянта. Под действием хлорида железа происходит физико-химический процесс укрупнения, слипания мелких частиц (коагуляция), что способствует выпадению из коллоидного раствора хлопьевидного осадка, либо образования геля, который, в дальнейшем, легко удаляется из очищаемых стоков. При очистке хлорным железом, количество нерастворимых примесей в сточных водах уменьшается до 95%, растворимых до 25%.
По сравнению с некоторыми коагулянтами хлорид железа имеет ряд преимуществ, это:
- достаточно высокая скорость осаждения примесей.
- положительное действие на биохимическое разложение осажденных примесей, активного ила.
- более низкая стоимость по сравнению с другими распространенными коагулянтами.
Так же хлорид железа используют:
- в качестве катализатора в процессах органического синтеза.
- для травления металлов (печатных плат, печатных форм)
- как протрава при крашении ткани.
- как добавку для повышения прочности бетона.
Класс опасности хлорного железа
Раствор хлорида железа представляет собой едкую нелетучую, коррозийную жидкость.
Пожаро- и взрывобезопасно.
При попадании на кожные покровы, хлорное железо вызывает раздражение, зуд, сухость кожи, дерматит. При попадании в глаза, вызывает раздражение слизистой оболочки. Кожные покровы или глаза следует немедленно промыть обильным количеством воды, при необходимости обратиться к врачу. При работе, необходимо пользоваться индивидуальными средствами защиты.
Номер ООН 2582
Упаковка, Транспортировка и хранение хлорного железа
Транспортируют любым видом транспорта в соответствии с правилами перевозок опасных грузов, действующими на данном виде транспорта.
Перевозят раствор в стальных гуммированных железнодорожных или автомобильных цистернах, а так же в специальных контейнерах вместимостью до 1000 дм3.
Хлорид железа должен храниться в гуммированных, титановых или полиэтиленовых емкостях.
В холодное время года, хранение продукта производится в закрытых складских помещениях с соблюдением температурного режима.
Гарантийный срок хранения — один год со дня изготовления.
Обязательной сертификации не подлежит.
Железо хлорное Водный раствор FeCl3
Главная \ ХИМИЯ ДЛЯ ВОДОПОДГОТОВКИ \ ЖЕЛЕЗО ХЛОРНОЕ ВОДНЫЙ РАСТВОР FeCl3Водный раствор Железо хлорное
Химическая формула - FeCl3
Внешний вид: Жидкость буровато - коричневого цвета.
Высокоэффективный коагулянт, применяется для очистки городских и проммышленных сточных вод и обезвоживания остатка.
Хранение: в гуммированных или титановых емкостях. Гарантийный срок хранения - один год со дня изготовления.
Едкое коррозионное вещество, содержащее в составе соляную кислоту до 2% масс. Негорючее, пожаро - взрывобезопасное.
| НАИМЕНОВАНИЕ ПОКАЗАТЕЛЯ | ЗНАЧЕНИЕ | |
| Первый сорт | Второй сорт | |
| Массовая доля железа хлорного, %, не менее | 40 | 30 |
| Массовая доля железа хлористого, %, не более | 1 | 1 |
| Массовая доля нерастворимых в воде веществ, %, не более | 2 | 2 |
| Массовая доля кислоты соляной, %, не более | 1,5 | 2,0 |
| Плотность при 20° С, г/см3, не менее | 1,41 | 1,29 |
Область применения хлорного железа:
Хлорное железо применяется в промышленности, в основном, это: очистные сооружения птицефабрик, водоканалы, металлообработка, химическая, пищевая, пивоваренная, кожевенная, нефтяная и т.д.
Применение раствора хлорида железа приходится на очистку промышленных и сточных вод, в качестве первичного коагулянта. Под действием хлорида железа происходит физико-химический процесс укрупнения, слипания мелких частиц (коагуляция), что способствует выпадению из коллоидного раствора хлопьевидного осадка, либо образования геля, который, в дальнейшем, легко удаляется из очищаемых стоков. При очистке хлорным железом, количество нерастворимых примесей в сточных водах уменьшается до 95%, растворимых до 25%.
По сравнению с некоторыми коагулянтами хлорид железа имеет ряд преимуществ, это:
- достаточно высокая скорость осаждения примесей.
- положительное действие на биохимическое разложение осажденных примесей, активного ила.
- низкая стоимость по сравнению с другими распространенными коагулянтами.
Так же хлорид железа используют:
- в качестве катализатора в процессах органического синтеза.
- для травления металлов (печатных плат, печатных форм)
- как протрава при крашении ткани.
- как добавку для повышения прочности бетона.
Транспортировка: IBC контейнер (еврокуб) или специальные стальные гуммированные железнодорожные, автомобильные цистерны.
Хлорное железо своими руками | Все своими руками
Опубликовал admin | Дата 13 сентября, 2011Хлорное железо это самый эффективный химикат для травления печатных плат, но уж очень дорогой. Приготовить его собственными руками в резиновых перчатках можно по рецептам выписанным из журнала «Радио».
Способы приготовления хлорного железа
Для приготовления хлорного железа, используемого при травлении печатных плат, мы использовали порошкообразный железный сурик и техническую соляную кислоту, имеющиеся в продаже. На одну (по объему) часть соляной кислоты требуется 1,5—2 части сурика. Компоненты смешивают в стеклянной посуле, добавляя сурик небольшими порциями до прекращения химической реакции, в результате которой образуется раствор хлорного железа, готового к употреблению, а на дно выпадает осадок. Приготовление хлорного железа необходимо производить на открытом воздухе, соблюдая меры предосторожности В. БАЦУЛА. В. КУЗИН г. Севастополь
 
В «Радио» (1990. № 8, с. 74) была опубликована заметка А. Сергиенко и В. Иваненко «Приготовление хлорного железа», в которой рассказано, как в любительских условиях приготовить треххлористое железо для травления плат. Суть этого способа состоит в обработке соляной кислотой обычной ржавчины. Однако набрать необходимое количество ржавчины не так просто, как кажется. К тому же в ней неизбежно бывает немало «грязи», которая портит конечный продукт. Эту задачу я решил химическим путем. При прокаливании на огне железного купороса (его можно приобрести в магазинах, торгующих бытовой химией или садово-огородными принадлежностями) из него сначала испаряется вода и остается белая масса безводной соли сульфата железа. При дальнейшем нагревании (при температуре более 400С) масса разлагается с выделением газообразных окислов серы, которые образуют в воздухе пары серной кислоты. Поэтому работу надо проводить под хорошей вытяжкой или на открытом воздухе. В процессе прокаливания необходимо дробить спекающуюся массу. Через некоторое время она превращается в тонкодисперсный порошок ржавчины довольно высокой чистоты. Хранить порошок следует в герметичной посуде, так как он гигроскопичен и из-за этого слеживается в комки. Химическое обоснование процесса получения ржавчины изложено в учебном пособии Глинки Н. Л. «Общая химия» (например, 1975 г. на с. 680)
В. ЗАБИРОНИН, г. Луцк, Украина
 
Журнал уже опубликовал насколько вариантов рецептуры раствора для травления печатных плат, не содержащего хлорного железа. И все же многие предпочитают обрабатывать платы в растворе хлорного железа, поскольку в нем травление идет значительно быстрее. К сожалению, готовое хлорное железо остается дефицитом, и это заставляет радиолюбителей искать способы самостоятельного его приготовления (некоторые из них тоже были описаны в журнале). Мы предлагаем еще один довольно простой способ приготовления хлорного железа в домашних условиях. Для этого потребуется техническая соляная кислота, продаваемая в магазинах хозяйственных товаров, и двуокись железа — ржавчина. В трехлитровую банку наливают примерно 1л кислоты, соблюдая необходимые меры предосторожности, и засыпают туда понемногу двуокись железа до тех пор, пока не прекратится реакция. После отстаивания раствор надо слить в другую посуду — он готов к травлению. Работу желательно проводить вне жилого помещения, так как в ходе реакции выделяется большое количество пены и газов, имеющих неприятный запах, а в пене могут быть остатки кислоты.
А. СЕРГИЕНКО. В ИВАНЕНКО г. Артемовск Ворошиловградскои обл.
 
Если нет хлорного железа в готовом виде (в порошке), то его можно приготовить самому. Для этого необходимо иметь 9 %-ную соляную кислоту и мелкие железные опилки. На 25 объемных частей кислоты берут одну часть железных опилок. Опилки засыпают в открытый сосуд с кислотой на несколько дней. По окончании реакции раствор становится светло-зеленым, а через пять-шесть дней окраска меняется на желто-бурую — раствор хлорного железа готов к применению. Для приготовления хлорного железа можно использовать порошкообразный железный сурик. При этом на одну объемную часть концентрированной соляной кислоты требуется 1,2—2 части сурика. Компоненты смешивают в стеклянной посуде, добавляя сурик небольшими порциями. После прекращения химической реакции на дно выпадает осадок — раствор хлорного железа готов к применению.
 
В процессе травления печатных плат раствор хлорного железа постепенно теряет свою активность, и скорость травления уменьшается. Это объяс¬няется тем, что раствор насыщается ионами меди.
Обычно такой раствор сливают. Од¬нако можно восстановить его актив¬ность простым способом. В отработан-ный раствор надо погрузить несколько больших стальных гвоздей. Через не¬которое время излишек меди из раст¬вора осядет на поверхности гвоздей и на дне сосуда. После этого раствор сливают в другую посуду, удаляют медь из травильной ванны, очищают гвозди, а затем снова кладут их в ванну и заливают этим же раствором. По мере накопления меди на гвоздях ее удаляют. Таким образом, удается значительно продлить «жизнь» раство¬ра хлорного железа.
В. КОЛОБОВ г. Люберцы Московской обл.
 
«Обычная ржавчина» для изготовления хлорного железа практически не годится. Тем более железные опилки или кусочки железа — проверено! Нужно брать ржавчину, отделяющуюся от железа пластами — она образуется в очень влажной атмосфере (шахта, подвал и т.п.) Эта ржавчина состоит из окиси + закиси железа, что и нужно. На 0,5 л соляной кислоты (продается в хозяйственных магазинах) нужно взять по объему 1,5 стакана измельченной (0,3 — 0,5 см.) ржавчины. Все это поместить в 1 л. стеклянную банку и добавить 25 мл. ацетона (катализатор). Именно ацетона, а не какого-то растворителя. Банку накрыть куском стекла. Помешать 3 — 4 раза за пару дней — и у Вас будет хлорное железо лучше заводского.
Обсудить эту статью на - форуме "Радиоэлектроника, вопросы и ответы".
Просмотров:18 616
Хлорид железа (III) - это... Что такое Хлорид железа (III)?
- Хлорид железа (III)
-
Хлорид железа(III), хлорное железо FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
Физические свойства
Мерцающие, слегка зеленоватые листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6Н2О — гигроскопичные жёлтые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Методы получения
- Самым простым методом получения трихлорида железа является действие на жлезные опилки газообразным хлором. При этом, в отличии от действия соляной кислоты, образуется соль трёхвалентного железа:
- 2Fe + 3Cl2 → 2FeCl3
- Также трихлорид получается при окислении хлором хлорида железа(II):
- 2FeCl2 + Cl2 → 2FeCl3
- 4FeCl2 + SO2 + 4HCl → 4FeCl3 + S + 2H2O
Химические свойства
- При нагревании в атмосферном давлении до температуры плавления, начинается медленное разложение трихлорида железа с образованием дихлорида и молекулярного хлора:
- 2FeCl3 → 2FeCl2 + Cl2↑
- За счёт того, что трихлорид железа является сильной кислотой Льюиса, он вступает во взаимодействие с некоторыми другими хлоридами, при этом образуются комлексные соли тетрахлорожелезной кислоты:
- FeCl3 + Cl− → [FeCl4]−
- FeCl3 + Fe2O3 → 3FeOCl
- Соли трёхвалентного железа являются слабыми окислителями, в частности, трихлорид железа хорошо окислет металлическую медь, переводя её в растворимые хлориды:
- FeCl3 + Cu → FeCl2 + CuCl
- FeCl3 + CuCl → FeCl2 + CuCl2
Применение
Хлорид железа(III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса- Хлорид железа(III) применятеся для травлении печатных плат.
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств, широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
См. также
Wikimedia Foundation. 2010.
- Котельня-Боярская
- Оффенбург
Смотреть что такое "Хлорид железа (III)" в других словарях:
Хлорид железа(III) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(III) … Википедия
хлорид железа(III) — трёххлористое железо, хлористое железо(III) … Cловарь химических синонимов I
Хлорид хрома(III) — Хлорид хрома(III) … Википедия
Хлорид гексаамминхрома(III) — Общие Систематическое наименование Хлорид гексаамминхрома(III) Традиционные названия гексамминхромихлорид Химическая формула [Сr(Nh4)6]Cl3 Физические свойства … Википедия
Хлорид золота (III) — трихлорид золота AuCl3. Внешний вид красные моноклинные кристаллы. Молярная масса 303,33 г/моль. В безводном состоянии лучше всего получать действием хлора на золотую фольгу или на сухой порошок золота, полученный восстановлением сульфатом… … Википедия
Хлорид хрома (III) — Хлорид хрома(III) CrCl3. Свойства Фиолетовые кристаллы; плотность 2,76 г/см3; tпл 1152°С. При 600°С возгоняется в токе хлора и разлагается в его отсутствие на хлор и CrCl2. В воде растворим в присутствии восстановителей (Cr2+, Fe2+). Получение В… … Википедия
Хлорид золота(III) — У этого термина существуют и другие значения, см. Хлорид золота. Хлорид золота(III) … Википедия
Хлорид железа(II,III) — Общие Систематическое наименование Хлорид железа(II,III) Традиционные названия Хлористое железо Химическая формула Fe3Cl8 Физические свойства … Википедия
Хлорид железа (II) — Хлорид железа(II) (хлористое железо) FeCl2 соль. Содержание 1 Свойства 2 Получение 3 Применение 4 См. также // … Википедия
Хлорид железа(II) — У этого термина существуют и другие значения, см. Хлорид железа. Хлорид железа(II) … Википедия
Как разводить хлорное железо? - Diodnik

Столкнувшись с процессом создания печатных плат в домашних условиях, новички часто на различных форумах задают простой вопрос о том, как разводить хлорное железо. Вроде эта тема не такая и обширная, что бы посвящать на нее целую обширную статью, но немного подумав, мы все-таки решились на небольшую заметку.
Как разводить хлорное железо?
В продаже можно встретить два вида хлорного железа:
- Шестиводное хлорное железо. Напоминает мокрый песок желто-оранжевого цвета.
- Безводное хлорное железо. Порошок или комки чёрного цвета.
И то и другое отлично травит текстолит. Время травления свежеприготовленным раствором составляет порядка 5 минут, а со старым раствором время травления может увеличиваться до 20 минут и более. Для наглядности, мы приготовим совсем немного раствора и покажем, как разводить хлорное железо для травления плат.

Первым делом открываем нашу емкость с хлорным железом. Стараемся не выпачкать им руки, одежду и стол, т.к. его практически невозможно отмыть или отстирать от ткани.

Готовим посуду с водой, в которой будем делать раствор хлорного железа. Посуда должна быть пластиковой или керамической, применения металлических емкостей и инструментов категорически недопустимо. Воду в идеале лучше брать дистиллированную, но на практике все обходятся теплой прокипяченной.

Насыпаем пластиковой ложкой в емкость с водой хлорное железо и постоянно перемешиваем.
Добавлять хлорное железо лучше по пол чайной ложки за раз, раствор будет постепенно нагреваться, а также будут выделяться газы. Примерная пропорция раствора 1:3 (т.е. одна часть хлорного железа на три части воды) по весу.

Концентрацию можно определять и на глаз, хороший раствор должен быть по цвету как крепкий чай. По сути, разводить хлорное железо можно как угодно, но от этого напрямую будет завесить скорость травления платы.

Сам процесс травления лучше производить в слегка подогретом растворе. После травления плат отработанный раствор хлорного железа необходимо хранить в темном месте в герметичной таре до следующего использования.
Надеемся, что наша заметка будет полезной. Подписывайтесь на наши странички в социальных сетях и не упустите выход нового полезного материала.
Вконтакте
Одноклассники
comments powered by HyperCommentsХлорное железо формула химическая. Приготовление хлорного железа.
Синонимы: Хлорид железа (раствор хлорида железа), железо хлорное.
Описание: Раствор хлорного железа представляет собой едкую нелетучую буро-коричневую жидкость. Продукт соответствует требованиям СТО 00203275-228-2009
Химические характеристики хлорного железа
В зависимости от времени года, температуры воздуха, хлорное железо выпускается 1 либо 2 сорта.
Физические характеристики хлорного железа
Молекулярная масса: 162,21 г/моль
Температура кипения колеблется в диапазоне: 100-106°С.
Значение рН ориентировочно равен от 1 до 2.
При травлении меди в растворе хлорида желез максимальная способность растворения 100 г./1 л. Скорость травления при 50–55°С равна 4,3 – 5 мкм/мин.
Плотности водных растворов хлорида железа представлены на Рис.1:
Область применения хлорного железа
Хлорное железо применяется в таких отраслях промышленности, как: очистные сооружения, водоканалы, металлообработка, химическая, пищевая, пивоваренная, кожевенная, нефтяная и т.д.
Основное применение раствора хлорида железа приходится на очистку промышленных и сточных вод, в качестве первичного коагулянта. Под действием хлорида железа происходит физико-химический процесс укрупнения, слипания мелких частиц (коагуляция), что способствует выпадению из коллоидного раствора хлопьевидного осадка, либо образования геля, который, в дальнейшем, легко удаляется из очищаемых стоков. При очистке хлорным железом, количество нерастворимых примесей в сточных водах уменьшается до 95%, растворимых до 25%.
По сравнению с некоторыми коагулянтами хлорид железа имеет ряд преимуществ, это:
- достаточно высокая скорость осаждения примесей.
- положительное действие на биохимическое разложение осажденных примесей, активного ила.
- более низкая стоимость по сравнению с другими распространенными коагулянтами.
Так же хлорид железа используют:
- в качестве катализатора в процессах органического синтеза.
- для травления металлов (печатных плат, печатных форм)
- как протрава при крашении ткани.
- как добавку для повышения прочности бетона.
Класс опасности хлорного железа
Раствор хлорида железа представляет собой едкую нелетучую, коррозийную жидкость.
Пожаро- и взрывобезопасно.
При попадании на кожные покровы, хлорное железо вызывает раздражение, зуд, сухость кожи, дерматит. При попадании в глаза, вызывает раздражение слизистой оболочки. Кожные покровы или глаза следует немедленно промыть обильным количеством воды, при необходимости обратиться к врачу. При работе, необходимо пользоваться индивидуальными средствами защиты.
Номер ООН 2582
Упаковка, Транспортировка и хранение хлорного железа
Транспортируют любым видом транспорта в соответствии с правилами перевозок опасных грузов, действующими на данном виде транспорта.
Перевозят раствор в стальных гуммированных железнодорожных или автомобильных цистернах, а так же в специальных контейнерах вместимостью до 1000 дм3.
Хлорид железа должен храниться в гуммированных, титановых или полиэтиленовых емкостях.
В холодное время года, хранение продукта производится в закрытых складских помещениях с соблюдением температурного режима.
Гарантийный срок хранения - один год со дня изготовления.
Обязательной сертификации не подлежит.
Весь хром на наших детальках появляется вследствие гальванического хромирования.
Хромирование гальваническое - представляет собой электрохимический метод нанесения металлических покрытий на пластмассу. Суть – наносят три слоя металла: медь + никель + хром. Хром вступает в реакцию и равномерно оседает на поверхности изделия. Данный тип хромирования применяется для эмблем автомобиля, радиаторных решеток, сувенирной продукции и т.д. и т.п.
Как избавитьлся от этого хрома?
Есть вариант активно поработать наждачкой, но очень часто детали ни разу не ровные, с множеством мельких элементов. Шкурить такое - руки отсохнут. Именно поэтому нам поможет химия, котрую мы любии прогуливать в школе!
Самый простой способ – это положить на некоторое время нашу пластиковую деталь в раствор хлорного железа и протравить, как печатную плату.
Хлорное железо
Что такое хлорное железо?
Хлорное железо FeCl3 - средняя соль трёхвалентного железа и соляной кислоты. На вид это химическое сырье представляет собой мягкую кристаллическую массу ржаво-коричневато-черного цвета. Применяется для травления печатных плат в электронной промышленности и приборостроении.
Приготовление .
Раствор хлорного железа принято готовить исходя из пропорции 1 к 3 (1часть железа на 3части воды) по весу.
Раствор следует готовить в термостойкой неметаллической емкости, в которую наливается вода с температурой около 60-80 градусов. Желательно конечно использовать кипяченую воду, но прекрасно справляется с этой задачей и обычная вода из под крана. По науке нужно использовать дистиллированную воду, но на практике никто этим не заморачивается – у нас же не химическая лаборатория!
Хлорное железо необходимо всыпать в воду (!не в коем случае не наоборот!) малыми порциями, непрерывно помешивая раствор. При растворении вода будет нагреваться и будет видна достаточно бурная реакция (бурление, шипение, выделение пара, который крайне не рекомендуется вдыхать). На растворение придется затратить минут 20(тут все зависит от объемов) зато железо растворится полностью и не осядет на дно емкости как и не произойдет вскипания раствора, расплавления тары. Совет один – торопиться не надо!
После растворения необходимо дать отстояться раствору. Через 20 минут можно будет наблюдать оседание гидроксида железа (ржавчина) на дне, который всегда содержится в порошке хлорного железа и который препятствует травлению. Лучше дать раствору
отстояться часов 10-12, чтобы на дно емкости осел всякий мусор, который в хлорном железе часто присутствует. После того, как раствор отстоялся его нужно отфильтровать в чистую емкость, в которой он собственно и будет храниться. Раствор можно
запросто использовать неоднократно, и хранится он сколь угодно долго.
В итоге мы получили чистый, прозрачный, бурый раствор хлорного железа.
Результат травления:

Результат травления
Восстановление раствора
Каждый раз после использования раствор будет терять свою силу и последующее травление будет длиться дольше. Ускорить процесс травления опять же поможет подогрев и помешивание раствора.
Раствор можно восстановить, добавив в него соляной кислоты – часть гидроксида вновь
восстановится до хлорида железа. Но самый простой способ до ужаса банален – кидаем в раствор несколько обыкновенных гвоздей, на них из раствора осядет медь и раствор вновь наберет силу. Но злоупотреблять этим не стоит, особенно когда ра
Хлорное железо
Хлорное железо
ТУ 6-005763450-129-91
FeCl3
Хлорид железа (III), хлорное железо FeCl3 — средняя соль трёхвалентного железа и соляной кислоты.
Хлорид железа - мерцающие, черно-коричневые, либо темно-красные, либо фиолетовые в проходящем свете, зеленые в отраженном свете листочки с металлическим блеском. Сильно гигроскопичен, на воздухе превращается в гидрат FeCl3· 6Н2О — гигроскопичные жёлтые, по другим источникам желто-коричневые кристаллы, хорошо растворимые в воде (при 20 °C в 100 г воды растворяется 91,9 г безводной соли). Tпл 309 °C.
Хлорид железа (FeCl3) представляет собой бесцветные кристаллы (плотность 1,93 г/с м³), желтеющие под воздействием воздуха и напоминающие внешне мокрый песок. Температура плавления хлорида железа — 677 °C, кипения — 1026 °C. Вещество хорошо растворяется в воде, ацетоне, этаноле. В диэтиловом эфире не растворяется. При растворении в воде происходит слабая реакция гидролиза. При температуре ниже 12,3 °C из водных растворов хлорида железа выкристаллизовывается FeCl2•6h3O, в пределах температур 12,3 °C — 76,5 °C — FeCl2•4h3O, при 76,5 °C и выше — FeCl2•2h3O, который после нагревания свыше 120 °C переходит в FeCl2•h3O. При нагревании на открытом воздухе сухой хлорид железа (II) самопроизвольно окисляется до хлорида железа (III).
Технические характеристики:
| Физические свойства | |
|---|---|
| Состояние | твердый |
| Молярная масса | 162.2 г/моль |
| Плотность | 2,8 г/см³ |
| Термические свойства | |
| Т. плав. | 306 °C |
| Т. кип. | 315 °C |
| Химические свойства | |
| Растворимость в воде | 92 г/100 мл |
Применение:
Хлорид железа (III) в роли катализатора реакции электрофильного замещения Фриделя-Крафтса
- Хлорид железа(III) применяется при травлении печатных плат (радиотехника, системотехника).
- Используется для травления печатных форм (офорт, цинкография), как альтернатива азотной кислоты, реакция с которой сопровождается выделением высокотоксичных паров («лисий хвост»).
- Применяется как протрава при крашении тканей.
- В промышленных масштабах применяется как коагулянт для очистки воды.
- За счёт чётко выраженных кислотных свойств, широко применяется в качестве катализатора в органическом синтезе. Например, для реакции электрофильного замещения в ароматических углеводородах.
Хлорид железа применяется для очистки воды в промышленных условиях, в косметической, пищевой, текстильной, пивоваренной и кожевенной отрасли, а также в металлургии, металлообработке и химической промышленности. Кроме того, хлорид железа широко используется при изготовлении медицинских препаратов и в ювелирном деле.