Интравитреальное введение лекарственных препаратов что это такое
Интравитреальное введение | Центр микрохирургии глаза
Интравитреальные инъекции препаратов позволяют действующему веществу достичь проблемной зоны сетчатки. Методика интравитреального введения разработана для лечения многих заболеваний заднего отрезка глаза, таких, как макулодистрофия, диабетический макулярный отек, посттромботический макулярный отек, центральная серозная хориоретинопатия и других более редких заболеваний. Преимуществом ее является достижение действующего вещества сетчатки в обход гемато-офтальмического барьера.
Гемато-офтальмологический барьер представлен эндотелием капилляров сосудистой оболочки глаза, является физиологическим заграждением между кровеносными сосудами внутри глазного яблока и кровеносным руслом человека (схож с гемато- энцефалическим барьером). Его задачей является препятствие прохождению внутрь глаза токсинов, бактерий и других нежелательных элементов, однако так же он препятствует прохождению лекарственных веществ. По этой причине и была разработана техника безопасного интравитреального введения лекарственных препаратов к поверхности сетчатки.
Интравитреальное введение Луцентиса при макулярной дегенерации
В настоящее время во всем мире не существует препаратов для лечения влажной формы макулярной дегенерации сетчатки. Однако, введение в витреальную полость Луцентиса позволяет замедлить снижение зрительных функций зрения или даже улучшить зрение.
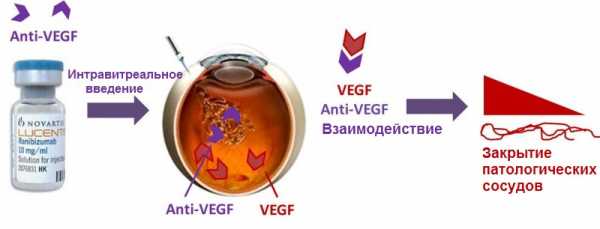
Луцентис широко вощел офтальмологическую практику в 2006 году, является модифицированной формой препарата Авастин. Интравитреальное введение Авастина при влажной форме ВМД, так же широко применялось до разработки более современных препаратов. Люцентис и другие препараты (Макуджен, Авастин или Айлия) из этой группы ингибирует особые белки, называемые факторы роста эндотелия сосудов (VEGF), которые и являются причиной развития влажной макулодистрофии.
Интравитреальное введение при макулярном отеке
Различные заболевания могут становиться причиной развития макулярного отека. Макулярный отек может развиваться при диабетической ретинопатии, после тромбоза вен сетчатки глаза или может быть вызван ранее проведенными хирургическими вмешательствами на глазах.
В настоящее время для лечения макулярного отека используются глюкокортикостероиды, либо короткого срока действия, либо пролонгированного (Озурдекс). Пролонгированные стероидные препараты применяются в основном в лечении рецидивирующих отеков макулы. Препараты способствуют рассасыванию жидкости из сетчатки, а так же оказывают положительное действие на микроциркуляцию, за счет противовоспалительного действия.
Техника выполнения интравитреального введения препаратов
Увеличение эффективности и безопасности интравитреальных инъекций, в сочетании с развитием фармакотерапии, привело быстрому росту количества таких вмешательств. В нашей клинике все интравитреальные уколы выполняются только в стерильной операционной, после обработки глазного яблока дезинфицирующими растворами, аналогично большой полостной хирургии, например, так же, как перед операцией по замене хрусталика.
До интравитреального введения нет необходимости отменять препараты назначенные вам по поводу другой соматической патологии (например антикоагулянты)!
До оперативного вмешательства за три дня вам будет необходимо начать закапывать антибактериальные капли, прием которых будет необходимо продолжить в течении 7 дней после инъекции (включая день укола).
Обезболивание во время инъекции достигается путем закапывания местных анестетиков. Во время введения препарата вы не будите чувствовать боль, однако тактильная чувствительность будет сохранена. После инъекции будет ощущение распирания глазного яблока, может отмечаться умеренная головная боль на стороне инъекции.
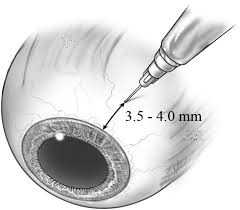
Интравитреальное введение фото и описание
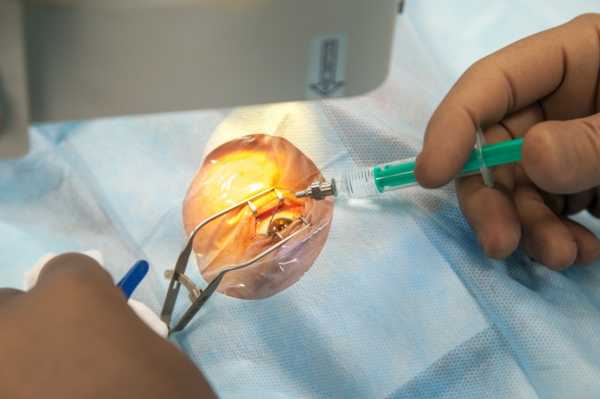
Место инъекции находится в нижне-наружном квадрате глазного яблока на расстояние 3,5 мм от поверхности роговицы. Слизистая оболочка в месте инъекции смещается в сторону. Расстояние от роговицы измеряется специальным стерильным циркулем, точно измерение является неоспоримым преимуществом интравитреального введения в условия операционной. Направление иглы должно быть перпендикулярно поверхности склеры. Размер иглы позволяет исключить возможность повреждения внутриглазных структур заднего отрезка глаза. Препарат медленно вводили в полость стекловидного тела.
| Интравитреальное введение ингибитора ангиогенеза со стоимостью препарата (Луцентис) | 22500 р. |
| Интравитреальное введение препарата ловушка VEFG со стоимостью препарата (Эйлеа) | 33500 р. |
| Интравитреальное введение пролонгированного глюкокортикостероида со стоимостью препарата (Озурдекс) | 70000 р. |
Интравитреальные инъекции
Интравитреальные инъекции – новый эффективный метод лечения тяжелых воспалительных заболеваний переднего и заднего сегмента глаза.
Лечение внутриглазных воспалительных заболеваний у собак и кошек – хориоретинитов, панувеитов, гемофтальмов, иридоциклитов – является серьезной проблемой для ветеринарного офтальмолога вследствие трудной «адресной доставки» лекарственных препаратов к поражённым тканям. Основным препятствием на пути лекарственных препаратов при инстилляциях, субконъюнктивальных или парабульбарных инъекциях к тканям-мишеням – сетчатке, сосудистой оболочке и цилиарному телу – становится гематоофтальмический барьер. Гематоофтальмологический барьер представлен эндотелием капилляров сосудистой оболочки глаза и служит физиологическим заграждением между кровеносными сосудами и внутренними тканями глаза (схож с гематоэнцефалическим барьером). Его задачей является препятствие прохождению внутрь глаза токсинов, бактерий и других нежелательных элементов, однако он также препятствует прохождению лекарственных веществ. Таким образом, большая часть препаратов вследствие наличия этого барьера просто не доходит до проблемных зон. По этой причине и была разработана техника интравитреального введения лекарственных препаратов к сетчатке и стекловидному телу.
Интравитреальные инъекции – это введение препаратов непосредственно в полость стекловидного тела через прокол склеры. Преимуществами интравитреальных инъекций перед всеми другими методами лечения является прямая и быстрая доставка препаратов в обход гематоофтальмического барьера непосредственно к пораженным тканям-мишеням.
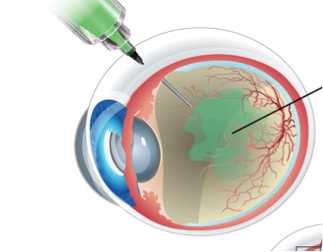
Рисунок 1. Интравитреальная инъекция – введение препаратов в стекловидное тело
При интравитреальном введении лекарственное вещество попадает в ретроцилиарные цистерны стекловидного тела. В случае сохранной структуры стекловидного тела оно через 8 ч – 2 суток достигает задних его отделов, а затем сосудистой оболочки и сетчатки. Это позволяет поддерживать концентрацию лекарственного препарата в течение более длительного времени по сравнению с другими путями доставки, а также снижает возможные побочные системные эффекты ввиду меньшей дозы и количества вещества, которое выводится из глаза и попадает в системный кровоток. В гуманитарной офтальмологии интравитреальные инъекции широко применяются для успешного лечения многих заболеваний заднего отрезка глаза: диабетической пролиферативной ретинопатии, гемофтальмов, эндофтальмитов, хориоретинитов, тромбозов центральной вены сетчатки и т. д. (2, 3, 5, 18, 19). В ветеринарной офтальмологии данная процедура также периодически используется рядом врачей (Лужецкий С. А, Гончаров Д. В). Однако сама методика техники интравитреальных инъекций для животных в отечественной ветеринарной литературе практически не описана. Отсутствуют данные о клинической эффективности метода, непосредственных и отдаленных клинических результатах лечения, осложнениях, показаниях и противопоказаниях к его применению (9).
Целью данной работы являлось:
- внедрение и применение в клинической практике нового метода лечения заболеваний заднего отрезка глаза - интравитреальных инъекций;
- проведение анализа эффективности методики;
- сравнение непосредственных и отдаленных результатов лечения;
- определение показаний и противопоказаний к применению интравитреальных инъекций.
Собственные исследования
Нами методом инравитреального введения препаратов было пролечено 13 глаз собак и кошек в возрасте от 1 до 10 лет. Девять глаз имели бесперспективные и проблемные патологии, что на сленге офтальмологов называется «глазами, выброшенными на помойку»; в этих случаях другие методы лечения не работали и интравитреальные инъекции являлись единственной альтернативой энуклеации или эвисцерации. Из них было семь случаев тяжелых рецидивирующих иридоциклитов. Односторонние иридоциклиты наблюдались у 5 животных (3 кошки и 2 собаки). Две коши имели с двусторонний панувеит на фоне иммунодефицита и вирусного лейкоза.
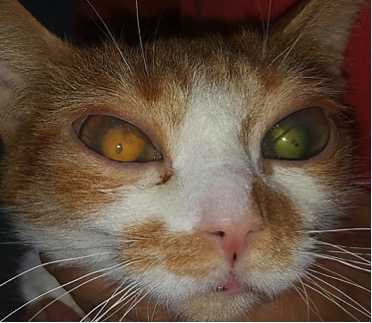
Рисунок 2. Тяжелый двухсторонний кератоувеит у кота 3 лет в сочетании с множественными эрозиями роговицы и хориоретинитом на фоне вирусного лейкоза
Всем этим животным для купирования интраокулярного воспаления интравитреально вводили триамцинолон (кеналог 40) в дозе 0,2 мл. Триамцинолон являлся базисным препаратом первого выбора при интравитреальных инъекциях вследствие того, что этот препарат снижает экспрессию сосудистого эндотелиального фактора роста (VEGF), одновременно редуцирует отек, уменьшает воспаление внутриглазных структур и повышает проницаемость сосудов. (2, 4, 13, 14, 16). Интравитреальное введение кеналога позволяет добиться высокой внутриглазной концентрации стероидов, избежав системных побочных эффектов (11, 12).
Двое животных было с односторонними рецидивирующими гемофтальмами в сочетании с гифемой сроком более 7 дней. Им в стекловидное тело для рассасывания внутриглазных кровоизлияний вводилось 0,4 мл АТР (актилизе) с разведенной в ней гемазой (4).
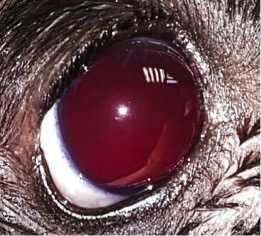
Рисунок 3. Тотальная гифема в сочетании с гемофтальмом у собаки чихуахуа 6 лет
Чтобы ввести такое большое количество препарата внутрь глаза и не повысить резко внутриглазное давление осуществляли следующую процедуру. Перед проведением интравитреальной инъекции делали парацентез (прокол) передней камеры и выпускали шпателем или иглой несколько капель внутриглазной жидкости. Тем самым мы уменьшали внутренний объем жидкости в глазу и могли вводить большое количество лекарств в стекловидное тело, не боясь повышения внутриглазного давления и без истечения препаратов из стекловидного тела наружу глаза.
Интраоперационное сопровождение факоэмульсификации с имплантацией искусственного хрусталика для купирования фибринозной воспалительной реакции в передней камере после операции – 4 собаки.
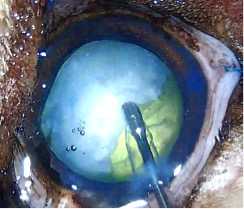
Рисунок 4. Ультразвуковая факоэмульсификация катаракты у собаки 5 лет с набухающей катарактой
Этим животным на завершающем этапе операции после имплантации интраокулярной линзы через роговичный разрез и отверстие в гаптической части ИОЛ в стекловидное тело вводили 0,05-0,1 мл триамцинолона с целью снижения послеоперационного фибринозного воспаления.
Техника интравитреальных инъекций
Манипуляция у всех животных осуществлялась под операционным микроскопом и ингляционной анестезией. В конъюнктивальную полость до инъекции закапывали анестетик алкаин 2 раза в течение 2 минут, затем в глаз закапывали офтальмоантибиотик ципровет или тобрекс.
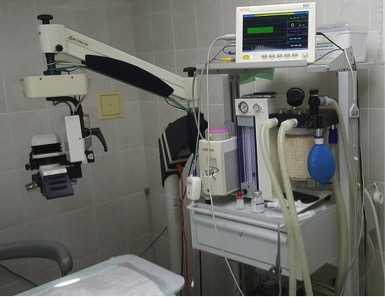
Рисунок 5. Интравитреальные инъекции проводились под операционным микроскопом и ингаляционной анестезией
В верхне-наружном сегменте глаза на расстоянии 5 мм от лимба у собак и 6 мм от лимба у кошек при помощи одноразового 1-мл шприца с размером иглы в 30G производился сквозной прокол склеры. В месте прокола конъюнктива несколько смещалась в сторону для предотвращения развития эндофтальмита. Расстояние от лимба до места инъекции размечалось специальным офтальмологическим циркулем.
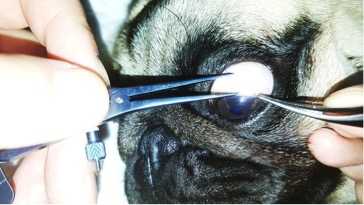
Рисунок 6. Разметка места интравитреальной инъекции с помощью офтальмологического циркуля
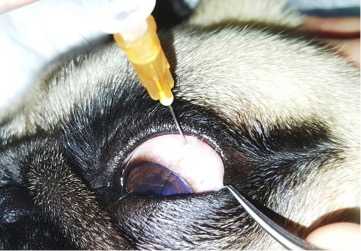
Рисунок 7. Техника интравитреальной инъекции
Это место анатомически соответствует плоской части цилиарного тела (pars plana) и является наиболее безопасным для инъекцией. При проколе склеры дальше 6 мм от лимба возможна отслойка сетчатки. Игла вводилась на глубину до 0,3-0,5 см под косым углом в направлении к центру стекловидного тела.
Правильная ориентация угла укола очень важна, при введении иглы под прямым углом возможна перфорация хрусталика и развитие травматической катаракты, особенно у кошек, имеющих сферофакичный большой хрусталик.
Рисунок 8. В стекловидное тело игла вводится под косым углом в направлении к центру стекловидного тела
Препараты в стекловидное тело вводили медленно. После извлечения иглы конъюнктива зажималась пинцетом в месте прокола на 1 минуту для предотвращения вытекания препарата под конъюнктиву.
Анализ результатов лечения
Интравитреальные инъекции показали себя полностью безопасной для глаза животного и достаточно простой манипуляцией. При их проведении у нас не отмечалось никаких осложнений и аллергических реакций. Перфорации хрусталика, развития токсической катаракты или тракционных отслоек сетчатки не было. Признаков воспаления после интравитреальной инъекции ни в передней камере, ни на глазном дне нами не выявлено. Влага передней камеры оставалась без изменений, радужная оболочка и цилиарное тело также не реагировали на введение препаратов. Токсические изменения со стороны сетчатки и зрительного нерва отсутствовали. У двух животных мы наблюдали единичные мелкие кровоизлияния на конъюнктиве в зоне инъекции, которые рассосались в течение 2-5 суток. Какие-либо другие изменения в тканях глаза не визуализировались. Небольшая офтальмогипертензия на фоне инъекций носила кратковременный транзиторный характер и на следующий день после инъекции цифры внутриглазного давления регистрировались в пределах нормы. Развития внутриглазных инфекций вследствие интравитреальных инъекций не было ни у одного животного. После интравиреальной инъекции триамцинолон у животных визуализировался как сгусток белого цвета в передней трети стекловидного тела. Через день-два дня после введения кристаллы стероида определялись, в основном, в нижнем сегменте стекловидного тела (вследствие большей силы тяжести и массы триамцинолона) в виде подвижного белого очага неправильной формы с четкими контурами. При биомикроскопии глаза на большом 16 кратном увеличении и максимальном освещении практически у всех животных четко визуализировалось уменьшающееся со временем диффузное осаждение кристаллов триамцинолона на волокнах стекловидного тела в виде белых несколько мутных образований или волокон. Стероидный сгусток имел медленную тенденцию к резорбции в течение нескольких месяцев с момента введения. У двух животных он так и не рассосался полностью при сроках наблюдения до 9 мес.
Терапевтическая эффективность данной методики составила чуть более 50%. У 7 из 13 животных произошло значительное улучшение клинической картины. Для таких изначально тяжелых и бесперспективных глаз данную эффективность мы считаем очень высокой. У 3 из 5 животных с односторонними иридоциклитами воспалительный процесс купировался полностью после однократной инъекции. Исчезли преципитаты с задней поверхности роговицы, отек и кровоизлияния на радужной оболочке. Резорбировался экссудат в передней камере, восстановилась прозрачность внутриглазной жидкости.
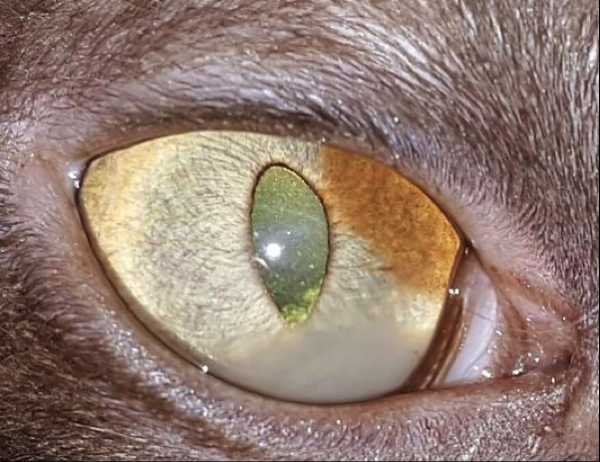
Рисунок 9. Глаз до лечения. Рецидивирующий вялотекущий односторонний увеит у кота сфинкса 5 лет невыясненной этиологии.
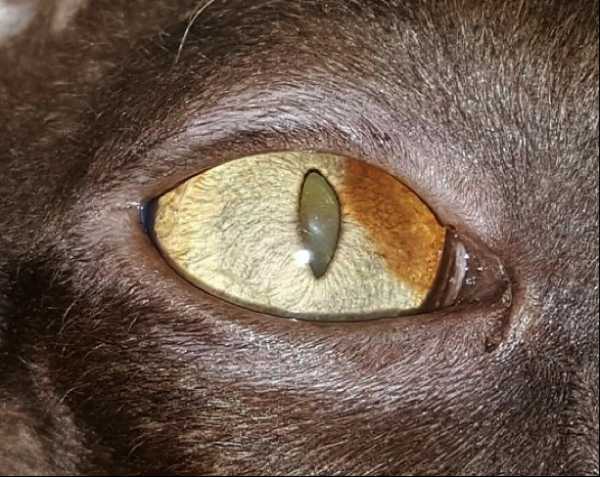
Рисунок 10. Глаз после проведения интравитреальной инъекции. Воспалительный процесс полностью исчез. Сроки наблюдения за животным – 11 мес.
Клиническое состояние всех этих глаз является стабильным, эффективность не снижается при сроках наблюдения до 11 мес.
У двух кошек с двухсторонними панувеитами на фоне подтверждённых вирусных инфекций в начале произошла некоторая положительная динамика процесса: частично резорбировался экссудат в передней камере, произошло снижение дилятации и кровенаполненности сосудов радужки. Однако эффект оказался нестойким и полностью исчез в течение 1,5 месяцев. В дальнейшем отрицательная динамика со стороны воспаления опять нарастала. Такой кратковременный эффект был, по-видимому, обусловлен прогрессирующим течением общего инфекционного заболевания и легко объясним.
При гемофтальмах и гифемах кровь постепенно рассосалась у одной собаки из двух в течение 10 дней. Стабилизация процесса произошла полностью и больше кровоизлияние не рецидивировало. У второй собаки на следующий день после инъекции произошло осложнение – свежее кровоизлияние в переднюю камеру высотой 5мм. Проведение дальнейших инъекций на фоне возникшего свежего кровоизлияния было признано нецелесообразным.
После факоэмульсификации катаракты с имплантацией искусственного хрусталика у 1 из 4 собак – 10-летней овчарки – через 21 день после операции факоэмульсификации с ИОЛ на фоне благополучного состояния глаза внезапно возникла вторичная глаукома. Насколько она связана с интравитреальной инъекцией кеналога, сказать достаточно сложно. У остальных 3 из 4 животных с интравитреальным введением триамцинолона фибринозное воспаление в передней камере было незначительным. Триамцинолон визуализировался за интраокулярной линзой в передней трети стекловидного тела в виде небольшого локального сгустка при длительном (до 8 месяцев) периоде наблюдения и рассасывался достаточно медленно.
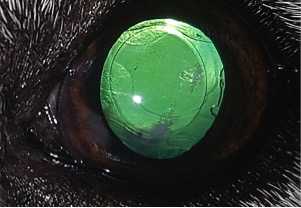
Рисунок 11. Глаз собаки хаски через 1,5 мес. после факоэмулсификации катаракты с имплантацией хрусталика и интравитреальным введением триамцинолона. Триамцинолон четко визуализируется в виде белого небольшого сгустка за искуственным хрусталиком в нижней части
Хочется отметить, что введение триамцинолона в стекловидное тело при факоэмульсификации катаракты у животных несколько уменьшает фибринозную увеальную реакцию, но, к сожалению, полностью проблему фибрина в послеоперационном периоде не решает.
Заключение
Интравитреальные инъекции являются совершенно новым, интересным и перспективным способом лечения многих заболеваний заднего отрезка глаза: хориоретинитов, панувеитов, гемофтальмов, иридоциклитов. Преимуществом интравитреальных инъекций перед всеми другими методами лечения этих патологий является безопасность и быстрая «адресная» доставка лекарственных препаратов непосредственно к пораженным тканям в обход гематоофтальмического барьера. Метод показал высокие и длительные клинические результаты даже на самых сложных и бесперспективных глазах.
Сама техника интравитреальных инъекций достаточно проста в выполнении, не требует специальной аппаратуры или подготовки врача. При их проведении осложнений, воспалительных процессов, длительного повышения внутриглазного давления и аллергических реакций не наблюдалось.
Процедура экономически малозатратна для владельцев животных, что тоже немаловажно. Мы пока не знаем всех границ и возможностей интравитреальных инъекций, но будем их серьезно изучать в наших дальнейших исследованиях.
Список литературы
1. С. Э. Аветистов, В. П. Еричев, М. В. Будзинская, М. А. Карпилова, И. В. Гурова, И. В. Щеголева, Е. А. Чикун. Возрастная макулярная дегенерация и глаукома: мониторинг внутриглазного давления после интравитреальных инъекций. ФГБУ «Научно-исследовательский институт глазных болезней» РАМН, Москва
2. Амир, Али Азим Заде Гоми. Автореферат кандидатской диссертации. Интравитреальное введение кеналога в лечении макулярного отека при диабетической ретинопатии. Москва 2011.
3. Балашевич Л. И., Гацу М. В., Байбородов Я. В. Эффективность интравитреального введения кеналога при лечении рефрактерного диффузного диабетического макулярного отека осложненного наличием твердых экссудатов // Офтальмохирургия. 2006. - № 2 . - С. 25-29.
4. Беспалова Т. О., Артюшина Ю. Ю., Олейник В. В., Ротанов Д. А., Пудовкина Т. Н., научный консультант Шилкин А. Г. Опыт применения фибринолитических ферментов в ветеринарной офтальмологии. Центр ветеринарной офтальмологии доктора Шилкина А. Г. Москва 2008.
5. Вартанян А. Г., Абгарян Л. В. ЕГМУ им. М. Гераци, кафедра глазных болезней Офтальмологический центр им. С. В. Малаяна. Наш опыт интравитреального применения авастина у больных с различными видами макулярного отека. Вопросы теоретической и клинической медицины, 2 – 2008.
6. Гильманшин Т. Р. Интравитреальное введение кеналога в витреоретинальной хирургии (экспериментально-клиническое обоснование). Автореферат кандидатской диссертации. Москва 2008.
7. Егоров Е. А., Лопухина И. Ю. Применение триамцинолона ацетонида (Кеналог-40) для лечения заболеваний глаз. // Офтальм. журн. 1980. - № 4. -С. 212-21.
8. Захаров В. Д. Витреоретинальная хирургия. М., 2003. - С.157 -165.
9. Шилкин А. Г. Интравитреальные инъекции у животных. Москва 2014 г..
10. Aaberg Т. М., Van Horn D. L. Late complications of pars plana vitreous surgery// Ophthalmology. 1978. - Vol. 85. - P. 126-140.
11. Albini Т. A., Abd-El-Barr M. M., Carvounis P. E. et al. Long-term retinal toxicity of intravitreal commercially available preserved triamcinolone acetonide (Kenalog) in rabbit eyes // Invest. Ophthalmol. Vis. Sci. 2007. - Vol. 48, № 1. -P. 390-395.
12. Antoszyle A. N., Gothlief J. L. The effects of intravitreal triamsinalone acetonide on experimental pre-retinal novascularisation Graefes Arch Clin. Exp. Ophthalmol. 1993;231:34- 40.
13. Choi Y. J., Oh I. K., Oh J. R., Huh K. Intravitreal versus posterior subtenon injection of triamcinolone acetonide for diabetic macular edema // Korean J. Ophthalmology. 2006. V. 20. P. 205-209.
14. Danis R. P, Biugman D. P. Yang Y., Hadd. H. Juhibition of preretinal and optic nerve head neovascularisation in pigs by intravitreal triamcinalone acetonide. Ophthalmology. 1996; 103:2099-2104.
15. Smith T. J., Pearson P. A., Blandford D. L., Brown J. D. et al. Intravitreal sustained-release ganciclovir // Archives of Ophthalmology. 1992. V. 2 (110). P. 255-258.
16. Hu M., Huang G., Karasina F., Wong V. G. Verisome, a novel injectable, sustained release, biodegradable, intraocular drug delivery system and triamcinolone acetonide // Investigative Ophthalmology and Visual Science. N. Y. 2008. V. 49.
17. Tan D. T. H., Chee S. P., Lim L., Lim A. S. M. Randomized clinical trial of a new dexamethasone delivery system (Surodex) for treatment of post-cataract surgery inflammation // Ophthalmology. 1999. № 2 (106). P. 223-231.
18. Tano Y. Chaudler D., Machemer R. Treatment of intraocular proliferation with intravitreal injection of triamcinalone acetonide. Am J. Ophthalmology 1980; 90; 810-816..
19. T. Yamamoto, M. Kamei, K. Sayanagi, et al. Simultaneous intravitreal injection of triamcinolone acetonide and tissue plasminogen activator for central retinal vein occlusion: a pilot study // Br. J. Ophthalmol.- 2011.- Vol. 95.- P. 69-73.
Автор статьи: Шилкин А. Г., микрохирург-офтальмолог, кандидат медицинских наук, руководитель центра ветеринарной офтальмологии доктора Шилкина А. Г.
1. С. Э. Аветистов, В. П. Еричев, М. В. Будзинская, М. А. Карпилова, И. В. Гурова, И. В. Щеголева, Е. А. Чикун
Возрастная макулярная дегенерация и глаукома: мониторинг внутриглазного давления после интравитреальных инъекций.
ФГБУ «Научно-исследовательский институт глазных болезней» РАМН, Москва
2. Амир, Али Азим Заде Гоми. Автореферат кандидатской диссертации. Интравитреальное введение кеналога в лечении макулярного отека при диабетической ретинопатии. Москва 2011.
3. Балашевич Л. И., Гацу М. В., Байбородов Я. В. Эффективность интравитреального введения кеналога при лечении рефрактерного диффузного диабетического макулярного отека осложненного наличием твердых экссудатов // Офтальмохирургия. 2006. - № 2 . - С. 25-29.
4. Беспалова Т. О., Артюшина Ю. Ю., Олейник В. В., Ротанов Д. А., Пудовкина Т. Н., научный консультант Шилкин А. Г.
Опыт применения фибринолитических ферментов в ветеринарной офтальмологии. Центр ветеринарной офтальмологии доктора Шилкина А. Г. Москва 2008.
5. Вартанян А. Г., Абгарян Л. В. ЕГМУ им. М. Гераци, кафедра глазных болезней Офтальмологический центр им. С. В. Малаяна
Наш опыт интравитреального применения авастина у больных с различными видами макулярного отека. Вопросы теоретической и клинической медицины, 2 – 2008.
6. Гильманшин Т. Р. Интравитреальное введение кеналога в витреоретинальной хирургии (экспериментально-клиническое обоснование). Автореферат кандидатской диссертации. Москва 2008.
7. Егоров Е. А., Лопухина И. Ю. Применение триамцинолона ацетонида (Кеналог-40) для лечения заболеваний глаз. // Офтальм. журн. 1980. - № 4. -С. 212-21.
8. Захаров В. Д. Витреоретинальная хирургия. М., 2003. - С.157 -165.
9. Шилкин А. Г. Интравитреальные инъекции у животных. Москва 2014 г..
10. Aaberg Т. М., Van Horn D. L. Late complications of pars plana vitreous surgery// Ophthalmology. 1978. - Vol. 85. - P. 126-140.
11. Albini Т. A., Abd-El-Barr M. M., Carvounis P. E. et al. Long-term retinal toxicity of intravitreal commercially available preserved triamcinolone acetonide (Kenalog) in rabbit eyes // Invest. Ophthalmol. Vis. Sci. 2007. - Vol. 48, № 1. -P. 390-395.
12. Antoszyle A. N., Gothlief J. L. The effects of intravitreal triamsinalone acetonide on experimental pre-retinal novascularisation Graefes Arch Clin. Exp. Ophthalmol. 1993;231:34- 40.
13. Choi Y. J., Oh I. K., Oh J. R., Huh K. Intravitreal versus posterior subtenon injection of triamcinolone acetonide for diabetic macular edema // Korean J. Ophthalmology. 2006. V. 20. P. 205-209.
14. Danis R. P, Biugman D. P. Yang Y., Hadd. H. Juhibition of preretinal and optic nerve head neovascularisation in pigs by intravitreal triamcinalone acetonide. Ophthalmology. 1996; 103:2099-2104.
15. Smith T. J., Pearson P. A., Blandford D. L., Brown J. D. et al. Intravitreal sustained-release ganciclovir // Archives of Ophthalmology. 1992. V. 2 (110). P. 255-258.
16. Hu M., Huang G., Karasina F., Wong V. G. Verisome, a novel injectable, sustained release, biodegradable, intraocular drug delivery system and triamcinolone acetonide // Investigative Ophthalmology and Visual Science. N. Y. 2008. V. 49.
17. Tan D. T. H., Chee S. P., Lim L., Lim A. S. M. Randomized clinical trial of a new dexamethasone delivery system (Surodex) for treatment of post-cataract surgery inflammation // Ophthalmology. 1999. № 2 (106). P. 223-231.
18. Tano Y. Chaudler D., Machemer R. Treatment of intraocular proliferation with intravitreal injection of triamcinalone acetonide. Am J. Ophthalmology 1980; 90; 810-816..
19. T. Yamamoto, M. Kamei, K. Sayanagi, et al. Simultaneous intravitreal injection of triamcinolone acetonide and tissue plasminogen activator for central retinal vein occlusion: a pilot study // Br. J. Ophthalmol.- 2011.- Vol. 95.- P. 69-73.
Автор статьи: Шилкин А. Г., микрохирург-офтальмолог, кандидат медицинских наук, руководитель центра ветеринарной офтальмологии доктора Шилкина А. Г.
Пациентам, которым проведено интравитреальное введение препарата
В день операции:
- Снять повязку с оперированного глаза, после того, как приедете домой. Повторно никаких повязок не накладывать.
- После снятия повязки закапать капли: Тобрадекс , через 5 минут Индоколлир. Закапывать капли каждые два часа – по 1-2 капли каждого препарата. Последнее закапывание перед сном. Ночью капли не капать.
- Пациентам с глаукомой продолжать закапывание назначенных капель для снижения внутриглазного давления в обычном режиме
- Спать на спине или на боку неоперированного глаза (первую ночь)
После операции могут развиться следующие симптомы:
- Слезотечение
- Чувство инородного тела в глазу.
- Перед глазом могут появиться плавающее помутнение или пузырьки от введенного лекарства
- При болях принять таблетку Баралгина (или другого анальгетика), в случае отсутствия аллергических реакций на указанные препараты.
Послеоперационный период
- Необходимо явиться на контрольный осмотр в назначенное время на следующий день после операции. Точное время Вам скажет администратор
- Закапывать капли: Тобрадекс, через 5 минут Индоколлир по 1 капле 4 раза в день в течение 7 дней.
- Не рекомендуем длительное нахождение на улице в течение трех дней после операции, чтобы избежать простуды и других вирусных заболеваний. (За исключением визита к доктору)
- Все препараты, назначенные терапевтом, кардиологом, эндокринологом или другими врачами следует принимать в соответствии с рекомендациями.
- Восстановительный период длится в течение месяца, по истечении которого Вам необходимо явиться на контрольный осмотр, выполнить ОКТ (OCT) сетчатки глаза (снимки платные, просим это учесть при записи на прием к Вашему лечащему врачу) для определения дальнейшей тактики лечения или дополнительного введения препарата.
- Ограничения на занятия физическими нагрузками полностью снимаются через 1 месяц.
При возникновении вопросов, выраженного дискомфорта или болей звонить по телефону горячей линии +7 499 499-45-49
Интравитреальная инъекция. Показания и результат.
Содержание статьи:
- В каких случаях применяют интравитреальные инъекции
- Какой результат дают инъекции
Этот вид инъекций предполагает введение лекарственного вещества непосредственно в стекловидное тело.
В клинике «Окулюс» инъекции проводятся квалифицированным офтальмологом с соблюдением строгих требований стерильности при помощи специального инструментария. Весь процесс занимает около 6 минут и проходит безболезненно.
В каких случаях применяют интравитреальные инъекции
Показаниями к проведению подобных манипуляций являются диабетическая ретинопатия, возрастная макулярная дегенерация, болезни, связанные с воспалительными процессами глаз.
Все эти заболевания сопровождаются поражением кровеносных сосудов, вследствие чего нарушается полноценное питание тканей. Также происходит формирование аномальных сосудов, дающих утечку жидкости в макулу. Медикаменты, которые применяются в ходе интравитреальных инъекций, притормаживают рост патологических сосудов и препятствуют возникновению кровотечения и утечке глазной жидкости.
Эффективным методом лечения в настоящее время считается анти-VEGF-терапия. VEGF – это инновационный препарат, который воздействует на эндотелиальную сосудистую ткань, подавляя рост слабых и патологических сосудов. Воздействуя именно на это физиологическое звено, VEGF позволяет успешно бороться с макулярной дегенерацией влажной формы.
Какой результат дают инъекции
Традиционные методы лечения, к примеру, лазерная терапия, направлены прежде всего на стабилизацию состояния пациента. В большинстве случаев они не способны улучшить зрение, а лишь предотвращают дальнейшее его ухудшение.
Интравитреальные инъекции с применением инновационных препаратов позволяют добиться улучшения зрения у каждого второго пациента, а у девяти из десяти больных предотвращают прогрессирование болезни.
Успешность терапии зависит от давности поражения и его размера. Иногда назначаются повторные инъекционные манипуляции для закрепления результата.
Обычно лечение считается успешным, когда зрение хотя бы перестает ухудшаться, при условии, что пациент регулярно посещает врача и проходит повторные лечебные процедуры при необходимости.
«Лучшее лечение – это профилактика!» Если вести здоровый образ жизни и регулярно посещать офтальмолога, шанс сохранить зрение до глубокой старости значительно увеличивается.
Хорошего вам зрения в любом возрасте!
Интравитреальные инъекции сетчатки в Екатеринбурге
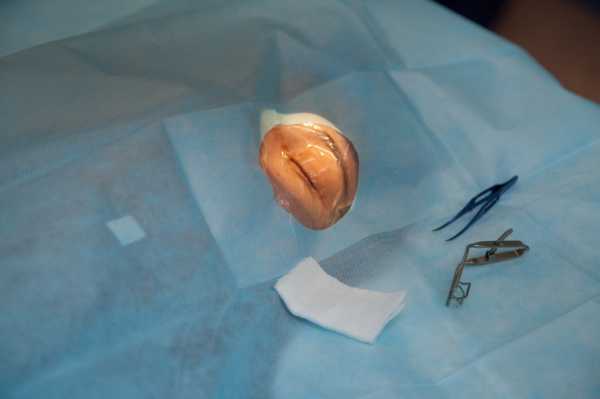
Одним из эффективных и малотравматичных методов лечения многих заболеваний органа зрения является интравитреальные инъекции. Он заключается в введении препарата непосредственно в стекновидное тело глаза, что позволяет добиться максимальной эффективности. Этот метод применяется для лечения макулярного отека, заболеваниях сосудов сетчатки, кровоизлияний, воспалительных процессов, макулярной дегенерации и др.Выполнение операции
Данный метод лечения достаточно сложен, поэтому выполнять процедуру лучше только опытному офтальмохирургу. Интравитреальные иньекции проводятся только в условиях операционной под контролем операционного микроскопа и являются витреоретинальной операцией.
Для обеспечения безболезненного введения препарата применяется местная анестезия в виде капель. Помимо офтальмохирурга в операционной должен присутствовать анестезиолог, который на протяжении всей операции следит за жизненными функциями пациента.
На первом этапе в глаз устанавливается векорасширитель, после чего при помощи глазного метчика определяется точное место прокола. Далее препарат вводят сквозь конъюнктиву и склеру прямо в стекловидное тело глаза.
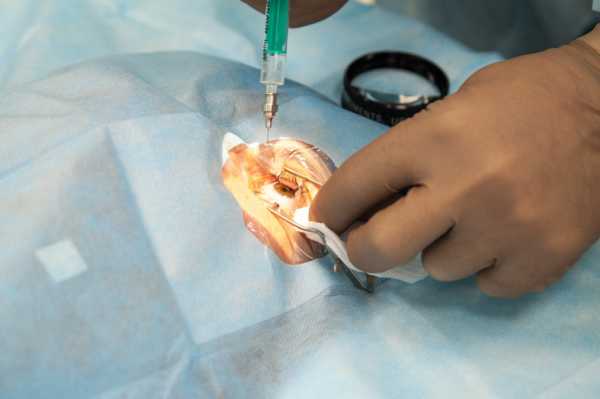
Точное определение место прокола и соблюдение техники его выполнения позволяют предотвратить осложнения в послеоперационный период.
После инъекции проводится измерение внутриглазного давления и назначаются капли антибактериального и противовоспалительного действия.
Интравитреальное введение препарата Луцентис

Для лечения макулярного отека и макулодистрофии уже многие годы применяют препарат Луцентис.
Ранибизумаб – действующее вещество препарата, обладающее уникальными свойствами снижения роста патологических сосудов сетчатки при возрастной макулодистрофии и нормализации толщины сетчатки при макулярном отеке. После введения Луцентис проникает напрямую во все слои сетчатки и воздействует на пораженную область и останавливает прогрессирование патологии. После воздействия препарата макулярный отек уменьшается, исключаются дальнейшие кровоизлияния в сетчатку и увеличение пораженной области.
Эффективность и безопасность Луцентис обусловлена тем, что он был создан специально для решения офтальмологических проблем определенного спектра.
После прохождения полного обследования зрительной системы и подтверждения офтальмологом необходимости применения интравитреального введения Луцентис. В большинстве случаев для нормальзации ситуации необходимо пройти курс процедур, состоящий из 3 инъекций препарата. Врач составляет индивидуальный график процедур по введению препарата и прогнозирует результат этого лечения. Введение Луцентис осуществляется 1 раз в месяц. После обследования результатов лечения количество инъекций может быть увеличено, а после прохождения всего курса необходимо регулярно контролировать состояние здоровья своих глаз и посещать офтальмолога минимум 1 раз в 6 месяцев.
Стоимость интравитреального введения препарата Луцентис в «Клинике микрохирургии «Глаз» имени академика С.Н. Федорова»
Интравитреальное введение Эйлеа
Самый современный препарат для решения проблем макулярного отека и макулодегенерации является Эйлеа. Его инъекции в России стали применять лишь в 2016 году. Его активное вещество афлиберцепт обладает свойствами снижения роста патологических состудов и выведения жидкости при макулярном отеке. В отличае от Луцентис Эйлеа обладает более продолжительным действием, что позволяет проводить инъекции реже. Также этот препарат помогает при любой форме макулодистрофии, как влажно, так и сухой и эффективен при отеке макулы.
В препарате молекулы действующего вещества действуют как «ловушка», сращиваясь с молекулами не только эндотелиального фактора роста сосудов (VEGF), а также плацентарного фактора роста (PIFG).
Как и при лечении препаратом Луцентис, при назначении Эйлеа составляется индивидуальный график инъекций, состоящий из 3 уколов. Процедуры проводятся 1 раз в 2 месяца, а при нормализации ситуации перерыв может быть увеличен лечащим врачом-офтальмологом.
Стоимость интравитреального введения препарата Эйлеа в клинике микрохирургии «Глаз» имени академика С.Н. Федорова»
Интравитреальная инъекция препарата Озурдекс

Одним из самых эффективных методов лечения макулярного отека является интравитреальное введение препарата Озурдекс.
Озурдекс - это имплантат с высоким содержанием действующего вещества Дексаметазонта, который вводится в стекловидное тело.
Действующее вещество в Озурдекс имеет необычный метод воздействия на поррежденный участок – оно выделяется небольшими порциями, благодаря чему длительность эффекта от лечения значительно увеличивается.
Данный препарат не только устраняет проблему макулярного отека, но и воздействует на его причину, что позволяет исключить или значительно снизить риск проявления рецидива заболевания, а также обладает противовоспалительным действием, что
Для лечения макуларного отека достаточно всего 1 инъекции препарата Озурдекс. После процедуры имплант действует полтора месяца, а лечебный эффект длится до 6 месяцев. При комплексной терапии макулярного отека может быть назначена лазеркоагуляция сетчатки.
Стоимость интравитреального введения препарата Озурдекс в клинике микрохирургии «Глаз» имени академика С.Н. Федорова»
В «Клинике микрохирургии «Глаз» имени академика С.Н. Федорова» выполняются инъекции всех перечисленных препаратов. График проведения процедур подбирается индивидуально для каждого пациента после полного обследования зрительной системы.
Основной задачей специалистов «Клиники микрохирургии «Глаз» имени академика С.Н. Федорова» при работе с пациентами, страдающими возрастной макулодистрафией и макулярным отеком — предотвратить слепоту и восстановить зрение. В нашей клинике мы применяем самые современные и эффективные методы лечения этих заболеваний.
Интраназально это как?
В настоящее время медики стали использовать новый метод введения лекарственного препарата — интраназальный(через нос).
Раньше такой способ также применялся, но только для введения противовоспалительных препаратов и исключительно для местного лечения ринита. На данном этапе развития в медицине начали более активно использовать именно интраназальный способ введения медикаментов для лечения многих болезней, в том числе — остеопороза, мигрени, конъюнктивитов, а также воспалительных процессов, протекающих в носоглотке. Кроме того, в данный момент применяется интраназальная вакцинация.
Форма выпуска

Интраназальное введение осуществляется при помощи спреев, которые могут выпускаться в виде баллончика с дозатором, содержащим сжатый воздух. Последним нововведением стал выпуск баллончика, снабженного активной помпой-пульверизатором. Подобная форма выпуска препарата очень удобна, ведь таким образом можно предельно точно контролировать дозировку. Помимо этого, лекарство полностью орошает слизистую оболочку носа, что позволяет добиться его максимального фармакологического действия. Все перечисленные доводы обусловливают тот факт, что спрей является наиболее предпочтительной формой интраназальных препаратов.
Ограничением по применению подобных спреев является возраст до 2 лет.
Форма выпуска препаратов, вводимых интраназально, не ограничивается лишь спреями и включает сюда мази и капли.
Выбор формы выпуска препарата зависит непосредственно от заболевания. В любом случае, данный вопрос необходимо обсудить с лечащим врачом.
Преимущества и недостатки
Из преимуществ можно отметить, что при помощи такого метода введения лекарственное вещество не участвует непосредственно в первичном метаболизме печени. Это происходит потому, что препарат вводится через носовую полость, которая обогащена кровеносными сосудами, благодаря чему необходимая доза препарата быстро поступает в кровь. Также из преимуществ стоит отметить, что это – довольно безопасный метод, ведь при интраназальном введении не травмируется слизистая оболочка в носовой полости.
Простота использования фармацевтического препарата – еще одно несомненное преимущество интраназального способа введения, что особенно актуально для категории пациентов, проходящих этап лечения в домашних условиях.
Недостатки
- Что касается недостатков этого способа, то необходимо отметить фактор биодоступности. Физиология полости носа сложна и имеет свои индивидуальные особенности. Тем самым возникает потребность в разной биодоступности действующего вещества у каждого отдельного пациента.
- Второй недостаток заключается в таких побочных эффектах, как развитие местных реакций: появление раздражений на слизистой оболочке носа, возникновение синуситов, ринитов или полная потеря обоняния. Однако это в большей степени зависит не от метода введения как такового, а от лекарственного препарата (его состава, дозировки, длительности курса).
- Также стоит отметить, что если вводить лекарственное средство интраназальным путем, то оно достаточно быстро всасывается в слизистую оболочку. Этим фактом обусловливается невозможность долгосрочного применения такого метода в терапевтических целях.
Препараты, которые могут вводиться интраназально
Интраназальный способ введения возможен при применении следующих групп препаратов:
- противоаллергических;
- сосудосуживающих;
- антибиотических;
- гормональных;
- противогормональных;
- противовирусных;
- наркотических анальгетиков;
- психостимуляторов;
- ноотропов;
- корректоров обмена веществ костной и хрящевой ткани;
- иммуностимуляторов.
Особенности интраназальной вакцинации
Одним из методов введения вакцин является интраназальный, или аэрозольный. Техника подобной вакцинации подразумевает распыление вакцины в носовых ходах при помощи специального устройства. Также в этих целях могут применяться капли. Медики считают, что данный способ позволяет создать иммунологический барьер на слизистых оболочках, повышая устойчивость организма к инфекциям, передающимся воздушно-капельным путем.
Тем не менее, такой способ имеет и недостатки. В частности, это недостаточность иммунитета для борьбы с инфекциями, которые уже проникли через слизистые оболочки верхних дыхательных путей. К недостаткам также относят существенный разлив препарата при непосредственной вакцинации.
Меры предосторожности
Несмотря на то, что препараты с интраназальным способом введения не требуют особых умений и дополнительных препаратов, нужно помнить, что само лекарственное средство может быть непереносимо для тех или иных пациентов. Например, многие препараты с данной формой выпуска рекомендуют использовать предельно осторожно тем лицам, которые предрасположены к аллергическим реакциям.
Само собой разумеется, что дозировка и длительность применения этих препаратов должна назначаться и контролироваться врачом.
Еще один немаловажный показатель – совместимость лекарственных средств. Часто возникают ситуации, когда показан одновременный прием различных по характеру фармацевтических продуктов. В таком случае необходимо проконсультироваться со специалистом и выяснить, не окажет ли такой прием неблагоприятного воздействия на организм, сказавшись на работе органов и систем организма.
Наш опыт интравитреального применения авастина у больных с различными видами макулярного отека
Наш опыт интравитреального применения авастина у больных с различными видами макулярного отека
Экссудативные заболевания желтого пятна являются одной из причин стойкого снижения или потери зрения у людей. К сожалению, различные методы лазерного лечения только у 15-20% больных с хроническим отеком макулы приводят к положительному результату. У многих пациентов с невыраженной или слабовыраженной субфовеальной мембраной фотолазеркоагуляция неэффективна. И только у больных с классической формой субретинальных неоваскулярных мембран фотодинамическая терапия показана и может дать временный эффект (1). Многие исследователи стали искать альтернативные методы лечения макулярных отеков. Было показано, что многие кортикостероиды, в том числе и триамцинолон, являются эффективными ингибиторами неоваскуляризации на моделях животных (2,3,4). Многие офтальмологи начали применять интравитреальные инъекции триамцинолона у больных с экссудативной возрастной макулодистрофией с целью ингибиции неоваскулярных сосудов и предотвращения субретинальных неоваскулярных мембран (5,6). Авторы отмечают временное улучшение зрения до 3 месяцев. Однако. наряду с положительным эффектом этого лечения, у 30-40% больных было выявлено повышение ВГД до 35- 40мм рт. ст., а также прогрессирование катаракты. Учитывая вышеизложенное, целью нашей работы явилось исследование эффективности интравитреальной иньекции препарата авастин, который по данным некоторых авторов дает очень хорошие результаты у больных с макулярным отеком.
Авастин(Вепа^итаЬ) является ангиоингибитором и используется для лечения рака прямой и толстой кишок. За последние несколько лет применение авастина в виде интравитреальных инъекций получил широкий размах. Многие офтальмологи отмечают высокую эффективность при лечении макулодистрофии экссудативной формы.
Но пока в доступной нам литературе мы не нашли публикаций по данной теме. Механизм действия авастина - ангиоингибиция, он вызывает обратное развитие неоваскулярных сосудов и тормозит образование фиброваскулярной ткани. Нами оценена эффективность интравитреального введения 1,25 мг авастина у 60 больных.
Материал и методы
60 пациентов с симптомами понижения зрения 3и более месяцев и с наличием макулярного отека были взяты в группы наблюдения и лечения в V отделении офтальмологического центра им С. В. Малаяна. 44 из них с диагнозом диабетическая макулопатия (I группа), 11 с диагнозом возрастная макулодистрофия экссудативной формы (II группа) и 5 с диагнозом постромботическая макулопатия (III группа).
Всем больным при каждом визите произведена визиометрия по таблице Сивцева, обследование переднего отрезка глаза щелевой лампой “Торсоп”, обратная офтальмоскопия с применением офтальмоскопа фирмы “Heine”, тонометрия по Маклакову. ОСТ (оптическая когерентная томография) проводилась до лечения и через 1,3,6 месяцев. Всем пациентам была произведена интравитреальная инъекция 1,25 мг авастина.
Техника интравитреальной инъекции
В конъюнктивальную полость до инъекции закапывали 0,5% раствор тетракаина 2-3 раза в течение 3минут, затем в глаз закапывали 5% раствор бетади- на, после чего вставляли векорасширитель. На расстоянии 4мм от лимба, при помощи одноразового 0.5мл шприца с размером иглы в 30G, интравитреально медленно (3-4 сек.) вводился 1,25 мг раствора авастина. После завершения инъекции в конъюнктивальную полость закапывался 5% раствор бетадина и производился легкий масаж глазного яблока с целью нормализации ВГД (1-2 мин). После чего производили осмотр глазного дна до полного возобновления циркуляции ретинальных сосудов. Для профилактики воспалительного процесса больным назначались противовоспалительные капли на 7 дней. Больные обследовались на следующий день после инъекции, через 7 дней, 30 дней, 60 дней и на 90-ый день.
Результаты исследования
Пациенты, получившие интравитреальную инъекцию авастина, отмечали минимальный дискомфорт после процедуры, иногда в течение нескольких минут затуманивание зрения. Ни один больной не нуждался в проведении парацентеза. Циркуляция в ретинальных сосудах восстанавливалась в течение 5-6 минут.
У 7 больных выявлено прогрессирование на-чальной катаракты в ходе наблюдения. Развитие офтальмогипертензии не наблюдалось ни у одного больного.
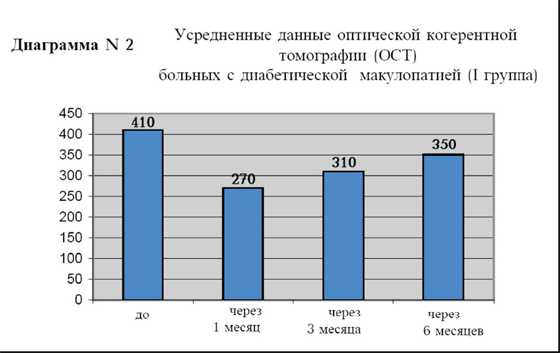
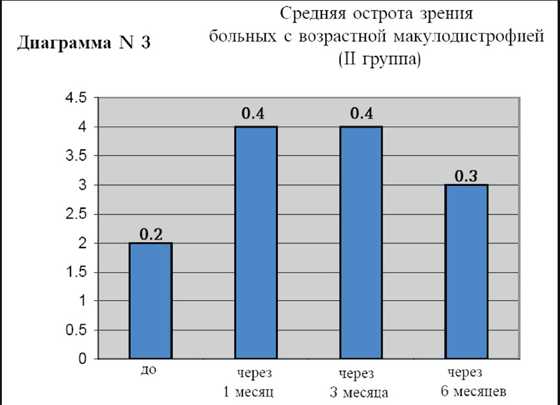
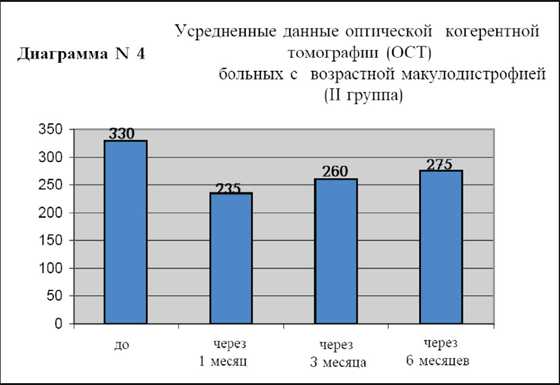
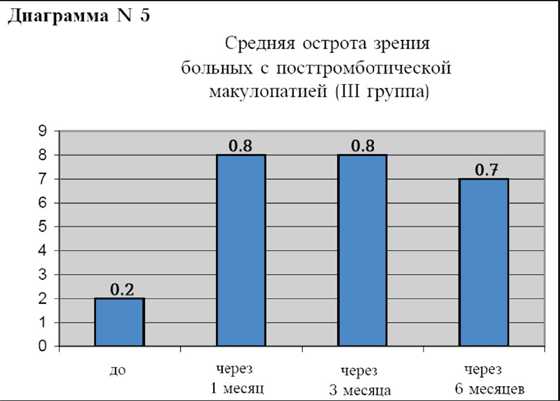
Острота зрения больных до и после интравитреальной инъекции авастина по группам представлена на диаграммах N 1,3,5. Результаты данных ОСТ до и после интравитреальной иньекции авастина по группам представлены на диаграммах N 2,4,6.
Частота повторных инъекций составила 65%. В группе пациентов с диабетической ретинопатией (I группа) средний исходный уровень остроты зрения с коррекцией составил 0.2 (диаграмма N1). Через 1 месяц он улучшился до 0.6, через 3 месяца острота зрения составила 0.4, а через 6 месяцев 0.3. Исходная толщина фовеальной зоны сетчатки у этих больных (диаграмма N2) в среднем составила 410 мкм, через 1 месяц 270 мкм, через 3 месяца 310 мкм, а через 6 месяцев 350 мкм.
В группе пациентов с возрастной экссудативной макулодистрофией (II группа) средний исходный уровень остроты зрения с коррекцией составил 0.2, через 1 месяц 0.4, через 3 месяца острота зрения осталась прежней 0.4 и через 6 месяцев острота зрения составила 0.3 (диаграмма N3). Исходная толщина фовеальной зоны сетчатки у этой группы больных (диаграмма N4) в среднем составила 330 мкм, через 1месяц 235 мкм, через 3 месяца 260 мкм, а через 6 месяцев 275 мкм.
 |
 |
 |
 |
 |
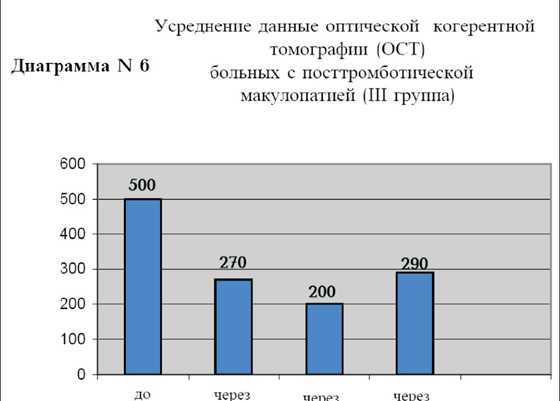 |
И наконец, в III группе больных с посттромботической макулопатией исходный средний уровень остроты зрения с коррекцией составил 0.2, через 1 месяц 0.8, через 3 месяца острота зрения снова 0.8 и через 6 месяцев острота зрения составила 0.7 (диаграмма N5). Исходная толщина фовеальной зоны сетчатки у этой группы больных (диаграмма N6) в среднем составила 500 мкм, через 1 месяц после инъекции 270 мкм, через 3 месяца 200 мкм, а через 6 месяцев 290 мкм.
Заключение
Наши исследования показали, что интравитреальная инъекция ингибитора эндотелиального сосудистого роста авастина в дозе 1.25 мг у больных I и II групп привела в первые месяцы к значительному улучшению зрения. Толщина фовеальной зоны сетчатки составила в I группе 410 мкм до инъекции и 350мкм через 6 месяцев. Во II группе соответственно 330 мкм до и 275 мкм через 6 месяцев.
Исходя из вышеизложенного, можно с уверенностью сказать, что у этих больных заболевание не прогрессировало и имело место улучшение остроты зрения в среднем на одну десятую и уменьшение толщины фовеальной области сетчатки в среднем на 50-60 мкм.
Однако у больных с посттромботической макулопатией (III группа) мы наблюдали значительное улучшение остроты зрения в среднем до 0.7-0.8 и уменьшение толщины фовеи почти в два раза, с 500 мкм до 270 мкм.
Из осложнений можно отметить прогрессирование начальной катаракты у 7 больных (только в I группе). Других осложнений мы не наблюдали.
Таким образом интравитреальная инъекция 1.25 мг препарата авастин у больных всех групп привела к стабилизации и улучшению остроты зрения, а так же к уменьшению толщины фовеальной области сетчатки в той или иной степени.
Список литературы
- Top study Group Photodynamic therapy of subfoveal choroidal neovascularization in age related macular degeneration with verteporfin. Arch Ophthalmol. 1999: 117:1329-1345.
- Danis R.P, Biugman D.P. Yang Y., Hadd. H. Juhibition of preretinal and optic nerve head neovascularisation in pigs by intravitreal triamcinalone acetonide. Ophthalmology. 1996; 103:2099-2104.
- Tano Y. Chaudler D., Machemer R. Treatment of intraocular proliferation with intravitreal injection of triamcinalone acetonide. Am J. Ophthalmology 1980; 90; 810-816.
- Antoszyle A.N., Gothlief J.L.
- The effects of intravitreal triamsinalone acetonide on experimental pre-retinal neovascularisation Graefes Arch Clin. Exp. Ophthalmol. 1993;231:34- 40.
- Penfold P., Cyory J. Hunyor A., Billson F. Exudative macular degeneration and intravitreal triamcimalone: a pilot study, Aust N.Z. J. Ophthalmol. 1995:23:293-298
- Challa J.K. Gillies M. C., Penfold P.L. at al. Exudative macular degeneration and intravitreal triamcinalone: 18 month follow up. Aust N.Z. J Ophthalmol. 1998;26:277-281
21.07.2008 4198 Показ
Автор. Вартанян А.Г., Абгарян Л.В. ЕГМУ им. М. Гераци, кафедра глазных болезней Офтальмологический центр им. С.В. Малаяна
Источник. Вопросы теоретической и клинической медицины 2.2008
Информация. med-practic.comАвторские права на статью (при отметке другого источника - электронной версии) принадлежат сайту www.med-practic.com
Новые технологии:интраназальный путь введения | Еженедельник АПТЕКА
|
Интраназальный способ введения лекарственных средств в настоящее время становится «модным» и все более распространенным. Он не является принципиально новым, на протяжении многих лет этот путь использовали для введения противовоспалительных средств при местном лечении ринитов. Однако сейчас нос рассматривают как удобный путь доставки в организм многих лекарственных средств, включая вакцины, препараты для лечения остеопороза, мигрени, сексуальных расстройств и даже инсулин.
Метод имеет свои преимущества…
Право метода на существование было доказано в середине 80-х годов минувшего столетия. Как оказалось, интраназальная форма препарата кальцитонин, используемого для лечения болезни Педжета, по эффективности не уступает лекарственной форме для внутримышечного введения, но имеет меньше побочных эффектов. Такой способ введения является наиболее подходящим для препаратов, которые выпускаются только в форме инъекционных растворов. Лекарственное вещество не участвует в первичном метаболизме в печени, так как через богатый кровеносными сосудами эпителий носовой полости оно поступает непосредственно в кровь. Кроме того, этот путь введения менее травматичен и трудоемок по сравнению с инъекционным, что позволяет повысить комплаентность пациентов, а также уменьшить расходы на лечение.
… и недостатки
Несмотря на преимущества, у интраназального пути введения есть и недостатки. Физиология носа достаточно сложна и имеет индивидуальные отличия, что обусловливает разную биодоступность препарата у пациентов. Нос имеет множество защитных механизмов, которые ограничивают абсорбцию вещества. Кроме того, лекарственные препараты могут необратимо повредить нежные ткани носа. Наряду с незначительным раздражением слизистой оболочки и ринитом, отмечаются, хотя и реже, более серьезные осложнения: носовые кровотечения, синуситы, перфорация носовой перегородки, потеря обоняния и др. Вид и выраженность развивающихся осложнений зависит как от свойств используемого вещества, так и от длительности его применения. Безопасность местных противовоспалительных средств давно доказана, однако еще очень мало данных по оценке безопасности системно действующих лекарственных средств. Основной проблемой остается низкая биодоступность препаратов при данном способе введения, а разнообразные методики, использующиеся для улучшения всасывания препарата, достаточно агрессивны — повреждают основную мембрану слизистой оболочки носа.
Чтобы избежать возможных осложнений при назначении лекарственного средства интраназально, необходимо учитывать другие препараты, принимаемые пациентом (антикоагулянты, например, повышают риск развития носового кровотечения).
Доктор Рой Фостер, директор международного токсикологического центра (Франция), подчеркивает, что исследования по оценке безопасности и токсичности лекарственных средств, произведенных по данной технологии, являются жизненно необходимыми. В любом случае, назначая и используя такие лекарственные средства, даже если их безопасность подтверждена, необходимо проводить местные пробы на их переносимость.
Опыт фармацевтической компании «Berna Biotech» подтверждает важность оценки безопасности препаратов. Назалфлу — первая интраназальная вакцина, которая в октябре 2000 г. появилась на фармацевтическом рынке Швейцарии, через год была отозвана с рынка из-за предполагаемой возможности развития паралича лицевого нерва при ее использовании. И хотя эти подозрения не подтвердились, публикации в прессе сделали невозможным присутствие препарата на
рынке.
Интраназальные вакцины
Наибольший шанс использования данного пути введения имеют вакцины, поскольку не требуют решения проблемы раздражающего действия препаратов на слизистую оболочку носа в результате их многоразового повторного введения, как при применении для лечения хронических заболеваний. Интраназальные вакцины удобны для иммунизации большого количества людей без риска инфекции, связанной с применением игл. Слизистая оболочка носа содержит большое количество клеток лимфоидной ткани и обычно первой контактирует с вдыхаемыми антигенами, которые таким образом активируют не только общий, но и местный иммунитет.
Флумист, интраназальная вакцина против гриппа компании «Wyeth», предназначенная для иммунизации здоровых людей в возрасте от 5 до 49 лет, получила первичное одобрение FDA. Окончательное одобрение ожидается в конце 2003 г. На стадии разработки находятся вакцины против Yersinia pestis (возбудителя чумы), Helicobacter pylori (этиологического фактора развития пептической язвы желудка и двенадцатиперстной кишки), E. coli, вируса бешенства и ВИЧ.
Инновационные технологии
Потенциал использования данного пути доставки лекарственных препаратов не ограничивается вакцинами. Разрабатываются неинвазивные интраназальные формы инсулина, которые позволят решить проблему нежелания больных сахарным диабетом, особенно II типа, придерживаться назначенного лечения из-за его травматичности. Разработанный по данной технологии инсулин компании «Wyeth» находится на I стадии клинических испытаний.
Для полной реализации преимуществ новой технологии необходимо решить проблему низкой биодоступности лекарственных средств при данном пути введения. Стивен Квей, директор фармацевтической компании «Nastech», специализирующейся на разработке новых форм лекарственных препаратов и путей их введения, сообщает, что в 80-х — первой половине 90-х годов биодоступность данных препаратов составляла менее 10%, в связи с чем производство препарата по приемлемой цене было невозможным. Для решения этой проблемы компания разработала несколько технологий, позволяющих увеличить всасываемость лекарственного препарата:
• STA-T — технология, позволяющая стабилизировать сложные лекарственные вещества и обеспечить быстрое их всасывание при помощи небольших молекул, состоящих из анионов и катионов;
• PTC — технология, позволяющая адсорбировать белки массой до 20 кД при помощи белка-пептида, комбинации активаторов межмембранных соединений, ингибиторов протеаз и индукторов абсорбции.
• JAT — технология, предназначенная для молекул массой более 32 кД.
Плотные межмембранные соединения в эпителиальной и эндотелиальной тканях регулируют межклеточный транспорт веществ. Эти плотные связи селективно ослабляются и усиливаются в ответ на внутриклеточные и внеклеточные стимулы, в результате чего возможен пассаж растворов между клетками. Технологии, разработанные компанией, регулируют функционирование данных соединений в мембране слизистой оболочки носовой полости, создавая возможность абсорбции веществ, не проникающих до этого через эпителий носовой полости. Эта способность транспортировки лекарственных средств через межклеточные соединения наиболее важна для препаратов, применяемых для лечения заболеваний центральной нервной системы (ЦНС). Гематоэнцефалический барьер, защищающий ЦНС от проникновения токсинов, непроницаем и для многих лекарственных средств, используемых при болезни Альцгеймера, Паркинсона и ряде других заболеваний.
Разработанные компанией технологии позволяют повысить биодоступность препаратов до 30–50% и значительно расширить список лекарств с данным путем введения.
Моделированием пути движения воздуха в носовой полости при помощи компьютерной программы установлено, что наибольшее количество вдыхаемого вещества поступает в верхние и задние части. На основании этого открытия разрабатывается новая форма доставки аэрозольного вещества в носовую полость с целью повышения количества всасываемого лекарственного вещества.
Из носовой полости — непосредственно в мозг?
Спорным и открытым остается вопрос о возможности доставки лекарственных веществ непосредственно в ткани мозга из носовой полости. В то время как противники такой идеи считают, что это невозможно, сторонники убеждены, что это может быть открытием в лечении многих заболеваний ЦНС. Существует теория, согласно которой лекарственное вещество, попадая в полость носа, распространяется до верхней ее части — обонятельной области, а затем непосредственно в ткани головного мозга, проникая в спинномозговую жидкость, распространяясь через клетки эпителия обонятельной области. Теория вызывает огромный интерес, так как, кроме применения для лечения пациентов с болезнью Альцгеймера, данный путь может быть использован при болезни Паркинсона, депрессии и даже опухолях головного мозга. В исследованиях на приматах получены доказательства данной теории, но применяемые при изучении методы были чрезвычайно агрессивными, с использованием органических растворителей, которые потенциально могли разрушить слизистую оболочку обонятельной области. Исследования, проведенные на грызунах и собаках, недостаточны, так как следует учитывать, что обоняние для животных очень важно, в связи с чем до 50% слизистой оболочки носа расположено в обонятельной области, тогда как у человека — 3–10%. Проведенные на животных исследования не дают права экстраполировать полученные результаты на людей.
Интересным моментом в противоречивых исследованиях, касающихся этой теории, является то, что, попадая в носовую полость, слизистая оболочка которой имеет большую сеть кровеносных капилляров, препараты всасываются в кровь и таким образом могут проникать в ЦНС. Доказать теорию проникновения вещества в ЦНС через обонятельную область может исследование с использованием вещества, не способного проникать в кровь. Но даже если этот путь проникновения препарата в головной мозг будет доказан, существует еще проблема его доставки в обонятельную область, так как из-за анатомических особенностей носовой полости традиционные спреи не годятся для этих целей. Исследованиями Вильяма Фрея, профессора отдела неврологии университета Минессоты, установлено, что лекарства могут транспортироваться в головной мозг также по тройничным и обонятельным нервам. Однако эти данные должны быть подтверждены многими обширными научными исследованиями.
Интраназальный путь введения бесспорно очень перспективен. Около 20 препаратов, произведенных по данной технологии, уже представлены на фармацевтическом рынке, планируется увеличение их количества. На стадиях разработки и испытаний находится вдвое больше препаратов в данной лекарственной форме по сравнению с препаратами для внутривенного введения.
Станет ли интраназальный путь введения безопасным и простым способом доставки препарата и займет ли он достойное место в производстве лекарственных средств? Пока этот вопрос остается открытым.
По материалам журнала «Scrip Magazine»,
www.nastech.comrel="nofollow">