Кардиоэзофагеальный рак что это такое
Кардиоэзофагеальный рак желудка: причины, лечение
Рак желудка считается распространенной патологией. Средний коэффициент людей, у которых диагностируют рак кардиального отдела желудка, составляет 15% от основной массы онкобольных с желудочной карциномой. Часто такой тип онкологии развивается не 1 год и протекает безболезненно. Боли появляются лишь на последних стадиях рака. Поэтому человек может и не подозревать, о своем недуге, что приводит к позднему выявлению заболевания.
Что собой представляет?
Кардиоэзофагеальный тип рака представляет собой опухоль злокачественного характера, которая развивается на соустье желудка, захватывая его кардиальный отдел, и нижней части пищевода. Подобную форму желудочного рака называют комбинированной, так как опухоль охватывает сразу два органа. Такое размещение злокачественного образования не всегда поддается диагностике, что является еще одной причиной позднего обнаружения болезни.
Вернуться к оглавлениюСимптомы рака кардиального отдела желудка
Частое присутствие изжоги может быть симптомом рака.Для карциномы, локализующейся в кардиальной части желудка и затрагивающей ближайший кусочек пищевода, характерны следующие симптомы, которые может чувствовать больной:
- болезненные ощущения в эпигастральной области;
- спазмирующие приступы сразу после трапезы;
- боли в ночное время суток;
- частое присутствие изжоги;
- неприятный привкус при отрыжке;
- тошнота и рвота с примесью крови;
- ухудшение аппетита;
- антипатия к некоторым блюдам;
- тяжесть в желудке;
- почерневший кал.
Причины развития
Основную причину развития кардиоэзофагеальной опухоли обуславливает гастроэзофагеальная рефлюксная болезнь. При этом недуге кислый желудочный сок забрасывается в пищеварительный канал и раздражает его стенки. Со временем внутренняя часть пищевода деформируется, образуя предраковое состояние, когда ткани воспаляются, приобретают цилиндрическую форму. Второй причиной роста опухли в кардии желудка является неправильное питание. Сюда можно отнести такие моменты:
- постоянное употребление горячей пищи, особенно это касается жителей севера, у которых частота развития подобной патологии в разы превышает случаи у южан;
- пристрастие к острым приправам, соусам, чесноку, луку;
- частое потребление кислых, жареных консервированных блюд, копченостей, солений;
- несоблюдение режима питания, большие разрывы между приемами пищи.
К третьей причине относят курение и чрезмерное употребление крепких спиртных напитков. Конечно, прямое воздействие на рост злокачественного образования в кардиальной области плохое питание, курение и алкоголь не оказывают. Но они благотворно влияют на развитие патогенных состояний (той же рефлюксной болезни), которые предшествуют раку подобного типа. Немаловажную роль в данном аспекте играет генетическая наследственность.
Вернуться к оглавлениюУ людей, в роду которых встречались случаи развития кардиоэзофагеального рака, риск заболеть тем же недугом возрастает в несколько раз.
Диагностика
Диагностика подобной онкологической патологии позволяет определить место размещения опухоли, ее размеры, степень развития недуга, выявить наличие метастазов и, исходя из полученных сведений, определиться с методикой лечения, плюс спрогнозировать результат. При карциноме кардиальной области желудка применяются такие методы исследований:
- Общий анализ крови. По этому исследованию смотрят количество гемоглобина и определяют, не страдает ли человек анемией, что свойственно при подобном онкологическом заболевании.
- Анализ крови на онкомаркеры. Число онкомаркеров позволяет не только выявить наличие рака, но и оценить, насколько активно ведет себя болезнь.
- Эзофагогастродуоденоскопия (глотание зонда) позволяет обследовать пищеварительный канал, желудок, двенадцатиперстную кишку, оценить их работоспособность, увидеть патологические изменения на тканях этих органов.
- УЗИ. Ультразвуковое исследование помогает увидеть состояние органов брюшины, проверить их на наличие опухоли.
- Биопсия проводится во время гастроскопии, обуславливает взятие пораженной ткани на анализ. Исследование этих тканей поможет выяснить характер опухоли, стадию ее роста.
- Эзофагогастрография подразумевает под собой рентгенологическую диагностику с использованием контрастного вещества. Показывает состояние органа, присутствие в нем опухоли в виде разросшихся тканей.
- Суточная рН-метрия. Данное обследование направлено на диагностику патологий, предшествующих раку желудка (гастрита, язвы, рефлюксной болезни), что, в свою очередь, помогает вовремя исправить ситуацию и предотвратить пагубные последствия.
- Манометрия позволяет увидеть состояние и оценить уровень работоспособности клапана, размещенного на границе пищеварительного тракта и желудка. Этот клапан пропускает пищу из пищевода в желудок, но препятствует забросу содержимого желудка обратно в пищеварительный канал.
- КТ и МРТ. Эти два исследования при кардиальной карциноме направлены на определение границ разрастания опухоли, плюс на выявление метастазов в других органах и частях организма.
- Сцинтиграфия являет собой радиоизотопное исследование, которое помогает увидеть распространение онкоклеток в костную ткань.
Методы лечения
Лучевая терапия при раке желудка.Комбинированная форма рака лечится сложнее. Чем меньше стадия заболевания и чем меньше пораженных тканей, тем больше шансов получить хороший результат и благоприятный исход лечения. Методы:
- В основе борьбы с карциномой кардиальной части желудка стоит оперативный метод. Он обуславливает частичное либо полное удаление желудка вместе с пораженной частью пищеварительного канала. Если желудок нужно удалять полностью, что бывает на 2 или 3 стадии рака, то в таком случае остаток пищевода соединяется с тонкой либо толстой кишкой. Если требуется резекция большей части пищеварительного канала, то в этой ситуации проводится пластика с использованием части кишечника. При диагностировании 4 стадии комбинированной кардиальной карциномы оперативное вмешательство практически не имеет смысла. В таком случае пациентам назначаются спазмолитические и поддерживающие препараты.
- Лучевая терапия применяется как перед оперативным вмешательством, так и в послеоперационный период. Предоперационное облучение направлено на замедление роста опухоли и распространения метастазов. Лучевая терапия, применяемая после операции и удаления пораженных тканей, убивает остатки злокачественных клеток, сокращая тем самым вероятность рецидивов болезни.
- Химиотерапия подразумевает под собой употребление цитостатических препаратов, которые подавляют увеличение как самой опухоли, так и метастатических процессов. Применяется сей метод в комплексе с другими.
Прогноз на выздоровление
Люди с кардиоэзофагеальным раком, которых оперировать уже невозможно, живут от 3 месяцев до года. После проведения операции при таком диагнозе 5-летняя выживаемость составляет у 20−30% людей. Это при условии своевременного удаления пораженных тканей и отсутствия метастазов, что возможно лишь на начальных стадиях рака. Прогноз результата борьбы с карциномой желудка зависит от многих факторов. К ним относят:
- стадию развития болезни;
- тип злокачественного образования, его активность в плане роста;
- своевременное обнаружение недуга;
- разрастание метастазов;
- верно подобранные методы лечения.
Хирургическое лечение кардиоэзофагеального рака
Кардиоэзофагеальный рак
Кардиоэзофагеальный рак – это злокачественное новообразование, поражающее нижние отделы пищевода и кардиальный отдел желудка. Комбинированное поражение органов пищеварительной системы определяет трудности, возникающие в диагностике и лечении данного патологического состояния. Среди факторов риска развития данного опухолевого заболевания выделяют гастроэзофагеальную рефлюксную болезнь. Это патологическое состояние сопровождается забросом кислого желудочного содержимого в просвет пищевода с раздражением его стенок. С течением времени происходит трансформация клеток слизистой оболочки с формированием пищевода Барретта. Это предраковое заболевание может являться основой для развития кардиоэзофагеального рака.
Кроме того среди факторов риска возникновения опухолей такого типа выделяют пристрастие к кислой, соленой, острой, жареной, консервированной пище, злоупотребление крепкими алкогольными напитками и курение. Определенное значение играет и наследственная предрасположенность к развитию рака пищевода и желудка. Пациентам с факторами риска развития данного заболевания необходимо регулярно посещать профилактические осмотры и выполнять ФГДС-исследование.
Содержание:
Симптомы кардиоэзофагеального рака
Вследствие локализации в области кардии желудка и нижней трети пищевода новообразования такого типа довольно рано способствуют появлению характерной клинической симптоматики. Чаще всего больные предъявляют следующие жалобы:
- дискомфорт и боль в области эпигастрии;
- появление болевого приступа вскоре после принятия пищи;
- «голодные» и «ночные» боли;
- регулярное появление чувства изжоги;
- отрыжка с неприятным привкусом;
- тошнота;
- рвота с примесью крови;
- снижение аппетита;
- отвращение к определенным видам пищи;
- чувство тяжести в области желудка;
- появление характерного черного стула или мелены.
Кардиоэзофагеальный рак диагностика в Израиле
Обследование пациентов с признаками кардиоэзофагеального рака дает возможность установить локализацию и степень распространенности патологического процесса, определить прогноз и тактику лечения. Для получения наиболее полной информации проводится ряд диагностических тестов и исследований.
- Анализ крови – может выявить признаки анемии, развивающейся в результате регулярной потери небольшого количества крови из кровоточащей опухоли. Кроме того возможности современной лабораторной диагностики позволяют определить ряд веществ, свидетельствующих о наличии онкологического процесса. По концентрации онкомаркеров можно судить об активности патологического процесса и эффективности проводимой терапии.
- Эзофагогастродуоденоскопия – в ходе проведения этого эндоскопического исследования появляется возможность непосредственно рассмотреть изменения стенки пищевода и желудка, оценить функциональную активность этих органов.
- УЗИ – это современный неинвазивный диагностический метод, который дает возможность оценить состояние органов брюшной полости и определить наличие в них признаков опухолевого роста.
- Биопсия – эта процедура направлена на получение образцов опухолевой ткани. Образцы направляются в лабораторию, где подвергаются патогистологическому, иммунохимическому, иммуноферментному, цитогенетическому и другим исследованиям. В результате удается установить тип новообразования, стадию его развития и степень распространенности опухолевого процесса.
- Эзофагогастрография – это рентгенологическое исследование, которое выполняется с применением контрастного вещества. На рентгеновских снимках можно определить опухоль как разрастание ткани в просвет пищевода и желудка, дефект наполнения.
- Суточная рН-метрия – выполнение этого исследования имеет большое значение для обследования пациентов с признаками гастрита, язвенной болезни желудка и гастроэзофагеальной рефлюксной болезни.
- Манометрия – при проведении данного исследования проводится оценка степени функциональной активности сфинктера, расположенного между желудком и пищеводом.
- КТ – проведение рентгеновской компьютерной томографии позволяет выявить метастатические очаги в легочной ткани.
- МРТ – при проведении этого современного исследования удается не только определить границы распространения опухолевого процесса, но и выявить отдаленные очаги опухолевого роста в других органах и тканях.
- Сцинтиграфия – это радиоизотопное исследование позволяет выявить очага вторичного опухолевого роста в различных отделах костной системы организма.
Кардиоэзофагеальный рак лечение
Лечение кардиоэзофагеального рака направлено на радикальное удаление очага опухолевого роста и предупреждение рецидивирования патологического процесса. Тактика лечения определяется в зависимости от индивидуальных особенностей клинической картины у данного пациента. При выявлении определенных размеров и степени распространенности патологического процесса используется та или иная комбинация методов воздействия на опухоль.
- Хирургическое лечение – единственным методом радикальной борьбы кардиоэзофагеальным раком является оперативное вмешательство. Для достижения поставленной цели проводятся комбинированные оперативные вмешательства с удаление части желудка и пищевода. После этого осуществляется наложение гастростомы или эзофагостомы или же создание анастомозов. При удалении большого объема пищевода может потребоваться проведение пластики с использованием части кишечника.
- Лучевая терапия – лучевое лечение в предоперационном периоде дает возможность уменьшить стадийность опухоли и подготовить ее к хирургическому удалению. После выполнения оперативного вмешательства облучение позволяет снизить вероятность рецидивирования патологического процесса благодаря уничтожению сохранившихся злокачественных клеток.
- Химиотерапия – этот метод лечения чаще всего применяется в сочетании с другими методами воздействия на опухоль. Прием цитостатических препаратов позволяет подавить рост и развитие не только первичной опухоли, но и отдаленных очагов метастатического роста.
Лечение кардиоэзофагеального рака в Израиле
Лечение кардиоэзофагеального рака в Израиле обладает высокой эффективностью по следующим причинам:
- индивидуальный подход к обследованию и лечению каждого пациента;
- передовые технологии обследования больных;
- хирургическое лечение с применением современных малоинвазивных технологий;
- лечение на новейших установках для лучевой терапии;
- применение наиболее эффективных химиопрепаратов.
Чем раньше будет начато лечение кардиоэзофагеального рака, тем более эффективным оно окажется.
Опухоль кардиального отдела желудка
16 ноября 2016, 13:00 0 8,612
Рак желудка считается распространенной патологией. Средний коэффициент людей, у которых диагностируют рак кардиального отдела желудка, составляет 15% от основной массы онкобольных с желудочной карциномой. Часто такой тип онкологии развивается не 1 год и протекает безболезненно. Боли появляются лишь на последних стадиях рака. Поэтому человек может и не подозревать, о своем недуге, что приводит к позднему выявлению заболевания.
Что собой представляет?
Кардиоэзофагеальный тип рака представляет собой опухоль злокачественного характера, которая развивается на соустье желудка, захватывая его кардиальный отдел, и нижней части пищевода. Подобную форму желудочного рака называют комбинированной, так как опухоль охватывает сразу два органа. Такое размещение злокачественного образования не всегда поддается диагностике, что является еще одной причиной позднего обнаружения болезни.
Симптомы рака кардиального отдела желудка
Для карциномы, локализующейся в кардиальной части желудка и затрагивающей ближайший кусочек пищевода, характерны следующие симптомы, которые может чувствовать больной:
- болезненные ощущения в эпигастральной области;
- спазмирующие приступы сразу после трапезы;
- боли в ночное время суток;
- частое присутствие изжоги;
- неприятный привкус при отрыжке;
- тошнота и рвота с примесью крови;
- ухудшение аппетита;
- антипатия к некоторым блюдам;
- тяжесть в желудке;
- почерневший кал.
Вернуться к оглавлению
Причины развития
Основную причину развития кардиоэзофагеальной опухоли обуславливает гастроэзофагеальная рефлюксная болезнь. При этом недуге кислый желудочный сок забрасывается в пищеварительный канал и раздражает его стенки. Со временем внутренняя часть пищевода деформируется, образуя предраковое состояние, когда ткани воспаляются, приобретают цилиндрическую форму. Второй причиной роста опухли в кардии желудка является неправильное питание. Сюда можно отнести такие моменты:
- постоянное употребление горячей пищи, особенно это касается жителей севера, у которых частота развития подобной патологии в разы превышает случаи у южан;
- пристрастие к острым приправам, соусам, чесноку, луку;
- частое потребление кислых, жареных консервированных блюд, копченостей, солений;
- несоблюдение режима питания, большие разрывы между приемами пищи.
К третьей причине относят курение и чрезмерное употребление крепких спиртных напитков. Конечно, прямое воздействие на рост злокачественного образования в кардиальной области плохое питание, курение и алкоголь не оказывают. Но они благотворно влияют на развитие патогенных состояний (той же рефлюксной болезни), которые предшествуют раку подобного типа. Немаловажную роль в данном аспекте играет генетическая наследственность.
У людей, в роду которых встречались случаи развития кардиоэзофагеального рака, риск заболеть тем же недугом возрастает в несколько раз.
Диагностика
Диагностика подобной онкологической патологии позволяет определить место размещения опухоли, ее размеры, степень развития недуга, выявить наличие метастазов и, исходя из полученных сведений, определиться с методикой лечения, плюс спрогнозировать результат. При карциноме кардиальной области желудка применяются такие методы исследований:- Общий анализ крови. По этому исследованию смотрят количество гемоглобина и определяют, не страдает ли человек анемией, что свойственно при подобном онкологическом заболевании.
- Анализ крови на онкомаркеры. Число онкомаркеров позволяет не только выявить наличие рака, но и оценить, насколько активно ведет себя болезнь.
- Эзофагогастродуоденоскопия (глотание зонда) позволяет обследовать пищеварительный канал, желудок, двенадцатиперстную кишку, оценить их работоспособность, увидеть патологические изменения на тканях этих органов.
- УЗИ. Ультразвуковое исследование помогает увидеть состояние органов брюшины, проверить их на наличие опухоли.
- Биопсия проводится во время гастроскопии, обуславливает взятие пораженной ткани на анализ. Исследование этих тканей поможет выяснить характер опухоли, стадию ее роста.
- Эзофагогастрография подразумевает под собой рентгенологическую диагностику с использованием контрастного вещества. Показывает состояние органа, присутствие в нем опухоли в виде разросшихся тканей.
- Суточная рН-метрия. Данное обследование направлено на диагностику патологий, предшествующих раку желудка (гастрита, язвы, рефлюксной болезни), что, в свою очередь, помогает вовремя исправить ситуацию и предотвратить пагубные последствия.
- Манометрия позволяет увидеть состояние и оценить уровень работоспособности клапана, размещенного на границе пищеварительного тракта и желудка. Этот клапан пропускает пищу из пищевода в желудок, но препятствует забросу содержимого желудка обратно в пищеварительный канал.
- КТ и МРТ. Эти два исследования при кардиальной карциноме направлены на определение границ разрастания опухоли, плюс на выявление метастазов в других органах и частях организма.
- Сцинтиграфия являет собой радиоизотопное исследование, которое помогает увидеть распространение онкоклеток в костную ткань.
Вернуться к оглавлению
Методы лечения
Комбинированная форма рака лечится сложнее. Чем меньше стадия заболевания и чем меньше пораженных тканей, тем больше шансов получить хороший результат и благоприятный исход лечения. Методы:
- В основе борьбы с карциномой кардиальной части желудка стоит оперативный метод. Он обуславливает частичное либо полное удаление желудка вместе с пораженной частью пищеварительного канала. Если желудок нужно удалять полностью, что бывает на 2 или 3 стадии рака, то в таком случае остаток пищевода соединяется с тонкой либо толстой кишкой. Если требуется резекция большей части пищеварительного канала, то в этой ситуации проводится пластика с использованием части кишечника. При диагностировании 4 стадии комбинированной кардиальной карциномы оперативное вмешательство практически не имеет смысла. В таком случае пациентам назначаются спазмолитические и поддерживающие препараты.
- Лучевая терапия применяется как перед оперативным вмешательством, так и в послеоперационный период. Предоперационное облучение направлено на замедление роста опухоли и распространения метастазов. Лучевая терапия, применяемая после операции и удаления пораженных тканей, убивает остатки злокачественных клеток, сокращая тем самым вероятность рецидивов болезни.
- Химиотерапия подразумевает под собой употребление цитостатических препаратов, которые подавляют увеличение как самой опухоли, так и метастатических процессов. Применяется сей метод в комплексе с другими.
Вернуться к оглавлению
Прогноз на выздоровление
Люди с кардиоэзофагеальным раком, которых оперировать уже невозможно, живут от 3 месяцев до года. После проведения операции при таком диагнозе 5-летняя выживаемость составляет у 20−30% людей. Это при условии своевременного удаления пораженных тканей и отсутствия метастазов, что возможно лишь на начальных стадиях рака. Прогноз результата борьбы с карциномой желудка зависит от многих факторов. К ним относят:
- стадию развития болезни;
- тип злокачественного образования, его активность в плане роста;
- своевременное обнаружение недуга;
- разрастание метастазов;
- верно подобранные методы лечения.
Хирургическое лечение рецидивов кардиоэзофагеального рака -
М.Д. Тер-Ованесов, М.И. Давыдов, И.С. Стилиди, А.Н. Абдихакимов, В.А. Марчук
Российский онкологический научный центр им. Н.Н. Блохина РАМН, Москва
Несмотря на длительную историю развития онкохирургии, крайне актуальным, с точки зрения выбора тактики лечения, остается проблема лечения рецидивных опухолей. Особенно остро эта проблема стоит при рецидивах рака проксимального отдела желудка с переходом на пищевод, что обусловлено как особенностями роста и метастазирования первичной опухоли, так и характером выполненных ранее вмешательств. Опыт, накопленный отечественными и зарубежными авторами, свидетельствует о том, что при рецидивах кардиоэзофагеального рака именно хирургическое лечение является методом выбора.
Все вышеизложенное позволяет отметить высокую актуальность совершенствования методологии повторных операций с учетом технических особенностей резекционного и реконструктивного этапов.
По определению Н.Н. ПЕТРОВА, «рецидивы — это разрастания опухолевой ткани, возникающие на том самом месте, где располагалась первичная опухоль:из неудаленных или неразрушенных частиц опухолевой тканей, уцелевших на месте, в ближайших лимфопутях или лимфоузлах после удаления : первичного опухолевого очага». Таким образом, к рецидивам рака желудка следует относить все опухолевые узлы, выявляемые после выполнения радикальных вмешательств как в зоне реконструированного желудочно-кишечного тракта, так и в области ложа удаленного органа. Причем с учетом развития методологии «превентивной расширенной лимфодиссекции» возникновение рецидивной опухоли в регионарных лимфатических узлах, подлежащих удалению с учетом путей лимфооттока, следует рассматривать как «локорегионарный рецидив заболевания».
В основу исследования положены результаты лечения 144 пациентов, находившихся в торакоабдоминальном отделении РОНЦ РАМН за период с 1981 по 1995 гг. по поводу рецидива кардиоэзофагеального рака. Из общего числа наблюдений 28 пациентов были ранее оперированы в РОНЦ РАМН, 116 пациентам операции произведены в других лечебных учреждениях. Следует отметить, что частота рецидивов кардиоэзофагеального рака среди пациентов, ранее оперированных в РОНЦ РАМН, составила лишь 4%.
Среди пациентов преобладали мужчины — 104 (72,2%). Соотношение мужчин и женщин составило 2,6:1, что соответствует аналогичному показателю для первичного рака кардиоэзофагеальной зоны. Возраст пациентов — от 27 до 82 лет. Преобладал возрастной интервал от 50 до 59 лет. Средний возраст в мужской группе составил 59 лет, а в женской 57 лет.
При прочих равных условиях наибольшее значение в возникновении рецидива имеют объем оперативного вмешательства и хирургический доступ. Из всей группы 93 пациентам ранее были выполнены проксимальные резекции чрезбрюшинным доступом. Среди 43 больных с рецидивами в анастомозе после гастрэктомии у 34 операция была выполнена абдоминальным доступом, и лишь у 9 — чресплевральным. Следует отметить, что чрезбрюшинная проксимальная резекция была выполнена лишь пациентам, оперированным в других лечебных учреждениях, что, с учетом развития рецидива, свидетельствует о неадекватности объема хирургического вмешательства.
Таким образом, несмотря на то, что проксимальные резекции выполнялись при меньшем объеме органного поражения, чем гастрэктомии, рецидив в анастомозе после них встречался чаще.
Комбинированные вмешательства ранее были выполнены лишь у 33 пациентов (22,9%). Сравнительно небольшое количество больных с рецидивами после комбинированных вмешательств может быть связано с более широким объемом удаляемых тканей, особенно на путях лимфооттока.
С учетов данных рентгено-эндоскопического исследования мы разделяем тип роста рецидивной опухоли на экзофитную — 36 (25%) пациенток, эндофитную — 49 (34%) больных и смешанную 59 (41%) больных. Значительное преобладание эндофитных и смешанных опухолей, характеризующихся значительным распространением подслизистой инфильтрации, видимых шире границ опухоли, свидетельствует о высокой злокачественности процесса в этих наблюдениях и косвенно отражает характеристики рецидивной опухоли.
Максимальное количество рецидивов после гастрэктомии и проксимальной резекции желудка диагностировано в 1-ый год после операции — у 58 (40,3%) больных; в сроки от 1 года до 2 лет — у 35 (24,3%) пациентов, от 2 до 3 лет — у 22 (15,2%) больных, от 3 до 4 лет — у 14 (9,7%) больных, от 4 до 5 лет — у 6 (4,2%) больных, в сроки свыше 5 лет — у 9 (6,2%) больных. Таким образом, с учетом сроков возникновения рецидивов после хирургического лечения можно выделить две группы:
1) ранний рецидив (до трех лет) — 115 больных;
2) поздний рецидив (более трех лет) — 29 больных.
Основным методом лечения рецидива кардиоэзофагеального рака был хирургический: повторные операции выполнены у 102/144 (70,8%) больных, в том числе у 65 — радикальные. Резектабельность составила 45,1% по отношению ко всем госпитализированным и 63,7% по отношению к оперированным больным.
Паллиативные шунтирующие вмешательства были выполнены 15 (14,7%) пациентам, т.е. почти у каждого седьмого больного.
Эксплоративные вмешательства были произведены 22 (21,5%) пациентами и объяснялись либо распространенностью опухолевого процесса, либо тяжестью сопутствующей патологии.
При рассмотрении вопроса о локализации рецидивного злокачественного процесса необходимо учитывать объем ранее перенесенного вмешательства. С учетом особенностей местного роста и метастазирования мы различали следующие локализации опухолевого процесса:
1. После проксимальной резекции желудка:
а) поражение пищеводно-желудочного анастомоза с инфильтрацией или без инфильтрации пищевода;
б) субанастомотическое расположение опухоли без вовлечения пищеводно-желудочного анастомоза;
в) тотальное поражение оставшейся части желудка.
2.После гастрэктомии:
а) поражение пищеводно-кишечного анастомоза с инфильтрацией или без инфильтрации пищевода.
После проксимальной резекции желудка и гастрэктомии закономерным является поражение пищеводного анастомоза (пищеводно-желудочное соустье — 95 случаев, пищеводно-кишечное — 40 случаев), что в большинстве случаев, особенно при возникновении рецидива в ближайшие сроки после операции, следует объяснять неадекватностью объема вмешательства по поводу первичного заболевания. Лишь в 9 случаях имела место субанастомотическая локализация опухоли в дистальной культе желудка.
Особенности лимфогенного метастазирования рецидивов кардиоэзофагеального рака во многом определяются характером предшествующего вмешательства с учетом объема выполненной лимфодиссекции. Закономерным как для первичного кардиоэзофагеального рака, так и для рецидивов является метастазирование в лимфатические коллекторы по обе стороны диафрагмы.
Опыт торакоабдоминального отделения показывает, что принципиальное применение абдоминоторакального доступа при хирургическом лечении первичного кардиоэзофагеального рака с обязательной резекцией не менее 5-6 см непораженного пищевода от проксимальной границы опухоли и выполнение лимфодиссекции в объеме D4 достоверно уменьшает число местных рецидивов в 4 раза.
Морфологические характеристики рецидивов кардиоэзофагеального рака с поражением пищеводных соустий и распространением инфильтрации на пищевод свидетельствуют о том, что при планировании хирургического лечения оптимальным является комбинированный абдоминоторакальный доступ по VI или VII межреберью слева.
Комбинированный доступ из срединной лапаротомии и правосторонней торакотомии по V межреберью необходим при локализации и распространении рецидивной опухоли на среднюю треть пищевода с целью адекватной его резекции и выполнения верхнемедиастинальной лимфодиссекции.
Всем больным были выполнены повторные операции различного объема. Характер повторных вмешательств, главным образом, определяется вариантом первой операции и степенью распространенности опухолевого процесса. 50 больным выполнена экстирпация оставшейся части желудка с резекцией пищевода, 15 больным — экстирпация пищеводно-кишечного анастомоза.
Распространение опухолевой инфильтрации на прилегающие структуры не являлось сдерживающим моментом при решении вопроса о возможности выполнения атипичной операции: комбинированные резекции выполнены 59 из 65 больных, причем у 51 пациента (86,4%) возникла необходимость выполнения мультиорганных резекций.
Реконструктивный этап после повторных вмешательств с высокой резекцией пищевода характеризуется значительным разнообразием способов восстановления непрерывности пищеварительного тракта, однако, на наш взгляд, оптимальными являются три варианта, каждый из которых имеет свои четкие показания:
1) после экстирпации культи желудка и резекции пищевода у 31 пациента использовалась петлевая пластика тонкой кишкой, во второй группе у 9 больных применялась пластика Roux-en-Y, в третьей группе у 10 пациентов использовался изоперистальтический сегмент толстой кишки;
2) у пациентов с перенесенной ранее гастрэктомией в интересах реконструктивного этапа отмечались различия объема резекции анастомозированной петли тонкой кишки: у 9 из 15 пациентов пищевод анастомозировали с непересеченной петлей тонкой кишки, у 3 больных восстанавливали непрерывность пищеварительного тракта по Ру, и еще у 3 больных для пластики использовали сегмент толстой кишки.
Показатели операбельности и резектабельности в различные периоды деятельности отделения имели существенные отличия. Показатель операбельности за весь период с 1981 по 1995 гг. составил 70,2%. В группе оперированных больных резектабельность составила 63,7%. И если в первый период работы отделения этот показатель был равен 55,6% (25 из 45 больных), то во второй период он увеличился до 70,8% (40 из 57).
В группе больных, перенесших пробные и паллиативные хирургические вмешательства, наоборот, отмечается динамика в сторону уменьшения пробных и увеличения паллиативных шунтирующих операций, направленных в основном на купирование наиболее тягостного симптома — дисфагии и улучшение социально-психологического состояния пациентов.
Таким образом, отработка методологии выполнения повторных вмешательств по поводу рецидивов кардиоэзофагеального рака способствовала значительному смещению акцентов в течение второго периода хирургической деятельности с увеличением показателей операбельности и резектабельности.
Самые высокие показатели операбельности отмечены после операции чрезбрюшинной проксимальной резекции желудка. Они составили 80,6% (75 из 93 больных). Резектабельность после операции чрезбрюшинной гастрэктомии составила 72,2% (13 из 18 больных). При рецидивах опухоли после операции типа Гэрлока и чресплевральной гастрэктомии отмечена меньшая частота операбельности и резектабельности.
При раннем рецидиве кардиоэзофагеального рака возможности радикального хирургического лечения ограничены. Из 115 больных, госпитализированных в клинику, оперированы 76 (66,0%), из них только у 43 удалось выполнить радикальную операцию. Таким образом, резектабельность по отношению к госпитализированным больным составила лишь 37,4%, а по отношению к оперированным — 56,6%. Столь низкие показатели операбельности и резектабельности в этой группе связаны с биологическими особенностями опухоли, в частности выраженным инфильтративным ростом с вовлечением окружающих структур и ранним метастазированием.
При позднем рецидиве кардиоэзофагеального рака показатели хирургического лечения лучше. Так из 29 госпитализированных пациентов оперированы 26 (89,7%), причем у 22 человек удалось выполнить радикальную операцию. Показатели резектабельности составили 75,9% по отношению к госпитализированным и 84,7% — по отношению ко всем оперированным больным.
Самая высокая резектабельность отмечена при экзофитной форме роста рецидивной опухоли — 73,0% (19 из 26 больных). Самые низкие показатели отмечены при смешанной форме роста рецидивной опухоли. Хотя операбельность составила 71,2%, возможность выполнения радикальной операции была значительно ограничена, а резектабельность по отношению ко всем оперированным больным составила 57,1%, а по отношению к госпитализированным — лишь 40,7%.
Из 102 оперированных по поводу рецидива кардиоэзофагеального рака больных осложнения после операции возникли у 30 (29,4%) человек, из них умерли 10, что составило 9,5% к общему числу оперированных. Наиболее высокий процент послеоперационных осложнений (33,8%) отмечался после радикальных вмешательств. После паллиативных вмешательств частота осложнений составила 26,6%, а после пробных — 18,8%.
Анализ полученных результатов показал, что ведущее место в структуре послеоперационных осложнений заняли функциональные осложнения со стороны дыхательной и сердечно-сосудистой систем.
В серии операций по поводу рецидивных опухолей кардиоэзофагеальной зоны хирургические осложнения встречаются значительно реже, чем функциональные. Это связано с анатомичностью оперирования и детальной отработкой техники выполнения вмешательств.
Внедрение усовершенствованных погружных антирефлюксных пищеводных анастомозов, а также успехи анестезиологии и реаниматологии во второй период деятельности отделения (1988-1995 гг.) значительно уменьшили частоту послеоперационных осложнений и летальности. За этот период частота несостоятельности швов пищеводных соустий снизилась до 2,5%.
Из 65 больных, которым были произведены повторные радикальные вмешательства, в послеоперационном периоде от различных осложнений умерли 7 человек (10,7%).
Из 58 пациентов, переживших радикальные вмешательства различного объема, 31 пациент умер в различные сроки от прогрессирования основного заболевания или от других соматических заболеваний. Одногодичный рубеж пережили 53 пациента. Средняя продолжительность жизни радикально оперированных пациентов составила 32,8 месяцев. Самый длительный срок наблюдения за больной после повторной операции — 10 лет. 5-летняя актуариальная выживаемость среди 65 оперированных больных, рассчитанная по таблицам дожития Cutler-Ederer, составила 24,6%.
При анализе отдаленных результатов радикального хирургического лечения в зависимости от сроков развития рецидива опухоли получены следующие данные: 44 больных имели ранний и 21 — поздний рецидив. Один больной из первой группы выбыл из-под наблюдения через 11 месяцев. Из 43 больных с ранними рецидивами до одного года умерли 7 человек. Среди больных с поздними рецидивами после радикальных операций до одного года умерли 5 из 21 больного.
Из 31 больного с ранним рецидивом опухоли трехлетний период прожили 7 пациентов (32,1%). Из 16 больных с поздним рецидивом 3 года пережили 9 пациентов (55,4%). В этом промежутке времени отмечается более благоприятное течение заболевания у пациентов с поздним появлением рецидива, хотя эти различия статистически недостоверны. Результаты 5-летней выживаемости не зависят от времени возникновения рецидива и составляют приблизительно одинаковое количество больных: 23,6% при раннем рецидиве и 25,6% — при позднем.
Из 15 больных, которым была выполнена паллиативная операция, в послеоперационном периоде умер 1 больной. Причиной смерти была тромбоэмболия легочной артерии. Из оставшихся 14 больных дальнейшая судьба 2 больных неизвестна. Остальные пациенты умерли от прогрессирования опухолевого процесса в сроки до 2 лет. Средняя продолжительность жизни у больных с паллиативными операциями составила 7 месяцев.
Улучшение качества жизни убедительно свидетельствует о целесообразности применения шунтирующих операций у больных с нерезектабельной формой рецидива кардиоэзофагеального рака и является альтернативой наложению кишечных свищей. В связи со сложностью выполнения шунтирующих операций, требующих навыка формирования высокого пищеводного соустья, часто выше дуги аорты, выполнение этих операций оправдано только в условиях специализированных клиник, располагающих опытом подобных вмешательств. Средняя продолжительность жизни после эксплоративных вмешательств равна 3,4 месяца.
Таким образом, радикальные операции при рецидиве кардиоэзофагеального рака позволяют не только избавить больных от тяжелых проявлений заболевания, но и увеличить продолжительность жизни. В ряде случаев возможно полное излечение больных. В целом, после отработки показаний и методологии выполнения повторных вмешательств отдаленные результаты приближаются к результатам хирургического лечения первичных опухолей кардиоэзофагеальной зоны.
Паллиативные шунтирующие операции обеспечивают лучшее качество жизни по сравнению с гастро-(еюно-)стомией и являются операциями выбора при технически неудалимых и диссеминированных рецидивных опухолях.
(Visited 28 times, 1 visits today)
Комбинированное лечение кардиоэзофагеального рака -
В С. Мазурин
МОНИКИ, Москва
Каким образом можно улучшить непосредственные и отдаленные результаты лечения кардиоэзофагельного рака, какие есть для этого резервы? Мы полагаем, что резервы для этого следующие:
ранняя диагностика и раннее оперирование этой категории больных;
строгое соблюдение и выполнение разработанных методик оперативных вмешательств;
обязательное выполнение расширенной лимфаденэктомии при радикальных хирургических вмешательствах;
обеспечение адекватного послеоперационного периода;
концентрация больных раком кардиоэзофагеальной области в специализированных клиниках;
подготовка высококвалифицированных хирургов, способных выполнять сложные хирургические вмешательства в такой трудной для оперирования анатомической области, как кардиоэзофагеальная зона.
При правильном подходе к данной проблеме и учете всех перечисленных факторов, эффективность хирургического лечения больных раком кардиоэзофагеальной области может быть значительно повышена.
Хирургия кардиоэзофагеального рака прошла долгий путь в своем развитии и достигла высот, и мы не согласны с мнением тех специалистов, которые считают, что хирургический метод лечения достиг своего «потолка». Не следует забывать о том, что общий прогноз хирургического лечения не должен служить индивидуальным прогнозом в каждом конкретном случае.
Мы глубоко убеждены, что улучшение результатов хирургического лечения рака пищевода и желудка в целом и в частности кардиоэзофагеального рака связано с дальнейшим развитием, усовершенствованием и оптимизацией хирургического метода лечения, в котором до окончательного совершенства еще очень далеко. И в этом свою роль должны сыграть отказ от консервативных традиций, принятых в ряде клиник, постоянная переоценка и переосмысление существующих способов и методов лечения и неустанный творческий поиск новых, более эффективных средств и путей их лечения.
Несомненно и то, что перспектива улучшения отдаленных результатов лечения кардиоэзофагеального рака связана с развитием методов комбинированного лечения. Хирургический метод, оставаясь основным, должен быть совершенен, ибо никакое комбинирование не сможет исправить дефекты хирургии. Задача комбинирования — дополнить диапазон хирургического метода системным воздействием для того, чтобы нивелировать реализацию отдаленных метастазов, являющихся основной причиной гибели больных в отдаленные сроки.
Учитывая локальный характер лечебного воздействия при применении гипоксирадиотерапии, мы рассчитывали на уменьшение числа местных рецидивов, но полученные результаты не подтвердили эти предположения. Повлиять же на отдаленные результаты с помощью сочетания двух локальных методов лечения (хирургического и лучевого), которые после 1,5-2 лет в основном являются результатом реализации отдаленных метастазов, не представляется возможным. Эти соображения и полученные результаты заставили нас искать более перспективные и эффективные варианты комбинированного лечения. Таковыми нам представляются комбинации из локального (хирургического) и системного (химиотерапии) методов лечения.
Несмотря на предполагаемую высокую эффективность адъювантной химиотерапии, получить этому подтверждение не удалось; данные других авторов также не позволяют сделать однозначных выводов. На наш взгляд, более перспективным является применение предоперационной (неоадъювантной) химиотерапии. При этом можно достичь девитализации опухоли, разрушения мигрирующих раковых клеток, уменьшения массы основной опухоли до операции. Следовательно, к моменту операции возможно создание наиболее благоприятных условий для удаления опухоли.
При применении неоадъювантной полихимиотерапии во всех случаях кардиоэзофагеального рака мы наблюдали выраженные в той или иной степени изменения в морфологической структуре опухоли, обусловленные предоперационной регионарной химиотерапией: I степень патоморфоза получена у 38,5% больных; II степень — у 36,5%; III степень — у 19,2%; IV степень — у 5,8% пациентов.
К настоящему времени мы имеем результаты 5-летней выживаемости в группе комбинированного лечения с предоперационной регионарной химиотерапией:
1 год прожили 85,7% (42/49) больных;
2 года прожили 77,6% (38/49) больных;
3 года прожили 53,1% (26/49) больных;
5 лет прожили 49,8% (20/49) больных.
В группе чисто хирургического лечения 3-летний показатель равен 34,6% (без лимфодиссекции) и 41,1% (с лимфодиссекцией).
Перспективу эффективного комбинированного лечения мы связываем не только с системными методами лечения (химиотерапией и иммунотерапией), но и с дальнейшим совершенствованием техники абластичного выполнения оперативных вмешательств. Добиться значимых результатов от применения комбинированного лечения возможно лишь при совершенстве всех составляющих комбинацию методов. Такова наша основная позиция в оценке перспектив лечения кардиоэзофагеального рака.
(Visited 29 times, 1 visits today)
Способ оперативного лечения кардиоэзофагеального рака
Изобретение относится к медицине, а именно к хирургии пищевода и желудка. Сущность: диафрагмотомию проводят от пищеводного отверстия диафрагмы с перечислением левой ножки диафрагмы под углом 70° к реберной дуге слева с дренированием дренажом, уложенным по задней поверхности до верхушки легкого, что позволяет создать возможность к более оптимальному доступу к органам брюшной и плевральной полости слева, что обеспечивает сохранение принципов радикальности операции, техническую простоту наложения внутриплевральных пищеводных соустий и делает его эффективным при использовании у пожилых и ослабленных больных с сопутствующей патологией.
Изобретение относится к медицине, а именно к хирургии, и может быть использовано при оперативном лечении кардиоэзофагеального рака (КЭР) II, III типа (по Зиверту).
Хирургическое лечение рака кардиоэзофагеальной области продолжает оставаться одной из наиболее сложных проблем современной клинической онкологии. Рак проксимального отдела желудка с переходом на пищевод характеризуется как высокозлокачественная опухоль с лимфогенным метастазированием в лимфоколлекторы как брюшной полости, так и средостения. В литературе до настоящего времени нет единого подхода в выборе наиболее рационального доступа и соответственно объема оперативного вмешательства при лечении больных раком кардиоэзофагеальной области. Хирургический доступ в значительной степени определяет эффективность операции. Особенно актуальным становится вопрос о хирургическом доступе при раке кардиального отдела у пожилых и ослабленных больных с сопутствующими кардиореспираторными заболеваниями.
Известен способ оперативного лечения кардиоэзофагеального рака, заключающийся в осуществлении комбинированного торакоабдоминального доступа в VII межреберье слева по Осава-Гэрлоку (М.И.Давыдов, И.Н.Туркин, И.С.Стилиди и др. Кардиоэзофагеальный рак: классификация, хирургическая тактика, основные факторы прогноза. //Вестник РОНЦ им. Н.Н.Блохина РАМН. - №1. - 2003. - С.82-88), при котором выполняют гастрэктомию из единого левостороннего абдомино-торакального доступа, проксимальную резекцию желудка с резекцией нижнегрудного отдела пищевода. Известный способ позволяет под визуальным контролем мобилизовать пищевод до уровня дуги аорты, выполнить лимфодиссекцию до уровня бифуркации трахеи и сформировать высокий анастомоз.
Однако недостатком известного способа является сложность в исполнении, травматичность, значительная кровопотеря и большое количество легочных осложнений.
Известен способ оперативного лечения кардиоэзофагеального рака путем торакофренотомии слева (операция Sweet) (Д.Г.Мустафин, М.Р.Панькова, П.Н.Злыгостев и др. Чресплевральные операции при кардиоэзофагеальном раке. // Вопросы онкологии: Хирургия пищевода и кардиального отдела желудка. - 1995. - С.55-57).
Несмотря на хороший подход к пораженному отрезку пищевода, удобство наложения пищеводно-желудочного анастомоза, полноценную ревизию грудной и брюшной полости, известный способ имеет недостаток, а именно - сложность в выполнении расширенных лимфодиссекций D2-D4 и комбинированных операций.
Наиболее близким по достигаемому положительному результату является способ оперативного лечения кардиоэзофагеального рака путем ляпаротомии с сагитальной диафрагмотомией по А.Г.Савиных (В.С.Рогачева, П.Д.Фомин. Хирургия пищевода (ошибки и опасности). - М., 1983. - С.29-31; А.Ф.Черноусов, В.С.Сильверстов, Ф.С.Курбанов. Пластика пищевода желудком при раке и доброкачественных структурах. - М.: Медицина, 1990. - С.68-78), заключающийся в том, что выполняют диссекцию наддиафрагмальных, нижних параэзофагеальных и бифуркационных лимфоузлов, резицируют дистальный отдел пищевода с формированием анастомоза до уровня нижней легочной вены.
Недостатком известного способа являются значительные трудности в формировании высокого соустья в заднем средостении при резекции нижней трети пищевода, а также при прорастании опухолью медиастинальной плевры, а в ряде наблюдений и легкого, невозможность соблюдения основных принципов радикальности операции. В группе больных, оперированных из доступа по Савиных, частота обнаружения элементов опухоли по линии резекции пищевода оказалась наиболее высокой (М.И.Давыдов, И.Н.Туркин, И.С.Стилиди и др. Кардиоэзофагеальный рак: классификация, хирургическая тактика, основные факторы прогноза. //Вестник РОНЦ им. Н.Н.Блохина РАМН. - №1. - 2003.)
Положительным результатом заявленного способа является снижение травматичности, повышение надежности формирования внутриплеврального соустья за счет оптимальной доступности в выполнении двухзональной абдомино-медиастинальной лимфодиссекции (D2, 2S) и возможности выполнения заявленного способа у пожилых и ослабленных больных с сопутствующей патологией.
Положительный результат заявленного способа (ляпарофренотомия слева) достигается тем, что выполняют диафрагмотомию со вскрытием плевральной полости слева после ляпаротомии под углом 70°, причем диафрагму вскрывают от диафрагмального отверстия пищевода до реберной дуги к VII межреберью, обеспечивая тем самым оптимальный доступ к органам брюшной и плевральной полости слева, с возможностью выполнения двухзональной абдомино-медиастинальной лимфодиссекции (D2 2S). В связи с тем, что реберную дугу не пересекают и истинную торакотомию в VII межреберье не проводят, обеспечивается меньшая травматичность способа, который позволяет свободно формировать пищеводные соустья в заднем средостении до дуги аорты, не используя специальный инструментарий, как в прототипе.
Способ осуществляют следующим образом.
Больного кладут на операционный стол. Стол наклоняют в сторону оперирующего хирурга под углом 20°, под спину на уровне мечевидного отростка подкладывают валик. Под общим обезболиванием операционное поле обрабатывают хлоргикседином дважды, выполняют верхнесрединную ляпаротомию, ревизию брюшной полости, затем производят мобилизацию абдоминального отрезка пищевода и ревизию задненижнего средостения. В случае резектабельности процесса производят диафрагмотомию от диафрагмального отверстия пищевода с пересечением левой ножки диафрагмы в косом направлении под углом 70° по направлению к реберной дуге слева к VII межреберью. Рану расширяют расширителями Сигала. Проводят мобилизацию желудка и пищевода с большим и малым сальником с выполнением двухзональной лимфодиссекции (2D 2S) с пересечением и перевязкой сосудов желудка. Производят субтотальную проксимальную резекцию желудка с резекцией нижней трети пищевода, формируют анастомоз внутриплеврально слева на уровне бифуркации трахеи или ниже. После ревизии брюшной и грудной полостей и дополнительного гемостаза диафрагму ушивают отдельными капроновыми швами от реберной дуги до культи желудка с подшиванием последней к диафрагме. В культю желудка трансназально для декомпрессии анастомоза вводят зонд на 2-3 суток. В плевральную полость устанавливают дренаж в VII межреберье по задней подмышечной линии с несколькими отверстиями для удаления остаточного воздуха и послеоперационного экссудата и укладывают его по задней поверхности до верхушки легкого. Ляпаротомную рану ушивают послойно.
Для анатомо-физиологического обоснования оперативного лечения кардиоэзофагеального рака по заявленному способу в анатомическом эксперименте в 10 наблюдениях выполнены антропометрические измерения с изучением параметров доступа. Выявлены оптимальные параметры: глубина раны - 16,2 см, наклонение операционного действия - 65°, угол операционного действия - 40°.
Клинический пример
Больной А., 63 года, поступил с жалобами на затруднение прохождения твердой, грубой пищи и потерю веса до 5 кг. Сопутствующая патология: ИБС - мерцательная аритмия, нормаформа, НIБ, гипертоническая болезнь II, средний риск осложнения. При эзофагогастроскопии пищевод свободно проходим. Начиная с 40 см, определяется язвенно-инфильтративный рак в кардиальном отделе желудка с переходом на зубчатую линию и малую кривизну тела желудка размером 2×2 см. Гистологический диагноз - аденокарцинома.
Проведена операция из доступа по предложенному способу (ляпарофренотомия слева). При ревизии выявлена опухоль в кардиоэзофагеальной области с переходом по малой кривизне на субкардию, плотная язвенно-инфильтративная форма 2×2 см. Отдаленных метастазов не выявлено. Произведена расширенная комбинированная субтотальная проксимальная резекция желудка с резекцией нижней трети пищевода, со спленэктомией и двухзональной абдоминомедиастинальной лимфодиссекцией (D2 2S). Сформирован погружной инвагинационный эзофагогастроанастомоз по М.И.Давыдову. Ближайшее послеоперационное течение гладкое. Релаксации диафрагмы и, в связи с этим, легочных осложнений не наблюдалось. Дренаж из плевральной полости удален на 4 сутки, назогастральный зонд - на 3 сутки.
Больной выписан на 14 сутки после операции в удовлетворительном состоянии. Осмотрен через 1, 3, 6 месяцев. Жалоб на дисфагию, жжение за грудиной, боли нет. При контрольной рентгеноскопии и ФГС слизистая пищевода на всем протяжении розовая, анастомоз хорошо проходим, признаков эзофагита нет; бариевая взвесь свободно порционно проходит и поступает в желудок. Диафрагма в полипозиционном исследовании стоя, лежа адекватно участвует в акте дыхания.
Таким образом, заявленный способ обеспечивает наиболее оптимальный объем операции, особенно при местнораспространенных кардиоэзофагеальных раках, с выполнением двухзональной абдоминомедиастинальной лимфодиссекции (D2 2S), техническую простоту выполнения более высоких пищеводных внутриплевральных соустий слева. Особенно актуально применение заявленного способа у пожилых и ослабленных больных с сопутствующей патологией.
Способ оперативного лечения кардиоэзофагиального рака, заключающийся в осуществлении лапаротомии с диафрагмотомией, отличающийся тем, что диафрагмотомию проводят от пищеводного отверстия диафрагмы с пересечением левой ножки диафрагмы под углом 70° к реберной дуге слева с последующим дренированием плевральной полости дренажом, который укладывают по задней поверхности до верхушки легкого.
Онкология
М.В. Бурмистров, Е.И. Сигал, Р.М. Тазиев, И.Л. Бродер,
И.Ф. Раббаниев, Л.Л. Морошек, Э.Р. Тикаев
ГОУ ДПО «Казанская государственная медицинская академия», кафедра онкологии и хирургии
Республиканский клинический онкологический диспансер МЗ РТ, Казань
Реферат. Представлен опыт хирургического лечения кардиоэзофагеального рака у 224 пациентов, находившихся на лечении в РКОД МЗ РТ г. Казани. Больные разделены на 3 группы в зависимости от типа аденокарциномы по классификации J.R. Siewert. Таким образом, в 1-й группе было 35 (15,62%) пациентов, во 2-й — 107 (47,76%) и в 3-й — 82 (36,62%). Каждая группа разделена на подгруппы, в зависимости от выполненной операции. Пациентам производились следующие виды операций: трансхиатальная пластика пищевода с эзофагогастроанастомозом на шее, трансторакальная пластика пищевода (операции типа Льюиса и Гэрлока) с внутриплевральным эзофагогастроанастомозом и гастрэктомия с высокой резекцией пищевода. Показана высокая результативность дифференцированного подхода в хирургическом лечении кардиоэзофаге-ального рака в зависимости от типа аденокарциномы. Именно такой подход позволяет улучшить радикальность, уменьшить количество ранних и отдаленных осложнений и повысить выживаемость. Так, выявлено, что при аденокарциномах 1-го типа возможно проведение трансхиатальных и трансторакальных пластик пищевода. При аденокарциномах 2-го типа выполнение гастрэктомий прогностически неблагоприятно. И при аденокарциномах 3-го типа трансхиатальная пластика пищевода крайне неблагоприятна.
Ключевые слова: кардиоэзофагеальный рак, аденокарцинома, экстирпация пищевода, рак Барретта.
Введение
Длительность безрецидивного периода, 3- и 5-летняя выживаемость являются главными критериями эффективности помощи пациентам с онкологическими заболеваниями. Достижения современной онкохирургии, анестезиологии, реаниматологии, химиотерапии и радиологии позволили добиться существенного увеличения продолжительности жизни пациентов со злокачественными новообразованиями [3, 5, 6].
Кардиоэзофагеальный рак (КЭР) — рак проксимального отдела желудка с переходом на пищевод, который характеризуется как высокозлокачественная опухоль с лимфогенным метастазированием в лимфоколлекторы как брюшной полости, так и средостения. За последние 20 лет на фоне снижения заболеваемости раком желудка отмечен резкий рост случаев КЭР [9].
Рак пищеводно-желудочного перехода занимает 6-е место среди причин смерти от рака во всем мире. За последнее время в Европе и Соединенных Штатах произошли значительные изменения в структуре гистологического типа рака пищевода и пищеводно-желудочного перехода в сторону роста аденокарциномы [1, 2].
Несмотря на заметные успехи в хирургическом лечении КЭР, ближайшие и отдаленные результаты экстирпаций и резекций пищевода с одномоментной пластикой остаются неудовлетворительными. Данное обстоятельство требует всесторонней оценки оперативной техники и путей улучшения хирургического лечения КЭР. В связи с этим актуальным остается вопрос выбора оперативного доступа при этом виде рака [4].
Практически значимым примером попытки создания универсальной классификации для адено-карциномы зоны пищеводно-желудочного перехода является классификация, предложенная J.R. Siewert, A.H. Holscher и соавт. в 1996 г. [7, 8].
Материал и методы
В основу работы положен анализ результатов хирургического лечения КЭР у 224 пациентов. Все операции выполнены за период с 01.01.1998 г. по 31.12.2009 г. на базе отделения хирургии пищевода и желудка Республиканского клинического онкологического диспансера Министерства здравоохранения Республики Татарстан. Все больные согласно классификации для аденокарциномы зоны пищеводно-желудочного перехода J.R. Siewert, A.H. Holscher и со-авт. (1996) [7, 8] были разделены на 3 группы. Каждая группа подразделена на подгруппы, в зависимости от выполненной операции. Это трансхиатальная (ТХ) экстирпация пищевода с одномоментной заднемедиа-стинальной пластикой «стеблем» желудка и эзофаго-гастроанастомозом (ЭГА) на шее, экстирпация пищевода трансторакальным (ТТ) право- или левосторонним доступом с внутриплевральным эзофагогастроанасто-мозом и гастрэктомией (ГЭ).
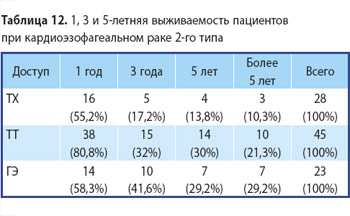
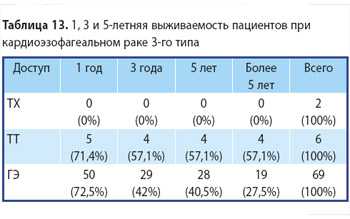
В 1-ю группу вошли 35 (15,62%) пациентов с аденокарциномой 1-го типа (рак Барретта). Из них 17 (48,57%) произведена трансхиатальная пластика пищевода и 18 (51,43%) — трансторакальная. Во 2-й группе было 107 (47,76%) человек с аденокарциномой 2-го типа, из которых 32 (29,9%) прооперированы из абдоминоцервикального доступа, 49 (45,79%) больных после операции из абдоминоторакального доступа и 24 (24,31%) после гастрэктомии. И в 3-й группе было 82 (36,6%) человека с аденокарциномой 3-го типа. Из них 2 (2,43%) произведена трансхиа-тальная пластика пищевода (колопластика), 8 (9,75%) прооперированы из абдоминоторакального доступа (операции типа Льюиса и Гэрлока) и 71 (87,82%) пациенту выполнена гастрэктомия. Распределение пациентов по характеру оперативного вмешательства в зависимости от локализации опухоли представлено в табл. 1.
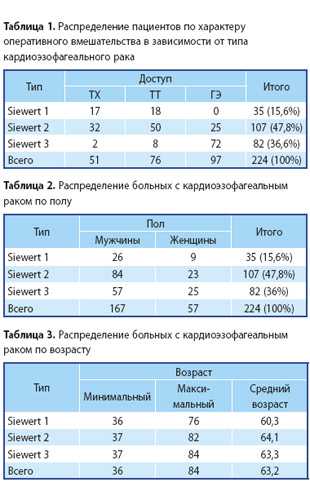
Как видно из представленной табл. 1, в нашем исследовании преобладали пациенты с КЭР 2-го и 3-го типа, что составило 47,8% и 36,6% соответственно.
Распределение пациентов по половому и возрастному составу представлено в табл. 2 и 3.
Мужчин было 167 (74,5%), женщин — 57 (25,5%). В возрасте от 36 до 84 лет (средний возраст пациентов составил 63,2 года). Во всех группах наибольшая заболеваемость отмечалась среди мужчин (в 2—3 раза больше).
Результаты и их обсуждение
Среднее количество послеоперационных койко-дней составило 25,4 дня. Среднее количество лимфатических узлов, удаленных в процессе хирургического вмешательства, составило 5,2. Отмечено, что наибольшее количество удаленных лимфоузлов было при аденокарциноме 3-го типа (18), а наименьшее — при аденокарциноме 1-го типа (11). Данные по количеству удаленных лимфоузлов, в зависимости от типа КЭР, представлены в табл. 4.
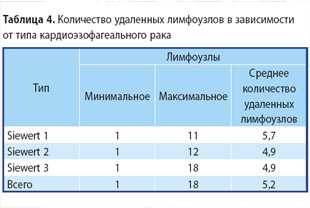
При аденокарциноме 1-го типа во время выполнения ТХ-операций (17) среднее количество обнаруженных лимфоузлов составило 5,3 (минимум — 1, максимум — 8). В этой же группе при выполнении ТТ-операций (18) среднее количество лимфоузлов составило 6,1 (минимум — 1, максимум — 11).
При аденокарциноме 2-го типа во время ТХ-вмешательства (32) в среднем удалено 4,9 лимфоузла (минимум — 1, максимум — 12). В этой же группе при ТТ-операциях (50) выделено в среднем 5 лимфоузлов (минимум — 1, максимум — 11). И наконец, при ГЭ (2) в среднем удалено 4,8 лимфоузла (минимум — 1, максимум — 10).
При аденокарциноме 3-го типа во время ТХ-операций (2) в среднем обнаружено 3 лимфоузла (минимум — 1, максимум — 5), а при ТТ-операциях (8) выделено 8,1 лимфоузла (минимум — 1, максимум — 18). И при ГЭ (72) в данной группе удалено 4,6 лимфоузла (минимум — 1, максимум — 15).
Осложнения в процессе хирургического лечения КЭР представлены ранними и отдаленными. Это несостоятельность эзофагогастро- и эзофагоеюноанасто-моза, свищ ЭГА, различные по локализации плевриты и эмпиемы плевры, интралевральное и внутрибрюшинное кровотечение, нагноение послеоперационной раны, приступы аритмии (пароксизмальная фибрилляция предсердий), серозный перитонит, подкожная эвентрация, острый тромбоз мезенте-риальных сосудов, кишечная непроходимость, отек легких, печеночно-почечная недостаточность, стриктуры анастомозов, рецидив рака в зоне анастомоза. Количество послеоперационных осложнений в зависимости от типа КЭР представлено в табл. 5.
Как видно из представленной табл. 5, при аде-нокарциноме 1-го типа 57,1% послеоперационных осложнения пришлось на долю ТХ-операций и 42,9% после ТТ-вмешательств. В отдаленном послеоперационном периоде осложнений в этой группе не наблюдалось.
При аденокарциноме 2-го типа в послеоперационном периоде при ТХ-, ТТ-операциях и гастрэктомиях наблюдалось 46,2%, 38,4% и 15,4% осложнений соответственно. А в отдаленном послеоперационном периоде — 25%, 50% и 25% осложнений соответственно.
При аденокарциноме 3-го типа 9% послеоперационных осложнений наблюдалось после ТХ-операции, 9% после ТТ и 82% после ГЭ. Два отдаленных осложнения наблюдались после гастрэктомий.
Основным критерием эффективности хирургического лечения у пациентов со злокачественными новообразованиями, как уже было отмечено выше, является их выживаемость. Учитывая убывание пациентов в группах с течением времени по причине их летальности, подсчет производился по формуле Каплана—Мейера. График оценки функции выживаемости представляет убывающую ступенчатую линию, приближающую реальные значения функции выживаемости для этой задачи. Значения функции выживаемости между точками наблюдений считаются константными.
Важным преимуществом процедуры Каплана— Мейера является то, что этот метод справляется с цензурированными данными, т.е. учитывается, что пациенты могут выбывать в ходе эксперимента. Таким образом, предварительно было выявлено, что к концу исследования часть пациентов погибла. Данные представлены в табл. 6.
циномах 2-го типа после ТХ-, ТТ-операций и ГЭ и при аденокарциномах 3-го типа после ТТ-вмешательств и ГЭ составила 5,5%, 3,4%, 4,2%, 4,1%, 14,2% и 1,42% соответственно. Причинами летальных исходов являлись острый тромбоз мезентериальных сосудов, несостоятельность анастомозов с последующей эмпиемой плевры либо перитонитом, отек легких, полиорганная недостаточность и острый инфаркт миокарда.
При аденокарциноме 1-го типа больные перенесли ТХ- и ТТ-пластику пищевода. Количество живых и умерших пациентов показано в табл. 8.
Следует отметить, что в данном случае представлено 213 пациентов из 224, так как 11 пациентов проживают в отдаленных регионах страны и из нашего исследования выбыли.
Важно выделить послеоперационную летальность, которая представлена в табл. 7.
Сроки жизни 12 (75%) погибших пациентов после ТХ-пластики пищевода составили от 2 мес до 8,5 лет. Аналогичный показатель при ТТ-операциях у 9 (53%) пациентов составил от 3 мес до 4 лет и 2 мес.
Сроки жизни 4 (25%) живых пациентов после ТХ-пластики пищевода составили от 1,5 до 9 лет 3 мес. У 8 (44,4%) живых пациентов после ТТ-операций — от 1 года 3 мес до 10 лет 11 мес (рис. 1).
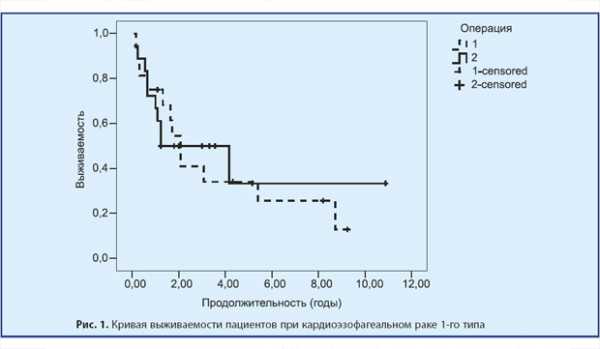
Медиана продолжительность жизни (ПЖ) составила при ТХ-операциях 2 года 1 мес и при ТТ — 1 год 3 мес соответствено.
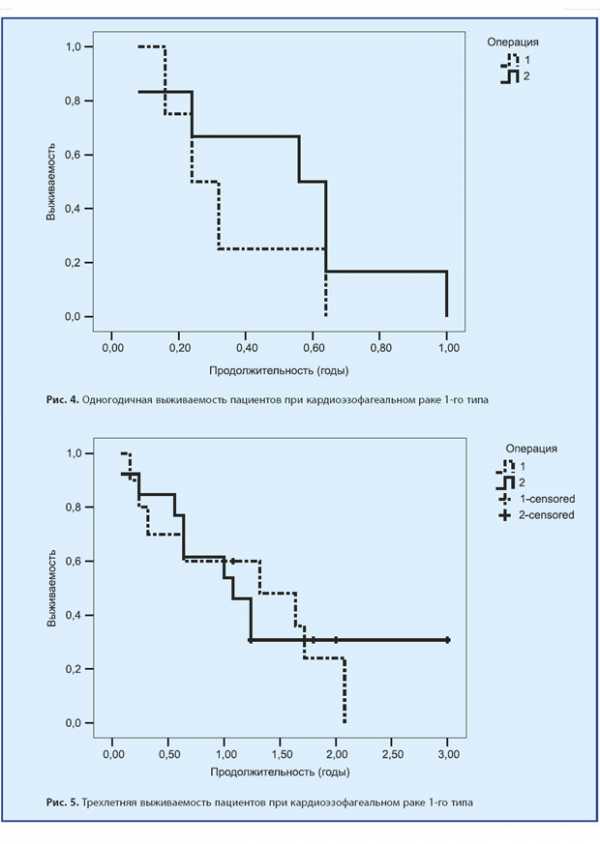
При аденокарциномах 1-го типа после ТХ-операций в течение одного года наблюдалось 75% пациентов, до 3 лет наблюдалось 43,7% пациентов, до 5 лет — 37,5% и более 5 лет — 12,5%. После ТТ-операций — 66,6%, 53%, 44,4% и 33,3% соответственно. Это представлено на рис. 4, 5 и 6.
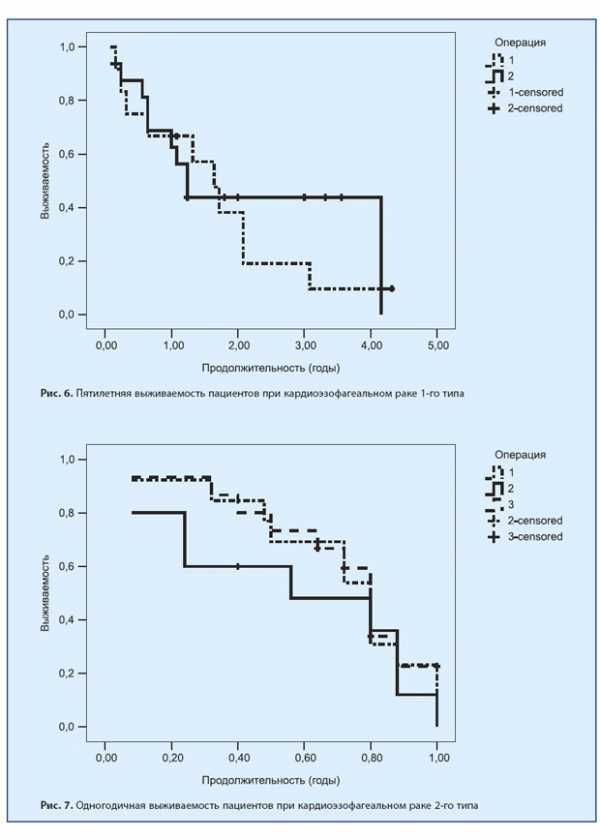
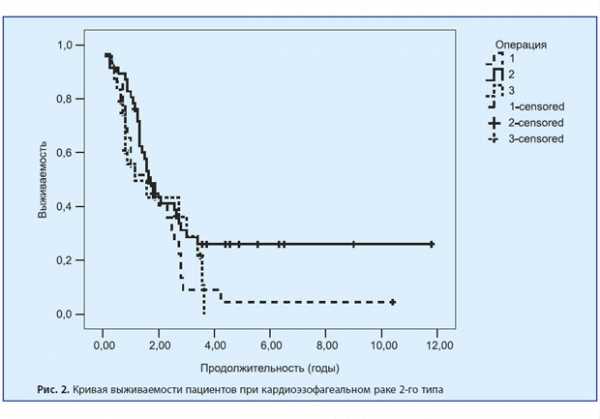
При аденокарциномах 2-го типа после ТХ-операций в течение одного года наблюдалось 55,2% пациентов, до 3 лет наблюдалось 17,2% пациентов, до 5 лет — 13,8% и более 5 лет — 3%. После ТТ-операций — 80,8%, 32%, 30% и 21,3% соответственно.
И после ГЭ один год наблюдалось 58,3%, до 3 лет — 41,6%, до 5 лет — 29,2% и более 5 лет — также 29,2%.
Это представлено на рис. 7, 8 и 9.
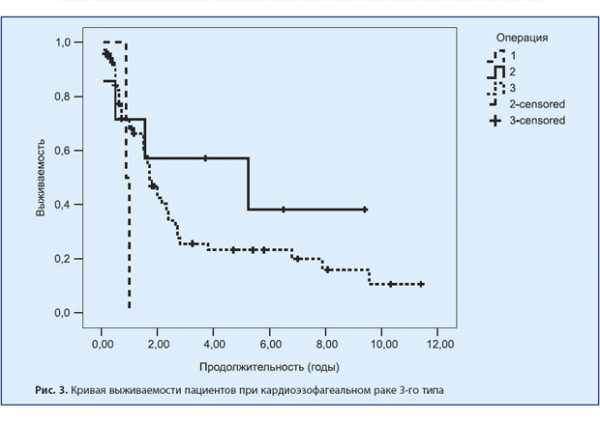
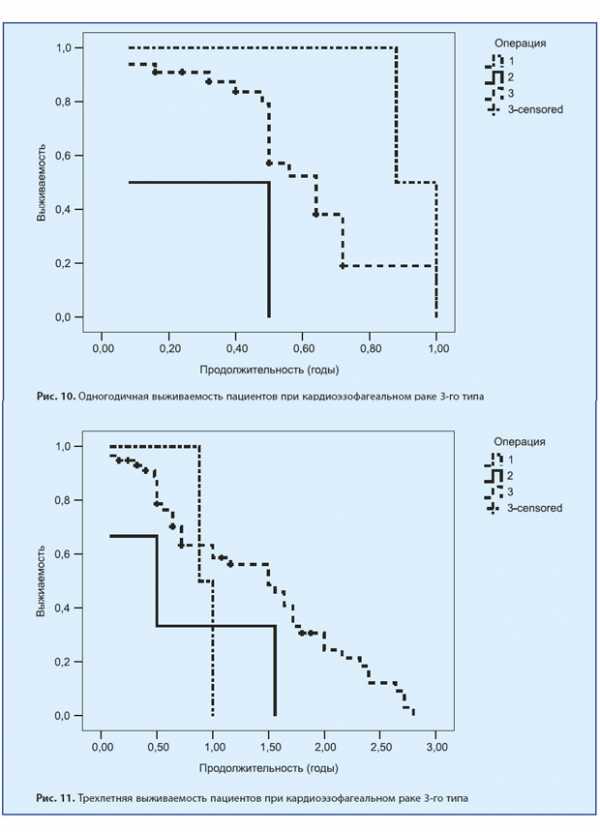
При аденокарциномах 3-го типа после ТХ-операций в течение одного года наблюдалось 0% пациентов. После ТТ-операций — 71,4%, 57,1%, 57,1% и 57,1% соответственно. И после ГЭ один год наблюдалось 72,5%, до 3 лет — 42%, до 5 лет — 40,5% и более 5 лет — 27,5%. Это представлено на рис. 10, 11 и 12.
При аденокарциноме 2-го типа больные перенесли ТХ-, ТТ-операции и ГЭ. Количество живых и умерших пациентов показано в табл. 9.
При аденокарциноме 3-го типа больные также перенесли ТХ-, ТТ-операции и ГЭ. Количество живых и умерших пациентов показано в табл. 10.
Сроки жизни 24 (86,2%) погибших пациентов после ТХ-пластики пищевода составили от 3 мес до 4 лет 3 мес. Аналогичный показатель при ТТ-операциях у 30 (68,0%) пациентов составил от 4 мес до 3 лет и 5 мес. При ГЭ у 16 (70,0%) пациентов — от 4 мес до 3 лет и 8 мес.
Сроки жизни 4 (13,8%) живых пациентов после ТХ-пластики пищевода составили от 1 года 10 мес до 10 лет 5 мес. У 15 (31,9%) живых пациентов после ТТ-операций — от 5 мес до 11 лет 10 мес. И при ГЭ у 7 (29,2%) пациентов — от 8 мес до 3,5 лет. Это показано на рис. 2.
Таким образом, медиана ПЖ составила при ТХ 1 год 7 мес, при ТТ — 1 год 8 мес и при ГЭ — 1 год 2 мес.
Сроки жизни 2 (100%) погибших пациентов после ТХ-пластики пищевода составили от 11 мес до 1 года. Аналогичный показатель при ТТ-операциях у 3 (57,1%) пациентов составил от 5 мес до 5 лет и 3 мес. При ГЭ у 44 (64,3%) пациентов — от 11 мес до 9 лет и 7 мес.
Сроки жизни 3 (42,9%) живых пациентов после ТТ-пластики пищевода составили от 3 лет 9 мес до 9 лет 5 мес. У 25 (35,7%) живых пациентов после ГЭ — от 2 мес до 11 лет 5 мес. Это показано на рис. 3.
Медиана ПЖ составила при ТХ 10 мес, при ТТ — 5 лет 3 мес и при ГЭ — 1 год 8 мес.
Рассмотрим выживаемость пациентов по временным шкалам (1 год, 3 года, 5 лет и более 5 лет).
Таким образом, при аденокарциномах 1-го типа возможно проведение как ТХ-, так и ТТ-операций с небольшим преимуществом ТТ, учитывая, что критерий достоверности в данном случае больше 0,05 (радикальность после ТХ и ТТ хирургических вмешательств составила 5,31 (от 1 до 8) и 6,11 (от 1 до 11) лимфоузлов соответственно. 4 (57,1 %) послеоперационных осложнения пришлись на долю ТХ-операций и 3 (42,9%) наблюдались после ТТ-вмешательств. В отдаленном послеоперационном периоде осложнений в этой группе не наблюдалось. После ТХ-операций 12 (75%) пациентов погибли и 4 (25%) живут. Сроки жизни 12 погибших пациентов после ТХ-пластики пищевода составляют от 58 дней до 8,5 лет. Сроки жизни 4 живых пациентов после ТХ-пластики пищевода составляют от 1,5 года до 9 лет 3 мес. После ТТ-операций в этой группе 10 (55,6%) человек погибли и 8 (44,4%) живут. Сроки жизни при ТТ-операциях у 10 пациентов составляет от 29 дней до 4 лет и 2 мес. У 8 живых пациентов после ТТ-опе-раций — от 1 года 3 мес до 10 лет 11 мес. Медиана ПЖ составила при ТХ-операциях 3 года 8 мес и при ТТ — 4 года 8 мес.
При аденокарциномах 2-го типа выполнение ГЭ прогностически неблагоприятно. Также возможно проведение как ТХ-, так и ТТ-операций с небольшим преимуществом ТТ, учитывая, что критерий достоверности в данном случае больше 0,05, радикальность хирургических вмешательств после ТХ, ТТ и ГЭ составила 4,88 (минимум — 1, максимум — 12), 5,02 (минимум — 1, максимум — 11) и 4,84 (минимум — 1, максимум — 10) лимфоузлов соответственно. В послеоперационном периоде при ТХ-, ТТ-операциях и гастрэктомиях наблюдались 6 (46,2%), 5 (38,4%) и 2 (15,4%) осложнения соответственно, в отдаленном послеоперационном периоде — 1 (25%), 2 (50%) и 1 (25%) осложнений соответственно. После ТХ-операций в этой группе 25 (86,2%) пациентов погибло, 4 (13,8%) — живы. Сроки жизни 25 погибших пациентов после ТХ-пластики пищевода составили от 1 мес до 4 лет 3 мес. Сроки жизни 4 живых пациентов после ТХ-пластики пищевода составили от 1 года 10 мес до 10 лет 5 мес. После ТТ-операций в этой группе погибло 32 (68,1%) пациента, живут — 15 (31,9%) пациентов. Сроки жизни 32 погибших пациентов составили от 1 мес до 3 лет и 5 мес. Сроки жизни 15 живых пациентов составляют от 5 мес до 11 лет 10 мес. После ГЭ в этой группе погибло 17 (70,8%) человек и живут 7 (29,2%) пациентов. Сроки жизни 17 погибших пациентов — от 1 мес до 3 лет и 8 мес. Сроки жизни
7 живых пациентов — от 8 мес до 3,5 лет. Медиана ПЖ составила при ТХ 2 года, при ТТ — 4 года 2 мес и при ГЭ — 1 год 11 мес.
ТХ-пластика пищевода при аденокарциномах 3-го типа прогностически крайне неблагоприятна. Возможно проведение как ТТ-операций, так и ГЭ, с небольшим преимуществом ГЭ по причине малочисленности ТТ хирургических вмешательств. В 3-й группе было 82 человека с аденокарциномой 3-го типа. Из них двум проведена трансхиатальная пластика пищевода,
8 прооперированы одномоментно из абдоминотора-кального доступа (операции типа Льюиса и Гэрлока) и 71 пациенту выполнена гастрэктомия. Радикальность после ТХ, ТТ хирургических вмешательств и ГЭ составила 3 (минимум — 1, максимум — 5), 8,13 (минимум — 1, максимум — 18) и 4,61 (минимум — 1, максимум — 15) лимфоузлов соответственно. Одно (9,09%) послеоперационное осложнение наблюдалось после ТХ-операции, одно после ТТ (9,09%) и 9 (81,82%) после ГЭ. В 2 случаях после ГЭ пациенты повторно поступали с рецидивом рака в месте ЭЕА. После ТХ-операций в этой группе 2 пациента погибли (100%). Сроки жизни 2 погибших пациентов после ТХ-пластики пищевода составляют от 11 мес до 1 года. После ТТ-операций в этой группе погибли 4 (57,1%) пациента, живут 3 (42,9%) пациента. Сроки жизни 4 погибших пациентов составляют от 1 мес до 5 лет и 3 мес. Сроки жизни 3 живых пациентов составляют от 3 лет 9 мес до 9 лет 5 мес. После ГЭ в этой группе погибли 45 (63,8%) человек и живут 25 (36,2%) пациентов. Сроки жизни 45 погибших пациентов — от 11 мес до 9 лет и 7 мес. Сроки жизни 25 живых пациентов — от 2 мес до 11 лет 5 мес. Медиана ПЖ составила при ТХ 11 мес, при ТТ — 4 года 7 мес и при ГЭ — 3 год 4 мес.
Выводы
Наилучшие результаты радикальности имели место при аденокарциномах 1-го типа после ТХ- и ТТ-операций и аденокарциномах 3-го типа после ТТ-вмешательств — 5,31; 6,11 и 8,13 лимфоузлов соответственно.
Однолетняя выживаемость превалировала в группе аденокарцином 1-го типа после ТХ-операций и составила 75%. Трехлетняя выживаемость наилучшая в группе аденокарцином 3-го типа после ТТ-операций и составляет 57,1%. И наконец, 5-летняя выживаемость наивысшей оказалась в этой же группе и составила 57,1%.
Таким образом, полученные нами данные важны для определения хирургической тактики лечения больных КЭР. Становится очевидным, что выбор вида оперативного вмешательства зависит от типа аденокарциномы пищеводно-желудочного перехода. Факты, выявленные в настоящем исследовании, позволили получить дополнительное подтверждение правильности этой концепции, так как благодаря этому достигаются наилучшие послеоперационные и отдаленные результаты лечения и показатели выживаемости.
Литература
1. Давыдов, М.И. Расширенные операции в хирургии рака желудка / М.И. Давыдов, А.Б. Германов, И.С. Стилиди, В.А. Кузьмичев // Хирургия. — 1995. — № 5. — С.41 — 46.
2. Тер-Ованесов, М.Д. Факторы прогноза хирургического лечения рака проксимального отдела желудка: дис. ... д-ра мед. наук / М.Д. Тер-Ованесов. — М., 2007.
3. Баймухамедов, А.А. Оптимизация лечебной тактики при распространенном кардиоэзофагеальном раке: дис. . д-ра мед. наук / А.А. Баймухамедов. — М., 1999. —265 с.
4. Долгоруков, М.И. О хирургическом лечении гастроэзо-фагеального рака: автореф. дис. . канд. мед. наук / М.И. Долгоруков. — Л., 1969. —17 с.
5. Тер-Ованесов, М.Д. Расширенная двух- и трехзональная лимфодиссекция в хирургическом лечении рака грудного отдела пищевода: дис. . канд. мед. наук / М.Д. Тер-Ованесов. — М., 1998.
6. Тер-Ованесов, М.Д. Индекс лимфогенного метастазирова-ния (ИЛМ) как прогностический фактор хирургического лечения рака желудка, способный нивелировать феномен миграции стадии / М.Д. Тер-Ованесов, М.И. Давыдов, Э.Э. Леснидзе // 5-й съезд онкологов стран СНГ. — Ташкент, 2008. — С.36.
7. Siewert, J.R. Kardiakarzinom: Versuch einer therapeutisch relevanten Klassifikation / J.R. Siewert, A.H. Holscher, K. Becker [et al.] // Chirurg. — 1996. — Vol. 58. — P.25—34.
8. Siewert, J.R. Classification of the adenocarcinoma of the oesophagogastric junction / J.R. Siewert, H.J. Stein // British. Journal Surgery. — 1998. — Vol. 85. — P.1457—1459.
9. Fukagawa, T. Isolated tumour cells in lymph nodes in proximal gastric cancer / T. Fukagawa, M. Sasako, S. Nunobe [et al.] // The proceedings of the 6th International Gastric Cancer Congress, Tokyo. — Japan, 2005. — Workshop 3 (Micrometastasis). — P.63.
Что такое аденокарцинома пищевода?
Рак пищевода (РП) находится в 10-ке самых распространенных видов злокачественных опухолей, причем наибольшие показатели заболеваемости регистрируют в развитых странах. Основное число пациентов – мужчины за 50 лет, у молодых людей рак пищевода встречается крайне редко. По причине отсутствия специфических симптомов на первых стадиях болезни, диагностируют карциному пищевода у 70% людей на 3-4 стадии.
Разделяют два вида данного заболевания, которые поражают человеческий организм в равных количествах, то есть 50/50 — это плоскоклеточный рак и аденокарцинома. В данной статье мы рассмотрим аденокарциному пищевода и узнаем причины его появления, симптомы опухоли, стадии развития, способы диагностики и лечения.
Пищевод представляет собой мышечный канал длиной 25 см, который соединяет глотку и желудок. В нем происходит первый этап переваривания еды. Различают три отдела: шейный, грудной и абдоминальный (брюшной). Стенки этого органа состоят из нескольких оболочек: слизистой, подслизистой, мышечного слоя и наружной адвентиции.
Аденокарцинома пищевода, которую еще называют железистым раком, поражает подслизистую оболочку. Чаще это происходит в нижнем отделе. Постепенно опухоль прорастает глубже в мышечный слой, а затем выходит за пределы органа. Эта стадия представляет большую опасность из-за соседства пищевода с аортой, бронхами, трахеей, верхней полой веной, перикардом.
Железистый рак
Аденокарцинома может расти экзофитно (то есть в полости пищевода) или эндофитно (прорастая из слизистой оболочки в другие слои и обхватывая пищевод вокруг). Не редко встречаются и смешанные типы.
Опухоли нижнего отдела чаще растут вверх по пищеводу, нежели в сторону желудка. Метастазирует рак пищевода лимфогенно и гематогенно, поражая легкие и печень, реже – кости. По статистике, уже на первых стадиях болезни у 40-80% пациентов наблюдаются метастазы в прилегающих лимфоузлах, так как пищевод имеет богатую лимфатическую сеть. Отдаленные поражения находят в половине случаев.
Преимущественно встречается первичная опухоль пищевода, и лишь в 3% случаются метастатические поражения от рака груди, мозга, легких, шеи, желудка и других органов.
Причины возникновения аденокарциномы пищевода
Распространенной причиной аденокарциномы пищевода является болезнь под названием пищевод Баррета. Это явление, при котором нормальные клетки оболочки пищевода замещаются цилиндрическими, характерными для желудка или кишечника. Доказано, что у половины людей с такой патологией со временем образовывается рак.
Другие предраковые заболевания:
- полипы и язвы;
- тилоз. Это генетическое заболевание, при котором структура слизистой пищевода отличается от нормальной. Это может стать причиной мутаций в ней;
- дивертикулы;
- синдром Пламмера-Винсона, который характеризуется постоянным воспалительным процессом в пищеводе. Он вызывает РП в 10% случаев;
- гастроэзофагеальная рефлюксная болезнь. У людей с таким недугом происходят выбросы кислоты из желудка в пищевод, из-за чего велика вероятность развития аденокарциномы;
- папиллома вирус;
- ахалазия. Такое нарушение моторики пищевода увеличивает риск возникновения злокачественных образований в 15 раз;
- ожоговые стриктуры. Ожоговые травмы пищевода, вызванные химикатами, твердой пищей или инородными предметами, могут дать о себе знать даже спустя 10-20 лет.
Онкология пищевода может быть следствием таких факторов:
- курение. Эта вредная привычка способствует появлению рака, особенно, если у человека есть какие-то хронические болезни пищевода. Из-за курения мужчины в 3 раза чаще болеют РП, чем женщины;
- неправильное питание. Является причиной недостатка витаминов и микроэлементов в организме. Слишком горячая, острая, твердая пища наносит вред пищеводу. Также засоленная и минерализированная вода, в сочетании с курением и алкоголем могут стать причиной различных нарушений.
- ожирение. Избыточный вес оказывает давление на пищевод, плюс переедание и неправильное питание – эти факторы приводят к рефлюксной болезни, она – к пищеводу Баррета, что в свою очередь – к РП.
Для профилактики аденокарциномы необходимо отказаться от вредных привычек, питаться полезной едой и заниматься физическими упражнениями.
Симптомы опухоли пищевода
Первым тревожным признаком РП является дисфагия (перекрытие трети или половины пищевода). Вначале она проявляется в трудности проглатывания твердой пищи, затем становится тяжело глотать даже кашу и жидкость. Когда опухоль достигает больших размеров и сдавливает пищевод – развивается последняя степень дисфагии – полное перекрытие пищевода.
Симптомы аденокарциномы пищевода это:
- болевые ощущения, тяжесть и дискомфорт за грудиной;
- отрыжка, срыгивание пищи;
- боль во время глотания;
- тошнота и рвота.
- изжога;
- повышенное слюноотделение;
- неприятный запах изо рта.
Появление этих симптомов уже говорит о запущенности процесса.
Признаки распространения опухоли за пределы пищевода:
- охриплость или изменение голоса;
- брадикардия;
- увеличенные лимфоузлы;
- сильный кашель;
- отдышка;
- внутренние кровотечения (проявляются в виде рвоты с кровью или темным стулом).
К общим симптомам рака относятся: слабость, большая потеря веса, анемия, повышенная температура тела.
Стадии аденокарциномы пищевода
Выделяют 4 стадии онкологического процесса:
- 1 стадия — новообразование небольшого размера (до 3 см) находится в слизистой оболочке пищевода, не проникающее в слой мышц;
- 2 стадия — аденокарцинома прорастает в мышечный слой и сужает пищевод. Диаметр ее составляет около 5 см. На второй стадии возможно возникновение региональных метастаз в лимфатических узлах;
- 3 стадия характеризуется опухолью, которая проросла сквозь внешний слой пищевода и прилегающую жировую ткань или серозную оболочку. Она имеет множественные метастазы в лимфоузлах. Отдаленных поражений пока нет;
- аденокарцинома пищевода 4 степени имеет большой размер. Наблюдаются обширные поражения пищевода и соседних тканей. Прослеживаются отдаленные поражения в органах и лимфатических узлах.
Как видите, эта форма рака развивается очень быстро, поэтому лечение аденокарциномы пищевода необходимо начинать как можно раньше.
Диагностика заболевания
Первичная диагностика аденокарциномы пищевода включает:
- опрос больного (жалобы, семейный анамнез и т.д.) и внешний осмотр;
- ренгенологическое исследование с применением контрастного вещества. Эта процедура позволит выявить наличие поражения, его размер и степень сдавливания пищевода;
- ФЭГДС. С помощью эндоскопа, который вводят через рот до желудка можно точнее рассмотреть поверхность внутренних органов, определить распространенность аденокарциномы в глотке, гортани и желудке, а также в региональных лимфоузлах. Одновременно берут материал разных участков пищевода для последующего исследования в лаборатории и определения типа опухоли.
Для уточнения диагноза назначают:
- УЗИ томография. Такое исследование направленно на выявление метастаз в шейной зоне, брюшной полости и забрюшинном пространстве. Также можно увидеть такие органы, как печень и почки;
- по показаниям проводят компьютерную или магниторезонансную томографию (например, если результаты УЗИ были спорными). Эти методы показывают даже самые мелкие патологии. Можно вывить поражения в отдаленных органах и лимфатических узлах;
- трахеобронхоскопия. Используется для исследования трахеи и бронхов;
- иногда проводят торакоскопию и лапороскопию. Это методы, при которых через разрез в коже вводятся специальные инструменты с видеокамерой. При торакоскопии изучают плевральную полость, а при лапароскопии – брюшную.
Если пациенту будет назначена операция, то нужно пройти целый ряд анализов: кардиографию, анализ свертываемости крови, УЗИ сосудов, исследование дыхания и другие тесты для оценки функционального состояния главных систем организма.
Информативное видео
Лечение аденокарциномы пищевода
Есть несколько методов лечения опухоли пищевода:
- Хирургический. Операция на пищеводе при раке проводится всегда, когда есть возможность, так как этот метод самый эффективный. Зачастую делают субтотальную резекцию пищевода, которая подразумевает удаление целого отдела этого органа вместе с прилегающей клетчаткой и опухолью, отступая от нее не менее 5 см. Одновременно выполняют лимфодиссекцию (удаляют региональные трахеобронхиальные, абдоминальные и средостенные лимфоузлы). Во время операции проводят пластику пищевода желудком. В редких случаях (например, при опухолях или язвах желудка) для пластики используют часть толстого или тонкого кишечника. Иногда выполняют полное удаление пищевода, с последующей пластикой из желудка и участка кишки.
Для опухолей первой стадии. Когда они затрагивают только слизистую оболочку, применяют метод эндоскопической резекции, то есть удаление с помощью эндоскопа. 5-летняя выживаемость составляет от 80 до 100%. Но для рака 2 и 3 стадии только лишь хирургическое лечение не даст должных результатов. Поэтому его совмещают с химиотерапией и облучением.
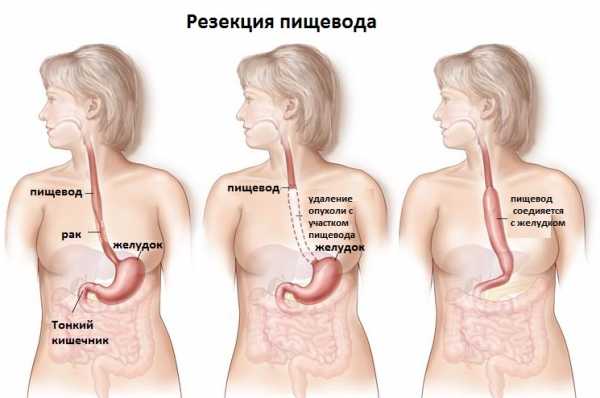
Резекция
- Химиотерапия. Назначается как самостоятельный метод лечения, так и в дополнение к хирургическому (до или после операции). При аденокарциноме обычно проводят несколько курсов до резекции, и несколько – после. Предоперационная химия позволяет уменьшить опухоль и симптомы дисфагии.
- Облучение. Применяют для больных, которым резекция противопоказана или в комплексе с резекцией и химией. Лучевая терапия, проведенная на ранних стадиях, может лишь незначительно увеличить продолжительность жизни больного. По разным данным совмещение облучений с химиопрепаратами не продлевают жизнь пациента, в других случаях – улучшения заметны.
Химиолучевая терапия применяется при нерезектабельном раке (например, когда прослеживаются отдаленные метастазы или множественные региональные поражения).
При выраженной дисфагии, когда опухоль перекрывает пищевод, человеку необходимо провести лечение, направленное на восстановление нормального питания. Для этого используют операцию по наложению гастростромы или стенирования (установление трубки, которая расширяет просвет пищевода), также возможно проведение лазерной коагуляции опухоли, что позволяет уничтожить ее клетки и освободить пищевод.
Прогноз жизни при аденокарциноме пищевода
Вовремя диагностированная опухоль пищевода хорошо поддается лечению. 5-летняя выживаемость для первой стадии после операции составляет 80-100%. Беда в том, что на 1 стадии опухоль обнаруживают редко. Поэтому общий показатель 5-летней выживаемости равен 10%. Для 2 стадии показатель составляет 30-40%, для 3 – до 10%. Пациенты с 4 стадией живут не больше года.
Для выявления рака на ранних стадиях людям, которые находятся в зоне риска (с рефлюксной болезнью, пищеводом Баррета, вирусом папилломы и др.) необходимо проходить регулярное обследование. Оно включает эндоскопическое исследование и биопсию раз в год. Если по результатам анализов выявлена дисплазия, то назначают паллиативное лечение или операцию.
Питание при раке пищевода должно включать в себя побольше белка. Это отварное, нежирное мясо, яйца, молочные продукты, орехи. Нужно кушать жидкие каши, супы и пюре, вареные овощи. Порции должны быть маленькими, переедать нельзя. Для больных, которые не могут питаться самостоятельно, предусмотрено зондовое искусственное питание.
Информативное видео:
Будьте здоровы!
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ КАРДИОЭЗОФАГЕАЛЬНОГО РАКА
В С. Мазурин
МОНИКИ, Москва
Каким образом можно улучшить непосредственные и отдаленные результаты лечения кардиоэзофагельного рака, какие есть для этого резервы? Мы полагаем, что резервы для этого следующие:
- ранняя диагностика и раннее оперирование этой категории больных;
- строгое соблюдение и выполнение разработанных методик оперативных вмешательств;
- обязательное выполнение расширенной лимфаденэктомии при радикальных хирургических вмешательствах;
- обеспечение адекватного послеоперационного периода;
- концентрация больных раком кардиоэзофагеальной области в специализированных клиниках;
- подготовка высококвалифицированных хирургов, способных выполнять сложные хирургические вмешательства в такой трудной для оперирования анатомической области, как кардиоэзофагеальная зона.
При правильном подходе к данной проблеме и учете всех перечисленных факторов, эффективность хирургического лечения больных раком кардиоэзофагеальной области может быть значительно повышена.
Хирургия кардиоэзофагеального рака прошла долгий путь в своем развитии и достигла высот, и мы не согласны с мнением тех специалистов, которые считают, что хирургический метод лечения достиг своего "потолка". Не следует забывать о том, что общий прогноз хирургического лечения не должен служить индивидуальным прогнозом в каждом конкретном случае.
Мы глубоко убеждены, что улучшение результатов хирургического лечения рака пищевода и желудка в целом и в частности кардиоэзофагеального рака связано с дальнейшим развитием, усовершенствованием и оптимизацией хирургического метода лечения, в котором до окончательного совершенства еще очень далеко. И в этом свою роль должны сыграть отказ от консервативных традиций, принятых в ряде клиник, постоянная переоценка и переосмысление существующих способов и методов лечения и неустанный творческий поиск новых, более эффективных средств и путей их лечения.
Несомненно и то, что перспектива улучшения отдаленных результатов лечения кардиоэзофагеального рака связана с развитием методов комбинированного лечения. Хирургический метод, оставаясь основным, должен быть совершенен, ибо никакое комбинирование не сможет исправить дефекты хирургии. Задача комбинирования - дополнить диапазон хирургического метода системным воздействием для того, чтобы нивелировать реализацию отдаленных метастазов, являющихся основной причиной гибели больных в отдаленные сроки.
Учитывая локальный характер лечебного воздействия при применении гипоксирадиотерапии, мы рассчитывали на уменьшение числа местных рецидивов, но полученные результаты не подтвердили эти предположения. Повлиять же на отдаленные результаты с помощью сочетания двух локальных методов лечения (хирургического и лучевого), которые после 1,5-2 лет в основном являются результатом реализации отдаленных метастазов, не представляется возможным. Эти соображения и полученные результаты заставили нас искать более перспективные и эффективные варианты комбинированного лечения. Таковыми нам представляются комбинации из локального (хирургического) и системного (химиотерапии) методов лечения.
Несмотря на предполагаемую высокую эффективность адъювантной химиотерапии, получить этому подтверждение не удалось; данные других авторов также не позволяют сделать однозначных выводов. На наш взгляд, более перспективным является применение предоперационной (неоадъювантной) химиотерапии. При этом можно достичь девитализации опухоли, разрушения мигрирующих раковых клеток, уменьшения массы основной опухоли до операции. Следовательно, к моменту операции возможно создание наиболее благоприятных условий для удаления опухоли.
При применении неоадъювантной полихимиотерапии во всех случаях кардиоэзофагеального рака мы наблюдали выраженные в той или иной степени изменения в морфологической структуре опухоли, обусловленные предоперационной регионарной химиотерапией: I степень патоморфоза получена у 38,5% больных; II степень - у 36,5%; III степень - у 19,2%; IV степень - у 5,8% пациентов.
К настоящему времени мы имеем результаты 5-летней выживаемости в группе комбинированного лечения с предоперационной регионарной химиотерапией:
-
1 год прожили 85,7% (42/49) больных;
2 года прожили 77,6% (38/49) больных;
3 года прожили 53,1% (26/49) больных;
5 лет прожили 49,8% (20/49) больных.
В группе чисто хирургического лечения 3-летний показатель равен 34,6% (без лимфодиссекции) и 41,1% (с лимфодиссекцией).
Перспективу эффективного комбинированного лечения мы связываем не только с системными методами лечения (химиотерапией и иммунотерапией), но и с дальнейшим совершенствованием техники абластичного выполнения оперативных вмешательств. Добиться значимых результатов от применения комбинированного лечения возможно лишь при совершенстве всех составляющих комбинацию методов. Такова наша основная позиция в оценке перспектив лечения кардиоэзофагеального рака.
Способ комбинированного лечения кардиоэзофагеального рака iii стадии
Изобретение относится к области медицины, а именно к онкологии, и касается способов комбинированного лечения кардиоэзофагеального рака III стадии. Способ обеспечивает повышение эффективности комбинированного лечения кардиоэзофагеального рака III стадии за счет предотвращения прогрессирования опухолевого процесса в анатомических структурах средостения. Проводят комбинированную гастрэктомию, спленэктомию и интраоперационную лучевую терапию (ИОЛТ) через лапаротомный доступ непосредственно на ложе удаленной опухоли и зоны регионального метастазирования. При этом выполняют резекцию нижней трети пищевода и проводят дополнительно ИОЛТ с очаговой дозой 10 Гр через торакотомный хирургический доступ на поле облучения, включающее в себя структуры средостения.
Изобретение относится к области медицины, в частности к онкологии, и касается способов комбинированного лечения кардиоэзофагеального рака III стадии.
Известны способы комбинированного лечения кардиоэзофагеального рака III стадии (абдоминальный и нижнегрудный отделы), которые заключаются в сочетании радикального оперативного вмешательства с предоперационной лучевой терапией. Однако последние недостаточно эффективны, поскольку облучение перед операцией вызывает постлучевые изменения в виде воспалительной реакции и нарушения микроциркуляции в облучаемых тканях. В послеоперационном периоде это ведет к нарушению репаративных процессов и, как следствие, к частому развитию тяжелых, а подчас смертельных гнойно-септических осложнений [3]. Наиболее опасным является недостаточность пищеводно-кишечного анастомоза, летальность при данном виде осложнений равняется 60-70%. Таким образом, тяжелое течение раннего послеоперационного периода с высоким уровнем хирургической летальности нивелирует антибластоматозный эффект комбинированного лечения, который не успевает реализоваться в отдаленные сроки наблюдения.
Наиболее близким к предлагаемому способу (прототипом) является способ комбинированного лечения рака желудка III стадии, включающий в себя радикальную операцию в сочетании с интраоперационной лучевой терапией (ИОЛТ). Интраоперационное облучение как компонент комбинированного лечения, несомненно, повышает эффективность лечения, так как очаговая доза подводится непосредственно на ложе удаленной опухоли и зоны регионального метастазирования, что по литературным данным приводит к улучшению отдаленных результатов лечения больных [1,2]. Однако данная методика комбинированного лечения у больных кардиоэзофагеальным раком III стадии не позволяет предотвратить прогрессирование опухолевого процесса за счет развития рецидива в культи пищевода либо в лимфоузлах средостения.
Новая техническая задача - повышение эффективности комбинированного лечения больных кардиоэзофагеальным раком III стадии за счет предотвращения прогрессирования опухолевого процесса в анатомических структурах средостения.
Для решения поставленной задачи в способе комбинированного лечения кардиоэзофагеального рака III стадии, включающего комбинированную гастрэктомию, спленэктомию и интраоперационную лучевую терапию (ИОЛТ) через лапаротомный доступ непосредственно на ложе удаленной опухоли и зоны регионального метастазирования, выполняют резекцию нижней трети пищевода и проводят дополнительно ИОЛТ с очаговой дозой 10 Гр через торакотомный хирургический доступ на поле облучения, включающее в себя структуры средостения..
Новым в изобретении является то, что во время операции проводят дополнительно ИОЛТ на второе поле облучения, включающее в себя структуры средостения, интраоперационное облучение подводится через торакотомный хирургический доступ.
Таким образом, изобретение соответствует критерию «новизна».
Изобретение соответствует критерию «изобретательский уровень», так как оно явным образом не следует для специалиста из уровня техники.
Изобретение соответствует критерию «промышленно применимо», так как оно успешно применено в клинической практике.
Способ осуществляют следующим образом. Интраоперационное облучение разовой дозой 10 Гр на первое поле проводят во время абдоминального этапа операции, коллиматор вводится через применяемый лапаротомный доступ, облучению подвергается ложе удаленной опухоли и зоны регионального лимфогенного метастазирования. Второе поле ИОЛТ разовой дозой 10 Гр формируется во время торакального этапа оперативного вмешательства, коллиматор вводится через правосторонний торакотомный доступ, в поле облучения включаются ложе удаленного пищевода и окружающая клетчатка средостения.
Обоснование способа. Отдаленные результаты лечения больных кардиоэзофагеальным раком остаются неудовлетворительными, причем они значительно хуже, чем при раке желудка прочих локализаций [3-6]. Одной из причин является иной спектр метастазирования, при злокачественном поражении кардиального отдела желудка одними из первых метастазами поражаются лимфатические узлы, находящиеся выше диафрагмы, в нижнем этаже средостения (группа по классификации). Удаление этих анатомических образований при хирургическом лечении кардиоэзофагеального рака возможно только при сочетанном торакоабдоминальном оперативном доступе.
Однако осуществить комбинированное лечение с дополнительным лучевым воздействием на зону метастатически измененных лимфоузлов очень трудно. При проведении предоперационной лучевой терапии в поле облучения неизбежно попадает комплекс здоровых тканей, включающий в себя такие критические органы, как сердце, печень, спинной мозг, возникающие тяжелые постлучевые реакции со стороны указанных органов особенно нежелательны в раннем послеоперационном периоде. Кроме того, дистанционная лучевая терапия вызывает изменения микроциркуляции в зоне облучения за счет быстрого формирования постлучевого фиброза, что приводит к нарушению процессов заживления и в конечном итоге к развитию смертельных послеоперационных осложнений.
Интраоперационная лучевая терапия быстрыми электронами лишена вышеуказанных недостатков, методика позволяет селективно подвести адекватную канцероцидную дозу излучения к очагу-мишени без какой-либо лучевой нагрузки на критические органы. Однако при поражении лимфатического аппарата средостения у больных кардиоэзофагеальным раком технически невозможно провести интраоперационное облучение анатомических структур, находящихся выше диафрагмы, из традиционного абдоминального хирургического доступа. Поэтому ряд авторов считает распространение опухолевой инфильтрации проксимальнее розетки кардии абсолютным противопоказанием для ИОЛТ местнораспространенного рака желудка.
Клинический пример 1. Больная Ш., 62 лет, находилась в отделении с 01.04.00, история болезни №122520 с диагнозом кардиоэзофагеальный рак, III стадия (T4N1M0). Гистология (№3693-3708, 10.04.99): перстневидноклеточный рак. При поступлении предъявляла жалобы на дисфагию II-III степени. Анамнез заболевания составлял около 3 месяцев. При ЭГДС и рентгенографии определялась опухолевая инфильтрация всех стенок желудка, суживающая его просвет и поражающая тело до антрального отдела, кардиальный отдел желудка с распространением на н/3 пищевода на протяжении до 4 см. После предоперационной подготовки 01.09.00 больной выполнена операция в следующем объеме: из верхнесрединного лапаротомного доступа мобилизован желудок с обоими сальниками, брыжейкой поперечно-ободочной кишки и селезенкой, поскольку имелась опухолевая инфильтрация 2-х последних анатомических образований. На зону культи левой желудочной артерии и ложе опухоли проведена ИОЛТ в дозе 10 Гр (1-е поле). Коллиматор для формирования поля облучения введен через лапаротомный разрез. Затем выполнен торакальный этап операции - отдельный торакотомный доступ справа, пищевод вместе с параэзофагеальной клетчаткой мобилизован до уровня нижней легочной связки. Макропрепарат удален в едином блоке. На ложе удаленного пищевода проведена ИОЛТ вторым полем в дозе 10 Гр, коллиматор вводился через торакотомную рану. Реконструктивный этап операции проводился стандартно, по принятой в клинике методике. Послеоперационный период протекал без осложнений, раны зажили первичным натяжением, больная выписана из клиники в удовлетворительном состоянии на 18-е сутки после операции. При контрольном обследовании через 1 год после операции данных за прогрессирование заболевание не получено.
Режим предлагаемого способа основан на анализе клинических наблюдений. По предлагаемому способу получили комбинированное лечение 3 больных кардиоэзофагеальным раком III стадии, в возрасте 41-62 года, 1 мужчина, 2 женщины. Всем больным выполнена комбинированная гастрэктомия с резекцией н/3 пищевода и спленэктомией из раздельного торако-абдоминального доступа справа. Пациентам проводилась ИОЛТ 2-я полями разовой дозой 10 Гр: 1-е поле - ложе опухоли и зона чревного ствола, облучение проводилось после мобилизации желудка через лапаротомный доступ, 2-е поле - ретроперикардиальная клетчатка, облучение проводилось через правосторонний торакотомный доступ, после удаления макропрепарата. В послеоперационном периоде в одном случае развилась послеоперационная пневмония на стороне операции, которая была купирована в результате антибиотикотерапии. Постлучевых реакций и летальных исходов не было. Сроки наблюдения после завершения лечения составили 3-24 месяца. В 2-х случаях пациенты наблюдаются без признаков прогрессирования заболевания. У одной больной через 18 месяцев после операции развился рецидив заболевания вне зоны, проведенной ИОЛТ, произошло метастатическое поражение лимфоузлов брыжейки тонкой кишки.
Таким образом, предложенный способ комбинированного лечения больных кардиоэзофагеальным раком III стадии снижает риск развития постлучевых повреждений критических органов и обеспечивает улучшение отдаленных результатов лечения данной категории онкологических больных.
Литература
1. Зырянов Б.Н., Афанасьев С.Г., Завьялов А.А., Мусабаева Л.И. Интраоперационная лучевая терапия. - Томск, 1999. - 286 с.
2. Бердов Б.А., Мардынский Ю.С., Скоропад В.Ю., Титова Л.Н. Возможности интраоперационной лучевой терапии в улучшении результатов хирургического лечения опухолей желудочно-кишечного тракта // Вопросы онкологии. - 1995. - №2. - с 94-96.
3. Давыдов М.И., Туркин И.Н., Стилиди И.С. и др. Кардиоэзофагеальный рак: классификация, хирургическая тактика, основные факторы прогноза. Вестн. РОНЦ им. Н.Н.Блохина. 2003.
4. Азимов Р.Х., Кубышкин В.А. Обзор. Рак кардии. Выбор хирургической тактики. Хирургия. 2004; 8:66-71.
5. Stein H, Sendler A, Fink U, Siewert J. Multidisciplinary Approach to Esophag-eal and Gastric Cancer. Surg Clin North Am 2000; 80.
6. Wayman J, Dresner S, Roumes S et al. Transhiatal approach to total gastrectomy for adenocarcinoma of the gastric cardia. Br J Surg 1999; 4:536-40.
Способ комбинированного лечения кардиоэзофагеального рака III стадии, включающий комбинированную гастрэктомию, спленэктомию и интраоперационную лучевую терапию (ИОЛТ) через лапаротомный доступ непосредственно на ложе удаленной опухоли и зоны регионального метастазирования, отличающийся тем, что выполняют резекцию нижней трети пищевода и проводят дополнительно ИОЛТ с очаговой дозой 10 Гр через торакотомный хирургический доступ на поле облучения, включающее в себя структуры средостения.
Лечение рака желудка. Часть 1
Для лечения рака желудка используют 3 основных метода: хирургический, лучевой и химиотерапевтический - как отдельно, так и в виде различных комбинаций. Метод лечения выбирают на основании распространённости процесса и состояния пациента. Хирургический способ остаётся «золотым стандартом» радикального лечении рака желудка, позволяющим надеяться на полное выздоровление.Именно поэтому, если в процессе обследования у пациента выявляют локализованную опухоль, ему показано радикальное хирургическое лечение.
Однако даже локализованный характер патологии, но с признаками местного распространения опухолевого процесса в виде вовлечения окружающих структур либо обширного лимфогенного метастазирования может служить показанием к проведению комбинированного лечения, которое можно проводить в следующих вариантах:
• хирургическое лечение с неоадъювантной химиотерапией;
• хирургическое лечение с адъювантной химиотерапией;
• хирургическое лечение с периоперационной химиотерапией;
• хирургическое лечение с адъювантной химиолучевой терапией;
• хирургическое лечение с проведением гипертермической интраоперационной интраперитонеальной химиотерапии или ранней послеоперационной интраперитонеальной химиотерапии;
• комбинированное химиолучевое лечение без операции.
При диссеминированных формах рака желудка тактика лечения тоже зависит от характера и распространённости заболевания. На сегодняшний день этой категории больных большинство онкологов назначают консервативное лечение, а хирургический метод используют лишь как средство экстренной помощи при развитии осложнений: перфорации опухоли с разлитым перитонитом, дисфагии с полной непроходимостью пищевода, декомпенсированного стеноза выходного отдела желудка и профузного желудочного кровотечения.
Отдалённые результаты лечения диссеминированных форм свидетельствуют о том, что активная тактика с проведением хирургического лечения может улучшить результаты у некоторых подгрупп этой категории больных. Более удовлетворительные результаты при комбинированном лечении диссеминированных форм могут быть получены:
• при выполнении расширенных (с D3-лимфодиссекцией) вмешательств у пациентов с метастазами в забрюшинные парааортальные лимфатические узлы;
• солитарных или единичных метастазах в одну долю печени, выполнением комбинированных резекций органа;
• метастазах в яичники, выполнением комбинированной надвлагалищной ампутации матки с придатками и проведением дополнительной гипертермической интраперитонеальной химиоперфузии.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Объём выполняемого вмешательства обусловлен как самой первичной опухолью, так и распространённостью лимфогенного метастазирования.Оперативные вмешательства подразделяют:
• на радикальные операции (тип А), в результате которых удаляют резидуальную опухолевую ткань с высокой вероятностью полного излечения;
• условно-радикальные операции (тип В), которые обеспечивают отсутствие микроскопической и макроскопической резидуальной опухоли, но существует вероятность субклинических опухолевых очагов;
• паллиативные операции (тип С), направленные на ликвидацию осложнений опухолеваго процесса, но предполагающие оставление опухоли.
ПОКАЗАНИЯ К РАДИКАЛЬНОМУ ХИРУРГИЧЕСКОМУ ВМЕШАТЕЛЬСТВУ
Основная цель радикального вмешательства при раке желудка - полное удаление опухоли с учётом возможных местных (интрамуральных) и лимфогенных путей распространения опухолевых клеток. Это основа выбора объёма хирургического вмешательства как с учётом интрамуральной распространённости, так и строения экстраорганной лимфатической системы.Радикальную операцию проводят если есть возможность полного удаления первичной опухоли, нет отдалённых метастазов и диссеминации процесса по брюшине, включая свободно расположенные в брюшной полости опухолевые клетки, а также если состояние пациента позволяет её провести. Окончательная оценка возможности выполнения радикального вмешательства возможна лишь после выполнения интраоперационной (острой) ревизии, то есть после рассечения связочного аппарата с мобилизацией желудка и вовлечённых в процесс органов, визуализацией сосудистых структур желудка и оценкой возможности выполнения моноблочной комбинированной резекции. «Острая» ревизия - начальный этап моноблочной мобилизации комплекса и её необходимо выполнять с учётом основных принципов онкологической хирургии.
При выборе объёма планируемого вмешательства необходимо чётко ответить на основные вопросы, отражающие тактику лечения у каждого конкретного пациента:
• Будет ли хирургическое лечение у данного пациента радикальным?
• Сопоставима ли операционная травма с индивидуальными особенностями данного пациента?
• Возможна ли послеоперационная реабилитация с удовлетворительным сохранением функций (приём пищи естественным путём, кратность и количество пищи, динамика массы тела)?
На сегодняшний день наиболее онкологически оправдано выполнение расширенного радикального вмешательства с последующим восстановлением непрерывности пищеварительного тракта наиболее функциональным способом.
При экзофитных локализованных формах роста опухоли желудка (Боррманн-1; II) в целях достижения достоверной радикальности необходимо отступать от края опухоли минимум на 3 см в проксимальном направлении.
При инфильтративных формах роста опухоли (Боррманн-III-IV) обычно отступают от определяемой границы минимум на 5 см в проксимальном направлении. При раке дистальной трети желудка в большинстве лечебных учреждений чаще выполняют дистальную субтотальную резекцию желудка.
Радикальной субтотальной резекцией желудка в онкохирургии можно считать только удаление 4/5 желудочной стенки с удалением всей малой кривизны до уровня пищеводно-желудочного перехода.
Конечно, такой объём оперативного вмешательства более функционален, чем гастрэктомия, но к этим операциям имеются строгие показания, и подобные вмешательства нельзя применять в ущерб онкологической радикальности.
В Российском онкологическом научном центре им. Н.Н. Блохина показанием к выполнению дистальной субтотальной резекции желудка считают локальную неинфильтративную опухоль (Боррманн-I; II), локализованную в антральном отделе, без перехода на угол желудка. Во всех случаях инфильтративных опухолей, а также при локализованных экзофитных опухолях с переходом на тело желудка обязательно выполняют гастрэктомию de principle.
Частота выполнения гастрэктомии косвенным образом свидетельствует о том, следуют хирурги этим положениям или нет. С учётом того что новообразования тела и проксимального отдела желудка составляют около 60%, а среди опухолей дистальной трети - более половины эндофитные и около 10% переходят на угол желудка, то при хирургическом лечении рака желудка более 80% должны составлять гастрэктомии.
Не менее важным фактором наряду с интрамуральной распространённостью опухолевого процесса считают лимфогенную распространённость, то есть вовлечение регионарных лимфатических узлов. При пальпаторно определяемых метастатических узлах в связочном аппарате желудка (особенно в паракардиальной области справа и слева при опухолях антрального отдела даже с учётом небольшого размера экзофитной неинфильтративной опухоли) целесообразно выполнение гастрэктомии.
Другим определяющим фактором считают наличие явных метастазов по ходу селезёночной артерии, а также в воротах селезёнки. Если при радикальной гастрэктомии всегда выполняют комбинированную спленэктомию, то при массивном поражении цепочки лимфоузлов по ходу селезёночной артерии показана комбинированная резекция поджелудочной железы различного объёма, вплоть до субтотальной резекции 95% паренхимы (по Фрею-Чайльду).
Проксимальную субтотальную резекцию желудка можно выполнить лишь у пациентов с небольшими размерами опухоли (до 4 см в наибольшем измерении), локализующейся в проксимальном отделе без распространения на верхнюю треть тела желудка. Причём необходимо резецировать и неизменённую визуально и пальпаторно стенку желудка на 2 см дистальнее определяемой границы опухоли при поверхностном (стелющемся) характере роста, на 3 см - при экзофитном и на 5 см и более - при эндофитном и смешанном типе роста. Эти границы допустимы и при выполнении радикальной операции.
Для определения возможности выполнения проксимальной субтотальной резекции желудка с высокой степенью надёжности можно использовать топографо-анатомическую классификацию рака проксимального отдела желудка по J.R. Siewert и соавт. (1998).
В основу классификации положены 2 принципа, объединённые вместе, - гистологическая структура опухоли (аденокарцинома) и её точная локализация. Основной определяющий фактор - расположение эпицентра опухоли относительно пищеводно-желудочного перехода и зоны анатомической кардии.
Авторы выделяют 3 типа опухоли с учётом локализации центра новообразования (рис. 61-4):
• I тип - аденокарцинома дистального отдела пищевода, эпицентр которой расположен в пределах от 1 до 5 см выше зоны пищеводно-желудочного перехода (Z-линии) с возможным распространением через неё в сторону желудка;
• II тип - истинная аденокарцинома зоны пищеводно-желудочного перехода (истинный рак кардии) с эпицентром в пределах 1 см проксимально и 2 см дистально от Z-линии;
• III тип - рак с локализацией основного массива опухоли в субкардиальном отделе желудка (от 2 до 5 см проксимально от Z-линии) и возможным вовлечением дистальных отделов пищевода.
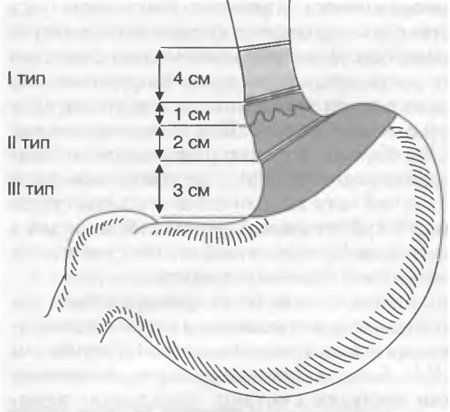
Рис. 61-4. Классификация аденокарциномы кардиоэзофагеального перехода по Зиверту (1998).
При II типе аденокарциномы пищеводно-желудочного перехода можно выполнить проксимальную субтотальную резекцию желудка, а при III типе во всех случаях требуется комбинированная гастрэктомия со спленэктомией и обязательным выполнением лимфодиссекции D2. Факторы, определяющие противопоказания к выполнению проксимальной субтотальной резекции желудка - метастазы в лимфатические узлы, расположенные вдоль правой половины большой кривизны желудка, а также супрапилорические и субпилорические. Поэтому пальпаторное обнаружение увеличенных лимфатических узлов этих групп при интраоперационной ревизии требует выполнения гастрэктомии с моноблочным удалением всего связочного аппарата желудка.
ОБЪЁМ ЛИМФОДИССЕКЦИИ ВО ВРЕМЯ РАДИКАЛЬНОЙ ОПЕРАЦИИ
Традиционные радикальные операции по поводу рака включали обязательное моноблочное удаление регионарных лимфатических узлов. Впервые такой подход был предложен более 100 лет назад Холстед при хирургическом лечении рака молочной железы. С тех пор это положение определяет стратегию онкохирургии в целом и тактику хирургического лечения рака органов желудочно-кишечного тракта в частности. Детально отработаны технические аспекты выполнения расширенных вмешательств при раке желудка со стандартным удалением забрюшинных лимфатических узлов чревного ствола и его ветвей.Понятие превентивной расширенной лимфодиссекции было впервые введено при хирургическом лечении рака желудка с удалением поражённого органа и зон регионарного метастазирования. На сегодняшний день широко применяют 2 термина, отражающие характер выполняемых вмешательств с учётом лимфатической системы желудка: «лимфодиссекция» и «лимфаденэктомия».
Лимфодиссекция включает удаление не только лимфатических узлов, но и всего лимфатического аппарата (лимфатических сосудов с окружающей жировой клетчаткой) в пределах фасциальных футляров и отражает принцип моноблочности удаления. Именно это положение, обоснованное временем и опытом, считают теоретической предпосылкой возможности выполнения радикальной операции при раке желудка путём удаления первичного очага с зонами возможного регионарного лимфогенного метастазирования.
Различные варианты лимфодиссекции нашли своё отражение в классификации объёма вмешательств (табл. 61-4).
Таблица 61-4. Варианты лимфодиссекции (D1-3) при гастрэктомии
| Тип вмешательства, D - объём лимфодиссекции | Объём лимфодиссекции | ||
| Регионарное метастазирование | n1 | n2 | n3 |
| Стандартная гастрэктомия, D1 | + | - | - |
| Стандартная радикальная гастрэктомия, D2 | + | + | - |
| Расширенная радикальная гастрэктомия, D3 | + | + | + |
На сегодняшний день данная классификация степени радикальности выполняемой лимфодиссекции применима лишь для Японских и некоторых специализированных европейских и американских клиник, так как в большинстве публикаций D2-лимфодиссекцию уже рассматривают как расширенную. Ведущие мировые клиники для улучшения отдалённых результатов лечения при удовлетворительных непосредственных результатах рекомендуют стандартный объём лимфодиссекции D2. Она представляется достаточно безопасной процедурой и должна стать обязательным элементом хирургического лечения рака желудка.
МЕТОДЫ РЕКОНСТРУКЦИИ ПОСЛЕ ГАСТРЭКТОМИИ
В настоящее время в хирургии рака желудка актуальна разработка физиологических методов восстановления непрерывности кишечной трубки. От этого этапа операции зависят качество жизни пациентов, социальная и функциональная реабилитация.В клинической практике широко используют 3 основные методики реконструкции после гастрэктомии (рис. 61-6):
• петлевую пластику с формированием кишечного резервуара;
• эзофагоэнтероанастомоз на отключённой петле по методу Ру;
• включение в пищеварительный тракт сегментов тонкой или толстой кишки (интерпозиция) на сосудистой ножке, с восстановлением естественного пассажа пищи по двенадцатиперстной кишке или с созданием тонкокишечного резервуара.
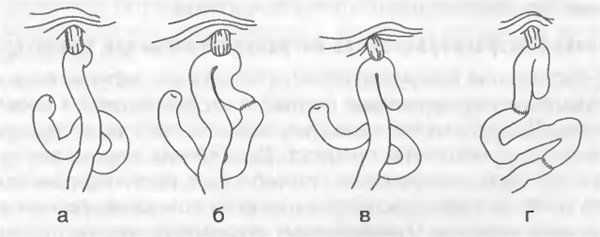
Рис. 61-6. Варианты реконструкции после гастрэктомии: а - по Ру; б - по Ханту-Лимо-Басто с формированием резервуара J-Pouch; в - с формированием резервуара на непересечённой петле по Ру; г - с включением в пассаж двенадцатиперстной кишки с резервуаром на сегменте петли.
Выбор метода пластической реконструкции зависит от нескольких факторов, и, в первую очередь, от радикальности выполненного вмешательства, а также от индивидуальных особенностей строения брыжейки каждого пациента. Алгоритм выбора метода реконструкции приведён на рис. 61-7.
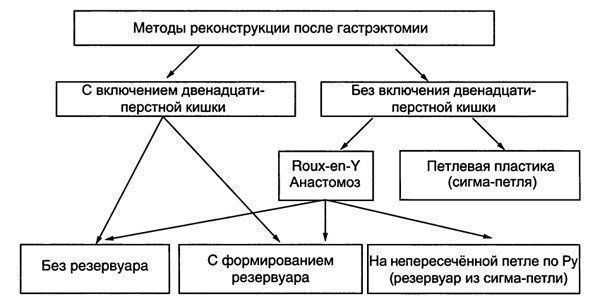
Рис. 61-7. Методы реконструкции после гастрэктомии.
Основные положения, которым необходимо следовать, - наиболее полное физиологическое восстановление кишечного тракта и минимизация возможного рефлюкс-эзофагита.
Наиболее оптимальными считают следующие варианты постгастрэктомической пластики:
• при полной радикальности, то есть резекции адекватного характеру опухоли объёма тканей (с учётом опухолевого роста) и отсутствии признаков диссеминации, возможно выполнение реконструкции с интерпозицией сегментов кишки на ножке с включением двенадцатиперстной кишки либо формирование тонкокишечных резервуаров;
• если операция представляется условно-радикальной, с учётом распространённости заболевания возможно выполнение реконструкции по Ру или петлевой пластики;
• при паллиативном вмешательстве единственно оправданным вариантом с точки зрения безопасности и прогнозируемого периода жизни считается выполнение петлевой впередиободочной пластики.
М.И. Давыдов, М.Д. Тер-Ованесов
Рак пищевода — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 июня 2019; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 июня 2019; проверки требуют 4 правки.Рак пищевода — онкологическое заболевание пищевода, составляет значительную часть от всех заболеваний этого органа. Основными симптомами этого заболевания являются: прогрессивное нарушение глотания (сначала твёрдой пищи, потом жидкой) и непреднамеренное снижение массы тела. По состоянию на 2012 год рак пищевода был восьмым наиболее распространенным онкологическим заболеванием в мире с 456 000 новых случаев заболевания в течение года.[1] У мужчин рак пищевода встречается примерно в 3 раза чаще, чем у женщин.[2]
К основным факторам риска, которые могут вызвать возникновение рака пищевода, относятся:
- Постоянный приём горячей, грубой и плохо пережёванной пищи
- Употребление спиртных напитков
- Частое употребление горячих напитков (чай, кофе)[3]
- Курение
- Пищевод Барретта
- Эзофагиты
- Дивертикулит
- Термические и химические ожоги пищевода, сопровождающиеся образованием рубцов
- Лейкоплакии
Встречаются 3 типа рака пищевода:
- Экзофитный (узловой, грибовидный, папилломатозный - рост в просвет органа)
- Эндофитный (язвенный)
- Инфильтративный склерозирующий (циркулярная форма)
Чаще всего (97—99 % случаев) обнаруживают плоскоклеточный рак с ороговением и без ороговения. Также встречаются железистые формы рака пищевода и опухоли, происходящие из дистопированного эпителия. Редко обнаруживают также недифференцированный рак.
Метастазирование рака пищевода обусловлено развитой лимфатической сетью пищевода. Метастазы распространяются на прилежащие лимфатические сосуды, а затем и лимфатические узлы. Рак шейного отдела пищевода метастазирует в глубокие шейные лимфатические узлы, рак верхнегрудного и среднегрудного отделов пищевода поражает метастазами параэзофагеальные, трахеобронхиальные и задние средостенные лимфоузлы; рак нижнегрудного и брюшного отделов распространяется в поддиафрагменные, параэзофагеальные, паракардиальные лимфатические узлы, а также в лимфоузлы вдоль малой кривизны желудка и левой желудочной артерии. Кроме того, встречаются метастазы в лимфоузлы малого сальника, вдоль левой желудочной артерии и в шейные и надключичные лимфоузлы.
Отдалённые метастазы поражают печень, лёгкие, костную систему.
Согласно TNM-классификации:
Т — первичная опухоль
- Тх — недостаточно информации для оценки первичной опухоли
- Т0 — первичная опухоль не обнаружена
- Tis — carcinoma in situ.
- T1 — опухоль прорастает стенку пищевода вплоть до подслизистого слоя
- Т2 — опухоль прорастает стенку пищевода до мышечного слоя
- Т3 — опухоль прорастает стенку пищевода до адвентиции.
- Т4 — опухолевый процесс распространяется на соседние органы
N — регионарные лимфатические узлы
- Nх — недостаточно данных для оценки регионарных лимфатических узлов
- N0 — метастазы в регионарные лимфоузлы не обнаружены
- N1 — обнаруживаются метастазы в регионарные лимфоузлы
М — отдаленные метастазы
- Мх — недостаточно информации для определения отдаленных метастазов
- М0 — отдалённые метастазы не обнаружены
- М1 — обнаруживаются отдалённые метастазы
В соответствии с отечественной классификацией рак пищевода делится на 4 стадии:
- 1 стадия — небольшое новообразование поражает слизистую оболочку и подслизистую основу стенки пищевода, но не сужают просвет пищевода и не прорастают его мышечный слой. Метастазы отсутствуют (T1N0M0)
- 2 стадия — опухолевые массы проникают в мышечную оболочку пищевода и сужают просвет, но за пределы органа не выходят. В регионарных лимфоузлах обнаруживаются единичные метастазы (2А-стадия: T2N0M0, T3N0M0; 2Б-стадия: T1N1M0, T2N1M0)
- III стадия — в опухолевый процесс вовлечены все слои стенки пищевода, а также околопищеводная клетчатка или серозная оболочка, но соседние органы не задеты. В регионарных лимфоузлах обнаруживаются многочисленные метастазы (T3N1M0, T4 любая N M0)
- IV стадия — рак поражает все слои стенки пищевода и распространяется на соседние органы. Метастазы обнаруживаются в регионарных и отдалённых лимфоузлах (любая T, любая N, M1)
Клинические симптомы рака пищевода можно разделить на три группы: первичные или местные симптомы, обусловленные поражением стенок пищевода; вторичные симптомы, возникающие в результате распространения опухолевого процесса на соседние органы и ткани; общие симптомы, обусловленные интоксикацией и нарушением питания.
К первичным симптомам относятся дисфагия, боли за грудиной, ощущение полноты за грудиной, срыгивание пищей (регургитация), усиленная саливация. Практически все эти симптомы свидетельствуют о достаточно большом распространении патологического процесса по пищеводу.
Типичные симптомы рака пищевода обусловлены феноменом обтурации. Наиболее ярким из них является дисфагия — затруднение прохождения пищи по пищеводу. Дисфагия обусловлена сужением просвета органа растущей опухолью (механическая дисфагия), но иногда она зависит от спазма в вышележащих отделах пищевода (рефлекторная дисфагия).
В большинстве случаев дисфагия нарастает постепенно. Вначале появляются едва заметные задержки при прохождении по пищеводу твёрдой пищи. Больной как бы ощущает твёрдый пищевой комок, продвигающийся по пищеводу. Сужение прогрессирует, и вскоре больной вынужден запивать твёрдую пищу глотком воды или отказываться от приёма вторых блюд. В дальнейшем через несколько недель или месяцев перестаёт проходить полужидкая пища, а затем и жидкость. Такое последовательное развитие дисфагии наблюдается не всегда. Иногда в результате распада опухоли или медикаментозного лечения проходимость пищевода частично или полностью восстанавливается. Улучшение состояния длится недолго, и вскоре дисфагия вновь начинает прогрессировать.
- Отказ от курения и приема алкоголя
- Употребление в пищу овощей (согласно статистическим данным Национального Института Рака (США) употребление в пищу капусты, брокколи, брюссельской капусты коррелирует с уменьшением частоты возникновения рака пищевода)
- Умеренное употребление кофе статистически коррелирует с уменьшением частоты возникновения рака пищевода
- Осторожное употребление чрезмерно горячих напитков - чая и кофе[4].
- ↑ World cancer report 2014. — Lyon, France. — 630 pages с. — ISBN 9789283204299, 9283204298.
- ↑ World cancer report 2014. — Lyon, France. — 630 pages с. — ISBN 9789283204299, 9283204298.
- ↑ Farhad Islami, Hossein Poustchi, Akram Pourshams, Masoud Khoshnia, Abdolsamad Gharavi. A prospective study of tea drinking temperature and risk of esophageal squamous cell carcinoma (англ.) // International Journal of Cancer. — Vol. 0, iss. 0. — ISSN 1097-0215. — doi:10.1002/ijc.32220.
- ↑ Carcinogenicity of drinking coffee, mate, and very hot beverages - The Lancet Oncology