Лейкомаляция что это такое
Перивентрикулярная лейкомаляция — Википедия
Перивентрикулярная лейкомаляция (ПВЛ) — форма поражения белого вещества полушарий головного мозга у детей, открытая морфологами, одна из причин детского церебрального паралича. ПВЛ характеризуется возникновением очагов некроза, преимущественно коагуляционного, в перивентрикулярных зонах белого вещества полушарий головного мозга у новорождённых детей (редко у мёртворождённых).[3] Она относится к одной из форм так называемой «гипоксически-ишемической энцефалопатии».
Первое микроскопическое описание очага ПВЛ принадлежит J. M. Parrot (1873)[4]. Р. Вирхов[5] лишь макроскопически описал очаги желтоватого цвета в перивентрикулярных зонах боковых желудочков мозга у умерших новорождённых, родившихся от матерей с сифилисом и оспой, относя их к врождённому энцефалиту. Нет достаточных оснований относить данные очаги к ПВЛ. Поражение описывалось под разными названиями («энцефалодистрофия», «ишемический некроз», «перивентрикулярный инфаркт», «коагуляционный некроз», «лейкомаляция», «размягчение мозга», «инфаркт перивентрикулярного белого вещества», «некроз белого вещества», «диффузная симметричная перивентрикулярная лейкоэнцефалопатия»), причём чаще немецкими учеными, но всемирное распространение получил термин «перивентрикулярная лейкомаляция», введённый в 1962 г. B. A. Banker и J. C. Larroche [6]. Термин недостаточно чёткий, так как при ПВЛ возникают не размягчения, а более плотные по сравнению с окружающими участками мозга очаги коагуляционных некрозов. Первая статья в СССР и России, посвящённая ПВЛ, написана В. В. Власюком с соавт. (1981), который предложил воспользоваться термином «перивентрикулярная лейкомаляция».
Наиболее полные в мире исследования ПВЛ на самом большом секционном материале проведены В. В. Власюком (1981)(частота, этиопатогенез, топография, степень поражения различных отделов мозга, стадии развития очагов,нейрогистология, роль микроглии, электроная микроскопия и др.), который впервые выявил высокую частоту поражения зрительной лучистости и доказал, что ПВЛ — это персистирующий процесс, что к старым очагам некрозов могут присоединяться новые, что очаги ПВЛ могут находиться на разных стадиях развития.[7][8]
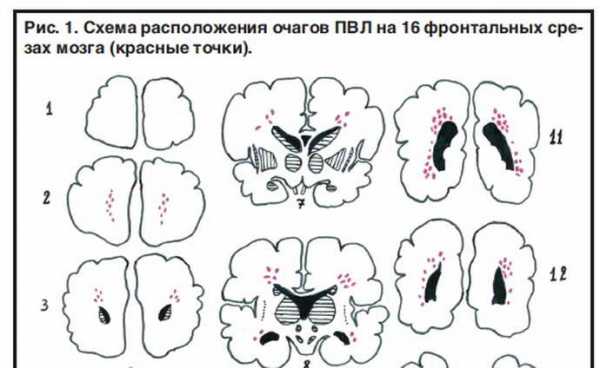
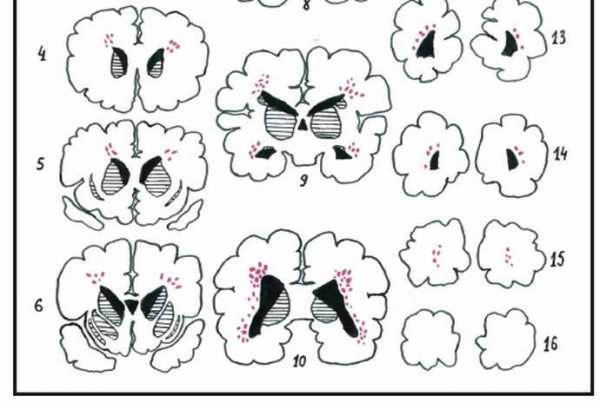
По морфологической сути ПВЛ — это мелкоочаговые в основном коагуляционные перивентрикулярные инфаркты белого вещества мозга, чаще двусторонние и относительно симметричные. При ПВЛ очаги некрозов располагаются в перивентрикулярной зоне, но при наличии множества очагов (тяжёлых поражениях) отдельные из них могут распространяться на центральные отделы белого вещества мозга. C наибольшей частотой очаги ПВЛ возникают в перивентрикулярном белом веществе начальных отделов задних рогов боковых желудочков мозга (поражается зрительная лучистость) и центральных отделов желудочков на уровне зрительных бугров (поражается кортико-спинальный тракт). В процессе морфогенеза очаги проходят три стадии: 1) развития некроза, 2) резорбции и 3) формирования глиозного рубца или кисты. Кисты возникают при крупных и сливающихся очагах ПВЛ, при смешанных некрозах (колликвация в центре и коагуляционный ободок по периферии). Вокруг очагов обычно определяется зона других поражений белого вещества мозга — гибель проолигодендроцитов, пролиферация микроглиоцитов и тучных астроцитов, отек, кровоизлияния, гибель капилляров и др. (так называемый «диффузный компонент» ПВЛ). Однако диффузные поражения без некрозов это не ПВЛ. Если произвести 15 фронтальных срезов мозга, то обнаружение очагов ПВЛ в 1-4 срезах свидетельствует о лёгкой степени ПВЛ, в 5-8 срезах — о средней степени ПВЛ и в 9-13 срезах — о тяжёлой степени ПВЛ (2).
Частота ПВЛ по данным разных авторов колеблется от 4,8 % до 88 %, однако часто среди определённой группы детей или по данным нейросонографических исследований, что не вполне объективно. На невыборочном секционном материале частота ПВЛ составляет 12,6 %, причём чаще у мальчиков, а в зависимости от массы при рождении: 1001—1500 г — 13,3 %, 1501—2000 г — 21,5 %, 2001—2500 г — 31,6 %, 2501-3000 г — 14,8 %, более 3000 г — 3,5 %. У недоношенных 1-й и 2-й степеней встречается чаще всего. У умерших в первые сутки после рождения ПВЛ встречается с частотой 1,8 %, а у умерших на 6-й-8-й дни — 59,2 %. В группе родившихся при головном предлежании частота ПВЛ составляет 19,6 %, тазовом предлежании — 17,4 %, при кесаревом сечении — 35,6 %.[9]
Этиологически ПВЛ это гипоксически-ишемическое поражение белого вещества мозга, связанное с артериальной гипотонией, приступами апноэ после рождения, реанимационными мероприятиями, инфекциями и др. Способствует ПВЛ недоношенность, причём небольшой степени (1-2-й). Патогенетические факторы: гипоксия, ацидоз, гипокапния, токсины и др. Очаги некрозов (инфаркты) возникают в пограничной зоне между вентрикулофугальными и вентрикулопетальным артериальными ветвями[10], локализующейся в перивентрикулярном белом веществе мозга.
Для данной нозологии характерны 2 основных признака:
- 1. локализация в перивентрикулярных зонах белого вещества больших полушарий
- 2. очаги имеют характер преимущественно коагуляционных некрозов.
Вокруг очагов ПВЛ могут определяться другие поражения, так называемый «диффузный компонент».
Время возникновения ПВЛ — в основном в первые дни после рождения, иногда анте- и интранатально.
У глубоко недоношенных детей чаще возникают другие поражения белого вещества мозга, отличные от ПВЛ — диффузная лейкомаляция и мультикистозная энцефаломаляция. Ввиду недостаточной изученности последних поражений, их часто стали ошибочно относить к ПВЛ.
ПВЛ надо дифференцировать с со следующими основными поражениями белого вещества больших полушарий мозга:
- отечно-геморрагическая лейкоэнцефалопатия (ОГЛ)
- телэнцефальный глиоз (ТГ)
- диффузная лейкомаляция (ДФЛ)
- субкортикальная лейкомаляция (СЛ)
- перивентрикулярный геморрагический инфаркт (ПГИ)
- внутримозговое кровоизлияние (ВМК)
- мультикистозная энцефаломаляция[11]
- субэпендимальная псевдокиста.
При СЛ очаги некрозов располагаются в субкортикальной области и в отдельных тяжёлых случаях могут распространяться на центральные отделы больших полушарий. При ДФЛ очаги некрозов располагаются диффузно во всех отделах белого вещества мозга, захватывая перивентрикулярную, субкортикальную и центральную области больших полушарий; некрозы колликвационные, ведут к кистообразованию и возникают наиболее часто у глубоко недоношенных детей. При ТГ нет полного некроза мозга и кисты не образуются. ПГИ возникают при тромбозах в системе внутренних мозговых вен или являются осложнением внутрижелудочковых кровоизлияний. Псевдокисты не имеют никакого отношения к некрозам мозга и относятся скорее всего к порокам развития. Патогенез всех перечисленных поражений различен.
В настоящее время имеет место гипердиагностика ПВЛ за счёт переоценки данных нейровизуализационных исследований и недооценки других поражений белого вещества мозга.
- Власюк В. В. Перивентрикулярная лейкомаляция у детей. СПб, «Гликон Плюс», 2009.- 218 с.,ISBN 978-5-93682-540-8.
- Власюк В. В., Туманов В. П. Патоморфология перивентрикулярной лейкомаляци. Новосибирск, «Наука», 1985.- 96 с.
- Власюк В. В., Майер И. О., Охтырская Л. А., Бабуцидзе Т. Я. Перивентрикулярная лейкомаляция у новорождённых и её танатогенетическое значение. Педиатрия, 1981, № 11, с. 32-36.
- Nervivporyadke.ru
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ 1 2 Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ 1. Власюк В. В. Перивентрикулярная лейкомаляция у детей. — СПб.: Гликон Плюс, 2009. — 218 с. ISBN 978-5-93682-540-8.
- ↑ Parrot J. M. Etude sur le ramollissement de l’encephale chez le nouveaune. — Arch. Physiol. Norm. Path., 1873, v. 5, p. 59-79.
- ↑ Virchow R. Zur pathologischen Anatomie des Gehirns: I. Congenitale Encephalitis und Myelitis. — Virchows Arch., 1867, Bd 38, S. 129—138.
- ↑ Banker B. A., Larroche J. C. Periventricular leukomalacia of infancy. A form of neonatal anoxic encephalopathy. — Arch. Neurol., 1962, v. 7, p. 386—410.
- ↑ Власюк В. В., Туманов В. П. Патоморфология перивентрикулярной лейкомаляци. Новосибирск, «Наука», 1985.- 96 с.
- ↑ Власюк В. В., Майер И. О., Охтырская Л. А., Бабуцидзе Т. Я. Перивентрикулярная лейкомаляция у новорождённых и её танатогенетическое значение. Педиатрия, 1981, № 11, с. 32-36.
- ↑ В. В. Власюк Родовая травма и перинатальные нарушения мозгового кровообращения. СПб, «Нестор История», 2009.- 252 С. ISBN 978-5-98187-373-7.
- ↑ De Reuck J., Chattha A. S., Richardson E. P. Pathogenesis and evolution of periventricular leukomalacia in infancy. — Arch. Neurol., 1972, v. 27, p. 229—236.
- ↑ В. В. Власюк, Ю. П. Васильева, А. А. Вильниц, В. Е. Карев. Мультикистозная энцефаломаляция у детей, роль инфекций. Журнал инфектологии, 2010, № 2, с. 45-53. ISSN 2072-6732.
Лейкомаляция (перивентрикулярная) головного мозга детей
© Автор: А. Олеся Валерьевна, к.м.н., практикующий врач, преподаватель медицинского ВУЗа, специально для СосудИнфо.ру (об авторах)
Лейкомаляцию относят к ишемически-гипоксическим повреждениям головного мозга, диагностируемым у новорожденных. Она представляет серьезную проблему неонатологии и неврологии, поскольку отдаленные последствия патологии очень сложно поддаются лечению, приводя к инвалидности.
При лейкомаляции в головном мозге обнаруживают очаги некроза, возникшие после тяжелой гипоксии и нарушения кровотока. Они расположены главным образом вокруг боковых желудочков, поэтому перивентрикулярное поражение – наиболее частый вариант патологии, о котором и пойдет речь ниже.
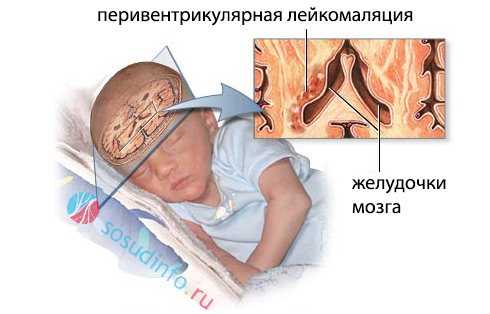
перивентрикулярная (околожелудочковая) лейкомаляция
Перивентрикулярная лейкомаляция (ПЛ) встречается примерно в 12% случаев среди новорожденных, обычно – у недоношенных детей, причем, частота ее зависит от массы, с которой младенец появился на свет. Наибольшее число малышей страдает лейкомаляцией, если масса при рождении была 1500-2500 г. В этом случае патология обнаруживается практически у каждого третьего.
Около 60% новорожденных, проживших до недели, имеют признаки ПЛ. Кесарево сечение значительно повышает ее риск (до 35%) по сравнению с естественными родами, но это касается случаев с уже имеющейся пренатальной патологией. Если малыш внутриутробно рос и развивался нормально, а кесарево сечение проводится в положенный срок, то сама по себе операция не увеличивает риск подобного повреждения головного мозга.
Причины лейкомаляции
Головной мозг недоношенных новорожденных очень чувствителен к недостатку кислорода, так как компенсаторные механизмы еще не развиты, и микроциркуляторное русло не может своевременно обеспечить доставку крови. У доношенных детей с более или менее зрелой нервной системой и кровотоком гипоксия стимулирует кровообращение, поэтому повреждения не будут так выражены.
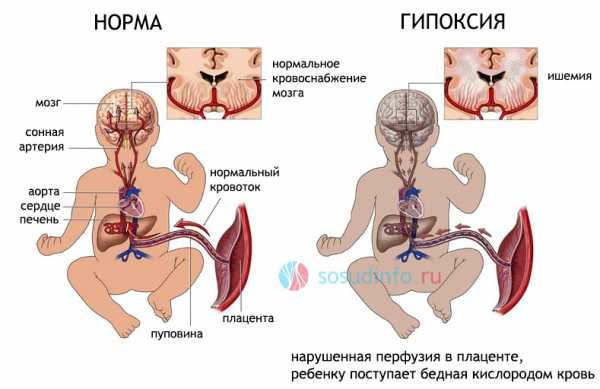
Вариант развития внутриутробной гипоксии (кислородного голодания) из-за недостаточности плацентарного кровотока
Проблема усугубляется еще и тем, что у недоношенных детей нет хорошей связующей сети между артериями мозга, и особенно страдает при этом подкорковый отдел вокруг желудочков, на расстоянии до 1 см от их стенок, больше в теменных зонах. Этим объясняется именно перивентрикулярное (около желудочков) расположение очагов некроза.
Гипоксия вызывает образование свободных радикалов, кислых продуктов обмена, которые не только оказывают непосредственное повреждающее действие на нейроны, но и способствуют нарушению микроциркуляции в виде тромбозов, застоя крови в мелких артериях и венах. Таким образом, гипоксия, сама по себе вызывающая некроз, провоцирует метаболические расстройства и тромбозы, которые еще больше усугубляют ситуацию.
Замечено, что перивентрикулярная энцефалопатия чаще развивается у малышей, находившихся на искусственной вентиляции легких (ИВЛ). Казалось бы, аппарат обеспечивает дыхание и доставку кислорода, поэтому головной мозг страдать не должен. Однако, избыток кислорода, подаваемый через аппарат, провоцирует спазм артериол, который приводит к ишемии.
Частота ПЛ среди новорожденных зависит от времени года. Обычно большее число таких пациентов приходится на зимне-весенний период. Возможной причиной считают недостаток витаминов и влияние неблагоприятных метеоусловий на организм беременной в поздние сроки гестации.
Факторами риска лейкомаляции считают:
- Тяжелые гестозы;
- Хронические инфекции у беременных;
- Внутриутробная гипоксия из-за нарушений в плаценте или кровотоке у плода;
- Аномалии родов – преждевременные роды, преждевременное излитие вод, слабость родовых сил;
- Патология новорожденных – респираторный дистресс-синдром, пневмонии, требующие проведения ИВЛ.
Что происходит в мозге при лейкомаляции?
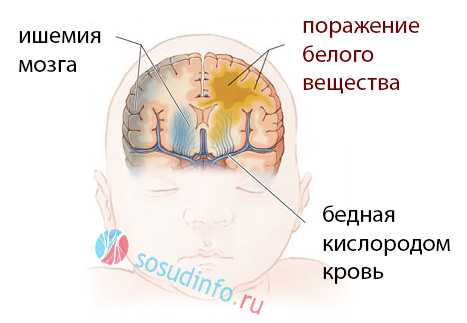
При лейкомаляции головного мозга в подкорковых структурах появляются очаги некроза, обычно – коагуляционного, гибнут нервные клетки, а дефекты замещаются размножающимися клетками микроглии наподобие того, как образуются рубцы в других органах. Нейроны не могут размножаться, и поля омертвения мозгу нечем заполнить, поэтому следствием их становятся кисты (полости) – кистозная лейкомаляция.
Более половины случаев ПЛ сопровождаются вторичными кровоизлияниями в зоне ишемии и некрозов, возможны кровоизлияния в желудочки мозга. Важно, что кора мозга у таких детей поражается крайне редко в связи с хорошим кровоснабжением.
Лейкомаляция начинается в первые дни и продолжается около недели с момента рождения. Возможно и более позднее ее возникновение, обычно связанное с инфекцией или нарушением дыхания у новорожденного ребенка. В этих случаях на фоне уже имеющихся некрозов могут появляться новые, а состояние ребенка будет прогрессивно ухудшаться.
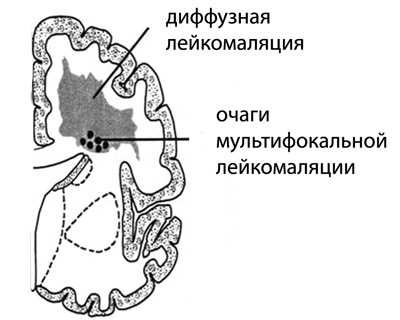
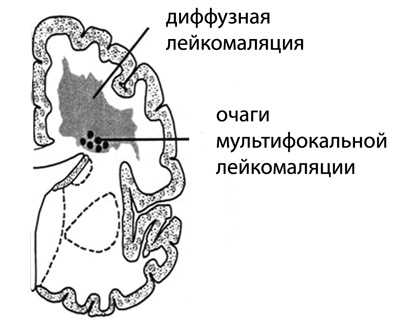
Очаги мультифокальной лейкомаляции диаметром в 2-3 мм обнаруживают в теменных и лобных долях, симметрично, вокруг стенок боковых желудочков. Реже поражаются височные и затылочные доли мозга. Исходом некроза становится образование множества кист разных размеров, рассеянных по подкорковому слою мозга (кистозная дегенерация), число которых со временем увеличивается. При тяжелой ПЛ они занимают всю перивентрикулярную часть полушарий.
На некроз и образование кист уходит около двух недель, а последующие несколько месяцев в мозге малыша происходит спадение полостей, замещение погибших участков рубцами из нейроглии и необратимая атрофия нервной ткани.
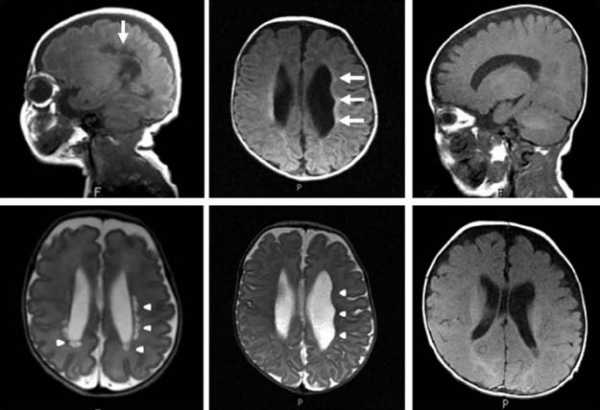
лейкомаляции на снимках МРТ
Проявления лейкомаляции
Признаки лейкомаляции разнообразны и часто неспецифичны, но тяжелое гипоксическое повреждение мозговой ткани не может протекать бессимптомно. Выделяют несколько степеней ПЛ:
- Легкая степень – признаки поражения нервной системы сохраняются до недели от момента рождения;
- Средняя тяжесть – от 7 до 10 дней, возможны судороги, внутричерепная гипертензия, вегетативные нарушения;
- Тяжелая ПЛ – глубокое повреждение с угнетением головного мозга, нередко – кома.
Среди симптомов церебральной лейкомаляции возможны:
- Избыточная нервно-рефлекторная возбудимость или, наоборот, ее угнетение;
- Судорожный синдром;
- Гипотонус мышц;
- Стволовая симптоматика;
- Парезы и параличи;
- Зрительные нарушения в виде косоглазия;
- Задержка психомоторного развития, нарушения интеллекта, гиперактивность, дефицит внимания.
Специалисты особо отмечают, что неврологическая симптоматика в остром периоде и до 3-5 месяцев жизни может быть невыраженной. Примерно у 90% детей после острого периода наступает мнимое благополучие, длящееся до 5 и даже 8-9 месяцев жизни. И только по прошествии такого длительного времени возникают признаки дефицита нервной деятельности на фоне атрофии мозговой ткани.
Вокруг желудочков мозга сконцентрированы проводящие нервные пути, ответственные за двигательную функцию конечностей, поэтому основным признаком церебральной лейкомаляции у детей становится детский церебральный паралич, но степень выраженности его зависит от массивности некроза.
В связи с вовлечением ствола мозга, черепных нервов большая половина малышей страдает косоглазием, чаще – сходящимся, возможны нарушения глотания, дыхательные расстройства. К полугодовалому возрасту проявляется судорожный синдром. Чем больше размер полей некроза и, соответственно, кист, тем больше выражена мозговая недостаточность. Характер симптомов определяется локализацией очагов повреждения (двигательные, зрительные расстройства, судороги, задержка психического развития).
Тяжелое поражение теменных и лобных долей влечет детский церебральный паралич с одновременным нарушением психического развития. Если вовлечены лишь проводящие пути, отвечающие за иннервацию конечностей, то паралич может не сопровождаться нарушением интеллекта и развития ребенка.
Часто у детей, перенесших перинатальную гипоксию, среди симптомов фигурируют дефицит внимания и гиперактивность при сохранном моторном развитии. Это относительно благоприятный вариант патологии, который можно корректировать специальными лечебными мероприятиями.
Ввиду такой непредсказуемости и разнообразия симптомов, маме бывает сложно разобраться, чего ожидать, когда малыш родился раньше срока и в условиях гипоксии. Если поражение носит умеренный или тяжелый характер, то ребенок не будет развиваться соответственно возрасту – не научится вовремя переворачиваться, сидеть и, тем более, ходить. Речевое развитие затормозится, малыш не сможет гулять, не будет следить за игрушками и проявлять такого характерного для своего возраста любопытства.
Особое внимание привлекает гипертонус, который может быть болезненным, поэтому ребенок будет беспокойным, плаксивым, нарушится сон. Грудное вскармливание может стать проблемой из-за плохого сосательного рефлекса, избыточной нервно-мышечной возбудимости или атонии.
Недостаточная прибавка в весе, медленный рост, не соответствующий возрасту, и отсутствие навыков, которыми должен овладевать растущий ребенок – основные симптомы, с которыми приходится иметь дело родителям малыша с умеренной или легкой степенью повреждения подкорковых структур.
Примерно к году становится заметным неврологический дефицит, развивается церебральный паралич, задерживается психомоторное развитие. После года, когда восстановительный период подходит к концу, в клинике преобладают такие последствия, как задержка психоречевого развития, эмоциональная лабильность, проблемы со сном и вниманием, которые могут быть наряду с более тяжелыми моторными расстройствами (детский церебральный паралич).
ПЛ у взрослых может быть причиной церебрального паралича, гипертонуса, нарушений интеллекта, тяжелой олигофрении. При благоприятном течении патологии взрослые люди мало чем отличаются от остальных.
Лечение
Лейкомаляция сопровождается необратимыми изменениями нервной ткани, и какой-либо четкой схемы лечения этого состояния не разработано. Обычно врачи применяют симптоматический подход, в зависимости от конкретных проявлений патологии.
В качестве основного компонента лечения применяют ноотропные средства, помогающие улучшить кровоток и метаболизм в головном мозге (пирацетам, ницерголин, стугерон). Дополнительная терапия направлена на коррекцию двигательных расстройств, нарушений психомоторного развития.
В качестве профилактической меры акушеры-гинекологи предпринимают все возможные попытки пролонгирования беременности до того срока, когда роды станут безопасными для малыша. Если ребенок все же рождается недоношенным, то необходимо сразу же наладить контроль за дыханием и показателями гомеостаза – уровнем кислорода и углекислоты в крови, артериальным давлением, кислотно-щелочным равновесием.

При тяжелой ПЛ дети нуждаются в лечении в условиях реанимации. При необходимости ИВЛ следует четко контролировать газовый состав крови, а при респираторном дистресс-синдроме показаны препараты сурфактанта, позволяющие в части случаев отказаться от искусственной вентиляции.
После года, когда на первый план выходят последствия перенесенной острой ПЛ, лечение большей частью симптоматическое. Повышенная нервно-рефлекторная возбудимость обычно требует наблюдения, а по показаниям могут быть назначены ноотропы, пантогам, фенибут, обладающие некоторым тормозным эффектом. При нарушении сна назначаются успокоительные растительные средства (мелисса, валериана), водные процедуры.
При повышенном внутричерепном давлении и гидроцефалии показан диакарб, возможно применение фуросемида или глицерина одновременно в препаратами калия. При отсутствии эффекта от мочегонных и при нарастании внутричерепной гипертензии проводятся шунтирующие операции для отвода излишков ликвора из головного мозга.
Судорожный синдром лечится с помощью карбамазепина, фенобарбитала. При повышении артериального давления и тахикардии возможно применение бета-адреноблокаторов (анаприлин, обзидан).
При двигательных расстройствах с повышенным тонусом показаны баклофен, мидокалм, реланиум, а при пониженном тонусе – массаж, специальные упражнения, физиотерапевтическое лечение.
Задержка психомоторного развития и речи требует коррекции со стороны педагогов и дефектологов. Помимо ноотропной терапии, витаминов, необходимы постоянные занятия с такими детьми, направленные на развитие внимания, памяти, речи.
Прогноз при церебральной лейкомаляции зависит от масштаба поражения головного мозга. В относительно легких случаях среди последствий преобладают минимальные изменения неврологического статуса, обратимые нарушения интеллекта, а при тяжелых формах поражения мозга возможен детский церебральный паралич, эпилепсия, олигофрения – умственная отсталость.
Рекомендации читателям СосудИнфо дают профессиональные медики с высшим образованием и опытом профильной работы.
На ваш вопрос ответит один из ведущих авторов сайта.
В данный момент на вопросы отвечает: А. Олеся Валерьевна, к.м.н., преподаватель медицинского вуза
Поблагодарить специалиста за помощь или поддержать проект СосудИнфо можно произвольным платежом по ссылке.
причины, лечение и способы профилактики
В процессе родовой деятельности будущего малыша поджидает множество опасных моментов. Одним из них является перивентрикулярная лейкомаляция – патологический очаг в головном мозге новорожденного, обусловленный недостатком поступления кислорода к его клеткам.
Преимущественное расположение перивентрикулярной зоны поражения – вдоль наружно-верхних отделов боковых желудочков органа. В дальнейшем они могут преобразоваться в кисты или полости, ведущие к тяжелым нарушениям центральной нервной системы малыша. Поэтому профилактике этой патологии уделяется большое внимание врачами во всем мире.
Причины и факторы риска
О важности первых 2–3 месяцев внутриутробного развития ребёнка знают большинство будущим мам. Однако последний триместр беременности также таит в себе множество опасностей для полноценного роста и формирования головного мозга человека.
Специалисты отмечают, что в особой группе риска по формированию перивентрикулярной лейкомаляции – очагам с отмирающими клетками в тканях боковых желудочков, находятся недоношенные дети и те, кто родился ранней весной.
Снижение поступления кислорода к мозговым клеткам обусловлено метеорологическими условиями, провоцирующими спазмы сосудов.
Другие факторы неврологического заболевания:
- эндокринные нарушения у будущей матери – к примеру, диабет;
- анемия беременных;
- авитаминозы;
- внутриутробное инфицирование плода;
- обильные кровотечения в момент родовой деятельности;
- резкие колебания кровяного давления у малыша;
- ранняя острая дыхательная недостаточность у новорожденного.
Тем не менее, главной причиной лейкомаляций головного мозга остается глубокая недоношенность. Поэтому основной упор акушеры-гинекологи делают на своевременную профилактику преждевременных родов и внутриутробной кислородной недостаточности.
Процесс формирования патологии
Для того чтобы понять, что такое ПВЛ и как с нею бороться, необходимо разобраться в механизме ее формирования. На фоне провоцирующих факторов в нервных клетках появляется патологический очаг – из-за кислородного голодания белое вещество органа отмирает. Полноценные нейроциты заменяются иными элементами, которые не способны выполнять те же функции.
Позже – через 7-14 суток на этом участке возникают перивентрикулярные кисты – полые или заполненные особой жидкостью. На завершающем этапе могут появляться рубцы на нервной ткани. Реже в боковых желудочках органа могут наблюдаться вторичные геморрагические инфаркты. В последующем пораженные участки полностью атрофируются.
Как правило, перивентриулярная лейкомаляция развивается в первые часы появления малыша на свет. Однако встречаются случаи, когда перивентрикулярный вариант патологии возникают позднее – до 5-7 суток от момента родов.
Поражение боковых желудочков головного мозга может происходить и внутриутробно – при беременности, сопровождающейся обострением пиелонефрита, гепатита. Для того чтобы этого избежать, женщине необходимо обращаться к наблюдающему за течением беременности врачу при первых же признаках ухудшения самочувствия.
Симптомы и признаки болезни
Заподозрить, что лейкомаляция головного мозга у новорожденных появилась, затруднительно – признаки перивентрикулярной патологии разнообразны и крайне неспецифичны. Тем не менее, недостаток поступления кислорода к нервным клеткам не протекает вовсе бессимптомно. Основные клинические признаки перивентрикулярной лейкомаляции:
- чрезмерная возбудимость новорожденного – крикливость, избыточная хаотичность движений;
- склонность к судорожным состояниям;
- вялость мышечных рефлексов.

У глубоко недоношенных детей симптоматика намного грубее:
- колебание температуры тела;
- вялость;
- повышенная сонливость;
- снижение аппетита;
- нарушение сна;
- парезы/параличи конечностей;
- дыхательные расстройства;
- зрительные нарушения – косоглазие.

Специалисты подчеркивают – проявления перивентрикулярной формы заболевания после острого периода могут стихать. Этот период мнимого благополучия длится до 8-9 месяцев. И только к году лейкомаляция головного мозга дает о себе знать дефицитом нервной деятельности. О течение патологического процесса свидетельствуют:
- недостаточная прибавка в весе;
- медленный рост;
- отставание в освоении навыков;
- несоответствие интеллекта возрасту;
- задержка психоречевого развития;
- выраженная эмоциональная лабильность.
Практически в 90% случаев это заболевание становится причиной развития детского церебрального паралича – тяжелой неврологической патологии, приводящей к инвалидизации.
Прогнозы и степень тяжести ПВЛ
Если женщине не удается доносить малыша до положенного срока – дети появляются на свет недоношенными. Родителям следует заранее подготовиться к правильному уходу за новорожденным.
Относительно благоприятным прогноз будет при легкой степени лейкомаляции головного мозга. В перивентрикулярной клинике преобладает дефицит внимания, а также гиперактивность – хаотичность движений конечностей. Тогда как моторное развитие – своевременность ползанья, ходьбы, переворотов сохраняется.
Специальные коррекционные мероприятия позволяют добиться компенсации расстройства, улучшить физическое и интеллектуальное развитие.
При среднетяжелом и тяжелом характере перивентрикулярной лейкомаляции малыш не будет соответствовать усредненным возрастным нормам – родителям следует быть к этому готовыми. Он позже начнет переворачиваться, присаживаться, ходить.
Затруднено и речевое развитие – слоги появятся позднее, предложения же будут практически недоступны. Иные проявления перивентрикулярной патологии:

- отсутствие естественного детского любопытства;
- болезненность и напряженность мышц конечностей;
- беспокойность, чрезмерная плаксивость;
- нарушение сна – прерывистость, частая путаность дня с ночью;
- грудное вскармливание затруднено – плохо выражен сосательный, а также глотательный рефлекс;
- отклонения в дательной системе – потребность в применении аппарата искусственного дыхания.
Легкая перивентрикулярная лейкомаляция компенсируется к школьному возрасту, при благоприятном течении патологии подросток ничем не отличим от сверстников. Тогда как при тяжелой форме болезни дети становятся инвалидами и требуют постоянного постороннего ухода.
Тактика лечения
Поскольку очаги лейкомаляции подразумевают необратимую гибель нервных клеток, то каких-либо четких схем устранения подобных перивентрикулярных состояний не разработано. Специалисты придерживаются симптоматического подхода – лечение направлено на уменьшение выраженности негативных проявлений.
Перивентрикулярная лейкомаляция у недоношенных детей требует незамедлительного принятия мер по улучшению снабжения клеток кислородом. Для этого следует восстановить полноценный кровоток. Эффективные группы медикаментов:
- ноотропы – усиливают приток крови к нервным клеткам: Пирацетам;
- противосудорожные средства – Карбамазепин;
- витаминные комплексы;
- при высоком внутричерепном давлении – Диакарб;
- при повышенной плаксивости, нарушении сна – успокоительные лекарства на растительной основе, к примеру, Валериана, Мелисса.
Помимо медикаментозной терапии, врачи рекомендуют курсы лечебного массажа и физиотерапии. Обязательно проводятся коррекционные занятия с психологом, педагогами – для стимулирования памяти, мышления, внимания, а также речи.
Родители детей с перивентрикулярной лейкомаляцией должны понимать, что чем больше внимания и труда они вложат в ребенка с первых же дней его жизни, тем лучше он будет развиваться. Поэтому все рекомендации врачей следует выполнять – прием лекарств и массаж, физкультура и правильное питание.
При тяжелой степени перивентрикулярной болезни лечебные мероприятия будут проводиться в стационарных условиях – восстановление дыхательной, сердечнососудистой деятельности, компенсация внутричерепной гипертензии. В этом случае о благоприятном прогнозе речи уже вестись не будет.

Профилактика
Крепкое здоровье детей – это результат усилий их мам с первых дней, когда они узнали о своей беременности. Для того чтобы перивентрикулярная лейкомаляция не возникала, рекомендуется заранее принимать меры профилактики:
- соблюдать принципы здоровой жизни еще на этапе планирования беременности;
- придерживаться сбалансированного питания, с присутствием в рационе различных овощей и фруктов;
- отказаться от всех вредных привычек, особенно употребления табачной и алкогольной продукции;
- заранее пройти консультацию врача, сдать анализы на присутствие в организме скрытых инфекций;
- избегать тяжелых физических, психоэмоциональных нагрузок;
- укреплять защитные барьеры – принимать витаминные комплексы;
- хорошо высыпаться;
- свести к минимуму контакты с людьми, страдающими от заболеваний инфекционного характера.

Узнавшей о своей беременности женщине следует незамедлительно встать на учет к врачу, который будет ее наблюдать на всех этапах внутриутробного развития малыша. Профилактике различных патологий, в том числе и периветрикулярной лейкомаляции у новорожденных, специалистами системы здравоохранения уделяется огромное внимание – разработаны стандарты профилактических исследований у беременных.
Крепкий, здоровый малыш – гордость родителей. Для его полноценного роста и развития – без лейкомаляции, будущая мать должна тесно сотрудничать с врачами и выполнять все их рекомендации.
Перивентрикулярная лейкомаляция (ПВЛ): причины, патогенез
Осложненные роды могут стать причиной травматизма у новорожденных детей. Одной из травм является гипоксико-ишемическое поражение вещества, которое располагается вдоль наружно-верхних отделов боковых желудочков головного мозга. Главным повреждающим фактором является кислородное голодание, хотя в некоторых случаях существуют и другие причины. Таким образом, при наличии мелкоочаговых инфарктов вещества ставится диагноз «перивентрикулярная лейкомаляция» (ПВЛ).
Изменения головного мозга проявляются кистами и полостями, которые формируются в течение примерно одного месяца. Именно поэтому в конце первого месяца жизни для всех новорожденных детей должна быть проведена нейросонография (НСГ).
Поражение носит необратимый характер. Это значит, что лечение, которое применяется после постановки этого диагноза, не может помочь избавиться от патологии.
У недоношенных новорожденных детей часто могут возникать другие поражения головного мозга, которые необходимо дифференцировать от ПВЛ. К некоторым из них относятся церебральная лейкомаляция, телэнцефальный глиоз, псевдокисты, мультикистозная энцефаломаляция, субкортикальная
лейкомаляция и т. д.
Причины и факторы риска
Возможность появления этой патологии повышается у недоношенных детей: при этом чем меньше вес при рождении, тем вероятнее развитие патологического процесса. К другим факторам риска относят пол ребенка: мальчикам диагностируют это заболевание чаще, чем девочкам.
Помимо гипоксии мозга на появление очагов ПВЛ может влиять избыточное количество углекислого газа (гиперкапния) в крови, а также кислородное отравление (гипероксия), которое иногда возникает при искусственной вентиляции легких во время реанимационных мероприятий. Опасной является ситуация резкой смены гипоксии гипероксией, что может случиться без контроля содержания и соотношения кислорода и углекислоты в крови во время ИВЛ. Кроме того, усугублять положение может развившаяся инфекция.
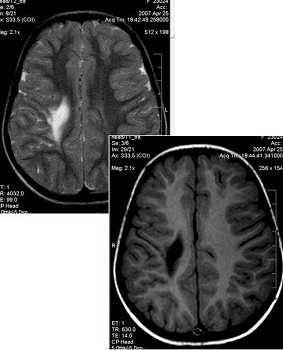
Отмечено также, что риск появления ПВЛ повышается, в зависимости от времени года: чаще всего она диагностируется у тех детей, последние два – три месяца которых приходятся на зиму или раннюю весну. Специалисты связывают это с влиянием метеорологических перепадов, которые влияют на беременность. Также может играть роль гиповитаминоз.
Патогенез
В результате названных причин возникает некроз белого вещества головного мозга, после чего к патологическому процессу добавляется дегенерация астроцитов (звездчатых нейроглиальных клеток с отростками), разрастание микроглии (специфических глиальных клеток ЦНС) и скопление липидосодержащих макрофагов в некротизированных тканях. После этого начинается фагоцитоз поврежденных участков – примерно через 5–7 дней, а через неделю происходит формирование кист (это занимает две недели, а иногда – больше). На завершающих стадиях возникают глиозные рубцы или псевдокисты. В некротизированных областях появляются вторичные геморрагические инфаркты. В течение 2–4 месяцев происходит атрофия ткани.
ПВЛ развивается в первые часы, но также может возникнуть и позднее – вплоть до 10 дней после рождения. Лейкомаляция также может поражать внутриутробно – если течение беременности отличается патологическим характером (гестоз, обострение хронического пиелонефрита, гепатита, фетоплацентарная недостаточность).
Клиническая картина
Уже в роддоме у детей отмечается синдром угнетения центральной нервной системы. Он выражается снижением:
- тонуса мышц;
- специфических рефлексов;
- двигательной активности;
Примерно у четверти новорожденных младенцев присутствует судороги. Почти половина детей страдает от синдрома гипервозбудимости. У некоторых младенцев могут отмечаться стволовые симптомы (нарушения сердечно-сосудистой, дыхательной деятельности). В некоторых случаях какие-либо аномалии в периоде новорожденности могут отсутствовать, а в отдельных вариантах ПВЛ приводит к летальному исходу, независимо от лечения.
Для этого патологического процесса характерно присутствие стадии «мнимого благополучия», которая может длиться 3–9 месяцев, после чего развиваются признаки церебральной недостаточности. Это проявляется нарушением сознания, глотательных рефлексов, дыхания, повышением артериального давления.
Перивентрикулярная лейкомаляция становится почти в 90% случаев причиной детского церебрального паралича (ДЦП), в 60% - сходящегося косоглазия.
Степень тяжести церебральных расстройств зависит от многочисленности и площади лейкомаляционных полостей. Однако в тех случаях, когда очаги распределены тонко вокруг желудочков, прогноз имеет более благоприятный характер.
Процент практически здоровых младенцев с ПВЛ составляет примерно 4%. Последствия поражения для них могут быть незначительны.
Терапевтические мероприятия
Изменения головного мозга носят необратимый характер – по этой причине радикальное лечение, позволяющее избавиться от патологии, не существует. Терапия направлена на устранение негативных симптомов и улучшение мозговых процессов. Стандартно используются ноотропы, корректоры мозгового кровообращения, а также препараты, позволяющие справляться с двигательными нарушениями.
Поскольку ПВЛ в большинстве случаев встречается у недоношенных новорожденных детей, главной мерой профилактики патологии является продление срока беременности, предупреждение преждевременных родов.
Частота осложнений после получения кровоизлияний может снижаться, если адекватно использовать в лечении препараты сурфаканта, уменьшающего проявление дыхательных нарушений. Кроме того, оснащение реанимации новорожденных современной аппаратурой для проведения автономной искусственной вентиляции легких снижает возможность тяжелого последствия для детей.
Поддерживающее лечение ребенка с данным диагнозом должно происходить в течение всего периода детства.
Итак, перивентрикулярная лейкомаляция – это тяжелое поражение головного мозга, которое встречается у новорожденных (преимущественно, недоношенных) детей вследствие тяжелых родов, осложненной беременности. Заболевание следует отличать от других патологий (среди которых псевдокисты, церебральная лейкомаляция, телэнцефальный глиоз и т. д.), по той причине, что лечение этих болезней может отличаться друг от друга.
Оцените эту статью:
Всего голосов: 193
4.37 193
Читайте также
Лейкомаляция головного мозга у взрослых
| Перивентрикулярная лейкомаляция | |
|---|---|
| МКБ-10 | P 91.2 91.2 |
| МКБ-10-КМ | P91.2 |
| МКБ-9 | 779.7 779.7 |
| МКБ-9-КМ | 779.7 [1] [2] и 742.8 [2] |
| МКБ-О | ріст- @ міс раітпуТмоьвтабатф |
| OMIM | MTHU037926 |
| DiseasesDB | 9868 |
| MedlinePlus | 007232 |
| eMedicine | ped/1773 |
| MeSH | D007969 |
Перивентрикулярная лейкомаляция (ПВЛ) — форма поражения белого вещества полушарий головного мозга у детей, открытая морфологами, одна из причин детского церебрального паралича. ПВЛ характеризуется возникновением очагов некроза, преимущественно коагуляционного, в перивентрикулярных зонах белого вещества полушарий головного мозга у новорождённых детей (редко у мёртворождённых). [3] Она относится к одной из форм так называемой «гипоксически-ишемической энцефалопатии».
Содержание
История описания [ править | править код ]
Первое микроскопическое описание очага ПВЛ принадлежит J. M. Parrot (1873) [4] . Р. Вирхов [5] лишь макроскопически описал очаги желтоватого цвета в перивентрикулярных зонах боковых желудочков мозга у умерших новорождённых, родившихся от матерей с сифилисом и оспой, относя их к врождённому энцефалиту. Нет достаточных оснований относить данные очаги к ПВЛ. Поражение описывалось под разными названиями («энцефалодистрофия», «ишемический некроз», «перивентрикулярный инфаркт», «коагуляционный некроз», «лейкомаляция», «размягчение мозга», «инфаркт перивентрикулярного белого вещества», «некроз белого вещества», «диффузная симметричная перивентрикулярная лейкоэнцефалопатия»), причём чаще немецкими учеными, но всемирное распространение получил термин «перивентрикулярная лейкомаляция», введённый в 1962 г. B. A. Banker и J. C. Larroche [6] . Термин недостаточно чёткий, так как при ПВЛ возникают не размягчения, а более плотные по сравнению с окружающими участками мозга очаги коагуляционных некрозов. Первая статья в СССР и России, посвящённая ПВЛ, написана В. В. Власюком с соавт. (1981), который предложил воспользоваться термином «перивентрикулярная лейкомаляция».
Наиболее полные в мире исследования ПВЛ на самом большом секционном материале проведены В. В. Власюком (1981)(частота, этиопатогенез, топография, степень поражения различных отделов мозга, стадии развития очагов,нейрогистология, роль микроглии, электроная микроскопия и др.), который впервые выявил высокую частоту поражения зрительной лучистости и доказал, что ПВЛ — это персистирующий процесс, что к старым очагам некрозов могут присоединяться новые, что очаги ПВЛ могут находиться на разных стадиях развития. [7] [8]
Морфология [ править | править код ]
По морфологической сути ПВЛ — это мелкоочаговые в основном коагуляционные перивентрикулярные инфаркты белого вещества мозга, чаще двусторонние и относительно симметричные. При ПВЛ очаги некрозов располагаются в перивентрикулярной зоне, но при наличии множества очагов (тяжёлых поражениях) отдельные из них могут распространяться на центральные отделы белого вещества мозга. C наибольшей частотой очаги ПВЛ возникают в перивентрикулярном белом веществе начальных отделов задних рогов боковых желудочков мозга (поражается зрительная лучистость) и центральных отделов желудочков на уровне зрительных бугров (поражается кортико-спинальный тракт). В процессе морфогенеза очаги проходят три стадии: 1) развития некроза, 2) резорбции и 3) формирования глиозного рубца или кисты. Кисты возникают при крупных и сливающихся очагах ПВЛ, при смешанных некрозах (колликвация в центре и коагуляционный ободок по периферии). Вокруг очагов обычно определяется зона других поражений белого вещества мозга — гибель проолигодендроцитов, пролиферация микроглиоцитов и тучных астроцитов, отек, кровоизлияния, гибель капилляров и др. (так называемый «диффузный компонент» ПВЛ). Однако диффузные поражения без некрозов это не ПВЛ. Если произвести 15 фронтальных срезов мозга, то обнаружение очагов ПВЛ в 1-4 срезах свидетельствует о лёгкой степени ПВЛ, в 5-8 срезах — о средней степени ПВЛ и в 9-13 срезах — о тяжёлой степени ПВЛ (2).
Частота [ править | править код ]
Частота ПВЛ по данным разных авторов колеблется от 4,8 % до 88 %, однако часто среди определённой группы детей или по данным нейросонографических исследований, что не вполне объективно. На невыборочном секционном материале частота ПВЛ составляет 12,6 %, причём чаще у мальчиков, а в зависимости от массы при рождении: 1001—1500 г — 13,3 %, 1501—2000 г — 21,5 %, 2001—2500 г — 31,6 %, 2501-3000 г — 14,8 %, более 3000 г — 3,5 %. У недоношенных 1-й и 2-й степеней встречается чаще всего. У умерших в первые сутки после рождения ПВЛ встречается с частотой 1,8 %, а у умерших на 6-й-8-й дни — 59,2 %. В группе родившихся при головном предлежании частота ПВЛ составляет 19,6 %, тазовом предлежании — 17,4 %, при кесаревом сечении — 35,6 %. [9]
Этиология и патогенез [ править | править код ]
Этиологически ПВЛ это гипоксически-ишемическое поражение белого вещества мозга, связанное с артериальной гипотонией, приступами апноэ после рождения, реанимационными мероприятиями, инфекциями и др. Способствует ПВЛ недоношенность, причём небольшой степени (1-2-й). Патогенетические факторы: гипоксия, ацидоз, гипокапния, токсины и др. Очаги некрозов (инфаркты) возникают в пограничной зоне между вентрикулофугальными и вентрикулопетальным артериальными ветвями [10] , локализующейся в перивентрикулярном белом веществе мозга.
Для данной нозологии характерны 2 основных признака:
1. локализация в перивентрикулярных зонах белого вещества больших полушарий 2. очаги имеют характер преимущественно коагуляционных некрозов.
Вокруг очагов ПВЛ могут определяться другие поражения, так называемый «диффузный компонент».
Время возникновения ПВЛ — в основном в первые дни после рождения, иногда анте- и интранатально.
Отличия от других поражений [ править | править код ]
У глубоко недоношенных детей чаще возникают другие поражения белого вещества мозга, отличные от ПВЛ — диффузная лейкомаляция и мультикистозная энцефаломаляция. Ввиду недостаточной изученности последних поражений, их часто стали ошибочно относить к ПВЛ.
ПВЛ надо дифференцировать с со следующими основными поражениями белого вещества больших полушарий мозга:
- отечно-геморрагическая лейкоэнцефалопатия (ОГЛ)
- телэнцефальный глиоз (ТГ)
- диффузная лейкомаляция (ДФЛ)
- субкортикальная лейкомаляция (СЛ)
- перивентрикулярный геморрагический инфаркт (ПГИ)
- внутримозговое кровоизлияние (ВМК)
- мультикистозная энцефаломаляция [11]
- субэпендимальная псевдокиста.
При СЛ очаги некрозов располагаются в субкортикальной области и в отдельных тяжёлых случаях могут распространяться на центральные отделы больших полушарий. При ДФЛ очаги некрозов располагаются диффузно во всех отделах белого вещества мозга, захватывая перивентрикулярную, субкортикальную и центральную области больших полушарий; некрозы колликвационные, ведут к кистообразованию и возникают наиболее часто у глубоко недоношенных детей. При ТГ нет полного некроза мозга и кисты не образуются. ПГИ возникают при тромбозах в системе внутренних мозговых вен или являются осложнением внутрижелудочковых кровоизлияний. Псевдокисты не имеют никакого отношения к некрозам мозга и относятся скорее всего к порокам развития. Патогенез всех перечисленных поражений различен.
В настоящее время имеет место гипердиагностика ПВЛ за счёт переоценки данных нейровизуализационных исследований и недооценки других поражений белого вещества мозга.
Перивентрикулярная лейкомаляция является тяжелым осложнением у недоношенных детей. Это ишемическо-гипоксическое повреждение головного мозга, которое тяжело поддается лечению и впоследствии может стать причиной инвалидности.
При перивентрикулярной форме лейкомаляции вокруг боковых желудочков располагаются очаги некроза из-за недостатка кислорода и нарушения кровообращения. С этой патологией рождается каждый третий недоношенный ребенок весом от 1,5 до 2,5 кг. При кесаревом сечении, если оно проводится раньше срока, риск развития болезни повышается.
Основные причины развития
Недостаток кислорода губительно сказывается на мозге недоношенных детей. Это связано с недостаточным развитием компенсаторных механизмов, которые не могут вовремя обеспечить клетки органа кислородом.
Если ребенок родился в положенный срок, то его нервная система и кровоток сформированы лучше, поэтому при кислородном голодании кровообращение усилится, и повреждения не возникнут.
Усугубить положение может отсутствие у недоношенных детей прочной связи между артериями мозга.
В результате гипоксии образуются свободные радикалы, кислые продукты обмена, которые наносят повреждение нейронам и нарушают циркуляцию крови в мелких сосудах, а также провоцируют застойные процессы в артериях и венах. Это сопровождается некрозом тканей, развитием нарушений метаболизма и тромбозов.
Перивентрикулярная лейкомаляция у недоношенных детей чаще встречается, если ребенок находился на искусственной вентиляции легких. Аппарат подает кислород, но при его большом количестве происходит спазм мелких артерий, из-за чего развиваются ишемические нарушения.
Интересно, что патология чаще возникает у детей, рожденных в зимне-весенний период. Ученые предполагают, что это связано с недостаточным количеством витаминов и неблагоприятными погодными условиями, негативно влияющими на организм женщины в последние недели беременности.
Повышают риск развития лейкомаляции следующие факторы:
- тяжелое течение беременности;
- хронические инфекционные процессы в организме матери;
- нарушение кровотока в плаценте или у плода, что приводит к гипоксии;
- рождение раньше срока, слабая родовая деятельность;
- патологии после рождения, которые требуют искусственной вентиляции легких.
Чем опасна для мозга лейкомаляция
При этом патологическом процессе в головном мозге происходит следующее:
- Отмирание тканей.
- Гибель нервных клеток.
- Замещение дефектных клеток клетками микроглии, то есть образование рубцов.
- Потеря нейронами способности размножаться, в результате чего омертвевшие участки ничем не заполняются, и в них развиваются кисты.
В половине случаев этого заболевания возникает кровоизлияние желудочков мозга. Поражение коры мозга у новорожденных происходит редко, так как она хорошо снабжается кровью.
Развитие лейкомаляции происходит в первые дни после рождения и длится в течение недели. Проблема может появиться и позже, но в этом случае она возникает из-за инфекции или нарушения дыхания. В такой ситуации к имеющимся некрозам присоединяются новые, и состояние ребенка стремительно ухудшается.
Отмирание тканей и образование кист развивается в течение нескольких недель. После этого в головном мозге спадают полости, омертвевшие участки замещаются рубцовой тканью, и возникают необратимые атрофические изменения в нервной ткани.
Как проявляется патология
Лейкомаляция головного мозга может иметь разные симптомы. Повреждение тканей мозга не может протекать незаметно. Существуют такие степени развития болезни:
- Легкая. При этом на протяжении недели заметны признаки поражения мозга.
- Средняя. На протяжении десяти дней у ребенка возникают судороги, нарушения вегетативных функций, повышение внутричерепного давления.
- Тяжелая. Повреждаются глубокие слои мозговых тканей, и часто дети впадают в кому.
Среди основных проявлений болезни выделяют:
- Угнетение или значительное повышение нервно-рефлекторной возбудимости.
- Судороги.
- Снижение тонуса мышц.
- Симптомы поражения ствола мозга.
- Паралич.
- Нарушение зрения, которое проявляется косоглазием.
- Повышенную активность, нарушения интеллекта и психомоторного развития.
Неврологические симптомы могут и не проявляться в остром периоде. У большей части детей после завершения периода обострения на 5-9 месяцев улучшается состояние. Этот период называют мнимым благополучием. После этого появляются симптомы атрофии нервной ткани.
Расположение нервных путей вокруг желудочков приводит к тому, что нарушается двигательная функция. Поэтому, если у ребенка возникла лейкомаляция, то первым ее проявлением будет церебральный паралич. Его выраженность зависит от степени поражения мозга.
Из-за поражения мозгового ствола и черепных нервов развивается косоглазие, нарушение глотания и дыхания. В возрасте 6 месяцев появляются судороги.
При тяжелом поражении теменной и лобной доли мозга развивается ДЦП с задержкой психического развития. Если затронуты проводящие пути, то возникает паралич без снижения интеллекта и нарушений развития.
Дети, перенесшие в перинатальном возрасте кислородное голодание, страдают от дефицита внимания и гиперактивности. Этот вариант течения болезни можно считать благоприятным, так как состояние ребенка можно нормализовать с помощью специальных препаратов.
При умеренных или тяжелых повреждениях затормаживается речевое развитие, малыш несвоевременно начинает ходить, переворачиваться и выполнять другие действия, свойственные детям его возраста.
Больше внимания нужно уделять развитию гипертонуса, который доставляет болезненные ощущения ребенку. Из-за этого малыш плохо спит, часто плачет и капризничает.

Сосательный рефлекс при этом нарушен, поэтому грудное вскармливание может оставаться под вопросом.
При умеренном или легком повреждении структур головного мозга ребенок медленно растет, недостаточно прибавляет в весе, с трудом овладевает новыми навыками.
Наличие неврологического дефицита наиболее ярко проявляется в год и выражается церебральным параличом и задержкой психомоторного развития.
В конце восстановительного периода у детей наблюдается:
- замедление психологического и речевого развития;
- неустойчивость настроения;
- нарушения сна и внимания;
- в тяжелых случаях развивается церебральный паралич.
У взрослых болезнь может протекать более благоприятно и ничем не отличает их от других людей.
Методы лечения
При лейкомаляции развиваются необратимые поражения мозговой ткани. Полностью восстановить некротические очаги не представляется возможным. Но для устранения негативных проявлений патологического процесса назначают симптоматическую терапию. Самочувствие ребенка улучшают с помощью специальных медикаментов. Среди них:
- Ноотропные препараты. Они необходимы для улучшения притока крови к тканям мозга и улучшения обменных процессов. Такими свойствами обладают Пирацетам и Ницерголин.
- Гипотензивные лекарственные средства. Их назначают для снижения внутричерепного давления и устранения водянки головного мозга.
- Противосудорожные препараты. Избавляют от судорог.
- Бета-адреноблокаторы. С их помощью нормализуют артериальное давление и устраняют тахикардию.
- Гипотонические медикаменты. Показаны, если повышен мышечный тонус.
- С помощью Валерианы, Мелиссы и других успокоительных средств нормализуют сон ребенка.

Все физиологические показатели ребенка обязательно должны контролироваться.
Кроме медикаментозного лечения, для улучшения состояния ребенка используют лечебные массажи, физиотерапевтические процедуры, занятия со специальными педагогами, в ходе которых нормализуется внимание и память, а также улучшается развитие речи.
Если нормализовать внутричерепное давление с помощью препаратов не удалось, то необходимо оперативное вмешательство, в ходе которого устанавливают шунты для уменьшения количества ликвора и снижения давления внутри черепа.
При тяжелой степени течения лейкомаляции лечение проводят в реанимационных условиях с использованием аппарата для искусственной вентиляции легких.
Каким будет прогноз при подобном патологическом процессе, зависит от объема поврежденной нервной ткани и степени повреждений. Если при перивентрикулярной лейкомаляции нарушения небольшие, то состояние больного и функции органа можно скорректировать специальными препаратами.
При тяжелом течении заболевания лекарственные препараты не могут купировать проявления лейкомаляции. В этом случае развивается детский церебральный паралич, олигофрения, эпилепсия и другие осложнения.
Чтобы избежать развития заболевания, специалисты могут попытаться довести беременность до такого срока, когда роды не будут для малыша опасными.
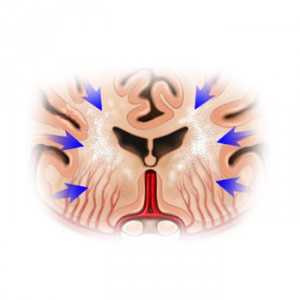
Все материалы публикуются под авторством, либо редакцией профессиональных медиков ( об авторах ), но не являются предписанием к лечению. Обращайтесь к специалистам!
При использовании материалов ссылка или указание названия источника обязательны.
Автор: А. Олеся Валерьевна, к.м.н., практикующий врач, преподаватель медицинского ВУЗа
Лейкомаляцию относят к ишемически-гипоксическим повреждениям головного мозга, диагностируемым у новорожденных. Она представляет серьезную проблему неонатологии и неврологии, поскольку отдаленные последствия патологии очень сложно поддаются лечению, приводя к инвалидности.
При лейкомаляции в головном мозге обнаруживают очаги некроза, возникшие после тяжелой гипоксии и нарушения кровотока. Они расположены главным образом вокруг боковых желудочков, поэтому перивентрикулярное поражение – наиболее частый вариант патологии, о котором и пойдет речь ниже.
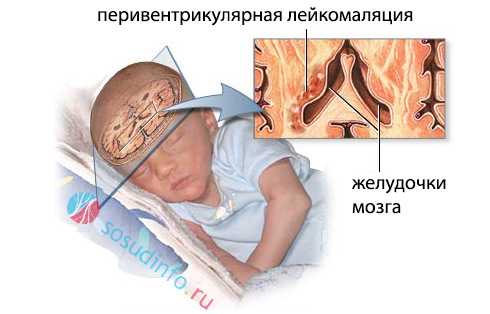
перивентрикулярная (околожелудочковая) лейкомаляция
Перивентрикулярная лейкомаляция (ПЛ) встречается примерно в 12% случаев среди новорожденных, обычно – у недоношенных детей, причем, частота ее зависит от массы, с которой младенец появился на свет. Наибольшее число малышей страдает лейкомаляцией, если масса при рождении была 1500-2500 г. В этом случае патология обнаруживается практически у каждого третьего.
Около 60% новорожденных, проживших до недели, имеют признаки ПЛ. Кесарево сечение значительно повышает ее риск (до 35%) по сравнению с естественными родами, но это касается случаев с уже имеющейся пренатальной патологией. Если малыш внутриутробно рос и развивался нормально, а кесарево сечение проводится в положенный срок, то сама по себе операция не увеличивает риск подобного повреждения головного мозга.
Причины лейкомаляции
Головной мозг недоношенных новорожденных очень чувствителен к недостатку кислорода, так как компенсаторные механизмы еще не развиты, и микроциркуляторное русло не может своевременно обеспечить доставку крови. У доношенных детей с более или менее зрелой нервной системой и кровотоком гипоксия стимулирует кровообращение, поэтому повреждения не будут так выражены.
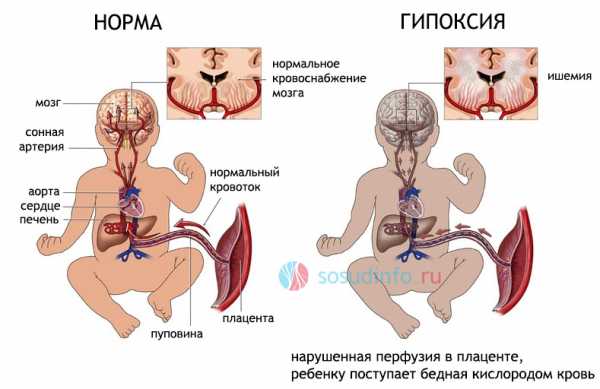
Вариант развития внутриутробной гипоксии (кислородного голодания) из-за недостаточности плацентарного кровотока
Проблема усугубляется еще и тем, что у недоношенных детей нет хорошей связующей сети между артериями мозга, и особенно страдает при этом подкорковый отдел вокруг желудочков, на расстоянии до 1 см от их стенок, больше в теменных зонах. Этим объясняется именно перивентрикулярное (около желудочков) расположение очагов некроза.
Гипоксия вызывает образование свободных радикалов, кислых продуктов обмена, которые не только оказывают непосредственное повреждающее действие на нейроны, но и способствуют нарушению микроциркуляции в виде тромбозов, застоя крови в мелких артериях и венах. Таким образом, гипоксия, сама по себе вызывающая некроз, провоцирует метаболические расстройства и тромбозы, которые еще больше усугубляют ситуацию.
Замечено, что перивентрикулярная энцефалопатия чаще развивается у малышей, находившихся на искусственной вентиляции легких (ИВЛ). Казалось бы, аппарат обеспечивает дыхание и доставку кислорода, поэтому головной мозг страдать не должен. Однако, избыток кислорода, подаваемый через аппарат, провоцирует спазм артериол, который приводит к ишемии.
Частота ПЛ среди новорожденных зависит от времени года. Обычно большее число таких пациентов приходится на зимне-весенний период. Возможной причиной считают недостаток витаминов и влияние неблагоприятных метеоусловий на организм беременной в поздние сроки гестации.
Факторами риска лейкомаляции считают:
- Тяжелые гестозы;
- Хронические инфекции у беременных;
- Внутриутробная гипоксия из-за нарушений в плаценте или кровотоке у плода;
- Аномалии родов – преждевременные роды, преждевременное излитие вод, слабость родовых сил;
- Патология новорожденных – респираторный дистресс-синдром, пневмонии, требующие проведения ИВЛ.
Что происходит в мозге при лейкомаляции?
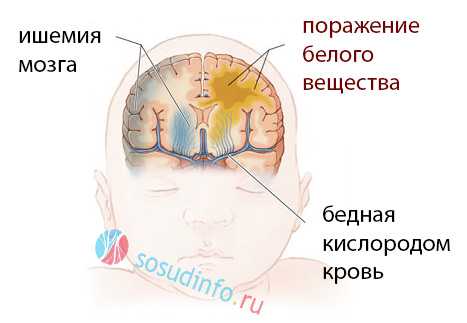
При лейкомаляции головного мозга в подкорковых структурах появляются очаги некроза, обычно – коагуляционного, гибнут нервные клетки, а дефекты замещаются размножающимися клетками микроглии наподобие того, как образуются рубцы в других органах. Нейроны не могут размножаться, и поля омертвения мозгу нечем заполнить, поэтому следствием их становятся кисты (полости) – кистозная лейкомаляция.
Более половины случаев ПЛ сопровождаются вторичными кровоизлияниями в зоне ишемии и некрозов, возможны кровоизлияния в желудочки мозга. Важно, что кора мозга у таких детей поражается крайне редко в связи с хорошим кровоснабжением.
Лейкомаляция начинается в первые дни и продолжается около недели с момента рождения. Возможно и более позднее ее возникновение, обычно связанное с инфекцией или нарушением дыхания у новорожденного ребенка. В этих случаях на фоне уже имеющихся некрозов могут появляться новые, а состояние ребенка будет прогрессивно ухудшаться.
Очаги мультифокальной лейкомаляции диаметром в 2-3 мм обнаруживают в теменных и лобных долях, симметрично, вокруг стенок боковых желудочков. Реже поражаются височные и затылочные доли мозга. Исходом некроза становится образование множества кист разных размеров, рассеянных по подкорковому слою мозга (кистозная дегенерация), число которых со временем увеличивается. При тяжелой ПЛ они занимают всю перивентрикулярную часть полушарий.
На некроз и образование кист уходит около двух недель, а последующие несколько месяцев в мозге малыша происходит спадение полостей, замещение погибших участков рубцами из нейроглии и необратимая атрофия нервной ткани.
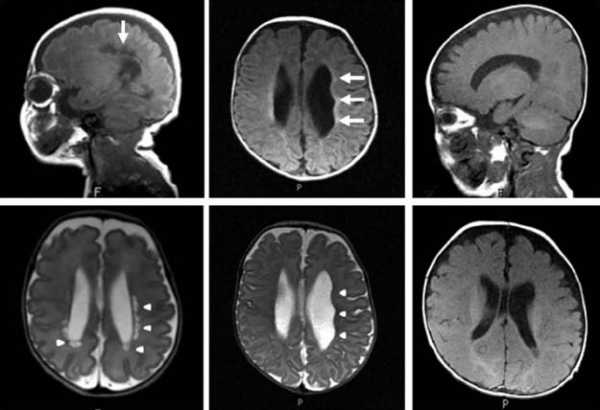
лейкомаляции на снимках МРТ
Проявления лейкомаляции
Признаки лейкомаляции разнообразны и часто неспецифичны, но тяжелое гипоксическое повреждение мозговой ткани не может протекать бессимптомно. Выделяют несколько степеней ПЛ:
- Легкая степень – признаки поражения нервной системы сохраняются до недели от момента рождения;
- Средняя тяжесть – от 7 до 10 дней, возможны судороги, внутричерепная гипертензия, вегетативные нарушения;
- Тяжелая ПЛ – глубокое повреждение с угнетением головного мозга, нередко – кома.
Среди симптомов церебральной лейкомаляции возможны:
- Избыточная нервно-рефлекторная возбудимость или, наоборот, ее угнетение;
- Судорожный синдром;
- Гипотонус мышц;
- Стволовая симптоматика;
- Парезы и параличи;
- Зрительные нарушения в виде косоглазия;
- Задержка психомоторного развития, нарушения интеллекта, гиперактивность, дефицит внимания.
Специалисты особо отмечают, что неврологическая симптоматика в остром периоде и до 3-5 месяцев жизни может быть невыраженной. Примерно у 90% детей после острого периода наступает мнимое благополучие, длящееся до 5 и даже 8-9 месяцев жизни. И только по прошествии такого длительного времени возникают признаки дефицита нервной деятельности на фоне атрофии мозговой ткани.
Вокруг желудочков мозга сконцентрированы проводящие нервные пути, ответственные за двигательную функцию конечностей, поэтому основным признаком церебральной лейкомаляции у детей становится детский церебральный паралич, но степень выраженности его зависит от массивности некроза.
В связи с вовлечением ствола мозга, черепных нервов большая половина малышей страдает косоглазием, чаще – сходящимся, возможны нарушения глотания, дыхательные расстройства. К полугодовалому возрасту проявляется судорожный синдром. Чем больше размер полей некроза и, соответственно, кист, тем больше выражена мозговая недостаточность. Характер симптомов определяется локализацией очагов повреждения (двигательные, зрительные расстройства, судороги, задержка психического развития).
Тяжелое поражение теменных и лобных долей влечет детский церебральный паралич с одновременным нарушением психического развития. Если вовлечены лишь проводящие пути, отвечающие за иннервацию конечностей, то паралич может не сопровождаться нарушением интеллекта и развития ребенка.
Часто у детей, перенесших перинатальную гипоксию, среди симптомов фигурируют дефицит внимания и гиперактивность при сохранном моторном развитии. Это относительно благоприятный вариант патологии, который можно корректировать специальными лечебными мероприятиями.
Ввиду такой непредсказуемости и разнообразия симптомов, маме бывает сложно разобраться, чего ожидать, когда малыш родился раньше срока и в условиях гипоксии. Если поражение носит умеренный или тяжелый характер, то ребенок не будет развиваться соответственно возрасту – не научится вовремя переворачиваться, сидеть и, тем более, ходить. Речевое развитие затормозится, малыш не сможет гулять, не будет следить за игрушками и проявлять такого характерного для своего возраста любопытства.
Особое внимание привлекает гипертонус, который может быть болезненным, поэтому ребенок будет беспокойным, плаксивым, нарушится сон. Грудное вскармливание может стать проблемой из-за плохого сосательного рефлекса, избыточной нервно-мышечной возбудимости или атонии.
Недостаточная прибавка в весе, медленный рост, не соответствующий возрасту, и отсутствие навыков, которыми должен овладевать растущий ребенок – основные симптомы, с которыми приходится иметь дело родителям малыша с умеренной или легкой степенью повреждения подкорковых структур.
Примерно к году становится заметным неврологический дефицит, развивается церебральный паралич, задерживается психомоторное развитие. После года, когда восстановительный период подходит к концу, в клинике преобладают такие последствия, как задержка психоречевого развития, эмоциональная лабильность, проблемы со сном и вниманием, которые могут быть наряду с более тяжелыми моторными расстройствами (детский церебральный паралич).
ПЛ у взрослых может быть причиной церебрального паралича, гипертонуса, нарушений интеллекта, тяжелой олигофрении. При благоприятном течении патологии взрослые люди мало чем отличаются от остальных.
Лечение
Лейкомаляция сопровождается необратимыми изменениями нервной ткани, и какой-либо четкой схемы лечения этого состояния не разработано. Обычно врачи применяют симптоматический подход, в зависимости от конкретных проявлений патологии.
В качестве основного компонента лечения применяют ноотропные средства, помогающие улучшить кровоток и метаболизм в головном мозге (пирацетам, ницерголин, стугерон). Дополнительная терапия направлена на коррекцию двигательных расстройств, нарушений психомоторного развития.
В качестве профилактической меры акушеры-гинекологи предпринимают все возможные попытки пролонгирования беременности до того срока, когда роды станут безопасными для малыша. Если ребенок все же рождается недоношенным, то необходимо сразу же наладить контроль за дыханием и показателями гомеостаза – уровнем кислорода и углекислоты в крови, артериальным давлением, кислотно-щелочным равновесием.

При тяжелой ПЛ дети нуждаются в лечении в условиях реанимации. При необходимости ИВЛ следует четко контролировать газовый состав крови, а при респираторном дистресс-синдроме показаны препараты сурфактанта, позволяющие в части случаев отказаться от искусственной вентиляции.
После года, когда на первый план выходят последствия перенесенной острой ПЛ, лечение большей частью симптоматическое. Повышенная нервно-рефлекторная возбудимость обычно требует наблюдения, а по показаниям могут быть назначены ноотропы, пантогам, фенибут, обладающие некоторым тормозным эффектом. При нарушении сна назначаются успокоительные растительные средства (мелисса, валериана), водные процедуры.
При повышенном внутричерепном давлении и гидроцефалии показан диакарб, возможно применение фуросемида или глицерина одновременно в препаратами калия. При отсутствии эффекта от мочегонных и при нарастании внутричерепной гипертензии проводятся шунтирующие операции для отвода излишков ликвора из головного мозга.
Судорожный синдром лечится с помощью карбамазепина, фенобарбитала. При повышении артериального давления и тахикардии возможно применение бета-адреноблокаторов (анаприлин, обзидан).
При двигательных расстройствах с повышенным тонусом показаны баклофен, мидокалм, реланиум, а при пониженном тонусе – массаж, специальные упражнения, физиотерапевтическое лечение.
Задержка психомоторного развития и речи требует коррекции со стороны педагогов и дефектологов. Помимо ноотропной терапии, витаминов, необходимы постоянные занятия с такими детьми, направленные на развитие внимания, памяти, речи.
Прогноз при церебральной лейкомаляции зависит от масштаба поражения головного мозга. В относительно легких случаях среди последствий преобладают минимальные изменения неврологического статуса, обратимые нарушения интеллекта, а при тяжелых формах поражения мозга возможен детский церебральный паралич, эпилепсия, олигофрения – умственная отсталость.
Перивентрикулярная лейкомаляция (ПВЛ) у новорожденного
Особенности патологии
Перивентрикулярная лейкомаляция у недоношенных детей представляет собой повреждение белого вещества, локализованного вблизи боковых желудочков. Для нее свойственны некротические повреждения тканей головного мозга из-за недостаточного поступления кислорода и ослабленного кровотока. Возникает ПВЛ преимущественно у малышей, чья масса тела не превышает 2 кг.
Из-за гипоксии плода (нехватки кислорода) постепенно развивается киста в головном мозге, но происходит этот процесс не во время внутриутробного развития. Появляются такие образования в первые 30 дней с момента рождения. Их диаметр обычно не превышает 3 мм и локализуются полости преимущественно в теменной и лобной области.
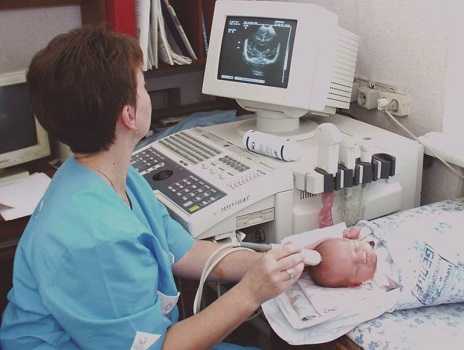
Увидеть очаг лейкомаляции можно с помощью нейросонограммы. Такое инструментальное обследование является обязательным для недоношенных детей и его назначает всем малышам из этой группы.
Для ПВЛ свойственны такие стадии:
- Первая. В первые 7 дней наблюдается увеличение эхоплотности в вентрикулярной области;
- Вторая. Эхоплотность повышается и образуются небольшие кистообразные образования;
- Третья. Эхоплотность остается на высоком уровне и при этом кистозных образований становится значительно больше;
- Четвертая. Высокий уровень эхоплотности распространяется на белое вещество и в нем же начинают появляться кистообразные образования.
Симптомы и проявления
Признаки лейкомаляции разнообразны и часто неспецифичны, но тяжелое гипоксическое повреждение мозговой ткани не может протекать бессимптомно. Выделяют несколько степеней ПЛ:
- Легкая степень – признаки поражения нервной системы сохраняются до недели от момента рождения;
- Средняя тяжесть – от 7 до 10 дней, возможны судороги, внутричерепная гипертензия, вегетативные нарушения;
- Тяжелая ПЛ – глубокое повреждение с угнетением головного мозга, нередко – кома.
Среди симптомов церебральной лейкомаляции возможны:
- Избыточная нервно-рефлекторная возбудимость или, наоборот, ее угнетение;
- Судорожный синдром;
- Гипотонус мышц;
- Стволовая симптоматика;
- Парезы и параличи;
- Зрительные нарушения в виде косоглазия;
- Задержка психомоторного развития, нарушения интеллекта, гиперактивность, дефицит внимания.
Вокруг желудочков мозга сконцентрированы проводящие нервные пути, ответственные за двигательную функцию конечностей, поэтому основным признаком церебральной лейкомаляции у детей становится детский церебральный паралич, но степень выраженности его зависит от массивности некроза.
В связи с вовлечением ствола мозга, черепных нервов большая половина малышей страдает косоглазием, чаще – сходящимся, возможны нарушения глотания, дыхательные расстройства. К полугодовалому возрасту проявляется судорожный синдром. Чем больше размер полей некроза и, соответственно, кист, тем больше выражена мозговая недостаточность. Характер симптомов определяется локализацией очагов повреждения (двигательные, зрительные расстройства, судороги, задержка психического развития).
Тяжелое поражение теменных и лобных долей влечет детский церебральный паралич с одновременным нарушением психического развития. Если вовлечены лишь проводящие пути, отвечающие за иннервацию конечностей, то паралич может не сопровождаться нарушением интеллекта и развития ребенка.
Часто у детей, перенесших перинатальную гипоксию, среди симптомов фигурируют дефицит внимания и гиперактивность при сохранном моторном развитии. Это относительно благоприятный вариант патологии, который можно корректировать специальными лечебными мероприятиями.
Ввиду такой непредсказуемости и разнообразия симптомов, маме бывает сложно разобраться, чего ожидать, когда малыш родился раньше срока и в условиях гипоксии. Если поражение носит умеренный или тяжелый характер, то ребенок не будет развиваться соответственно возрасту – не научится вовремя переворачиваться, сидеть и, тем более, ходить.
Особое внимание привлекает гипертонус, который может быть болезненным, поэтому ребенок будет беспокойным, плаксивым, нарушится сон. Грудное вскармливание может стать проблемой из-за плохого сосательного рефлекса, избыточной нервно-мышечной возбудимости или атонии.
Недостаточная прибавка в весе, медленный рост, не соответствующий возрасту, и отсутствие навыков, которыми должен овладевать растущий ребенок – основные симптомы, с которыми приходится иметь дело родителям малыша с умеренной или легкой степенью повреждения подкорковых структур.
Примерно к году становится заметным неврологический дефицит, развивается церебральный паралич, задерживается психомоторное развитие. После года, когда восстановительный период подходит к концу, в клинике преобладают такие последствия, как задержка психоречевого развития, эмоциональная лабильность, проблемы со сном и вниманием, которые могут быть наряду с более тяжелыми моторными расстройствами (детский церебральный паралич).
ПЛ у взрослых может быть причиной церебрального паралича, гипертонуса, нарушений интеллекта, тяжелой олигофрении. При благоприятном течении патологии взрослые люди мало чем отличаются от остальных.
Лейкомаляция головного мозга в основном диагностируется при рождении в таких случаях:
- Недостаток кислорода еще в утробе матери.
- Родоразрешение произошло раньше поставленного срока,а именно между 26 и 34 неделей беременности.
- Оценка по шкале Апгар не более 5 баллов.
- Вес ребенка от 1,5 до 2 килограмм, у таких детей 30% вероятность развития болезни.
- Скачки гипертонии, сменяемой гипотонией.
- Вынужденная искусственная вентиляция легких.
- Дети, рожденные в зимний или весенний период.
- Перенесенная инфекция во время беременности или злоупотребление алкоголем, курением, наркотиками.
- Гестоз матери на поздних сроках беременности.
- Патологические роды.
Так основные факторы риска – это патология течения беременности или патология родовой деятельности. Поэтому состояние ребенка во многом зависит от квалифицированной врачебной помощи.
Так как очаги некроза располагаются чаще всего в перивентрикулярных областях белого вещества полушарий головного мозга, то почти всегда развивается именно перивентикулярная лейкомаляция (ПВЛ).
Заболевание почти встречается у недоношенных малышей (редко недоношенных), причем есть прямая зависимость от массы тела. В основном заболеванием страдают малыши, вес которых составляет от 1500 до 2000 грамм. В этом случае патология фиксируется у каждого третьего малыша.
Если верить статистике, то практически 60 % недоношенных детей, или появившихся на свет при помощи кесарево сечения в той иной степени страдают от этого заболевания.
Нейросонограмма — стрелкой указан очаг ПВЛ
Так как главным фактором, который провоцируют лейкомаляцию, является кислородное голодание, то в области поражение также может развиться кистозное образование или полость. И формируются они не в утробе, а на первом месяце жизни. Поэтому обязательным условием для каждого новорожденного достигшего месячного возраста является проведение нейросонографии.
При данном заболевании в мозгу гибнут нервные клетки, а вместо них образуются рубцы. Также для данного нарушения характерно повторное кровоизлияние.
При осмотре малыша невролог видит, что происходит избыточная нервно-рефлекторная возбудимость или же наоборот происходит так, что она полностью отсутствует.
Малыша мучает судорожный синдром, характерно появление гипотонуса мышц. Эти симптомы может определить только врач.
Но и родители должны обращать внимание на то, как меняется их малыш. Если заболевание имеет место быть, то у малыша начинает развиваться косоглазие. Так же ребенок перестает реагировать на действия окружающих, а впоследствии, в большей степени не понимает, чего от него хотят.
Вот как выглядит ребенок, у которого диагностирована лейкомаляция головного мозга и другие дружественные патологии…
Короткая анатомическая справка
Очаги заболевания бывают около 2-3 миллиметров диаметре и могут быть обнаружены в теменных долях и лобных. При этом их образование абсолютно ассиметрично.
Основным исходом заболевания является образование огромного количества кист, при этом они все разных размеров. На появление некроза и образования кистозных соединений уходит около двух недель, а затем в мозгу малыша происходит спадание полостей – то есть атрофия нервных тканей головного мозга.
Причины
Перивентрикулярная лейкомаляция у ребёнка развивается внутриутробно или же в первые дни его жизни. Основной причиной развития этого недуга считается неправильный приток крови к области вокруг желудочков мозга.
К другим причинам, повышающим риск развития ПВЛ у ребёнка, относят:
- эндокринные нарушения и анемия у беременной;
- внутриутробное инфицирование плода;
- кровотечения во время беременности и родов;
- гестоз беременной;
- гипоксия ребёнка в момент родов;кардиореспираторная недостаточность новорожденного;
- резкие колебания кровяного давления у ребёнка;
- ранняя острая дыхательная недостаточность.
Данная патология головного мозга провоцирует развитие детского церебрального паралича, а иногда и сходящегося косоглазия. Тяжесть церебральных расстройств напрямую зависит от степени поражения головного мозга.
Перивентрикулярная лейкомаляция развивается преимущественно из-за гипоксии плода. Возникает это явление вследствие таких факторов:
- Злоупотребление вредными привычками во время беременности;
- Отравление во время беременности различными газами или повышенная концентрация углекислого газа в крови;
- Недоношенность.
Касается болезнь как мальчиков, так и девочек, но у мужского пола она встречается в 2 раза чаще.
Перивентрикулярная лейкомаляция и механизм ее развития
ПВЛ у недоношенных детей возникает по следующим причинам:
- недоношенность малыша, соответственно, как ранее уже обозначалось, идет привязка к массе тела;
- в большей степени это заболевание поражает мальчиков, так как у девочек оно встречается реже;
- вредные привычки будущей мамы;
- если у мамы в крови больше количество содержания углекислого газа или же кислородное отравление, то малыш в наибольшей степени подвержен данному заболеванию.
Морфология [ править | править код ]
По морфологической сути ПВЛ
— это мелкоочаговые в основном коагуляционные перивентрикулярные инфаркты белого вещества мозга, чаще двусторонние и относительно симметричные. При ПВЛ очаги некрозов располагаются в перивентрикулярной зоне, но при наличии множества очагов (тяжёлых поражениях) отдельные из них могут распространяться на центральные отделы белого вещества мозга.
C наибольшей частотой очаги ПВЛ возникают в перивентрикулярном белом веществе начальных отделов задних рогов боковых желудочков мозга (поражается зрительная лучистость) и центральных отделов желудочков на уровне зрительных бугров (поражается кортико-спинальный тракт). В процессе морфогенеза очаги проходят три стадии:
1) развития некроза, 2) резорбции и 3) формирования глиозного рубца или кисты. Кисты возникают при крупных и сливающихся очагах ПВЛ, при смешанных некрозах (колликвация в центре и коагуляционный ободок по периферии). Вокруг очагов обычно определяется зона других поражений белого вещества мозга — гибель проолигодендроцитов, пролиферация микроглиоцитов и тучных астроцитов, отек, кровоизлияния, гибель капилляров и др.
(так называемый «диффузный компонент» ПВЛ). Однако диффузные поражения без некрозов это не ПВЛ. Если произвести 15 фронтальных срезов мозга, то обнаружение очагов ПВЛ в 1-4 срезах свидетельствует о лёгкой степени ПВЛ, в 5-8 срезах — о средней степени ПВЛ и в 9-13 срезах — о тяжёлой степени ПВЛ (2).
Частота [ править | править код ]
1001—1500 г — 13,3 %, 1501—2000 г — 21,5 %, 2001—2500 г — 31,6 %, 2501-3000 г — 14,8 %, более 3000 г — 3,5 %. У недоношенных 1-й и 2-й степеней встречается чаще всего. У умерших в первые сутки после рождения ПВЛ встречается с частотой 1,8 %, а у умерших на 6-й-8-й дни — 59,2 %. В группе родившихся при головном предлежании частота ПВЛ составляет 19,6 %, тазовом предлежании — 17,4 %, при кесаревом сечении — 35,6 %. [9]
Как помочь малышу?
Когда ребенку уже исполнился 1 год, то необходимо тщательно следить за тем, чтобы не проявлялась симптоматика свойственная ПВЛ. Если проявления болезни будут обнаружены, то врач назначит Фенибут или Пантогам. Они замедляют развитие атрофии тканей в головном мозге.
Для восстановления ритма сна рекомендуется давать малышу седативные медикаменты (успокаивающие) по типу таблеток или настоек на основе Валерианы или Мелиссы. В сочетании с ними можно использовать водные процедуры.
При повышении давления, его нужно сразу стабилизировать, для этого желательно пропить Диакарб или Глицерин. Последний медикамент необходимо принимать с витаминными комплексами, в которых большая концентрация калия.
Судорожные припадки устраняются преимущественно с помощью Фенобарбитала. Если появляются побочные эффекты, такие как высокое давление и учащенный ритм сердца, то его меняют на бета-адреноблокаторы. Среди них можно выбрать Анаприлин или Обзидан.
Двигательные сбои свойственные ПВЛ обычно купируются с помощью массажа, физиотерапевтических процедур и лечебной гимнастики. При проблемах с речевым аппаратом обычно обращаются к дефектологам и специальным учителям для исправления этого осложнения.
В наиболее запущенных случаях у малыша может развиться респираторный дистресс-синдром. Такое осложнение означает острую дыхательную недостаточность и не допустить ее развитие можно, применяя медикаменты на основе сурфактаната.
Церебральная лейкомаляция сопровождается изменениями нервной ткани и данные изменения необратимы, и, к сожалению, какой-либо четкой схемы лечения заболевания на данный момент просто нет. Как правило, врачи смотрят на симптоматику, а затем назначают лечение в зависимости от проявлений нарушения.
Для лечения заболевания применяют ноотропные лекарства, благодаря которым происходит улучшение кровотока в головном мозге и также улучшается метаболизм. Препараты, которые чаще всего назначают – Пирацетам, Стугерон.
Вся остальная терапия, назначенная врачом, идет на исправление двигательных движений, а также нарушений психомоторного развития.
Для того чтобы избежать появления заболевания акушеры стараются сохранить беременность как можно дольше. Но в случае, если малыш родился недоношенным, то они необходимо сделать все возможное для его безопасности. Сразу после родов налаживается дыхание, и оно обязательно контролируется. Важно, чтобы было правильное соотношение кислорода и углекислого газа в крови, должно быть в норме артериальное давление.
Если малыш подрос…
После того, как малыш достигает возраста одного года, лечение становится больше симптоматическим. Состояние ребенка в этот период требует постоянного наблюдения и в случае обнаружения симптомов лейкомаляции, ему назначаются такие препараты, как: Пантогам, Фенибут. Благодаря их применению происходит тормозной эффект в образований зон некроза в коре мозга.
Если у ребенка фиксируется нарушение сна, то ему прописываются успокаивающие препараты – Валериана и Мелисса. Также хорошим эффектом обладают водные процедуры.
Если у малыша фиксируется повышение артериального давления, то назначают препараты Диакарб, Фуросемид или Глицерин. Но последние два препарата не применяются самостоятельно, обязательно необходимо, чтобы в организм поступал калий.
Все судорожные проявления убираются с помощью препарата Фенобарбитал. Если его применение вызывает тахикардию и давление, то его можно заменить его на бета-адреноблокаторы – Анаприлин и Обзидан.
Так как заболевание влечет за собой нарушение в работе двигательного аппарата, то назначают массаж и упражнения, а также физиотерапевтическое лечение.
Если происходит задержка в развитии речевого аппарата, то здесь на помощь приходят педагоги и дефектологи, которые помогут исправить речь.
В особо сложных случаях развивается респираторный дистресс-синдром. Для того, чтобы его избежать применяются препараты сурфактаната. Благодаря его применению уменьшается тяжесть дыхательного расстройства и потребность в аппарате для вентиляции легких пропадает.
Ребенок, у которого появляются первые симптомы заболевания не отличается ни чем, от здорового, но как только болезнь начинает прогрессировать, она становится основной причиной развития детского церебрального паралича.
При это тяжесть симптомов ДЦП будет зависеть от тяжести и зоны повреждения головного мозга.
У самого ребенка в этот период можно заметить:
- нарушения в сознании;
- изменения в дыхательных функциях;
- изменяется функция глотания;
- повышается артериальное давление;
- сильно страдает умственное развитие и изменяется работа ЦНС.
Прогноз зависит от масштаба самого заболевания. Если нарушения минимальные, то они ведут к изменениям неврологического статуса, а если они максимальные, то может развиться детский церебральный паралич.
Благодаря тому, что медицина не стоит на месте, проведенное лечение может способствовать уменьшению рисков появления такого рода заболеваний.
Курс терапии
Лекарство от ПВЛ на сегодняшний день так и не было придумано. Врач при составлении схемы лечения ориентируется в основном на результаты обследования и проявления болезни. Курс терапии лейкомаляции преимущественно направлен на купирование симптомов патологии.
В основу лечения входят медикаменты из ноотропной группы. Они улучшают обменные процессы и кровообращение в головном мозге. Обычно назначается Стугерон или Пирацетам. Не менее важно исправить двигательные и психомоторные сбои, так как ПВЛ является основной причин появление детского церебрального паралича.
В таком случае уменьшатся шансы на развитие патологии.
Профилактические меры
Чтобы снизить риски развития лейкомаляции необходимо:
- продлить срок беременности, так как, чем меньше срок, тем больше вероятность в развитии данного заболевания;
- по возможности необходимо предупредить у роженицы преждевременные роды.
Но не только врач может повлиять на развитие беременности, но и сама беременная может изменить ситуацию в положительную сторону. Что нужно делать:
- прежде всего, беременная женщина – это будущая мать и она должна вести здоровый образ жизни;
- нельзя, чтобы беременность возникла спонтанно, ее необходимо тщательно запланировать;
- питание должно быть слаженным и сбалансированным;
- каждая женщина в положении должна встать на учет и строго следовать рекомендациям врачей;
Во время беременности нужно стараться не болеть различными заболеваниями, особенно вирусными и инфекционными. Из-за перенесенного заболевания может пострадать будущий малыш.
История описания [ править | править код ]
Первое микроскопическое описание очага ПВЛ принадлежит J. M. Parrot (1873) [4] . Р. Вирхов [5] лишь макроскопически описал очаги желтоватого цвета в перивентрикулярных зонах боковых желудочков мозга у умерших новорождённых, родившихся от матерей с сифилисом и оспой, относя их к врождённому энцефалиту.
Нет достаточных оснований относить данные очаги к ПВЛ. Поражение описывалось под разными названиями («энцефалодистрофия», «ишемический некроз», «перивентрикулярный инфаркт», «коагуляционный некроз», «лейкомаляция», «размягчение мозга», «инфаркт перивентрикулярного белого вещества», «некроз белого вещества», «диффузная симметричная перивентрикулярная лейкоэнцефалопатия»), причём чаще немецкими учеными, но всемирное распространение получил термин «перивентрикулярная лейкомаляция», введённый в 1962 г. B. A. Banker и J. C.
Larroche [6] . Термин недостаточно чёткий, так как при ПВЛ возникают не размягчения, а более плотные по сравнению с окружающими участками мозга очаги коагуляционных некрозов. Первая статья в СССР и России, посвящённая ПВЛ, написана В. В. Власюком с соавт. (1981), который предложил воспользоваться термином «перивентрикулярная лейкомаляция».
Наиболее полные в мире исследования ПВЛ на самом большом секционном материале проведены В. В. Власюком (1981)(частота, этиопатогенез, топография, степень поражения различных отделов мозга, стадии развития очагов,нейрогистология, роль микроглии, электроная микроскопия и др.), который впервые выявил высокую частоту поражения зрительной лучистости и доказал, что ПВЛ — это персистирующий процесс, что к старым очагам некрозов могут присоединяться новые, что очаги ПВЛ могут находиться на разных стадиях развития. [7] [8]
Профилактика
К основным мерам профилактики данной патологии относят:
- продление срока беременности;
- предупреждение преждевременных родов.
Помимо этого, беременная должна строго придерживаться следующих профилактических мер:
- вести здоровый образ жизни;
- тщательно планировать беременность;
- придерживаться сбалансированного питания;
- регулярно посещать врача и проходить все необходимые обследования в срок;
- избегать инфекционных и вирусных заболеваний, которые могут негативно сказаться на здоровье будущего ребёнка.
Для снижения шанса на развитие ПВЛ желательно избежать преждевременных родов. Для этого беременная девушка должна соблюдать такие правила:
- Отказаться от вредных привычек;
- Полноценно высыпаться;
- Избегать умственных и физических перегрузок;
- Правильно питаться;
- Заниматься специальной лечебной гимнастикой;
- Наблюдаться у врача на протяжении всей беременности;
- Стараться избегать болезней, особенно инфекционного характера;
- Укреплять иммунитет, например, с помощью витаминных комплексов.
Мозг новорожденного
Длительное кислородное голодание может привести к отмиранию нейронов головного мозга. Так у новорожденных развивается некроз. На том месте, где ранее были нейроны, начинают образовываться кистозные соединения разной величины. После двух недель развития заболевания нервные ткани головного мозга атрофируются.
Легкая степень. Болезнь развивается до 7 дней, и поддается лечению. При должном уходе, выполнении комплекса мер по стабилизации состояния новорожденного – можно минимизировать разницу в развитии между больным и здоровым ребенком.
Средняя степень. Патологические необратимые изменения проходят до 10 дней. К основному диагнозу начинают добавляться новые расстройства: повышенное внутричерепное давление, судороги конечностей, нарушения вегетативной нервной системы.
Тяжелая степень. Поражение большого количества белого вещества мозга, а также возможно впадение в кому. Исход данного заболевания не благоприятный в любом случае, и не зависимо от назначенного лечения.
Новорожденный, которому поставили диагноз перивентрикулярная лейкомаляция, имеет отличия от здоровых детей, а именно:
- Гипер или гиповозбудимость.
- Судороги конечностей.
- Тонус мышц новорожденного, вследствие чего повышенная плаксивость ребенка.
- Парализованные конечности.
- Тяжелое дыхание, затрудненное глотание.
- Косоглазие, в большинстве случаев сходящееся.
- Отставание в развитии от своих сверстников как психомоторно, так и физически.
- Импульсивность, плохая концентрация внимания на предмете или действии.
Младенцы, у которых диагностирована ПВЛ, отстают в развитии по всем показателям. Уже при средней степени болезни можно говорить о параличе конечностей или нарушении двигательной функции ребенка. Младенцев с таким заболеванием следует лечить в специализированных центрах, где назначается комплекс необходимых процедур.
Головной мозг состоит из огромного числа клеток, плотно скомпонованных в один орган. В толще головного мозга могут возникать патологические участки разных размеров. Количество таких очагов также может быть разнообразно. Когда поражается весь мозг чередующимися участками здоровой и больной ткани, говорят о диффузном поражении.
Для головного мозга, как и любого органа нашего тела, характерны общие патологические процессы. При диффузном поражении возможны абсолютно любые характеристики изменений:
- Уплотнение ткани (склерозирование)
- Размягчение ткани (маляция)
- Воспаление ткани.
- Опухолевый процесс.
Ткань мозга очень богата жидкостью. Поэтому при гибели клеток мозга возникает так называемый влажный некроз. Ткань становится мягкой, возникают очаги размягчения. Когда в процесс вовлекается весь орган, происходит диффузная гибель нейронов. Дальше возможно два исхода: склероз омертвевших участков или образование кист. Таким образом, размягчение мозга является промежуточным этапом заболевания вне зависимости от причины его вызвавшей.
Возникнуть диффузное размягчение может из-за абсолютно различных причин. Но для его развития требуется повреждение абсолютно всей ткани мозга. Инсульты и черепно-мозговые травмы приводят к очаговым поражениям. Поэтому основными заболеваниями являются:
- Нейроинфекции.
- Отек мозга.
- Состояние после клинической смерти.
Нейроинфекции дают типичную воспалительную реакцию. Это приводит к универсальным последовательным процессам. Также из-за вовлечения в процесс всего органа иммунитет старается обособить возбудителя. Так, на фоне полного поражение мозга образуются очаги омертвения ткани с гнойным отделяемым. Часто энцефалит заканчивается летально, но возможно и восстановление структур мозга при своевременном лечении. Стоит отметить, что ткань мозга не способна восстанавливать мертвые нейроны. Их функция берется соседними клетками.
Вместо вывода
Учитывая, что лейкоэнцефалопатия, возникает на фоне тотального иммунодиффицита, любые меры по её профилактике, должны быть направлены на поддержание защитных сил организма, и предотвращению ВИЧ инфицирования.
К таким мерам можно отнести:
- избирательность при выборе полового партнёра.
- отказ от употребления наркотических препаратов, и от инъекционной их формы в частности.
- использование средств контрацепции во время полового контакта.
Тяжесть течения патологического процесса, зависит от состояния защитных сил организма. Чем сильнее снижен общий иммунитет, тем более остро протекает заболевание.
И напоследок, можно сказать, что в настоящий момент, медицинские специалисты активно работают над созданием эффективных методов лечения различных форм патологии.
Но как показывает практика, лучшим лекарством от данного недуга, является его профилактика. Лейкоэнцефалопатия головного мозга, относится к заболеваниям, которые напоминают запущенный механизм, остановить который не представляется возможным.
Добрый день! В статье упоминаются люди взрослые и преклонного возраста, а как протекает такое заболевание у подростка?
Лейкоэнцефалопатия — страшное, стремительное заболевание. Страшно смотреть, как близкий человек умирает буквально на глазах, и никто не в состоянии помочь.
У моего отца заболевание началось очень остро (предшествовала стойкая гипертония работа на жаре любитель саун и бань употреблял кофе в больших объемах).
Все описанные выше симптомы проявлялись по нарастающей. Умер через 9 месяцев от начала заболевания. Врачи практически не выходили из квартиры (терапевты, неврологи, скорая), бегали всей родней-помогали маме (психозы, агрессия,не мог глотать или давление начинает скакать, то почки…, последние 2 месяца кричал очень сильно 24 часа в сутки, бил ногами, руками везде, где можно).
Три раза лежали в стационаре. Умер через 9 месяцев от начала заболевания. Как и прогнозируют по данному заболеванию. Из здорового, полного жизни мужчины через 9 месяцев ни осталось ничего…
избирательность при выборе полового партнёра. отказ от употребления наркотических препаратов, и от инъекционной их формы в частности. использование средств контрацепции во время полового контакта.
Прогноз неутешителен
К сожалению, излечится от лейкоэнцефалопатии невозможно, при отсутствии вышеупомянутого лечения, пациенты живут не более полугода с момента появления первых признаков поражения ЦНС.
Антиретровирусная терапия может увеличить сроки жизни от года до полутора лет с момента появления первых признаков поражения мозговых структур.
Были отмечены случаи острого течения заболевания. При таком течении, летальный исход наступал в течение 1 месяца с момента начала заболевания.В 100% случаев, течение патологического процесса заканчивается летальным исходом.
В 100% случаев, течение патологического процесса заканчивается летальным исходом.
лейкомаляция — Викисловарь
Морфологические и синтаксические свойства[править]
| падеж | ед. ч. | мн. ч. |
|---|---|---|
| Им. | лейкомаля́ция | лейкомаля́ции |
| Р. | лейкомаля́ции | лейкомаля́ций |
| Д. | лейкомаля́ции | лейкомаля́циям |
| В. | лейкомаля́цию | лейкомаля́ции |
| Тв. | лейкомаля́цией лейкомаля́циею | лейкомаля́циями |
| Пр. | лейкомаля́ции | лейкомаля́циях |
лей-ко-ма-ля́-ци·я
Существительное, неодушевлённое, женский род, 1-е склонение (тип склонения 7a по классификации А. А. Зализняка).
Корень: -лейко-; корень: -маляц-; суффикс: -иj; окончание: -я.
Произношение[править]
- МФА: ед. ч. [lʲɪɪ̯kəmɐˈlʲat͡sɨɪ̯ə], мн. ч. [lʲɪɪ̯kəmɐˈlʲat͡sɨɪ]
Семантические свойства[править]
Значение[править]
- мед. ишемически-тромботическое поражение белого вещества полушарий головного мозга ◆ Таким образом,В. В. Власюк показал, что одной из частых причин перинатальной смертности является перивентрикулярная лейкомаляция, но, к сожалению, ничего не сообщает о происхождении этого размягчения мозга. Александр Ратнер, «Неврология новорожденных», 2015 г.
Синонимы[править]
- лейкоэнцефалопатия
Антонимы[править]
Гиперонимы[править]
- маляция, заболевание
Гипонимы[править]
Родственные слова[править]
| Ближайшее родство | |
Этимология[править]
Происходит от др.-греч. λευκός «белый» + лат. malacia «размягчение» из др.-греч. µαλακία «мягкость» от µαλακός «мягкий», далее от ??
Фразеологизмы и устойчивые сочетания[править]
Перевод[править]
Библиография[править]
Для улучшения этой статьи желательно:
|
Перивентрикулярная лейкомаляция головного мозга у новорожденных
Рейтинг автора
Автор статьи
Невропатолог, образование: Первый Московский государственный медицинский университет имени И.М. Сеченова. Стаж работы 20 лет.
Написано статей
Перивентрикулярная лейкомаляция является тяжелым осложнением у недоношенных детей. Это ишемическо-гипоксическое повреждение головного мозга, которое тяжело поддается лечению и впоследствии может стать причиной инвалидности.
При перивентрикулярной форме лейкомаляции вокруг боковых желудочков располагаются очаги некроза из-за недостатка кислорода и нарушения кровообращения. С этой патологией рождается каждый третий недоношенный ребенок весом от 1,5 до 2,5 кг. При кесаревом сечении, если оно проводится раньше срока, риск развития болезни повышается.
Основные причины развития
Недостаток кислорода губительно сказывается на мозге недоношенных детей. Это связано с недостаточным развитием компенсаторных механизмов, которые не могут вовремя обеспечить клетки органа кислородом.
Если ребенок родился в положенный срок, то его нервная система и кровоток сформированы лучше, поэтому при кислородном голодании кровообращение усилится, и повреждения не возникнут.
Усугубить положение может отсутствие у недоношенных детей прочной связи между артериями мозга.
В результате гипоксии образуются свободные радикалы, кислые продукты обмена, которые наносят повреждение нейронам и нарушают циркуляцию крови в мелких сосудах, а также провоцируют застойные процессы в артериях и венах. Это сопровождается некрозом тканей, развитием нарушений метаболизма и тромбозов.
Перивентрикулярная лейкомаляция у недоношенных детей чаще встречается, если ребенок находился на искусственной вентиляции легких. Аппарат подает кислород, но при его большом количестве происходит спазм мелких артерий, из-за чего развиваются ишемические нарушения.
Интересно, что патология чаще возникает у детей, рожденных в зимне-весенний период. Ученые предполагают, что это связано с недостаточным количеством витаминов и неблагоприятными погодными условиями, негативно влияющими на организм женщины в последние недели беременности.
Повышают риск развития лейкомаляции следующие факторы:
- тяжелое течение беременности;
- хронические инфекционные процессы в организме матери;
- нарушение кровотока в плаценте или у плода, что приводит к гипоксии;
- рождение раньше срока, слабая родовая деятельность;
- патологии после рождения, которые требуют искусственной вентиляции легких.
Чем опасна для мозга лейкомаляция
При этом патологическом процессе в головном мозге происходит следующее:
- Отмирание тканей.
- Гибель нервных клеток.
- Замещение дефектных клеток клетками микроглии, то есть образование рубцов.
- Потеря нейронами способности размножаться, в результате чего омертвевшие участки ничем не заполняются, и в них развиваются кисты.
В половине случаев этого заболевания возникает кровоизлияние желудочков мозга. Поражение коры мозга у новорожденных происходит редко, так как она хорошо снабжается кровью.
Развитие лейкомаляции происходит в первые дни после рождения и длится в течение недели. Проблема может появиться и позже, но в этом случае она возникает из-за инфекции или нарушения дыхания. В такой ситуации к имеющимся некрозам присоединяются новые, и состояние ребенка стремительно ухудшается.
Отмирание тканей и образование кист развивается в течение нескольких недель. После этого в головном мозге спадают полости, омертвевшие участки замещаются рубцовой тканью, и возникают необратимые атрофические изменения в нервной ткани.
Как проявляется патология
Лейкомаляция головного мозга может иметь разные симптомы. Повреждение тканей мозга не может протекать незаметно. Существуют такие степени развития болезни:
- Легкая. При этом на протяжении недели заметны признаки поражения мозга.
- Средняя. На протяжении десяти дней у ребенка возникают судороги, нарушения вегетативных функций, повышение внутричерепного давления.
- Тяжелая. Повреждаются глубокие слои мозговых тканей, и часто дети впадают в кому.
Среди основных проявлений болезни выделяют:
- Угнетение или значительное повышение нервно-рефлекторной возбудимости.
- Судороги.
- Снижение тонуса мышц.
- Симптомы поражения ствола мозга.
- Паралич.
- Нарушение зрения, которое проявляется косоглазием.
- Повышенную активность, нарушения интеллекта и психомоторного развития.
Неврологические симптомы могут и не проявляться в остром периоде. У большей части детей после завершения периода обострения на 5-9 месяцев улучшается состояние. Этот период называют мнимым благополучием. После этого появляются симптомы атрофии нервной ткани.
Расположение нервных путей вокруг желудочков приводит к тому, что нарушается двигательная функция. Поэтому, если у ребенка возникла лейкомаляция, то первым ее проявлением будет церебральный паралич. Его выраженность зависит от степени поражения мозга.
Из-за поражения мозгового ствола и черепных нервов развивается косоглазие, нарушение глотания и дыхания. В возрасте 6 месяцев появляются судороги.
При тяжелом поражении теменной и лобной доли мозга развивается ДЦП с задержкой психического развития. Если затронуты проводящие пути, то возникает паралич без снижения интеллекта и нарушений развития.
Дети, перенесшие в перинатальном возрасте кислородное голодание, страдают от дефицита внимания и гиперактивности. Этот вариант течения болезни можно считать благоприятным, так как состояние ребенка можно нормализовать с помощью специальных препаратов.
При умеренных или тяжелых повреждениях затормаживается речевое развитие, малыш несвоевременно начинает ходить, переворачиваться и выполнять другие действия, свойственные детям его возраста.
Больше внимания нужно уделять развитию гипертонуса, который доставляет болезненные ощущения ребенку. Из-за этого малыш плохо спит, часто плачет и капризничает.

Сосательный рефлекс при этом нарушен, поэтому грудное вскармливание может оставаться под вопросом.
При умеренном или легком повреждении структур головного мозга ребенок медленно растет, недостаточно прибавляет в весе, с трудом овладевает новыми навыками.
Наличие неврологического дефицита наиболее ярко проявляется в год и выражается церебральным параличом и задержкой психомоторного развития.
В конце восстановительного периода у детей наблюдается:
- замедление психологического и речевого развития;
- неустойчивость настроения;
- нарушения сна и внимания;
- в тяжелых случаях развивается церебральный паралич.
У взрослых болезнь может протекать более благоприятно и ничем не отличает их от других людей.
Методы лечения
При лейкомаляции развиваются необратимые поражения мозговой ткани. Полностью восстановить некротические очаги не представляется возможным. Но для устранения негативных проявлений патологического процесса назначают симптоматическую терапию. Самочувствие ребенка улучшают с помощью специальных медикаментов. Среди них:
- Ноотропные препараты. Они необходимы для улучшения притока крови к тканям мозга и улучшения обменных процессов. Такими свойствами обладают Пирацетам и Ницерголин.
- Гипотензивные лекарственные средства. Их назначают для снижения внутричерепного давления и устранения водянки головного мозга.
- Противосудорожные препараты. Избавляют от судорог.
- Бета-адреноблокаторы. С их помощью нормализуют артериальное давление и устраняют тахикардию.
- Гипотонические медикаменты. Показаны, если повышен мышечный тонус.
- С помощью Валерианы, Мелиссы и других успокоительных средств нормализуют сон ребенка.

Все физиологические показатели ребенка обязательно должны контролироваться.
Кроме медикаментозного лечения, для улучшения состояния ребенка используют лечебные массажи, физиотерапевтические процедуры, занятия со специальными педагогами, в ходе которых нормализуется внимание и память, а также улучшается развитие речи.
Если нормализовать внутричерепное давление с помощью препаратов не удалось, то необходимо оперативное вмешательство, в ходе которого устанавливают шунты для уменьшения количества ликвора и снижения давления внутри черепа.
При тяжелой степени течения лейкомаляции лечение проводят в реанимационных условиях с использованием аппарата для искусственной вентиляции легких.
Каким будет прогноз при подобном патологическом процессе, зависит от объема поврежденной нервной ткани и степени повреждений. Если при перивентрикулярной лейкомаляции нарушения небольшие, то состояние больного и функции органа можно скорректировать специальными препаратами.
При тяжелом течении заболевания лекарственные препараты не могут купировать проявления лейкомаляции. В этом случае развивается детский церебральный паралич, олигофрения, эпилепсия и другие осложнения.
Чтобы избежать развития заболевания, специалисты могут попытаться довести беременность до такого срока, когда роды не будут для малыша опасными.
Перивентрикулярная лейкомаляция - это... Что такое Перивентрикулярная лейкомаляция?
| В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 18 июля 2011. |
Перивентрикулярная лейкомаляция (ПВЛ) — форма поражения белого вещества полушарий головного мозга у детей, открытая морфологами, одна из причин детского церебрального паралича. ПВЛ характеризуется возникновением очагов некроза, преимущественно коагуляционного, в перивентрикулярных зонах белого вещества полушарий головного мозга у новорожденных детей (редко у мертворожденных).[1] Она относится к одной из форм так называемой «гипоксически-ишемической энцефалопатии».
История описания
Первое микроскопическое описание очага ПВЛ принадлежит J.M.Parrot (1873)[2]. Р.Вирхов[3] лишь макроскопически описал очаги желтоватого цвета в перивентрикулярных зонах боковых желудочков мозга у умерших новорожденных, родившихся от матерей с сифилисом и оспой, относя их к врожденному энцефалиту. Нет достаточных оснований относить данные очаги к ПВЛ. Поражение описывалось под разными названиями («энцефалодистрофия», «ишемический некроз», «перивентрикулярный инфаркт», «коагуляционный некроз», «лейкомаляция», «размягчение мозга», «инфаркт перивентрикулярного белого вещества», «некроз белого вещества», «диффузная симметричная перивентрикулярная лейкоэнцефалопатия»), причем чаще немецкими учеными, но всемирное распространение получил термин «перивентрикулярная лейкомаляция», введенный в 1962 г. B.A.Banker и J.C.Larroche[4]. Термин недостаточно четкий, так как при ПВЛ возникают не размягчения, а более плотные по сравнению с окружающими участками мозга очаги коагуляционных некрозов. Первая статья в СССР и России, посвященная ПВЛ, написана В. В. Власюком с соавт. (1981), который предложил воспользоваться термином «перивентрикулярная лейкомаляция».
Наиболее полные в мире исследования ПВЛ на самом большом секционном материале проведены В. В. Власюком (1981)(частота, этиопатогенез, топография, степень поражения различных отделов мозга, стадии развития очагов,нейрогистология, роль микроглии, электроная микроскопия и др.), который впервые выявил высокую частоту поражения зрительной лучистости и доказал, что ПВЛ — это персистирующий процесс, что к старым очагам некрозов могут присоединяться новые, что очаги ПВЛ могут находиться на разных стадиях развития.[5][6]
Морфология
По морфологической сути ПВЛ — это мелкоочаговые в основном коагуляционные перивентрикулярные инфаркты белого вещества мозга, чаще двусторонние и относительно симметричные. При ПВЛ очаги некрозов располагаются в перивентрикулярной зоне, но при наличии множества очагов (тяжелых поражениях) отдельные из них могут распространяться на центральные отделы белого вещества мозга. C наибольшей частотой очаги ПВЛ возникают в перивентрикулярном белом веществе начальных отделов задних рогов боковых желудочков мозга (поражается зрительная лучистость) и центральных отделов желудочков на уровне зрительных бугров (поражается кортико-спинальный тракт). В процессе морфогенеза очаги проходят три стадии: 1)развития некроза, 2)резорбции и 3)формирования глиозного рубца или кисты. Кисты возникают при крупных и сливающихся очагах ПВЛ, при смешанных некрозах (колликвация в центре и коагуляционный ободок по периферии). Вокруг очагов обычно определяется зона других поражений белого вещества мозга — гибель проолигодендроцитов, пролиферация микроглиоцитов и тучных астроцитов, отек, кровоизлияния, гибель капилляров и др. (так называемый «диффузный компонент» ПВЛ). Однако диффузные поражения без некрозов это не ПВЛ. Если произвести 15 фронтальных срезов мозга, то обнаружение очагов ПВЛ в 1-4 срезах свидетельствует о легкой степени ПВЛ, в 5-8 срезах — о средней степени ПВЛ и в 9-13 срезах — о тяжелой степени ПВЛ (2).
Частота
Частота ПВЛ по данным разных авторов колеблется от 4,8 % до 88 %, однако часто среди определенной группы детей или по данным нейросонографических исследований, что не вполне объективно. На невыборочном секционном материале частота ПВЛ составляет 12,6 %, причем чаще у мальчиков, а в зависимости от массы при рождении: 1001—1500 г. — 13,3 %, 1501—2000 г. −21,5 %, 2001—2500 г.- 31,6 %, 2501-3000 г.- 14,8 %, более 3000 г. — 3,5 %. У недоношенных 1-й и 2-й степеней встречается чаще всего. У умерших в первые сутки после рождения ПВЛ встречается с частотой 1,8 %, а у умерших на 6-8 дни — 59,2 %. В группе родившихся при головном предлежании частота ПВЛ составляет 19,6 %, тазовом предлежании — 17,4 %, при кесаревом сечении — 35,6 %.[7]
Этиология и патогенез
Этиологически ПВЛ это гипоксически-ишемическое поражение белого вещества мозга, связанное с артериальной гипотонией, приступами апноэ после рождения, реанимационными мероприятиями, инфекциями и др. Способствует ПВЛ недоношенность, причем небольшой степени (1-2-й). Патогенетические факторы: гипоксия, ацидоз, гипокапния, токсины и др. Очаги некрозов (инфаркты) возникают в пограничной зоне между вентрикулофугальными и вентрикулопетальным артериальными ветвями[8], локализующейся в перивентрикулярном белом веществе мозга.
Для данной нозологии характерны 2 основных признака:
- 1. локализация в перивентрикулярных зонах белого вещества больших полушарий
- 2. очаги имеют характер преимущественно коагуляционных некрозов.
Вокруг очагов ПВЛ могут определяться другие поражения, так называемый «диффузный компонент».
Время возникновения ПВЛ — в основном в первые дни после рождения, иногда анте- и интранатально.
Отличия от других поражений
У глубоко недоношенных детей чаще возникают другие поражения белого вещества мозга, отличные от ПВЛ, — диффузная лейкомаляция и мультикистозная энцефаломаляция. Ввиду недостаточной изученности последних поражений, их часто стали ошибочно относить к ПВЛ.
ПВЛ надо дифференцировать с со следующими основными поражениями белого вещества больших полушарий мозга:
- отечно-геморрагическая лейкоэнцефалопатия (ОГЛ)
- телэнцефальный глиоз (ТГ)
- диффузная лейкомаляция (ДФЛ)
- субкортикальная лейкомаляция (СЛ)
- перивентрикулярный геморрагический инфаркт (ПГИ)
- внутримозговое кровоизлияние (ВМК)
- мультикистозная энцефаломаляция[9]
- субэпендимальная псевдокиста.
При СЛ очаги некрозов располагаются в субкортикальной области и в отдельных тяжелых случаях могут распространяться на центральные отделы больших полушарий. При ДФЛ очаги некрозов располагаются диффузно во всех отделах белого вещества мозга, захватывая перивентрикулярную, субкортикальную и центральную области больших полушарий; некрозы колликвационные, ведут к кистообразованию и возникают наиболее часто у глубоко недоношенных детей. При ТГ нет полного некроза мозга и кисты не образуются. ПГИ возникают при тромбозах в системе внутренних мозговых вен или являются осложнением внутрижелудочковых кровоизлияний. Псевдокисты не имеют никакого отношения к некрозам мозга и относятся скорее всего к порокам развития. Патогенез всех перечисленных поражений различен.
В настоящее время имеет место гипердиагностика ПВЛ за счет переоценки данных нейровизуализационных исследований и недооценки других поражений белого вещества мозга.
Литература
- ↑ 1. Власюк В. В. Перивентрикулярная лейкомаляция у детей. — СПб.: Гликон Плюс, 2009. — 218 с. ISBN 978-5-93682-540-8.
- ↑ Parrot J. M. Etude sur le ramollissement de l’encephale chez le nouveaune. — Arch. Physiol. Norm. Path., 1873, v. 5, p. 59-79.
- ↑ Virchow R. Zur pathologischen Anatomie des Gehirns: I. Congenitale Encephalitis und Myelitis. — Virchows Arch., 1867, Bd 38, S. 129—138.
- ↑ Banker B. A., Larroche J. C. Periventricular leukomalacia of infancy. A form of neonatal anoxic encephalopathy. — Arch. Neurol., 1962, v. 7, p. 386—410.
- ↑ Власюк В. В., Туманов В. П. Патоморфология перивентрикулярной лейкомаляци. Новосибирск, «Наука», 1985.- 96 с.
- ↑ Власюк В. В., Майер И. О., Охтырская Л. А., Бабуцидзе Т. Я. Перивентрикулярная лейкомаляция у новорожденных и её танатогенетическое значение. Педиатрия, 1981, № 11, с. 32-36.
- ↑ В. В. Власюк Родовая травма и перинатальные нарушения мозгового кровообращения. СПб, «Нестор История», 2009.- 252 С. ISBN 978-5-98187-373-7.
- ↑ De Reuck J., Chattha A. S., Richardson E. P. Pathogenesis and evolution of periventricular leukomalacia in infancy. — Arch. Neurol., 1972, v. 27, p. 229—236.
- ↑ В. В. Власюк, Ю. П. Васильева, А. А. Вильниц, В. Е. Карев. Мультикистозная энцефаломаляция у детей, роль инфекций. Журнал инфектологии, 2010, № 2, с. 45-53. ISSN 2072-6732.
Прогрессирующая мультифокальная лейкоэнцефалопатия — Википедия
Прогрессивная мультифокальная лейкоэнцефалопатия (ПМЛ) — это быстро прогрессирующее демиелинизирующее инфекционное[3] заболевание центральной нервной системы с асимметричным поражением мозга. Вызывается активацией полиомавируса человека 2, носителем которого является около 80 % населения.[4]
Полиомавирус человека 2 (вирус JC) является одним из шести видов человеческих полиомавирусов и был назван по инициалам пациента (John Cunningham), у которого он был впервые обнаружен в 1971 году.[5]. Его активации в организме человека предшествует значительная супрессия иммунной системы: в подавляющем большинстве случаев ПМЛ является проявлением синдрома приобретенного иммунодефицита (СПИД), в остальных случаях — после иммуносупресивной и иммуномодуляторной терапии, например в рамках лечения моноклональными антителами или после трансплантации органов, а также при гематологических новообразованиях — таких как болезнь Ходжкина, хронический лимфолейкоз.[6] Особенно часто заболевание после трансплантации костного мозга. Проблемой является возникновение ПМЛ у больных рассеянным склерозом, находящихся на лечении натализумабом.
Эффективного метода лечения ПМЛ к настоящему моменту не найдено[7] (кроме случаев, когда иммуносупрессия достигалась применением моноклональных антител).
До эпидемии ВИЧ-инфекции это было крайне редкое заболевание. За 26 лет с 1954 до 1984 было описано только 230 случаев ПМЛ. Заболеваемость была 1:1 000 000. В 1990-х годах заболеваемость выросла до 1:200 000. При этом среди ВИЧ-инфицированных заболеваемость достигала 3,3 на 1000 больных. После введения в практику высокоактивной антиретровирусной терапии (ВААРТ) частота возникновения ПМЛ составляет около 1,3 случаев на 1000 ВИЧ-инфицированных в год.[7]
Патогенез и патологические изменения[править | править код]
Инфицирование вирусом JC протекает бессимптомно. Инфицирование наступает, как правило, ещё в детском возрасте, возбудитель остается в теле пожизненно.[8][9] Возможное место персистенции вируса — почки и/или костный мозг. В случае ослабления иммунной системы вирус транспортируется лейкоцитами в центральную нервную систему и начинает свою репликацию в белом веществе полушарий, ствола мозга, мозжечке и спинном мозге. Заболевание является демиелинизирующим, нейропатологически определяются множественные очаги демиелинизации, гиперхромные и увеличенные в размерах ядра олигодендроцитов, увеличенные и деформированные астроциты. Серое вещество мозга остается практически незатронутым. Гистопатолгически считается заболевание доказанным в случае обнаружения JC-протеина, продуцируемого вирусом (при проведении иммуногистохимического исследования) или обнаружение генома JC-вируса при гибридизировании ткани.
Начало как правило, подострое и выражается в быстро прогрессирующем психосиндроме, диссоциированном с очаговыми неврологическими симптомами — прежде всего моно- или гемипарезами, нарушениями речи и нарушениями зрения — такими, как геми- и квадрантные анопсии. Атаксии, головокружение, головные боли, нарушения чувствительности и эпилептические приступы возникают гораздо реже. Психические нарушения выражаются в прогрессирующих когнитивных нарушениях и, в отличие от деменции при ВИЧ-инфекции, сопровождаются очаговыми неврологическими нарушениями.[6]. Было описано чисто спинальное протекание болезни (очаги только в спинном мозге) без нарушений психики.[10]
Магнитно-резонансная томография (МРТ) является по сравнению с компьютерной томографией предпочтительной методикой. В Т2-взвешенных изображениях определяются гиперинтенсивные очаги — асимметрично распределенные в белом веществе лобных и теменно-затылочных отделов, а также в корковом веществе, в стволе мозга и мозжечке, без — или с незначительным захватом контрастного вещества; увеличения объёма ткани не наблюдается. В Т1-взвешенных изображениях эти очаги гипоинтенсивны. У одной трети пациентов также обнаруживаются инфратенториальные очаги, которые могут также определяться изолированно.[11].
Изменения спинномозговой жидкости неспецифичны и характерны для таковых при заболеваниях, связанных с вирусом иммунодефицита. Прямое обнаружение вируса JC путём ПЦР-обследования удается в 74-90 %. Также может быть определена нагрузка JC-вируса по аналогии с такой при ВИЧ. Исследования показали, что снижение показателей вирусной нагрузки или даже их исчезновение в связи с проводимой терапией связаны с улучшенным прогнозом заболевания и общим числом выживания.[12]
Электроэнцефалография: неспецифическое замедление активности.
Биопсия ткани мозга: проводится при повторно негативной ПЦР и прогрессирующем заболевании.
Для окончательной постановки диагноза необходимо: наличие заболевания, обуславливающего иммуносупрессию; типичные изменения МРТ и положительная ПЦР; иногда — биопсия ткани мозга.
При подозрении на ПМЛ в первую очередь должны быть исключены более частые, чем ПМЛ энцефалопатии — такие, как при токсоплазмозе, криптококкозе. Далее проводится дифференциальный диагноз с лимфомой ЦНС, ВИЧ-деменцией и лейкодистрофией; у детей — с подострым склерозирующим панэнцефалитом. При подозрении на ПМЛ у больных с рассеянным склерозом, находящихся на терапии натализумабом, необходимо исключить очередное обострение основного заболевания — при этом очаги в МРТ принимают на себя контрастное вещество.
Специфическая терапия неизвестна. Для подтверждения эффекта лечения различными противовирусными препаратами не хватает рандомизированных исследований[13]. Самым эффективным методом лечения является восстановление активности иммунной системы. У пациентов с иммуносупрессивной терапией она должна быть по возможности отменена или уменьшена дозировка[14]. Пациентам, получавшим моноклональные антитела показан плазмаферез. У пациентов с возникновением ПМЛ после трансплантации органов при определенных условиях трансплантированный орган должен быть удален. Обсуждается возможность применения атипичных нейролептиков: известна их способность блокирования рецепторов- 5-HT2A — эти же рецепторы являются целью вируса JC; для подтверждения этого предположения пока нет контролируемых исследований.[13]
Негативный. Если не удалось восстановить или улучшить функцию иммунной системы, смерть наступает от 3 до 20 месяцев после постановки диагноза ПМЛ.
- Maschke MArent G. und Maschke M. HIV-Infektion und AIDS: neurologische Manifestation. Kohlhammer-Verlag 2013 «Therapie und Verlauf neurologischer Erkrankungen» p. 612
- C. S. Tan, I. J. Koralnik: Progressive multifocal leukoencephalopathy and other disorders caused by JC virus: clinical features and pathogenesis. In: Lancet Neurology, 2010; 9:425-437. PMID 20298966, doi:10.1016/S1474-4422(10)70040-5.
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ A. K. Bag, J. K. Curé, P. R. Chapman, G. H. Roberson, R. Shah. Инфекция головного мозга вирусом JC (неопр.).
- ↑ Weissert R. Progressive multifokale Leukenzephalopathie. Journal of Neuroimmunologie 2011; 231: 73-74
- ↑ Padgett BL, Walker DL, Zu Rhein GM et al. Cultivation of papova-like virus from human brain with progressive multifocal leucoencephalopathy. Lancet. 1971; 1:1257-60
- ↑ 1 2 Berger JR. The clinical features of PML. Cleve Clin J Med. 2011; 78: S8-12
- ↑ 1 2 Прогрессирующая мультифокальная лейкоэнцефалопатия (обзор литературы) (недоступная ссылка)
- ↑ Kean et al. PLoS Pathog. 2009 5
- ↑ Egli et al J Infect Dis. 2009 Mar 15;199
- ↑ Stich O., Herpers M., Keil A. Et al. JC virus myelitis without cerebral involvement in acute myeloid leukemia. European Journal of Neurology 2011; 18 (11): e143-e144
- ↑ Whiteman ML, Post MJ, Berger JR, Tate LG, Bell MD, Limonte LP. Progressive multifocal leukoencephalopathy in 47 HIV-seropositive patients: neuroimaging with clinical and pathologic correlation. Radiology. 1993 Apr;187(1):233-40
- ↑ Weber T, Turner RW, Frye S, Lüke W, Kretzschmar HA, Lüer W, Hunsmann G. Progressive multifocal leukoencephalopathy diagnosed by amplification of JC virus-specific DNA from cerebrospinal fluid. AIDS 1994 Jan;8(1):49-57.
- ↑ 1 2 Progressive multifokale Leukoenzephalopathie (неопр.). hivbuch.de. Дата обращения 23 сентября 2015.
- ↑ Stüve O, Marra CM, Cravens PD et al. Potential risk of progressive multifocal leukoencephalopathy with natalizumab therapy: possible interventions. Arch Neurol. 2007;64:169-76. PMID 17296831
Лейкоэнцефалопатия головного мозга: в чем опасность заболевания
Лекарственных препаратов, способных остановить развитие заболевания, в настоящее время не существует.
Описание
Лейкоэнцефалопатия – заболевание, характеризующееся стойким разрушением в головном мозге белого вещества. Болезнь развивается быстро и практически всегда приводит к летальному исходу.
Патология впервые описана Людвигом Бинсвангером в 1964 г., поэтому иногда ее называют болезнью Бинсвангера.
Причины
Принято выделять 3 основные причины, приводящие к лейконэнцефалопатии. Это гипоксия, стабильно высокое давление и вирусы. Провоцируют ее возникновение следующие заболевания и состояния:
- эндокринные нарушения;
- гипертония;
- атеросклероз;
- злокачественные опухоли;
- туберкулез;
- ВИЧ и СПИД;
- патологии позвоночника;
- генетический фактор;
- вредные привычки;
- родовая травма;
- прием препаратов, снижающих иммунную реакцию организма.
Провоцирующее действие вредоносных факторов ведет к демиелинизации пучков нервных волокон. Белое вещество уменьшается в объеме, размягчается, изменяет структуру. В нем появляются кровоизлияния, очаги поражения, кисты.
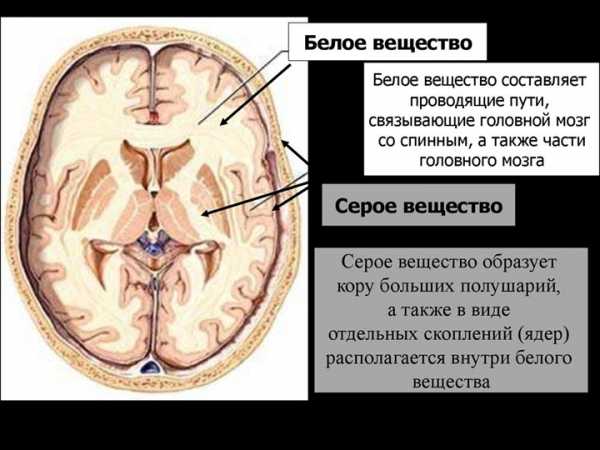
Часто демиелинизацию вызывают полиомавирусы. В неактивном состоянии они присутствуют в жизни человека постоянно, сохраняясь в почках, костном мозге, селезенке. Ослабление иммунитета приводит к активизации вирусов. Лейкоциты переносят их в центральную нервную систему, где они находят благоприятную среду в мозге, поселяются в нем и разрушают его.
Обычно необратимым изменениям подвергается только белое вещество. Однако есть данные и о том, что, вероятно, перивентрикулярный вид лейкоэнцефалопатии ведет также к поражению серого вещества.
Классификация
Определение основной причины патологии и характера ее течения позволяет выделять несколько типов лейкоэнцефалопатии.
Дисциркуляторная
Основной причиной появления и развития мелкоочаговой лейкоэнцефалопатии сосудистого генеза является поражение сосудов мозга, вызванное гипертонией, травмами, появлением атеросклеротических бляшек, эндокринными заболеваниями, болезнями позвоночника. Кровообращение нарушается из-за сгущения крови и закупорки сосудов. Ухудшающим состояние фактором является алкоголизм и ожирение. Считается, что болезнь развивается при наличии отягчающих наследственных факторов.
Данную патологию называют также прогрессирующей сосудистой лейкоэнцефалопатией. Сначала появляются небольшие очаги поражения сосудов, потом они увеличиваются в размерах, вызывая ухудшение состояния больного. С течением времени нарастают признаки патологии, заметные окружающим. Ухудшается память, снижается интеллект, возникают психоэмоциональные расстройства.
Больной жалуется на тошноту, головную боль, постоянную усталость. Сосудистая мелкоочаговая энцефалопатия характеризуется скачками давления. Человек не может глотать, с трудом пережевывает пищу. Появляется тремор, отличающий болезнь Паркинсона. Утрачивается способность контролировать процессы мочеиспускания и дефекации.
Очаговая энцефалопатия сосудистого генеза регистрируется в основном у мужчин после 55 лет. Ранее данное нарушение было включено в список МКБ, но в дальнейшем его исключили.
Прогрессирующая мультифокальная
Главной особенностью этого типа нарушения считается появление большого количества очагов повреждения. Вызывают воспаление полиомавирус человека 2 (JC polyomavirus). Он обнаруживается у 80% жителей Земли. В скрытом состоянии живет в организме несколько лет, но при ослаблении иммунитета активируется и, попадая в ЦНС, вызывает воспаление.
Провоцирующими заболевание факторами являются СПИД, ВИЧ-инфицирование, длительное применение иммунодепрессантов и лекарств, предназначенных для лечения онкологических заболеваний. Прогрессирующая мультифокальная энцефалопатия диагностируется у половины пациентов со СПИДом и 5% людей с ВИЧ-инфекцией.
Поражение часто имеет асимметричный характер. Признаками ПМЛ являются параличи, парезы, ригидность мышц, тремор, напоминающий болезнь Паркинсона. Лицо приобретает вид маски. Возможна потеря зрения. Проявляются тяжелые когнитивные нарушения, снижение внимания.
Мультифокальная лейкоэнцефалопатия не лечится. Для улучшения состояния больного убирают препараты, подавляющие иммунитет. Если заболевание вызвано пересадкой органа, он подлежит удалению.
Перивентрикулярная
Лейкопатию головного мозга у ребенка вызывает гипоксия, возникшая при родах. Инструментальные методы диагностики позволяют увидеть участки гибели ткани, преимущественно рядом с мозговыми желудочками. Перивентрикулярные волокна несут ответственность за двигательную активность, и их поражение ведет к детскому церебральному параличу. Очаги поражения возникают симметрично, в особо тяжелых случаях обнаруживаются во всех центральных зонах мозга. Поражение характеризуется прохождением 3 стадий:
- возникновение;
- развитие, приводящее к структурным изменениям;
- образование кисты или рубца.
Перивентрикулярная лейкоэнцефалопатия характеризуется 3 степенями заболевания. Легкая степень характеризуется незначительной выраженностью симптомов. Обычно они проходят через неделю после рождения. Для средней степени характерно повышение внутричерепного давления, возникают судороги. При тяжелой ребенок находится в коме.
Симптомы появляются не сразу, некоторые из них можно заметить только через 6 месяцев после рождения ребенка. Чаще всего обращают на себя внимание парезы и парализация. Наблюдается косоглазие, заторможенность, гиперактивность.
Лечение включает массаж, физиопроцедуры, специальные комплексы упражнений.
Лейкоэнцефалопатия с исчезающим белым веществом
Основной причиной этого заболевания являются мутации генов, подавляющие белковый синтез. Чаще всего появляется у детей, преимущественно в возрасте от двух до шести лет. К провоцирующим факторам относят сильное психическое напряжение, вызванное травмой или тяжелой болезнью.
Для заболевания характерны парезы, судороги, слабость и ригидность мышц, вялость, нарушения мышления. У грудничков возникают проблемы с сосанием, часто появляется рвота, температура, признаки сильного возбуждения. Ночью возможны случаи апноэ. У женщин нарушается работа яичников, возникает гормональный дисбаланс. В тяжелом состоянии больной впадает в кому. Исследование показывает, что в таком состоянии возможно полное исчезновение белого вещества, остается только кора и стенки желудочков.
Симптомы
Заболевание развивается в большинстве случаев достаточно быстро. Сначала обращает на себя внимание рассеянность, эмоциональная лабильность, безразличие, склонность к депрессии, появление фобий. Больной теряет способность произносить слова, концентрировать и переключать внимание, быстро утомляется, не может проанализировать даже обычные события дня, забывает имена родственников.
Прогрессирующая болезнь приводит к нарушениям сна, раздражительности, нарастанию тонуса мышц, возникновению непроизвольных движений головы, глаз. У больного нарушается походка.
На следующей стадии отмечается нарушение движений, глотания, замедление выполнения всех действий, парализация, потеря чувствительности, онемение, тремор, эпилептические приступы. Ухудшаются когнитивные способности, развивается слабоумие. Возможна потеря речи. Резкое ухудшение зрения может привести к слепоте. Часто люди страдают от недержания мочи, кала.
Диагностика
Консультация невропатолога и инфекциониста необходима при малейшем подозрении на энцефалопатию любого происхождения.
В обязательном порядке назначается электроэнцефалография – она позволяет определить электрическую активность головного мозга, обнаружить признаки и очаги судорожной активности. Магнитно-резонансная томография предоставит точную информацию о сосудах, локализации очагов повреждения, их количестве, особенностях. Практически всем больным назначается биопсия – берут пробу мозговой ткани. Биопроба используется в проведении ПЦР и позволяет обнаружить вирус. Обнаружить белок в ликворе позволяет люмбальная пункция.
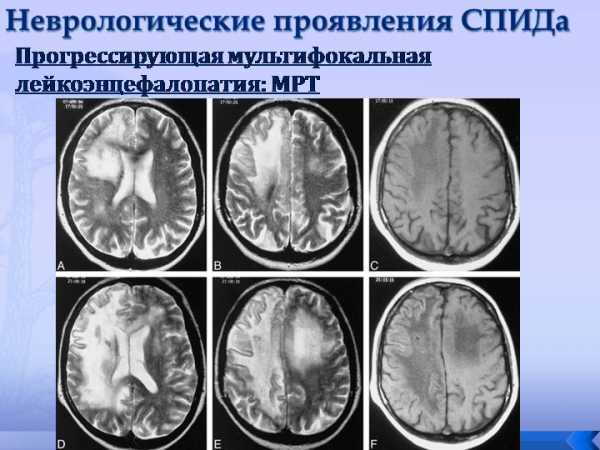
В качестве одной из диагностических мер проводится консультация у психиатра. Он уточняет психические нарушения больного с помощью нейропсихологического тестирования.
Из лабораторных исследований делают общий анализ крови, пробу на наркотические и токсические вещества.
Лечение
На сегодняшний момент не существует средства, позволяющего предотвратить разрушение белого вещества ЦНС. Основная причина – невозможность повлиять на воспаление. Лекарства не проникают сквозь гематоэнцефалический барьер (естественное препятствие между мозговой тканью и кровью).
Назначаемая терапия имеет комплексный поддерживающий характер. Ее целями являются замедление скорости развития заболевания, нормализация психоэмоционального состояния человека, снятие симптомов:
- Лекарства, стимулирующие и нормализующие кровообращение, – Актовегин, Кавинтон.
- Ноотропные средства – Ноотропил, Пантогам, Церебролизин, Пирацетам.
- Препараты, предназначенные для защиты сосудов, — Курантил, Циннаризин, Плавикс.
- Средства для защиты от вирусов – Ацикловир, Кипферон, Циклоферон.
- Лекарственные средства, содержащие стероидные гормоны, – Дексаметазон.
- Препараты, улучшающие свертываемость крови, – Гепарин, Фрагмин.
- Антидепрессанты – Флувал, Прозак, Флунисан.
- Витаминные комплексы с витаминами A, B, Е.
- Препараты, способные повысить сопротивляемость организма к вредному воздействию окружающей среды, — экстракт алоэ, женьшеневые препараты.
Лечение включает гомеопатические медикаменты, лекарства на основе трав. Дополнительно проводится массаж, преимущественно воротниковой зоны, физиотерапевтические методы, рефлексотерапия, иглоукалывание.
Прогноз
Лейкоэнцефалопатия не лечится. Сколько живут люди, у которых выявлена эта патология, зависит от особенностей ее течения и соблюдения врачебных назначений. Постоянный прием предписанных лекарств, выполнение профилактических мер, осуществление физиотерапевтического лечения продлевают жизнь больного до полутора лет с момента возникновения первых симптомов.
Без лекарственной поддержки срок жизни составляет шесть месяцев. Отсутствие своевременного и правильного лечения остро развивающегося заболевания сокращает прогноз жизни до одного месяца.
Профилактика
С учетом того, что лейкоэнцефалопатия возникает из-за повышенного давления и гипоксии, основные меры профилактики направлены на предотвращение обострения этих факторов. Рекомендуется нормализовать вес, заниматься спортом, укреплять иммунитет, не допускать чрезмерных физических и эмоциональных нагрузок, соблюдать режим дня, применять назначенные лекарственные препараты. Для недопущения заражения СПИДом следует избегать случайных половых связей.
Уменьшая риск возникновения гипертонии, сахарного диабета, ВИЧ-инфекции, человек тем самым снизит вероятность развития энцефалопатии.
Современная медицина позволяет установить точный диагноз, выявить причины лейкоэнцефалопатии, однако не в ее силах пока остановить развитие этого заболевания и предотвратить его появление. Большинство современных лекарств помогает ненадолго облегчить состояние больного, снять некоторые симптомы. Однако их применение оправданно, т. к. они позволяют человеку прожить еще несколько лет.