Нитриты что это такое
Нитриты — Википедия
Объёмная модель иона NO2Нитриты — соли азотистой кислоты HNO2, например, нитрит натрия NaNO2, нитрит кальция Ca(NO2)2. Известны нитриты щелочных, щелочноземельных, 3d-металлов, а также нитриты свинца и серебра.
Кристаллическими веществами являются только нитриты калия, серебра, кальция и бария. Нитриты калия, натрия и бария в воде хорошо растворимы, малорастворимы нитриты серебра, ртути (II), меди. С повышением температуры растворимость нитритов возрастает. В органических растворителях нитриты растворяются плохо.
Нитриты являются термически малоустойчивыми соединениями. Так, без разложения могут плавиться только нитриты щелочных металлов, остальные же начинают разлагаться при 250—300 °C с выделением металла либо его оксида, азота, оксидов азота и кислорода.
Нитриты реагируют с солями меди, образуя комплексный гексонитритокупрат-анион, придающий раствору характерный зелёный цвет, что можно использовать в лаборатории как качественную реакцию.
- CuSO4+6NaNO2→Na2SO4+Na4[Cu(NO2)6]{\displaystyle {\mathsf {CuSO_{4}+6NaNO_{2}\rightarrow Na_{2}SO_{4}+Na_{4}[Cu(NO_{2})_{6}]}}}
Нитриты медленно разлагаются под действием кислот с выделением газа (продуктов разложения азотистой кислоты).
- 2NaNO2+h3SO4→Na2SO4+NO+NO2+h3O{\displaystyle {\mathsf {2NaNO_{2}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+NO+NO_{2}+H_{2}O}}}
В горячей воде те же вещества реагируют с образованием оксида азота (II) и азотной кислоты:
- 6NaNO2+3h3SO4→3Na2SO4+2HNO3+4NO+4h3O{\displaystyle {\mathsf {6NaNO_{2}+3H_{2}SO_{4}\rightarrow 3Na_{2}SO_{4}+2HNO_{3}+4NO+4H_{2}O}}}
Нитриты могут выступать как окислителями, так и восстановителями — в кислой среде они окисляются до нитратов, в щелочной способны восстанавливаться до оксида азота NO.
При взаимодействии нитритов со спиртами в кислой среде при пониженной температуре образуются органические нитриты:
- ROH+NaNO2→oth3SO4RO-N=O{\displaystyle {\mathsf {ROH+NaNO_{2}{\xrightarrow[{^{o}t}]{H_{2}SO_{4}}}RO{\text{-}}N{\text{=}}O}}}
В промышленности нитриты получают поглощением нитрозного газа (NO + NO2) растворами гидроксида или карбоната натрия с образованием раствора нитрита натрия, из которого кристаллизацией получают сухой продукт. Нитриты других металлов получают обменной реакцией с нитритом натрия либо восстановлением соответствующих нитратов.
Нитриты используются при получении азокрасителей, для получения капролактама, как окисляющие и восстанавливающие реагенты в резинотехнической, текстильной и металлообрабатывающей промышленности. Нитрит натрия используется как консервант.
Нитрит натрия также применяется при производстве бетонных смесей в качестве ускорителя твердения и противоморозной добавки.
Нитриты попадают в организм человека двумя путями: прямым содержанием или же нитратами, которые в пищеварительном тракте (в основном в полости рта[1], также желудке или кишечнике) человека превращаются в нитриты под действием фермента нитратредуктазы. Также нитриты используются в производстве обработанных мясных продуктов (колбасы, сосиски, ветчина и пр.)
Эпидемиологические исследования высокого уровня потребления нитратов из овощей выявили снижение риска рака желудка, в то время как другие исследования о потреблении нитратов/нитритов из обработанных мясных продуктов, в которых нитриты используются как консерванты, показывают повышение рисков. [2] Механические исследования показывают, что образование опасных нитросоединений (таких как нитрозамины) ускоряется в присутствии компонентов мяса и подавляется витаминов С и другими антиоксидантами и фитонутриентами из растительных продуктов [3].
Таким образом, нитриты ведут себя неодинаково в зависимости от того, из каких источников они поступают в организм. Нитриты, добавляемые в мясные продукты для их консервации, преобразуются в нитрозамины. [4] Нитриты, преобразовавшиеся из нитратов из овощей и фруктов, далее превращаются в оксид азота(II), которые способствует расширению кровеносных сосудов и нормализации кровяного давления. [5]
При нормальном физиологическом состоянии и поступлении нитритов в организм не более допустимой суточной дозы, утверждённой Министерством здравоохранения РФ в 0,2 мг/кг массы тела (за исключением детей грудного возраста), в организме человека образуется примерно 2 % метгемоглобина, поскольку редуктазы эритроцитов взрослого человека обладают способностью превращать образовавшийся метгемоглобин обратно в гемоглобин.
В Европейском Союзе допустимая суточная доза нитритов принята в 0.1 мг/кг массы (в пересчете на нитрит натрия)[1].
Продажа нитритов для пищевых применений разрешена в Евросоюзе только в смеси с пищевой солью, с содержанием нитритов около 0,6 %, для уменьшения риска превышения суточных норм.[1] C 2013 года сходные правила действуют в России.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
- Каплин В. Г. Основы экотоксикологии — М.; Издательство КолосС, 2006. — 232 с.
- Батраков В. Г. Модифицированные бетоны. Теория и практика. - 2-е изд., перераб. и доп. - М.: 1998 - 768 с.
Что нужно знать о нитратах и нитритах
22.06.2017
Проблема накопления нитратов и нитритов в продуктах питания (овощах, плодах, питьевой воде и пр.) остается достаточно острой в наши дни. Недостаточная информированность приводит к ее ошибочному пониманию, недооценке или же, наоборот, драматизации ситуации. Что же такое нитриты и нитраты? И в чем их опасность для нашего организма?
Нитратами являются соли азотной кислоты (НNO3), а нитритами – соли азотистой (HNO2). В природной среде нитраты образуются в процессе распада азотсодержащих органических веществ. Также они попадают в почву вместе с минеральными азотными удобрениями (селитрами). В клетках растений поступившие из почвы нитраты превращаются сначала в нитриты, затем в аминокислоты, а впоследствии – в белки. Процесс этот у растений происходит непрерывно, поэтому определенная часть нитратов постоянно присутствует в клеточном соке.
Попадая в желудок, нитраты могут преобразовываться в нитриты, которые в небольших дозах обладают сосудорасширяющим и спазмолитическим действием, что способствует снижению давления крови. Если же употребление нитратосодержащих продуктов происходит длительное время и в значительных количествах, то может произойти нарушение углеводного и белкового обмена веществ. При этом в крови увеличивается количество метгемоглобина, который в отличие от гемоглобина не способен насыщать кровь кислородом и передавать его клеткам и органам. Установлено также, что в определенных условиях нитраты могут превращаться в нитрозамины – канцерогенные вещества, провоцирующие образование злокачественных опухолей.

Накопление в растениях нитратов связано со многими факторами, среди которых недостаточное освещение, резкие температурные изменения во время вегетации растений, засуха или избыточная влажность, дефицит или излишнее количество питательных элементов, неправильное их соотношение, кислотность почвы и многое другое. Немаловажную роль в этом играют также биологические особенности различных видов растений. Так, среди культур, склонных к значительной аккумуляции нитратов, можно выделить салат, укроп, шпинат, редьку, редис, кольраби, свеклу столовую. Гораздо меньшее количество их способны накапливать морковь, петрушка, сельдерей, капуста, тепличные огурцы. А такие культуры как картофель, томаты, перец, горох, лук, огурцы, выращенные в открытом грунте, отличаются незначительным содержанием нитратов. Большое значение имеют также условия выращивания: у тепличных растений концентрация нитратов обычно выше в 1,5 – 2 раза, чем у тех же культур, выросших в открытом грунте. Относительно мало нитратов в ягодах и фруктах, в этом отношении они наиболее безопасны для нашего организма.

Очень важно знать, что преобразованию нитратов в нежелательные соединения значительно препятствует аскорбиновая кислота (витамин С), основным источником которого являются овощи, в особенности зеленные листовые культуры. Как правило, они накапливают немало нитратов, но вместе с ними мы употребляем и спасительный витамин С. Содержание его в листьях петрушки достигает 290 мг/100 г, для укропа этот показатель несколько ниже – 180 мг/100 г, у цветной капусты – 105 мг/100 г, а в листьях шпината – 72 мг/100 г.

Распределение нитратов в различных частях растений также происходит неравномерно и зависит от их биологического строения и особенностей. Например, у листовых овощей максимальная концентрация наблюдается в черешках и прожилках листьев; во внешних листках капусты и кочанных форм салата количество нитратов в 2 – 2,5 раза выше, чем во внутренних; в кожуре картофеля, огурцов, патиссонов – больше, чем в мякоти, а у корнеплодов (свеклы столовой, редиса, редьки) они накапливаются максимально в нижней части (самом корне) и верхушке (у листьев). Эти особенности помогут правильно выбрать съедобную часть у овощей, обезопасив себя от употребления наиболее заполненных нитратами кожуры, корней или наружных листьев.
На основании многолетних исследований во многих странах мира, Всемирная организация охраны здоровья (ВОЗ) установила допустимую суточную норму потребления нитратов, которая составляет 3,6 мг из расчета на 1 кг массы тела человека. Исходя из этого создана таблица допустимого содержания нитратов в овощах и фруктах.

Среди множества факторов, влияющих на накопление нитратов в растениях, ведущая роль принадлежит экологическим условиям, в частности световому режиму, агротехнике выращивания и биологическим особенностям сортов. Для образования собственных белков растениям необходим азот, источниками которого в почве являются аммиак и нитраты. Поступающий в растения посредством корневой системы аммиак тут же присоединяется к органическим кислотам и образует аминокислоты. Нитратам же для этого необходимо предварительно преобразоваться в аммиак. Чтобы осуществилась такая реакция, необходима энергия, источником которой и является солнце. Именно поэтому культуры южных широт отличаются более низким содержанием нитратов по сравнению с растениями, обитающими в северных регионах.

Выращивание овощей в плохо освещаемых теплицах, на затененных участках в открытом грунте, чрезмерное загущение посадок, засорение грядок сорняками, длительное отсутствие солнечной погоды – все эти обстоятельства способствуют излишнему накоплению нитратов в культурах. Это происходит по причине снижения интенсивности фотосинтеза, способствующего образованию углеводов. Именно углеводы в дальнейшем преобразуют нитраты, поступающие в растения из почвы, в более сложные органические соединения.
Содержание нитратов зависит и от типа грунта, на котором выращивают овощные культуры: у растений, выросших на супесях, этот показатель на 20 – 25 % ниже, чем у выращиваемых на богатых органикой почвах, особенно на пойменных торфяно-болотных. Влияют на содержание нитратов и такие экологические факторы как резкие перепады температуры, неравномерные поливы, способствующие нарушению процесса обмена веществ в растениях.
Среди агротехнических причин наиболее влиятельным является азотное питание растений и соотношение основных элементов минерального питания (азота, фосфора и калия). Содержание нитратов в растениях напрямую зависит от количества азотных удобрений в почве: чем выше дозы азота, тем больше количество нитратов (при соблюдении оптимальных условий роста и развития). Если же нарушаются световой, температурный, влажностный режимы, то даже незначительное количество азотных удобрений способно вызвать излишек нитратов в растениях.
Во избежание накопления нитратов в растительной продукции, загрязнения почвы, расположенных вблизи водоемов и грунтовых вод нитратами и нитритами, атмосферы – окислами азота, необходимо строго придерживаться оптимальных норм внесения азотсодержащих удобрений. Для аммиачной селитры достаточным будет ее применение в количестве 120 – 170 г/10 м2. Формы удобрений также оказывают большое влияние на степень перенасыщения и загрязнения нитратами, поэтому предпочтительнее пользоваться аммонийными (сульфат аммония, хлористый аммоний) и амидными (мочевина). Норма внесения для первых составляет 220 – 300 г/10 м2, а для вторых соответственно 100 – 140 г/10 м2. Обязательным условием является также сочетание азотных удобрений с фосфорными и калийными в соотношении 1:1 – 1,2:1,5, поскольку их недостаток (в особенности калия) провоцирует увеличение количества нитратов. Нельзя игнорировать также обеспечение растений необходимыми микроэлементами.
Накопление нитратов в растениях зависит также от их вида, рода, сортовых и генетических особенностей. Есть культуры, которые способны аккумулировать нитраты даже в случае их незначительного количества в окружающей среде. К ним относятся представители семейства Тыквенных (огурцы, кабачки, патиссоны, тыква, дыня, арбуз, люфа), Капустных (редис, редька, хрен, капуста) и Маревых (лебеда, шпинат, свекла). Сортовые отличия даже в пределах одной и той же культуры могут вызывать от двух- до пятикратного расхождения в количестве содержащихся нитратов.
Одним из способов уменьшения поступления нитратов в культуры и окружающую среду является применение локального (ленточного) внесения минеральных, в первую очередь азотных, удобрений. При этом расход их уменьшается в два раза, а урожайность остается на прежнем уровне. Применяют подобный метод и в садах, размещая смесь из перегноя (3 – 5 кг), суперфосфата (1 кг) и калийной соли (1 кг) в небольшие скважины (глубина – до 50 см, диаметр – до 20 см), образованные на периферии приствольного круга и равноудаленные друг от друга на 0,7 – 1,0 м. Такой способ очень эффективен на каменистых участках и в садах, расположенных на склонах.
Не рекомендуется вносить азотные удобрения в мерзло-талые почвы, на сильнокислых грунтах (рН < 4) и на участках, богатых минеральным азотом. Для картофеля и овощей нельзя использовать аммиачную воду или безводный аммиак. Также существенно увеличивает накопление нитратов в картофеле значительное количество извести, находящееся в почве.
Не менее важно соблюдать нормы и при внесении органических компонентов. Например, внесение весной под картофель бесподстилочного свежего гноя в пределах 30 – 90 кг/10 м2 приводит к значительно большему накоплению нитратов, чем в случае применения только минеральных удобрений. Поэтому необходимо вносить органические удобрения осенью, под зяблевую вспашку или под предыдущую культуру.
Очень популярные нынче "органические" овощи, выращенные на почвах, удобренных органикой, далеко не так безопасны, нежели те, которые росли с применением готовых синтезированных удобрений. Тот же навоз или перегной потребляются корневой системой растений только в виде водных растворов, содержащих те же нитраты и нитриты, образовавшиеся в процессе минерализации навоза (перегноя). И безопасность овощей для человеческого организма напрямую зависит лишь от концентрации нитрата (нитрита) в этих водных растворах. На практике рассчитать безопасную дозу готовых азотных удобрений гораздо доступней и результативней, чем для навоза (перегноя). Во втором случае слишком много непредсказуемых факторов оказывают влияние на сам процесс минерализации органического удобрения, и слишком велики риски передозировки растений опасными соединениями во время их питания. Поэтому мнение о пользе "органической продукции" и ее безопасности по причине отсутствия в плодах нитратов - всего лишь необоснованный миф, созданный для повышения спроса и прибыли.
Азотные подкормки на приусадебных участках желательно проводить в теплую солнечную погоду, во второй половине дня. В то же время большая жара приводит к быстрому испарению влаги и увеличению концентрации удобрений, поэтому внекорневая подкормка может вызвать ожоги вегетативных частей растений.
При выращивании тепличных овощей, необходимо помнить, что последнюю подкормку азотными удобрениями следует провести не позже чем за неделю до сбора урожая: чем более продолжителен этот период, тем меньше нитратов останется в продукции. Также нельзя допускать в теплицах резких колебаний температур, влажности и загущения посадок и посевов. Сбор тепличной продукции рекомендуется проводить в сухую солнечную погоду, ближе к вечеру, - именно в это время нитратное содержание в овощах наименьшее. Последнюю подкормку бахчевых культур следует провести до наступления фазы цветения у женских цветов.
Еще один из способов регулирования содержания нитратов в овощах – соблюдение оптимальных сроков выращивания и их собирания. Известно, что молодые растения характеризуются значительно большим накоплением нитратов, чем созревшие. Объясняется это периодом интенсивного роста и более активными обменными процессами, требующими присутствия нитратов для формирования новых органов, образования плодов и семян. Культуры с коротким вегетационным периодом также отличаются большим количеством нитратов по сравнению с растениями длительного вегетационного периода.
Способствует увеличению количества содержащегося нитрата и повреждение растений вредными насекомыми или поражение их заболеваниями, поэтому надо избегать подобных негативных факторов. Но применение на грядках или в теплицах ядохимикатов очень нежелательно. Существует множество способов упредить развитие заболеваний и оградить культуры от вредителей с помощью безопасных методов, основанных на народных рецептах. Применение природных средств для защиты растений, а также соблюдение вышеперечисленных мер и некоторых других факторов позволит получать на садово-огородных участках собственную качественную продукцию с низким содержанием нитратов.
нитриты - это... Что такое нитриты?
НИТРИ́ТЫ, соли неустойчивой азотистой кислоты НNO2. Наиболее широко известны нитриты натрия NaNO2 и калия KNO2. Эти стабильные при хранении и нагревании нитриты можно получить сильным нагреванием соответствующих нитратов (см. НИТРАТЫ). Все нитриты хорошо растворимы в воде. Обладают как восстановительным, так и окислительным действием. При окислении азот (см. АЗОТ), присутствующий в нитритах в степени окисления +3, окисляется до степени окисления +5 (до нитрат-иона), в кислой среде азот восстанавливается до степени окисления +2 (до монооксида азота NO). Например, нитрит натрия используют в промышленности при выделении элементарного иода из разбавленных водных растворов иодидов:2NaNO2 + 2NaI + 2H2SO4 = I2 + 2NО + 2Na2SO4 + 2H2O
Физиологическое действие
Нитриты, например, NaNO2 и KNO2, токсичны, вызывают головную боль, рвоту, угнетают дыхание. При отравлении NaNO2 в крови образуется метгемоглобин, повреждаются мембраны эритроцитов. Возможно образование нитрозаминов из NaNO2и аминов (см. АМИНЫ) непосредственно в желудочно-кишечном тракте.
Нитриты органические высокотоксичные соединения. Этил- и пентилнитриты учащают пульс, понижают кровяное давление, окисляют гемоглобин в метгемоглобин (см. МЕТГЕМОГЛОБИН), обладают сосудорасширяющим действием. Изопентилнитрит — противоядие при отравлении синильной кислотой (см. СИНИЛЬНАЯ КИСЛОТА) и ее солями.
Применение
Нитриты используют при синтезе азокрасителей, при получении капролактама, как окислители или восстановители в промышленности. Иногда нитриты применяют как пищевые консерванты.
Нитриты натрия и калия входят в состав нитрат-нитритной смеси, которая в расплавленном состоянии служит хорошим негорючим теплоносителем (температура 200—450°C). NaNO2 в очень небольших количествах ранее добавляли в некоторые колбасные изделия для придания им «естественного» красного цвета.
Нитриты и нитраты - что это
Мы часто слышим про нитратные арбузы, клубнику и вообще овощи. А что такое нитриты и нитраты? Откуда они берутся и для чего нужны? Чем опасны для человека, как попадают к нам в организм и как этого избежать – на все эти сложные и важные вопросы мы попытались ответить в этой статье. Читайте, запоминайте и рассказывайте знакомым.

Что такое нитриты и нитраты
В Большой Советской Энциклопедии (БЭС) читаем: «Нитриты – соли и эфиры азотистой кислоты HNO2». Нитриты используются в резинотехнической, текстильной, металлообрабатывающей промышленностях. Нитрит натрия (мы писали про него здесь) – популярный консервант в мясных продуктах.
А что такое нитраты? Это «соли и эфиры азотной кислоты HNO3». Казалось бы, разница небольшая, но все же это два разных химических соединения – одно переходит в другое в результате химических реакций в рамках азотного цикла в биосфере. Как именно это происходит, для нас не так уж важно.
Откуда берутся нитриты и нитраты и для чего они нужны?
Азот – это хорошо и важно, даже жизненно необходимо. Азотистые соединения – это строительный материал аминокислот, из которых состоят белки, из которых, в свою очередь, состоит значительная часть нашего организма. Азот и фосфор – основные минеральные вещества, которыми питаются растения, недаром именно про азотистые и фосфорные удобрения мы слышим больше всего. Без азота не было бы жизни на земле, какой мы ее знаем.
С другой стороны, азотный цикл в биосфере – это четко отлаженная устоявшаяся система, имеющая свои постоянные величины и «дозировки» азота в разных соединениях в разных местах. Внося гигантские количества азотных удобрений на поля в рамках модели традиционного сельского хозяйства, человек добивается рекордных урожаев из красивых, ровных и крупных плодов, но вместе с тем нарушает отлаженный природой механизм азотного цикла, вредя природе и самому себе.
Внесение большого количества азота ведет к вымыванию его с полей в озера, реки, оттуда в моря и океаны. Это ведет к процессу эвтрофикации, т.к. фосфор и азот – основные питательные вещества фитопланктона, т.е. мельчайших растений, которыми, в свою очередь, питается зоопланктон.
Вся эта масса накапливается на поверхности водоема, начинается бурное цветение водорослей, солнечный свет больше не попадает на дно водоема, придонные растения больше не могут фотосинтезировать, кислорода в воде не хватает, как следствие – погибает рыба и животные. Водоем вымирает, вокруг мрак и тлен.
Но вернемся к нитритам и нитратам…

Как нитраты попадают в человеческий организм?
Во-первых, через продукты питания, причем через растительную пищу в гораздо большей мере, чем через животную. Овощи, растущие в земле, получают больше дозы нитратных и аммонийных удобрений, чем корова, пасущаяся на лугу.
Со скотом, конечно, отдельный вопрос, потому что они получают массу всего другого в зависимости от того, чем их кормят и колют, но это отдельная тема. Так вот, все, что растет в земле, которую удобряют химическими азотистыми удобрениями, получает массу нитратов. Человек, съедая овощ, фрукт или зелень, выращенные в традиционном сельском хозяйстве, почти со 100% вероятностью получает дозу нитратов.
Во-вторых, нитриты и нитраты попадают в организм человека с питьевой водой – этим вечным источником веществ, про который многие забывают. Все, что в рамках с/х выливается на поля, попадает со стоком не только в реки и моря, но часто и в подземные воды.
Структура подземных вод сложна и отличается в зависимости от рельефа местности, глубины залегания и типа почв – в некоторых случаях подземные воды хорошо изолированы глинистыми слоями почвы, и никакие вещества с поверхности в них не проникают.
Как правило, это артезианская вода – она одна из самых чистых. В других случаях, однако, в подземные воды попадают те самые азотистые удобрения, причем не только с полей, но и непосредственно с производящих такие удобрения предприятий, если у последних стоят плохие системы очистки водных сбросов и атмосферных выбросов. Результат – повышенный уровень нитратов и нитритов в воде в близлежащей местности.
Тут мы опять скажем спасибо Мосводоканалу за его сайт и возможность узнать на нем уровень нитритов и нитратов в той воде, что течет из-под крана в вашем районе Москвы. Например, в районе Проспект Вернадского, где живет автор этих строк, с водой все хорошо: уровень нитритов у нас менее 0,5 мг/дл3 (при норме не более 3), а уровень нитратов – 3,3 мг/дл3 (при норме не более 45).
Источниками попадания нитратов и нитритов в человеческий организм может стать и табак, и лекарства, и животная пища – например, в мясных и колбасных изделиях нитрит натрия используется в качестве консерванта.
Наш главный редактор Татьяна Лебедева как раз недавно писала о том, какие сосиски не содержат нитрита натрия, а вот здесь мы писали про органическое мясо (пока только говядину), которое тоже не содержит этих веществ по умолчанию. Почитайте на досуге, если едите мясо.

Чем опасны нитриты и нитраты
«При неправильном использовании нитратов в качестве удобрений они накапливаются в сельскохозяйственных продуктах в чрезмерных количествах, что может привести к отравлению людей и животных», – написано в БЭС.
В человеческом организме конкретно нитраты не задерживаются – под действием ферментов они преобразуются в нитриты и образуют нитрозил-ионы. Основная опасность заключается в том, что нитрозил-ионы воздействуют на гемоглобин, ответственный за перенос кислорода в крови по всему организму.
Гемоглобин превращается в метгемоглобин, а превышение в крови концентрации метгемоглобина даже в 1% ведет к метгемоглобинемии – явлении, при котором кровь плохо или вообще не переносит кислород от легких к тканям организма. Чем грозит подобная дисфункция крови, думаю, объяснять не требуется.
Нитриты особенно опасны для грудных детей, у которых выработка ферментов еще не устоялась, организм в целом слабый, репродукция гемоглобина идет медленно, что дает большую уязвимость. Поэтому предельно допустимая суточная доза нитратов, установленная в РФ для взрослых – 0,2 мг/кг массы тела – для детей не применима. Кстати, в ЕС эта цифра вдвое меньше – 0,1 мг/кг массы тела.

Как избегать нитритов и нитратов
Как избегать овощей и фруктов? Никак. Но полезно знать, что нитраты в основном скапливаются в корнях, корнеплодах, стеблях, черешках и крупных жилках листьев, значительно меньше их в плодах – это хорошие новости, ведь именно плоды нас и интересуют (правда, корнеплоды составляют значительную часть нашего рациона, но тут уж ничего не поделаешь).
Нитратов также больше в зеленых плодах, чем в спелых – и это тоже хорошо. Из разных сельско-хозяйственных растений больше всего нитратов содержится в салате (особенно в тепличном), в редьке, петрушке, редисе, столовой свёкле, капусте, моркови и укропе.
Так что эти продукты по возможности надо покупать у тех поставщиков, в которых вы уверены, растить их самим на даче с использованием только натуральных (в идеале – самодельных) удобрений из трав, навоза, компоста или покупать в органическом качестве.
Некоторое время назад мы делали подборку мест, где можно купить органические овощи. Продукция российских фермеров – как сертифицированных, так и просто заявляющих, что они не используют химические удобрения, – а также импортные сушеные овощи, оливки, грибы, консервы и приправы продаются в магазинах Биостория, Био-Маркет, ФРЭШ, Lavka.Lavka, Сырой обед, И-МНЕ, Серегина.ру, Экотопия и прочих.
Также не забывайте про важность сезонности продуктов (арбузы в мае и клубника в декабре – не лучшее решение). Про сезонность мы довольно подробно писали здесь.
Не курите, не ешьте мясные продукты с нитритом натрия. Следите за водой. Если вы выяснили, что в вашем районе вода не отличается чистотой, озаботьтесь вопросом фильтра. Если у вас есть дачный участок и вы не в курсе качества воды там, скиньтесь всем кооперативом и закажите лабораторные анализы воды из вашего колодца, скважины, пруда или откуда вы там получаете свою воду. Будьте активны и неравнодушны – здоровье любит, чтобы о нем думали и заботились, тогда оно не будет о себе напоминать.
Определение нитратов и нитритов в воде
Водопроводная вода, так же как и вода из скважин и родников, содержит в себе различные вредные примеси, которые оказывают негативное влияние на здоровье человека. Своим клиентам мы предалагем системы очистки воды в загородный дом. Бытовые приборы, сантехника, производственное оборудование, трубопроводы также страдают от негативного воздействия примесей, в частности под влиянием нитритов. Что такое нитриты в воде? Нитриты в воде - это соли и эфиры азотистой кислоты HNO2, которые являются промежуточными компонентами разложения азотсодержащих органических соединений.
Как образуются нитриты в воде
В природе все взаимосвязано. На сегодняшний день много факторов, которые способствуют высокому содержанию нитратов и нитритов в воде. Микроорганизмы способны перерабатывать нитриты, но если уровень загрязнения воды превышает «установленные природой нормы», бактерии не успевают их перерабатывать. Основной причиной загрязнения вод нитритами считается деятельность человека. К источникам нитритов в воде относятся:
- азотсодержащие удобрения, которые вносятся в почту в огромных количествах;
- стоки и выбросы производственных предприятий;
- канализационные источники;
- отходы животноводства;
- естественные источники (биологическое разложение).
Все эти факторы влияют на содержание нитритов в воде. Внесенные удобрения вымываются из почты, попадая в реки, озера, моря и подземные воды. В зависимости от рельефа местности, глубины залегания подземных вод и типа почвы, в водоемы попадет различное количество загрязнений. Например, на глиняной местности из-за структуры почвы загрязнение воды нитритами практически не происходит.
Загрязнение воды антропогенными факторами происходит при плохой очистке сточных вод и атмосферных выбросов производственными предприятиями. Так, например, атмосферные осадки дает около 23% нитратно-нитритной нагрузки. Нитриты часто используются для процессов аэрации, а также в качестве ингибиторов коррозии в процессах водоподготовки для технологических целей.
На повышенное содержание нитритов в воде большое влияние имеют сезонные колебания. Так их наибольшая концентрация обнаруживается весной, когда вместе с талой водой в почту и подземные воды попадают продукты разложения. Зимой же присутствует незначительное количество нитрит ионов в воде, появляющихся исключительно естественным путем.
Нормы нитритов для воды
Допустимая концентрация нитритов в поверхностных водах находится в пределах от тысячной до сотой доли миллиграмма в 1 куб. дм., в подземных водах этот показатель выше и составляет сотые и десятые доли миллиграмма на 1 куб. дм.
В России качество питьевой воды определяется стандартом СанПиН 2.1.4.1074-01. Питьевая вода. Нормы содержания нитритов как в природной, так и питьевой воде строго регламентированы. Содержание нитритов в питьевой воде не должно превышать 3 мг/л. В перерасчете на азот этот показатель равен 1 мг/дм3. ПДК для нитритов в воде - 0,08 мг/дм3 в виде иона NO2- или 0,02 мг/дм3 в пересчете на азот.
В соответствии с требованиями систем мониторинга состояния окружающей среды наблюдение за концентрацией нитритов ионов в питьевой воде является обязательным условием контроля загрязнения питьевой воды из природных водоемов.
Влияние нитритов в воде на организм человека
Нитриты относятся к опасным, токсичным веществам. В организм человека они попадают вместе с растительной пищей, мясом и, конечно, с питьевой водой. Доказано, что нитриты гораздо опаснее своих предшественников в химической цепочке - нитратов. Но в чем же опасность нитритов в воде для человека?
Острое токсичное влияние на организм они оказывают вследствие своей склонности к образованию метгемоглобина, содержание в крови которого свыше 20% приводит к развитию гипоксии.
Одновременно с гипоксией повышенное содержание в воде нитритов и нитратов в воде может привести к таким проблем, как:
- расширение сосудов;
- тахикардия;
- поражение желудочно-кишечного тракта, которое выражается тошнотой, рвотой, диареей;
- раздражения и аллергические реакции на коже;
- нарушение работы щитовидной железы;
- слабость, головная боль, депрессия, отдышка, раскоординация движений, шум в ушах и иные признаки угнетения ЦНС.
Наиболее опасны нитриты в воде для детей до 1 года, ведь в их организме еще не сформированы достаточные защитные функции.
Методика определения нитритов в воде
Существует несколько методов определения нитритов в воде. Концентрацию нитрит-ионов в природной воде определяют физико-химическим методом: визуально-колориметрическим, путем сравнения окраски раствора с контрольной шкалой образцов окраски. В лабораторных условиях определение нитритов в воде проводят с помощью реактива Грисса, добавлением к анализируемой воде смесь растворов сульфаниловой кислоты и a-нафтиламина. Эти два раствора являются инертными относительно друг друга, однако, нитрит-ионы являются катализатором их реакции, и в присутствии нитритов они образуют соединение красно-фиолетового цвета. Степень окраски прямо пропорциональна концентрации нитрит-иона. Чувствительность такого метода определения нитритов в воде находится на уровне 0,003 мг/л.
Как очистить воду от нитратов и нитритов
Прежде чем определиться с подходящим способом очистки воды от нитритов необходимо провести лабораторное исследование. Сдать воду на анализ нужно в кратчайшие сроки, ведь нитрит ионы в свободном состоянии довольно быстро переходят в другие не менее опасные соединения. Также можно вызвать на дом (офис или предприятие) сотрудника фирмы для забора пробы, чтобы определить содержание нитритов в воде.
Среди всего многообразия методик очистки воды от нитритов способны справиться два вида очистки:
- Удаление из воды нитритов с помощью ионообменных смол. При работе такого типа устройства происходит последовательный обмен ионами между водой и специальными смолами, которые связывают нитрит-ионы. Так вода сначала проходит через водород-катионный фильтр, заменяя катионы металлов в нитритах. На последующих этапах происходит доочистка воды от других примесей. Недостаток данного метода очистки воды от нитритов в том, что смолы очень быстро теряют свою способность очищать, поэтому качество получаемой воды спустя время становится минимальным.
- Очистка воды от нитритов с помощью обратного осмоса. Более подробно поговорим ниже.
Как очистить воду от нитритов на установках обратного осмоса
На сегодняшний день обратноосмотические системы считаются самыми эффективными устройствами очистки воды в широком спектре загрязнений, начиная с механических включений, песка, ила, ржавчины, заканчивая хлором, тяжелыми металлами, хлоридами и нитритами. Эффективность такого способа очистки воды от нитратов и нитритов составляет 98%. Системы основаны на способности молекул воды под действием сил обратного осмоса проникать через полупроницаемую мембрану, в то время как частицы других веществ задерживаются и выводятся в сток. Это обуславливает возможность длительного использования одной и той же мембраны без необходимости замены.
Обратноосмотические системы подходят как для бытового использования, при установке под раковину, так и для общедомового использования, и применения на промышленных и коммерческих предприятиях. В нашем инетренет-магазине представлены различные виды обратного осмоса.
Мы знаем, как вам помочь, если в вашей воде есть нитриты
Очистка воды от нитритов является залогом здоровья, поэтому важно правильно подобрать систему очистки. Хорошим вариантом будет сдать пробу воды в лабораторию и на основании полученных качественных и количественных результатов приобрести фильтр, для того чтобы убрать нитриты из воды. Однако лучшим решением будет, предоставив результаты анализов, обратиться в специализированную компанию, которая является разработчиком обратноосмотических систем очистки.
Мы знаем, что такое нитриты в питьевой воде, и поможем вам снизить их содержание. Наша компания является производителем систем фильтрации на основе обратного осмоса. Мы тщательно изучаем предоставляемые нам данные о качестве воды (в том числе общем загрязнении) и уровне ее потребления, подбираем подходящий метод, имеющий заданные характеристики, количество ступеней очистки, конструкцию.
У нас вы можете также приобрести уже готовую универсальную систему для дачи, многоквартирного дома или предприятия, которая поможет удалить нитриты и нитраты в воде из скважины, колодца или водопровода. Если вам нужна консультация и помощь в подборе устройства, вы можете связаться с нашими специалистами, готовыми оказать вам любую информационную поддержку, а также оформить заказ по телефону 8-499-391-39-59 или почте [email protected].
Мы ценим всех наших новых и имеющихся клиентов, поэтому наша задача помочь сделать правильный выбор комплексных систем водоподготовки и водоочистки с учетом всех пожеланий и имеющихся данных по потреблению и качеству воды.
Нитраты и нитриты в пищевых продуктах
Нитраты и нитриты — это химические неорганические соединения, соли и эфиры азотистой (HNO2) и азотной (HNO3) кислот. Они попадают в организм с пищей, водой, соками и молоком. Нитраты образуются и в нашем собственном организме, выполняя роль антимикробного агента в слюне, а также участвуя в работе сердечно-сосудистой системы, регулируя кровяное давление.
Чем опасны нитраты и нитриты
Под воздействием ферментов организма и некоторых бактерий, обитающих в кишечнике и полости рта, избыточные нитраты превращаются в гораздо более токсичные нитриты.
Нитриты, поступая в кровь, переводят гемоглобин в метгемоглобин, имеющий коричневый цвет и не способный переносить кислород и углекислый газ; нарушается тканевое дыхание. Некоторое количество метгемоглобина — около 2%, под воздействием ферментов способно восстанавливаться в гемоглобин.
Если количество метгемоглобина в крови достигает 30%, то начинается острое отравление, удушье, тошнота, рвота, диарея, тахикардия, боль в затылке, слабость, снижается давление. 50% метгемоглобина в крови может привести к смерти, если не оказать срочную помощь (принять активированный уголь, солевые слабительные, обеспечить приток свежего воздуха, обратиться в больницу для промывания желудка).
Кроме этого, нитриты в пищеварительной системе человека, в кислой среде, в присутствии аминов превращаются в нитрозамины — сильные канцерогены.
Регулярное употребление пищи и воды с повышенным содержанием нитратов может вызвать аллергические заболевания, заболевания щитовидной железы, болезни обмена веществ. Нитраты уменьшают содержание витаминов в растительных продуктах, отрицательно влияют на микрофлору кишечника, воздействуют на гормональную систему человека, вызывая выкидыши у женщин и импотенцию у мужчин.
Еще одна неприятная особенность нитратов — они могут накапливаться в организме.
Нормы содержания нитратов
Особенно опасны нитраты и нитриты, содержащиеся в воде. Исследования показали, что они оказывают более сильное токсическое воздействие, чем те, что поступают в организм с пищей.
Очень опасны нитриты для детей до года, так как ферменты, которые восстанавливают метгемоглобин обратно в гемоглобин, отсутствует у детей до трех месяцев. Поэтому Министерство здравоохранения РФ определяет разные допустимые суточные нормы потребления нитритов для взрослых и для детей. Для взрослых считается безопасным употребление 0,2 мг нитритов на 1 кг тела человека (в ЕС эта норма вдвое ниже). Для нитратов норма составляет 5 мг на килограмм веса взрослого человека. То есть человек массой около 60 кг может безопасно для себя съесть и выпить в день около 300 мг нитратов.
Норма для воды: концентрация нитратов не должна превышать 45 мг/л.
Существуют нормы содержания нитратов и для различных продуктов питания.
Как нитраты и нитриты попадают в пищу
Больше всего нитратов попадает в организм с растительной пищей — до 70%. Азот — основной строительный материал для любого растения, поэтому для нормального развития растений и получения хороших урожаев используются органические и неорганические азотосодержащие удобрения: аммиачная селитра, калиевая, натриевая селитра, сернокислый аммоний и др. Особенно активно растения накапливают нитраты в период роста и созревания, а к моменту сбора урожая их количество обычно уже не превышает нормы. Чтобы исключить возможность превышения норм нитратов в овощах и фруктах, инструкции запрещают вносить удобрения незадолго до сбора урожая.
Нитриты в пищу обычно попадают с мясными продуктами (колбасами, беконом, ветчиной, сосисками). Они используются при копчении, солении, мариновании в качестве консерванта, антибактериального и подсаливающего ингредиента. Термообработка и высокое содержание белка способствуют превращению нитритов в канцерогены-нитрозамины. Впрочем, нужно заметить, что современные мясные продукты содержат в разы меньшие количества нитритов, чем еще десять лет назад.
Советы, как минимизировать потребление нитратов и нитритов
— Старайтесь покупать овощи и фрукты в сезон; в созревших плодах нитраты, как правило, содержатся в допустимых количествах.
— Грунтовые овощи и зелень содержат меньше нитратов, чем тепличные.
— Из растений активно накапливают нитраты зелень (петрушка, укроп, салат, щавель), свекла, редис, капуста, морковь, дыни и арбузы. Мытье и чистка овощей сокращает количество нитратов на 10%. Варка — на 40-70%. Это связано с тем, что нитраты хорошо растворяются в воде и разрушаются при нагревании. Зелень можно на пару часов поставить в воде на солнце —большая часть нитратов переработается.
— Приобретите портативный нитрат-тестер или экотестер, например, Soeks NUC-019-1, и носите его с собой, когда отправляетесь на рынок или в супермаркет.
Современные нитрат-тестеры компактны, достаточно точны, просты, а экспресс-анализ занимает не более 20 секунд.
Нитраты и нитриты в продуктах питания: вредны ли они?
Что такое нитраты и нитриты?
Нитраты и нитриты – это два разных типа соединений.
Нитраты (NO₃) состоят из 1 атома азота и 3 атомов кислорода. Нитриты (NO₂) состоят из 1 атома азота и 2 атомов кислорода.
Нитраты относительно инертны – это означает, что они стабильны и вряд ли изменятся, и причинят вред.
Однако бактерии во рту или ферменты в организме могут превращать их в нитриты, и они могут быть вредными.
В свою очередь, нитриты могут превращаться в:
- оксид азота, который полезен для организма
- нитрозамины, которые могут быть вредными
Производители добавляют нитриты в мясо, чтобы сохранить его. Именно их добавление делает обработанное мясо розовым или красным. В мясе нитриты превращаются в оксид азота. Он реагирует с белками в мясе, изменяя его цвет и помогая сохранить его (1).
Без нитритов и других добавок мясо быстро станет коричневым.
Вывод:
Нитраты и нитриты представляют собой соединения, состоящие из атомов азота и кислорода. Нитраты могут превращаться в нитриты, которые затем могут образовывать либо оксид азота (полезно), либо нитрозамины (вредно).
Где содержатся нитраты и нитриты
Производители продуктов питания часто добавляют нитраты и нитриты к обработанному мясу, такому как бекон, ветчина, колбасы и полуфабрикаты.
Эти добавленные соединения помогают:
- предотвратить рост вредных бактерий
- придать соленый вкус
- улучшить внешний вид мяса, придав ему красный или розовый цвет
Высокий уровень потребления обработанного мяса может увеличить риск развития рака в желудочно-кишечном тракте. Некоторые люди считают, что нитраты и нитриты являются причиной повышенного риска (2, 3).
Однако нитраты и нитриты также естественным образом встречаются в овощах, что может снизить риск возникновения некоторых видов рака и других заболеваний (4, 5).
Фактически, согласно одному исследованию, люди получают около 80% нитратов из овощей (6).
Организм также производит нитраты и выделяет их в слюну (7, 8).
Нитраты и нитриты попадают из пищеварительной системы в кровь, затем в слюну и обратно в пищеварительную систему (9).
Они могут быть полезны для поддержания здоровья организма, так как они, кажется, действуют как противомикробные средства в пищеварительной системе. Они могут помочь убить бактерии, такие как сальмонелла. Они также могут превращаться в оксид азота (NO) – важную сигнальную молекулу (10, 11, 12).
Нитраты также встречаются в природе в воде. В некоторых районах использование удобрений может привести к высоким уровням нитратов, которые могут быть вредными для детей. По этой причине органы здравоохранения регулируют уровень нитратов в питьевой воде (13).
Вывод:
Нитраты присутствуют в небольших количествах в обработанном мясе и в больших количествах в здоровой пище, такой как овощи. Они также встречаются в питьевой воде, и организм человека также производит нитраты.
Как нитраты влияют на кровяное давление и здоровье сердца
При некоторых обстоятельствах нитрит теряет атом кислорода. Затем он превращается в оксид азота, важную молекулу.
Оксид азота (NO) выполняет различные функции в организме. Он может быть токсичным в больших количествах, но также может помочь защитить организм (14).
Самое главное, это сигнальная молекула. Она проходит через стенки артерий и посылает сигналы к крошечным мышечным клеткам вокруг артерий, приказывая им расслабиться (15).
Когда эти клетки расслабляются, кровеносные сосуды расширяются, и кровяное давление понижается.
Нитроглицерин – это препарат, который содержит нитраты. Врачи используют его для лечения сердечной недостаточности и других состояний (16).
Нитроглицерин может предотвратить или обратить вспять стенокардию – тип боли в груди, которая возникает, когда сердечная мышца не получает достаточно кислорода из-за плохого кровотока.
Содержащиеся в продуктах питания нитраты и нитриты также могут превращаться в оксид азота, расширять кровеносные сосуды и понижать кровяное давление (17).
Исследования показали, что продукты с высоким содержанием нитратов и нитритов, такие как свёкла или свекольный сок, могут снизить кровяное давление. В одном исследовании артериальное давление снизилось на 4–10 мм/рт в течение нескольких часов (18, 19, 20).
Высокое кровяное давление является ключевым фактором риска развития сердечно-сосудистых заболеваний и инсульта, которые могут быть опасными для жизни.
Вывод:
В организме нитриты могут превращаться в оксид азота (NO) – сигнальную молекулу, которая вызывает расширение кровеносных сосудов и снижение артериального давления.
Могут ли нитраты стимулировать физическую работоспособность?
Исследования показывают, что нитраты могут улучшить физическую работоспособность, особенно во время физических упражнений высокой интенсивности на выносливость.
Некоторые люди часто используют свёклу или свекольный сок для этой цели, потому что они содержат большое количество нитратов.
Причиной такого улучшения физической работоспособности могут быть нитраты, повышающие эффективность митохондрий. Митохондрии являются частями клеток, которые производят энергию (21).
Несколько исследований показали, что свёкла может снизить расход кислорода при выполнении физических упражнений на 5,4%, увеличить время до истощения при беге на 15% и улучшить производительность в спринте на 4% (22, 23, 24).
Вывод:
Исследования показывают, что присутствующие в продуктах нитраты и нитриты могут повысить физическую работоспособность, особенно во время высокоинтенсивных упражнений на выносливость.
Потенциальный вред нитратов и нитритов
Нитраты и нитриты являются важными соединениями, но они могут стать опасными, если они образуют нитрозамины. Нитрозамины могут образовываться, если вы готовите нитраты или нитриты на сильном огне (25).
Существуют различные типы нитрозаминов, и многие из них могут увеличить риск развития рака (26).
Например, нитрозамины являются одними из основных канцерогенов в табачном дыме.
Бекон, колбасные изделия и обработанное мясо могут содержать высокие уровни нитрита натрия. Они также богаты белком, который состоит из аминокислот. Под воздействием высокой температуры эта комбинация создает идеальные условия для образования нитрозаминов (27).
Приготовление овощей, однако, с меньшей вероятностью приведет к образованию нитрозаминов. Люди редко готовят овощи при очень высокой температуре, и они не содержат большого количества белка.
Вывод:
Если продукты содержат нитраты и аминокислоты, во время приготовления при высокой температуре могут образовываться канцерогенные соединения под названием нитрозамины.
Как минимизировать воздействие нитрозаминов
По закону производители должны ограничивать количество нитритов, которые они используют в обработанном мясе, из-за опасностей, которые представляют нитрозамины.
Они также должны добавлять витамин C, который препятствует образованию нитрозаминов (28).
Обработанное мясо, которое вы едите сегодня, содержит меньше нитритов, чем несколько десятилетий назад.
Вы можете снизить риск воздействия нитрозаминов, делая правильный выбор при покупке обработанного мяса, такого как колбасные изделия.
Некоторые торговые точки продают качественные колбасы и сосиски без нитратов. Списки ингредиентов должны показывать, что в них нет высоких уровней добавок, содержащих нитраты.
При покупке всегда проверяйте этикетки на наличие следующих добавок:
- нитрат натрия (E251)
- нитрит натрия (E250)
- нитрат калия (E252)
- нитрит калия (E249)
Некоторые природные и органические способы продления срока годности мяса, например, соль сельдерея, могут содержать нитраты. В результате некоторые колбасные изделия без нитратов могут содержать больше нитратов, чем обычно (29).
Чтобы быть уверенным в получении мясных изделий с низким содержанием нитратов, вы можете попробовать следующее:
- Покупайте домашние колбасы и бекон.
- Найдите поставщика бекона, сделанного из домашних свиней.
- Жарьте или готовьте бекон на медленном огне дольше и не пережаривайте его.
Одно более старое исследование предполагает, что приготовление бекона и колбасных изделий в микроволновой печи – лучший способ минимизировать образование нитрозамина (30).
Нитраты являются формой консерванта, и колбасные изделия и бекон с низким содержанием нитратов могут храниться не так долго. Вы можете увеличить их срок годности, заморозив.
как понизить, проверить, бороться и удерживать?
 Нитриты в аквариуме
Нитриты в аквариуме
Всем привет. Мы решили написать отдельную статью посвященную присутствию нитрита NO2 в аквариуме. Почему? Потому, что на нашем форуме постоянно возникают вопросы по этим азотистым соединениям и нужен базовый отсылочный материал для всех тех, что столкнулся с проблемой.
Мы не будет делать упор на базовых понятиях. В этом плане, если вам интересно, смотрите статью «Азотный цикл в аквариуме», форум «Аммиак, нитриты, нитраты в аквариуме». Здесь мы акцентируем внимание на способах, которые помогут быстро и эффективно завалить NO2 в ноли и удерживать их всегда на этом уровне.
Поехали. Прежде всего, отметим, что важно знать точные концентрации нитрита. Забудьте вы про всякие тесты полоски. Пользуйтесь капельными тестами. При этом отметим, что тест на NO2 не является повседневным тестом. Мы не видим смысла брать чрезмерно дорогие наборы. И еще всегда смотрите на «свежесть продукта» - срок годности. Любые тесты, а тем более с жидкими реагентами достаточно быстро выходят из строя.
С учетом сказанного, наша рекомендация будет вам в отношении тестов UHE, которые мы вот уже как более полгода обкатываем всем аквариумным сообществом ФФ. И пока форумчане весьма довольны, глобальных нареканий и багов нет.
Единственное НО, тесты UHE на данный момент продаются только через онлайн-магазин производителя. А это + расходы на доставку.

В этой связи, есть бюджетные тесты Vladox, которые можно найти оффлайн - в своем городе. Тесты рабочие, а главное недорогие.
Концентрация нитрита в любом аквариуме должна равняться
0 мг/л
Нитрит – это жутчайший яд, от его минимальных доз пухнет все живое в аквариуме. Если ваши рыбки бодро плавают в нитритном супе – это не значит, что им хорошо. У рыбок, как и у любого живого существа, есть такая фишечка – привыкание и адаптация к негативным условиям. Этот механизм работает за счет иммунной системы, которая в свою очередь нерезиновая. Как только иммунитет рушится, все кирдык и финита ля комедия.
Часто бывает так, что рыбки переносят нитритные невзгоды и живут дальше. Но вы всегда должны понимать, что все же иммунитет у них подубился. И желательно его восстановить – благоприятными условиями содержания (идеальные параметры воды + разнообразным рационом питания + витаминчики + отсутствием каких-либо стрессовых факторов).
И упаси вас Всевышний громовержец Посейдон от лечения рыбок при азотистом отравлении. Это просто бич-фэил всех новичков, которые, не видя всей картины, заливают к NO2 еще и лекарства. Лекарства – это не панацея, ни пилюлька. Они, как и любое другое вещество имеют побочные действия. И в данном случае, они просто добьют рыбу, а не вылечат.
Собственно именно поэтому на форумах, в темах о болячках спрашивают первым делом: «А какие у вас азотистые?». И спрашивают не для того, чтобы вы потратились на тесты. А потому, что в 90% случаях, именно азотистые являются причиной проникновения в ослабленный организм рыбы патогенной флоры. Лечение занитрифицированной рыбы – крайне затруднительно.
Та же самая обстановка обстоит с аммиаком и в растительном аквариуме. Так случилось, что в Рунете возник стереотип о том, что растения берут азот (N) только из нитрата (NO3). Однако, это не так. Они берут его из всего, в частности из Nh4/Nh5 и из NO2. Более того, буферная система растений настроена так, что им лучше и проще брать азот напрямую из аммиака, а не из нитрата. Усвоение нитрата для растений – это более энергозатратное мероприятие. Подробнее см. «Азотный цикл в травнике». Но при всем при этом давайте не забывать, что аммиак/аммоний – это самый страшный азотистый яд, это прямой путь к водорослевой вспышке... борода, вьетнамка, ксен… раз, два, три и травник похож на болото.
В общем, друзья! NO2 – ЭТО ПЛОХО!
Как понизить концентрацию нитрита в аквариуме?

Ниже способы выведения нитрита из аквариума, их можно применять вместе и по отдельности.
СПОСОБ 1: Ежедневная смена воды по 10%. Этот способ наиболее актуален при запуске аквариума, когда к 1-2 недели NO2 могут свирепствовать.
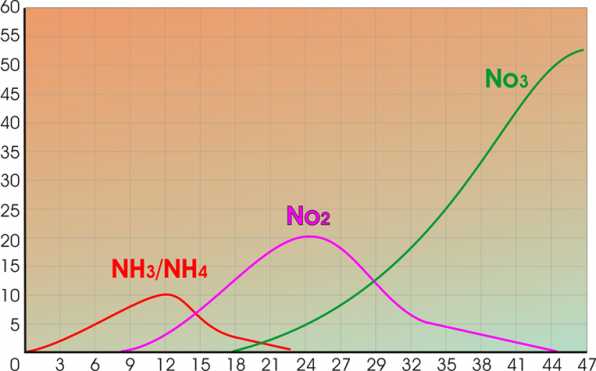 График становления азотного цикла в аквариуме после запуска
График становления азотного цикла в аквариуме после запуска
Если вы видите, что есть серьезные отклонения от графика. Действуйте указанным способом. Подменивая немного воды, вы снижаете концентрацию ядов, но в тоже время не сбиваете настройку азотного цикла в молодом аквариуме.
Обратим ваше внимание, что при аммиачной вспышке нельзя делать глубокие подмены воды (не слушаете всяких блаженных из Инета). Во-первых, вы можете сбить биологическое равновесие и азотный цикл. А во-вторых, крайне не рекомендуется резко выводить рыбок из занитрифицированного состояния. От этого они тоже могут уйти в страну вечного и вкусного мотыля.
СПОСОБ 2: Применение цеолита. Подробно о цеолите написано в нашей статье – здесь. Суть в двух словах, цеолит – ионообменник, который забирает на себя катионы Nh4+|Nh5+. Отметим, что цеолит действует плавно и в этом его достоинство, он мягонько так «всасывает аммиак», не нарушая дальнейшее течение дел в аквариуме.
Смысл применения цеолита при нитритной вспышке в том, что он не забирает ионы нитрита, но глушит аммиак/аммоний, которые являются первородными для NO2.


СПОСОБ 3: Применение препаратов – блокаторов нитритов. Например, Sera toxivec. Такие препараты именно блокируют, а не удаляют из воды азотистые, они просто переводят их в безопасную для гидробионтов форуму, грубо говоря, препарат дает шанс рыбам не отравиться до тех пор, пока аквариумист наладит биобаланс: подменами воды, усилением фильтрации, аэрации, рассадкой рыбы и т.д.
В тоже время азотный цикл на то и цикл, выпадение одного звена влечет за собой сбой во всей цепочке. Мы рекомендуем использовать подобные препараты аккуратно, ну и когда в аквариум просто полный треш по аммиаку и нитриту.
СПОСОБ 4: Снижение температуры и кислотности воды. Это даже не способ, а метода, но проговорить его стоит. Азотистые более "забористые" в теплой и щелочной воде. Поэтому, если вы снизите температуру с 27 до 22 градусов – это уже облегчит жизнь гидробионтам. Тоже самое и с pH, желательно, чтобы среда в аквариуме была с pH 7 и ниже.
СПОСОБ 5: Аквариумный уголь. Сам по себе уголь не забирает на себя нитрит. Но он адсорбирует «мертвую органику», которая является первоисточником возникновения Nh4/Nh5 и далее NO2.
СПОСОБ 6: Применение стартовых препаратов. Стереотипно эти препараты почему-то называют «аквариумной химией». Самое смешное, что 99% подобных препаратов – это чистая биология. Химия – это Sera toxivec. Стартовые же препараты – это концентраты полезных бактерий нитрификаторов, которые расщепляют азотистые и/или способствуют развитию этих полезных колоний бактерий.

К таким препаратам можно отнести, например, Tetra SafeStart, Tetra FilterActive, Tetra Bacrozym и т.д.
Проблему этих препаратов, по отношению к аммиачной вспышке, можно выразить фразой: «хороша ложка к обеду» или «поздно пить боржоми, когда почки отказали». Свое отношение к стартовым препаратам мы подробно изложили в статье «Быстрый запуск аквариума». Здесь скажем, только то, что если у вас уже случился полный абзац с NO2, то поздно применять "стартовые" препараты» на "финише". Их применение имеет место быть при запуске аквариума, тогда они действительно сглаживают азотистые вспышки. То есть они не действуют здесь и сейчас – прямо вот сразу.
Вот такие способы удаления аммиака и аммония из аквариума мы расписали для вас. Наиболее эффективная схема на наш взгляд – совокупность способа 1, 2 и 5. В этом случае, мы достаточно быстро и мягко уберем яды.
Помните, что важную роль в становлении и удержании азотного цикла играет качественная фильтрация и аэрация аквариума. А также хороший грунт (легкий, пористы, покаты) уложенный слоем в 5-7 см. Ведь именно в грунте протекает львиная доля всех процессов нитрификации.
Смотрите также:
Пропорция Редфилда
С.Спотт "Содержание рыб в замкнутых системах"
Параметры воды для травника
Хардскейп - наше аквариумное всё!
Грунт и питательная подложка для аквариумных растений
Освещение аквариума с растениями
Аквариумные удобрения
Акваскейп: через звезды в астрал
Коричневый налет в аквариуме – диатомовые водоросли
Правила оформления аквариума
Параметры воды для идеального травника
Подмена воды в травнике
Помпы для аквариума и все о них
Все о макро-удобрениях для аквариума
Как выбрать лучшее освещение для аквариума
Рекомендуем так же почитать:
Нитриты — Википедия. Что такое Нитриты
Объёмная модель иона NO2Нитриты — соли азотистой кислоты HNO2, например, нитрит натрия NaNO2, нитрит кальция Ca(NO2)2. Известны нитриты щелочных, щелочноземельных, 3d-металлов, а также нитриты свинца и серебра.
Физические свойства
Кристаллическими веществами являются только нитриты калия, серебра, кальция и бария. Нитриты калия, натрия и бария в воде хорошо растворимы, малорастворимы нитриты серебра, ртути (II), меди. С повышением температуры растворимость нитритов возрастает. В органических растворителях нитриты растворяются плохо.
Химические свойства
Нитриты являются термически малоустойчивыми соединениями. Так, без разложения могут плавиться только нитриты щелочных металлов, остальные же начинают разлагаться при 250—300 °C с выделением металла либо его оксида, азота, оксидов азота и кислорода.
Нитриты реагируют с солями меди, образуя комплексный гексонитритокупрат-анион, придающий раствору характерный зелёный цвет, что можно использовать в лаборатории как качественную реакцию.
- CuSO4+6NaNO2→Na2SO4+Na4[Cu(NO2)6]{\displaystyle {\mathsf {CuSO_{4}+6NaNO_{2}\rightarrow Na_{2}SO_{4}+Na_{4}[Cu(NO_{2})_{6}]}}}
Нитриты медленно разлагаются под действием кислот с выделением газа (продуктов разложения азотистой кислоты).
- 2NaNO2+h3SO4→Na2SO4+NO+NO2+h3O{\displaystyle {\mathsf {2NaNO_{2}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+NO+NO_{2}+H_{2}O}}}
В горячей воде те же вещества реагируют с образованием оксида азота (II) и азотной кислоты:
- 6NaNO2+3h3SO4→3Na2SO4+2HNO3+4NO+4h3O{\displaystyle {\mathsf {6NaNO_{2}+3H_{2}SO_{4}\rightarrow 3Na_{2}SO_{4}+2HNO_{3}+4NO+4H_{2}O}}}
Нитриты могут выступать как окислителями, так и восстановителями — в кислой среде они окисляются до нитратов, в щелочной способны восстанавливаться до оксида азота NO.
При взаимодействии нитритов со спиртами в кислой среде при пониженной температуре образуются органические нитриты:
- ROH+NaNO2→oth3SO4RO-N=O{\displaystyle {\mathsf {ROH+NaNO_{2}{\xrightarrow[{^{o}t}]{H_{2}SO_{4}}}RO{\text{-}}N{\text{=}}O}}}
Получение
В промышленности нитриты получают поглощением нитрозного газа (NO + NO2) растворами гидроксида или карбоната натрия с образованием раствора нитрита натрия, из которого кристаллизацией получают сухой продукт. Нитриты других металлов получают обменной реакцией с нитритом натрия либо восстановлением соответствующих нитратов.
Применение
Нитриты используются при получении азокрасителей, для получения капролактама, как окисляющие и восстанавливающие реагенты в резинотехнической, текстильной и металлообрабатывающей промышленности. Нитрит натрия используется как консервант.
Нитрит натрия также применяется при производстве бетонных смесей в качестве ускорителя твердения и противоморозной добавки.
Биологическая роль
Нитриты попадают в организм человека двумя путями: прямым содержанием или же нитратами, которые в пищеварительном тракте (в основном в полости рта[1], также желудке или кишечнике) человека превращаются в нитриты под действием фермента нитратредуктазы. Также нитриты используются в производстве обработанных мясных продуктов (колбасы, сосиски, ветчина и пр.)
Эпидемиологические исследования высокого уровня потребления нитратов из овощей выявили снижение риска рака желудка, в то время как другие исследования о потреблении нитратов/нитритов из обработанных мясных продуктов, в которых нитриты используются как консерванты, показывают повышение рисков. [2] Механические исследования показывают, что образование опасных нитросоединений (таких как нитрозамины) ускоряется в присутствии компонентов мяса и подавляется витаминов С и другими антиоксидантами и фитонутриентами из растительных продуктов [3].
Таким образом, нитриты ведут себя неодинаково в зависимости от того, из каких источников они поступают в организм. Нитриты, добавляемые в мясные продукты для их консервации, преобразуются в нитрозамины. [4] Нитриты, преобразовавшиеся из нитратов из овощей и фруктов, далее превращаются в оксид азота(II), которые способствует расширению кровеносных сосудов и нормализации кровяного давления. [5]
При нормальном физиологическом состоянии и поступлении нитритов в организм не более допустимой суточной дозы, утверждённой Министерством здравоохранения РФ в 0,2 мг/кг массы тела (за исключением детей грудного возраста), в организме человека образуется примерно 2 % метгемоглобина, поскольку редуктазы эритроцитов взрослого человека обладают способностью превращать образовавшийся метгемоглобин обратно в гемоглобин.
В Европейском Союзе допустимая суточная доза нитритов принята в 0.1 мг/кг массы (в пересчете на нитрит натрия)[1].
Продажа нитритов для пищевых применений разрешена в Евросоюзе только в смеси с пищевой солью, с содержанием нитритов около 0,6 %, для уменьшения риска превышения суточных норм.[1] C 2013 года сходные правила действуют в России.
См. также
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
- Каплин В. Г. Основы экотоксикологии — М.; Издательство КолосС, 2006. — 232 с.
- Батраков В. Г. Модифицированные бетоны. Теория и практика. - 2-е изд., перераб. и доп. - М.: 1998 - 768 с.
Нитрит натрия: какая доза опасна для здоровья?
Форумы во Всемирной сети пестрят сообщениями типа: «Купила колбасу. Посмотрела состав – добавлен нитрит натрия. Залезла в интернет – пишут, вредный консервант! Больше колбасу покупать не буду». Бедный нитрит натрия оброс слухами и мифами. Правда ли, что популярная пищевая добавка – это яд, или данное утверждение не более чем очередная «страшилка»? В этом вопросе Роскачеству помог разобраться руководитель лаборатории химии пищевых продуктов ФГБУН «ФИЦ питания и биотехнологии», доктор биологических наук Владимир Бессонов.
Что такое нитрит натрия и зачем он нужен?
Нитрит натрия – это соль азотистой кислоты. Он обладает антибактериальными и антиокислительными свойствами, поэтому применяется при производстве пищевой продукции как консервант и, побочно, как фиксатор окраски. На этикетках нитрит натрия обычно указывается как пищевая добавка Е250. Встретить ее можно в составе вареных, сырокопченых, солено-копченых и вяленых мясных продуктов (сосисок, колбас и др.), а также мясных консервов.
Пищевая добавка Е250 разрешена во всем мире:
- Как консервант – она защищает продукты от бактерий ботулизма.
- Как фиксатор окраски – помогает разным мясным и рыбным деликатесам выглядеть аппетитно, сохранять розовый цвет.
Ботулизм
Ботулизм – тяжелое инфекционное заболевание. Интоксикация, которая возникает после употребления пищи с ботулотоксинами, приводит к поражению нервной системы, параличу мышц и, нередко, к смерти. Возбудитель ботулизма – бактерия Clostridium botulinum.
Как распознать колбасу, в которой есть Е250?

Только по цвету. У колбас и сосисок, в составе которых нет нитрита натрия, цвет – серый, как у обычного вареного мяса. И срок годности у них небольшой.
Розовый цвет, характерный для мяса свежего, обеспечивает как раз Е250. Это вещество, добавленное в виде нитритно-посолочной смеси в колбасный фарш, соединяется с белками и фиксирует цвет, не дает ему окисляться. Причем чем больше белка, тем ярче, розовее, окраска готового продукта.
Справочно:
Что такое нитритная соль? Это нитрит натрия, смешанный с обычной поваренной солью. Такой микс – нитритно-посолочную смесь – производители используют, чтобы было проще и удобнее дозировать консервант.
Сколько нитрита натрия в колбасе и сосисках?
По нормативу на килограмм колбасы приходится 50 миллиграмм нитрита натрия. Это безопасный уровень. Он рассчитывается исходя из того, сколько в среднем за год мы съедаем сосисок и колбасы. Однако производители кладут гораздо меньше, обычно около 30 миллиграмм на килограмм – этого достаточно, чтобы добиться необходимого технологического эффекта, а организм при этом не пострадал.
Справочно:
Какая дозировка нитрита натрия безопасна, устанавливает Всемирная организация здравоохранения (ВОЗ). Когда появляются хоть малейшие сомнения относительно добавки, ВОЗ пересматривает норматив. На данный момент допустимая суточная доза потребления нитрита натрия – 0,6 миллиграмма на килограмм массы тела. Норматив установлен в 1995 году.
Важно! Нитрит натрия запрещен для использования в продуктах для детей до 3 лет.
Вызывает ли Е250 рак?
Эта пищевая добавка спасает от ботулизма. Но существует мнение, что из-за нитрита натрия в организме образуются нитрозамины, которые вызывают онкологические заболевания. Частично это правда. В слабокислой среде – в среде желудка – нитрозамины могут синтезироваться под воздействием нитрита натрия.
Однако для этого синтеза требуется множество условий. В желудке должны при этом присутствовать различные необходимые кислоты, органические соединения и т. д.
С точки зрения химии такое возможно. Но в реальности, при низком содержании нитритов в продукте – маловероятно. Даже если нитрит натрия вступит в реакцию в желудке с другими объектами, будет включен защитный механизм. Начнут действовать хелперы – биохимические организмы, которые вычистят онкоклетки из нашего организма. Та доза нитрита натрия, которую получает человек, съедая кусок колбасы, не причинит вреда организму.
Конечно, мы живем в атмосфере рисков для здоровья: дышим выхлопным газом, едим копченое и т. д. Если многократно и из разных источников поступают какие-то канцерогены, система защиты может обрушиться. Но все равно риск очень мал. Вопрос один – насколько правильно мы сами себя ведем по отношению к нашему организму и как его поддерживаем.
Сколько нужно съесть колбасы, чтобы нанести ущерб организму?
Без вреда для здоровья взрослый человек в день может съесть около килограмма колбасы, в составе которой есть Е250.
Расчет прост: на один килограмм массы тела допускается 0,6 миллиграмма нитрита натрия в сутки. Такое количество нитрита натрия гарантированно не нанесет ущерба человеку. Чтобы здоровье пошатнулось, за сутки надо употребить в 100 раз больше нитрита натрия, чем рекомендовано.
Приведем пример: чтобы нанести ущерб здоровью, человек, весящий 70 кг, должен съесть 120 килограмм колбасы за сутки! Безопасным для такого человека будет кило двести вареной колбасы (42 мг натрия).
Малыш 5–6 лет, который весит 20 килограмм, может съесть за сутки примерно 330 грамм колбасы. Небезопасным для малыша станет 33 килограмма колбасы.
Звучит комично, ведь ущерб здесь будет нанесен не столько нитритом натрия, сколько количеством еды. К счастью, такая «колбасная диета» возможна только в теории.
Нитрит натрия не может накапливаться в организме
Даже если вы будете питаться сосисками каждый день, нитрит натрия будет выводиться из организма снова и снова. Откладываться, как, например, холестерин, нитрит натрия не может, для него попросту нет места. В организме человека есть жировое «депо», но нитрит натрия не является жирорастворимым веществом. А для водорастворимых веществ у нас «депо» нет.
– Однако все хорошо в меру, – подытожил Владимир Бессонов.
– Каждый человек решает – покупать ли, есть или нет ему колбасу. Но надо помнить, что колбаса лишь один из видов продуктов с не самым сбалансированным составом, и питаться ей постоянно – значит нанести вред здоровью другими путями. На такой колбасной монодиете долго не протянет ни один человек.
Подробные результаты исследования сосисок «Молочные», проведенного Роскачеством, читайте ЗДЕСЬ.
Чем отличаются нитриты от нитратов
Нитриты и нитраты отличаются не только по названию, в своей формуле они имеют и разные элементы. Однако есть и то, что их «роднит». Область применения этих веществ достаточно широка. В организме человека они тоже присутствуют, причем, если их скапливается слишком много, человек получает сильное отравление, которое может привести даже к летальному исходу.Проще говоря, нитраты - это соли азотной кислоты. В своей формуле они содержат одноразрядный анион. Раньше нитрат именовали селитрой. Теперь так называют минералы, а также удобрения, применяемые в сельском хозяйстве.
Нитраты получаются при помощи азотной кислоты, которая воздействует на металлы, оксиды, соли и гидроксиды. Все нитраты можно развести в воде. В твердом состоянии они являются сильными окислителями, но их свойства пропадают, если в раствор добавить азотной кислоты.
Нитраты сохраняют свои свойства при обычной температуре, но при низкой температуре плавятся, причем до самого полного разложения. Процесс получения этих веществ очень сложный, поэтому будет интересен, пожалуй, только химикам.
Нитраты являются основой для взрывчатых веществ - это аммониты и иные вещества. Применяются они в основном и в качестве минеральных удобрений. Сейчас уже не существует секрета в том, что растения используют азот из соли для построения клеток своего организма. Растение создает хлорофилл, которым и живет. Но в организме людей, нитраты становятся нитритами, которые способны свести человека в могилу.
Нитриты тоже являются солями азотной кислоты, но с другой формулой в своем химическим составе. Известны нитриты натрия, нитриты кальция. Известны также нитриты свинца, серебра, щелочных, щелочноземельных, 3D-металлов.
Это кристаллические вещества, которые присущи также калию или барию. Одни вещества хорошо растворяются в воде, другие, такие как нитриты серебра, ртути или меди, плохо растворяются в ней. Примечательно, что в органических растворителях нитриты тоже практически не растворяются. Но если повысить температуру, растворимость нитритов улучшается.
Человечество использует нитриты при получении азотных красителей, для получения капролактама, а также как окисляющие и восстанавливающие реагенты в резинотехнической, текстильной и металлообрабатывающей промышленности. Например, нитрит натрия является хорошим консервантом, применяется при производстве бетонных смесей в качестве ускорителя твердения и противоморозной добавки.
Нитриты являются ядом для гемоглобина человека, поэтому их нужно ежедневно выводить из организма. Они попадают в человеческий организм или прямым путем или с какими-либо другими веществами. Если человеческий организм функционирует нормально, необходимое количество вещества остается, а ненужное – удаляется. А вот если человек болен, появляется проблема с отравлением нитритами.