С2Н5Он что это такое
С2Н5ОН: название вещества, получение, свойства этанола, виды, безопасность, применение и назначение
Многим из нас известно, что такое С2Н5ОН. Название вещества - этиловый спирт. Не одно десятилетие данное соединение успешно используется в самых разных сферах деятельности человека, и, пожалуй, каждому доводилось сталкиваться с ним. Поэтому ниже расскажем более подробно о свойствах вещества, его назначении и мерах безопасности.
Внешний вид С2Н5ОН
Название вещества, которое употребляется обывателями чаще других, - просто "спирт". Соединение интересно своими свойствами. Чтобы ответить на вопрос о том, что это - c2h5oh, нужно изучить его внешний вид и ряд особенностей.
Визуально вещество представляет собой бесцветный прозрачный раствор, который имеет резкий алкогольный запах и жгучий вкус.
Основные свойства
Соединение является летучим, очень легко воспламеняется, смешивается с водой во всех соотношениях. Температура кипения спирта составляет +78 градусов Цельсия, а замерзания - минус 117. Структурная формула соединения представлена на рисунке, а обозначается по-научному как С2Н5ОН.
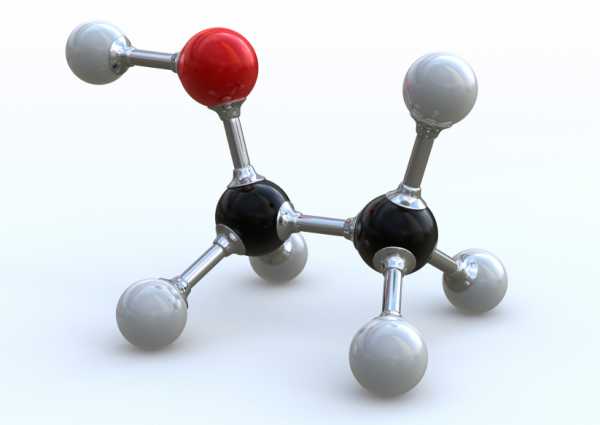
Названий вещества существует несколько. Его можно именовать как метилкарбинол, винный спирт, алкоголь и так далее. Глядя на формулу, становится понятно, что спирт состоит из двух атомов углерода, шести атомов водорода и одного - кислорода.
Получение
Несмотря на то что названий вещества С2Н5ОН существует множество, образуется оно всего лишь двумя путями:
- Синтетический, когда применяются химические реактивы.
- Натуральный, для чего используется природное сырье.
Синтетический путь более выгоден экономически. Реакция получения вещества С2Н5ОН проводится в две стадии:
- Сначала на этилен воздействуют сульфатной кислотой, в результате чего образуется сульфатноэтиловый эфир.
- Затем этот эфир взаимодействует с водой, и появляется этиловый спирт и кислота как побочный продукт.

Существует также способ получения спирта из природного сырья. Рассмотрим его более подробно. В качестве источника необходимо использовать сахаристые вещества, которые затем подвергаются брожению. Это может быть картофель, маис, рожь и тому подобное.
- Сырье отмывают, помещают в специальное устройство, в котором оказывается воздействие давлением в 2-3 атм. рт. ст. При этом крахмал, содержащийся, например, в картофеле, превращается в клейстер.
- Полученную массу энергетически размешивают и охлаждают до температуры 50 градусов.
- Затем добавляют солод, перемешивают. Получается так называемая "бражка". Содержание спирта в ней составляет примерно 18 %.
- Всю остальную массу представляют собой побочные продукты брожения: глицерол, этаналь (ацетатный альдегид), высшие спирты, эфиры и т. д.
- Бражку подвергают процессу ректификации (разделения смеси на компоненты за счет теплообмена между паром и жидкостью). Причем сначала образуется спирт с концентрацией 70 %. Постепенно эта цифра увеличивается до 96 %.
- Для закрепления результата раствор прогоняют через адсорбент. Например, активированный уголь.

Виды этанола
Чтобы узнать, какое вещество С2Н5ОН, следует разобрать его состав. В зависимости от характеристик этанол можно поделить на четыре основных вида:
- Сырец. Второе наименование вещества С2Н5ОН в этом случае - неочищенный спирт. Концентрация этанола варьируется от 92 до 95 градусов. Он считается очищенным от примесей и сивушных масел в недостаточной степени.
- Ректифицированный (95-96 °С). Данный вид практически не содержит в себе посторонних соединений.
- Абсолютный спирт. Название c2h5oh в этом случае - чистый этанол. Такое соединение практически безводно.
- И последний вид - спирт денатурированный. Это неочищенное вещество с добавлением азотистых оснований пиридина. Такое вещество подойдет для использования в технических целях.

Безопасность
Дело в том, что этиловый спирт - токсичное соединение. В высоких концентрациях оно оказывает сильное влияние на работу центральной нервной, сердечно-сосудистой и пищеварительной систем. Поэтому очень важно соблюдать правила безопасности при обращении с С2Н5ОН.
- Конечно, спирт очень токсичен в высоких концентрациях. Стоит учитывать такую закономерность: чем менее очищен спирт, тем он более вреден. Касается это как употребления внутрь, так и вдыхания паров.
- Этиловый спирт может быть опасен не только при приеме внутрь, но и при вдыхании его паров. При превышении допустимой предельной концентрации паров спирта в воздухе (1 000 мг/м3) возможен ожог и повреждение слизистой верхних дыхательных путей. Поэтому на производстве этанола сотрудники большую часть времени должны находиться в противогазе.
- В случае повреждения дыхательных путей человека нужно вывести на свежий воздух, при необходимости сделать искусственное дыхание. При отравлении спиртом в результате приема внутрь следует промыть желудок водой или раствором соды в концентрации 2 %.
- При воздействии на целостные кожные покровы спирт не оказывает токсичного воздействия. Однако поверхность тела может стать сухой, шелушащейся, с многочисленными трещинами.
- Этиловый спирт достаточно легко воспламеняется, поэтому категорически запрещено подносить его к источнику открытого огня.

- Всем известно, что этиловый спирт можно употреблять внутрь для расслабления. Однако стоит сказать, что злоупотреблять этим нельзя. Дело в том, что этанол очень быстро может вызвать стойкую зависимость у человека, а также изменение психики и сознания.
- Нужно следить за тем, чтобы тара с опасным веществом всегда хранилась вне зоны доступа маленьких детей.
Применение и назначение
Этиловый спирт имеет довольно широкую область применения, основное значение уделяется ему в медицине. Вещество c2h5oh с названием "этанол" может быть использовано:
- Как антисептик. Благодаря тому что спирт эффективно уничтожает все патогенные микроорганизмы, его широко используют в медицинской практике. Например, обрабатывают операционное поле перед хирургическим вмешательством или перед забором крови. Протирая участок кожи, медик добивается этим стерильности, чтобы снизить риск развития инфекции до минимума.
- Еще одно широкое медицинское применение спирта - в качестве растворителя. На основе спирта делается огромное количество настоек. Он сохраняет полезные свойства целебных трав.
- Также спирт известен своими согревающими свойствами, поэтому часто его используют для изготовления лечебных компрессов при травмах.
- Кроме того, этиловый спирт является лучшим противоядием при отравлении таким жизненно опасным веществом, как метилен.
- В косметических целях спирт и настойки на нем эффективно применяются для лечения акне, угревой сыпи. Однако стоит помнить, что этанол сильно сушит кожу, поэтому злоупотреблять процедурой не нужно.

И это далеко не все варианты возможного применения этанола.
Заключение
Этиловый спирт - универсальное средство, с которым приходилось сталкиваться любому человеку. Во многих ситуациях данное соединение значительно облегчает жизнь. Однако всегда стоит учитывать свойства вещества и меры безопасности при использовании этанола.
|
|
Этиловый, или винный, спирт может быть получен всеми общими способами получения спиртов. Наиболее старым техническим методом его получения является алкогольное, или спиртовое, брожение. Этот процесс основан на том, что один из простейших сахаров состава C6H12O6 — виноградный сахар, или глюкоза, получаемый в технике из крахмала, в присутствии особого рода микроорганизмов, называемых дрожжевым грибком (Saccharomyces cerevisiae), распадается на спирт и углекислоту по уравнению Спиртовому брожению может подвергаться не только виноградный сахар, но и другие сахаристые вещества состава C6H12O6 (гексозы). Виноградный сахар и другие гексозы, например плодовый сахар (фруктоза), часто находятся в природе уже в готовом виде в соке плодов различных растений (виноградный сахар в соке винограда), а также могут получаться из других природных веществ (например, из свекловичного или тростникового сахара) в процессе брожения. Так как зародыши дрожжевых грибков всегда находятся в воздухе (в пыли), то процесс брожения сладких жидкостей есть самое обычное явление, нередко наблюдаемое в повседневном быту. Поэтому приготовление алкогольных напитков известно с самой глубокой древности. В природе спиртовое брожение происходит так часто, что спирт, хотя и в ничтожных количествах, является постоянной составной частью почвенных вод, а пары его всегда в небольшом количестве содержатся в воздухе. Из растительного сырья, содержащего крахмал (например, из картофеля, хлебных злаков, риса и пр.), брожением получают пищевой этиловый спирт. Богатый крахмалом материал измельчают и заваривают перегретым водяным паром при температуре 140—150° С. При этом получается густая масса, содержащая крахмал в виде «клейстера». По охлаждении массы к ней прибавляют солод, представляющий собой измельченные проросшие зерна ячменя. В солоде имеется азотсодержащее вещество — диастаз, относящееся к классу сложных органических катализаторов, образующихся в живых организмах и называемых энзимами или ферментами. Диастаз способен вызывать превращение крахмала в мальтозу, т. е. в сахар состава C12H22O11. Это превращение, идущее с присоединением воды, быстрее всего совершается при температуре около 62° С. К осахаренному раствору прибавляют дрожжи и ведут брожение при 33 °С. Благодаря присутствию в дрожжах энзима, получившего название мальтазы, мальтоза превращается с присоединением воды в глюкозу, которая и подвергается процессу спиртового брожения. По окончании брожения содержащую спирт жидкость подвергают дробной перегонке (ректификации) в особых ректификационных аппаратах. Дробной перегонкой, однако, нельзя получить безводный (абсолютный) алкоголь, так как этиловый спирт, кипящий при 78,3° С, образует с водой азеотропную смесь, содержащую около 4,5% воды и кипящую при 78,15° С. Такой спирт, называемый 96-градусным, обычно готовят в технике. Чтобы получить абсолютный алкоголь, азеотропную смесь надо освободить от воды химическим способом, например настаиванием с негашеной известью или действием металлического кальция и пр. Можно также отделить воду, прибавляя к водному спирту немного бензола и подвергая эту смесь перегонке. Тогда сначала отгоняется постояннокипящая «тройная» смесь бензола, воды и спирта (при 64,85° С), затем «двойная» смесь спирта и бензола (68,25° С) и, наконец, чистый безводный спирт (78,3° С). Кроме винного спирта, при спиртовом брожении образуются также вещества, кипящие при более низкой температуре (уксусный альдегид) и кипящие при более высокой температуре, представляющие собой смесь высших гомологов спирта, называемую «сивушными маслами». Кроме того, всегда образуются небольшие количества глицерина и янтарной кислоты. Этиловый спирт представляет собой бесцветную жидкость, смешивающуюся с водой и обладающую жгучим вкусом; горит голубоватым, слабо светящим пламенем. Он имеет важное применение для технических целей. Так, спирт применяется для получения синтетического каучука (С. В. Лебедев), как исходный продукт в производстве ацетальдегида и уксусной кислоты, как растворитель для экстракции и кристаллизации, для приготовления лаков и политур, для синтеза органических красителей и фармацевтических препаратов (хлороформа, хлораля, иодоформа и пр.), для приготовления лекарственных экстрактов и настоек, для консервирования анатомических препаратов и пр., а также в виде различных спиртных напитков. Из готового перегнанного спирта приготовляют лишь часть спиртных напитков (водку крепостью 40—50 градусов, коньяк и др.). Другие спиртные напитки (виноградные и плодово-ягодные вина, пиво, квас, кумыс, сидр и пр.) представляют собой непосредственные продукты брожения жидкостей, содержащих сахаристые вещества. Чтобы сделать негодным для питья непищевой спирт, к нему прибавляют различные «денатурирующие» вещества. В связи со значительным ростом потребления этилового спирта в промышленности, в частности для производства синтетического каучука, техническое значение этилового спирта чрезвычайно возросло. Поэтому было разработано несколько промышленных методов его получения из непищевого сырья. Основным промышленным методом синтеза этанола является гидратация этилена, выделяемого из газов крекинга нефти или продуктов пиролиза низших парафиновых углеводородов (этана, пропана, бутана), а также легких нефтяных фракций. Большое распространение получил метод гидратации этилена водой под давлением в присутствии катализатора, чаще всего фосфорнокислого (так называемый метод прямой гидратации). Некоторое количество технического этилового спирта готовят сбраживанием смеси углеводов (главным образом, глюкозы), получаемой при гидролизе кислотами целлюлозы, содержащейся в древесных опилках и тому подобных отходах лесной промышленности. Этот так называемый «гидролизный» спирт содержит небольшие количества практически трудно отделимого метилового спирта, который образуется при расщеплении лигнина, содержащегося в древесине. В несколько меньших количествах спирт получают гидролизом неполностью разложившейся целлюлозы, содержащейся в сульфитных щелоках целлюлозно-бумажного производства. |

|
Этиловый спирт — Циклопедия
| Этиловый спирт | |
| Общие | |
|---|---|
| Систематическое наименование | Этанол |
| Традиционные названия | Этиловый спирт |
| Химическая формула | С2H5OH |
| Рац. формула | СH3СH2OH |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 46,069 г/моль |
| Плотность | 0,7893 г/см³ |
| Поверхностное натяжение | 22,39 · 10−3 Н/м при 20 °C Н/м |
| Термические свойства | |
| Т. плав. | −114,3 °C |
| Т. кип. | +78,4 °C |
| Т. всп. | 13 °C |
| Т. свспл. | +363 °C |
| Пр. взрв. | 3,28 — 18,95 % |
| Тройная точка | −114,3 °C, ? Па |
| Кр. точка | +241 °C, 63 бар |
| Мол. теплоёмк. | 112,4 Дж/(моль·К) |
| Энтальпия образования | −234,8 кДж/моль |
| Химические свойства | |
| pKa | 15,9 |
| Растворимость в воде | неограничена |
| Оптические свойства | |
| Показатель преломления | 1,3611 |
| Структура | |
| Дипольный момент | (газ) 1,69 Д |
| Классификация | |
| Рег. номер CAS | 64-17-5 |
| Рег. номер PubChem | 702 |
| SMILES | CCO |
| Безопасность | |
| ЛД50 | 10 300 мг/кг |
| Токсичность | метаболит, малотоксичен |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Этиловый спирт (этанол, метилкарбинол, винный спирт) — одноатомный алифатический спирт, бесцветная легкоподвижная жидкость с характерным запахом и жгучим вкусом. Относится к сильнодействующим наркотикам, вызывающим сначала возбуждение, а затем паралич нервной системы. Имеет формулу CH3CH2OH (упрощённо: С2Н5ОН)[1].
Этиловый спирт получают сбраживанием пищевого сырья. С 1930−1950-х гг. были разработаны способы получения синтетического спирта гидратацией этилена и гидрированием ацетальдегида. Гидратация этилена стала основным способом производства этилового спирта в 1970-е гг.[2]
Этиловый спирт прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, имеет наркотический эффект: вызывает опьянение, а при многократном употреблении вызывает алкоголизм. Также вредно воздействует на зародыш ребенка.
[править] Физические свойства
Этиловый спирт — горючая прозрачная жидкость. Температура плавления = - 114.15 °С, температура кипения = 78,39 °С, плотность 0,7893 г/см³. [2] Молярная масса = 46,069.[3]
[править] Химические свойства
Этанол смешивается во всех соотношениях с водой, спиртами, диэтиловым эфиром, глицерином, хлороформом, ацетальдегидом, бензином; образует азеотропные смеси с водой; бензолом; гексаном; толуолом; этилацетатом, а также тройные азеотропные смеси.
Этиловый спирт реагирует с щелочными металлами и с магнием с образованием этилатов и водорода.
Например при реакции с натрием Na образуется этилат натрия:
2C2H5OH + 2Na → 2C2H5ONa + Н2↑
Аналогично идёт реакция с калием K:
2C2H5OH + 2К → 2С2Н5ОК + Н2↑
Этанол вступает в реакцию гидрогалогенирования в присутствии хлорида цинка:
CH3CH2OH + HCl → CH3CH2Cl + H2O
При поджигании на воздухе этиловый спирт горит бледно-голубым, синеватым пламенем:
C2H5OH + 3O2 → 2CO2↑ + 3H2O
При нагревании в колбе с холодильником этанола с галогеноводородной кислотой, например с HBr (или смесью NаHBr и H2SO4, дающей при реакции бромистый водород), то будет отгоняться маслянистая жидкость — бромистый этил C2H5Вг:
C2H5OH + HBr → C2H5HBr + H2O
При нагревании с серной кислотой (при температуре меньше 120 °C), этиловый спирт превращается в диэтиловый эфир (реакция дегидратации):
2C2H5OH → C2H5-O-C2H5 + H2O
Вступает в реакцию дегидратации в присутствии серной кислоты при температуре больше 120 °C с образованием непредельного углеводорода:
CH3CH2OH → CH2CH2 + H2O
Этиловый спирт реагируя с карбоновыми кислотами в присутствии серной кислоты при нагревании приводит к реакции этерификации, например в реакции с уксусной кислотой образуется уксусно-этиловый эфир:
СН3СООН + С2Н5ОН → СН3СООC2H5 + H2O
Этанол получают в основном двумя способами: микробиологическим (спиртовое брожение) и синтетический (гидратация этилена):
Спиртовое брожение представляет собой биохимический процесс превращения сахара в спирт с выделением углекислого газа под воздействием дрожжей вида Saccharomyces cerevisiae и др., по формуле:
C6H12O6 → 2C2H5OH + 2CO2 + 27 ккал
Данный метод в основном применяется в пищевой промышленности, не только для производства этилового спирта, но и например при производстве хлебобулочных изделий, при этом дрожжи, выделяемый углекислый газ разрыхляет и поднимает тесто.
В химической промышленности, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
Первый вариант — прямая гидратация при температуре 300 °C, давлении 7 МПа, в качестве катализатора применяют ортофосфорную кислоту, нанесённую на силикагель, активированный уголь или асбест:
CH2=CH2 + H2O → C2H5OH
Второй вариант — гидратация через стадию промежуточного эфира серной кислоты, с последующим его гидролизом (при температуре 80—90 °С и давлении 3,5 МПа:
CH2=CH2 + H2SO4 → CH3-CH2-OSO2OH (этилсерная кислота)
CH3-CH2-OSO2OH + H2O → C2H5OH + H2SO4
Реакция осложняется образованием диэтилового эфира.
[править] Практическое значение
Этиловый спирт широко применяется в промышленности.
Этиловый спирт идёт на изготовление спиртных напитков.
Этанол является растворителем в лакокрасочной и фармацевтической промышленности, в производстве кинофотоматериалов, товаров радиоэлектроники и бытовой химии, взрывчатых веществ и пр.
Этот спирт служит сырьём для производств диэтилового эфира, хлороформа, тетраэтилсвинца, ацетальдегида, уксусной кислоты, этилацетата, этиламина, этилакрилатов, этилсиликатов и пр. Этиловый спирт — компонент антифриза, топливо для реактивных двигателей.
Для технических целей часто используют денатурированный спирт (денатурат) — спирт-сырец, содержащий добавки красителя, окрашивающего этиловый спирт в сине-фиолетовый цвет, и специфических веществ, придающих ему неприятный запах и вкус. Денатурат ядовит.
В медицине этиловый спирт применяется для дезинфекции, как поверхностное сосудорасширяющее средство, коагулянт белка, в том числе при лечении ожогов.
Мозг и алкоголь — Вячеслав Дубынин // ПостНаука [15:27]Этанол чрезвычайно гигроскопичен, при концентрации выше 70% (по объему) прижигает кожу и слизистые оболочки; при приёме внутрь угнетает центры торможения мозга, вызывает опьянение, при многократном употреблении вызывает алкоголизм.
ПДК в атмосфере воздухе 5 мг/м³, в воздухе рабочей зоны 1000 мг/м³.
Помимо признанного ВОЗ и ГОСТ наркотического действия, этиловый спирт обладает тератогенным действием (отрицательно воздействует на зародыш, см. в частности Зависимость числа дебилов от потребления алкоголя), его употребление многократно повышает риски преступности и психиатрических проблем, а также является одной из ведущих причин смертности в России (в частности, вследствие убийств, самоубийств и ведущих причин смертности — атеросклеротического кардиосклероза и нарушения мозгового кровообращения).
Бензиловый спирт — Википедия
Материал из Википедии — свободной энциклопедии
Бензиловый спирт (фенилкарбинол) — органическое соединение, простейший ароматический спирт, C6H5CH2OH.
Бесцветная жидкость со слабым приятным запахом; tкип 205,8 °C; плотность 1045,5 кг/м³ (1,0455 г/см³) при 20 °C. Бензиловый спирт хорошо растворим в органических растворителях и жидких SO2 и NH3, в 100 г воды растворяется 4 г бензилового спирта.
Взаимодействие с щелочными и щелочноземельными металлами:
- 2C6H5Ch3OH+2Na→2C6H5Ch3ONa+h3{\displaystyle {\mathsf {2C_{6}H_{5}CH_{2}OH+2Na\rightarrow 2C_{6}H_{5}CH_{2}ONa+H_{2}}}}
образуется бензилат натрия
Взаимодействие с треххлористым фосфором — образуется бензилхлорид
- 3C6H5Ch3OH+PCl3→3C6H5Ch3Cl+h4PO3{\displaystyle {\mathsf {3C_{6}H_{5}CH_{2}OH+PCl_{3}\rightarrow 3C_{6}H_{5}CH_{2}Cl+H_{3}PO_{3}}}}
Взаимодействие с уксусным ангидридом — образуется бензиловый эфир уксусной кислоты (бензилацетат):
- C6H5Ch3OH+(Ch4CO)2O→C6H5Ch3OCOCh4+Ch4COOH{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}OH+(CH_{3}CO)_{2}O\rightarrow C_{6}H_{5}CH_{2}OCOCH_{3}+CH_{3}COOH}}}
В свободном состоянии или в виде сложных эфиров бензойной, салициловой и уксусной кислот бензиловый спирт содержится в эфирных маслах, например жасминном, гвоздичном, перуанском бальзаме и др.
Получают бензиловый спирт омылением бензилхлорида в основном в присутствии щёлочи:
- C6H5Ch3Cl+h3O→C6H5Ch3OH+HCl{\displaystyle {\mathsf {C_{6}H_{5}CH_{2}Cl+H_{2}O\rightarrow C_{6}H_{5}CH_{2}OH+HCl}}}
а также действием щёлочи на смесь бензойного альдегида и формальдегида:
- C6H5CHO+HCHO+NaOH→C6H5Ch3OH+HCOONa{\displaystyle {\mathsf {C_{6}H_{5}CHO+HCHO+NaOH\rightarrow C_{6}H_{5}CH_{2}OH+HCOONa}}}
(см. Реакция Канниццаро).
Бензиловый спирт применяют в парфюмерии, а также как растворитель лаков. Также применяется для обеззараживания масляных растворов препаратов для внутримышечного введения в фармакологии.
Зарегистрирован в качестве пищевой добавки E1519.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
Топливо. C2H5OH
Формула, вынесенная в заголовок, в комментариях не нуждается. Этот набор символов знает даже тот, кто на уроках химии считал за окном ворон или мечтал об одноклассницах, раздетых в мыслях до состояния ню
Формула, вынесенная в заголовок, в комментариях не нуждается. Этот набор символов знает даже тот, кто на уроках химии считал за окном ворон или мечтал об одноклассницах, раздетых в мыслях до состояния ню.

Для тех, кто в свое время не доучился до девятого класса, на всякий случай уточним: речь идет об этиловом спирте. Том самом, который не только многим сломал жизнь, но и многим помог. Помог стать миллионерами и миллиардерами. Помог европейцам победить индейцев, англичанам — обосноваться в Африке и так далее. Впрочем, это история.
Отбросив «питьевой» аспект, заметим, что при помощи спирта и его сородичей (простых эфиров) многие автомобильные и топливные компании делают неплохой бизнес, который практически во всем мире поддерживается не только собственно «самогонщиками», но и «зелеными». Дело в том, что спирт может служить пищей для двигателей внутреннего сгорания. Вдобавок, в некоторых регионах земного шара он значительно дешевле и доступнее в производстве, чем топливо из нефти. Но главное то, что спирты, в отличие от нефти, можно гнать в очень больших количествах из совершенно различного сырья (по уверению О. Бендера, вплоть до табуреток). Причем сырья как минерального, так и растительного, которое, как известно, каждый год воспроизводится, в отличие от нефти.
Этиловый спирт (или этанол, Ch4Ch3OH) использовался как энергоноситель уже в конце XIX века, но в силу определенных политических и экономических причин не снискал популярности на этом поприще.
Злые языки утверждают, что идею загубили нефтедобывающие компании, которые к тому времени уже набрали силу, изготавливая и продавая такие продукты, как керосин, асфальт, гудрон, мазут и т.д. Нефтяным королям был невыгоден C2H5OH во всех своих проявлениях, поэтому развитие альтернативных видов топлива тормозилось любыми методами.
Как бы там ни было на самом деле, в мировой автомобильной промышленности до сих пор существует проблема, связанная с применением спиртов и простых эфиров в качестве основного топлива для автомобильного транспорта. Она состоит из нескольких подпроблем.
Во-первых, спирт достаточно агрессивен ко многим стандартно применяемым в автомобилестроении материалам.
Во-вторых, в чистом виде использовать спирт очень сложно из-за его гигроскопичности. Наличие же в топливе вещества с не менее «популярным» химическим составом — h3O — приводит к образованию различного рода отложений в топливной магистрали и цилиндрах двигателя и, естественно, вызывает коррозию.
Ну, и третья составляющая — сравнительно низкая калорийность спирта при сгорании, не позволяющая использовать «зеленого змия» в стандартных двигателях. Необходимо изменять степень сжатия и режим работы системы зажигания. Однако переделанные «под спирт» двигатели уже не могут потреблять бензин. Получается «железная привязка» к одному виду топлива.
Тем не менее сегодня в Бразилии, США и некоторых других странах родной брат этилового спирта метанол (метиловый, он же древесный спирт, Ch4OH) достаточно широко применяется как добавка к топливу в моторах с искровым зажиганием. В отличие от слухов, которыми сегодня полнится пресса, метанол не применяется в чистом виде, а служит именно добавкой, составляющей около трех процентов. Впрочем, многие ученые ищут способ увеличения доли метанола в нефтяных видах топлива до 15-85%.
Чтобы лучше представить место спиртов в борьбе за топливный рынок, предлагаем обратиться к таблице.
Кстати
В последнее время, даже у нас в России, очень остро стоит вопрос загазованности больших городов. Почти 85% вредных выбросов, которые попадают в атмосферу, лежат на совести двигателей внутреннего сгорания.
Спирт, как метиловый, так и этиловый, может несколько исправить положение. Тем более, опыт использования спиртов в качестве топлива для ДВС имеет давнюю историю.
Есть и другие положительные аспекты применения спирта в виде добавки к бензину. К примеру, парламент Колумбии недавно принял закон, согласно которому бензин будет разбавляться спиртом на десять процентов.
Эта мера, по мнению экспертов, решит ряд экономических, экологических и социальных проблем. Новый закон, возможно, позволит отказаться от импорта бензина на сумму в 150 миллионов долларов.
Для выработки спирта посевные площади сахарного тростника в стране увеличатся на 150 тысяч гектаров. Будет построено
10 перерабатывающих заводов, что создаст 170 тысяч новых рабочих мест и сократит безработицу в сельских районах.
Предполагается, что возделывание тростника будет приносить средней крестьянской семье до трех условных минимальных зарплат (примерно 500 долларов США) в месяц. Власти Колумбии считают, что имея подобный заработок, крестьяне смогут воздержаться от посевов коки, листья которой, помимо «обычного применения» в пищевой промышленности, используются для производства сильнодействующего наркотика.
Считается, что добавление 10 процентов спирта в бензин увеличивает мощность автомобильных двигателей, не приводя к их преждевременному износу.
Специалисты также ссылаются на положительный опыт Бразилии, в которой уже несколько лет спирт используется в качестве топлива для автомашин.
Хочу получать самые интересные статьи
Ответы Mail.ru: C2H5OH Что это такое?
Этано́л (эти́ловый спирт, метилкарбинол, винный спирт, гидроксид пентагидродикарбония, часто просто «спирт» ) — C2H5OH или Ch4—Ch3—OH, второй представитель гомологического ряда одноатомных спиртов. Легковоспламеняющаяся, бесцветная жидкость с характерным запахом, обладает наркотическим действием. Действующий компонент алкогольных напитков.
Спирт этиловый
этиловый спирт
Формула спирта)))
Это песдетс для мозга
Этанол, или этиловый спирт
это полезно по пятницам
Этиловый спирт.
Этиловый спирт)))))))))
Напиток русских богов - спирт!
Помоему в нашей стране это даже младенец знает-спирт
h3O девиз не наш. НАШ - C2H5OH!
Спиииииииииииииииииииииииииирт!!!!
со всеми согласен. он родимый
спирт этиловый
этиловый спирт, что изобрел Менделеев!
Этано́л (эти́ловый спирт, метилкарбинол, винный спирт, гидроксид пентагидродикарбония, часто в просторечии просто «спирт» или алкого́ль) — C2H5OH или Ch4-Ch3-OH, второй представитель гомологического ряда одноатомных спиртов. Легковоспламеняющаяся, бесцветная жидкость с характерным запахом.
Спирт этиловый
Этилен — Википедия
Этиле́н (по ИЮПАК: этен) — органическое химическое соединение, описываемое формулой С2H4. Является простейшим алкеном (олефином). При нормальных условиях — бесцветный горючий газ легче воздуха со слабым сладковатым запахом. Частично растворим в воде (25,6 мл в 100 мл воды при 0 °C), этаноле (359 мл в тех же условиях). Хорошо растворяется в диэтиловом эфире и углеводородах.
Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном. Этилен — самое производимое органическое соединение в мире[1]; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2—3 % в год[2]. Этилен обладает наркотическим действием. Класс опасности — четвёртый[3].
Этилен стали широко применять в качестве мономера перед Второй мировой войной в связи с необходимостью получения высококачественного изоляционного материала, способного заменить поливинилхлорид. После разработки метода полимеризации этилена под высоким давлением и изучения диэлектрических свойств получаемого полиэтилена началось его производство в мире.
Основным промышленным методом получения этилена является пиролиз жидких дистиллятов нефти или низших насыщенных углеводородов. Реакция проводится в трубчатых печах при +800-950 °С и давлении 0,3 МПа. При использовании в качестве сырья прямогонного бензина выход этилена составляет примерно 30 %. Одновременно с этиленом образуется также значительное количество жидких углеводородов, в том числе и ароматических. При пиролизе газойля выход этилена составляет примерно 15-25 %. Наибольший выход этилена — до 50 % — достигается при использовании в качестве сырья насыщенных углеводородов: этана, пропана и бутана. Их пиролиз проводят в присутствии водяного пара.
При выпуске с производства, при товарно-учётных операциях, при проверке его на соответствие нормативно-технической документации производится отбор проб этилена по процедуре, описанной в ГОСТ 24975.0-89 «Этилен и пропилен. Методы отбора проб». Отбор пробы этилена может производиться и в газообразном и в сжиженном виде в специальные пробоотборники по ГОСТ 14921.
Промышленно получаемый в России этилен должен соответствовать требованиям, изложенным в ГОСТ 25070-2013 «Этилен. Технические условия».
В настоящее время в структуре производства этилена 64 % приходится на крупнотоннажные установки пиролиза, ~17 % — на малотоннажные установки газового пиролиза, ~11 % составляет пиролиз бензина и 8 % падает на пиролиз этана.
Этилен является ведущим продуктом основного органического синтеза и применяется для получения следующих соединений (перечислены в алфавитном порядке):
Этилен в смеси с кислородом использовался в медицине для наркоза вплоть до середины 1980-х годов в СССР и на ближнем Востоке. Этилен является фитогормоном практически у всех растений[4], среди прочего[5] отвечает за опадание иголок у хвойных.
Электронное и пространственное строение молекулы[править | править код]
Атомы углерода находятся во втором валентном состоянии (sp2-гибридизация). В результате, на плоскости под углом 120° образуются три гибридных облака, которые образуют три σ-связи с углеродом и двумя атомами водорода; p-электрон, который не участвовал в гибридизации, образует в перпендикулярной плоскости π-связь с р-электроном соседнего атома углерода. Так образуется двойная связь между атомами углерода. Молекула имеет плоскостное строение.
Этилен — химически активное вещество. Так как в молекуле между атомами углерода имеется двойная связь, то одна из них, менее прочная, легко разрывается, и по месту разрыва связи происходит присоединение, окисление, полимеризация молекул.
- Ch3=Ch3+Br2→Ch3Br-Ch3Br+D{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+Br_{2}\rightarrow CH_{2}Br{\text{-}}CH_{2}Br+D}}}
- Происходит обесцвечивание бромной воды. Это качественная реакция на непредельные соединения.
- Ch3=Ch3+h3→NiCh4-Ch4{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+H_{2}{\xrightarrow[{}]{Ni}}CH_{3}{\text{-}}CH_{3}}}}
- Ch3=Ch3+HBr→Ch4Ch3Br{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+HBr\rightarrow CH_{3}CH_{2}Br}}}
- Ch3=Ch3+h3O→H+Ch4Ch3OH{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+H_{2}O{\xrightarrow[{}]{H^{+}}}CH_{3}CH_{2}OH}}}
- Эту реакцию открыл A.M. Бутлеров, и она используется для промышленного получения этилового спирта.
- Этилен легко окисляется. Если этилен пропускать через раствор перманганата калия, то он обесцветится. Эта реакция используется для отличия предельных и непредельных соединений. В результате образуется этиленгликоль. Уравнение реакции[6]:
- 3Ch3=Ch3+2KMnO4+4h3O→Ch3OH-Ch3OH+2MnO2+2KOH{\displaystyle {\mathsf {3CH_{2}{\text{=}}CH_{2}+2KMnO_{4}+4H_{2}O\rightarrow CH_{2}OH{\text{-}}CH_{2}OH+2MnO_{2}+2KOH}}}
- Ch3=Ch3+3O2→2CO2+2h3O{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+3O_{2}\rightarrow 2CO_{2}+2H_{2}O}}}
- nCh3=Ch3→(-Ch3-Ch3-)n{\displaystyle {\mathsf {nCH_{2}{\text{=}}CH_{2}\rightarrow ({\text{-}}CH_{2}{\text{-}}CH_{2}{\text{-}})_{n}}}}
- 2Ch3=Ch3→Ch3=CH-Ch3-Ch4{\displaystyle {\mathsf {2CH_{2}{\text{=}}CH_{2}\rightarrow CH_{2}{\text{=}}CH{\text{-}}CH_{2}{\text{-}}CH_{3}}}}
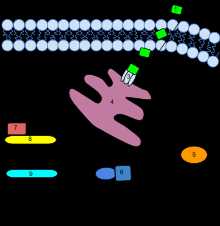 Сигнальный каскад этилена у растений. Этилен легко проникает сквозь клеточную мембрану и связывается с рецепторами, расположенными на эндоплазматическом ретикулуме. Рецепторы после активации высвобождают связанный EIN2. Это активирует каскад передачи сигнала, который приводит к активации экспрессии определённых генов и в конечном итоге к включению специфического ответа на этилен у данного растения в данной фазе созревания. Активированные участки ДНК считываются в мРНК, которая, в свою очередь, в рибосомах считывается в функционирующий белок фермента, который катализирует биосинтез этилена, тем самым продукция этилена в ответ на изначальный этиленовый же сигнал повышается до определённого уровня, запуская каскад реакций созревания растения.
Сигнальный каскад этилена у растений. Этилен легко проникает сквозь клеточную мембрану и связывается с рецепторами, расположенными на эндоплазматическом ретикулуме. Рецепторы после активации высвобождают связанный EIN2. Это активирует каскад передачи сигнала, который приводит к активации экспрессии определённых генов и в конечном итоге к включению специфического ответа на этилен у данного растения в данной фазе созревания. Активированные участки ДНК считываются в мРНК, которая, в свою очередь, в рибосомах считывается в функционирующий белок фермента, который катализирует биосинтез этилена, тем самым продукция этилена в ответ на изначальный этиленовый же сигнал повышается до определённого уровня, запуская каскад реакций созревания растения. Этилен — первый из обнаруженных газообразных растительных гормонов, обладающий очень широким спектром биологических эффектов[8]. Этилен выполняет в жизненном цикле растений многообразные функции, среди которых контроль развития проростка, созревание плодов (в частности, фруктов)[9], распускание бутонов (процесс цветения), старение и опадание листьев и цветков. Этилен называют также гормоном стресса, так как он участвует в реакции растений на биотический и абиотический стресс, и синтез его в органах растений усиливается в ответ на разного рода повреждения. Кроме того, являясь летучим газообразным веществом, этилен осуществляет быструю коммуникацию между разными органами растений и между растениями в популяции, что важно, в частности, при развитии стресс-устойчивости[10].
К числу наиболее известных функций этилена относится развитие так называемого тройного ответа у этиолированных (выращенных в темноте) проростков при обработке этим гормоном. Тройной ответ включает в себя три реакции: укорочение и утолщение гипокотиля, укорочение корня и усиление апикального крючка (резкий изгиб верхней части гипокотиля). Ответ проростков на этилен крайне важен на первых этапах их развития, так как способствует пробивание ростков к свету[10].
В коммерческом сборе плодов и фруктов используют специальные комнаты или камеры для дозревания плодов, в атмосферу которых этилен впрыскивается из специальных каталитических генераторов, производящих газообразный этилен из жидкого этанола. Обычно для стимулирования дозревания плодов используется концентрация газообразного этилена в атмосфере камеры от 500 до 2000 ppm в течение 24-48 часов. При более высокой температуре воздуха и более высокой концентрации этилена в воздухе дозревание плодов идёт быстрее. Важно, однако, при этом обеспечивать контроль содержания углекислого газа в атмосфере камеры, поскольку высокотемпературное созревание (при температуре выше 20 градусов Цельсия) или созревание при высокой концентрации этилена в воздухе камеры приводит к резкому повышению выделения углекислого газа быстро созревающими плодами, порой до 10 % углекислоты в воздухе спустя 24 часа от начала дозревания, что может привести к углекислотному отравлению как работников, убирающих уже дозревшие плоды, так и самих фруктов[11].
Этилен использовался для стимулирования созревания плодов ещё в Древнем Египте. Древние египтяне намеренно царапали или слегка мяли, отбивали финики, фиги и другие плоды с целью стимулировать их созревание (повреждение тканей стимулирует образование этилена тканями растений). Древние китайцы сжигали деревянные ароматические палочки или ароматические свечи в закрытых помещениях с целью стимулировать созревание персиков (при сгорании свеч или дерева выделяется не только углекислый газ, но и недоокисленные промежуточные продукты горения, в том числе и этилен). В 1864 году было обнаружено, что утечка природного газа из уличных фонарей вызывает торможение роста близлежащих растений в длину, их скручивание, аномальное утолщение стеблей и корней и ускоренное созревание плодов.[8] В 1901 году русский учёный Дмитрий Нелюбов показал, что активным компонентом природного газа, вызывающим эти изменения, является не основной его компонент, метан, а присутствующий в нём в малых количествах этилен[12]. Позднее в 1917 году Сара Дубт доказала, что этилен стимулирует преждевременное опадание листьев[13]. Однако только в 1934 году Гейн обнаружил, что сами растения синтезируют эндогенный этилен.[14]. В 1935 году Крокер предположил, что этилен является растительным гормоном, ответственным за физиологическое регулирование созревания плодов, а также за старение вегетативных тканей растения, опадание листьев и торможение роста[15].
Этилен образуется практически во всех частях высших растений, включая листья, стебли, корни, цветки, мякоть и кожуру плодов и семена. Образование этилена регулируется множеством факторов, включая как внутренние факторы (например фазы развития растения), так и факторы внешней среды. В течение жизненного цикла растения, образование этилена стимулируется в ходе таких процессов, как оплодотворение (опыление), созревание плодов, опадание листьев и лепестков, старение и гибель растения. Образование этилена стимулируется также такими внешними факторами, как механическое повреждение или ранение, нападение паразитов (микроорганизмов, грибков, насекомых и др.), внешние стрессы и неблагоприятные условия развития, а также некоторыми эндогенными и экзогенными стимуляторами, такими, как ауксины и другие[16].
Цикл биосинтеза этилена начинается с превращения аминокислоты метионина в S-аденозил-метионин (SAMe) при помощи фермента метионин-аденозилтрансферазы. Затем S-аденозил-метионин превращается в 1-аминоциклопропан-1-карбоксиловую кислоту (АЦК, ACC) при помощи фермента 1-аминоциклопропан-1-карбоксилат-синтетазы (АЦК-синтетазы). Активность АЦК-синтетазы лимитирует скорость всего цикла, поэтому регуляция активности этого фермента является ключевой в регуляции биосинтеза этилена у растений. Последняя стадия биосинтеза этилена требует наличия кислорода и происходит при действии фермента аминоциклопропанкарбоксилат-оксидазы (АЦК-оксидазы), ранее известной как этиленобразующий фермент. Биосинтез этилена у растений индуцируется как экзогенным, так и эндогенным этиленом (положительная обратная связь). Активность АЦК-синтетазы и, соответственно, образование этилена повышается также при высоких уровнях ауксинов, в особенности индолуксусной кислоты, и цитокининов.
Этиленовый сигнал у растений воспринимается минимум пятью различными семействами трансмембранных рецепторов, представляющих собой димеры белков. Известен, в частности, рецептор этилена ETR1 у арабидопсиса (Arabidopsis). Гены, кодирующие рецепторы для этилена, были клонированы у арабидопсиса и затем у томата. Этиленовые рецепторы кодируются множеством генов как в геноме арабидопсиса, так и в геноме томатов. Мутации в любом из семейства генов, которое состоит из пяти типов этиленовых рецепторов у арабидопсиса и минимум из шести типов рецепторов у томата, могут привести к нечувствительности растений к этилену и нарушениям процессов созревания, роста и увядания[17]. Последовательности ДНК, характерные для генов этиленовых рецепторов, были обнаружены также у многих других видов растений. Более того, этиленсвязывающий белок был найден даже у цианобактерий[8].
Неблагоприятные внешние факторы, такие, как недостаточное содержание кислорода в атмосфере, наводнение, засуха, заморозки, механическое повреждение (ранение) растения, нападение патогенных микроорганизмов, грибков или насекомых, могут вызывать повышенное образование этилена в тканях растений. Так, например, при наводнении корни растения страдают от избытка воды и недостатка кислорода (гипоксии), что приводит к биосинтезу в них 1-аминоциклопропан-1-карбоксиловой кислоты. АЦК затем транспортируется по проводящим путям в стеблях вверх, до листьев, и в листьях окисляется до этилена. Образовавшийся этилен способствует эпинастическим движениям, приводящим к механическому стряхиванию воды с листьев, а также увяданию и опаданию листьев, лепестков цветков и плодов, что позволяет растению одновременно и избавиться от избытка воды в организме, и сократить потребность в кислороде за счёт сокращения общей массы тканей[18].
Небольшие количества эндогенного этилена также образуются в клетках животных, включая человека, в процессе перекисного окисления липидов. Некоторое количество эндогенного этилена затем окисляется до этиленоксида, который обладает способностью алкилировать ДНК и белки, в том числе гемоглобин (формируя специфический аддукт с N-терминальным валином гемоглобина — N-гидроксиэтил-валин)[19]. Эндогенный этиленоксид также может алкилировать гуаниновые основания ДНК, что приводит к образованию аддукта 7-(2-гидроксиэтил)-гуанина, и является одной из причин присущего всем живым существам риска эндогенного канцерогенеза[20]. Эндогенный этиленоксид также является мутагеном[21][22]. С другой стороны, существует гипотеза, что если бы не образование в организме небольших количеств эндогенного этилена и соответственно этиленоксида, то скорость возникновения спонтанных мутаций и соответственно скорость эволюции была бы значительно ниже.
- ↑ Devanney Michael T. Ethylene (англ.) (недоступная ссылка). SRI Consulting (September 2009). Архивировано 18 июля 2010 года.
- ↑ Ethylene (англ.) (недоступная ссылка). WP Report. SRI Consulting (January 2010). Архивировано 31 августа 2010 года.
- ↑ Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, бутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (Утв. главным государственным санитарным врачом РФ 30.03.2003)
- ↑ «Рост и развитие растений» В. В. Чуб (неопр.) (недоступная ссылка). Дата обращения 21 января 2007. Архивировано 20 января 2007 года.
- ↑ «Delaying Christmas tree needle loss»
- ↑ Хомченко Г.П. §16.6. Этилен и его гомологи // Химия для поступающих в вузы. — 2-е изд. — М.: Высшая школа, 1993. — С. 345. — 447 с. — ISBN 5-06-002965-4.
- ↑ В. Ш. Фельдблюм. Димеризация и диспропорционирование олефинов. М.: Химия, 1978
- ↑ 1 2 3 Lin, Z.; Zhong, S.; Grierson, D. Recent advances in ethylene research (англ.) // Journal of Experimental Botany : journal. — Oxford University Press, 2009. — Vol. 60, no. 12. — P. 3311—3336. — doi:10.1093/jxb/erp204. — PMID 19567479.
- ↑ Ethylene and Fruit Ripening / J Plant Growth Regul (2007) 26:143-159 doi:10.1007/s00344-007-9002-y (англ.)
- ↑ 1 2 Лутова Л.А. Генетика развития растений / ред. С.Г. Инге-Вечтомов. — 2-е изд.. — Санкт-Петербург: Н-Л, 2010. — С. 432.
- ↑ External Link to More on Ethylene Gassing and Carbon Dioxide Control. ne-postharvest.com Архивная копия от 14 сентября 2010 на Wayback Machine
- ↑ Нелюбов Д. Н. О горизонтальной нутации у Pisum sativum и некоторых других растений (рус.) // Труды Санкт-Петербургского Общества Естествознания : журнал. — 1901. — Т. 31, № 1., также Beihefte zum «Bot. Centralblatt», т. Х, 1901
- ↑ Doubt, Sarah L. The Response of Plants to Illuminating Gas (англ.) // Botanical Gazette : journal. — 1917. — Vol. 63, no. 3. — P. 209—224. — doi:10.1086/332006.
- ↑ Gane R. Production of ethylene by some fruits (англ.) // Nature. — 1934. — Vol. 134, no. 3400. — P. 1008. — doi:10.1038/1341008a0. — Bibcode: 1934Natur.134.1008G.
- ↑ Crocker W, Hitchcock AE, Zimmerman PW. (1935) «Similarities in the effects of ethlyene and the plant auxins». Contrib. Boyce Thompson Inst. 7. 231-48. Auxins Cytokinins IAA Growth substances, Ethylene
- ↑ Yang, S. F., and Hoffman N. E. Ethylene biosynthesis and its regulation in higher plants (англ.) // Ann. Rev. Plant Physiol. : journal. — 1984. — Vol. 35. — P. 155—189. — doi:10.1146/annurev.pp.35.060184.001103.
- ↑ Bleecker A. B., Esch J. J., Hall A. E., Rodríguez F. I., Binder B. M. The ethylene-receptor family from Arabidopsis: structure and function. (англ.) // Philosophical transactions of the Royal Society of London. Series B, Biological sciences. — 1998. — Vol. 353, no. 1374. — P. 1405—1412. — doi:10.1098/rstb.1998.0295. — PMID 9800203. [исправить]
- ↑ Explaining Epinasty. planthormones.inf
- ↑ Filser J. G., Denk B., Törnqvist M., Kessler W., Ehrenberg L. Pharmacokinetics of ethylene in man; body burden with ethylene oxide and hydroxyethylation of hemoglobin due to endogenous and environmental ethylene. (англ.) // Arch Toxicol. : journal. — 1992. — Vol. 66, no. 3. — P. 157—163. — PMID 1303633.
- ↑ Bolt H. M., Leutbecher M., Golka K. A note on the physiological background of the ethylene oxide adduct 7-(2-hydroxyethyl)guanine in DNA from human blood. (англ.) // Arch Toxicol. : journal. — 1997. — Vol. 71, no. 11. — P. 719—721. — PMID 9363847.
- ↑ Csanády G. A., Denk B., Pütz C., Kreuzer P. E., Kessler W., Baur C., Gargas M. L., Filser JG. A physiological toxicokinetic model for exogenous and endogenous ethylene and ethylene oxide in rat, mouse, and human: formation of 2-hydroxyethyl adducts with hemoglobin and DNA. (англ.) // Toxicol Appl Pharmacol. : journal. — 2000. — 15 May (vol. 165, no. 1). — P. 1—26. — PMID 10814549.
- ↑ Thier R., Bolt HM. Carcinogenicity and genotoxicity of ethylene oxide: new aspects and recent advances. (англ.) // Crit Rev Toxicol. : journal. — 2000. — September (vol. 30, no. 5). — P. 595—608. — PMID 11055837.
- Безуглова О. С. Этилен (неопр.). Удобрения и стимуляторы роста. Дата обращения 22 февраля 2015.
Ацетилен — Википедия
| Ацетилен | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Систематическое наименование | Этин | ||
| Традиционные названия | Ацетилен | ||
| Хим. формула | C2H2 | ||
| Рац. формула | HCCH | ||
| Молярная масса | 26,038[1] г/моль | ||
| Плотность | 1,0896 г/л | ||
| Энергия ионизации | 11,4 ± 0,1 эВ[2] | ||
| Температура | |||
| • плавления | -80,8 1277 мм Hg °C | ||
| • сублимации | −119 ± 1 °F[2] | ||
| • кипения | −83,6 °C | ||
| • самовоспламенения | 335 °C | ||
| Пределы взрываемости | 2,5 ± 0,1 об.%[2] | ||
| Тройная точка | −80,55 | ||
| Критическая точка | 35,2°С; 6,4 МПа | ||
| Мол. теплоёмк. | 44,036 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | +226,88 кДж/моль | ||
| • сгорания | –1302 кДж/моль | ||
| Давление пара | 44,2 ± 0,1 атм[2] | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 25 | ||
| Растворимость | |||
| • в воде | 10018 мл/100 мл | ||
| • в этаноле | 60018 мл/100 мл | ||
| Гибридизация | sp | ||
| Рег. номер CAS | 74-86-2 | ||
| PubChem | 6326 | ||
| Рег. номер EINECS | 200-816-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | AO9600000 | ||
| ChEBI | 27518 | ||
| Номер ООН | 1001 | ||
| ChemSpider | 6086 | ||
| Пиктограммы ECB | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Ацетиле́н (по ИЮПАК — этин) — органическое соединение, непредельный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. При нормальных условиях — бесцветный, очень горючий газ.
В лаборатории[править | править код]
В лаборатории, а также в газосварочном оборудовании, ацетилен получают действием воды на карбид кальция[3] (Ф. Вёлер, 1862 год)[4]:
- CaC2+2h3O→Ca(OH)2+C2h3↑{\displaystyle {\mathsf {CaC_{2}+2H_{2}O\rightarrow Ca(OH)_{2}+C_{2}H_{2}\uparrow }}}
а также при дегидрировании двух молекул метана при температуре свыше 1400 °C:
- 2Ch5→C2h3+3h3{\displaystyle {\mathsf {2CH_{4}\rightarrow C_{2}H_{2}+3H_{2}}}}
В промышленности[править | править код]
В промышленности ацетилен получают гидролизом карбида кальция и пиролизом углеводородного сырья — метана или пропана с бутаном. В последнем случае ацетилен получают совместно с этиленом и примесями других углеводородов. Карбидный метод позволяет получать очень чистый ацетилен, но требует высокого расхода электроэнергии. Пиролиз существенно менее энергозатратен, т.к. для нагрева реактора используется сгорание того же рабочего газа во внешнем контуре, но в газовом потоке продуктов концентрация самого ацетилена низка. Выделение и концентрирование индивидуального ацетилена в таком случае представляет сложную задачу. Экономические оценки обоих методов многочисленны, но противоречивы[5][:стр. 274].
Получение пиролизом[править | править код]
Электрокрекинг[править | править код]
Метан превращают в ацетилен и водород в электродуговых печах (температура 2000—3000 °С, напряжение между электродами 1000 В). Метан при этом разогревается до 1600 °С. Расход электроэнергии составляет около 13000 кВт•ч на 1 тонну ацетилена, что относительно много (примерно равно затрачиваемой энергии по карбидному методу) и потому является недостатком процесса. Выход ацетилена составляет 50 %.
Регенеративный пиролиз[править | править код]
Иное название — Вульф-процесс. Сначала разогревают насадку печи путём сжигания метана при 1350—1400 °С. Далее через разогретую насадку пропускают метан. Время пребывания метана в зоне реакции очень мало и составляет доли секунды. Процесс реализован в промышленности, но экономически оказался не таким перспективным, как считалось на стадии проектирования.
Окислительный пиролиз[править | править код]
Метан смешивают с кислородом. Часть сырья сжигают, а образующееся тепло расходуют на нагрев остатка сырья до 1600 °С. Выход ацетилена составляет 30—32 %. Метод имеет преимущества — непрерывный характер процесса и низкие энергозатраты. Кроме того, с ацетиленом образуется еще и синтез-газ. Этот процесс (Заксе-процесс или BASF-процесс) получил наиболее широкое внедрение.
Гомогенный пиролиз[править | править код]
Является разновидностью окислительного пиролиза. Часть сырья сжигают с кислородом в топке печи, газ нагревается до 2000 °С. Затем в среднюю часть печи вводят остаток сырья, предварительно нагретый до 600 °С. Образуется ацетилен. Метод характеризуется большей безопасностью и надёжностью работы печи.
Пиролиз в струе низкотемпературной плазмы[править | править код]
Процесс разрабатывается с 1970-х годов, но, несмотря на перспективность, пока не внедрён в промышленности. Сущность процесса состоит в нагреве метана ионизированным газом. Преимущество метода заключается в относительно низких энергозатратах (5000—7000 кВт•ч) и высоких выходах ацетилена (87 % в аргоновой плазме и 73 % в водородной).
Карбидный метод[править | править код]
Этот способ известен с XIX века, но не потерял своего значения до настоящего времени. Сначала получают карбид кальция, сплавляя оксид кальция (негашёную известь) и кокс в электропечах при 2500—3000 °С:
- CaO+3C→CaC2+CO↑{\displaystyle {\mathsf {CaO+3C\rightarrow CaC_{2}+CO\uparrow }}}
Негашёную известь получают из карбоната кальция:
- CaCO3→CaO+CO2↑{\displaystyle {\mathsf {CaCO_{3}\rightarrow CaO+CO_{2}\uparrow }}}
Далее карбид кальция обрабатывают водой:
- CaC2+2h3O→C2h3+Ca(OH)2{\displaystyle {\mathsf {CaC_{2}+2H_{2}O\rightarrow C_{2}H_{2}+Ca(OH)_{2}}}}
Получаемый ацетилен имеет высокую степень чистоты 99,9 %. Основным недостатком процесса является высокий расход электроэнергии: 10000—11000 кВт•ч на 1 тонну ацетилена.
Рис.1. Пи-связи в молекуле ацетиленаПри нормальных условиях — бесцветный газ, легче воздуха. Чистый 100 % ацетилен не обладает запахом. Технический ацетилен хранится в баллонах с пористым наполнителем, пропитанным ацетоном (т.к. чистый ацетилен при сжатии взрывается), и может содержать другие примеси, которые придают ему резкий запах[6]. Малорастворим в воде, хорошо растворяется в ацетоне. Температура кипения −83,6 °C[7]. Тройная точка −80,55 °C при давлении 961,5 мм рт. ст., критическая точка 35,18 °C при давлении 61,1 атм[8].
Ацетилен требует большой осторожности при обращении. Может взрываться от удара, при нагреве до 500 °C или при сжатии выше 0,2 МПа[4] при комнатной температуре. Струя ацетилена, выпущенная на открытый воздух, может загореться от малейшей искры, в том числе от разряда статического электричества с пальца руки. Для хранения ацетилена используются специальные баллоны, заполненные пористым материалом, пропитанным ацетоном[9].
Ацетилен обнаружен на Уране и Нептуне.
Ацетилено-кислородное пламя (температура «ядра» 2621 °C)- Для ацетилена (этина) характерны реакции присоединения:
- HC≡CH+Cl2⟶ClCH=CHCl{\displaystyle {\ce {HC#CH + Cl_2 -> ClCH=CHCl}}}
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³ (50,4 МДж/кг). При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в ~500 °C. В присутствии катализаторов, например, трикарбонил(трифенилфосфин)никеля, температуру реакции циклизации можно снизить до 60—70 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так, ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
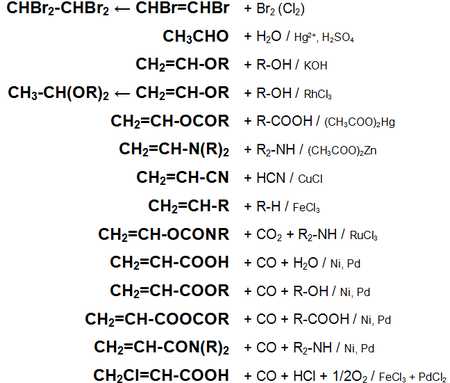
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
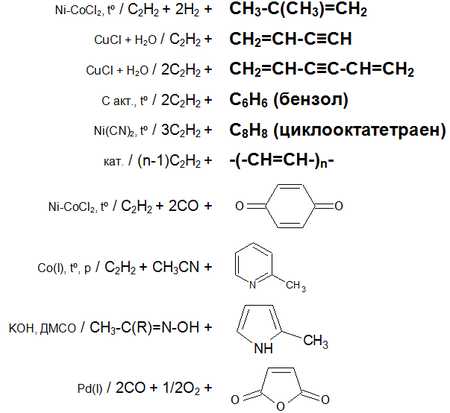
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Реагирует с аммиачными растворами солей Cu(I) и Ag(I) с образованием малорастворимых, взрывчатых ацетиленидов — эта реакция используется для качественного определения ацетилена и его отличия от алкенов (которые тоже обесцвечивают бромную воду и раствор перманганата калия).
Открыт в 1836 году Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 год).
Ацетиленовая лампаАцетилен используют:
- для газовой сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидная лампа),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.
- для получения технического углерода
- в атомно-абсорбционной спектрофотометрии при пламенной атомизации
- в ракетных двигателях (вместе с аммиаком)[10]
Поскольку ацетилен нерастворим в воде, и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры.
Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3—80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например азотом, метаном или пропаном.
При длительном соприкосновении ацетилена с медью и серебром образуются ацетилениды меди и серебра, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов).
Ацетилен обладает незначительным токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м³ согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населённых мест».
ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2.2.5.1314-03), так как концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5—100 %.
Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углём) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5—2,5 МПа.
- ↑ ГОСТ 5457-75. Ацетилен растворённый и газообразный технический. Технические условия
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0008.html
- ↑ Видео данного процесса
- ↑ 1 2 Хвостов, 1988.
- ↑ Лапидус А. Л., Голубева И. А., Жагфаров Ф. Г. Газохимия. Учебное пособие. — М.: ЦентрЛитНефтеГаз, 2008. — 450 с. — ISBN 978-5-902665-31-1.
- ↑ Большая энциклопедия нефти и газа. Неприятный запах — ацетилен (неопр.). Дата обращения 10 октября 2013.
- ↑ Корольченко. Пожаровзрывоопасность веществ, 2004, с. 198.
- ↑ Миллер. Ацетилен, его свойства, получение и применение, 1969, с. 72.
- ↑ Ацетилен (неопр.) (недоступная ссылка). Дата обращения 10 октября 2013. Архивировано 1 октября 2013 года.
- ↑ В России разработали ракетный двигатель на аммиаке — Известия
- Миллер С. А. Ацетилен, его свойства, получение и применение. — Л.: Химия, 1969. — Т. 1. — 680 с.
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 1. — М.: Ассоциация «Пожнаука», 2004. — 713 с. — ISBN 5-901283-02-3.
- Хвостов И. В. Ацетилен // Химическая энциклопедия: в 5 т. / И. Л. Кнунянц (гл. ред.). — М.: Советская энциклопедия, 1988. — Т. 1: А—Дарзана. — С. 226—228. — 623 с. — 100 000 экз. — ISBN 5-85270-008-8.
C2H5OH — Абсурдопедия
Алкоголь — как соль. Можно, конечно, без него. Но не вкусно.
- ~ Дарт Херохито. «Афоризмы житейской мудрости для научных сотрудников младшего возраста»
C2H5OH (цэ — два — аш — пять — о — аш) — химико-органико-физическое соединение, назначение которого смог открыть только русский химик Дмитрий Иванович Менделеев. Есть мнение, что открыл Менделеев это назначение только после отдыха в Ебипте, где упомянутое соединение втюхивалось хитрыми арабами русским туристам как «аль-кохооль», то есть живая вода. Как правило, используется сокращённое название по последним двум буквам (то есть он). Вещество создано древним майянским богом Цедваашпятёашем с целью уничтожения человечества, однако его планы разрушил я.
Место в политической картине мира[править]
Существует несколько сект и религиозных организаций, в том числе и весьма влиятельных, в открытую поклоняющихся ему. Среди них особо выделяются Оракулы ОН (сокр. ООН) — группа кентавров-генетических мутантов, которые получают видения о будущем после ритуального испивания его. Полученные знания они используют для установления мира во всём мире. Их авторитет непререкаем, и все мировые лидеры с большим уважением прислуживаются к их видениям. На данных момент в ООН состоят:
Первой важной фазой его жизненного цикла является его получение.
Получение из аптечного киоска[править]
Самый тривиальный способ, особенно для читеров из Меда. Для получения литра его необходимо взять пятьсот грамм аптечного киоска, сто грамм сахара, литр воды и философский камень. Все ингридиенты необходимо тщательно перемешать, посолить и поперчить по вкусу, а затем оставить бродить на три часа. Следите за тем, чтобы отвар не забрёл далеко от дома. После того, как брожение завершится, залейте отвар в бурбулятор c жаропрочным змеевиком. В течение нескольких часов он изыдет из вашего отвара и сконденсируется в бурбурляционной капсуле.
Получение из кухонно-плиточного газа[править]
Древний, придуманный ещё шумерчегами, но забытый способ. Основан на превращении этана в этанол, этанола в полипропилен, полипропилена в тригидроэтенхлорвинил, тригидроэтенхлорвинила в карамель, карамели в чаппи с сытным мясным паштетом, чаппи с сытным мясным паштетом в сферического коня в вакууме, сферического коня в вакууме в Бориса Бурду, Бориса Бурду в какую-то хрень, а какую-то хрень — в него. Но воспроизвести способ не удаётся. Одни учёные полагают, что всё дело в отсутствии в природе такого вещества, как Борис Бурда. Другие думают, что во всём виноват Чубайс, который добавляет в природный газ слишком много пропана.
Это вторая фаза его существования. Она является очень сложным и комплексным процессом, а именно: измерением его ёмкостным попугаеметром. Погрешность в таких измерения всегда отрицательна и обычно очень велика, поскольку с самого момента своего появления он необъяснимым образом исчезает в чужих желудках, смешавшись с водой. Этому явлению объяснения пока не нашли.
Третьей важной фазой жизненного цикла C2H5OH, является… э-э чего я хотел сказать-то? Да, ты прав, Кузьмич, наливай!
Ацетальдегид — Википедия
| Ацетальдегид | |||
|---|---|---|---|
| |||
| Систематическое наименование | этаналь | ||
| Традиционные названия | ацетальдегид, метилформальдегид | ||
| Хим. формула | СH3СHO | ||
| Рац. формула | С2H4O C 54,53 %, H 9,15 %, O 36,32 % | ||
| Состояние | бесцветная жидкость, с резким запахом | ||
| Молярная масса | 44,0526 ± 0,0022 г/моль | ||
| Плотность | 0,784 г/см³ | ||
| Динамическая вязкость | ~0,215 при 20 °C | ||
| Энергия ионизации | 10,22 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | −123,37 °C | ||
| • кипения | 20,2 °C | ||
| • вспышки | −36 ± 1 °F[1] | ||
| • воспламенения | 234,15 K (−39 °C) °C | ||
| • самовоспламенения | 458,15 K (185 °C) °C | ||
| Пределы взрываемости | 4-60 % | ||
| Критическая точка | 192,85 | ||
| Энтальпия | |||
| • образования | -166 кДж/моль | ||
| Давление пара | 2,7650; 4,8670; 10,0100[2] атм | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 13,57 (25 °C) | ||
| Растворимость | |||
| • в воде | С водой, этанолом смешивается во всех соотношениях. | ||
| Показатель преломления | 1,3316 | ||
| Дипольный момент | 2,750 ± 0,006 Д | ||
| Рег. номер CAS | 75-07-0 | ||
| PubChem | 177 | ||
| Рег. номер EINECS | 200-836-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | AB1925000 | ||
| ChEBI | 15343 | ||
| Номер ООН | 1089 | ||
| ChemSpider | 172 | ||
| Предельная концентрация | 5 мг/м3 | ||
| ЛД50 | 1232 мг/кг (мыши, внутрижелудочно), 900 мг/кг (мыши, перорально), 661 мг/кг (крысы, перорально) | ||
| Токсичность | токсичен, вызывает привыкание, ирритант, канцероген | ||
| Пиктограммы ECB | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Ацетальдеги́д (у́ксусный альдегид, этана́ль, метилформальдегид) — органическое соединение класса альдегидов с химической формулой CH3-CHO, является альдегидом этанола и уксусной кислоты. Это один из наиболее важных альдегидов, широко встречающийся в природе и производится в больших количествах индустриально. Ацетальдегид встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями как результат их метаболизма. Также производится окислением этанола.
Вещество представляет собой бесцветную ядовитую жидкость, при стандартных условиях, бесцветный газ с резким запахом, похожим на запах прелых яблок, хорошо растворяется в воде, спирте, эфире. Из-за очень низкой температуры кипения (20,2 °C) хранят и перевозят ацетальдегид в виде тримера — паральдегида, из которого он может быть получен нагреванием с минеральными кислотами (обычно серной).
В 2003 глобальное производство было около миллиона тонн в год.
Основной способ получения — окисление этилена (процесс Вакера):
- 2Ch3=Ch3+O2→2Ch4CHO{\displaystyle {\mathsf {2CH_{2}{\text{=}}CH_{2}+O_{2}\rightarrow 2CH_{3}CHO}}}
В качестве окислителя в процессе Вакера используется хлорид палладия, регенерирующийся окислением хлоридом меди в присутствии кислорода воздуха:
- Ch3=Ch3+PdCl2+h3O→Ch4CHO+Pd+2HCl{\displaystyle {\mathsf {CH_{2}{\text{=}}CH_{2}+PdCl_{2}+H_{2}O\rightarrow CH_{3}CHO+Pd+2HCl}}}
- Pd+2CuCl2→PdCl2+2CuCl{\displaystyle {\mathsf {Pd+2CuCl_{2}\rightarrow PdCl_{2}+2CuCl}}}
- 4CuCl+4HCl+O2→4CuCl2+2h3O{\displaystyle {\mathsf {4CuCl+4HCl+O_{2}\rightarrow 4CuCl_{2}+2H_{2}O}}}
Также получают уксусный альдегид гидратацией ацетилена в присутствии солей ртути (реакция Кучерова), с образованием енола, который изомеризуется в альдегид:
- C2h3+h3O→Hg2+,H+Ch4CHO{\displaystyle {\mathsf {C_{2}H_{2}+H_{2}O{\xrightarrow[{}]{Hg^{2+},H^{+}}}CH_{3}CHO}}}
Другой метод доминировал до открытия процесса Вакера. Он состоял в окислении или дегидрировании этилового спирта, на медном или серебряном катализаторе.
- C2H5OH→Ag,oCCh4CHO+h3{\displaystyle {\mathsf {C_{2}H_{5}OH{\xrightarrow[{}]{Ag,^{o}C}}CH_{3}CHO+H_{2}}}}
- 2C2H5OH+O2→Ag,oC2Ch4CHO+2h3O{\displaystyle {\mathsf {2C_{2}H_{5}OH+O_{2}{\xrightarrow[{}]{Ag,^{o}C}}2CH_{3}CHO+2H_{2}O}}}
По своим химическим свойствам уксусный альдегид является типичным алифатическим альдегидом, и для него характерны реакции этого класса соединений. Его реакционная способность определяется двумя факторами: активностью карбонила альдегидной группы и подвижностью атомов водорода метильной группы, вследствие индуктивного эффекта карбонила.
Подобно другим карбонильным соединениям с атомами водорода у α-углеродного атома, ацетальдегид таутомеризируется, образуя енол — виниловый спирт, равновесие почти полностью смещено в сторону альдегидной формы (константа равновесия — только 6⋅10−5 при комнатной температуре[3]):
Реакция конденсации[править | править код]
Из-за небольших размеров молекулы и доступности в виде безводного мономера (в отличие от формальдегида) ацетальдегид является широко распространённым электрофильным агентом в органическом синтезе[4]. Что касается реакций конденсации, альдегид прохирален. Он используется, в основном, как источник синтона «CH3C+H(OH)» в альдольной и соответствующих реакциях конденсации. Реактив Гриньяра и литий-органические соединения реагируют с MeCHO, образуя производные гидроксиэтила. В одной из реакций конденсации, три эквивалента формальдегида присоединяются, а один восстанавливает образующийся альдегид, образуя из MeCHO пентаэритрит (C(CH2OH)4.)
В реакции Штрекера[5] ацетальдегид конденсируется с цианидом и аммиаком, образуя после гидролиза аминокислоту — аланин[6]. Ацетальдегид способен конденсироваться с аминами образуя имины, так как конденсация циклогексиламина даёт N-этилиден циклогексиламин. Эти имины могут быть использованы для прямой последующей реакции, таких, как альдольная конденсация[7].
Ацетальдегид также — важный строительный блок для синтезов гетероциклических соединений. Выдающийся пример — конверсия под действием аммиака до 5-этил-2-метилпиридина («альдегид-коллидин»)[8]
Реакция альдольной конденсации обусловлена подвижностью водорода в альфа-положении в радикале и осуществляется в присутствии разбавленных щелочей. Её можно рассматривать как реакцию нуклеофильного присоединения одной молекулы альдегида к другой:
- Ch4-CHO+Ch4-CHO→Ch4-CH(OH)-Ch3-CHO{\displaystyle {\mathsf {CH_{3}{\text{-}}CHO+CH_{3}{\text{-}}CHO\rightarrow CH_{3}{\text{-}}CH(OH){\text{-}}CH_{2}{\text{-}}CHO}}}
Производные ацеталя[править | править код]
Три молекулы ацетальдегида конденсируются, образуя «паральдегид» — циклический тример, содержащий одиночные С-О связи. Конденсация четырёх молекул даёт циклическое соединение, называемое метальдегид.
Ацетальдегид образует стабильные ацетали при реакции с этанолом в условиях дегидратации. Продукт CH3CH(OCH2CH3)2 называется «ацеталь»[9], хотя термин используется для описания более широкой группы соединений с общей формулой RCH(OR')2.
Применяют уксусный альдегид для получения уксусной кислоты, бутадиена, некоторых органических веществ, альдегидных полимеров.
Традиционно ацетальдегид, в основном, использовался в качестве прекурсора к уксусной кислоте. Такое применение было отвергнуто ввиду того, что уксусная кислота более эффективно производится из метанола с помощью процессов Монсанто[10] и Катива[11]. В терминах реакции конденсации, ацетальдегид — важный прекурсор к пиридиновым производным, пентаэритролу и кротональдегиду. Мочевина и ацетальдегид конденсируются, образуя смолы. Уксусный ангидрид реагирует с ацетальдегидом, давая этилидендиацетат, из которого получают винилацетат — мономер поливинилацетата.
В печени имеется фермент алкогольдегидрогеназа, который окисляет этанол в ацетальдегид, который затем окисляется в безопасную уксусную кислоту посредством ацетальдегиддегидрогеназы. Эти две реакции окисления связаны с восстановлением NAD+ в NADH[12]. В мозгу алкогольдегидрогеназа не играет особой роли в окислении этанола в ацетальдегид, это делает энзим каталаза. Конечные шаги алкогольной ферментации в бактериях, растениях и дрожжах включают конверсию пирувата в ацетальдегид под действием пируват декарбоксилазы, после чего — конверсию ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, но уже в обратном направлении.
Табачная зависимость[править | править код]
Ацетальдегид — значительная часть дыма табака. Была продемонстрирована синергическая связь с никотином, увеличивающая появление зависимости, особенно у молодёжи.[13][14]
Болезнь Альцгеймера[править | править код]
Люди, у которых отсутствует генетический фактор конверсии ацетальдегида в уксусную кислоту, могут иметь большой риск предрасположенности к болезни Альцгеймера. «Эти результаты указывают, что отсутствие ALDh3 — это фактор риска для поздно возникающей болезни Альцгеймера.»[15]
Проблема алкоголя[править | править код]
Ацетальдегид, полученный из поглощённого этанола, связывает ферменты, образуя аддукты, связанные с заболеваниями органов.[16] Лекарство дисульфирам (Antabuse) предотвращает окисление ацетальдегида до уксусной кислоты. Это даёт неприятные ощущения при принятии алкоголя. Antabuse используется в случае, когда алкоголик сам хочет излечиться.
Канцероген[править | править код]
Ацетальдегид является канцерогеном первой группы.[17][18] «Существует достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) в экспериментах на животных», кроме того, ацетальдегид повреждает ДНК[19] и вызывает несоразмерное с общей массой тела развитие мускулов, связанное с нарушением белкового равновесия организма.[20] В результате исследования 818 алкоголиков ученые пришли к выводу, что у тех пациентов, которые подвергались действию ацетальдегида в большей степени, присутствует дефект в гене фермента алкогольдегидрогеназы. Поэтому такие пациенты подвержены большему риску развития рака верхней части ЖКТ и печени.[21]
Безопасность[править | править код]
Ацетальдегид[22] токсичен при действии на кожу, ирритант, канцероген. Однако токсичность ацетальдегида ниже, чем у формальдегида, так как ацетальдегид в организме быстро окисляется до безвредной уксусной кислоты. Он также является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Кроме того, этаналь образуется при термической обработке полимеров и пластиков.[23]
При длительном контакте с воздухом могут образоваться перекиси, и произойти взрыв, который может разрушить ёмкость[24]
Санитарно-гигиенические рекомендации[24][править | править код]
- Кожа: Использование адекватной защитной одежды для предотвращения контакта с кожей.
- Глаза: Использование адекватных средств индивидуальной защиты (СИЗ) глаз
- Переодевание: При намокании (из-за пожароопасности)
- Рекомендации: Установить фонтанчики для промывки глаз, оборудовать места для быстрого переодевания
По данным[25] ПДК ацетальдегида 5 мг/м3. В то же время, по данным[26] порог восприятия запаха этого вещества может достигать, например, 1800 мг/м3.
Врожденная непереносимость алкоголя[править | править код]
Одним из механизмов врожденной непереносимости алкоголя является накопление ацетальдегида.
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0001.html
- ↑ Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ↑ March, J. «Organic Chemistry: Reactions, Mechanisms, and Structures» J. Wiley, New York: 1992. ISBN 0-471-58148-8.
- ↑ Sowin, T. J.; Melcher, L. M. «Acetaldehyde» in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289
- ↑ en:Strecker amino acid synthesis
- ↑ Kendall, E. C. McKenzie, B. F. (1941), «dl-Alanine», Org. Synth.; Coll. Vol. 1: 21
- ↑ Wittig, G.; Hesse, A. (1988), «Directed Aldol Condensations: β-Phenylcinnamaldehyde», Org. Synth.; Coll. Vol. 6: 901
- ↑ Frank, R. L.; Pilgrim, F. J.; Riener, E. F. (1963), «5-Ethyl-2-Methylpyridine», Org. Synth.; Coll. Vol. 4: 451
- ↑ Adkins, H.; Nissen, B. H. (1941), «Acetal», Org. Synth.; Coll. Vol. 1: 1
- ↑ en:Monsanto process
- ↑ en:Cativa process
- ↑ NAD+ to NADH Hipolito, L.; Sanchez, M. J.; Polache, A.; Granero, L. Brain metabolism of ethanol and alcoholism: An update. Curr. Drug Metab. 2007, 8, 716—727
- ↑ Study Points to Acetaldehyde-Nicotine Combination in Adolescent Addiction (неопр.) (недоступная ссылка). Дата обращения 10 апреля 2010. Архивировано 25 августа 2009 года.
- ↑ Nicotine’s addictive hold increases when combined with other tobacco smoke chemicals, UCI study finds Архивировано 9 февраля 2011 года.
- ↑ «Mitochondrial ALDh3 Deficiency as an Oxidative Stress». Annals of the New York Academy of Sciences 1011: 36-44. April 2004. doi:10.1196/annals.1293.004. PMID 15126281. Retrieved 2009-08-13.
- ↑ Nakamura, K.; Iwahashi, K.; Furukawa, A.; Ameno, K.; Kinoshita, H.; Ijiri, I.; Sekine, Y.; Suzuki, K.; Iwata, Y.; Minabe, Y.; Mori, N. Acetaldehyde adducts in the brain of alcoholics. Arch. Toxicol. 2003, 77, 591.
- ↑ IARC: IARC STRENGTHENS ITS FINDINGS ON SEVERAL CARCINOGENIC PERSONAL HABITS AND HOUSEHOLD EXPOSURES (неопр.) (Press release). International Agency for Research on Cancer (IARC). — «November 2, 2009 ‐‐ IARC has updated the cancer assessments of several personal habits and household exposures that cause cancer, including tobacco, areca nut, alcohol, and household coal smoke. The update was conducted with the advice of 30 scientists from 10 countries who met at IARC in October 2009. [...] The Working Group concluded that acetaldehyde associated with alcohol consumption is carcinogenic to humans (Group 1) and confirmed the classification in Group 1 of alcohol consumption and of ethanol in alcoholic beverages.». Дата обращения 1 августа 2014.
- ↑ Chemical Summary For Acetaldehyde, US Environmental Protection Agency
- ↑ DNA and chromosome damage induced by acetaldehyde in human lymphocytes in vitro
- ↑ ^ Nicholas S. Aberle, II, Larry Burd, Bonnie H. Zhao and Jun Ren (2004). «Acetaldehyde-induced cardiac contractile dysfunction may be alleviated by vitamin В1 but not by vitamins B6 or B12». Alcohol & Alcoholism 39 (5): 450—454. doi:10.1093/alcalc/agh085.
- ↑ Nils Homann, Felix Stickel, Inke R. König, Arne Jacobs, Klaus Junghanns, Monika Benesova, Detlef Schuppan, Susanne Himsel, Ina Zuber-Jerger, Claus Hellerbrand, Dieter Ludwig, Wolfgang H. Caselmann, Helmut K. Seitz Alcohol dehydrogenase 1C*1 allele is a genetic marker for alcohol-associated cancer in heavy drinkers International Journal of Cancer Volume 118, Issue 8, Pages 1998—2002
- ↑ Климов А.Н., Иоффе Д.В., Будковская Н.Г. Уксусный алдегид // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1985. — Т. 26. Углекислые воды - Хлор. — 560 с. — 150 000 экз.
- ↑ Smoking. (2006). Encyclopædia Britannica. Accessed 27 Oct 2006.
- ↑ 1 2 NIOSH Pocket guide to chemical hazards / Michael E. Barsan (technical Editor). — NIOSH. — Cincinnati, Ohio, 2007. — С. 2. — 454 с. — (DHHS (NIOSH) Publication No. 2005-149).
- ↑ (Роспотребнадзор). № 206. Ацетальдегид // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» (рус.) / утверждены А.Ю. Поповой. — Москва, 2018. — С. 18. — 170 с. — (Санитарные правила).
- ↑ Pliska V. and G. Janicek. Die Veranderungen der Wahrnehmungsschwellen - Konzentration der Riechstoffe in Einiger Homologischen Serien (нем.) // Heymans Institute of Pharmacology Archives internationales de pharmacodynamie et de thérapie. — Gent (Belgium), 1960. — Vol. 156. — S. 211-216. — ISSN 0003-9780.
Химическая формула — Википедия
Материал из Википедии — свободной энциклопедии
Хими́ческая фо́рмула — условное обозначение химического состава и структуры соединений с помощью символов химических элементов, числовых и вспомогательных знаков (скобок, тире и т. п.). Химические формулы являются составной частью языка химии, на их основе составляются схемы и уравнения химических реакций, а также химическая классификация и номенклатура веществ[1]. Одним из первых начал использовать их русский химик А. А. Иовский.
Химическая формула может обозначать или отражать[1]:
Например, формула HNO3 обозначает:
- 1 молекулу азотной кислоты или 1 моль азотной кислоты;
- качественный состав: молекула азотной кислоты состоит из водорода, азота и кислорода;
- количественный состав: в состав молекулы азотной кислоты входят один атом водорода, один атом азота и три атома кислорода.
В настоящее время различают следующие виды химических формул:
- Простейшая формула. Может быть получена опытным путём через определение соотношения химических элементов в веществе с применением значений атомной массы элементов. Так, простейшая формула воды будет H2O, а простейшая формула бензола CH (в отличие от C6H6 — истинной, см. далее). Атомы в формулах обозначаются знаками химических элементов, а относительное их количество — числами в формате нижних индексов.[2]
- Истинная формула. Молекулярная формула[3] — может быть получена, если известна молекулярная масса[3] вещества. Истинная формула воды Н2О, что совпадает с простейшей. Истинная формула бензола С6Н6, что отличается от простейшей. Истинные формулы также называют брутто-формулами. Они отражают состав, но не структуру молекул вещества. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле. Этому количеству отвечает [нижний] индекс — маленькая цифра после символа соответствующего элемента. Если индекс равен 1, то есть в молекуле присутствует только один атом данного элемента, то такой индекс не указывают.
- Рациональная формула. В рациональных формулах выделяются группы атомов, характерные для классов химических соединений. Например, для спиртов выделяется группа -ОН. При записи рациональной формулы такие группы атомов заключаются в круглые скобки (ОН). Количество повторяющихся групп обозначаются числами в формате нижних индексов, которые ставятся сразу за закрывающей скобкой. Квадратные скобки применяются для отражения структуры комплексных соединений. Например, К4[Co(CN)6][4] — гексацианокобальтат калия. Рациональные формулы часто встречаются в полуразвернутом виде, когда часть одинаковых атомов показывается по отдельности для лучшего отражения строения молекулы вещества.
- Формула Маркуша представляют собой формулу, в которой выделяется активное ядро и некоторое количество вариантов заместителей, объединяемых в группу альтернативных структур. Она является удобным способом обозначения химических структур в обобщенном виде. Формула относится к описанию целого класса веществ. Использование «широких» формул Маркуша в химических патентах приводит к массе проблем и дискуссий.
- Эмпирическая формула. Разные авторы могут использовать этот термин для обозначения простейшей[5], истинной или рациональной[6] формулы.
- Структурная формула. В графическом виде показывает взаимное расположение атомов в молекуле. Химические связи между атомами обозначаются линиями (чёрточками). Различают двумерные (2D) и трёхмерные (3D) формулы. Двумерные представляют собой отражение структуры вещества на плоскости (также скелетная формула — попытки приблизить 3D-структуру на 2D-плоскости). Трёхмерные [пространственные модели] позволяют наиболее близко к теоретическим моделям строения вещества представлять его состав, и, зачастую (но не всегда), более полное (истинное) взаимное расположение атомов, угол связи и расстояния между атомами.
Например, для этанола:
- Простейшая формула: С2Н6О
- Истинная, эмпирическая, или брутто-формула: С2Н6О
- Рациональная формула: С2Н5ОН
- Рациональная формула в полуразвернутом виде: СН3СН2ОН
- Структурная формула (2D):
Н Н │ │ Н—С—С—О—Н │ │ Н Н
- Структурная формула (3D):
- Вариант 1:
- Вариант 2:
Простейшей формуле С2Н6О в равной мере может соответствовать и диметиловый эфир (рациональная формула; структурная изомерия): СН3—О—СН3.
Существуют и другие способы записи химических формул. Новые способы появились в конце 1980-х с развитием персональной компьютерной техники (SMILES, WLN, ROSDAL, SLN и др.). В персональных компьютерах для работы с химическими формулами также используются специальные программные средства, называемые молекулярными редакторами.
- ↑ 1 2 Основные понятия химии (неопр.) (недоступная ссылка). Дата обращения 23 ноября 2009. Архивировано 21 ноября 2009 года.
- ↑ Различают эмпирическую и истинную формулы. Эмпирическая формула выражает простейшую формулу вещества (химического соединения), которую устанавливают путём элементного анализа. Так, анализ показывает, что простейшая, или эмпирическая, формула некоторого соединения соответствует CH. Истинная формула показывает, какое количество таких простейших групп CH содержится в молекуле. Представим истинную формулу в виде (CH)x, тогда при значении x = 2 имеем ацетилен C2H2, при x= 6 — бензол C6H6.
- ↑ 1 2 Строго говоря, нельзя употреблять термины «молекулярная формула» и «молекулярная масса» соли, поскольку в солях нет молекул, а имеются только упорядоченные решётки, состоящие из ионов. Ни один из ионов натрия [катион] в структуре хлорида натрия не «принадлежит» какому-либо конкретному хлорид-иону [аниону]. Правильно говорить о химической формуле соли & соответствующей ей формульной массе. Поскольку химическая формула (истинная) хлорида натрия — NaCl, формульная масса хлорида натрия определяется как сумма атомных масс одного атома натрия и одного атома хлора: 1 атом натрия: 22,990 а. е. м.
1 атом хлора: 35,453 а. е. м.
———————————
Итого: 58,443 а. е. м.
Принято называть эту величину «молекулярной массой» хлорида натрия, и не возникает никаких недоразумений, если ясно отдавать себе отчёт, какую структуру имеет соль. Моль хлорида натрия имеет массу 58,443 г. В нём содержится 6,022·1023 ионов натрия и 6,022·1023 хлорид-ионов. Хотя они и не объединены попарно в молекулы, соотношение между числом тех и других ионов точно 1 : 1. - ↑ Формулы соединений ионного типа [и/или в предположении что они ионны — полярные ковалентные (промежуточные ионно-ковалентные)] выражают лишь простейшее соотношение между ионами (катионами и анионами). Так, кристалл поваренной соли NaCl состоит из ионов Na+ и Cl−, находящихся в соотношении 1:1, что обеспечивает электронейтральность соединения в целом. Рассуждая аналогично, отмечаем, что кристаллы CaF2 состоят из Ca2+ и F− в соотношении 1:2. Таким же образом К4[Co(CN)6] состоит из катионов К+ и [комплексных координационных] анионов Co(CN)64− в соотношении 4:1 (хотя данное соединение имеет более сложное координационно-комплексное кристаллическое строение). Аналогичным образом пирит FeS2 содержит катионы Fe2+ и анионы S22− в соотношении 1:1 (сульфид-анионов S2− оно не имеет; атомы серы в персульфид-анионе связаны относительно прочной ковалентной [неполярной ковалентной] связью).
В соединениях подобного типа нельзя обнаружить отдельные молекулы NaCl и CaF2, и поэтому эти формулы указывают лишь на соотношение катионов и анионов, из которых состоят эти вещества (хим. соединения). - ↑ М. А. Федоровская. Формула химическая // Химическая энциклопедия в 5 т.. — М.: Большая Российская Энциклопедия, 1998. — Т. 5. — С. 123. — 783 с.
- ↑ Справочник химика. — Л.: Химия, 1971. — Т. II. — С. 397. — 1168 с. — 20 000 экз.