Самый легкоплавкий металл в мире
Самый легкоплавкий металл в мире, его использование и стоимость
Каждый человек множество раз держал в руках самый легкоплавкий металл, причём без всяких последствий. Речь идет о ртути, грозном и загадочном элементе из подгруппы цинка, занимающем в периодической таблице атомный номер 80.
Общие сведения
Название переводится с греческого, как «серебряная вода». На латинском звучит как hydrargyrum, а в русском это толкование праславянского — «катиться». Первая цивилизация шумеров уже вовсю использовала ртуть. Металл добывали из киновари (сульфида ртути) просто обжигая руду, или же из пород, где его видно в виде небольших вкраплений.
Это редкий элемент — общая доля в земных недрах составляет всего 83 мг на одну тонну, причем чаще в рассеянной форме, чем в виде месторождений. Больше всего ее содержится в сульфидах и сланцах, а всего в мире имеется более 20 минералов со ртутью.
Самый легкоплавкий металл
Это единственный из металлов, который может находиться в жидком состоянии при обычной температуре. Такой же и бром, только он относится к галогенам. Твердеет ртуть (и плавится) при -39 °С.
Всего 7 металлов плавятся при минусовой температуре. Литр ртути очень тяжелый — 13,5 кг, а закипит она при +357°С.
Ртуть в природе
Интересно что доказательства ее принадлежности к металлам были опубликованы только в середине XVIII века Брауном и Ломоносовым. Они смогли заморозить ртуть и убедиться в ее металлических свойствах: ковкости, электропроводности, расширении при нагреве.
Ртути принадлежит высочайшая степень токсичности. Это самый ядовитый из всех нерадиоактивных элементов на планете, который начинает распространять свои пары при комнатной температуре. Если рядом присутствует человек, происходит поражение пищеварения, легких и нервной системы, причём первые признаки интоксикации наступают очень быстро, через 8 часов.
Симптомы отравления ртутью
И даже воздействие небольших доз, но длительный период, способно проявить себя в виде хронических заболеваний. Нервная система в первую очередь реагирует раздражением, недосыпанием, головными болями и быстрой усталостью. Выводится ртуть через почки. Начинаются частые позывы к мочеиспусканию, повышение температуры, рвота, слабость, тошнота, дрожь в теле.
Самая известная экологическая трагедия XX века, болезнь Минамата, вызвана отравлением метилртутью. Промышленное загрязнение бухты этого японского города в 1956 году привело к 3 тыс. жертв.
Люди всегда знали о токсических свойствах ртути. Например, при изготовлении фетровых шляп использовались ртутные соединения, но другого способа тогда не было. У мастеров часто развивались поражения нервной системы и слабоумие. Поэтому безумный Шляпник, описанный Льюисом Кэрроллом в «Алисе в стране чудес», совсем не выдуманный персонаж.
Безумный Шляпник из “Алисы в стране чудес”
В обычной жизни пищевые отравления грозят любителям морепродуктов. Ртуть содержится и растворяется в морской воде, накапливаясь в организмах его обитателей.
Симптомы хронического отравления часто встречаются в прибрежных районах по всему миру. Особенно страдают беременные и дети, у которых это основная пища. Умеренная олигофрения диагностируется там намного чаще, чем у тех групп, где морская рыба не является основным источником питания.
Болезнь Минамата
Хищники, поедая мелочь, сохраняют и приумножает отраву в своих организмах. У каждой четвертой выловленной рыбы содержание металла превышает допустимые пределы. Особенно много его в тунце и лобстере. Экологи бьют тревогу, а компании по производству рыбных продуктов открещиваются. И никакая тепловая обработка не делает мясо менее токсичным.
Несмотря на токсичность, человечество до сих пор не может отказаться от ртути.
Хорошая электропроводимость делает ее незаменимой в энергосберегающих лампах, паровых турбинах, вакуумных и диффузных насосах. Умение реагировать на малейшие колебания температуры и давления используется в барометрах и термометрах.
Ртутные градусники
Батарейки, энергосберегающие лампы, аккумуляторы, контакты выключателей — везде содержится этот высокоионизированный металл. В градуснике находится от 1 до 2 гр этого металла (в стандартных российских 1 гр). Но и эти несколько граммов полностью испарятся из помещения только в течение 20 лет. При концентрации менее 0,25 мг\м3 ртуть оседает в легких. При более высоких дозах организм начинает впитывать яд через кожу. Мужчины менее чувствительны к парам, чем дети и женщины.
Энергосберегающие лампы
Вы можете найти ртуть в холодильнике, стиральной машине и кондиционере. Сельское хозяйство чаще всего использует соли ртути в составе пестицидов. Взрывчатка содержит фульминат ртути, антисептики — сульфат.
Фульминат ртути (взрывчатое вещество)
Не могут отказаться от ртути при окрашивании бортов корабля. Морские микроорганизмы всегда селятся там и существенно разрушают обшивку. Только краска на основе «серебряной воды» помогает сохранить судно.
Покраска суднаЧеловечество с самых древних времен использовало ртуть для добычи из руды драгоценных металлов. Ртуть создает сплавы со всеми металлами (амальгамация) и только благодаря ей добыча серебра и золота в Мексике конкистадорами, начиная XVI века, достигла таких впечатляющих размеров и изменила весь мир.
Добыча золота ртутью
Никогда ртуть не транспортируют в самолетах, причем дело не в токсичности. Ртуть хорошо вступает в контакт со всеми металлами, делая их ломкими. Особенно это касается алюминиевых сплавов — случайная авария может повредить самолет.
Ядовитый металл чаще всего встречался в эликсирах бессмертия и лекарствах для продления жизни. Алхимики пробовали добывать золото прямо из ртути, только сначала ее надо было нагреть. Ртуть называли праматерью металлов, она входила в теорию трех начал (с серой и солью) и была основным элементом философского камня.
РтутьДаже магические действия шаманов не могли обойтись без ртути. Распыляемым порошком киновари отпугивали нечистых духов. Несмотря на токсичность, «серебряную воду» активно использовали древние врачи практически во всех сферах своей деятельности.
Древнеегипетские жрецы клали немного ртути в сосуд и помещали в горло фараона, чтобы обезопасить его в загробной жизни.
В Индии йоги пили ртутно-серный напиток и утверждали, что таким образом можно продлить жизнь. Одним из самых вопиющих случаев в древности было лечение заворота кишок с помощью данного химического элемента.
Врачи были уверены, что жидкое серебро должно замечательно проходить сквозь человеческие кишки, распрямляя их. Но данный способ почему-то не прижился, так как у пациентов от большого объема высокоплотного «лекарства» происходил разрыв желудка.
Утверждают, что Иван Грозный стал жертвой именно ртути. Предположительно, ему или лечили сифилис, или давали лекарства, содержащие ртуть. То, что русский царь умер в результате ртутной интоксикации и имел деформации костей, свойственные глубоким старикам, уже доказано несколькими учеными.
Иван ГрозныйИсторики отмечали, что перед смертью царь очень изменился. Постоянная свирепость, искаженные черты лица, на теле не осталось ни единого волоса. Постоянные эпилептические припадки служили очередным доказательством отравления.
Интересно, что мгновенно покончить с жизнью с помощью ртути ни у кого не получалось. Когда самоубийцы выпивали металл — все они выживали. Самыми опасными являются пары и раствор, а сама ртуть никогда не растворится в желудке и выйдет из организма.
В 70-х годах в продаже можно было встретить множество препаратов с ртутью: мочегонные, слабительные, в мазях для отбеливания лица и антисептиках.
Амальгама серебра не так давно была распространенным пломбировочным стоматологическим материалом в России и до сих пор используется в дешевых пломбах за рубежом.
Пломба из амальгамыСамый легкоплавкий металл на планете необходим человечеству по-прежнему. А вот смогут ли люди дружить с ним, не отравляя жизнь вокруг — очень спорный вопрос…
Металлы и сплавы - температуры плавления
Точка плавления - это температура, при которой вещество переходит из твердого состояния в жидкое.
Точки плавления для некоторых металлов и сплавов:
| Металл | Точка плавления ( o C) | |
|---|---|---|
| Адмиралтейство Латунь | 900 - 940 | |
| Алюминий | 660||
| Алюминиевый сплав | 463-671 | |
| Алюминий бронза | 1027-1038 | |
| Сурьма | 630 | |
| Баббит | 249 | |
Бериллий 0 | ||
| Висмут | 271.4 | |
| Латунь, красный | 1000 | |
| Латунь, желтый | 930 | |
| Кадмий | 321 | |
| Хром | 1860 | |
| Кобальт | 9959 | 1084 |
| Купроникель | 1170-1240 | |
| Золото, 24K чистое | 1063 | |
| Hastelloy C | 1320-1350 | |
| Инконель | 1390-1425 | 1390–1425 |
| Иридий | 2450 | |
| Кованое железо | 1482–1593 | |
| Железо, серое литье | 1127–1204 | |
| Ковкое железо | 1149 | |
| Свинец | 327.5 | |
| Магний | 650 | |
| Магниевый сплав | 349 - 649 | |
| Марганец | 1244 | |
| Марганцевая бронза | 865 - 890 | |
| Ртуть | -890 | |
| Молибден | 2620 | |
| Монель | 1300-1350 | |
| Никель | 1453 | |
| Ниобий (колумбий) | 2470 | |
| Осмий | 925824 0 Палладий 1555 | |
| Фосфор | 44 | |
| Платина | 1770 | |
| Плутоний | 640 | |
| Калий | 63.3 | |
| Красная латунь | 990-1025 | |
| Рений | 3186 | |
| Родий | 1965 | |
| Рутений | 2482 | |
| Селен | 924 | |
| Селен | 1411 | |
| Серебро, монета | 879 | |
| Серебро, чистое | 961 | |
| Серебро, стерлинговое | 893 | |
| Натрий | 97.83 | |
| Припой 50-50 | 215 | |
| Сталь углеродистая | 1425-1540 | |
| Сталь нержавеющая | 1510 | |
| Тантал | 2980 | |
| Торий | 1750 | |
| Олово | 232 | |
| Титан | 1670 | |
| Вольфрам | 3400 | |
| Уран | 1132 | |
| Ванадий | 1900 | |
| Цинк | 419.5 | |
| Цирконий | 1854 |
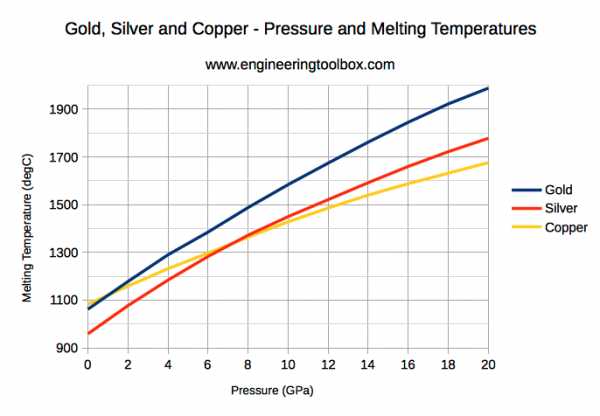
Золото, серебро и медь - давление и температура плавления
Точки плавления и кипения элементов Периодической таблицы
Точки плавления и кипения элементов Периодической таблицы Менделеева ХИМИЧЕСКАЯ ШКОЛАТемпературы плавления и кипения очень важны физические свойства в химии, когда мы изучаем элементы и соединения. Различные элементы и соединения имеют разные точки плавления и кипения. Из изучения значений плавления и точки кипения элементов, мы можем получить представление о структуре элементов, межмолекулярных силах между молекулы или атомы и многое другое.
В этом руководстве мы рассмотрим следующие разделы.
- Причины разной температуры плавления и кипения элементов и соединений
- Сравнение значений точек плавления и кипения каждой группы в периодической таблице с тенденциями
- Температуры плавления и кипения органические соединения
- Сравнение точек плавления и кипения различных элементов и соединений в блоках s, p и d
Автор: Хешан Нипуна, дата обновления: 2020/01/05
Температуры плавления и кипения элементов
Вариации точек плавления и кипения неясны (не имеют единообразного рисунка) по всей таблице Менделеева (это означает, что мы не всегда можем видеть подобную тенденцию.Вы поймете это, когда закончите читать это руководство).
Но мы видим, что некоторые элементы имеют более высокие температуры плавления и кипения, а некоторые - меньше. В В первой части этого урока мы изучаем точки плавления и кипения s, p, d блокирует элементы и их соединения, а затем - органические соединения.
IVA th элементы группы (углерод и кремний) показывают высокие температуры плавления и кипения в секунду и третьи периоды соответственно, потому что они имеют ковалентных гигантских решеток структур.
Температуры плавления и кипения за период
В первых трех периодах наблюдается четкая вариация точек плавления и кипения (имеет четкую тенденцию). Плавление и точки кипения увеличиваются до IVA группы с при движении слева направо. (Например, от натрия к аргону в третьем периоде). Группа IVA имеет элемент с наивысшей температурой плавления и кипения. Затем начинает снижаться температура плавления и кипения от группы VA к благородным газам (VIIIA).
Почему разные элементы и соединения имеют разные точки плавления и кипения?
Есть много причин для воздействия на точки плавления и кипения элементов и соединений. Одна или несколько вещей могут эффект до точек плавления и кипения.
- Молекулярная масса - при увеличении молекулярной массы возможно увеличение плавления и кипения точка тоже высока.
- Межмолекулярные силы , такие как водородные связи, силы диполь-дипольного притяжения, силы Ван-дер-Ваальса между атомами или молекулами.Когда межмолекулярные силы становятся сильнее, это также увеличивает температуры плавления и кипения. элементов и соединений.
- Металлическая решетка (важно для определения температуры плавления металлов , таких как натрий, магний и др. металлические элементы)
- Ионная решетка - В ионных соединениях, таких как NaCl, CaF 2 , MgO, существует ионная решетка. Согласно прочность ионной решетки, температуры плавления и кипения могут различаться.
Элементы с самыми низкими температурами плавления и кипения за период
Инертные газы имеют элемент с самыми низкими температурами плавления и кипения за период, потому что их форма только ван-дер-ваальсова силы - они очень слабые, чтобы образовать сильную межмолекулярную силу между атомами.
Тенденции групп точек плавления и кипения таблицы Менделеева
Теперь мы собираемся узнать о том, как точки плавления и кипения элементов различаются в группах, рассматривая каждый группа отдельно.
Значения точек плавления и кипения s-блока
БлокS содержит группу IA и группу IIA, и большинство элементов из них являются металлами без водород. (водород имеет как свойства щелочного металла, так и свойства галогена.)
Щелочные металлы, температура плавления и кипения
Щелочные металлы (Li, Na, K, Rb, Cs): мягкие и имеют низкие температуры плавления и кипения.Щелочные металлы имеют только один валентный электрон на атом металла и, следовательно, энергия, связывающая атомы в кристаллической решетке металла, мала. Следовательно, металлические связи в этих металлах не очень сильно. Таким образом, температуры плавления и кипения снижаются при переходе от лития к цезию.
Водород
- Температура плавления: -259,2 0 C
- Точка кипения: -252,9 0 C
Температуры плавления и кипения щелочноземельных металлов
Щелочноземельные металлы (Be, Mg, Ca, Sr, Ba, Ra) имеют низкие температуры плавления и кипения по сравнению с металлами d-блока.Но их температуры плавления и кипения выше, чем у соответствующих щелочных металлов за тот же период из-за сравнительно меньший размер. Но точки плавления и кипения не показывают регулярных тенденций в щелочноземельных металлах. группа.
Почему щелочные металлы имеют более низкую температуру плавления, чем щелочноземельные металлы?
И щелочные, и щелочноземельные металлы находятся в блоке s. Мы знаем, что щелочные металлы имеют всего одного валентного электрона на атом металла.
Но щелочноземельные металлы имеют двух валентных электронов по на атом металла.
Также щелочноземельные металлы имеют меньший размер, чем щелочные металлы.
Когда количество валентных электронов в решетке увеличивается до , металлическая связь становится прочной. Также, когда атомный радиус уменьшается, металлическая связь стать сильным. Также поэтому металлические связи щелочноземельных металлов намного сильнее щелочных металлов.
Следовательно, температуры плавления и кипения щелочных металлов ниже, чем температуры плавления и кипения щелочноземельных металлов
Почему бериллий имеет более высокую температуру плавления и кипения, чем другой член второй группы?
Бериллий - атом наименьшего размера из элементов группы 2. Таким образом, его ионная решетка сильнее, чем у других щелочных земные металлы.
Температура плавления и кипения элементов p-блока
Теперь поговорим об изменении температур плавления и кипения p-блочных элементов.
В p-блоке есть различные типы элементов, включая металлы, неметаллы, и их физические состояния также очень другой. При комнатной температуре некоторые из них находятся в твердом состоянии, а некоторые - в газообразном. Бром тоже находится в жидком состоянии.
БлокP содержит элемент с самой высокой температурой плавления (углерод) и элемент с самой низкой точкой плавления таблица Менделеева (гелий).
Теперь посмотрим на температуры плавления и кипения p-блочных элементов от группы 13 до группы 18.
Галогены и инертные газы точки плавления и кипения
Галогены и благородные газы находятся в блоке p периодической таблицы. Галогены существуют в виде двухатомных молекул, таких как F 2 , Cl 2 , Br 2 , I 2 и благородные газы существуют в виде одноатомных молекул.
При понижении каждой группы молекулярная масса увеличивается, что может быть причиной более высоких точек плавления и кипения.Кроме того, все молекулы галогена и инертного газа образуют только силы Ван-дер-Ваальса, которые являются самыми слабыми межмолекулярными силами и не сильно влияет на плавление и кипение галогенов и благородных газов. Молекулярные массы молекул имеют Наибольшее влияние на повышение температуры плавления и кипения. Итак, точки плавления и кипения как галогена, так и инертных газов увеличиваются по группе.
Температуры кипения и плавления элементов 13 группы
Бор, алюминий, галлий, индий, таллий - элементы группы 13.Понижаются точки плавления и кипения при движении вниз по группе. Однако снижение температуры плавления не такое регулярное, как точек кипения. Галлий имеет очень низкую температуру плавления (303К).
Температуры плавления и кипения элементов 14 группы
Атомы этой группы образуют ковалентные связи друг с другом, и поэтому между их атомами в обоих случаях существуют сильные силы связи. твердое и жидкое состояния.
Температуры плавления и кипения элементов 14-й группы намного выше, чем элементов 13-й группы.
При движении вниз по группе, температура плавления и кипения снижается.
Углерод (алмаз как аллотроп углерода) имеет самую высокую температуру плавления и температуру кипения между 14 группой. элементы.
Группа 15 элементов точки плавления и кипения
- Азот имеет самую низкую температуру плавления точка и температура кипения.
- Сурьма имеет самую высокую температуру плавления и кипения.
Группа 16 элементов температуры плавления и кипения
- Кислород имеет самую низкую температуру плавления и кипения.
- Теллур (Те) имеет самую высокую температуру плавления и кипения.
Точки кипения группы 17
Температура кипения увеличивается при переходе от фтора к йод.
Температуры плавления и кипения 3d-металлов
Температуры плавления и кипения 3-х металлов обычно выше, чем s блочных элементов.
Ванадий имеет самую высокую температуру плавления и цинк имеет самую низкую температуру плавления.
Но температуры плавления и кипения не имеют регулярных тенденций.
Почему цинк имеет самую низкую температуру плавления среди металлов серии 3d?
Цинк имеет конфигурацию стабильных электронов , 3d 10 4s 2 .Следовательно, цинк не имеет большого значения. электроны к металлической решетке, как и другие 3d-металлы. Следовательно, прочность металлической решетки ниже, чем у других 3d-металлов. решетки. Таким образом, цинк имеет самую низкую температуру плавления в серии 3D-металлов.
Падение температуры плавления марганца
Конфигурация электронов марганца 3d 5 4s 2 . Эта конфигурация электронов имеет некоторую стабильность потому что все пять d-орбит наполовину заполнены (каждая d-орбита имеет один электрон.) Итак, вклад электронов в металлическая решетка ограничена марганцем. Поэтому решетка не очень прочная. Вот почему марганец внезапное падение температуры плавления.
Точки плавления и кипения соединений
Температуры плавления и кипения галогенидов щелочных металлов
Плавка и кипения точек щелочного металла галогениды уменьшается с увеличением атомной массы галогенидов как:
F - > Cl - > Br - > I -
Пример: температура плавления NaCl выше, чем у NaBr
Для данного галогенид-иона точки плавления и кипения LiX всегда ниже, чем у NaX.
Температуры плавления и кипения органических соединений
На сегодняшний день учеными всего мира открыты тысячи органических соединений. Открывая множество соединений, родилась органическая химия. В этой главе мы собираемся обсудить температуры плавления и кипения органических соединений.
Температуры кипения этана (алкана) и этановая кислота (карбоновая кислота) перечислены ниже, и это два разных типа органических соединений.
- Метан (CH 4 ): -161,5 0 C
- Этановая кислота (CH 3 COOH): 118,1 0 C
Следующие факты важны при изучении значений температуры плавления и кипения органических соединений.
- Относительная молекулярная масса
- Диполь-дипольные взаимодействия
- Способность образовывать водородные связи
- Структура углеродной цепи
Температура плавления и кипения алканов, алкенов, алкинов
- Алканы - неполярные молекулы.Между молекулами алканов действуют только силы Ван-дер-Ваальса. Когда относительная молекулярная масса увеличивается в алкане соединения, значения точек плавления и кипения также увеличиваются.
- Повышает температуру плавления и кипения алкана, алкена, алкины соответственно.
Рассмотрим этан, этен, этин
этин (соединение алкина) имеет самую высокую температуру плавления и кипения.
Когда количество водородных связей и прочность водородных связей увеличивается, температуры плавления и кипения повышаются.
Спирты, альдегиды, кетоны и карбоновые кислоты
- Все спирты и карбоновые кислоты может образовывать водородные связи.
- Карбоновые кислоты образуют самые прочные и самые высокие среди них водородные связи.
- Итак, карбоновые кислоты имеют самые высокие температуры плавления и кипения.
- Диполь-дипольные взаимодействия между Молекулы альдегидов и кетонов менее прочны, чем водородные связи в спиртах.
- Следовательно, температуры плавления и кипения спиртов выше, чем у альдегидов и кетонов.
Точки плавления и кипения алкилгалогенидных соединений
Атом галогена более отрицателен, чем атом углерода. Итак, связь C-X поляризована. Между алкилгалогенидными соединениями существует диполь-дипольное взаимодействие.Эти взаимодействия намного сильнее, чем межмолекулярные силы между алканами,
Точки плавления и кипения алкилгалогенидных соединений намного выше, чем у алканов.
Когда относительная молекулярная масса органического соединения увеличивается, температуры плавления и кипения также увеличиваются.
Теперь мы обсудим некоторые проблемы, сравнивая различные элементы и соединения, которые имеют разные точки плавления и кипения. Эти проблемы очень важны на экзаменах.Внимательно их изучите.
Температура плавления металлов p-блока выше, чем s-блока?
Сначала мы посмотрим, что такое металлы p-блока и какие металлы s-блока. Вы знаете, когда мы обсуждаем Что касается температур плавления металлов, так важна их металлическая решетка. Итак, теперь вы знаете, что мы должны узнать сравнить температуры плавления металлов p-блока и металлов s-блока.
Когда металлическая решетка металла прочна, этот металл с большой вероятностью имеет более высокую температуру плавления.
В качестве примера для сравнения взяты два металла, натрий и алюминий. Натрий - металлический блок, а алюминий - п блок металлический. Но оба находятся в 3-м периоде таблицы Менделеева.
За счет выделения трех электронов и меньшего радиуса металлическая решетка алюминия намного прочнее натрия. Таким образом, температура плавления алюминия выше, чем у натрия.
Почему элементы d-блока имеют более высокие температуры плавления, чем элементы s-блока?
d блочных элементов могут внести больше электронов в металлическую решетку.Например, ванадий может внести 5 электронов.
Но элементы блока s могут вносить только один или два электрона. Щелочные металлы могут иметь один электрон, а щелочноземельные металлы - два. электроны.
Добавление большего количества электронов в металлическую решетку увеличит прочность металлических связей.
Из-за более прочных металлических связей элементы d-блока имеют более высокие значения плавления.
Почему H 2 S имеет меньшую температуру кипения, чем H 2 O
H 2 S точка кипения: -60 0 C
H 2 O точка кипения: 100 0 C
- При комнатной температуре сероводород (H 2 S) представляет собой газ.Но вода (H 2 O) - жидкость. Это говорит нам H 2 S имеет меньшую температуру кипения.
- H 2 S и H 2 O представляют собой молекулы изогнутой формы.
- O и S - элементы группы VIA.
- Молекулярная масса H 2 S = 34 и молекулярная масса H 2 O = 18. Молекулярная масса H 2 S больше чем Н 2 О .
- Но, между молекулами H 2 O существует сильных водородных связей . H 2 Молекулы S имеют только слабых диполь-дипольные взаимодействия .
Водородные связи в H 2 O
- Из-за наличия сильных водородных связей в молекулах H 2 O, H 2 O имеет более высокую температуру кипения, чем H 2 S , хотя H 2 S имеет большую молекулярную массу.
у какого атома самая высокая температура плавления / кипения между Cs и W?
Вольфрам (W) имеет самую высокую температуру плавления из всех металлов. Цезий (Cs) - мягкий металл с очень низкой температурой плавления (28 0 ° C).
Какой металл имеет самую высокую температуру плавления?
Вольфрам (Вт). Из металлов вольфрам имеет самую высокую температуру плавления в периодической таблице. Он расположен в блоке D. 3422 0 C - температура плавления вольфрама.
Какой металл блока имеет самую высокую температуру плавления?
Бериллий имеет самую высокую температуру плавления из блочных металлов. Это около 1,287 0 C
точки кипения и плавления группы порядка 1а
Li> Na> K> Rb> Cs> Fr> H
Литий имеет самую высокую температуру плавления и кипения, а водород - самую низкую в группе IA.Водород существует в виде газа при комнатной температуре, а франций - в жидком состоянии при комнатной температуре. Все остальные материалы группы IA являются твердыми при комнатной температуре.
Самая низкая температура плавления металлических элементов
Ртуть (Hg) имеет самую низкую температуру плавления (-38,83 0 C), потому что ртуть имеет очень слабую металлическую решетку.
Какой элемент имеет самую низкую температуру плавления в периодической таблице Менделеева
Гелий (He) - это элемент с самой низкой температурой плавления (-272.2 0 С). Гелий существует в виде атомов. Он не образует соединений и не создает межмолекулярных сил между атомами He. Также относительная молекулярная масса (1) очень низкая.
Остались вопросы? Спросите сейчас у нас и найдите ответ.
Что можно понять под температурами плавления и кипения элементов в периодической таблице?
Мы знаем, что элементы в периодической таблице находятся в твердом, жидком и газообразном состоянии.Межмолекулярные силы, относительная молекулярная масса являются факторами, которые определяют температуру плавления и кипения элемента.
Рассмотрим два металла. Один металл имеет очень высокую температуру плавления, чем другой. В металлах металлическая решетка является основным фактором, определяющим температуру плавления и кипения. Более прочная металлическая решетка имеет более высокую температуру плавления.
Мы можем понять межмолекулярные силы элементов, относительные молекулярные массы, изучая температуры плавления и кипения.
Каковы температуры плавления и кипения некоторых горючих газов?
Мы можем перечислить несколько горючих газов и их точки плавления и кипения.
Алканы легко воспламеняются. В качестве примера рассмотрим метан. Температуры плавления и кипения метана составляют -182,4 0 C и -161,5 0 C соответственно.
Почему разные элементы имеют разную температуру плавления?
Температура плавления зависит от их молекулярной массы и межмолекулярных сил между элементами или молекулами.Различные элементы имеют разную молекулярную массу и межмолекулярные силы. Таким образом, их значения температуры плавления отличаются от других элементов и соединений.
точки кипения и плавления, которые зависят от каких факторов?
Температура плавления и кипения зависит от типа элемента или соединения. Это объясняется ниже.
- Если рассматривать металлы, их температура плавления и кипения зависит от их металлической решетки. Если их металлическая решетка прочная, температура плавления и кипения увеличивается.
- Когда мы подходим к таким молекулам, как кислород, вода, благородные газы, их температура плавления и кипения зависит от их молекулярной массы и межмолекулярных сил.
- Температура плавления и кипения ионных соединений, таких как хлорид натрия, зависит от их ионной решетки.
Почему элементы группы IIA плавятся при более высоких температурах, чем элементы группы IA?
Металлические решетки металлов группы II намного прочнее металлов группы I, потому что элементы группы II отдают решетке два электрона.Поэтому металлы группы i плавятся при более высоких температурах.
почему температура кипения кальция больше, чем у калия?
Прочность решетки кальция выше, чем у калия, по двум причинам.
- Радиус кальция меньше, чем у калия.
- кальций может отдавать два электрона металлической решетке, в то время как калий может отдавать только один электрон.
По этим двум причинам металлическая решетка кальция намного больше, чем у калия.
, что имеет температуру плавления -219 0 ° C и точку кипения -183 0 ° C?
Кислород (O 2 )
Какие-либо их соединения не имеют температуры плавления?
Да. Есть. Некоторые соединения неустойчивы к нагреванию. При нагревании такое соединение они разлагаются на другое вещество.
Пример:
Карбонат никеля (NiCO 3 ) разлагается до NiO и CO 2 при нагревании.
Температура плавления Mg находится в блоке s?
Металлическая решетка магния намного прочнее натрия. Таким образом, температура плавления Mg выше, чем у Na.
что происходит с точкой плавления в блоке s
Если вы изучите блочные элементы в тот же период, вы увидите, что щелочноземельный металл (группа 2) имеет более высокую температуру плавления, чем щелочной металл (группа 1), потому что прочность решетки щелочноземельного металла выше, чем у щелочного металла.
почему некоторые элементы имеют высокую температуру плавления?
Когда некоторые элементы превосходят по некоторым свойствам, они имеют высокую температуру плавления.
В качестве примера можно рассмотреть металлы. Когда мы говорим о металлах, необходимо понимать металлическую решетку. Когда металлическая решетка прочная, этот металл имеет более высокую температуру плавления. Металлическая решетка натрия слабее магния. Следовательно, магний имеет более высокую температуру плавления, чем натрий.
В качестве другого примера взяты вода и сероводород.Вода образует водородные связи, которые представляют собой самый сильный тип межмолекулярных сил. Но сероводород не может образовывать водородные связи. Таким образом, вода имеет более высокую температуру плавления, а также температуру кипения.
Статьи по теме
Число окисления Элементы в периодической таблице Характеристики металлов в периодической таблице Почему составы имеют разные точки кипения? - Причины изменения температуры кипения O 2 , HBr, этанола Органическая химия и соединения Реакции и возникновение щелочных металлов Реакции и возникновение щелочноземельных металлов Неорганические химические реакции и возникновение .Новый сплав имеет самую высокую температуру плавления среди всех известных веществ.
Ученые изобрели новый материал с более высокой температурой плавления, чем любое другое известное вещество.
Экзотический сплав, представляющий собой комбинацию редкометалльного гафния, углерода и азота, начнет плавиться в жидкость только при температуре выше 4,126 ° C (7460 ° F), что составляет две трети температуры поверхности солнце.
Крайняя температура плавления делает металл кандидатом на создание реальной версии адамантия - почти нерушимого вымышленного металла, из которого сделаны когти Росомахи в комиксах «Люди Икс».

Ученые изобрели новый материал, который, по их словам, имеет самую высокую температуру плавления среди всех известных материалов. Они подсчитали, что он расплавится при температуре 4400 градусов Кельвина (4126 ° C). Это свойство сделало бы его сильным кандидатом на копирование вымышленного металлического адамантия, использованного для изготовления когтей Росомахи в Людях Икс, изображенных выше
Ученые разрабатывают новый материал с помощью компьютерного моделирования для расчета оптимального состава, который придает материалу рекордное плавление. точка.
Теперь исследователи надеются синтезировать материал и протестировать его свойства в лаборатории.
ХИМИЯ ВАЛИРИАНСКИХ СТАЛЬНЫХ МЕЧЕЙ В ИГРЕ ПРЕСТОНОВ
В «Игре престолов» секрет изготовления сверхлегких и сильных валирийских стальных мечей был утрачен с Гибелью Валирии.
Но, несмотря на его вымышленную основу, ученый исследовал, можно ли создать подобное оружие, используя добросовестную химию.
Изучая состав современной стали, методы сварки и оценивая все характеристики валирийской стали, он приходит к выводу, что это вовсе не сталь, а композит с металлической матрицей.
Выводы были сделаны материаловедом Райаном Конселлом в видеоролике для американского химического общества в Вашингтоне.
Он предполагает, что наилучшим возможным сочетанием могут быть материалы с металлическим каркасом, встроенным в керамику.
Г-н Конселл сказал: «Один из них может обеспечить все экстремальные характеристики, необходимые для валирийской стали.
'Титановый карбид кремния может подойти идеально.
'Он имеет прочность, вес и цвет, необходимые для валирийской стали, и если матрица не будет идеально однородной, на лезвии могут быть серые завитки.
Профессор Аксель ван де Валле, инженер из Университета Брауна, Род-Айленд, который руководил исследованием, сказал: «Преимущество начала с вычислительного подхода в том, что мы можем очень дешево попробовать множество различных комбинаций и найти те, которые могут быть стоит поэкспериментировать в лаборатории.
'Иначе стреляли бы в темноте. Теперь мы знаем, что у нас есть кое-что, что стоит попробовать ».
До тех пор, пока ученые не синтезируют новый сплав и не проверит его температуру плавления, рекорд по самой высокой температуре плавления будет оставаться у вещества, сделанного с использованием гафния, тантала и углерода (Hf-N-C), которое плавится при температуре 3526 ° C.
Исследователи рассчитали формулу для нового сплава (Hf-N-C), моделируя физические процессы, происходящие на атомном уровне при плавлении вещества.
Они начали с анализа свойств материала Hf-Ta-C, а затем искали соединения, которые могли бы улучшить их в дальнейшем.
Они обнаружили, что Hf-Ta-C сочетает в себе высокую теплоту плавления - энергию, поглощаемую или высвобождаемую при превращении из твердого тела в жидкость, - и небольшие различия в беспорядке атомов или энтропии в твердом или жидком состоянии.
Большинство металлов требуют высоких температур для плавления, поскольку они имеют стабильные молекулярные структуры, для разрушения которых требуется много энергии. Поведение атомов как жидкости также определяет эту температуру плавления.
Они обнаружили, что их сплав Hf-N-C будет поглощать такое же количество энергии при плавлении, но имеет меньшую разницу между энтропией между твердым телом и жидкостью.
Они пришли к выводу, что его температура плавления на 474 ° C выше, чем у Hf-Ta-C.
Профессор ван де Валле и доктор Циджун Хонг, которые также принимали участие в исследовании, говорят, что их исследования могут помочь в разработке новых типов теплозащитных экранов на космических кораблях или в газовых турбинах.
Новый материал будет сделан из редкометалльного гафния вместе с небольшими количествами углерода и азота, что даст ему указанную выше химическую формулу. Это будет иметь самую высокую температуру плавления, которую еще предстоит обнаружить.

Большинство металлов требует высоких температур для плавления, потому что они имеют стабильные молекулярные структуры, которые требуют много энергии для разрушения. Поведение атомов как жидкости также определяет эту температуру плавления. Выше показано изображение расплавленного металла на литейном заводе
. Однако они предупреждают, что точное использование Hf-N-C будет неясным, пока они не смогут проверить другие его свойства.Они работают с исследователями из Калифорнийского университета в Дэвисе, чтобы синтезировать это соединение.
Профессор ван де Валле добавил: Точка плавления - не единственное важное свойство [при применении в материалах.
'Вам необходимо принять во внимание такие вещи, как механические свойства, стойкость к окислению и многие другие свойства.
'Итак, принимая во внимание эти вещи, вы можете смешать с этим другие вещества, которые могут снизить температуру плавления.
'Но поскольку вы уже начали так высоко, у вас есть больше возможностей для настройки других свойств.Думаю, это дает людям представление о том, что можно сделать ».
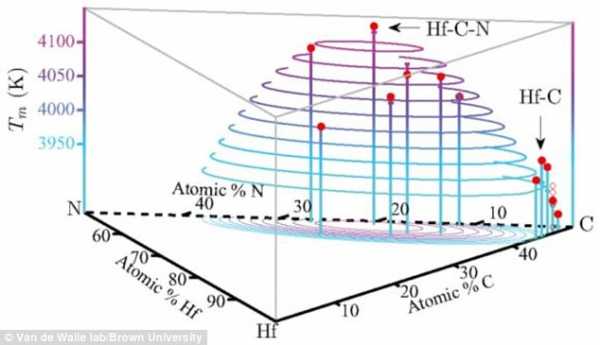
Соединения, изготовленные из гафния и углерода, имеют одни из самых высоких известных температур плавления, поэтому инженеры использовали компьютерное моделирование, чтобы вычислить, какие сплавы гафния будут иметь самую высокую температуру плавления из всех, выше
.Simple English Wikipedia, бесплатная энциклопедия
Некоторые химические элементы называются металлами . Это большинство элементов периодической таблицы. Эти элементы обычно обладают следующими свойствами:
- Они могут проводить электричество и тепло.
- Их легко сформировать.
- У них блестящий вид.
- Они имеют высокую температуру плавления.
Большинство металлов являются твердыми при комнатной температуре, но это не обязательно.Ртуть жидкая. Сплавы - это смеси, в которых хотя бы одна часть смеси представляет собой металл. Примеры металлов: алюминий, медь, железо, олово, золото, свинец, серебро, титан, уран и цинк. Хорошо известные сплавы включают бронзу и сталь.
Изучение металлов называется металлургией.
Признаки сходства металлов (свойства металлов) [изменить | изменить источник]
Большинство металлов твердые, блестящие, они кажутся тяжелыми и плавятся только при очень высоких температурах.Куски металла будут издавать звон колокольчика при ударе чего-то тяжелого (они звучные). Тепло и электричество могут легко проходить через металл (он проводящий). Кусок металла можно разбить на тонкий лист (он ковкий) или растянуть на тонкую проволоку (он пластичный). Металл трудно разорвать (у него высокая прочность на разрыв) или разбить (у него высокая прочность на сжатие). Если надавить на длинный тонкий кусок металла, он согнется, а не сломается (он эластичный). За исключением цезия, меди и золота, металлы имеют нейтральный серебристый цвет.
Не все металлы обладают этими свойствами. Ртуть, например, жидкая при комнатной температуре, свинец очень мягкий, а тепло и электричество не проходят через железо так, как через медь.
Мост в России металлический, вероятно, железный или стальной.Металлы очень полезны людям. Их используют для изготовления инструментов, потому что они могут быть прочными и легко поддающимися обработке. Из железа и стали строили мосты, здания или корабли.
Некоторые металлы используются для изготовления таких предметов, как монеты, потому что они твердые и не изнашиваются быстро.Например, медь (блестящая и красного цвета), алюминий (блестящая и белая), золото (желтая и блестящая), а также серебро и никель (также белые и блестящие).
Некоторые металлы, например сталь, можно сделать острыми и оставаться острыми, поэтому их можно использовать для изготовления ножей, топоров или бритв.
Редкие металлы высокой стоимости, такие как золото, серебро и платина, часто используются для изготовления ювелирных изделий. Металлы также используются для изготовления крепежа и шурупов. Кастрюли, используемые для приготовления пищи, могут быть сделаны из меди, алюминия, стали или железа.Свинец очень тяжелый и плотный, и его можно использовать в качестве балласта на лодках, чтобы не допустить их опрокидывания или защитить людей от ионизирующего излучения.
Многие изделия, сделанные из металлов, на самом деле могут быть сделаны из смесей по крайней мере одного металла с другими металлами или с неметаллами. Эти смеси называются сплавами. Некоторые распространенные сплавы:
Люди впервые начали делать вещи из металла более 9000 лет назад, когда они обнаружили, как получать медь из [] руды. Затем они научились делать более твердый сплав - бронзу, добавляя к ней олово.Около 3000 лет назад они открыли железо. Добавляя небольшое количество углерода в железо, они обнаружили, что из них можно получить особенно полезный сплав - сталь.
В химии металл - это слово, обозначающее группу химических элементов, обладающих определенными свойствами. Атомы металла легко теряют электрон и становятся положительными ионами или катионами. Таким образом, металлы не похожи на два других вида элементов - неметаллы и металлоиды. Большинство элементов периодической таблицы - металлы.
В периодической таблице мы можем провести зигзагообразную линию от элемента бора (символ B) до элемента полония (символ Po). Элементы, через которые проходит эта линия, - это металлоиды. Элементы, расположенные выше и справа от этой линии, являются неметаллами. Остальные элементы - это металлы.
Большинство свойств металлов обусловлено тем, что атомы в металле не очень крепко удерживают свои электроны. Каждый атом отделен от других тонким слоем валентных электронов.
Однако некоторые металлы отличаются. Примером может служить металлический натрий. Он мягкий, плавится при низкой температуре и настолько легкий, что плавает на воде. Однако людям не следует пробовать это, потому что еще одно свойство натрия состоит в том, что он взрывается при соприкосновении с водой.
Большинство металлов химически стабильны и не вступают в реакцию легко, но некоторые реагируют. Реактивными являются щелочные металлы, такие как натрий (символ Na) и щелочноземельные металлы, такие как кальций (символ Ca). Когда металлы действительно вступают в реакцию, они часто реагируют с кислородом.Оксиды металлов являются основными. Оксиды неметаллов кислые.
Соединения, в которых атомы металлов соединены с другими атомами, образуя молекулы, вероятно, являются наиболее распространенными веществами на Земле. Например, поваренная соль - это соединение натрия.
Кусок чистой меди, найденной как самородная медьСчитается, что использование металлов отличает людей от животных. До того, как стали использовать металлы, люди делали инструменты из камня, дерева и костей животных. Сейчас это называется каменным веком.
Никто не знает, когда был найден и использован первый металл. Вероятно, это была так называемая самородная медь, которую иногда находят большими кусками на земле. Люди научились делать из него медные инструменты и другие вещи, хотя для металла он довольно мягкий. Они научились плавке, чтобы получать медь из обычных руд. Когда медь плавили на огне, люди научились делать сплав под названием бронза, который намного тверже и прочнее меди. Из бронзы делали ножи и оружие.Это время в истории человечества примерно после 3300 г. до н.э. часто называют бронзовым веком, то есть временем бронзовых орудий и оружия.
Примерно в 1200 году до нашей эры некоторые люди научились делать железные орудия труда и оружие. Они были даже тверже и прочнее бронзы, и это было преимуществом на войне. Время железных инструментов и оружия теперь называется железным веком. . Металлы были очень важны в истории человечества и цивилизации. Железо и сталь сыграли важную роль в создании машин. Золото и серебро использовались как деньги, чтобы люди могли торговать, то есть обмениваться товарами и услугами на большие расстояния.
В астрономии металл - это любой элемент, кроме водорода или гелия. Это потому, что эти два элемента (а иногда и литий) - единственные, которые образуются вне звезд. В небе спектрометр может видеть признаки металлов и показывать астроному металлы в звезде.
В организме человека некоторые металлы являются важными питательными веществами, такими как железо, кобальт и цинк. Некоторые металлы могут быть безвредными, например рутений, серебро и индий. Некоторые металлы могут быть токсичными в больших количествах. Другие металлы, такие как кадмий, ртуть и свинец, очень ядовиты.Источники отравления металлами включают горнодобывающую промышленность, хвостохранилища, промышленные отходы, сельскохозяйственные стоки, профессиональные воздействия, краски и обработанную древесину.
.