Супероксиддисмутаза что это такое
Супероксиддисмутаза — Википедия
Материал из Википедии — свободной энциклопедии
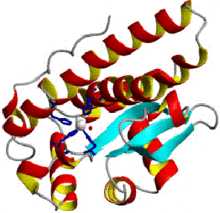 Структура митохондриальной супероксиддисмутазы человека
Структура митохондриальной супероксиддисмутазы человека Супероксиддисмутаза (СОД, КФ 1.15.1.1) относится к группе антиоксидантных ферментов. Вместе с каталазой и другими антиоксидантными ферментами она защищает организм человека от постоянно образующихся высокотоксичных кислородных радикалов. Супероксиддисмутаза катализирует дисмутацию супероксида в кислород и пероксид водорода. Таким образом, она играет важнейшую роль в антиоксидантной защите практически всех клеток, так или иначе находящихся в контакте с кислородом. Одним из редких исключений является молочнокислая бактерия Lactobacillus plantarum и родственные ей молочнокислые бактерии, использующие иной механизм защиты от образующегося супероксида.
Реакцию дисмутации супероксида, катализируемую супероксиддисмутазой, можно разбить на две части (парциальные реакции) следующим образом:
- M(n+1)+ − СОД + O2− → Mn+ − СОД + O2
- Mn+ − СОД + O2− + 2H+ → M(n+1)+ − СОД + H2O2.
где M (переходный металл) = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2).
В данной реакции окислительное состояние катиона металла осцилирует между n и n+1.
Введение[править | править код]
Существует несколько форм супероксиддисмутазы в зависимости от типа переходного металла-кофактора активного центра фермента: Cu,Zn-СОД (медь как кофактор активного центра и цинк как кофактор, стабилизирующий конформацию), Mn-СОД (с марганцем в активном центре), а также менее распространённые Fe-СОД (с железом)) и Ni-СОД (с никелем).
- Цитозоль практически всех эукариотических клеток содержит супероксиддисмутазу типа Cu,Zn-СОД. Это самая распространённая супероксиддисмутаза и единственная коммерчески доступная форма фермента (как правило выделенная либо из эритроцитов, либо из печени быка: PDB 1SXA, EC 1.15.1.1). Cu,Zn-СОД является гомодимером (то есть состоящим из двух одинаковых субъединиц), молекулярная масса 32,5 кДа. Субъединицы белка связаны друг с другом в первую очередь гидрофобными и электростатическими связями. Медь и цинк связаны с белковой частью молекулы через гистидиновые остатки.
- Митохондрии эукариотических клеток и многие бактерии содержат супероксиддисмутазу с Mn (Mn-СОД). Например, митохондриальная СОД человека: PDB 1N0J (недоступная ссылка), EC 1.15.1.1, молекулярная масса 86-88 кДа. Марганец в этом ферменте координирован с белком через 3 гистидина и аспартат и с водой либо гидроксильным лигандом в зависимости от окислительного состояния Mn (Mn(II) или Mn(III)).
- E. coli и многие другие бактерии содержат формы фермента с железом (Fe-СОД), другие — с марганцем (Mn-СОД), а некоторые — оба эти типа. (E. coli Fe-SOD: PDB 1ISA, EC 1.15.1.1). Активные центры Mn- и Fe-СОД содержат те же аминокислоты в боковых цепях.
Человек[править | править код]
В организме человека существует три типа СОД. СОД1 находится в цитоплазме, СОД2 — в митохондрии, а СОД3 — это внеклеточная (экстраклеточная) форма. Первая форма — димерная, тогда как вторая и третья формы — тетрамерные (состоящие из 4 равных субъединиц). СОД1 и СОД3 содержат медь в активном центре и цинк как структурный компонент, а СОД2 содержит марганец в активном центре. Гены этих форм локализуются соответственно в хромосомах 21, 6 и 4 (21q22.1, 6q25.3 и 4p15.3-p15.1). Цитозольная СОД1 является небольшим белком с молекулярной массой 32,5 кДа, молекулярная масса митохондриальной СОД2 — около 86-88 кДа. Экстраклеточная СОД3 представляет собой самую крупную супероксиддисмутазу, молекулярная масса — 135 кДа.
Супероксидный радикал (O2−) спонтанно довольно быстро дисмутирует в кислород O2 и пероксид водорода H2O2 (~105 M−1 s−1 при pH 7). Тем не менее, супероксид ещё быстрее реагирует с некоторыми другими молекулами-мишенями, такими как оксид азота NO, образуя при этом пероксинитрит. Однако супероксиддисмутаза обладает самой высокой известной каталитической скоростью реакции (~109 M−1 s−1). Реакция лимитирована только частотой столкновения супероксида с ферментом (т. н. диффузионно-лимитированная реакция), благодаря чему супероксиддисмутаза защищает клетку от повреждающего действия супероксида.
Супероксид является одним из основных прооксидантов в клетке, поэтому СОД играет одну из ключевых ролей в антиоксидантной защите организма. Роль этого фермента была показана экспериментально: мыши, у которых отсутствует митохондриальная СОД, выживают лишь несколько дней после рождения, так как у них развивается сильный окислительный стресс.
Мутации СОД1 у человека могут вызывать амиотрофический латеральный склероз, заболевание моторных нейронов. Механизм развития этого заболевания при этих мутациях, однако, не известен, так как ферментативная активность супероксиддисмутазы при этом не изменяется.
- A.V. Peskin, C.C. Winterbourn. A microtiter plate assay for superoxide dismutase using a water-soluble tetrazolium salt (WST-1) (англ.) // Clinica Chimica Acta (англ.)русск. : journal. — 2000. — Vol. 293. — P. 157—166.
- Campana, F. Topical superoxide dismutase reduces post-irradiation breast cancer ibrosis (англ.) // Journal of Cellular and Molecular Medicine (англ.)русск. : journal. — 2004. — Vol. 8, no. 1. — P. 109—116. Free text — PDF 333kB
- Li, Y.; Huang, T. T.; Carlson, E. J.; Melov, S.; Ursell, P. C.; Olson, J. L.; Noble, L. J.; Yoshimura, M. P.; Berger, C.; Chan, P. H.; et al. Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase. Nat. Genet. 11:376-381; 1995.
- Elchuri, S.; Oberley, T. D.; Qi, W.; Eisenstein, R. S.; Jackson Roberts, L.; Van Remmen, H.; Epstein, C. J.; Huang, T. T. CuZnSOD deficiency leads to persistent and widespread oxidative damage and hepatocarcinogenesis later in life. Oncogene 24:367-380; 2005.
- Muller, F. L.; Song, W.; Liu, Y.; Chaudhuri, A.; Pieke-Dahl, S.; Strong, R.; Huang, T. T.; Epstein, C. J.; Roberts, L. J., 2nd; Csete, M.; Faulkner, J. A.; Van Remmen, H. Absence of CuZn superoxide dismutase leads to elevated oxidative stress and acceleration of age-dependent skeletal muscle atrophy. Free Radic. Biol. Med. 40:1993-2004; 2006.
- Sentman, M. L.; Granstrom, M.; Jakobson, H.; Reaume, A.; Basu, S.; Marklund, S. L. Phenotypes of mice lacking extracellular superoxide dismutase and copper- and zinc-containing superoxide dismutase. J. Biol. Chem. 281:6904-6909; 2006.
Что такое супероксиддисмутаза? » Красота и здоровье

Как добавка супероксиддисмутазы используется для борьбы со свободными радикалами?
Супероксиддисмутаза (СОД), которая считается самым мощным антиоксидантом, который создает наш организм, - это фермент, который содержится почти во всех живых клетках.Супероксиддисмутаза - это энзим, который помогает расщеплять потенциально вредные молекулы кислорода в клетках, что может предотвратить повреждение тканей. Этот фермент сегодня исследуется, чтобы посмотреть, может ли он помочь при болезнях, где молекулы кислорода, как полагают, играют роль в возникновении или пролонгации болезни.
Польза для здоровья от супероксиддисмутазы
Как добавки супероксиддисмутазы используются для борьбы со свободными радикалами?Супероксиддисмутаза - это фермент, который естественным образом содержится в вашем организме. Добавка Супероксиддисмутазы, также доступная в виде пищевых добавок и инъекционных форм, способствует расщеплению свободных радикалов.
Добавки супероксиддисмутазы используются для лечения и профилактики ряда проблем со здоровьем и заболеваний. Эти добавки обычно изготавливаются из комбинации экстракта пшеницы и дыни.

Почему люди используют супероксиддисмутазу ради пользы для здоровья?
До настоящего времени исследования воздействия на здоровье добавок, содержащих супероксиддисмутазу, ограничены. Более того, есть некоторые доказательства того, что супероксиддисмутаза может не усваиваться организмом при приеме в форме добавок.В альтернативной медицине считается, что добавки супероксиддисмутазы защищают от следующих состояний:
Сообщается также, что супероксиддисмутаза замедляет процесс старения и устраняет признаки старения кожи. Тем не менее, нет достаточных доказательств в поддержку использования добавок СОД для всех этих целей.
Научные исследования позволили понять только некоторые преимущества супероксиддисмутазы для здоровья.
Предварительные исследования показывают, что супероксиддисмутаза является перспективной для лечения бокового амиотрофического склероза (также известного как болезнь Лу Герига), болезни Паркинсона, болезни Альцгеймера, катаракты и некоторых форм рака, согласно отчету, опубликованному в Medical Science Monitor в 2002 году. Однако в настоящее время отсутствуют клинические испытания, в которых проверяется использование супероксиддисмутазы для лечения этих состояний.
Есть также некоторые доказательства того, что прием супероксиддисмутазы в сочетании с глиадином (тип белка из пшеницы) может помочь защитить от повреждений, вызванных окислительным стрессом. Например, в предварительном исследовании, опубликованном в Phytotherapy Research в 2004 году, тесты на животных показали, что лечение комбинацией супероксиддисмутазы и глиадина может помочь повысить антиоксидантную активность.
Исследования воздействия на здоровье супероксиддисмутазы, вводимой внутривенно, включают доклад 1994 года, опубликованный в Circulation. В исследовании приняли участие 120 пациентов, которые недавно перенесли сердечный приступ. До проведения коронарной ангиопластики (процедура, используемая для открытия узких артерий в сердце) пациенты получали либо плацебо, либо инфузию супероксиддисмутазы. Результаты исследования показали, что супероксиддисмутаза не приводит к улучшению сердечной функции.
Возможные побочные эффекты супероксиддисмутазы?
Из-за отсутствия исследований мало что известно о безопасности длительного или регулярного использования добавок, содержащих супероксиддисмутазу.Инъекционная форма супероксиддисмутазы, используемая в научных исследованиях, представляется безопасной. Тем не менее, добавки СОД из животных источников вызывают обеспокоенность, поскольку они могут быть получены от больных или больных животных. Эксперты в области здравоохранения советуют потребителям избегать добавок из животных источников.
Кроме того, нет никаких данных о влиянии СОД на беременных или кормящих женщин, поэтому этим женщинам не рекомендуется использовать добавки.
Важно иметь в виду, что добавки не были проверены на безопасность, а пищевые добавки в основном не регулируются. В некоторых случаях продукт может доставлять дозы, которые отличаются от указанного количества для каждой травы. В других случаях продукт может быть загрязнен другими веществами, такими как металлы. Кроме того, безопасность добавок у беременных женщин, кормящих матерей, детей и тех, кто имеет заболевания или принимает лекарства, не была установлена.
Дозировка и подготовка супероксиддисмутазы?
Там не было достаточно научных исследований, чтобы установить соответствующую дозу супероксиддисмутазы. Правильная доза для вас может зависеть от таких факторов, как ваш возраст, пол и состояние здоровья. Лучше всего обратиться за советом к своему лечащему врачу для получения персональной консультации.Где в естественном виде содержится супероксиддисмутаза?
Исследование, опубликованное в Food Chemistry, указывает на то, что супероксиддисмутаза содержится во всех источниках свежей пищи. В обзоре специально рассматриваются шпинат, горох, помидоры, листья горчицы и другие источники. Тем не менее, многие потребители по-прежнему предпочитают дополнения.Добавки супероксиддисмутазы, доступные для покупки в Интернете, можно найти во многих магазинах натуральных продуктов и в магазинах, специализирующихся на пищевых добавках.
Но из-за отсутствия научных доказательств в поддержку добавок SOD, вы можете искать другой продукт. Ряд других природных средств может помочь защитить организм от повреждений, вызванных свободными радикалами. Например, исследования показывают, что такие вещества, как зеленый чай, ресвератрол, куркума, виноград, какао и антоцианы, могут помочь повысить антиоксидантную активность и бороться с окислительным стрессом. Кроме того, питательные вещества, такие как витамин С, витамин Е и бета-каротин, как известно, действуют как антиоксиданты.
Из-за ограниченных исследований слишком рано рекомендовать супероксиддисмутазу в качестве лечения любого заболевания. Важно отметить, что самостоятельное лечение состояния с помощью добавок супероксиддисмутазы и отказ от или откладывание стандартного ухода могут иметь серьезные последствия. Если вы планируете использовать его, обязательно проконсультируйтесь с вашим основным лечащим врачом.
Активность супероксиддисмутазы для коррекции состояний здоровья
Супероксиддисмутаза была названа самым важным антиоксидантом, который производится в организме. Активность супероксиддисмутазы (SOD, SOD) проявляется в борьбе со свободными радикалами и воспалением. Фактически, этот мощный фермент формирует передовую линию защиты от активных форм кислорода, которые приводят к повреждению клеток в организме.
Исследователи обнаружили связь между дефицитом супероксиддисмутазы и рядом патологий у людей и животных.
Поскольку мы естественным образом испытываем снижение уровня антиоксидантных ферментов с возрастом, использование добавок SOD может быть полезным при таких состояниях, как хроническое воспаление, нейродегенеративные заболевания и гипертония.
В статье мы рассмотрим – что такое супероксиддисмутаза, зачем она нужна организму и как активность супероксиддисмутазы помогает бороться с различными заболеваниями.
Что такое супероксиддисмутаза
Супероксиддисмутаза — это антиоксидантный фермент, который SODержится во всех живых клетках организма.
Для чего используется супероксиддисмутаза?
Фермент ускоряет химические реакции в организме и играет решающую роль в снижении окислительного стресса, связанного с образованием многих опасных для жизни заболеваний.
Формы супероксиддисмутазы можно разделить на четыре группы, включая медь-цинк-SOD, железо-SOD, марганцевую супероксиддисмутазу и никель-SOD. Эти формы антиоксидантного фермента распределены по всему организму в различных субклеточных компартментах.
Функция и активность супероксиддисмутазы зависит от формы и ее способности правильно усваиваться в организме. То, что известно как SOD1 и SOD2, встречается у людей и других млекопитающих, в то время как SOD также можно обнаружить у растений.
Ферменты катализируют превращение супероксида, который является активным видом кислорода, который вырабатывается во время аэробного дыхания, химической реакции, которая передает энергию нашим клеткам.
 Антиоксидантная активность супероксиддисмутазы позволяет ей бороться с воспалением
Антиоксидантная активность супероксиддисмутазы позволяет ей бороться с воспалениемПреимущества супероксиддисмутазы
Рассмотрим полезные свойства SOD для организма человека.
1. Уменьшает окислительный стресс
Когда уровень антиоксидантов в организме ниже, чем у свободных радикалов, мы сталкиваемся с серьезными проблемами со здоровьем. Это может произойти в результате неправильного питания, приема слишком большого количества токсинов и старения.
Нам действительно нужны свободные радикалы для правильной иммунной функции. Они естественным образом вырабатываются как побочные продукты клеточных реакций, вдыхая кислород и метаболизируя пищу, и вырабатываются печенью для детоксикации и уничтожения поврежденных клеток, бактерий и вирусов.
Проблема со свободными радикалами заключается в том, что они постоянно стремятся «реагировать» с клетками, чтобы украсть один из их электронов. Это приводит к тому, что клетки, которые до сих пор функционировали хорошо, нуждаются в недостающем электроне. Это создает цепную реакцию в организме и выработку еще большего количества свободных радикалов.
В конце концов, изобилие голодных электронов свободных радикалов может разрушить здоровые клетки и ткани, нанося вред и ускоряя старение с течением времени.
Это часто называют «окислительным стрессом», и это происходит, когда нарушается баланс антиоксидантов и свободных радикалов в организме. Когда уровень антиоксидантов становится слишком низким, уровень свободных радикалов увеличивается и причиняет вред.
Исследования показывают, что активность супероксиддисмутазы играет важную роль в антиоксидантной защите от окислительного стресса в организме.
Что SOD делает в организме?
Согласно International Journal of Health Sciences, этот фермент может использоваться в качестве фармацевтического средства при лечении различных заболеваний, возникающих в результате окислительного стресса. По словам исследователей, SOD известен как миметик на основе антиоксидантов, который может стать будущим терапии, направленной на окислительный стресс в химиопрофилактике.
2. Уменьшает воспаление
Фермент супероксиддисмутаза служит противовоспалительным средством. Исследование супероксиддисмутазы показывает обнадеживающие результаты ее применения в качестве терапевтического агента для человека при острых и хронических воспалительных состояниях, включая ожоги и раны.
Когда у пациентов с хроническим воспалением измеряли уровни SOD, их ферментативная активность была значительно ниже по сравнению со здоровыми людьми. Исследователи предлагают новые терапевтические возможности, которые направлены на антиоксидантные пути супероксиддисмутазы, так что провоспалительные реакции могут быть ограничены.
3. Снимает симптомы артрита
Исследование на животных, проведенное в Великобритании, показало, что снижение уровня SOD связано с самыми ранними стадиями остеоартрита. Показано, что энзим подавляется при остеоартрозе хряща как на модели человека, так и на мышах.
По мнению исследователей, это может быть связано с повышенным окислительным стрессом и снижением уровня SOD.
Другие исследования показали, что антиоксидантные свойства SOD и витамина Е играют противовоспалительную роль при экспериментально индуцированном артрите.
4. Помогает бороться с раком
Недавние исследования показывают, что существует значительная связь низкой активности внеклеточной супероксиддисмутазы с уменьшением выживаемости больных раком. Это говорит о том, что низкий уровень SOD способствует развитию внутренней среды, способствующей прогрессированию рака.
Исследование, опубликованное в Free Radical Biology & Medicine, указывает на то, что высокие уровни SOD ингибируют рост опухоли и метастазирование, что указывает на его роль в качестве супрессора опухоли.
Научный обзор, опубликованный в Antioxidants & Redox Signaling, предполагает, что биологически активная добавка на основе супероксиддисмутазы для профилактики рака дает еще одну возможность антиоксидантной терапии для профилактики рака. По словам исследователей, «новые механистические исследования показали, что SOD ингибирует не только онкогенную активность, но и последующие метаболические сдвиги во время раннего онкогенеза».
5. Повышает здоровье кожи
Крем с SOD и другие средства личной гигиены используются для уменьшения воздействия свободных радикалов на кожу и уменьшения признаков старения. Антиоксидантные эффекты SOD улучшают здоровье и внешний вид вашей кожи, и его часто используют для предотвращения морщин и возрастных пятен.
Также известно, что супероксиддисмутаза для ухода за кожей помогает заживлению ран, смягчает рубцовую ткань и защищает кожу от ультрафиолетовых лучей.
Возможные побочные эффекты супероксиддисмутазы
Необходимы дополнительные исследования, чтобы полностью понять потенциальные побочные эффекты активности супероксиддисмутазы, когда добавки используются для лечения определенных заболеваний. Некоторые исследователи выразили обеспокоенность по поводу риска потребления добавок SOD, полученных из животных источников, потому что животное может быть больным.
Некоторые слабые побочные эффекты, о которых сообщалось после внутривенного введения SOD, — это боль и раздражение в месте инъекции.
Препараты супероксиддисмутазы
Добавки супероксиддисмутазы используются для усиления защиты организма от свободных радикалов и воспалений, которые вызывают серьезные проблемы со здоровьем. Их можно принимать внутрь или в виде инъекций для борьбы с определенными состояниями, такими как остеоартрит, инфекции мочевого пузыря и повреждение легких.
Соответствующая дозировка супероксиддисмутазы зависит от состояния вашего здоровья, возраста и пола. Для получения наиболее точной информации о том, как использовать добавки SOD, обратитесь к врачу или нутрициологу.
Исследования показывают, что ежедневные или еженедельные внутривенные инъекции SOD колеблются от 8 до 80 мг, в зависимости от состояния, которое лечат. Клинические исследования также указывают на то, что доза супероксиддисмутазы из растений в дозе 50 мг может приниматься один раз в день в течение недели.
Вы можете найти комплекс добавок SOD, который содержит супероксиддисмутазу и другие супер антиоксиданты. Вы также можете найти добавку SOD без добавления других антиоксидантов.
Мы рекомендуем следующие варианты с iHerb.com
Jarrow Formulas, Супероксид Дисмутаза (SOD), 20 мг, 60 растительных капсул (профилактическая дозировка)
Bluebonnet Nutrition, Суперфрукты, вегетарианская форма супероксиддисмутазы (SOD), экстракт плодов дыни, 250 МЕ, 60 капсул в растительной оболочке (лечебная дозировка)
Life Extension, Endothelial Defense with GliSODin, 60 Vegetarian Capsules (комплекс антиоксидантов с SOD)
Для разработки индивидуальной программы оздоровления организма, в том числе с антиоксидантной поддержкой, рекомендуем обратиться к нам на Health-coaching.
Супероксиддисмутаза в продуктах питания
SOD содержится во многих источниках пищи. Лучшие продукты — источники супероксиддисмутазы включают в себя:
- Белокочанная капуста
- Брюссельская капуста
- Брокколи
- Горох
- Помидор
- Листья горчицы
- Шпинат
- Нектарин
- Мускусная дыня
- Нут
- Семена тыквы
- Кешью
- Фундук
Как повысить уровень SOD
Это нормально, когда уровни ферментов снижаются с возрастом, что может привести к дефициту супероксиддисмутазы. Это делает пожилых людей более уязвимыми для развития заболеваний, связанных с окислительным стрессом.
Есть несколько способов повысить уровень супероксиддисмутазы. Ваше тело вырабатывает антиоксидантный фермент естественным путем, но вы можете есть свежие источники SOD, чтобы повысить свой уровень, не полагаясь на добавки.
Если добавления продуктов – источников антиоксидантов в ваш рацион недостаточно, и вы используете SOD для борьбы с определенным состоянием здоровья, рекомендуется принимать SOD в виде добавки или инъекции.
Меры предосторожности
Важно проконсультироваться с врачом, прежде чем использовать добавки SOD для улучшения симптомов любого заболевания. Исследователи не уверены, что антиоксидантные ферменты из животных источников безопасны для регулярного и длительного потребления.
Также нет достаточных доказательств, чтобы рекомендовать SOD для женщин, которые беременны или кормят грудью, поэтому женщинам в этих обстоятельствах следует проявлять осторожность, если только ваш врач не рекомендует иное.
Заключительные мысли
- Супероксиддисмутаза — это фермент, который мы производим естественным путем в организме.
- Является ли супероксиддисмутаза антиоксидантом? Да!
- Активность супероксиддисмутазы позволяет бороться со свободными радикалами, повреждающими клетки. Полезные свойства супероксиддисмутазы также включают уменьшение воспаления, борьбу с раком, улучшение здоровья кожи и облегчение боли при артрите.
- Какие продукты содержат супероксиддисмутазу? Природные источники супероксиддисмутазы включают капусту, горох, брокколи и шпинат.
- Вы также можете принимать SOD в виде добавки к пище.
Вам также будет интересно:
Мы будем благодарны, если вы поделитесь этой статьей в социальных сетях!
Супероксиддисмутаза: фермент для борьбы с окислительным стрессом
Супероксиддисмутаза (Superoxide Dismutase)— это антиоксидантный фермент, присутствующий во всех живых клетках организма.
Для чего нужна супероксиддисмутаза?
Этот фермент ускоряет химические реакции в организме и играет важную роль в снижении окислительного стресса, связанного с развитием опасных для жизни заболеваний.
Формы супероксиддисмутазы можно разделить на четыре группы: медь-, цинк-содержащая супероксиддисмутаза; железо-содержащая супероксиддисмутаза; марганец-содержащая супероксиддисмутаза и никель-содержащая супероксиддисмутаза. Эти формы антиоксидантного фермента распределены по всему организму в различных субклеточных компартментах.
Функция супероксиддисмутазы (СОД) зависит от ее формы и способности правильно усваиваться в организме. Фермент, известный нам как СОД1 и СОД2 присутствует в организме человека и других млекопитающих, в то время как СОД также можно обнаружить и у растений.
Ферменты катализируют изменение супероксида, являющегося активной формой кислорода, вырабатываемой во время аэробного дыхания - химической реакции, которая передает энергию клеткам нашего организма.
Полезные свойства супероксиддисмутазы
Снижает окислительный стресс
Когда уровень антиоксидантов в организме ниже уровня свободных радикалов, начинаются серьезные проблемы со здоровьем. Такое может произойти в результате неправильного питания, воздействия чрезмерного количества токсинов и возрастных изменений.
Свободные радикалы нам все-таки необходимы для нормальной работы иммунной системы. Они естественным образом вырабатываются как побочные продукты клеточных реакций, вдыхания кислорода и метаболизма пищи. Кроме того, они вырабатываются печенью для детоксификации и разрушения поврежденных клеток, бактерий и вирусов.
Проблема свободных радикалов заключаются в том, что они постоянно стремятся «вступать в реакцию» с клетками, лишая их одного электрона. В результате у клетки, которая до этого нормально функционировала, появляется потребность вернуть утраченный электрон, что вызывает в организме цепную реакцию и приводит к выработке еще большего количества свободных радикалов.
В конце концов изобилие голодных до электронов свободных радикалов может привести к разрушению здоровых клеток и тканей, отрицательно сказываясь на здоровье организма и ускоряя естественные процессы старения.
Такое положение веществ чаще всего называют окислительным стрессом, возникающим в результате нарушения баланса антиоксидантов и свободных радикалов. Если уровень антиоксидантов слишком сильно понижается, уровень свободных радикалов возрастает, оказывая негативное воздействие на наше здоровье.
Исследования показывают, что супероксиддисмутаза играет важную роль в антиоксидантной защите от окислительного стресса. (1)
Какую функцию СОД выполняет в организме?
Согласно данным международного журнала «International Journal of Health Sciences» этот фермент может использоваться в качестве фармацевтического средства при лечении различных заболеваний, возникающих в результате окислительного стресса. По словам исследователей, СОД известна как миметик на основе антиоксидантов, который в будущем может использоваться в химиопрофилактике как терапия, направленная на окислительный стресс.
Снижает воспаление
Фермент супероксиддисмутазы является противовоспалительным средством. Исследования показали, что супероксиддисмутаза хорошо проявила себя в качестве терапевтического средства для пациентов с острыми и хроническими воспалительными состояниями, включая ожоги и раны.
Учеными было обнаружено, что по сравнению со здоровыми людьми, уровень ферментной активности СОД у пациентов с хроническим воспалением гораздо ниже. Ученые полагают, что антиоксидантные пути супероксиддисмутазы потенциально могут ограничивать провоспалительные реакции.
Облегчает симптомы артрита
Проведенное британскими учеными исследование на животных показало, что снижение уровня СОД связано с ранними стадиями остеоартрита. Было показано, что фермент подавляется при остеоартрозе хряща как у человека, так и у мыши. (2)
Ученые считают, что это может быть связанно с повышением уровня окислительного стресса и снижением уровня СОД.
Другие исследования показали, что антиоксидантные свойства СОД и витамина Е играют противовоспалительную роль при экспериментально индуцированном артрите.
Помогает в борьбе с раком
Недавние исследования выявили значительную связь низкой экспрессии внеклеточной супероксиддисмутазы с уменьшением выживаемости больных раком. Это дает основания полагать, что низкий уровень СОД поощряет развитие внутренней среды, способствующей прогрессированию рака.
Исследование, опубликованное в журнале «Free Radical Biology & Medicine», показало, что высокий уровень СОД ингибирует рост опухоли и развитие метастаз, что указывает на ее роль в качестве онкосупрессора. (3)
Согласно исследованию, опубликованному в журнале «Antioxidants & Redox Signaling», пищевые добавки супероксиддисмутазы для профилактики рака представляют собой еще одну возможность для профилактики рака на основе антиоксидантов. По словам ученых, «новые механистические исследования показали, что СОД ингибирует не только онкогенную активность, но и последующие метаболические сдвиги во время раннего онкогенеза». (4)
Улучшает здоровье кожи
Крема и прочие средства с супероксиддисмутазой используются для уменьшения вызванных свободными радикалами повреждений кожи и сокращения признаков старения. Антиоксидантный эффект СОД улучшает здоровье и внешний вид кожи. По этой причине данное средство часто используется для предотвращения появления морщин и пигментных пятен.
Также считается, что супероксиддисмутаза способствует заживлению ран, смягчает рубцовую ткань и защищает кожу от УФ-лучей.
Возможные побочные эффекты супероксиддисмутазы
Для того, чтобы в полной мере понять все потенциальные побочные эффекты добавок супероксиддисмутазы при приеме в рамках лечения того или иного состояния, требуется проведение большего количества исследований. Некоторые ученые выразили обеспокоенность относительно рисков, связанных с потреблением добавок СОД, изготовленных из животных источников, поскольку такие животные могут быть больны или заражены.
Некоторые слабые побочные эффекты, о которых сообщалось после внутривенного введения СОД, — это боль и раздражение в месте инъекции.
Дозировка и приготовление добавок супероксиддисмутазы
Добавки супероксиддисмутазы используются для повышения способности организма противостоять свободным радикалами и воспалению, которое является причиной множества серьезных заболеваний. Такие добавки могут приниматься перорально, либо в качестве инъекций при лечении различных заболеваний, включая остеоартрит, инфекции мочевого пузыря и повреждения легких.
Дозировка супероксиддисмутазы зависит от состояния здоровья, возраста и пола. Для получения более точной информации о приеме добавок СОД обратитесь к квалифицированному врачу.
Исследования показали, что ежедневный или еженедельный объем внутривенных инъекций СОД варьируется от 8 до 80 миллиграммов, в зависимости от состояния. Клинические исследования также указывают на то, что 500-миллиграмовая доза супероксиддисмутазы из растений может приниматься один раз в день в течение недели.
В прошлом добавки супероксиддисмутазы не приносили особой пользы для здоровья, поскольку, проходя через желудочно-кишечный тракт фермент деактивировался другими ферментами и кислотами. С тех пор ученые разработали новую биодоступную форму добавки, в которой фермент сочетается с защищающими его белками, полученными из пшеницы и других растительных источников.
Такие белки позволяют супероксиддисмутазе безопасно проходить через весь ЖКТ и попадать в кровоток.
Как и супероксиддисмутаза, каталаза является антиоксидантным ферментом, выводящим из организма перекись водорода, превращая ее в воду и кислород. Перекись водорода - это мощный окислитель, который делает каталазу еще одним чрезвычайно важным ферментом в снижении окислительного стресса и риска повреждения клеток.
Сегодня в магазинах доступны комплексные добавки СОД, сочетающие в себе супероксиддисмутазу, каталазу и прочие суперантиоксиданты. Также каталазу можно приобрести и в чистом виде.
Меры предосторожности
Перед началом приема СОД с целью облегчения симптомов какого-либо заболевания крайне важно проконсультироваться с квалифицированным специалистом. Исследователи не уверены в безопасности регулярного или длительного приема антиоксидантных ферментов из животных источников.
Также отсутствуют достаточные доказательства безвредности СОД для беременных или кормящих женщин.
Заключение
Супероксид дисмутаза (SOD) — это антиоксидантный фермент, естественным образом вырабатывающийся нашим организмом.
Часто ее используют за способность противостоять вызванным воздействием свободных радикалов клеточным повреждениям. Кроме того, супероксиддисмутаза снижает воспаление, помогает при борьбе с раком, улучшает здоровье кожи и облегчает боли при артрите.
В каких продуктах содержится супероксиддисмутаза? К натуральным источникам супероксиддисмутазы относят капусту, горох, брокколи и шпинат.
Также вы можете приобрести добавки СОД, либо получать инъекции этого вещества, но только под строгим контролем квалифицированного врача.
Изучить отзывы, а также купить cупероксиддисмутазу, можно в магазине iHerb.
- Этот абзац содержит рекламную ссылку. Вы получите от нас скидку при оформлении первого заказа, а магазин выплатит нам небольшой процент от прибыли с вашей покупки. Это позволяет вам сэкономить, а нам поддерживать работу сайта и редакции. Спасибо!
Супероксиддисмутаза - это... Что такое Супероксиддисмутаза?
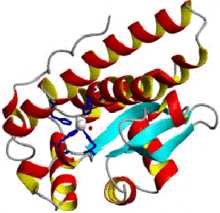 Структура митохондриальной супероксиддисмутазы человека
Структура митохондриальной супероксиддисмутазы человека супероксиддисмутаза 2, митохондриальная
Супероксиддисмутаза (СОД, КФ 1.15.1.1) относится к группе антиоксидантных ферментов. Вместе с каталазой и другими антиоксидантными ферментами она защищает организм человека от постоянно образующихся высокотоксичных кислородных радикалов. Супероксиддисмутаза катализирует дисмутацию супероксида в кислород и пероксид водорода. Таким образом, она играет важнейшую роль в антиоксидантной защите практически всех клеток, так или иначе находящихся в контакте с кислородом. Одним из редких исключений является молочнокислая бактерия Lactobacillus plantarum и родственные ей молочнокислые бактерии, использующие иной механизм защиты от образующегося супероксида.
Реакция
Реакцию дисмутации супероксида, катализируемую супероксиддисмутазой, можно разбить на две части (парциальные реакции) следующим образом:
- M(n+1)+ − СОД + O2− → Mn+ − СОД + O2
- Mn+ − СОД + O2− + 2H+ → M(n+1)+ − СОД + H2O2.
где M (переходный металл) = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2).
В данной реакции окислительное состояние катиона металла осцилирует между n и n+1.
Типы
Введение
Существует несколько форм супероксиддисмутазы в зависимости от типа переходного металла-кофактора активного центра фермента: Cu,Zn-СОД (медь как кофактор активного центра и цинк как кофактор, стабилизирующий конформацию), Mn-СОД (с марганцем в активном центре), а также менее распространённые Fe-СОД (с железом)) и Ni-СОД (с никелем).
- Цитозоль практически всех эукариотических клеток содержит супероксиддисмутазу типа Cu,Zn-СОД. Это самая распространённая супероксиддисмутаза и единственная коммерчески доступная форма фермента (как правило выделенная либо из эритроцитов, либо из печени быка: PDB 1SXA, EC 1.15.1.1). Cu,Zn-СОД является гомодимером (то есть состоящим из двух одинаковых субъединиц), молекулярная масса 32,5 кДа. Субъединицы белка связаны друг с другом в первую очередь гидрофобными и электростатическими связями. Медь и цинк связаны с белковой частью молекулы через гистидиновые остатки.
- Митохондрии эукариотических клеток и многие бактерии содержат супероксиддисмутазу с Mn (Mn-СОД). Например, митохондриальная СОД человека: PDB 1N0J, EC 1.15.1.1, молекулярная масса 86-88 кДа. Марганец в этом ферменте координирован с белком через 3 гистидина и аспартат и с водой либо гидроксильным лигандом в зависимости от окислительного состояния Mn (Mn(II) или Mn(III)).
- E. coli и многие другие бактерии содержат формы фермента с железом (Fe-СОД), другие — с марганцем (Mn-СОД), а некоторые — оба эти типа. (E. coli Fe-SOD: PDB 1ISA, EC 1.15.1.1). Активные центры Mn- и Fe-СОД содержат те же аминокислоты в боковых цепях.
Человек
В организме человека существует три типа СОД. СОД1 находится в цитоплазме, СОД2 — в митохондрии, а СОД3 — это внеклеточная (экстраклеточная) форма. Первая форма — димерная, тогда как вторая и третья формы — тетрамерные (состоящие из 4 равных субъединиц). СОД1 и СОД3 содержат медь в активном центре и цинк как структурный компонент, а СОД2 содержит марганец в активном центре. Гены этих форм локализуются соответственно в хромосомах 21, 6 и 4 (21q22.1, 6q25.3 и 4p15.3-p15.1). Цитозольная СОД1 является небольшим белком с молекулярной массой 32,5 кДа, молекулярная масса митохондриальной СОД2 — около 86-88 кДа. Экстраклеточная СОД3 представляет собой самую крупную супероксиддисмутазу, молекулярная масса — 135 кДа.
Биохимия
Супероксидный радикал (O2−) спонтанно довольно быстро дисмутирует в кислород O2 и пероксид водорода H2O2 (~105 M−1 s−1 при pH 7). Тем не менее, супероксид ещё быстрее реагирует с некоторыми другими молекулами-мишенями, такими как оксид азота NO, образуя при этом пероксинитрит. Однако, супероксиддисмутаза обладает самой высокой известной каталитической скоростью реакции (~109 M−1 s−1). Реакция лимитирована только частотой столкновения супероксида с ферментом (т. н. диффузионно-лимитированная реакция), благодаря чему супероксиддисмутаза защищает клетку от повреждающего действия супероксида.
Физиология
Супероксид является одним из основных прооксидантов в клетке, поэтому СОД играет одну из ключевых ролей в антиоксидантной защите организма. Роль этого фермента была показана экспериментально: мыши, у которых отсутствует митохондриальная СОД, выживают лишь несколько дней после рождения, так как у них развивается сильный оксидативный стресс.
Роль в патологии
Мутации СОД1 у человека могут вызывать амиотрофический латеральный склероз, заболевание моторных нейронов. Механизм развития этого заболевания при этих мутациях, однако, не известен, так как ферментативная активность супероксиддисмутазы при этом не изменяется.
Ссылки
- A.V. Peskin, C.C. Winterbourn (2000). «A microtiter plate assay for superoxide dismutase using a water-soluble tetrazolium salt (WST-1)». Clinica Chimica Acta 293: 157–166.
- Campana, F. (2004). «Topical superoxide dismutase reduces post-irradiation breast cancer ibrosis». J. Cell. Mol. Med. 8 (1): 109–116. Free text — PDF 333kB
- Li, Y.; Huang, T. T.; Carlson, E. J.; Melov, S.; Ursell, P. C.; Olson, J. L.; Noble, L. J.; Yoshimura, M. P.; Berger, C.; Chan, P. H.; et al. Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase. Nat. Genet. 11:376-381; 1995.
- Elchuri, S.; Oberley, T. D.; Qi, W.; Eisenstein, R. S.; Jackson Roberts, L.; Van Remmen, H.; Epstein, C. J.; Huang, T. T. CuZnSOD deficiency leads to persistent and widespread oxidative damage and hepatocarcinogenesis later in life. Oncogene 24:367-380; 2005.
- Muller, F. L.; Song, W.; Liu, Y.; Chaudhuri, A.; Pieke-Dahl, S.; Strong, R.; Huang, T. T.; Epstein, C. J.; Roberts, L. J., 2nd; Csete, M.; Faulkner, J. A.; Van Remmen, H. Absence of CuZn superoxide dismutase leads to elevated oxidative stress and acceleration of age-dependent skeletal muscle atrophy. Free Radic. Biol. Med. 40:1993-2004; 2006.
- Sentman, M. L.; Granstrom, M.; Jakobson, H.; Reaume, A.; Basu, S.; Marklund, S. L. Phenotypes of mice lacking extracellular superoxide dismutase and copper- and zinc-containing superoxide dismutase. J. Biol. Chem. 281:6904-6909; 2006.
См. также
Ссылки
Супероксиддисмутаза 3 — Википедия
Материал из Википедии — свободной энциклопедии
Супероксиддисмутаза 3 (СОД3, SOD3; внеклеточная супероксиддисмутаза, ВК-СОД, EC-SOD) — антиоксидантный фермент, одна из трёх супероксиддисмутаз человека, кодируемая геном SOD3. Как SOD1 и SOD2, этот фермент защищает организм от супероксид-анионов, катализируя их превращение в молекулярный кислород и пероксид водорода, однако местом его локализации является не цитозоль или митохондрии, а внеклеточное пространство.
Супероксиддисмутаза 3 была открыта в 1982 году.[1] Структурно она представляет собой гликопротеин-гомотетрамер массой около 30 килодальтон.
Содержание СОД3 в большинстве тканей очень небольшое и составляет 1—5 % от общего уровня супероксиддисмутаз, однако кровеносные сосуды, лёгкие, и, в меньшей степени, сердце, отличаются повышенной концентрацией СОД3.[2] В сосудистой системе СОД3 закрепляется за гепарансульфатные протеогликаны эпителия. При исследовании человеческого глаза отмечено высокое содержание СОД3 в роговице и склере.[3]
Показано, что производство СОД3 в фибробластах и мышечных клетках человека регулируется опосредованно — цитокинами и факторами роста, а не собственно окислительным стрессом.[4] По сообщениям одной группы исследователей, экспрессию СОД3 могут регулировать транскрипционные факторы sp1 и sp3.[5][6]
По данным исследований на животных, физические упражнения вызывают всплеск экспрессии SOD3.[7]
В одном исследовании, приём ингибиторов АПФ или антагонистов рецептора ангиотензина лицами с заболеванием коронарной артерии значительно повысил экспрессию СОД3.[8]
Кератоконус[править | править код]
По данным одного исследования, проведенного на участках роговицы, изъятых в ходе кератопластики, при кератоконусе уровень СОД3 снижен в центральной части роговицы примерно наполовину от нормы, даже если этот участок роговицы уже ранее был пересажен от человека, не страдавшего кератоконусом при жизни. При этом во всех роговицах СОД3 была распределена неравномерно, с минимумом концентрации в центре.[9] В одной статье отмечается, что уровни мРНК СОД3 при кератоконусе неизменны.[10] Еще в одной публикации сообщается о том, что культура кератоцитов (роговичных фибробластов), взятых из стромы роговиц, изъятых при кератопластике у больных кератоконусом, под воздействием провоспалительного цитокина интерлейкин 1 (альфа) демонстрирует продолжающееся снижение уровней СОД3. Контрольные культуры кератоцитов - из здоровых роговиц и роговиц, пораженных буллёзной кератопатией, напротив, постепенно усиливали производство СОД3 после первоначального падения уровней фермента при добавлении IL1-альфа.[11]
Роль полиморфизма ARG213GLY[править | править код]
В одном исследовании 1992 года у 6 % здоровых испытуемых было отмечено 10—15-кратное превышение уровней СОД3 в сыворотке над средним уровнем.[12] Позже такие группы были выявлены и в шведской,[13] и в японской популяциях;[14] при этом в КДНК была отмечена замена C->G в позиции 760 (однонуклеотидный полиморфизм ARG213GLY). В исследовании 2004 года этот полиморфизм оказался ассоциирован с повышенным (примерно в 1,5 раза) риском ишемической болезни сердца и ишемических церебрально-васкулярных заболеваний.[15] Это объясняют не ухудшенной ферментативной активностью, а сниженным связыванием СОД3R213G с поверхностью клеток, в том числе эндотелиальных: вариация изменяет структуру его гепарин-связывающего домена и соответственно способность закрепляться за гепарансульфатные протеогликаны.[16]
Исследования на животных[править | править код]
По данным одного исследования, трансгенные мыши с повышенной экспрессией SOD3 отличаются в пожилом возрасте улучшенной по сравнению с обычными мышами долговременной потенциацией в гиппокампе, лучше обучаются двигательным задачам в тестах, задействующих мозжечок, и ориентируются в пространстве. В юном возрасте у них были отмечены ухудшенные способности к контекстному обучению, но эти отличия несколько нивелировались по мере старения.[17]
Гомозиготный нокаут гена SOD3 не снижает ни продолжительности жизни мышей, ни их способности к воспроизведению.[18]:135
- ↑ Marklund S.L. Human copper-containing superoxide dismutase of high molecular weight (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1982. — December (vol. 79, no. 24). — P. 7634—7638. — PMID 6961438.
- ↑ Gongora M.C., Harrison D.G. Sad heart from no SOD (неопр.) // Hypertension. — 2008. — January (т. 51, № 1). — С. 28—30. — doi:10.1161/HYPERTENSIONAHA.107.101162. — PMID 18025292. (недоступная ссылка)
- ↑ Behndig A., Svensson B., Marklund S.L., Karlsson K. Superoxide dismutase isoenzymes in the human eye (неопр.) // Invest. Ophthalmol. Vis. Sci. (англ.)русск.. — 1998. — March (т. 39, № 3). — С. 471—475. — PMID 9501855.
- ↑ Strålin P., Marklund S.L. Effects of oxidative stress on expression of extracellular superoxide dismutase, CuZn-superoxide dismutase and Mn-superoxide dismutase in human dermal fibroblasts (неопр.) // Biochem. J. (англ.)русск.. — 1994. — March (т. 298 ( Pt 2)). — С. 347—352. — PMID 8135741.
- ↑ Zelko I.N., Folz R.J. Sp1 and Sp3 transcription factors mediate trichostatin A-induced and basal expression of extracellular superoxide dismutase (англ.) // Free Radic. Biol. Med. (англ.)русск. : journal. — 2004. — October (vol. 37, no. 8). — P. 1256—1271. — doi:10.1016/j.freeradbiomed.2004.06.022. — PMID 15451065.
- ↑ Zelko I.N., Mueller M.R., Folz R.J. Transcription factors sp1 and sp3 regulate expression of human extracellular superoxide dismutase in lung fibroblasts (англ.) // Am. J. Respir. Cell Mol. Biol. (англ.)русск. : journal. — 2008. — August (vol. 39, no. 2). — P. 243—251. — doi:10.1165/rcmb.2007-0378OC. — PMID 18314536.
- ↑ Hitomi Y., Watanabe S., Kizaki T., Sakurai T., Takemasa T., Haga S., Ookawara T., Suzuki K., Ohno H. Acute exercise increases expression of extracellular superoxide dismutase in skeletal muscle and the aorta (англ.) // Redox Rep. : journal. — 2008. — Vol. 13, no. 5. — P. 213—216. — doi:10.1179/135100008X308894. — PMID 18796240.
- ↑ Hornig B., Landmesser U., Kohler C., Ahlersmann D., Spiekermann S., Christoph A., Tatge H., Drexler H. Comparative effect of ace inhibition and angiotensin II type 1 receptor antagonism on bioavailability of nitric oxide in patients with coronary artery disease: role of superoxide dismutase (англ.) // Circulation : journal. — 2001. — February (vol. 103, no. 6). — P. 799—805. — PMID 11171786.
- ↑ Behndig A., Karlsson K., Johansson B.O., Brännström T., Marklund S.L. Superoxide dismutase isoenzymes in the normal and diseased human cornea (англ.) // Invest. Ophthalmol. Vis. Sci. (англ.)русск. : journal. — 2001. — September (vol. 42, no. 10). — P. 2293—2296. — PMID 11527942. (недоступная ссылка)
- ↑ Kenney M.C., Chwa M., Atilano S.R., Tran A., Carballo M., Saghizadeh M., Vasiliou V., Adachi W., Brown D.J. Increased levels of catalase and cathepsin V/L2 but decreased TIMP-1 in keratoconus corneas: evidence that oxidative stress plays a role in this disorder (англ.) // Invest. Ophthalmol. Vis. Sci. (англ.)русск. : journal. — 2005. — March (vol. 46, no. 3). — P. 823—832. — doi:10.1167/iovs.04-0549. — PMID 15728537.
- ↑ Olofsson E.M., Marklund S.L., Pedrosa-Domellöf F., Behndig A. Interleukin-1alpha downregulates extracellular-superoxide dismutase in human corneal keratoconus stromal cells (неопр.) // Mol. Vis. (англ.)русск.. — 2007. — Т. 13. — С. 1285—1290. — PMID 17679946.
- ↑ Adachi T., Ohta H., Yamada H., Futenma A., Kato K., Hirano K. Quantitative analysis of extracellular-superoxide dismutase in serum and urine by ELISA with monoclonal antibody (англ.) // Clin. Chim. Acta (англ.)русск. : journal. — 1992. — November (vol. 212, no. 3). — P. 89—102. — PMID 1477980.
- ↑ Sandström J., Nilsson P., Karlsson K., Marklund S.L. 10-fold increase in human plasma extracellular superoxide dismutase content caused by a mutation in heparin-binding domain (англ.) // Journal of Biological Chemistry : journal. — 1994. — July (vol. 269, no. 29). — P. 19163—19166. — PMID 8034674.
- ↑ Yamada H., Yamada Y., Adachi T., Goto H., Ogasawara N., Futenma A., Kitano M., Hirano K., Kato K. Molecular analysis of extracellular-superoxide dismutase gene associated with high level in serum (англ.) // Jpn. J. Hum. Genet. (англ.)русск. : journal. — 1995. — June (vol. 40, no. 2). — P. 177—184. — PMID 7662997.
- ↑ Juul K., Tybjaerg-Hansen A., Marklund S., Heegaard N.H., Steffensen R., Sillesen H., Jensen G., Nordestgaard B.G. Genetically reduced antioxidative protection and increased ischemic heart disease risk: The Copenhagen City Heart Study (англ.) // Circulation : journal. — 2004. — January (vol. 109, no. 1). — P. 59—65. — doi:10.1161/01.CIR.0000105720.28086.6C. — PMID 14662715.
- ↑ Heistad D.D. Oxidative stress and vascular disease: 2005 Duff lecture (англ.) // Arterioscler. Thromb. Vasc. Biol. (англ.)русск. : journal. — 2006. — April (vol. 26, no. 4). — P. 689—695. — doi:10.1161/01.ATV.0000203525.62147.28. — PMID 16410455. (недоступная ссылка)
- ↑ Hu D., Serrano F., Oury T.D., Klann E. Aging-dependent alterations in synaptic plasticity and memory in mice that overexpress extracellular superoxide dismutase (англ.) // J. Neurosci. (англ.)русск. : journal. — 2006. — April (vol. 26, no. 15). — P. 3933—3941. — doi:10.1523/JNEUROSCI.5566-05.2006. — PMID 16611809.
- ↑ Florian Muller; Satomi Miwa; Kenneth B. Beckman. Oxidative Stress in Aging: From Model Systems to Human Diseases (Aging Medicine) (англ.). — Totowa, NJ: Humana Press (англ.)русск., 2008. — ISBN 1-58829-991-0.
Супероксиддисмутаза — Википедия. Что такое Супероксиддисмутаза
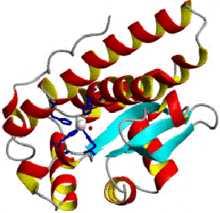 Структура митохондриальной супероксиддисмутазы человека
Структура митохондриальной супероксиддисмутазы человека Супероксиддисмутаза (СОД, КФ 1.15.1.1) относится к группе антиоксидантных ферментов. Вместе с каталазой и другими антиоксидантными ферментами она защищает организм человека от постоянно образующихся высокотоксичных кислородных радикалов. Супероксиддисмутаза катализирует дисмутацию супероксида в кислород и пероксид водорода. Таким образом, она играет важнейшую роль в антиоксидантной защите практически всех клеток, так или иначе находящихся в контакте с кислородом. Одним из редких исключений является молочнокислая бактерия Lactobacillus plantarum и родственные ей молочнокислые бактерии, использующие иной механизм защиты от образующегося супероксида.
Реакция
Реакцию дисмутации супероксида, катализируемую супероксиддисмутазой, можно разбить на две части (парциальные реакции) следующим образом:
- M(n+1)+ − СОД + O2− → Mn+ − СОД + O2
- Mn+ − СОД + O2− + 2H+ → M(n+1)+ − СОД + H2O2.
где M (переходный металл) = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2).
В данной реакции окислительное состояние катиона металла осцилирует между n и n+1.
Типы
Введение
Существует несколько форм супероксиддисмутазы в зависимости от типа переходного металла-кофактора активного центра фермента: Cu,Zn-СОД (медь как кофактор активного центра и цинк как кофактор, стабилизирующий конформацию), Mn-СОД (с марганцем в активном центре), а также менее распространённые Fe-СОД (с железом)) и Ni-СОД (с никелем).
- Цитозоль практически всех эукариотических клеток содержит супероксиддисмутазу типа Cu,Zn-СОД. Это самая распространённая супероксиддисмутаза и единственная коммерчески доступная форма фермента (как правило выделенная либо из эритроцитов, либо из печени быка: PDB 1SXA, EC 1.15.1.1). Cu,Zn-СОД является гомодимером (то есть состоящим из двух одинаковых субъединиц), молекулярная масса 32,5 кДа. Субъединицы белка связаны друг с другом в первую очередь гидрофобными и электростатическими связями. Медь и цинк связаны с белковой частью молекулы через гистидиновые остатки.
- Митохондрии эукариотических клеток и многие бактерии содержат супероксиддисмутазу с Mn (Mn-СОД). Например, митохондриальная СОД человека: PDB 1N0J, EC 1.15.1.1, молекулярная масса 86-88 кДа. Марганец в этом ферменте координирован с белком через 3 гистидина и аспартат и с водой либо гидроксильным лигандом в зависимости от окислительного состояния Mn (Mn(II) или Mn(III)).
- E. coli и многие другие бактерии содержат формы фермента с железом (Fe-СОД), другие — с марганцем (Mn-СОД), а некоторые — оба эти типа. (E. coli Fe-SOD: PDB 1ISA, EC 1.15.1.1). Активные центры Mn- и Fe-СОД содержат те же аминокислоты в боковых цепях.
Человек
В организме человека существует три типа СОД. СОД1 находится в цитоплазме, СОД2 — в митохондрии, а СОД3 — это внеклеточная (экстраклеточная) форма. Первая форма — димерная, тогда как вторая и третья формы — тетрамерные (состоящие из 4 равных субъединиц). СОД1 и СОД3 содержат медь в активном центре и цинк как структурный компонент, а СОД2 содержит марганец в активном центре. Гены этих форм локализуются соответственно в хромосомах 21, 6 и 4 (21q22.1, 6q25.3 и 4p15.3-p15.1). Цитозольная СОД1 является небольшим белком с молекулярной массой 32,5 кДа, молекулярная масса митохондриальной СОД2 — около 86-88 кДа. Экстраклеточная СОД3 представляет собой самую крупную супероксиддисмутазу, молекулярная масса — 135 кДа.
Биохимия
Супероксидный радикал (O2−) спонтанно довольно быстро дисмутирует в кислород O2 и пероксид водорода H2O2 (~105 M−1 s−1 при pH 7). Тем не менее, супероксид ещё быстрее реагирует с некоторыми другими молекулами-мишенями, такими как оксид азота NO, образуя при этом пероксинитрит. Однако, супероксиддисмутаза обладает самой высокой известной каталитической скоростью реакции (~109 M−1 s−1). Реакция лимитирована только частотой столкновения супероксида с ферментом (т. н. диффузионно-лимитированная реакция), благодаря чему супероксиддисмутаза защищает клетку от повреждающего действия супероксида.
Физиология
Супероксид является одним из основных прооксидантов в клетке, поэтому СОД играет одну из ключевых ролей в антиоксидантной защите организма. Роль этого фермента была показана экспериментально: мыши, у которых отсутствует митохондриальная СОД, выживают лишь несколько дней после рождения, так как у них развивается сильный оксидативный стресс.
Роль в патологии
Мутации СОД1 у человека могут вызывать амиотрофический латеральный склероз, заболевание моторных нейронов. Механизм развития этого заболевания при этих мутациях, однако, не известен, так как ферментативная активность супероксиддисмутазы при этом не изменяется.
Ссылки
- A.V. Peskin, C.C. Winterbourn (2000). «A microtiter plate assay for superoxide dismutase using a water-soluble tetrazolium salt (WST-1)». Clinica Chimica Acta 293: 157–166.
- Campana, F. (2004). «Topical superoxide dismutase reduces post-irradiation breast cancer ibrosis». J. Cell. Mol. Med. 8 (1): 109–116. Free text — PDF 333kB
- Li, Y.; Huang, T. T.; Carlson, E. J.; Melov, S.; Ursell, P. C.; Olson, J. L.; Noble, L. J.; Yoshimura, M. P.; Berger, C.; Chan, P. H.; et al. Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase. Nat. Genet. 11:376-381; 1995.
- Elchuri, S.; Oberley, T. D.; Qi, W.; Eisenstein, R. S.; Jackson Roberts, L.; Van Remmen, H.; Epstein, C. J.; Huang, T. T. CuZnSOD deficiency leads to persistent and widespread oxidative damage and hepatocarcinogenesis later in life. Oncogene 24:367-380; 2005.
- Muller, F. L.; Song, W.; Liu, Y.; Chaudhuri, A.; Pieke-Dahl, S.; Strong, R.; Huang, T. T.; Epstein, C. J.; Roberts, L. J., 2nd; Csete, M.; Faulkner, J. A.; Van Remmen, H. Absence of CuZn superoxide dismutase leads to elevated oxidative stress and acceleration of age-dependent skeletal muscle atrophy. Free Radic. Biol. Med. 40:1993-2004; 2006.
- Sentman, M. L.; Granstrom, M.; Jakobson, H.; Reaume, A.; Basu, S.; Marklund, S. L. Phenotypes of mice lacking extracellular superoxide dismutase and copper- and zinc-containing superoxide dismutase. J. Biol. Chem. 281:6904-6909; 2006.
См. также
Ссылки
Супероксиддисмутаза 1 - это... Что такое Супероксиддисмутаза 1?
супероксиддисмутаза 1, цитозольная
Супероксиддисмутаза 1 (СОД1, SOD1) — антиоксидантный фермент, одна из трёх супероксиддисмутаз человека, кодируемая геном SOD1. Фермент защищает внутриклеточное пространство от супероксид-анионов, катализируя их превращение в молекулярный кислород и пероксид водорода.
В активном центре СОД1 содержится атом меди. Кроме этого, для стабилизации структуры белка необходим цинк, поэтому эту супероксиддисмутазу часто обозначают Cu,Zn-SOD.
Альтернативный сплайсинг приводит к образованию пяти форм фермента, различающихся по своей локализации в организме.[1]
Животные модели
Мышь G93A (G93A mouse) является моделью бокового амиотрофического склероза.
Клиническое значение
От 15 % до 20 % случаев бокового амиотрофического склероза ассоциированы с мутациями гена SOD1[2].
Отмечены делеции в гене SOD1 в двух различных семьях с наследственным семейным кератоконусом[3][4].
В небольшом исследовании 18 семей с кератоконусом не было отмечено связи как с SOD1, так и с другим геном-кандидатом, VSX1. Не отмечено патогенных мутаций данных генов при кератоконусе и в крупном исследовании 2009 года[5], что может говорить о гетерогенности кератоконуса[6].
Примечания
- ↑ Hirano M, Hung WY, Cole N, Azim AC, Deng HX, Siddique T (September 2000). «Multiple transcripts of the human Cu,Zn superoxide dismutase gene». Biochem. Biophys. Res. Commun. 276 (1): 52–6. DOI:10.1006/bbrc.2000.3427. PMID 11006081.
- ↑ OMIM - AMYOTROPHIC LATERAL SCLEROSIS 1; ALS1. — информация в базе данных OMIM
- ↑ Udar N, Atilano SR, Brown DJ, Holguin B, Small K, Nesburn AB, Kenney MC (August 2006). «SOD1: a candidate gene for keratoconus». Invest. Ophthalmol. Vis. Sci. 47 (8): 3345–51. DOI:10.1167/iovs.05-1500. PMID 16877401.
- ↑ SOD1 haplotypes in familial keratoconus. Udar N, Atilano SR, Small K, Nesburn AB, Kenney MC. Cornea. 2009 Sep;28(8):902-7. PMID 19654524
- ↑ Stabuc-Šilih M, Stražišar M, Hawlina M, Glavač D (December 2009). «Absence of Pathogenic Mutations in VSX1 and SOD1 Genes in Patients With Keratoconus». Cornea. DOI:10.1097/ICO.0b013e3181aebf7a. PMID 20023586.
- ↑ Gajecka M, Radhakrishna U, Winters D, Nath SK, Rydzanicz M, Ratnamala U, Ewing K, Molinari A, Pitarque JA, Lee K, Leal SM, Bejjani BA (April 2009). «Localization of a gene for keratoconus to a 5.6-Mb interval on 13q32». Invest. Ophthalmol. Vis. Sci. 50 (4): 1531–9. DOI:10.1167/iovs.08-2173. PMID 19011015.
Ссылки
XuMuK.ru - СУПЕРОКСИДДИСМУТАЗЫ - Химическая энциклопедия
СУПЕРОКСИДДИСМУТАЗЫ
(-оксидоредуктазы,
СОД), ферменты класса
оксидоредуктаз, катализирующие диспропорционирование супероксидного анион-радикала:
Анион-радикалобразуется
в организме из О2 при фагоцитозе (поглощении бактерий, фрагментов
клетки или др. частиц нек-рыми клетками). При ряде патологич. состояний (напр.,
при ишемии ткани)может
играть важную роль в развитии заболевания.
Супероксиддисмутазы присутствуют во всех
тканях аэробионтов (обитатели суши и воздуха). В клетках млекопитающих супероксиддисмутазы в
осн. локализованы в цитозоле; ок. 10% фермента (по массе) находится в митохондриальных
мембранах.
Молекула изофермента супероксиддисмутазы
из цитозоля состоит из 2 идентичных субъединиц с мол. м. 16 тыс., каждая из
к-рых содержит по 1 атому Сu2+ и Zn2+ . Фермент активен
при рН 6-10, ингибируется NaCN и м.б. экстрагирован смесью хлороформ-этанол.
Изофермент, содержащий в качестве кофермента Сu2+ и Zn2+,
обнаружен также в матриксе митохондрий и в ядрах, а также в зрелых эритроцитах.
Изофермент митохондриальных
мембран состоит из 4 идентичных субъединиц с мол. м. 20 тыс., каждая из к-рых
содержит по 1 атому Мn3+ на субъединицу. Оптим. каталитич. активность
такой супероксиддисмутазы при рН ок. 7; фермент не ингибируется NaCN, разрушается при обработке
смесью хлороформ-этанол. Mn-содержащий изофермент, выделенный из бактерий, в
отличие от митохондриального тетра-мера является димером. В бактериях Escherichia
coli обнаружена также Fe3+-содержащая супероксиддисмутаза с мол. м. 39 тыс., к-рая
в отличие от др. изоферментов ингибируется NaN3.
Механизм действия супероксиддисмутаз можно
представить схемой (Е—Сu2+-фермент):
Донором протонов, вероятно,
является имидазольное кольцо остатка гистидина, связывающее ионы металлов. Супероксиддисмутазы,
содержащие Си2+ и Zn2+ , инактивируются Н2О2
из-за образования комплексов ионов этих металлов с ОН.
Ген, ответственный за биосинтез
супероксиддисмутаз, локализован в 21-й хромосоме человека. При трисомии по этой хромосоме (когда
организм содержит 3 гомологич. хромосомы) активность супероксиддисмутаз в клетках крови увеличена
на 50%. При увеличении парциального давления О2 кол-во супероксиддисмутаз в организме
увеличивается. Имеются сведения о радиопротекторном действии супероксиддисмутаз.
Изменение активности супероксиддисмутаз
возникает при нек-рых заболеваниях (напр., атеросклерозе, инфаркте миокарда),
что м. б. использовано для диагностич. целей.
Препараты супероксиддисмутаз применяют
в качестве противовоспалит. ср-ва, напр. при артритах.
Лит.: Фридович И.,
в кн.: Свободные радикалы в биологии, пер. с англ., т. 1, М., 1979, с. 272-314;
Афанасьев И. Б., "Успехи химии". 1979, т. 48, № 6, с. 977-1014;
его же, в кн.: Кислородные радикалы в химии и биологии, Минск, 1984; с. 13-29;
Ланкин В.З., в кн.: Биохимия липидов и их роль в обмене веществ, М., 1981, с.
75-95. В.З. Ланкин.
Супероксиддисмутаза 3 - это... Что такое Супероксиддисмутаза 3?
Супероксиддисмутаза 3
Супероксиддисмутаза 3 (СОД3, SOD3; внеклеточная супероксиддисмутаза, ВК-СОД, EC-SOD) — антиоксидантный фермент, одна из трёх супероксиддисмутаз человека, кодируемая геном SOD3. Как SOD1 и SOD2, этот фермент защищает организм от супероксид-анионов, катализируя их превращение в молекулярный кислород и пероксид водорода, однако местом его локализации является не цитозоль или митохондрии, а внеклеточное пространство.
Супероксиддисмутаза 3 была открыта в 1982 году.[1] Структурно она представляет собой гликопротеин-гомотетрамер массой около 30 килодальтон.
Локализация в организме
Содержание СОД3 в большинстве тканей очень небольшое и составляет 1—5 % от общего уровня супероксиддисмутаз, однако кровеносные сосуды, лёгкие, и, в меньшей степени, сердце, отличаются повышенной концентрацией СОД3.[2] В сосудистой системе СОД3 закрепляется за гепарансульфатные протеогликаны эпителия. При исследовании человеческого глаза отмечено высокое содержание СОД3 в роговице и склере.[3]
Регулировка экспрессии
Показано, что производство СОД3 в фибробластах и мышечных клетках человека регулируется опосредованно — цитокинами и факторами роста, а не собственно окислительным стрессом.[4] По сообщениям одной группы исследователей, экспрессию СОД3 могут регулировать транскрипционные факторы sp1 и sp3.[5][6]
По данным исследований на животных, физические упражнения вызывают всплеск экспрессии SOD3.[7]
В одном исследовании, приём ингибиторов АПФ или антагонистов рецептора ангиотензина лицами с заболеванием коронарной артерии значительно повысил экспрессию СОД3.[8]
Клиническое значение
Кератоконус
По данным одного исследования, проведенного на участках роговицы, изъятых в ходе кератопластики, при кератоконусе уровень СОД3 снижен в центральной части роговицы примерно наполовину от нормы, даже если этот участок роговицы уже ранее был пересажен от человека, не страдавшего кератоконусом при жизни. При этом во всех роговицах СОД3 была распределена неравномерно, с минимумом концентрации в центре.[9] В одной статье отмечается, что уровни мРНК СОД3 при кератоконусе неизменны.[10] Еще в одной публикации сообщается о том, что культура кератоцитов (роговичных фибробластов), взятых из стромы роговиц, изъятых при кератопластике у больных кератоконусом, под воздействием провоспалительного цитокина интерлейкин 1 (альфа) демонстрирует продолжающееся снижение уровней СОД3. Контрольные культуры кератоцитов - из здоровых роговиц и роговиц, пораженных буллёзной кератопатией, напротив, постепенно усиливали производство СОД3 после первоначального падения уровней фермента при добавлении IL1-альфа.[11]
Роль полиморфизма ARG213GLY
В одном исследовании 1992 года у 6 % здоровых испытуемых было отмечено 10—15-кратное превышение уровней СОД3 в сыворотке над средним уровнем.[12] Позже такие группы были выявлены и в шведской,[13] и в японской популяциях;[14] при этом в КДНК была отмечена замена C->G в позиции 760 (однонуклеотидный полиморфизм ARG213GLY). В исследовании 2004 года этот полиморфизм оказался ассоциирован с повышенным (примерно в 1,5 раза) риском ишемической болезни сердца и ишемических церебрально-васкулярных заболеваний.[15] Это объясняют не ухудшенной ферментативной активностью, а сниженным связыванием СОД3R213G с поверхностью клеток, в том числе эндотелиальных: вариация изменяет структуру его гепарин-связывающего домена и соответственно способность закрепляться за гепарансульфатные протеогликаны.[16]
Исследования на животных
По данным одного исследования, трансгенные мыши с повышенной экспрессией SOD3 отличаются в пожилом возрасте улучшенной по сравнению с обычными мышами долговременной потенциацией в гиппокампе, лучше обучаются двигательным задачам в тестах, задействующих мозжечок, и ориентируются в пространстве. В юном возрасте у них были отмечены ухудшенные способности к контекстному обучению, но эти отличия несколько нивелировались по мере старения.[17]
Гомозиготный нокаут гена SOD3 не снижает ни продолжительности жизни мышей, ни их способности к воспроизведению.[18]:135
Примечание
- ↑ Marklund SL (December 1982). «Human copper-containing superoxide dismutase of high molecular weight». Proc. Natl. Acad. Sci. U.S.A. 79 (24): 7634–8. PMID 6961438.
- ↑ Gongora MC, Harrison DG (January 2008). «Sad heart from no SOD». Hypertension 51 (1): 28–30. DOI:10.1161/HYPERTENSIONAHA.107.101162. PMID 18025292.
- ↑ Behndig A, Svensson B, Marklund SL, Karlsson K (March 1998). «Superoxide dismutase isoenzymes in the human eye». Invest. Ophthalmol. Vis. Sci. 39 (3): 471–5. PMID 9501855.
- ↑ Strålin P, Marklund SL (March 1994). «Effects of oxidative stress on expression of extracellular superoxide dismutase, CuZn-superoxide dismutase and Mn-superoxide dismutase in human dermal fibroblasts». Biochem. J. 298 ( Pt 2): 347–52. PMID 8135741.
- ↑ Zelko IN, Folz RJ (October 2004). «Sp1 and Sp3 transcription factors mediate trichostatin A-induced and basal expression of extracellular superoxide dismutase». Free Radic. Biol. Med. 37 (8): 1256–71. DOI:10.1016/j.freeradbiomed.2004.06.022. PMID 15451065.
- ↑ Zelko IN, Mueller MR, Folz RJ (August 2008). «Transcription factors sp1 and sp3 regulate expression of human extracellular superoxide dismutase in lung fibroblasts». Am. J. Respir. Cell Mol. Biol. 39 (2): 243–51. DOI:10.1165/rcmb.2007-0378OC. PMID 18314536.
- ↑ Hitomi Y, Watanabe S, Kizaki T, Sakurai T, Takemasa T, Haga S, Ookawara T, Suzuki K, Ohno H (2008). «Acute exercise increases expression of extracellular superoxide dismutase in skeletal muscle and the aorta». Redox Rep. 13 (5): 213–6. DOI:10.1179/135100008X308894. PMID 18796240.
- ↑ Hornig B, Landmesser U, Kohler C, Ahlersmann D, Spiekermann S, Christoph A, Tatge H, Drexler H (February 2001). «Comparative effect of ace inhibition and angiotensin II type 1 receptor antagonism on bioavailability of nitric oxide in patients with coronary artery disease: role of superoxide dismutase». Circulation 103 (6): 799–805. PMID 11171786.
- ↑ Behndig A, Karlsson K, Johansson BO, Brännström T, Marklund SL (September 2001). «Superoxide dismutase isoenzymes in the normal and diseased human cornea». Invest. Ophthalmol. Vis. Sci. 42 (10): 2293–6. PMID 11527942.
- ↑ Kenney MC, Chwa M, Atilano SR, Tran A, Carballo M, Saghizadeh M, Vasiliou V, Adachi W, Brown DJ (March 2005). «Increased levels of catalase and cathepsin V/L2 but decreased TIMP-1 in keratoconus corneas: evidence that oxidative stress plays a role in this disorder». Invest. Ophthalmol. Vis. Sci. 46 (3): 823–32. DOI:10.1167/iovs.04-0549. PMID 15728537.
- ↑ Olofsson EM, Marklund SL, Pedrosa-Domellöf F, Behndig A (2007). «Interleukin-1alpha downregulates extracellular-superoxide dismutase in human corneal keratoconus stromal cells». Mol. Vis. 13: 1285–90. PMID 17679946.
- ↑ Adachi T, Ohta H, Yamada H, Futenma A, Kato K, Hirano K (November 1992). «Quantitative analysis of extracellular-superoxide dismutase in serum and urine by ELISA with monoclonal antibody». Clin. Chim. Acta 212 (3): 89–102. PMID 1477980.
- ↑ Sandström J, Nilsson P, Karlsson K, Marklund SL (July 1994). «10-fold increase in human plasma extracellular superoxide dismutase content caused by a mutation in heparin-binding domain». J. Biol. Chem. 269 (29): 19163–6. PMID 8034674.
- ↑ Yamada H, Yamada Y, Adachi T, Goto H, Ogasawara N, Futenma A, Kitano M, Hirano K, Kato K (June 1995). «Molecular analysis of extracellular-superoxide dismutase gene associated with high level in serum». Jpn. J. Hum. Genet. 40 (2): 177–84. PMID 7662997.
- ↑ Juul K, Tybjaerg-Hansen A, Marklund S, Heegaard NH, Steffensen R, Sillesen H, Jensen G, Nordestgaard BG (January 2004). «Genetically reduced antioxidative protection and increased ischemic heart disease risk: The Copenhagen City Heart Study». Circulation 109 (1): 59–65. DOI:10.1161/01.CIR.0000105720.28086.6C. PMID 14662715.
- ↑ Heistad DD (April 2006). «Oxidative stress and vascular disease: 2005 Duff lecture». Arterioscler. Thromb. Vasc. Biol. 26 (4): 689–95. DOI:10.1161/01.ATV.0000203525.62147.28. PMID 16410455.
- ↑ Hu D, Serrano F, Oury TD, Klann E (April 2006). «Aging-dependent alterations in synaptic plasticity and memory in mice that overexpress extracellular superoxide dismutase». J. Neurosci. 26 (15): 3933–41. DOI:10.1523/JNEUROSCI.5566-05.2006. PMID 16611809.
- ↑ Florian Muller; Satomi Miwa; Kenneth B. Beckman Oxidative Stress in Aging: From Model Systems to Human Diseases (Aging Medicine). — Totowa, NJ: Humana Press, 2008. — ISBN 1-58829-991-0
Что такое Супероксиддисмутаза, которая находится в лосьонах Nanogen?
- В составе лосьонов для стимулирования роста волос марки Nanogen, в частности: Nanogen Swrum VEGF присутствует некий компонент со сложно произносимым названием - супероксиддисмутаза. Для того, чтоб Вам было понятно, что это (?), ознакомьтесь, пожалуйста, с небольшим научным докладом. Очень много терминов (всё можно не читать), хотя суть, которая относится к лечению волос, я выделил в тексте синим цветом.
Доклад на конференции НПО врачей-косметологов Санкт-Петербурга.
Супероксиддисмутаза – антиоксидантный фермент
применяемый в косметике.
Чурилова И.В., Шаронова В.Л.
ГосНИИ ОЧБ, ООО «Рэсбио»
«Всего несколько дней и растрескавшаяся кожа вновь становится эластичной». Примерно так выглядело резюме экспериментальных данных. Приведенных английскими учеными, изучавших действие фермента супероксиддисмутазы (СОД) на поврежденную кожу подопытных животных, появившееся в популярной литературе в начале 80-х годов, и , несомненно, заинтересовавшее косметологов. Следует отметить, что интерес к антиоксидантным ферментам и к СОД, в частности, объясняется возросшей популярностью к антиоксидантам в целом, как средствам, способным противодействовать процессам старения кожи по механизму ингибирования процессов свободно-радикального окисления. По современным представлениям молекулярный кислород инициирует развитие многих патологических состояний. Токсичность его для биологических систем связана с генерацией высокореакционных промежуточных соединений, таких как супероксидный анион радикал (О2 -), перекись водорода (Н 2О 2), синглетный кислород (О 2), гидроксильный радикал (ОН -), объединенных в один класс – активные формы кислорода (АФК). Контроль за определенным уровнем АФК в организме осуществляется многокомпонентной антиоксидантной системой, разбалансировка в которой приводит к состоянию окислительного стресса, причиной которого могут быть токсические, инфекционные, химические , механические воздействия, УФ- и ионизирующее излучение. Значительно повышение уровня АФК, характерное для состояния окислительного стресса, приводит к таким драматическим для организма событиям, как повреждение клеточных мембран
В современной медицинской литературе показана роль АФК в патогенезе более чем 100 заболеваний, начиная от артритов, заканчивая СПИДом [1]. Естественно, что нормального функционирования кожи эти процессы имеют существенное значение, поскольку кожа и глаза являются теми уникальными органами, которые подвержены воздействию высоких уровней кислорода и света, первый из которых является необходимой составляющей для генезиса и реактивности АФК, последний потенциальный поставщик АФК через УФ излучение. Ведущую роль в процессах токсичности АФК играет супероксидный анион радикал, продукт одноэлектронного восстановления кислорода; сам по себе не являясь высокотоксичным агентом, О2 участвует в целом каскаде реакций, в результате которых образуется мощный окислитель гидроксильный радикал, который затем атакует жизненно важные компоненты клетки и инициирует ПОЛ с высокой скоростью. Это особенно значимый процесс в коже, которая содержит большое количество липидов. Результатом ПОЛ является: нарушение барьерной функции рогового слоя, при этом эпидермальный барьер становится проницаемым не только для бактерий, некоторых токсинов, что приводит к развитию воспалительных процессов на коже.
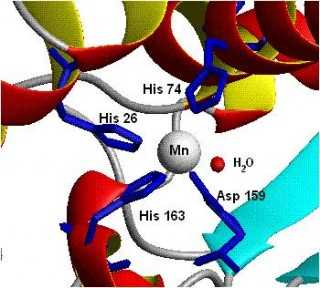 Так учёные изображают СОД
Так учёные изображают СОД
Можно предположить, что поверхностные слои кожи по сравнению с глубокими обеспечены хорошо развитой антиоксидантной системой защиты. Это действительно так; не касаясь неферменых антиоксидантов показано , что уровень каталазы, глутатион-пероксидазы и глутатион-редуктазы значительно больше в эпидермесе, чем в дерме. [2]. Уровень же СОД лишь на 20% выше в эпидермесе кожи человека, чем в дерме [3]. Наблюдается иерархия в содержание ферментных антиоксидантов в различных клеточных элементах. Так, фибробласты имеют большую антиоксидантную систему защиты, чем кератиноциты. Меньше всего уровень антиоксидантных ферментов был у меланоцитов, что по-видимому связано с тем, что меланин присутствующий в этих клетках сам выполняет функцию антиоксиданта. [4]. Интересным является тот факт, что нет разницы в АОЗ этих клеток у людей различного цвета кожи [5]. Внутри же клетки среди антиокидантных ферментов самый высокий уровень – каталазы [6]. При экспериментальном изучении УФ-индуцированных воспалениях на коже показана высокая инактивация СОД и каталазы как в эпидермесе, так и в дерме, за счет значительного повышения уровня АФК, что объясняется восстановлением кислорода
Альтернативным источником АФК при УФ-индуцируемом воспалении являются фагоцитирующие клетки, что подтверждается супероксидного радикала при экспозиции нейтрофилов человека к УФ-воздействию in vitro . Кератиноциты, экспонированные к УФ-излучению, способны к ПОЛ с высокой скоростью.
Повреждение тканей кожи, вне зависимости от того является ли оно химическим, токсическим или же термическим, вызывает местную реакцию, обычно рассматриваемую как воспаление, ответом на которую является образование метаболитов, производных кислорода. Таким образом, теоретически успех использования наружных средств, содержащих антиоксидантый фермент СОД, обоснован. Требовалось доказать, сможет ли СОД функционировать на поверхности кожи. Действительно, показано, что систематическое поверхностное нанесение СОД, ингибирует обратную пассивную реакцию Артюса на коже [7,8]. Кроме того , обработка повреждений на лице у пациентов с болезнью Крона, путем наружного применения липосом содержащих СОД, приводило к значительному улучшению , уменьшая опухание[9]. Наложени крема, содержащего СОД, защищало кожу человека от вредного влияния ультрафиолетового облучения ксеноновыми «солнечными» лампами [10]. Однако, продвижение СОД в косметике началось в 80-годах после опубликования патента, в котором заявлен общий метод предупреждения и устранения воспалительных процессов на коже на основе наружного применения СОД, выступающего в качестве единственного действующего вещества в различных рецептурах [11]. Было показано, что наружные средства, содержащие СОД, могут защищать кожу от различных классов химических раздражителей, таких как неорганические и органические перекиси, основания, кислоты (в том числе, жирные кислоты, вызывающие образование прыщей), кератинизирующие агенты, вещества, вызывающие образование струпьев на коже, производные пара-аминобензойной кислоты и т.д. Повреждение тканей может возникать как из прямого воздействия патологического химического агента, так и последующих воспалительных явлений. В этом отношении установлено, что СОД способна предупреждать, как прямое химическое повреждение, так последующие вредные проявления, вызываемые воспалением. Показано, средства, содержащие СОД, можно применять также для предупреждения или смягчения кожных воспалений неясной этиологии. Кроме того они могут быть пригодны для предотвращения образования вульгарных угрей.
СОД улучшает клеточной дыхание, улучшает и сохраняет такое свойство кожи , как мягкость, эластичность и бархатистость.
Рядом исследователей показано, что СОД может быть использована для защиты волос, сохраняя целостность кератиновой структуры, за счет ингибирования процессов окисления кератина. Присутствие СОД в средствах для волос (шампунях, красках, бальзамах, лаке и т.д.) положительно сказывапется не только на их структуре, но улучшает состояние кожи черепа [12].
СОД можно применять как стабилизирующий агент для компонентов, используемых для приготовления косметических средств, таких как натуральные масла содержащие полиненасыщенные жирные кислоты, веществ, подверженных быстрому окислению (некоторые красящие вещества и вещества, используемые для перманентной завивки), органических оснований (триэтаноламин), используемых для нейтрализации косметических композиций, содержащих кислые компоненты, такие как карбопол.
Использование в солнцезащитных средствах в качестве УФ-фильтров таких компонентов как окись титана, будет наиболее эффективно, если в них ввести дополнительно СОД, которая способна ограничить фотоокисление окиси титана, происходящее с выделением супероксидного радикала.