Треонин что это такое
Треонин — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 ноября 2014; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 ноября 2014; проверки требуют 5 правок.| Треонин | |||
|---|---|---|---|
{{{картинка2}}}) | |||
| Систематическое наименование | 2-амино-3- гидроксибутановая кислота | ||
| Сокращения | Тре, Thr, T ACU,ACC,ACA,ACG | ||
| Хим. формула | HO2CCH(NH2)CH(OH)CH3 | ||
| Рац. формула | C4H9NO3 | ||
| Молярная масса | 119,12 г/моль | ||
| Температура | |||
| • плавления | 256 °C | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 2,20 9,96 | ||
| Рег. номер CAS | [72-19-5] | ||
| PubChem | 6288 | ||
| Рег. номер EINECS | 200-774-1 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 16857 | ||
| ChemSpider | 6051 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Треони́н (англ. Threonine; α-амино-β-гидроксимасляная кислота; 2-амино-3-гидроксибутановая кислота) — гидроксиаминокислота; молекула содержит два хиральных центра, что обусловливает существование четырёх оптических изомеров: L- и D-треонина (3D), а также L- и D-аллотреонина (3L).
L-треонин вместе с 19 другими протеиногенными аминокислотами участвует в образовании природных белков. Для человека треонин является незаменимой аминокислотой. У бактерий, дрожжей и растений из L-треонина при участии фермента треониндезаминазы синтезируется другая незаменимая аминокислота изолейцин. Суточная потребность в треонине для взрослого человека составляет 0,5 г, для детей — около 3 г.
Бактериями и растениями треонин синтезируется из аспарагиновой кислоты через стадию образования гомосерин-O-фосфата. Треонин участвует в синтезе коллагена и эластина, в белковом и жировом обмене, стимулирует иммунитет и помогает работе печени, препятствуя отложению в ней жиров.
Свойства треонина в организме. Аминокислота, необходимая для производства коллагена
Скорее всего, вы не много слышали о треонине, но эта аминокислота участвует в ряде биологических процессов. Наиболее известные свойства треонина в организме — формировании основы соединительных тканей, таких как коллаген и эластин.
Она также помогает регулировать пищеварение, настроение и рост мышц.
Незаменимые аминокислоты такие как треонин, являются строительными блоками белков. Они играют жизненно важную роль в структуре наших костей, мышц и кожи.
Когда мы не употребляем достаточно продуктов с высоким содержанием этих важных соединений, мы можем испытывать симптомы дефицита. Это изменения настроения, раздражительность, спутанность сознания и проблемы с пищеварением.
Это одна из причин, по которой необходимо придерживаться сбалансированной диеты, включающей в себя ряд продуктов с высоким содержание белков. Эти продукты гарантируют получение достаточного количества незаменимых аминокислот.
Что такое треонин?
Треонин является незаменимой аминокислотой, которая играет важную роль в регулировании баланса белка в организме. Поскольку она считается «незаменимой аминокислотой», это означает, что организм не синтезирует аминокислоту. Поэтому для ее получения нам необходимо есть продукты с высоким содержанием треонина.
Аббревиатура треонина — Thr, а однобуквенный код — T. Правильное произношение треонина — «три-ух-необходимость».
Формула треонина — C4H9NO3, и он содержит — аминогруппу, карбоксильную группу и боковую цепь, содержащую гидроксильную группу. Это делает структуру треонина полярной незаряженной аминокислотой.
Аминокислота встречается в природе в L-форме, L-треонине. Это сопряженное основание L-треониния и сопряженная кислота L-треонината.
Вот некоторые общие вопросы о структуре аминокислоты треонина:
- Сколько стереоизомеров имеет треонин? Thr имеет четыре возможных стереоизомера: (2S, 3R), (2R, 3S), (2S, 3S) и (2R, 3R).
- Треонин положительно заряжен? Считается, что аминокислота T обладает полярными свойствами.
- Является ли треонин кислотным или основным? Thr считается полярным. Тогда как аминокислоты лизин и аргинин считаются основными и заряженными, а аспартат и глутамат являются кислыми и заряженными отрицательно.
- Что такое кодон треонина? Возможные треониновые кодоны включают ACA, ACC, ACG и ACT.
Аминокислота Т является предшественником серина и глицина, двух других аминокислот, необходимых для нормального функционирования организма.
Глицин является условно незаменимой аминокислотой. Это означает, что он вырабатывается организмом в небольших количествах. Он также доступен в продуктах питания, и многие люди могут извлечь выгоду из потребления большего количества из своего питания.
Это особенно верно, если у человека есть заболевание, ограничивающее синтез глицина.
Действие треонина в организме
1.Свойства треонина в организме – поддерживает здоровье пищеварительной системы
Треонин защищает пищеварительный тракт, создавая покрывающий его слой слизи и служит барьером для повреждения пищеварительных ферментов. Эта важная аминокислота также поддерживает здоровую функцию кишечника, способствуя защитным эффектам слизистого барьера кишечника.
Согласно исследованиям, опубликованным в Frontiers in Bioscience, большая часть пищевого треонина используется для синтеза белка слизистой оболочки кишечника. По этой причине потребление продуктов Thr может помочь улучшить здоровье кишечника в физиологических и патологических условиях как у людей, так и у животных.
2.Свойства треонина в организме — повышает иммунную систему
Нам нужно достаточно треонина для поддержания правильной иммунной функции. Тимус использует незаменимую аминокислоту для производства Т-клеток или Т-лимфоцитов, которые борются с инфекциями в организме.
Исследования, опубликованные в «Cold Spring Harbor Perspectives in Biology», утверждают, что
«серин/треонинкиназы контролируют эпигенетические, транскрипционные и метаболические программы, определяющие функцию Т-клеток»
.Исследователи объясняют, что на базовом уровне серин и треонинкиназы работают как выключатели. Они запускают рецепторы антигена и цитокинов, которые составляют иммунную систему.
3.Свойства треонина в организме — улучшает мышечное сокращение
Есть некоторые свидетельства того, что треонин может способствовать развитию симптомов БАС, или болезни Лу Герига. Хотя необходимы дополнительные исследования, чтобы лучше понять его роль. Треонин работает на повышение уровня глицина в центральной нервной системе.
Глицин используется для лечения спастичности. Поэтому L-треонин был оценен по его способности улучшать спастичность или сокращать мышцы у пациентов с БАС.
В обзоре, проведенном в Австралии, исследователи обнаружили, что двойное слепое, плацебо-контролируемое исследование перорального приема L-треонина для лечения спастичности позвоночника указывает на умеренный спазмолитический эффект. Тем не менее, исследования с участием пациентов с БАС не показали улучшения при лечении L-треонина.
Эти смешанные обзоры показывают, что использование добавок L-треонина может помочь уменьшить мышечные сокращения. Однако, он может быть неэффективным для симптомов БАС.
4.Свойства треонина в организме в поддержании силы в мышцах и костях
Знаете ли вы, что белки коллагена и эластина нуждаются в треонине для правильного производства? Возможно, вы уже знаете, что коллаген является наиболее распространенным белком в организме. Он содержится в наших мышцах, костях, коже, кровеносных сосудах, сухожилиях и пищеварительной системе.
Поскольку треонин позволяет производить коллаген, он играет жизненно важную роль в здоровье костей и мышц.
Исследования, проведенные в Техасском университете A&M, показывают, что глицин из треонина, пролина и гидроксипролина составляет 57% от общего количества аминокислот в коллагене. Аминокислота треонин является предшественником глицина. Он также используется во время биосинтеза креатина, обеспечивая мышцы прямым источником топлива для восстановления повреждений.
Треонин также учитывает правильную функцию эластина. Эластин – это белок, содержащийся в соединительной ткани. Он позволяет коже, сухожилиям и связкам восстанавливать форму после растяжения или сокращения.
5.Свойства треонина в организме — помогает предотвратить ожирение печени
Аминокислота предотвращает накопление жира в печени. Это достигается путем регулирования жирового обмена и облегчения липотропной функции.
Липтропные соединения способствуют расщеплению жира во время обмена веществ. Без аминокислот — треонина, метионина и аспарагиновой кислоты это было бы невозможно. Дефицит треонина может привести к ожирению печени и даже к печеночной недостаточности.
Исследование на животных, опубликованное в Американском журнале физиологии, показало, что треонин — дефицитное питание увеличивают митохондриальное разобщение в печени. Питание, в котором отсутствуют качественные белковые продукты, может привести к неправильной работе клеток и накоплению жиров в печени.
6.Свойства треонина в организме — облегчает беспокойство и легкую депрессию
Исследования показывают, что изменения уровня аминокислот в сыворотке, включая серин и глицин, требующие треонин для производства, связаны с большой депрессией. Исследователи в Бельгии обнаружили — изменения уровня треонина, аспартата, аспарагина и серина могут предсказать реакцию пациента на лечение антидепрессантами. Они модулируют уровни аминокислот в организме.
Треонин является предшественником глицина, помогающего успокоить нервы и поддерживающего когнитивное здоровье. Его часто используют в качестве добавки для снятия признаков тревоги и депрессии. Глицин также известен своей способностью улучшать сон, умственную деятельность, настроение и память.
7.Свойства треонина в организме — ускоряет заживление ран
Треонин нужен для правильного производства коллагена, необходимого для формирования соединительной ткани и заживления ран.
Исследования показывают, что после ожогов или травм у людей наблюдается больший выброс треонина в моче. Это указывает на то, что аминокислота метаболизируется из тканей организма после травмы.
Увеличение потребления треонина через продуктов или добавки может помочь ускорить заживление ран, ожогов и других форм травм.
Симптомы и причины дефицита треонина
Дефицит треонина встречается редко, так как большинство людей получают достаточно аминокислот в употребляемых продуктах. Однако люди с несбалансированным питанием, веганы и вегетарианцы, могут не потреблять достаточное количество треониновой пищи. Что может вызвать низкий уровень аминокислот.
Дефицит треонина может вызывать следующие симптомы:
- проблемы с пищеварением
- раздражительность или эмоциональное возбуждение
- путаница
- повышенное содержание жира в печени
- плохое усвоение питательных веществ
Продукты и добавки
В чем содержится треонин?
Аминокислота треонин встречается в природе в форме L-треонина. Хорошо сбалансированное питание, включающее высококачественные белковые продукты, обеспечит организм достаточным количеством для поддержания нормального уровня.
Лучшие треониновые продукты включают в себя:
- Мясо свободного выгула (включая курицу, баранину, говядину и индейку)
- Выловленная рыба (в том числе лосось)
- Молочные продукты
- Творог
- Яйца
- Морковь
- Бананы
- Семена кунжута
- Семена тыквы
- Фасоль
- Эдамамэ
- Спирулина
- Чечевица
Дефицит треонина редко встречается у людей, придерживающихся сбалансированного питания с высоким содержанием белка. Для веганов и вегетарианцев употребление в пищу бобов, семян и гороха поможет поддерживать нормальный его уровень.
Порошок и капсулы L-треонина доступны в Интернете или в большинстве магазинов здоровой пищи. Вы также можете обнаружить, что добавки эластина содержат L-треонин.
Как принимать треонин и дозировка
Добавки треонина бывают в виде капсул по 500 мг, которые можно принимать до трех раз в день. Это в зависимости от потребностей в здоровье и уровня дефицита Т-аминокислот.
Наиболее распространенная доза L-треонина составляет 500–1000 мг в день. Исследования показывают, что дозы до четырех грамм в день в течение 12 месяцев безопасны.
Использование L-треонин для устранения дефицита или улучшения симптомов какого-либо заболевания лучше производить под наблюдением врача.
Рецепты
Есть так много способов включить треонин в свой рацион. Сосредоточьтесь на получении достаточного количества белка в питании.
Вы можете сделать это с органическим мясом, пойманной в дикой природе рыбой, яйцами, бобами, орехами и семенами. Вот для начала несколько полезных и вкусных рецептов:
Риски и побочные эффекты
Хотя добавление треонина в соответствующих количествах обычно считается безопасным, некоторые люди могут испытывать незначительные побочные эффекты. Это головная боль, тошнота, расстройство желудка и кожная сыпь.
Недостаточно доказательств того, что беременным или кормящим женщинам следует принимать добавки треонина. Вместо этого лучше всего получать достаточно аминокислот из сбалансированного питания.
Люди, принимающие антагонисты NMDA под названием мемантин (Namenda), должны избегать использования этой добавки. Это один из видов лекарств от болезни Альцгеймера. Аминокислота может снизить эффективность этих лекарств.
Свойства треонина в организме — последние мысли
- Какова функция треонина? Треонина является незаменимой аминокислотой, которая играет важную роль в регулировании баланса белка в организме.
- Преимущества этой аминокислоты включают ее способность поддерживать здоровье пищеварительной системы, укреплять иммунную систему, улучшать мышечную силу. А также уменьшать мышечные спазмы, снимать беспокойство и легкую депрессию и ускорять заживление ран.
- Какие продукты с высоким содержанием треонина? Большое количество треонина содержат высококачественные белковые продукты, включая органическое мясо, пойманную в дикой природе рыбу. А также яйца, органические молочные продукты, семена и бобы.
- Кто не получает достаточное количества треонина в рационе питания, его прием в виде добавок может помочь поддерживать нормальный уровень. Капсулы и порошки доступны в интернете и в магазинах здоровой пищи.
ЧИТАЙТЕ ДАЛЕЕ: Удивительная польза тирозина для здоровья мозга и щитовидной железы. Информация о питании и дозировке
Поделиться:
Что такое аминокислота треонин и его польза для организма
L — Треонин – незаменимая протеиногенная алкоаминокислота, которая участвует в построение всех органов и тканей организма человека. Прочитайте статью до конца и вы узнаете: чем L-треонин отличается от других треонинов? для чего нужен треонин в организме человека? функции треонина? биохимический обмен треонина. С вами Галина Батуро и аминокислота треонин.
Структурная формула треонина
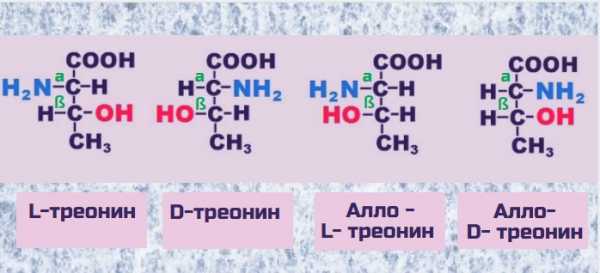
Треонин — аминокислота, а значит она имеет аминную голову Nh3 и карбоксильный хвост CООН. Как у всех природных аминокислот, входящие в состав белков (протеиногенные), аминная голова и карбоксильный хвост присоединены к первому атому углерода, т.е. в альфа-положении. Кроме того, треонин имеет алко-группу ОН, которая присоединена к атому углерода в бетта-положении.
Молекула треонина имеет два центра вращения (хиральных центра), поэтому возможны 4 варианта взаиморасположения друг относительно друга амино- и алко- групп, именуемых оптическими изомерами или энантиомерами. В составе животных белков входит L-энантиомер треонина, но при химическом синтезе образуются все четыре изомера в равных пропорциях. Очистка продукта от нефункциональных изомеров – процесс не простой, и это увеличивает стоимость коммерческих препаратов. При прочих равных, более очищенный препарат будет стоить дороже менее очищенного. L-треонин обладает биологической ценностью, ибо входит в состав природных белков. Другие изомеры не играют важной физиологической роли. Попадая в организм человека, они разрушаются ферментами, катализирующими их распад. D-треонин не используется для роста и не подвергается действию оксидазы D-аминокислот.
Свойства треонина
Треонин на одну углеродную последовательность длиннее серина, спиртовая ОН – группа присоединена к молекуле углерода в β-положении, придавая аминокислоте как гидрофильные, так и липофильные свойства, что позволяет молекуле растворяться как в воде, так и в жирах.
При укладке треонина в кристалле образуется трехмерная сетка водородных связей. Связи между спиртовой группой ОН одной молекулы и аминной группой Nh4 другой молекулы объединяют молекулы треонина в спирали, параллельные оси углерода. Отдельные спирали объединяются в каркас водородными связями. Таким образом треонин поддерживает вторичную структуру белка, укрепляя ее водородными связями, что важно для правильного функционирования белковых молекул.
Ион водорода в гидроксильной группе ОН очень подвижен, способен легко отщепляться, поэтому молекула треонина служит местом связи белка с сахарами в соединениях, называемых гликопротеидами, которые входят в состав соединительной ткани. Соединительная ткань – это такая же опора для внутренних органов, как кости – опора для мышц.
Фосфорная кислота в некоторых видах белков соединена сложно-эфирной связью с белковой молекулой через спиртовую группу ОН треонина. Такие белки называется фосфопротеидами. К группе фосфопротеидов относят казеиноген молока, вителин и фосфитин желтков яиц и протеинов икры рыб. Много фосфопротеидов содержится в головном мозгу животных и человека.
Треонин является глюкогенной аминокислотой. Он повышает уровень инсулина в крови, является источником гликогена в печени, из него синтезируется глюкоза.
Будучи протеиногенной аминокислотой, треонин входит в состав практически всех белков организма человека.
Треонин не синтезируется в человеческом организме, являясь незаменимой аминокислотой. Для нормальной жизнедеятельности он должен в достаточном количестве поступать с продуктами питания.
Суточная потребность в треонине для взрослого человека – 0,5 г., для детей – 3 г.
Функции треонина
- Структурная
- Участие в углеводном обмене
- Участие в жировом обмене
- Пищеварительная
- Антитоксическая
- Иммуностимулирующая
- Нейромедиаторная
Структурная функция треонина
Треонин входит в состав практически всех белков человеческого организма, в т.ч. фермента пепсина, участвующего в переваривании протеинов в желудочно-кишечном тракте, а также белка соединительной ткани фибрина. В большинстве природных белков его содержание 2-6%.
Треонин – ведущая аминокислота для нормального функционирования соединительной ткани. Треонин – это здоровая гладкая сияющая кожа, ибо именно коллаген придает ей упругость.
Единственным отличием человеческого инсулина от инсулина других млекопитающих является наличие треонина в положении 3 О В-цепи инсулина.
Треонин входит в состав зубной эмали. Без достаточного потребления этой аминокислоты начнется разрушение структуры зубов, а там и кариес не за горами.
Гликопротеиды
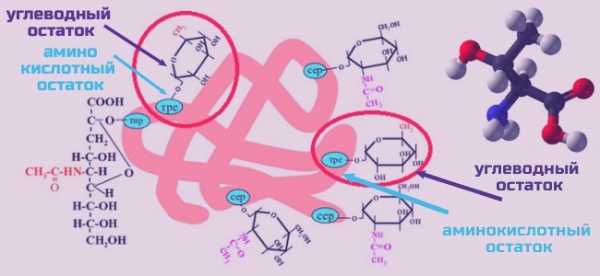
Гликопротеиды — особый класс белков, которые образуются присоединением сахарного кольца к белку через спиртовую группе ОН треонина. Небелковая часть, присоединенная к белку, обеспечивающая выполнение функции, называется простетической группой. Простетической группой гликопротеидов являются различные ГликозоАминоГликаны, в частности гиалуроновая кислота. Белки соединительной ткани, выполняют функцию опоры для внутренних органов, заполняя все промежутки между функциональными тканями. Гликопептиды вместе с коллагеном и гиалуроновой кислотой – это такая набивка внутреннего пространства организма. Гиалуроновая кислота является каркасом, поддерживающим кожу. Она удерживает молекулы воды, что позволяет сохранять гладкость и тургор кожи. Другие гликопротеиды входят в состав суставных хрящей, обеспечивая их высокую подвижность. Треонин помогает соединительным тканям (сухожилиям, костям, хрящам) быть сильными и упругими.
Коллаген в организме есть везде. Мышечные фасции – пленки, структурирующие мышечное волокно, связки, сухожилия, чехлы, покрывающие внутренние органы – везде есть коллаген, погруженный в матрикс из гликопротеидов – этакого вязкого желе, которое сообщает упругость и растяжимость тканям.
Понятно, почему потребность в треонине в детском возрасте в 12 раз больше, чем во взрослом: дети интенсивно растут, т.е. растут кости, мышцы, связки, сосуды, а это значит, что на конвейер, вырабатывающий белки соединительной ткани должны постоянно поступать строительная аминокислота треонин, необходимая для синтеза гликопротеидов . Нет строй.материала – каркас дома-организма будет с дефектами: сколиоз, плоскостопие, вывихи шейных позвонков, мышечная дистрофия, слабость сердечной мышцы, и даже близорукость и кариес – это болезни, связанные с соединительно-тканной недостаточностью, которая в том числе возникает при недостатке соединительно-тканных аминокислот, в т.ч. треонина.
Даже во взрослом состоянии организм постоянно обновляет сам себя: старые белки разрушаются и их место занимают вновь синтезированные, в организме нет ничего неизменного, даже костная ткань обновляется, даже зубная эмаль создается заново. В процессе самообновления вновь и вновь синтезируется соединительная ткань, и для того, чтобы с возрастом ее качество не ухудшалось, необходимо достаточное поступление аминокислот, в т.ч. треонина.
Будучи соединительно-тканной аминокислотой, треонин необходим для восстановления после любых травм и операций, когда идет активное производство соединительной ткани для починки поврежденных структур.
Фосфопротеиды
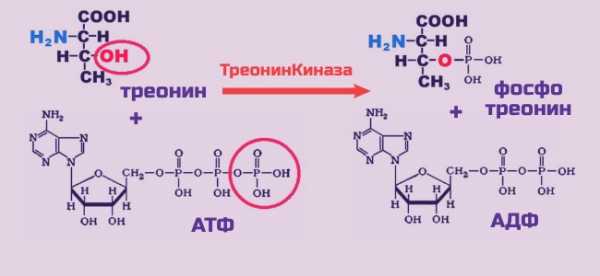
Фосфопротеиды — особый класс белков, в которых фосфорная кислота соединена сложно-эфирной связью с белковой молекулой через аминокислоты треонин или серин. К белкам этого класса относятся казеин молока, вителлин и фосвитин, выделенный из яичного желтка, ихтулин икры рыб. Особенно много фосфопротеидов содержится в головном мозгу. Некоторые фосфопротеиды являются ферментами: фосфорилаза, гликогенсинтетаза, ТАГ-липаза. Фосфопротеиды содержат органически-связанный лабильный, т.е. способный как легко отщепляться, так и присоединяться, фосфат, что необходимо для выполнения клеткой важных биологических функций.
Особые ферменты — протеинкиназы присоединяют остаток фосфорной кислоты, отщепляя его от молекулы АТФ. Фосфорилирование происходит по спиртовой группе ОН, т.е. фосфорные хвостики навешиваются на белок там, где есть аминокислоты треонин, серин и фенилаланин. Фосфорилирование регулирует работу белка: усиливает или тормозит каталитическую функцию ферментных белков, сродство белка при связывании с другими молекулами, изменяет его стабильность. При фосфорилировании активность белка может измениться в 500 раз. Путем фосфорилирования организм осуществляет тонкую настройку биохимического конвейера, приспосабливая свою работу к меняющимся условиям внешней среды.
При фосфорилировании на долю треонина приходится 8-10% фосфатных групп.
Участие в аминокислотном обмене
Поступающий с пищей треонин используется для синтеза белка. Оставшийся невостребованным треонин подвергается распаду.
Долгое время считалось, что в печени треонин разлагается ферментом ТреонинАльдолазой на аминокислоту глицин и ацетальдегид. Реакция, которая описана во многих учебниках биохимии можно посмотреть здесь: Синтез глицина. Как выяснилось (1) за работу ТреонинАльдолазы принимали действие ферментов ТреонинДегидратазы и ЛактатДегидрогеназы. В печени млекопитающих содержится фермент АллоТреонинАльдолаза, который расщепляет АллоТреонин, изомер Треонина, не входящий в состав белков и не поддерживающий рост и не встречающийся, как природное вещество.
У человека треонин НЕ распадается до аминокислоты глицин и НЕ является источником глицина, т.к. в митохондриях отсутствует специфический фермент ТреонинДегидрогеназа.
Распад Треонина и углеводный обмен
В клетках печени аминокислота треонин распадается под действием фермента ТреонинДегидратазы с участием Пиридоксаль-5-фосфата (активная форма витамина B6). Фермент отсекает аминную голову треонина, происходит необратимое дезаминирование аминокислоты. Конечным продуктом реакции выступает α-КетоМасляная Кислота (α-КетоБутират).
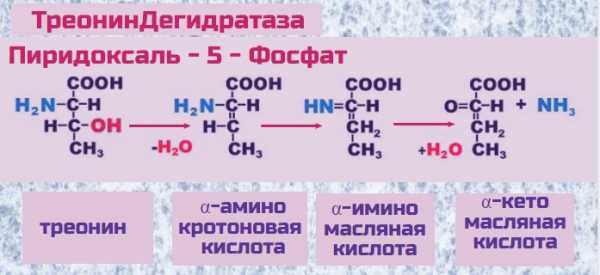
В дальнейшем альфа-КетоМасляная кислота быстро и необратимо расщепляется на пропионовую кислоту и углекислый газ, а пропионовая кислота через образование янтарной кислоты (сукцината) включается в глюконеогенез. Для переработки пропионовой кислоты требуется витамин В 12. Таким образом треонин является источником глюкозы, которая запасается в виде гликогена в печени и по мере необходимости вновь отправляется в топку для выработки энергии.
Основная функция ТреонинДегидратазы в печени — мобилизовывать углерод треонина для глюконеогенеза и синтеза глюкозы в печени, когда глюкозы не хватает. Это состояние возможно при голодании, низкоуглеводистой диете или высокобелковой диете, когда белки поступают с избытком. Фермент активизируется при высоком поступлении белка с пищей, перегоняя избыточный белок на глюкозу. Вот такая засада. В погоне за снижением веса мы отказываемся от углеводов, увеличиваем потребление белка, а организм включает ТреониДегидратазу и изготавливает сахар.
В митохондриях некоторых млекопитающих (морских свинок, крыс, но не человека!) треонин распадается под действием фермента ТреонинДегидрогеназа при участии НАД+ до аминоацетона.
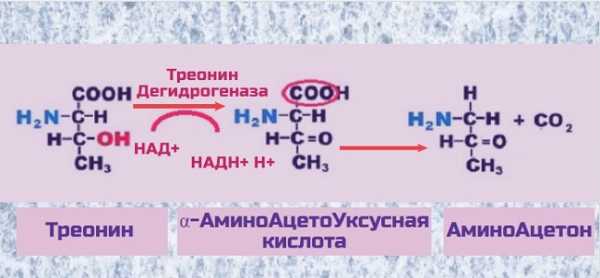
Аминоацетон в дальнейшем окисляется в митохондриях до ацетилКоА , который сгорает в цикле Кребса с выделением энергии. В печени крысы этим путем окисляется до 35% треонина. Эта реакция приведена во многих учебниках биохимии, причем без указания, что в организме человека данный процесс не происходит.
У человека отсутствует фермент ТреонинДегидрогеназа, поэтому распад треонина до аминоацетона невозможен.
Треонин — активная глюкогенная аминокислота. Академик А.А. Покровский считал треонин одной из пяти аминокислот, являющихся наиболее важными источниками углерода для синтеза глюкозы и гликогена. Потребление ее в больших количествах дает инсулиновую реакцию — выброс инсулина, как на потребление глюкозы. Организм как бы заранее готовится утилизировать сахар, на который будет переработан треонин.
Участие в жировом обмене
Треонин наряду с метионином и аспарагиновой кислотой помогает печени расщеплять жиры и жирные кислоты. Он входит в состав многих ферментов, утилизирующих жиры. Недостаток треонина в продуктах питания способствуют развитию жировой дистрофии печени
Пищеварительная функция треонина

Треонин входит в состав пищеварительного фермента пепсина, участвующего в расщеплении белков в желудочно-кишечном тракте. Он поддерживает нормальную работу кишечника, принимает активное участие в процессах пищеварения и усвоения питательных веществ. Функция треонина приобретает особое значение при недостатке аминокислоты холина.
Треонин помогает при непереносимости некоторых продуктов питания, например глютена пшеницы.
Антитоксическая функция треонина
За счет подвижной группы ОН, треонин соединяется с токсическими веществами и дезактивирует их, а потом выводит из организма
Иммуностимулирующая функция треонина
Треонин участвует в синтезе иммуноглобулинов и антител, которые защищают организм от инфекций.
Нейромедиаторная функция треонина

Треонин является источником для образования тормозного медиатора ГАМК. О его функции читайте здесь http://zaryad-zhizni.ru/tormoznyie-i-vozbuzhdayushhie-aminokislotyi/. Как предшественник нейромедиатора, он используется в комплексном лечении депрессии, и других заболеваний нервной системы.
Он улучшает память, повышает концентрацию внимания, увеличивает работоспособность, поднимает настроение. Он оказывает антидепрессантное действие и регулирует передачу нервного импульса в головном мозгу.
Добавки треонина бывают полезны при лечении бокового амиотрофического склероза и рассеянного склероза.
Применяется в комплексном лечении алкоголизма и наркомании, т.к. снижает тягу к веществам, вызывающим зависимость.
Продолжение читайте здесь: http://zaryad-zhizni.ru/treonin-v-produktah-pitaniya/.
Понравилась статья? Делитесь информацией в соц. сетях, оставляйте комментарии. С вами Галина Батуро и аминокислота треонин.
- Малиновский А.В. Переаминирование треонина. стр. 5-6.
Треонин | Химия онлайн
Треонин – незаменимая α-аминокислота, входит в состав многих белков (пепсин, глиадин, фибрин и др.).
Треонин относится к группе аминокислот, которые имеют полярные, но нейтральные боковые цепи.
Присутствие большого количества полярных аминокислот повышает растворимость белков в воде, в то же время функциональные группы этих молекул часто играют важную роль в действии ферментов и определяют другие физиологические свойства белков.
Цистеин, в частности, ответственен за сохранение трехмерной структуры белков.
Треонин — 2-амино-3-гидроксибутановая (α-амино-β-гидроксимасляная или α-амино-β-оксимасляная) кислота.
Треонин (Тре, Thr , T) — гидроксиаминокислота, химическая формула HO2CCH (NH2) CH (OH) CH3.
Треонин был обнаружен в гусиных перьях Н.Д. Зелинским и В.С. Садиковым, впервые выделен в 1925 г. С. Шрайвером и X. Бустоном из белка овса.
Суточная потребность в треонине для взрослого человека составляет 0,5 грамм, для детей – около 3 грамм.
Физические свойства
Треонин представляет собой белый кристаллический порошок, не имеющий запаха, Температура его плавления — 2530С (с разл.). Растворяется в воде, не растворяется в этаноле и диэтиловом эфире.
Биологическая роль
Аминокислота треонин выполняет ряд важных биологических функций. Треонин участвует в построении мышечного белка и поддерживает нужный протеиновый баланс в организме.
Треонин улучшает состояние сердечнососудистой системы, печени, а также служит дополнительным источником энергии.
Активирует иммунную систему, участвуя в образовании иммуноглобулинов и антител.
Из треонина в организме синтезируются другие аминокислоты – глицин и серин, необходимые для построения мышечной ткани, коллагена и эластина.
Стимулирует процессы роста тканей, способствует энергообмену в мышечных клетках, обладает гликогенными воздействием.
Синтез иммунных белков и многих ферментов пищеварительной системы без треонина невозможен.
Треонин повышает прочность костей и эмали зубов.
Треонин улучшает липотропную функцию печени, способствуя нормализации жирового обмена.
Треонин содержится в молекуле инсулина человека.
Треонин помогает соединительным тканям (сухожилиям, костям, хрящам) и мышцам стать сильными и упругими.
Природные источники
Мясо (индейка, свинина), молочные продукты, рыба (горбуша, семга), соя, фасоль белая, сыр (моцарелла, твердый), чечевица, горох, печень говяжья,
грибы, яйца, различные крупы, меньше его в орехах, бобах и семенах.
При недостатке треонина отмечается потеря аппетита и повышенная возбудимость нервной системы с последующим ее истощением.
Недостаток треонина в рационах питания приводит к нарушению обмена нуклеиновых кислот и белков.
Дефицит треонина приводит к эмоциональному возбуждению, спутанности сознания, трудности с пищеварением, ожирение печени.
Наблюдаются сдвиги в метаболизме высокомолекулярной РНК и нарушения в синтезе белка, а также значительные нейрогуморальные изменения структур и функциональной активности мембран клеток и их органелл.
Недостаток этой аминокислоты обычно наблюдается у вегетарианцев.
Пищевые добавки, содержащие треонин, могут быть полезны вегетарианцам, употребляющим мало животных белков или не употребляющим вовсе.
Избыток треонина приводит к усиленному накоплению мочевой кислоты.
Области применения
Треонин оказывает антидепрессантное действие на организм и регулирует передачу нервных импульсов в мозг.
Треонин поддерживает нормальную работу пищеварительного тракта и принимает активное участие в процессах пищеварения и усвоения питательных веществ.
При недостатке другой аминокислоты – холина – функции треонина приобретают большее значение.
Треонин участвует в процессе обезвреживания токсинов и вместе с другими аминокислотами — цистеином, аланином, лизином и аспарагиновой кислотой укрепляет иммунитет.
Дополнительный прием треонина оказывает влияние на ослабление мышечного тонуса.
БАДы, содержащие треонин, должны включать витамины В3, В6 и магний.
Аминокислоты как лекарственные препараты
Серин и треонин являются необходимым компонентом инфузорных растворов для парентерального питания, особенно треонин – незаменимая аминокислота для человека, способствующая поддержанию нормального обмена в организме.
Рекомендуемый нормы серина и треонина составляет 4-6 грамм в день.
Биотреин применяется при снижении умственной работоспособности и хроническом алкоголизме.
Церебролизат применяется при нарушении корковых функций ЦНС.
Гепансол Нео применяется при печеночной коме с нарушениями функции мозга.
Кетостерил обеспечивает полное снабжение незаменимыми аминокислотами при минимальном введении азота. Улучшает азотистый обмен. Снижает ионы К+ и концентрацию в крови ионов Mg2+ и фосфатов.
Инфезол
Назначается в качестве парентерального питания, способен улучшить общее состояние организма, поддержать обмен веществ и уменьшить вероятность снижения массы тела при критическом состоянии.
Аминокислоты
Классификация аминокислот
Треонин
Сегодня всем известно, насколько важны для нашего организма соединения называемые аминокислотами. Одно из таких соединений - треонин. И хотя он входит в состав практически всех белков человеческого организма, в организме человека треонин не синтезируется. То есть это незаменимая аминокислота, поступающая к нам только с пищей либо с пищевыми добавками. Особенно важна эта аминокислота для детей, их потребность в треонине больше, чем для взрослого человека.
Чем же полезен для нас треонин? Самое важное, что он необходим для синтеза аминокислот серина и глицина, которые в свою очередь участвуют в синтезе коллагена и эластина - белков соединительной и мышечной ткани. Коллаген и эластин необходимы и для мышц, и для сухожилий, и для связок, и для упругости сосудов, кожи, нормальной работы сердца. Естественно, что детям треонин нужен в больших объемах, чем взрослому человеку, ведь у них только строится организм. Если не хватает строительного материала возможно развитие проблем с позвоночником - сколиоз, вывихи шейных позвонков, с мышцами - плоскостопие, дистрофия мышц, с зубами - развитие кариеса, с ногтями, волосами. Возможно даже ухудшение зрения. Взрослому человеку также нужен треонин, так как и у взрослого организм постоянно обновляется. И для хорошего состояния кожи или зубов (а треонин входит в состав зубной эмали) нужно постоянное поступление в организм треонина.
Повышенные дозы этой аминокислоты необходимы при восстановлении после операций и различных травм.
Треонин необходим и для здоровой работы печени. В комплексе с метионином и аспарагиновой кислотой заботится о переработке жиров и жирных кислот. А значит препятствует развитию жировой болезни печени - гепатозу.
Для нормальной работы пищеварительного тракта также нужен треонин. Он входит в состав некоторых пищеварительных ферментов, например, пепсина, который отвечает за расщепление белков в желудке.
Треонин поддерживает работу иммунной системы организма, способствует выведению токсических веществ, поэтому очень важен и при беременности - уменьшает токсикоз в ранние месяцы.
Используется при лечении заболеваний центральной нервной системы, депрессивных состояний, улучшает настроение, повышает концентрацию внимания, работоспособность. При лечении алкоголизма и наркомании также применяют треонин.
Способствуют усвоению организмом треонина витамины В3 и В6, а также микроэлемент магний. Для полноценного качественного мышечного белка треонин необходимо употреблять в комплексе с метионином и аспарагиновой кислотой.
Как правило недостатка в треонине при полноценном питании быть не должно, но если человек употребляет малое количество белковых продуктов (мясо, рыба, грибы), нехватка этой важной аминокислоты может проявляться в мышечной слабости, депрессивных состояниях, выпадении волос, плохом состоянии кожных покровов, ногтей и зубов, задержке развития у детей. Недостаток треонина ведет к недостатку всех аминокислот, для синтеза которых он необходим. В медицинской практике зафиксированы случаи, когда треонин не усваивается организмом. Тогда для лечения назначают повышенные дозы глицина и серина, которые образуются в результате синтеза треонина.
Избыток треонина в организме приводит к накоплению мочевой кислоты. При употреблении пищевых добавок с этой аминокислотой необходимо следить за этим, так как и избыток и недостаток треонина вредит нашему здоровью.
В каких же продуктах содержится треонин? В белковых продуктах - мясе, птице, яйцах, сыре, в жирной морской рыбе, морепродуктах, а также в грибах. Растительная пища тоже содержит треонин, но в меньших количествах, он присутствует в чечевице, фасоли, пшенице, ржи, гречке, а также в орехах. Недостаток треонина могут испытывать вегетарианцы, ограничивающие употребление животной пищи.
Суточная потребность треонина составляет для взрослого человека 0,5 г, для детей - 3 г. Потребность в треонине возрастает при активном росте и развитии организма, при повышенных физических нагрузках, во время занятий спортом, при депрессивных состояниях, и, как мы уже говорили, вегетарианстве. А вот с возрастом человека потребность в треонине снижается.
Для спортсменов эта аминокислота имеет огромное значение, так как она способствует росту и развитию мышечной массы, укрепляет мускулатуру, повышает силовые показатели, ускоряет восстановление после тяжелых тренировок.
Интересно, что треонин используется и в косметологии, он входит в состав кремов, различных косметических средств, способствуя разглаживанию морщин и поддержанию упругой и здоровой кожи.
Треонин считается одной из восьми жизненно важных для человека аминокислот, наряду с триптофаном, метионином, лизином, валином, лейцином, изолейцином и фенилаланином, а так как поступает в организм он только с пищей, необходимо полноценное белковое питание.
Аминокислота Треонин. L-треонин. Польза и вред
Сегодня, мы рассмотрим последнюю из группы незаменимых аминокислот – треонин (2-амино-3-гидроксибутановая кислота l-threonine), которая участвует не только в поддержании белкового обмена, но и во многих других жизненно-важных процессах. Поэтому необходимо наладить ежедневное поступление данной АМК в достаточном количестве. Говоря о пользе, перечислим основные биологические функции L-треонина, помогающие организму пребывать в добром здравии и хорошем настроении.
Полезные свойства треонина:
- обеспечивает нормальное функционирование сердечно-сосудистой, иммунной и центральной нервной систем в комбинации с метионином и аминокислотами аспарагиновой кислоты;
- препятствует отложению жиров в печени совместно с лизином, аланином, цистеином и аспарагиновой кислотой;
- укрепляет иммунитет помогает тимусу (вилочковой железе) в выработке антител;
- является предшественником глицина и серина – аминокислот, которые участвуют в производстве мышечной и соединительной ткани;
- помогает формированию прочной (здоровой) зубной эмали и крепких костей, так как является составной коллагена и эластина;
- благотворно влияет на работу желудочно-кишечного тракта, обладает противоязвенными свойствами;
- обеспечивает быстрое заживление ран после травм и хирургических вмешательств;
- используется в лечении депрессии, рассеянного или множественного склероза (снижает спастичность мышц), бокового амиотрофического склероза (ALS), также известного как болезнь Шарко.
Суточная потребность в треонине с возрастом понижается, если для детей норма составляет около 3 г, то для взрослых – 0,5 г.
Пищевые источники треонина: мясо (телятина, свинина, говядина, индейка), яйца, молочные продукты, рыба, грибы, зерно, листовые овощи, орехи, семена.
Симптомы дефицита данной аминокислоты: спутанность сознания, эмоциональное возбуждение, жировой гепатоз, нарушение в работе сердца, ЦНС, пищеварения и др.
Люди, которые активно занимаются спортом или испытывают тяжелые физические нагрузки, равно как и страдающие неврологическими и психоэмоциональными расстройствами должны позаботиться о дополнительном приеме амк треонин. Также более высокая концентрация вещества требуется для растущего организма ребенка.
О приеме треонина в форме добавок следует задуматься и вегетарианцам, так как его основными источниками являются продукты животного происхождения.
Принимая незаменимый треонин в виде биологически активной добавки, важно знать, что избыток может нанести вред.
Последствия превышения рекомендуемых суточных доз:
- дисфункция печени
- повышение уровня мочевой кислоты и аммиака, обладающего токсическим действие
- снижение работоспособности легких
- расстройства желудка, тошнота
- головная боль
Кроме того, дополнительно принимать треонин не рекомендуется во время беременности и кормления грудью. Чтобы избежать этих и других побочных эффектов от применения аминокислот, мы рекомендуем Ламинин – препарат от известного американского производителя – компании Лайф Фарм.
Laminine является единственным в мире источником всех незаменимых и заменимых аминокислот природного происхождения в сбалансированном количестве.
Препарат имеет доказательную базу и много положительных отзывов и результатов по всему миру, с которыми можно ознакомиться здесь.
Поскольку ламинин – это функциональная еда, которой вы кормите свою клетку, то и употреблять его можно без ограничений как по возрасту и состоянию здоровья, так и по количеству (верхней границы нормы нет). Рекомендации врачей по применению препарата laminin читайте здесь.
Лица, имеющие генетические заболевания, при которых треонин не усваивается вообще, должны дополнительно принимать аминокислоты глицин и серин (производные треонина), надежным источником которых ламинин и является.
По вопросам приобретания обращайтесь на следующие контакты:
Email: [email protected]
Skype: LaminineSupport
Телефон: +7906-942-56-39 (Светлана), подключены приложения Viber и WhatsApp
Всегда будем рады оказать помощь!
L-Threonine Треонин - Суточная норма. Недостаток L-Threonine Треонин
Суточная норма: 500 — 3000 мг
Треонин (2-амино-3-гидроксибутановая кислота L-Threonine) – это одна из незаменимых аминокислот, которая участвует в природном синтезе белков и ферментов. Она выполняет ряд значительных биологических функций и помогает пребывать в хорошем настроении и здравии. А также треонин используется в производстве кормов для животных, в том числе птиц.
В чистом виде треонин представляет собой белый кристаллический порошок.
Так как треонин является незаменимой аминокислотой и не может вырабатываться организмом самостоятельно, ее поступление необходимо обеспечить с помощью пищи и биологически активных добавок. Стоит также взять во внимание информацию о суточной потребности организма в треонине.
Суточная потребность организма в треонине
Согласно установленным нормам суточная потребность организма в треонине для взрослого человека составляет 0,5 грамма. Что же касается растущего организма, то он особенно нуждается в строительном материале, чем сформированный, поэтому для детей суточная потребность организма в треонине будет составлять 3 грамма.
Стоит обратить внимание и на то, что при недостатке или избытке L-треонина могут быть неприятные последствия.
Последствия недостатка треонина в организме
Недостаток треонина в организме человека может проявляться такими симптомами как: мышечная слабость, нарушение концентрации внимания, потеря мышечной массы, задержка роста и развития, психическое расстройство (депрессия). А также его нехватка негативно сказывается на состоянии кожных покровов, волос, ногтей и зубов. Но, как правило, человек получает достаточное количество треонина с едой, поэтому при условии полноценного и сбалансированного питания дефицитные состояния возникают крайне редко.
Последствия избытка треонина в организме
Избыток треонина проявляется усиленным накоплением мочевой кислоты в организме человека. Вследствие этого не стоит допускать избытка треонина в организме, во всем должен быть баланс, что поможет получить только пользу от его употребления, без каких-либо нежелательных последствий влияющих на общее состояние здоровья.
Полезные свойства треонина
Треонин является одной из наиважнейших аминокислот, которая поддерживает нормальный белковый обмен в организме, иммунные функции, работу сердечной деятельности, ЦНС, а также препятствует отложению жиров в печени. Треонин положительно влияет на ЖКТ, ускоряет обмен веществ, что помогает сохранять фигуру в хорошей форме, повышает настроение, стимулирует мозговую активность и существенно снижает симптомы токсикоза у беременных женщин.
Организм использует L-треонин для синтеза аминокислот серина и глицина, которые нужны для построения эластина, коллагена и мышечной ткани, что немаловажно и для атлетов. Аминокислота треонин формирует прочную эмаль зубов, дарит коже красоту и здоровье, укрепляет связки и мышцы, включая сердечные. И для того, чтобы предохранить мышцы миокарда от раннего износа, а скелетную мускулатуру наделить качественным белком следует применять треонин вместе с аспарагиновой кислотой и метионином. Микроэлемент магний и витамины В3 и В6 также усиливают активность данной аминокислоты.
Треонин эффективно применяется в комплексной терапии алкоголизма и наркомании, так как он имеет свойство снижать тягу к вредным привычкам. Его не менее активно используют при белковом голодании, истощении или ожирении, анемиях, инфекционных заболеваниях, лечении нервных расстройств, депрессий, некоторых видов склерозов, в период восстановления после тяжелых травм и переломов.
Помимо полезных свойств треонин имеет противопоказания и вред и это касается различных медицинских препаратов или специальных добавок (БАД) на его основе.
Противопоказания и вред треонина
Как и в случае с остальными аминокислотами, треонин в виде БАД и фармакологических препаратов не должен применяться без контроля специалиста. Это в особенности касается беременных и кормящих женщин. Нужно знать о том, что треонин безопасен в определенных дозах, которые подбираются индивидуально для каждого.
Противопоказанием для применения треонина является индивидуальная непереносимость, его одновременный прием с антидепрессантами или алкоголем.
Некоторые люди отмечают после приема L-треонина расстройства желудка, головную боль, тошноту, аллергические реакции в виде сыпи на коже.
Не зависимо от противопоказаний и возможного вреда от приема треонина, каждый из нас должен знать, в каких продуктах питания содержится эта аминокислота.
Продукты питания богатые треонином
К продуктам, которые богаты треонином относится мясо тетерева, баранина, конина, говядина, курица, индейка. Значительное его количество содержится в куриных и перепелиных яйцах, сыре, морской рыбе, грибах. А также он присутствует в крупах и злаках.
Треонин [LifeBio.wiki]
Фармакологическая группа: Аминокислоты
Треонин (сокращенно Thr или T) - α-аминокислота с химической формулой HO2CCH (NH2) СН (ОН) СН3. Ее кодоны ACU, ACA, ACC и ACG. Это незаменимая аминокислота, классифицируемая как полярная. Вместе с серином треонин является одной из двух протеиногенных аминокислот, имеющих спиртовую группу (тирозин является фенолом, а не спиртом, так как его гидроксильная группа присоединена непосредственно к ароматическому кольцу, придавая ему различные кислотные/основные и окислительные свойства). Треонин также является одной из двух обычных аминокислот, имеющих хиральную боковую цепь, наряду с изолейцином. Остаток треонина подвергается многочисленным посттрансляционным модификациям. Гидроксильная боковая цепь может подвергаться О-связанному гликозилированию. Кроме того, треонин подвергается фосфорилированию под воздействием треонин киназы. В фосфорилированной форме он может упоминаться как фосфотреонин.
История
Треонин был обнаружен в 1930 году Уильямом Роузом Каммингом в качестве последней из 20 известных протеиногенных аминокислот.
Стереоизомерия
Треонин является одной из двух аминокислот, имеющих два хиральных центра. Треонин может существовать в четырех возможных стереоизомерах в следующих конфигурациях: (2S, 3R), (2R, 3S), (2S, 3S) и (2R, 3R). Однако название L-треонин используют для одного диастереомера, (2S, 3R)-2-амино-3-гидроксибутановой кислоты. Второй стереоизомер (2S, 3S), который редко присутствует в природе, называют L-алло-треонин. Два этих стереоизомера (2R, 3S)- и (2R, 3R)-2-амино-3- гидроксибутановая кислота имеют лишь второстепенное значение.
Биосинтез
Треонин является незаменимой аминокислотой, то есть не синтезируется в организме человека, поэтому ее необходимо потреблять в виде треонин-содержащих белков. У растений и микроорганизмов треонин синтезируется из аспарагиновой кислоты с помощью α-аспартил-полуальдегида и гомосерина. Гомосерин подвергается О-фосфорилированию, эта эфир фосфорная кислота подвергается гидролизу одновременно с перемещением группы ОН ферментов, участвующих в типичном биосинтезе треонина, включающем:
аспартокиназу\\ β-аспартат полуальдегиддегидрогеназу\\ гомосериндегидрогеназу\\ гомосерин киназу\\ треонинсинтазу.
Биосинтез треонина
Метаболизм
Треонин метаболизируется двумя способами:
Он превращается в пируват через треонин дегидрогеназу. Промежуточное соединение на этом пути может подвергаться тиолизу с коферментом А (СоА), производя ацетил-СоА и глицин. У человека он преобразуется в α-кетобутират через фермент серин дегидратазы, и таким образом способствует образованию сукцинил- СоА.
Источники
Продукты с высоким содержанием треонина включают творог, птицу, рыбу, мясо, чечевицу, фасоль сорта Черная черепаха и семена кунжута.
Рацемический треонин может быть получен из кротоновой кислоты путем альфа-функционализации с использованием ртуть (II) ацетата.
:Tags
Читать еще: ACE-031 , Адефовир , Ампакины , Бутея роскошная , Дигидроэрготамин ,
треонин.txt · Последние изменения: 2015/09/25 17:53 (внешнее изменение)
Незаменимые аминокислоты — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 сентября 2018; проверки требуют 60 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 сентября 2018; проверки требуют 60 правок. 21 протеиногенная α-аминокислота эукариот, сгруппированные согласно радикалам.
21 протеиногенная α-аминокислота эукариот, сгруппированные согласно радикалам. Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме. Для разных видов организмов список незаменимых аминокислот различен. Все белки, синтезируемые организмом, собираются в клетках из 20 базовых аминокислот, только часть из которых может синтезироваться организмом. Невозможность сборки определённого белка организмом приводит к нарушению его нормальной работы, поэтому необходимо поступление незаменимых аминокислот в организм с пищей. [1]
Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин; также часто к незаменимым относят гистидин[2][3]; (F V T W M L I K H). Для детей также незаменимым является аргинин.
6 других аминокислот (R C G Q P Y) считаются условно незаменимыми в питании человека, что означает ограниченные возможности их синтеза в зависимости от состояния организма, например у новорожденных и больных людей.[4].
5 аминокислот (A D N E S) — заменимые у человека, означает что они могут синтезироваться в достаточных количествах в организме.[4]
Роль незаменимых для человека аминокислот[править | править код]
В результате дефицита необходимых аминокислот в организме человека нарушается синтез белков, что приводит к ослаблению функций памяти и умственных способностей, снижению иммунитета (сопротивляемости организма болезням). В то же время избыток потребления несбалансированного белка приводит к перегрузке работы органов, в первую очередь печени и почек. Ценность потребляемого с пищей белка для человека определяется его сбалансированностью по содержанию незаменимых аминокислот.[1]
Рассчитать требования к рекомендованной суточной норме достаточно сложно; эти значения претерпели значительные изменения за последние 20 лет. Следующая таблица представляет список рекомендованных ВОЗ и Национальной библиотекой медицины США суточных норм для взрослого человека.[5][6]
| Аминокислота(ы) | ВОЗ мг на 1 кг веса тела | ВОЗ мг для веса 70 кг | США мг на 1 кг веса тела | Кодирующий кодон генетического кода |
|---|---|---|---|---|
| H Гистидин | 10 | 700 | 14 | CAU, CAC |
| I Изолейцин | 20 | 1400 | 19 | AUU, AUC, AUA |
| L Лейцин | 39 | 2730 | 42 | UUA, UUG, CUU, CUC, CUA, CUG |
| K Лизин | 30 | 2100 | 38 | AAA, AAG |
| M Метионин + C Цистеин | 10,4 + 4,1 (15 всего) | 1050 всего | 19 всего | Метионин: AUG; Цистеин: UGU, UGC. |
| F Фенилаланин + Y Тирозин | 25 (всего) | 1750 всего | 33 всего | Фенилаланин: UUU, UUC; Тирозин: UAU,UAC . |
| T Треонин | 15 | 1050 | 20 | ACU, ACC, ACA, ACG |
| W Триптофан | 4 | 280 | 5 | UGG |
| V Валин | 26 | 1820 | 24 | GUU, GUC, GUA, GUG |
Рекомендованная суточная норма для детей от 3 лет и старше на 10-20 % выше, чем для взрослого.[5][7]
Продукты с повышенным содержанием отдельных незаменимых аминокислот[править | править код]
- Валин: зерновые, бобовые, арахис, грибы, молочные продукты, мясо.
- Изолейцин: миндаль, кешью, турецкий горох (нут), чечевица, рожь, большинство семян, соя, яйца, куриное мясо, рыба, печень, мясо.
- Лейцин: чечевица, орехи, большинство семян, овёс, бурый (неочищенный) рис, рыба, яйца, курица, мясо.
- Лизин: пшеница, орехи, амарант, молочные продукты, рыба, мясо, горох.
- Метионин: бобы, фасоль, чечевица, соя, молоко, яйца, рыба, мясо.
- Треонин: орехи, бобы, молочные продукты, яйца.
- Триптофан: бобовые, овёс, сушёные финики[источник не указан 2022 дня], арахис, кунжут, кедровые орехи, молоко, йогурт, творог, рыба, курица, индейка, мясо.
- Фенилаланин: бобовые, орехи, говядина, куриное мясо, рыба, яйца, творог, молоко. Также образуется в организме при распаде синтетического сахарозаменителя — аспартама, активно используемого в пищевой промышленности.
- Аргинин (частично-заменимая аминокислота, образуется из аминокислот, поступающих с пищей, не путать с условно-заменимыми, которые образуются из незаменимых кислот, не поступающих с пищей): семена тыквы, арахис, кунжут, йогурт, швейцарский сыр, свинина, говядина, горох.
- Гистидин (частично-заменимая аминокислота): соевые бобы, арахис, чечевица, тунец, лосось, куриные грудки, свиная вырезка, говяжье филе.
Компенсация незаменимых аминокислот[править | править код]
Несмотря на то, что самостоятельно организм не способен синтезировать незаменимые аминокислоты, их недостаток в некоторых случаях все же может быть частично компенсирован. Так, например, недостаток поступающего вместе с пищей незаменимого фенилаланина может быть частично замещен заменимым тирозином. Гомоцистеин вместе с необходимым количеством доноров метильных групп снижает потребности в метионине, а глутаминовая кислота частично замещает аргинин.
- ↑ 1 2 https://cyberleninka.ru/article/n/metodologiya-otsenki-sbalansirovannosti-aminokislotnogo-sostava-mnogokomponentnyh-pischevyh-produktov.pdf
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/1123426 1975
- ↑ apps.who.int/iris/bitstream/10665/38133/1/9251030979_eng.pdf 1991
- ↑ 1 2 Dietary Reference Intakes: The Essential Guide to Nutrient Requirements Архивировано 5 июля 2014 года.. Institute of Medicine’s Food and Nutrition Board. usda.gov
- ↑ 1 2 FAO/WHO/UNU (2007), PROTEIN AND AMINO ACID REQUIREMENTS IN HUMAN NUTRITION, WHO Press, <http://whqlibdoc.who.int/trs/WHO_TRS_935_eng.pdf> , page 150
- ↑ Institute of Medicine (англ.)русск.. Protein and Amino Acids // Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (англ.). — Washington, DC: The National Academies Press (англ.)русск., 2002. — P. 589—768.
- ↑ Imura K., Okada A. Amino acid metabolism in pediatric patients (неопр.) // Nutrition. — 1998. — Т. 14, № 1. — С. 143—148. — doi:10.1016/S0899-9007(97)00230-X. — PMID 9437700.
- Amino acids / MedlinePlus Encyclopedia, 2015: (англ.) «The 9 essential amino acids are: histidine, isoleucine, leucine, lysine, methionine, phenylalanine, threonine, tryptophan, and valine.»
- https://web.archive.org/web/20150226110517/http://www.uic.edu/classes/phar/phar332/Clinical_Cases/aa%20metab%20cases/PKU%20Cases/essential-nonessential.htm
- ESSENTIAL AMINO ACID REQUIREMENTS: A REVIEW / FAO, 1981
- Recommended Dietary Allowances: 10th Edition., National Research Council (US), National Academies Press 1989. Chapter 6 «Protein and Amino Acids» (англ.)
Треонин. Суточная норма. Недостаток треонина
Треонин (2-амино-3-гидроксибутановая кислота L-Threonine) – это одна из незаменимых аминокислот, которая участвует в природном синтезе белков и ферментов. Она выполняет ряд значительных биологических функций и помогает пребывать в хорошем настроении и здравии. А также треонин используется в производстве кормов для животных, в том числе птиц.
В чистом виде треонин представляет собой белый кристаллический порошок.
Так как треонин является незаменимой аминокислотой и не может вырабатываться организмом самостоятельно, ее поступление необходимо обеспечить с помощью пищи и биологически активных добавок. Стоит также взять во внимание информацию о суточной потребности организма в треонине.
Суточная потребность организма в треонине
Согласно установленным нормам суточная потребность организма в треонине для взрослого человека составляет 0,5 грамма. Что же касается растущего организма, то он особенно нуждается в строительном материале, чем сформированный, поэтому для детей суточная потребность организма в треонине будет составлять 3 грамма.
Стоит обратить внимание и на то, что при недостатке или избытке L-треонина могут быть неприятные последствия.
Последствия недостатка треонина в организме
Недостаток треонина в организме человека может проявляться такими симптомами как: мышечная слабость, нарушение концентрации внимания, потеря мышечной массы, задержка роста и развития, психическое расстройство (депрессия). А также его нехватка негативно сказывается на состоянии кожных покровов, волос, ногтей и зубов. Но, как правило, человек получает достаточное количество треонина с едой, поэтому при условии полноценного и сбалансированного питания дефицитные состояния возникают крайне редко.
Последствия избытка треонина в организме
Избыток треонина проявляется усиленным накоплением мочевой кислоты в организме человека. Вследствие этого не стоит допускать избытка треонина в организме, во всем должен быть баланс, что поможет получить только пользу от его употребления, без каких-либо нежелательных последствий влияющих на общее состояние здоровья.
Полезные свойства треонина
Треонин является одной из наиважнейших аминокислот, которая поддерживает нормальный белковый обмен в организме, иммунные функции, работу сердечной деятельности, ЦНС, а также препятствует отложению жиров в печени. Треонин положительно влияет на ЖКТ, ускоряет обмен веществ, что помогает сохранять фигуру в хорошей форме, повышает настроение, стимулирует мозговую активность и существенно снижает симптомы токсикоза у беременных женщин.
Организм использует L-треонин для синтеза аминокислот серина и глицина, которые нужны для построения эластина, коллагена и мышечной ткани, что немаловажно и для атлетов. Аминокислота треонин формирует прочную эмаль зубов, дарит коже красоту и здоровье, укрепляет связки и мышцы, включая сердечные. И для того, чтобы предохранить мышцы миокарда от раннего износа, а скелетную мускулатуру наделить качественным белком следует применять треонин вместе с аспарагиновой кислотой и метионином. Микроэлемент магний и витамины В3 и В6 также усиливают активность данной аминокислоты.
Треонин эффективно применяется в комплексной терапии алкоголизма и наркомании, так как он имеет свойство снижать тягу к вредным привычкам. Его не менее активно используют при белковом голодании, истощении или ожирении, анемиях, инфекционных заболеваниях, лечении нервных расстройств, депрессий, некоторых видов склерозов, в период восстановления после тяжелых травм и переломов.
Помимо полезных свойств треонин имеет противопоказания и вред и это касается различных медицинских препаратов или специальных добавок (БАД) на его основе.
Противопоказания и вред треонина
Как и в случае с остальными аминокислотами, треонин в виде БАД и фармакологических препаратов не должен применяться без контроля специалиста. Это в особенности касается беременных и кормящих женщин. Нужно знать о том, что треонин безопасен в определенных дозах, которые подбираются индивидуально для каждого.
Противопоказанием для применения треонина является индивидуальная непереносимость, его одновременный прием с антидепрессантами или алкоголем.
Некоторые люди отмечают после приема L-треонина расстройства желудка, головную боль, тошноту, аллергические реакции в виде сыпи на коже.
Не зависимо от противопоказаний и возможного вреда от приема треонина, каждый из нас должен знать, в каких продуктах питания содержится эта аминокислота.
Продукты питания богатые треонином
К продуктам, которые богаты треонином относится мясо тетерева, баранина, конина, говядина, курица, индейка. Значительное его количество содержится в куриных и перепелиных яйцах, сыре, морской рыбе, грибах. А также он присутствует в крупах и злаках.
Аминокислоты — Википедия
Аминокисло́ты (аминокарбо́новые кисло́ты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы. Основные химические элементы аминокислот — это углерод (C), водород (H), кислород (O), и азот (N), хотя другие элементы также встречаются в радикале определенных аминокислот. Известны около 500 встречающихся в природе аминокислот (хотя только 20 используются в генетическом коде). [1] Аминокислоты могут рассматриваться как производные карбоновых кислот, в которых один или несколько атомов водорода заменены на аминогруппы.
Большинство из около 500 известных аминокислот были открыты после 1953 года, например во время поиска новых антибиотиков в среде микроорганизмов, грибов, семян, растений, фруктов и жидкостях животных. Примерно 240 из них встречается в природе в свободном виде, а остальные только как промежуточные элементы обмена веществ.[1]
Открытие аминокислот в составе белков[править | править код]
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен[2] |
|---|---|---|---|---|
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[de] |
| Глутамин | Gln, Q | |||
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[en] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шёлка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель[3], С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и другие |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и другие |
Жирным шрифтом выделены незаменимые аминокислоты.
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления; многие из них имеют сладкий вкус. Эти свойства отчётливо указывают на солеобразный характер этих соединений. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и основной.
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами:
- NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (Хлороводородная соль глицина)
- NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей.
- NH2 —CH2COOH N+H3 —CH2COO-
Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
- NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
- HOOC —CH2 —NH —H + HOOC —CH2 —NH2→ HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Большинство аминокислот можно получить в ходе гидролиза белков или как результат химических реакций:
- CH3COOH + Cl2 + (катализатор) → CH2ClCOOH + HCl; CH2ClCOOH + 2NH3→ NH2 —CH2COOH + NH4Cl
Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметрический атом углерода (треонин и изолейцин содержат два асимметрических атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-конфигурацию, и лишь L-аминокислоты включаются в состав белка, синтезируемых на рибосомах.
Аспарагиновые остатки в метаболически неактивных структурных белках претерпевают медленную самопроизвольную неферментативную рацемизацию: в белках дентина и эмали зубов L-аспартат переходит в D-форму со скоростью ~0,1 % в год[4], что может быть использовано для определения возраста млекопитающих. Рацемизация аспартата также отмечена при старении коллагена; предполагается, что такая рацемизация специфична для аспарагиновой кислоты и протекает за счёт образования сукцинимидного кольца при внутримолекулярном ацилировании атома азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[5].
С развитием следового аминокислотного анализа D-аминокислоты были обнаружены сначала в составе клеточных стенок некоторых бактерий (1966), а затем и в тканях высших организмов.[6] Так, D-аспартат и D-метионин предположительно являются нейромедиаторами у млекопитающих[7].
В состав некоторых пептидов входят D-аминокислоты, образующиеся при посттрансляционной модификации. Например, D-метионин и D-аланин входят в состав опиоидных гептапептидов кожи южноамериканских амфибий филломедуз (дерморфина, дермэнкефалина и делторфинов). Наличие D-аминокислот определяет высокую биологическую активность этих пептидов как анальгетиков.
Сходным образом образуются пептидные антибиотики бактериального происхождения, действующие против грамположительных бактерий — низин, субтилин и эпидермин.[8]
Гораздо чаще D-аминокислоты входят в состав пептидов и их производных, образующихся путём нерибосомного синтеза в клетках грибов и бактерий. Видимо, в этом случае исходным материалом для синтеза служат также L-аминокислоты, которые изомеризуются одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые селеноцистеин (Sec, U) и пирролизин (Pyl, O).[9][10] Это так называемые 21-я и 22-я аминокислоты.[11]
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым[12]. Решение этого вопроса смотрим в работе[13]. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих. Например, ключевым промежуточным метаболитом пути биосинтеза треонина, изолейцина и метионина является α-аминокислота гомосерин. Очевидно, что гомосерин — очень древний метаболит, но для треонина, изолейцина и метионина существуют аминоацил-тРНК-синтетазы, тРНК, а для гомосерина — нет.
Структурные формулы 20 протеиногенных аминокислот обычно приводят в виде так называемой таблицы протеиногенных аминокислот:
Классификация[править | править код]
| Аминокислота | 3-буквы[14] | 1-буква[14] | аминокислот | мнемоническое правило[15] | Полярность[16] | радикалу | Mr | Vw (Å3) | pI | шкала гидрофобности[17] | частота в белках (%)[18] |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75,067 | 48 | 6,06 | −0,4 | 7,03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89,094 | 67 | 6,01 | 1,8 | 8,76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117,148 | 105 | 6,00 | 4,2 | 6,73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131,175 | 124 | 6,05 | 4,5 | 5,49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131,175 | 124 | 6,01 | 3,8 | 9,68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6,30 | −1,6 | 5,02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105,093 | 73 | 5,68 | −0,8 | 7,14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119,119 | 93 | 5,60 | −0,7 | 5,53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Полярные | Серосодержащие | 121,154 | 86 | 5,05 | 2,5 | 1,38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149,208 | 124 | 5,74 | 1,9 | 2,32 |
| Аспарагиновая кислота | Asp | D | GAU, GAC | asparDic acid | Полярные заряженные отрицательно | заряженные отрицательно | 133,104 | 91 | 2,85 | −3,5 | 5,49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132,119 | 96 | 5,41 | −3,5 | 3,93 |
| Глутаминовая кислота | Glu | E | GAA, GAG | gluEtamic acid | Полярные заряженные отрицательно | заряженные отрицательно | 147,131 | 109 | 3,15 | −3,5 | 6,32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146,146 | 114 | 5,65 | −3,5 | 3,9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146,189 | 135 | 9,60 | −3,9 | 5,19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10,76 | −4,5 | 5,78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные заряженные положительно | Гетероциклические | 155,156 | 118 | 7,60 | −3,2 | 2,26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165,192 | 135 | 5,49 | 2,8 | 3,87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181,191 | 141 | 5,64 | −1,3 | 2,91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические, Гетероциклические | 204,228 | 163 | 5,89 | −0,9 | 6,73 |
По радикалу[править | править код]
- Неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин
- Полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин
- Ароматические: фенилаланин, триптофан, тирозин
- Полярные заряженные отрицательно при pH=7: аспартат, глутамат
- Полярные заряженные положительно при pH=7: лизин, аргинин, гистидин[16]
По функциональным группам[править | править код]
- Алифатические
- Моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин
- Оксимоноаминокарбоновые: серин, треонин
- Моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд
- Амиды моноаминодикарбоновых: аспарагин, глутамин
- Диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд
- Серосодержащие: цистеин, метионин
- Ароматические: фенилаланин, тирозин, триптофан,
- Гетероциклические: триптофан, гистидин, пролин
- Иминокислоты: пролин
По классам аминоацил-тРНК-синтетаз[править | править код]
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланин
Для аминокислоты лизин существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза[править | править код]
Пути биосинтеза протеиногенных аминокислот разноплановы. Одна и та же аминокислота может образовываться разными путями. К тому же совершенно различные пути могут иметь очень похожие этапы. Тем не менее, имеют место и оправданы попытки классифицировать аминокислоты по путям их биосинтеза. Существует представление о следующих биосинтетических семействах аминокислот: аспартата, глутамата, серина, пирувата и пентоз. Не всегда конкретную аминокислоту можно однозначно отнести к определённому семейству; делаются поправки для конкретных организмов и учитывая преобладающий путь. По семействам аминокислоты обычно распределяют следующим образом:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Фенилаланин, тирозин, триптофан иногда выделяют в семейство шикимата.
По способности организма синтезировать из предшественников[править | править код]
- Незаменимые
- Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые
- Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозин.
Классификация аминокислот на заменимые и незаменимые не лишена недостатков. К примеру, тирозин является заменимой аминокислотой только при условии достаточного поступления фенилаланина. Для больных фенилкетонурией тирозин становится незаменимой аминокислотой. Аргинин синтезируется в организме человека и считается заменимой аминокислотой, но в связи с некоторыми особенностями его метаболизма при определённых физиологических состояниях организма может быть приравнен к незаменимым. Гистидин также синтезируется в организме человека, но не всегда в достаточных количествах, потому должен поступать с пищей.
По характеру катаболизма у животных[править | править код]
Биодеградация аминокислот может идти разными путями.
По характеру продуктов катаболизма у животных протеиногенные аминокислоты делят на три группы:
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты[править | править код]
«Миллеровские» аминокислоты — обобщенное название аминокислот, получающихся в условиях, близких к эксперименту Стенли Л. Миллера 1953 года. Установлено образование в виде рацемата множества различных аминокислот, в том числе: глицин, аланин, валин, изолейцин, лейцин, пролин, серин, треонин, аспартат, глутамат
В медицине ряд веществ, способных выполнять некоторые биологические функции аминокислот, также (хотя и не совсем верно) называют аминокислотами:
Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона, энанта.[19]
Аминокислоты входят в состав спортивного питания и комбикорма. Аминокислоты применяются в пищевой промышленности в качестве вкусовых добавок, например, натриевая соль глутаминовой кислоты.[20]
- ↑ 1 2 Wagner I., Musso H. New Naturally Occurring Amino Acids (нем.) // Angewandte Chemie International Edition in English : magazin. — 1983. — November (Bd. 22, Nr. 11). — S. 816—828. — doi:10.1002/anie.198308161.
- ↑ Овчинников Ю. А. «Биоорганическая химия» М:Просвещение, 1987. — 815 с., стр. 25.
- ↑ Карпов В. Л. От чего зависит судьба гена (рус.) // Природа. — Наука, 2005. — № 3. — С. 34—43.
- ↑ Helfman, P M; J L Bada. Aspartic acid racemization in tooth enamel from living humans (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1975. — Vol. 72, no. 8. — P. 2891 —2894.
- ↑ CLOOS P; FLEDELIUS C. Collagen fragments in urine derived from bone resorption are highly racemized and isomerized: a biological clock of protein aging with clinical potential (неопр.) (1 февраля 2000). Дата обращения 5 сентября 2011. Архивировано 2 февраля 2012 года.
- ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R—36R. — ISSN 0959-6658.
- ↑ Herman Wolosker, Elena Dumin, Livia Balan, Veronika N. Foltyn. D-amino acids in the brain: D-serine in neurotransmission and neurodegeneration // The FEBS journal. — 2008-7. — Т. 275, вып. 14. — С. 3514—3526. — ISSN 1742-464X. — doi:10.1111/j.1742-4658.2008.06515.x.
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317—327. — ISSN 0950-382X.
- ↑ Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins—properties and biotechnological use // Biochimica et Biophysica Acta (BBA) - General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1—13. — ISSN 0304-4165. — doi:10.1016/j.bbagen.2005.05.010.
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706—712. — ISSN 1369-5274. — doi:10.1016/j.mib.2005.10.009.
- ↑ Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29—35. — ISSN 1552-4450. — doi:10.1038/nchembio847.
- ↑ Andrei S. Rodin, Eörs Szathmáry, Sergei N. Rodin. On origin of genetic code and tRNA before translation // Biology Direct. — 2011-02-22. — Т. 6. — С. 14. — ISSN 1745-6150. — doi:10.1186/1745-6150-6-14.
- ↑ Burtyka M.V. Биометрия: метрика молекулярного углеродистого многообразия.CTAG biometry=http://biometry-burtyka.blogspot.com.
- ↑ 1 2 Cooper, Geoffrey M. The cell : a molecular approach. — 3rd ed. — Washington, D.C.: ASM Press, 2004. — xx, 713 pages с. — ISBN 0878932143, 9780878932146, 0878930760, 9780878930760.
- ↑ Р. Б. Соловьев, учитель биологии. Несколько мнемонических правил
- ↑ 1 2 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с. — ISBN 5-225-02709-1.
- ↑ J. Kyte, R. F. Doolittle. A simple method for displaying the hydropathic character of a protein // Journal of Molecular Biology. — 1982-05-05. — Т. 157,