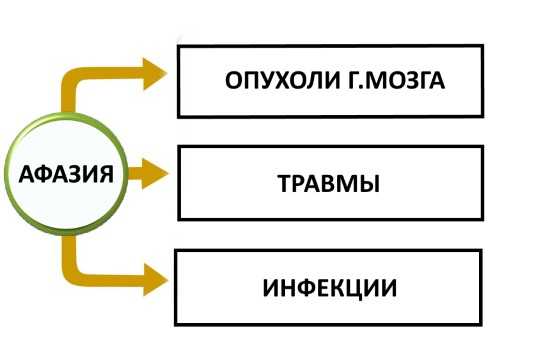
Триперекись ацетона что это такое
Пероксид ацетона — Википедия
| Пероксид ацетона[1] | |
|---|---|
| Изомеры | |
Общие | |
| Хим. формула | тример: C9H18O6 димер: C6H12O4 |
Физические свойства | |
| Молярная масса | |
| Плотность |
тример: 1,2 г/см³ |
Термические свойства | |
| Т. плав. | тример: 92—93 ℃ димер: 133—135 ℃ |
| Т. кип. | тример: 184,93 ℃ |
| Т. всп. | тример: 51,467 ℃ |
| Давление пара | тример: 0,98 мм рт. ст. (25 °C) |
Оптические свойства | |
| Показатель преломления | тример: 1,382 |
Классификация | |
| Номер CAS | 1336-17-0 |
| PubChem | 15908632 |
| ChemSpider | 3582942 |
| Номер ООН | 3105 |
1S/C3H8O4/c1-3(2,6-4)7-5/h5-5H,1-2h4 | |
Безопасность | |
| Токсичность | токсичен. |
| Пиктограммы СГС | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Пероксид ацетона или перекись ацетона — инициирующее взрывчатое вещество, впервые полученное Рихардом Вольфенштейном в 1895 году[2][3].
Первые эксперименты по получению пероксидов ацетона были проведены Вольфенштейном в 1895 году, когда он изучал действие пероксида водорода на кониин в ацетоновом растворе, полагая, что ацетон и пероксид водорода не взаимодействуют. Вольфенштейн обнаружил, что из смеси равных объёмов ацетона и 10%-го пероксида водорода выпадают кристаллы, которые он охарактеризовал как тримерный пероксид ацетона (триперекись ацетона 2). Также он заметил, что реакция происходит быстрее при добавлении малых количеств фосфорной кислоты[4].
В 1899 году Адольф Байер и Виктор Виллигер синтезировали также димерный пероксид ацетона (диперекись ацетона 1). В 1933 году Лекок наблюдал процесс деполимеризации трипероксида ацетона при определении его молекулярной массы методом криоскопии, а также при плавлении. В 1947 году изучалось влияние кислот на образование пероксидов ацетона, в частности, было замечено, что серная, соляная, фосфорная и азотная кислоты значительно ускоряют окисление ацетона пероксидом водорода, а в присутствии органических кислот (уксусной, бензойной) образования продукта не происходит [4].
К настоящему времени получены пероксиды ацетона четырёх структур[5].
Димерный пероксид ацетона (диперекись ацетона, 1) получают с выходом 94 % при обработке ацетона 86%-ным пероксидом водорода в ацетонитриле в присутствии серной кислоты при пониженной температуре. Другим способом синтеза диперекиси ацетона является реакция ацетона с персульфатом калия в разбавленной серной кислоте. Тримерный пероксид ацетона (триперекись ацетона, 2) образуется в данных реакциях как примесь. Для препаративного получения данного продукта применяют реакцию ацетона с эквивалентным количеством 50%-ной перекиси водорода и 0,25 эквивалентами серной кислоты. Триперекись ацетона можно очистить низкотемпературной перекристаллизацией из пентана [5]. При этом она кристаллизуется в виде длинных плоских призмовидных кристаллов[4].
Пероксиды 3 и 4 могут быть получены в данных реакциях при отсутствии минеральной кислоты. Например, смесь ацетона и 50%-ной перекиси водорода при перемешивании в течение трёх часов при 0 °С даёт исключительно 2,2-бис(гидроперокси)пропан 3. Увеличение времени реакции приводит к образованию продукта 4[5].
Трипероксид ацетона легко возгоняется:
- при температуре от +14 до +18 °С он теряет около 6,5 % массы за 24 часа;
- при +25 °С — 68 % массы за 14 дней;
- при +50 °С — 1,5 % массы за 2 часа;
- при 100 °С — возгоняется весьма быстро[6].
Он растворим в этаноле (0,15 г / 100 г при +17 °С), диэтиловом эфире (5,5), петролейном эфире (7,35), ацетоне (9,15), сероуглероде (9,97), пиридине (15,4), бензоле (18,0), трихлорэтилене (22,7), четырёххлористом углероде (24,8), хлороформе (42,5)[6], но нерастворим в воде[7].
При нагревании с разбавленной серной кислотой пероксид ацетона количественно гидролизуется с образованием ацетона и пероксида водорода:
- C6h22O4+2h3O→2C3H6O+2h3O2{\displaystyle {\mathsf {C_{6}H_{12}O_{4}+2H_{2}O\rightarrow 2C_{3}H_{6}O+2H_{2}O_{2}}}}[4]
Миллиграммовые количества дипероксида и трипероксида ацетона в течение 15 минут разлагаются сильными кислотами (например, серной кислотой или метансульфокислотой). Поскольку реакция экзотермична, действие сильных кислот на граммовые количества вызывает детонацию. Также трипероксид ацетона эффективно разрушается хлоридом олова(II) [7][8].
При получении с использованием метансульфокислоты, хлорной или серной кислоты трипероксид ацетона самопроизвольно превращается в дипероксид ацетона. Однако при использовании хлорида олова(IV), соляной или азотной кислоты он остаётся стабильным[9].
Использование в качестве взрывчатого вещества[править | править код]
Воспламенение пероксида ацетонаВ военных целях пероксид ацетона не используется из-за высокой летучести и чувствительности, однако, c 1980-x годов применяется в террористических целях как инициирующее или основное взрывчатое вещество[6][10]. Также существуют упоминания о применении пероксида ацетона в диверсионной практике советских разведчиков первой половины 20 века как импровизированного взрывчатого вещества, которое можно легко сделать из подручных химикатов:
«Мало кому из людей «мирных профессий» известно, что самые банальные «химикалии» могут стать иногда грозными разрушителями. Ацетон продается в аптеках для удаления с ногтей старого лака. Перекись водорода — для корректуры природного цвета женских волос. Соляная кислота идет на балансирование желудка и для пайки металлов. Но не рекомендуется смешивать вместе эти три вещества. Получающийся от смеси белый порошок является сильнейшей взрывчаткой»[11].
Использование террористами связано с простотой синтеза, а также с тем, что в молекуле данного вещества отсутствует азот, что делает невозможным определение взрывающего устройства стандартными устройствами, отвечающими на азот[12]. Трипероксид ацетона обладает примерно такой же взрывной силой, как тротил. Кроме того, он весьма чувствителен к нагреванию и удару и может воспламеняться под действием открытого пламени и электрического разряда[5], что делает сам процесс создания взрывающих устройств опасным (по этой причине трипероксид ацетона получил название «Мать Сатаны»)[12].
The Times сообщает, что через несколько дней после теракта в Манчестере (теракт произошел в ночь на 23 мая 2017 года) в открытом доступе в социальной сети Facebook и на YouTube находились пошаговые инструкции по изготовлению взрывных устройств на основе пероксида ацетона, вещества, которое использовал Абеди для совершения теракта.[13]
Сообщается, что данное вещество детонирует даже при содержании воды до 25 %[7]. К удару перекись ацетона чуть менее чувствительна, чем азид свинца. По бризантности она превосходит азид свинца и гремучую ртуть[4].
При взрыве пероксида ацетона происходит резкое образование большого объёма газов: из его одной молекулы образуются три молекулы ацетона и одна молекула озона[2]. Приводят также и другое уравнение разложения:
- (C3H6O2)3→1,3CO2+2,44CO+2,61Ch5+0,63C2H6+0,23C2h5+0,47h3+0,96h3O+0,47C{\displaystyle {\mathsf {(C_{3}H_{6}O_{2})_{3}\rightarrow 1,3CO_{2}+2,44CO+2,61CH_{4}+0,63C_{2}H_{6}+0,23C_{2}H_{4}+0,47H_{2}+0,96H_{2}O+0,47C}}}[4]
Скорость детонации трипероксида ацетона составляет 5300 м/с при плотности 1,2 г/см³ и около 1430 м/с при 0,47 г/см³. В диапазоне плотностей от 0,35 до 1,2 г/см³ эта зависимость линейна и подчиняется уравнению
y=5405,1x−1149{\displaystyle y=5405,1x-1149}.
Теплота взрыва составляет 2803 кДж/кг, что составляет 67 % от тротилового эквивалента (4.19 МДж/кг)
Использование в качестве пищевой добавки[править | править код]
Пероксид ацетона является пищевой добавкой, которой присвоено обозначение E929. Он улучшает качество мучных изделий. Однако, по состоянию на 2017 год пероксид ацетона практически не используется с этой целью, вместо него применяются другие улучшители[14].
Трипероксид и дипероксид ацетона можно обнаружить или проанализировать методом тонкослойной хроматографии на силикагеле (элюент: толуол, Rf 0,57 и 0,66 соответственно, проявка 1 % дифениламина в концентрированной серной кислоте). Подобраны также условия для анализа газовой хроматографией и масс-спектрометрией[7].
- ↑ 17088-37-8 Acetone peroxide (неопр.). Дата обращения 24 июля 2013. Архивировано 26 июля 2013 года.
- ↑ 1 2 Encyclopedia of Forensic Sciences, 3V Set ONLINE. — Academic Press. — 2013. — P. 102. — ISBN 978-0-12-382165-2.
- ↑ Wolffenstein R. Ueber die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd (нем.) // Berichte der Deutschen Chemischen Gesellschaft (англ.)русск. : magazin. — 1895. — Bd. 28, Nr. 2. — S. 2265—2269. — doi:10.1002/cber.189502802208.
- ↑ 1 2 3 4 5 6 Багал, 1975.
- ↑ 1 2 3 4 Agrawal J. P., Hodgson R. D. Organic Chemistry of Explosives. — Wiley, 2007. — P. 339—340. — ISBN 978-0-470-02967.
- ↑ 1 2 3 Yinon J. Forensic and Environmental Detection of Explosives. — John Wiley & Sons, 1999. — P. 10—12. — ISBN 0-471-98371-3.
- ↑ 1 2 3 4 Lunn G., Sansone E. B. Destruction of Hazardous Chemicals in the Laboratory. — John Wiley & Sons, 2012. — P. 459—462. — ISBN 978-0-470-48755-6.
- ↑ Oxley J. C., Smith J. L., Huang J., Luo W. Destruction of Peroxide Explosives (англ.) // Journal of Forensic Sciences. — 2009. — Vol. 54, no. 5. — P. 1029—1033. — doi:10.1111/j.1556-4029.2009.01130.x. — PMID 19737243.
- ↑ Matyas R., Pachman J., Ang H.-G. Study of TATP: Spontaneous Transformation of TATP to DADP (англ.) // Propellants, Explosives, Pyrotechnics. — 2008. — Vol. 33, no. 2. — P. 89—91. — doi:10.1002/prep.200700247.
- ↑ Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part I (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — Vol. 38, no. 2. — P. 244—254. — doi:10.1002/prep.201200116.
- ↑ Н. Хохлов. Право на совесть.
- ↑ 1 2 Girard J. E. Criminalistics: Forensic Science, Crime and Terrorism. — 2nd Ed.. — Jones & Bartlett Publishers, 2011. — P. 422. — ISBN 978-0-7637-7731-9.
- ↑ Террорист изготовил бомбу по инструкции в YouTube (неопр.). Cursorinfo. Дата обращения 24 июня 2017.
- ↑ Взрывоопасный кекс — о E-добавках, используемых при изготовлении хлебобулочных изделий, на канале «Наука 2.0»
- Багал Л. И. Химия и технология инициирующих взрывчатых веществ. — М.: Машиностроение, 1975. — С. 411—415.
- Wolffenstein R. Ueber die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd (нем.) // Berichte der deutschen chemischen Gesellschaft. — 1895. — Bd. 28, Nr. 2. — S. 2265—2269. — doi:10.1002/cber.189502802208.
- Baeyer A., Villiger V. Ueber die Einwirkung des Caro'schen Reagens auf Ketone (нем.) // Berichte der deutschen chemischen Gesellschaft. — 1900. — Bd. 33, Nr. 1. — S. 858—864. — doi:10.1002/cber.190003301153.
- Экспериментальные статьи
- Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part I (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — Vol. 38, no. 2. — P. 244—254. — doi:10.1002/prep.201200116.
- Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part 2 (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — doi:10.1002/prep.201200215.
Перекись ацетона: получение, свойства, формула
Образование 6 октября 2016Многие из нас в детстве увлекались взрывчатыми веществами. Но самодельная "взрывчатка" не всегда срабатывала, или вещество получалось недостаточно мощное. Всегда ждёшь от взрыва нечто большее, чем просто оглушающий звук. Так вот, сегодня мы разберём свойства, получение и применение такого взрывоопасного соединения, как перекись ацетона.
Сразу стоит предупредить, что получение этого вещества в домашних условиях не только очень опасно, но и карается Уголовным кодексом Российской Федерации.
Начнём мы с истории открытия этого замечательного вещества.

История
Первые эксперименты по получению пероксида ацетона проводились в 1895 году, когда немецкий химик Рихард Вольфенштейн проводил эксперимент по взаимодействию перекиси водорода и кониина (очень опасный яд, содержащийся в некоторых растениях). Он и не предполагал, что ацетон и пероксид водорода могут взаимодействовать между собой. Оказалось, что при смешивании равных количеств этих веществ (перекись имела концентрацию 10 %) выпадают кристаллы осадка. Вольфенштейн начал изучать эту реакцию и ко всему прочему обнаружил, что при добавлении фосфорной кислоты реакция ускоряется.
Однако всё было не так просто в этом веществе. Дело в том, что Рихард Вольфенштейн обнаружил триперекись ацетона. А в 1899 году ещё один немецкий химик Адольф Байер вместе с Виктором Виллигером синтезировал димерную модификацию пероксида ацетона. В 1947 году было изучено влияние различных кислот на скорость образования этого соединения. Как оказалось, соляная, серная, фосфорная и азотная кислоты значительно ускоряют окисление ацетона в присутствии перекиси водорода. Органические кислоты, такие как уксусная и бензойная, напротив, препятствуют образованию продукта.
Продолжим описание такого важного соединения, как перекись ацетона. Получение мы обсудим позже. А пока - немного теории.
Что такое перекись ацетона
В народе ее называют по-разному: "бомба из хозмага", "киса". Чем же всё-таки она так уникальна, что ее любят все начинающие пиротехники и террористы? Начнем с ее примечательных свойств. Любое химическое соединение обладает своими индивидуальными свойствами. Вот, например, соединение, которое мы освещаем в этой статье, относят к классу ВВ (взрывчатых веществ). Перекись ацетона запрещена к хранению и производству в России, так как может являться угрозой безопасности людей. Её часто применяют террористы в качестве инициатора - легкодетонирующего соединения, используемого для подрыва более сильного взрывоопасного соединения. Однако возможно использование и отдельно в качестве взрывчатки. Многие юные химики и пиротехники, заинтересовавшись эффектными взрывами различных химических веществ, начинают пробовать самостоятельно делать перекись ацетона в домашних условиях. Однако не всегда это заканчивается хорошо. Зачастую из-за взрыва люди получают травмы, что неудивительно, ведь перекись ацетона очень чувствительна к любым внешним воздействиям.
Сейчас поговорим немного о видах перекиси ацетона (точнее, её модификациях), их свойствах и способах синтеза. Это достаточно интересная тема, учитывая, что все виды отличаются друг от друга физическими и химическими характеристиками.

Модификации перекиси ацетона
Не все вещества, состоящие из молекул, устойчивы в обычном состоянии. Многие образуют полимерные формы. Одним из них и является обсуждаемое сегодня нами вещество. Поэтому однозначно нельзя сказать, какая формула перекиси ацетона. Она имеет несколько модификаций: три димера (полимер, состоящий из двух молекул) и один тример (состоит из трёх молекул). Но, перед тем как разобрать строение конкретно таких структур, мы обсудим формулу мономера, то есть одной отдельно взятой молекулы перекиси ацетона. В общем виде её можно представить так:
Но если попытаться нарисовать структурную формулу такого вещества, мы столкнёмся с некоторыми трудностями.
Перекись чего-либо - это вещество с дополнительным атомом кислорода, который соединяется с другим таким же атомом в этом соединении и образует так называемую "очковую" связь (так как в структурном виде она выглядит как очки: О-О). В ацетоне атом кислорода связан двойной связью с углеродом. Во-первых, эта связь достаточно прочная, и чтобы присоединить к атому углерода второй кислород, нужно приложить большую энергию. Во-вторых, если это всё же удалось (благодаря сильным окислителям, к которым также относится перекись водорода), устойчивость получившегося соединения крайне низкая из-за наличия двух атомов кислорода у одного атома углерода и недостатка электронов в системе. Для того чтобы создать устойчивую форму, молекулы группируются по две или по три и образуют полимеры.

Диперекись ацетона
Самый частый вариант группировки, которую принимает перекись ацетона, - это димер. Он состоит из двух молекул, связанных между собой через атомы кислорода. Такой продукт наиболее устойчив, но всё же разлагается за 15 минут сильными кислотами. Получить его сложнее, чем следующую модификацию, но об этом чуть позже.
Триперекись ацетона
Вообще, большей частью перекись ацетона (взрывчатое вещество) состоит из тримера (триперекиси) и получается достаточно легко в домашних условиях. По физическим свойствам немного отличается от других модификаций: легко возгоняется, особенно при повышении температуры, хорошо растворяется во многих органических растворителях, но выпадает в осадок в воде. Очень интересно то, что тример взрывается, даже если четверть его массы составляет вода. Ниже вы можете увидеть, как графически выглядит перекись ацетона, формула которой соответствует тримеру.
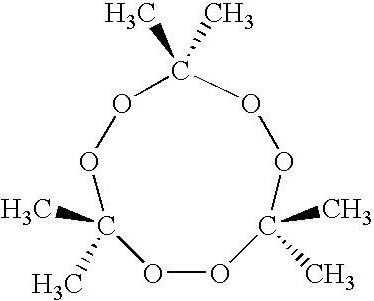
Синтез
Перекись ацетона, получение которой происходит только для технологических нужд, используется в пищевой промышленности. Удивительно, что такое взрывоопасное вещество используется как пищевая добавка под номером Е-929. Однако переживать не стоит: кроме детонирующих свойств это соединение обладает консервирующим действием. О его применении мы поговорим позже. А сейчас немного о способах получения.
Многие интересуются: как получить перекись ацетона без кислоты? Это самый простой способ её синтеза. Вообще, в лаборатории первый раз это соединение получили, смешав равные объёмы концентрированной (10-процентной) перекиси водорода и ацетона. Для ускорения реакции добавляют какую-либо минеральную кислоту, в роли которой может выступать как серная или соляная, так и фосфорная. Таким способом получают почти чистую триперекись. Для синтеза димера используют более сложный способ. Для этого в раствор ацетона добавляют 86-процентный пероксид водорода, ацетонитрил и серную кислоту. Всю систему охлаждают и в конце выделяют продукт с выходом 94 процента. Как стало понятно, чтобы получить димерную перекись ацетона в домашних условиях, надо очень хорошо постараться. Но есть ещё один способ. Подойдёт он для тех, у кого под рукой есть персульфат калия и разбавленная серная кислота. Смешение этих реагентов с ацетоном также даёт обсуждаемое нами соединение.
Можно использовать при получении разные кислоты, но они будут давать разные результаты. Например, при синтезе с использованием метансульфокислоты, серной или хлорной кислот, тример пероксида ацетона самопроизвольно превращается в димерную форму. Но такого не происходит, если использовать хлорид олова, соляную или азотную кислоту. Однако в самом простом случае не требуется ни кислот, ни каких-либо манипуляций с системой: только смешение равных объёмов исходных веществ.
Мы разобрали лабораторные методы, с помощью которых можно получить перекись ацетона. Как сделать это соединение в домашних условиях, мы не будем говорить, так как получение и хранение взрывоопасных веществ запрещено и уголовно наказуемо. Стоит рассказать ещё о нескольких интересных вещах. Перейдём к реакциям, в которых участвует перекись ацетона.

Свойства и химические реакции
Начнём с химических свойств. Их достаточно мало, потому что исследований на эту тему проводилось не много. Большинство реакций описывают разложение перекиси ацетона на различные продукты в определённых условиях. Например, при добавлении разбавленной серной кислоты и нагревании на водяной бане наше соединение разлагается с образованием исходных продуктов: ацетона и перекиси водорода. Реакцию, которая описывает это взаимодействие, можно записать так:
- С3Н6О2 + 3Н2О → 3С3Н6О + 3Н2О2.
Ещё одно хорошо изученное свойство этого соединения - детонация. Пожалуй, оно является основополагающим для перекиси ацетона, ведь основное применение этого вещества - пиротехника.
Но, перед тем как подробно разобрать сам процесс воспламенения, изложим некоторые теоретические основы. Для начала следует понять, что представляет собой химическая реакция взрыва. Детонация - это процесс выделения газов, который происходит с очень большой скоростью. При этом выделяется огромное количество теплоты. За счёт всего этого и создаётся взрывная волна: горячие газы с большой скоростью распространяются вокруг очага детонации и наносят большой ущерб всему, что находится рядом. Как правило, ударная волна распространяется со скоростью больше скорости звука.
Перейдём непосредственно к нашей реакции, которая приводит к детонации. В результате удара или какого-либо другого воздействия на перекись ацетона, она может сдетонировать. При этом происходит следующая реакция:
- (С3Н6О2)3 → 1,3СО2 + 2,44СО + 2,61СН4 + 0,63С2Н6 + 0,23С2Н4 + 0,47Н2 + 0,96Н2О + 0,47С.
Как мы можем видеть, выделяется огромное количество газов (и вода, кстати, находится в газообразном состоянии). При этом, кроме окисленных соединений вроде углекислого и угарного газов, выделяются взрывоопасные газы, такие как метан и этан. Если реакция происходит на воздухе, то эти вещества также могут дать выделение тепла, что увеличивает теплоту реакции и повышает температуру и силу ударной волны.
Очень хорошо триперекись ацетона разрушается двухвалентным хлоридом олова SnCl2. Кроме этого, неизвестно, какие вещества взаимодействуют с этим соединением. Однако есть данные о том, что при действии сильных кислот на достаточно большие количества (порядка нескольких граммов) этого пероксида вызывают взрыв.
Зачастую возникает вопрос, касаемый безопасности такого соединения, как перекись ацетона: как сделать так, чтобы не произошёл взрыв? Ответ очень прост: необходимо добавить достаточное количество воды (желательно такое, чтобы оно превышало 25 процентов по массе всего образца).
Есть также данные ещё об одном свойстве - коррозионной активности. Конечно, так как триперекись ацетона обладает окислительными свойствами, она может коррозировать (вызывать коррозию) некоторые металлы, например свинец. Однако большинство металлов она не в силах окислить.
А теперь ещё один интересный раздел, касающийся физических свойств данного соединения. Для любителей пиротехники будет полезно это прочитать, так как присутствует очень много практических сведений.
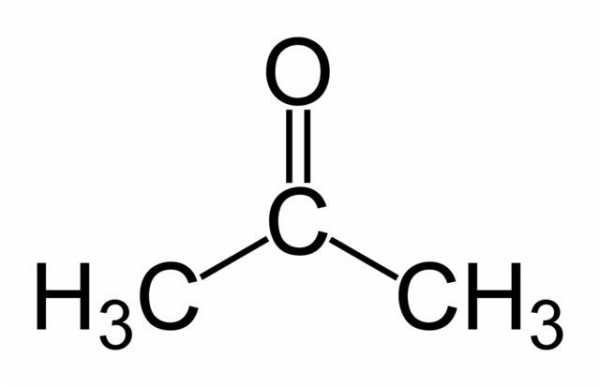
Физические свойства
Перекись ацетона обладает очень сильной взрывчатой силой. Всё это благодаря количеству выделяемых газов и теплоте, образуемой в результате реакции разложения. Эта величина достигает 5500 кДж/кг, что примерно на 20 процентов больше аналогичного показателя для тринитротолуола (сокращённо "тнт" - вещество, входящее в состав динамита).
Возможно приготовление таблеток из сухого вещества разной плотности. При этом меняются некоторые физические характеристики. Например, очень сильно плотность влияет на скорость детонации. При 0,92 г/см3 величина скорости детонации равна примерно 3750 м/с, а при 1,18 г/см3 этот показатель будет равен 5300 м/с. Конечно, это всё закономерно: при увеличении плотности увеличивается количество вещества в единице объёма, а значит, и при взрыве скорость распространения волны в пространстве будет расти за счёт увеличения количества тепла и газов, выделяемых в ходе реакции.
Есть также такой показатель, как скорость горения. Он отличается от скорости детонации тем, что показывает, как быстро может сгореть образец в присутствии кислорода. На самом деле, детонируя, перекись ацетона не использует кислород, то есть она не горит. А при взаимодействии с кислородом происходит следующая реакция: С3Н6О2 + 3,5О2 = 3СО2 + 3Н2О. Так вот, скорость горения, как правило, значительно ниже скорости детонации, и для перекиси ацетона она составляет 0,95 см/с. Очень скромный показатель в сравнении с 5300 м/с.

Применение перекиси ацетона
Основное применение - это, конечно, все области, так или иначе связанные с использованием взрывчатых веществ. Например, очень активно это соединение используется в горном деле для разработки новых месторождений. Там оно применяется либо в смеси с другими веществами как инициатор реакции детонации, либо очень редко как отдельный основной элемент взрывчатого заряда.
Мы уже говорили о применении пероксида ацетона в качестве пищевой добавки в пищевой промышленности. Тут стоит отметить, что для организма она безвредна и содержит в себе, как правило, такой процент влаги, что просто не способна сдетонировать. Поэтому не стоит опасаться продуктов, если увидите в их составе добавку Е-929. Это всего лишь консервант, не дающий продуктам испортиться.
Заключение
В этой статье мы попытались осветить обширную и интересную тему о получении и применении одного из самых популярных у террористов и молодых пиротехников взрывчатых веществ - перекиси ацетона. Мы разобрали свойства, лабораторные методы получения и применение этого вещества.
Эта статья ни в коем случае не призывает вас самостоятельно делать перекись ацетона в домашних условиях! Помните, что, помимо того что есть опасность получить серьёзные травмы, за хранение и использование этого вещества вы можете понести уголовную ответственность.
Источник: fb.ruПероксид ацетона - это... Что такое Пероксид ацетона?
| Проверить информацию. Необходимо проверить точность фактов и достоверность сведений, изложенных в этой статье. |
| Пероксид ацетона | |
| Общие | |
|---|---|
| Систематическое наименование | 3,3,6,6-тетраметил-1,2,4,5-тетраоксан (димер) 3,3,6,6,9,9-гексаметил-1,2,4, 5,7,8-гексаоксациклононан (тример) |
| Химическая формула | C6H12O4 (димер) C9H18O6 (тример) |
| Физические свойства | |
| Молярная масса | (димер) 148,157 г/моль (тример) 222,24 г/моль |
| Термические свойства | |
| Температура плавления | 91 °C |
| Температура кипения | 97–160 °C |
| Классификация | |
| Рег. номер CAS | 17088-37-8 |
| SMILES | CC1(OOC(OOC(OO1)(C)C)(C)C)C |
Пероксид ацетона (перекись ацетона, триперекись ацетона, диперекись ацетона, трициклоацетонпероксид, ТА, ДА, ТЦАП, киса, (3,3,6,6,9,9-гексаметил-1,2,4,5,7,8-гексаоксонан)) — инициирующее взрывчатое вещество, впервые получено в 1885 году Вольфенштейном. Существует в виде тримера и димера. Иногда можно встретить утверждения о существовании мономера и полимера, однако достоверные подтверждения этого неизвестны. В большинстве случаев образуется триперекись, иногда с небольшими примесями диперекиси. Чистая диперекись получается лишь при использовании специальных кислот. Часто можно встретить ошибку, когда триперекись называют диперекисью. Название «киса» является жаргонным, произошло, по всей видимости, от «перекись ацетона», или из-за сильной чувствительности к трению («против шерсти лучше не гладить»).
Физические свойства
Порошок перекиси ацетонаПредставляет собой мелкодисперсное вещество, похожее на муку. После многомесячного хранения или перекристаллизации из растворителя образуются крупные прозрачно-белые кристаллы неправильной формы. Вещество практически нерастворимо в воде, растворимо в ацетоне, эфире. Температура плавления триперекиси — 97 °С, диперекиси — 132 °С.
При комнатной температуре улетучивается с разложением, в открытом сосуде большие количества перекиси могут полностью испариться за десятки минут. При хранении даже в приоткрытом сосуде происходит кристаллизация из паров, что ведёт к росту высокочувствительных кристаллов.
Взрывчатые свойства
К удару менее чувствительна, чем гремучая ртуть, однако более чувствительна, чем азид свинца. Очень чувствительна к трению. Случайное попадание искры (в том числе электростатической от одежды) на порошкообразное вещество вызывает взрыв. В переплавленном (литая) или пластифицированном состоянии резко повышается чувствительность к механическим воздействиям. Идеально приготовленный слиток может сдетонировать, просто если поцарапать его ногтём.
Скорость детонации при плотности 0,92 г/см³ — 3750 м/с, 1,2 г/см³ — 5290 м/с. Способна к перепрессовке, то есть спрессованная под давлением около 2000 кгс/см² уже горит, а не детонирует.
Температура вспышки по Кестеру: 196 °C , по Фичерулью: 210-220 °C
По бризантности превосходит азид свинца и ГМТД, по инициирующей способности превосходит гремучую ртуть, но уступает ГМТД и азиду свинца.
Фугасность 250 мл.
Инициирующая способность для тетрила 0,09;г, для тротила 0,18;г.
Уравнение взрывчатого разложения:
(C3H6O2)3 = 1,3 CO2 + 2,44 CO + 2,61 CH4 + 0,63 C2H6 + 0,23 C4H4 + 0,47 H2 + 0,96 H2O + 0,47 C
Небольшие количества на открытой поверхности сгорают большим, объёмным пламенем, с глухим звуком хлопка. В количествах более 10 г и/или запрессованная в бумажный корпус оглушительно детонирует.
Не взаимодействует с большинством металлов, однако свинец является катализатором разложения перекисей и может привести к самоподрыву, поэтому контакт перекисей ацетона с ним опасен. Соли переходных металлов (железо, хром, марганец) также являются катализаторами разложения перекиси ацетона.
Получение
Перекись ацетона получают путём воздействия пероксида водорода на ацетон в кислой среде. Реакция отличается малой требовательностью к условиям. Для получения кислой среды используются разнообразные минеральные кислоты. Как правило, рекомендуется использование соляной кислоты, однако реакция идёт и при использовании азотной, ортофосфорной, серной, надсерной и других кислот. В случае использования серной кислоты образуется триперекись с примесями диперекиси, в случае надсерной кислоты — диперекись. В остальных случаях образуется триперекись ацетона
Применение
Промышленого применения в качестве инициирующего взрывчатого вещества не получила, из-за склонности к росту размеров кристаллов (см. выше), что повышает её чувствительность. В кустарных условиях часто приготовляется различного рода пиротехниками и преступниками в разрез со ст.222 УК РФ (и аналогичных статей УК других стран). Очень часто приводит к травматизации различной степени тяжести в процессе как приготовления, так и использования, поскольку химически неустойчива и склонна к самопроизвольному распаду со взрывом. Наиболее опасны подкисленные и недостаточно хорошо промытые от кислоты порошки данного вещества нестабильность которых намного выше. Взрыв 5 грамм перекиси ацетона вблизи человека уже способен нанести непоправимый вред его здоровью.
- Растворённая в эфире применяется в боеприпасах объёмного взрыва.
- В химической промышленности применяется в качестве инициатора реакций свободнорадикальной полимеризации.
- Имеются сведения о использовании перекиси ацетона в качестве консерванта пищевых продуктов.
Обсуждение:Пероксид ацетона — Википедия
Пользуясь данными из интернета можно получить данный продукт, и довольно чистый. Промыть его водой для выравнивания кислотности до нейтральной среды (щелочными растворами пользоваться нельзя), и хранить при постоянном контроле влажности и температуры, стеклянную тару использовать нельзя. Нагревать данное вещество не рекомендую, так же и возгонять, это действительно опасно для вашего здоровья. Получение в домашних условиях, простое и не требующее специальной подготовки, главное для начала подумайте о последствиях, они тоже просты: от Уголовного кодекса, до получения травм и увечий в разных формах и степенях тяжести. Кстати, пластик дает статический разряд при трении, это тоже необходимо помнить при обращении с данным продуктом. Под статью, кстати, подпадает и часть материалов размещенных на данном сайте, т.к. могут служить руководством по изготовлению материала и применению его. Если Вы хотите посвятить жизнь химии и химическому производству, то лучше обратитесь для этого в специализированные институты и производства. ТА и ДА не могут служить для сбора пиротехнических изделий из-за сложности хранения и применения, а так же степени опасности и ввиду высокой неустойчивости. 95.220.111.172 14:07, 4 мая 2011 (UTC) химии фанатик
- Что под уголовку попадает? Вот это: «Пероксид ацетона является пищевой добавкой, которой присвоено обозначение E929. Он улучшает качество мучных изделий»? 37.113.156.52 02:21, 19 августа 2017 (UTC)
Много народу взорвалось на этом соединении благодаря туповатой политике админа Конюшни (pirotek). Оттуда же и передраны все ошибки в описании этого соединения.
Я знаю, что 1354 ккал - это обычное число, которое указывают везде. Но иногда ведь и думать надо... Ну как с таким кислородным балансом киса выдаст под 5.7МДж/кг??? SONY 12:41, 8 января 2008 (UTC)
Точное определение (сертифицированным методом) дает вполне реальную цифру: 1005 ккал. Соответствует и балансу и химфизике.
Написано, что отчистить можно возгонкой, но какая возгонка при такой чувствительности?--daim 07:56, 24 октября 2008 (UTC)
Возгонка возможна при создании особых условий. Возможно только в специализированых лабораториях --[SapЁR]
Знаю, что многие юные химики полезут сюда, прежде чем эксперементировать. Так вот о пластификации. Боже упаси это делать на открытом огне, это раз. Лушче всего поставить большую кастрюлю на электроплиту и в момент закипания воды опустить для нагревания металлический стакан (водяная баня). Учитывая, что вода кипит при 100' (+ -) то врызва (скорей всего) не произойдет. Пластифицируйте малыми порциями, в защитных очках!
- А лучше этого вообще не делать... Ну совсем уж лучше не нарушать закон и не делать саму перекись, но если уж сделал, лучше в порошке и использовать. SONY 22:01, 3 февраля 2010 (UTC)
- Если жить только по закону, то лучше умереть чем так жить. У всех людей есть период, когда очень хочется взрывать. Даже у девочек это бывает. Главное дожить до конца этого периода и желательно сохранить все части своего тела.
- Пластификация кисы нагреванием -- бесполезный риск. Эффективность повышается не настолько, чтобы рисковать этим. Тем более, что достаточно сдетонировать паре грамм, чтобы оторвать пальцы и отправить осколки юному химику в глаза независимо от того, на нем очки или нет. ИМХО, лучше уделять больше времени пластификации не плавлением, а другими доступными способами. Чисто в энциклопедических целях, конечно же=). KibeR_ShuriK 15:36, 3 мая 2011 (UTC)
У меня был достаточный опыт изготовления и использования этого вещества. В большинстве случаев все заканчивалось благополучно, но один раз взрыв произошел все таки в руке. К счастью, размер заряда был всего 0,4 грамма, к тому же дело было на морозе, от чего все взрывается слабее, так что раны со временем зажили и число пальцев осталось прежним. Но это предел. Гарантирую, что взрыв 1 граммового заряда, удерживаемого пальцами, приведет к потере (полной или частичной) оных. Так же не следует тереть и скоблить там где есть следы или остатки вещества. Не использовать концентрированную серную кислоту. При обращении с веществом не использовать металлические инструменты - только пластмассу и дерево. Не нагревать НИКОГДА! Пусть те кто плавит ЭТО пеняют только на себя (если смогут, что вряд ли). Для любых целей достаточно ручной запрессовки в картонную или пластиковую трубку. Правда небольшое количество от поджигания может не взорваться или сработать слабо. Но плавление в этом не поможет. Тут есть один секретик - маленький, но очень эффективный - безотказная работа. Но рассказывать этот секрет - уже статья. Будьте здоровы 2.94.41.152 17:58, 6 апреля 2011 (UTC)F(x) --95.220.111.172 14:07, 4 мая 2011 (UTC)
Извините за плохой русский, все таки в школе только год учил. У кого есть глаза и пальцы лишные - занимайтесь перекисью как угодно. В свое время я тоже получал килограммами. Теперь даже рядом находится не хочу. Вещество опасное, летучее, и имеет плохую привычку сублимировать куда угодно, укрупнять кристалы, взрыватся само (особенно кога на батареях сушат). Молодые пиротехники и подрывники, не спешите заниматься перекисью - есть занятия гораздо приятнее. Вещество непредсказуемо, вне зависимости от способа изготовления. У меня конечно никогда само не взрывалось, но еще раз повторяю - только потому что сильно повезло. 78.130.218.205 12:46, 8 июля 2013 (UTC)
- Ни в коем случае не храните даже малые количества! Из-за сублимации возможно образование кристаллов между тарой и крышкой, которые сдетанируют из-за трения при открывании крышки. 176.59.141.143 05:53, 19 августа 2017 (UTC)
Иногда можно встретить утверждения о существовании мономера и полимера, однако достоверные подтверждения этого неизвестны.
- Право-же, тут какое творчество одержимых взрывников. Мономер перекиси ацетона вполне четко известное вещество, называется диметилдиоксиран, синтезируется чуть иначе чем кисы, используется как специальный окислитель в органической химии. Учите матчасть, прежде чем в вику писать. 195.13.138.164 17:55, 12 августа 2011 (UTC)
на витках резьбы или в щели горлышка за несколько дней образуются мелкие кристаллы, которые могут сдетонировать при откупоривании ' А в целом неплохой инициатор, --91.234.62.56 14:29, 8 апреля 2012 (UTC)
Его теплота взрыва составляет 2803 кДж/кг, что составляет 88 % от тротилового эквивалента. Исследования показали, что для трипероксида ацетона взрыв не является термодинамически выгодным процессом. При детонации не выделяется теплота и не происходит воспламенения: данные эффекты наблюдаются лишь вследствие трения образующихся молекул ацетона с воздухом[2].
Выделенное явно противоречит предыдущему и здравому смыслу. Детонация вещества не может происходить, если это процесс не является высокэкзотермическим. "трение молекул ацетона о воздух" это вообще за гранью.
трипероксид ацетона - "в военных целях данное вещество практически не применяется из-за своей летучести и чувствительности к ударам, нагреванию и другим внешним воздействиям, из-за чего процесс создания взрывных устройств на основе этого вещества является опасным (по этой причине трипероксид ацетона, как иногда пишут в СМИ, террористы называют "мать Сатаны")." https://news.rambler.ru/incidents/37641633/
Удалил раздел про теракты, поскольку это статья про химическое вещество, и его использование в качестве взрывчатки указано в соседнем разделе. Предлагаю подробности о том, кто, кого и зачем взорвал, описывать в соответствующих статьях, а не создавать здесь свалку, не подтверждённую источниками. — Maksim Fomich (обс.) 11:32, 25 апреля 2019 (UTC)
Техника безопасности при работе с кисой и ГМТД.../ Да хранит вас Бог - 20 Октября 2009
"киса" (перекись ацетона) - самое простое в получении ВВ. К сожалению, вместо чтения техники безопасности, вы скорее всего просто тупо полагаетесь на свое чутье ситуации. В итоге - оторванные пальцы или полная инвалидность
Все что здесь написано, касается большинства инициирующих ВВ. О
№ После отфильтровывания кисы (или ГМТД), их обязательно нужно несколько раз промыть холодной водой до нейтральной реакции. После промывки водой, следует промыть его 1-2% раствором соды, после чего опять чистой водой.
Особенно тщательно следует промывать при использовании серной кислоты. Любые кислотные примеси повышают чувствительность вещества и оно может взорваться самопроизвольно при хранении.
Имейте ввиду, что даже у хорошо промытой кисы могут оставаться примеси внутрикристаллической кислоты и чем больше кол-во используемой в синтезе кислоты, тем больше ее остается в кристаллах. По этой же причине нельзя использовать при синтезе концентрированные кислоты (чего бы не писали в интернете) – продукт получится либо нестабильным, либо может взорваться.
2. При сушке КИСЫ, ГМТД и изделий с ними, нельзя использовать батареи отопления, лампы накаливания, нагревательные приборы, и тем более источники открытого огня.
Лучше высыпать влажный сабж на стопку хорошо впитывающей бумаги, бумага впитает большую часть воды. А потом перложить на сухой лист.
Не сушите на балконе, особенно если балкон не остеклен (Из-за курящих соседей может произойти взрыв), казалось бы невозможная случайность, тем не менее такое имело место быть. К тому же соседи могут подумать что вы сушите героин и сообщить в ГНК.
3. Хранить кису (гмтд) желательно в герметичной емкости, в холодном или прохладном месте в темноте.
Не используйте туго закрывающиеся и завинчивающиеся пробки, открытие которых сопровождаются усилиями т.к. киса обладает летучестью и в зазоры между пробкой (крышкой) и емкостью могут попасть (образоваться) кристаллы вещества, которые могут взорваться от трения, вызванного открытием пробки. Такой микровзрыв часто провоцирует взрыв всей массы вещества. Часто это заканчивается смертью из-за баротравмы или потери крови.
4. Не перекусывайте снаряженные детонаторы и трубки набитые любыми ИВВ (например с помощью ножниц или кусачек) это иногда приводит к взрыву. (Касается любых типов корпусов). Об разделении следует позаботиться заранее. Например разрезание пакета с 8 г ГМТД с помощью ножниц привело к отрыву всех пальцов:(
5. Ни в коем случае НЕ ПЛАВЬТЕ кису, чего бы по этому поводу не писали на разных сайтах, типа посулов в увеличении мощности. Абсолютно все пироманы, утверждавшие что плавление безопасно, рано или поздно подрывались. У переплавленной кисы мощность возрастает совсем незначительно, зато опасность в обращении сильно повышается. При этом не важно большими или малыми порциями вы ее плавите, потому что взрыв малой порции как правило провоцирует взрыв рядом стоящей большой порции. А при затвердевании образуются локальные перенапряжения, способные вызвать самопроизвольную детонацию всей массы.
Не рекомендуется также использование кисы в смеси с затвердевающими/высыхающими связующими типа лака НЦ, раствора бездымного пороха в ацетоне, эпоксидки, жвачки, пластелина, алебастра и т.п. В обоих случаях экстремально растет чувствительность к удару и особенно к трению.
К примеру, в таком виде для детонации достаточно неосторожно ковырнуть или царапнуть заряд ногтем, а также несильно ударить емкость, где находится вещество. Подобные операции сроки хранения не увеличивают, правильно сделанная и отмытая киса и так хранится очень долго без разложения.
6. Киса и ГМТД крайне чувствительны к тепловым (огонь, малейшая искра) и механическим воздействиям (удар и особенно трение).
По чувствительности к трению они превосходят все штатные инициирующие вещества. Это также послужило одной из причин, почему кису и ГМТД так и не приняли на вооружение. Учитывая высокую чувствительность к трению, следует избегать любых лишних операций с этими веществами. А если вы что-то делаете, делайте это аккуратно.
Запрессовывать в корпус детонатора также следует очень осторожно, не делая резких толчков. Лучше всего использовать деревянный поршень - например карандаш.
Для уменьшения чувствительности кисы или ГМТД при запрессовке, их можно смочить спиртом а после запрессовки подождать пока высохнет. Корпус детонатора лучше делать из бумаги, проклеенной нейтральным клеем.
Не стоит забавляться с ВВ: простейшее поджигание даже небольшой кучки вещества может окончиться не только прикольной вспышкой, но и взрывом (если киса при этом насыпана на тарелку, есть большая вероятность что куски тарелки полетят вам в глаза). Не слушайте "авторитетов" говорящих: - "сколько поджигал насыпанную кису (ГМТД) -ни разу не взрывалось": она может 100 раз не взорваться, а один раз точно рванет или наоборот, все зависит от нюансов изготовления и случайных факторов.
Поджигание кисы (а также большинства других ИВВ), запрессованных или просто насыпанных в бумажный или еще какой корпус практически в 100% случаев заканчивается взрывом. Неправильно сделанная и плохо отмытая киса может рвануть самопроизвольно без видимых причин.
7. Статическое электричество: Хотя киса и ГМТД считаются веществами малоэлектризующимися, существует реальная опасность срабатывания от статической искры, тем более эти вещества крайне чувствительны к искре. Я полагаю больше половины самопроизвольных взрывов без видимых причин можно отнести на счет статики.
Например, это может произойти при простом прикосновении, засыпании и прессовании перекиси в корпус детонатора (были случаи, когда небольшие кол-ва ГМТД подрывались 4 раза подряд, пока человек не снял свитер, а также при ношении вещества, завернутого в пакет в кармане. Особенно опасна статика при низкой влажности (например в степях, а также в отапливаемых помещениях зимой). Поэтому перед работой с веществом желательно снять всю электризующуюся одежду и заземлиться :). Однажды взрыв произошел просто из-за того, что рядом с кучкой ГМТД просто пылесосили и ткань, где лежало вещество наэлектризовалась.
8. Учтите, что киса летуча. Небольшая кучка сабжа в открытой емкости полностью улетучивается за несколько дней.
При хранении в закрытой емкости сухой кисы, наблюдается рост более крупных кристаллов за счет мелких, что влечет за собой увеличение чувствительности к механическим воздействиям.
Ввиду перекристаллизации кисы со временем и постепенного разложения ГМТД (в обоих случаях растет чувствительность), не храните готовые детонаторы из пероксидов больше 2х месяцев (есть конечно индивиды что хранят год и более, но это все до случая).
9. Старайтесь чтобы орг. пероксиды не контактировали с металлами и их солями, это уменьшает их стабильность.
10. Не используйте кису, ГМТД или другие инициирующие ВВ в качестве основного ВВ и в смесях, для этого существуют бризантные ВВ.
Также не рекомендуется нарабатывать их в больших количествах. В целях безопасности лучше оперировать с количествами не больше чем нескольких грамм. Помните, что при взрыве в непосредственном контакте с пальцами, мягкие ткани превращаются в фарш и поэтому часто требуется ампутация.
Взрыв 2-3 г кисы в непосредственном контакте может вас полностью лишить кисти руки.
Взрыв же такого кол-ва на расстоянии в нескольких сантиметров обычно приводит лишь к сильному ушибу и руку удается сохранить. Поэтому если вы прессуете детонаторы вручную, есть смысл вставлять их в просверленное в куске пенопласта глухое отверстие, а не держать в руке. Будьте всегда морально готовы к незапланированному взрыву. Если заряд основного БВВ требует больше 1-2 г кисы, есть смысл задуматься об использовании промежуточного заряда из другого ВВ.
11. Не доверяйте изготовление ВВ, ВУ, а особенно детонаторов и фитилей друзьям. Во первых "друзья" могут быть менее компетентны чем вы, сделать чего-нить не так, и ваша дружба внезапно прекратится, а во вторых, когда вы сами делаете сабж, вы осознаете, что от качества вашей работы зависит ваше же физическое благополучие.
12. Когда делаете какие-либо изделия из кисы или гмтд (а также из любых других ВВ и пиросоставов) заготовьте отдельно необходимое кол-во вещества, а основную часть спрячьте подальше (в идеале в другую комнату), иначе в случае какого-либо эксцесса (скажем с кисой или ГМТД) вам оторвет не только палец, но и башку. По возможности, при работе используйте защитные очки, т.к. с глазами расставаться обиднее чем с пальцами.
Также не поджигайте (например ради забавы) небольшие кучки веществ и смесей в непосредственной близости от основной массы вещества или горючих материалов.
Помните, что незапланированный взрыв небольшого кол-ва кисы (гмтд), например, при поджигании или забивании детонатора, может вызвать взрыв другой кучки той же кисы, находящейся в 2 метрах.
Если при поджигании используете спички, помните, что кусок раскаленной спичечной серы может отвалиться от спички и попасть совсем не туда, куда надо.
13. Казалось бы мелкие, но очень важные нюансы.
Будьте пунктуальными и аккуратными.
Ни в коем случае не торопитесь.
Если чего то не успеваете - лучше отложите. Лучше отложить на следующий день, чем скрутить что-либо на скоряк, а потом пролежать месяц в больнице. Особенно это касается замедлителей и фитилей.
Не пользуйтесь фитилями из проселитренной бумаги любой конструкции при изготовления замедлителей к ВУ - такие фитили очень ненадежны и склонны
к внезапному быстрому прогоранию. Также при вставлении в детонатор куска проселитренной бумаги, свернутой в трубку есть вероятность попадания в полости и канал фитиля частиц кисы. Обычно это заканчивается внезапным взрывом при поджигании.
Замедлители из бенгальских огней тоже крайне опасны, т.к. искры попадают на место стыка такого «замедлителя» с зарядом или на сам заряд и происходит взрыв. Подобные замедлители можно применять только в неответственных пиротехнических изделиях - римских свечах, бураках, мортирах (конечно при условии, что поджигая, вы убираете свое лицо от места, откуда должны вылетать звездки.
Контролируйте место стыка фитиля с детонатором или корпусом изделия (например обматывайте скотчем): все должно быть сделано так, чтобы случайная искра, попавшая на место стыка или в щели не вызвала преждевременный взрыв.
Во всех случаях, если вы подожгли фитиль, отбежали, а взрыва бомбы не произошло - не подходите к изделию как минимум 30 мин. Выждав указанное время - смотрите заранее:
Если видите что горение или тление фитиля продолжается - непобаюсь этого слова уебывайте оттуда побыстрее.
Если фитиль прогорел и потух, не поджигайте его снова, а используйте новый фитиль, либо примотайте к потухшему фитилю запасной фитиль.
Если весь фитиль сгорел, а детонатор не взорвался настоятельно не рекомендую использовать этот детон снова и прикручивать к нему замедлитель опять.
Ни в коем случае не делайте короткие фитили, с расчетом, чтобы при метании, заряд взорвался в воздухе или в воде, есть очень большая вероятность,
что он взорвется у вас в руках, и как жизнь показала такое случается довольно часто. Как кто-то очень метко сказал - длина фитиля прямопропорциональна расстоянию до кладбища.
Вообще если есть возможность - не держите заряды в руке когда поджигаете фитиль, иначе при случайном взрыве вам оторвет пальцы или кисть, если же взрыв произойдет на расстоянии фитиля, есть вероятность, что после лечения рука будет нормально функционировать (конечно все зависит от массы ВВ и длины фитиля). Поэтому всегда лучше подойти, поджечь и свалить, нежели поджечь, кинуть и наблюдать че будет. При поджигании фитилей и прочих замедлителей всегда нужно сначала зажечь спичку, а особенно зажигалку, а уже потом подносить к фитилю, а не чиркать зажигалкой у самого фитиля. Дело в том, что из зажигалки вылетает облачко газа, и только потом он загорается. Такого облачка вполне достаточно, чтобы завести ТА сантиметрах в 10-15 от зажигалки(т.е. с коротким шнуром девайс может сработать мгновенно). При поджигании спички же вылетают более или мерее мелкие искры. В любом случае если вы делаете короткие фитили (неск. см), место состыковки фитиля с зарядом должно быть защищено от случайного воздействия пламени и искр.
Старайтесь все сделать понадежнее и минимизировать возможность отказа, т.к. отказ это всегда очень неприятное проишествие. Во-первых это лишний раз напрягает и без того напряженные нервы, во-вторых задерживает вас на месте "деяния", а в третьих в некоторых случаях это провоцирует неосознанные, или даже осознанные, грубые нарушения техники безопасности даже опытными пироманами.
(типа преждевременного приближения к невзорвавшемуся заряду или "придумывания" подручных замедлителей на ходу, если под рукой не оказалось запасного, а взорвать все равно хочется.
Если вы взрываете что то с друзьями, не слушайте никого, поступайте только как вам диктует логика и здравый смысл. Внушите себе что в этом деле они все дураки. Потому что бывает, например, фитиль прогорел и не взорвалось, а друзья начинают подначивать – типа давай бумажку прикрутим, кусочек коры и прочее…
14. При изготовлении чего либо не курите (находятся и такие кадры), не принимайте алкоголь, т.к. он уменьшает внимание и притупляет чувство опасности как во время изготовления, так и во время использования.
Вот к чему приводит курение вблизи кучки кисы:
15. Хранить и транспортировать инициирующие ВВ (типа кисы или ГМТД), а также готовые средства инициирования (детонаторы) нужно подальше от основного заряда ВВ.
Детонаторы лучше держать в чем нить мягком, во первых это уменьшит вероятность взрыва при случайном воздействии, а во-вторых в случае самопроизвольного взрыва повреждения будут меньше.
Вставляйте детонаторы только непосредственно перед взрывом. При этом соблюдайте максимальную аккуратность - не ударяйте и не сдавливайте детонаторы - это опасно. Отверстие под детонатор для прессованых и литых ВВ должно быть сделано заранее (и стопудово делайте это не детоном а сверлом или еще какой-нить хренью). Ни в коем случае нельзя прокалывать готовые детонаторы, например новички часто пытаются чем нить острым расковыривать в детонаторах дырку с целью подвода фитиля - это очень часто приводит к взрыву. Подводить фитиль необходимо во время сборки детонатора, а не после.
16. Никогда не поджигайте предметы в которых находятся ИВВ (киса, гмтд и т.д.) без нормально и аккуратно сделанного замедлителя (например фитиля, стопина и т.п.),
Расчитанного как минимум на 5сек для зарядов в неск. граммов и 15 сек для зарядов в неск. сотен грамм. Никогда не делайте суррогатные замедлители типа куска горящей бумаги, проселитренной бумаги, спичек, положенных в ряд и т.п.
17. И, наконец, не используйте корпуса для бомб из металла, стекла и подобных твердых материалов на расстоянии прямой видимости - единственно допустимо использование пивных банок, банок из под консервов и всяких дезодорантов. По возможности используйте легкие материалы - пластик, бумага, картон и т.п.
Осколки - это необязательно металл и стекло; та же резина, любой пластик и пластилин при детонации вв дают осколки, проникающие под кожу до 3-5мм; мелкий песок может делать "татуировку" с последующим нагноением и воспалением - даже на расстоянии порядка метра и через одежду. Компактные осколки летят дальше, имеют большее пробивное действие; однако осколки неправильной формы (например, кусок жести) легче рикошетят об кости и "скользят" внутри тела, делая обширные рваные раны.
При использовании всякой пиротехнической и взрывной хрени беспокойтесь также о безопасности окружающих: не шарахайте вблизи людей, лучше свалить куда нить подальше.
Не показывайте крутизну своих изделий по сравнению с фабричными - если кого нить ранит или убъет, то есть очень большой шанс что свою крутизну вам покажут менты и отечественное "правосудие". В отличие от террористов вас найдут гораздо быстрее.
Тщательно выбирайте места испытания - обязательно проверяйте, чтобы не мог подойти случайный человек; слишком часто бывает, что люди сами спрячутся, а тут прохожий... Ну и не испытывайте на одном и том же месте слишком часто, а то при очередном испытании вместо прохожих появятся омоновцы.
18. Напутствие на будущее: старайтесь не светиться - кучка порошка, сушащегося на балконе или запах перегоняющейся азотки, разные дымы и подозрительные запахи все это может привлечь внимание соседей, особенно если они пенсионеры или с вами не в ладах. Поменьше рассказывайте "друзьям", соседям и просто посторонним о своем увлечении.
19. Несушите Кису на гозетныx листаx в типографской краске может содержаться свинец, по этому недопустимо хранить или сушить перекись в бумаге с напечатаным текстом. Сушка завёрнутой в газету перекиси ацетона на батарее — типичная причина несчастных случаев среди пиротехников-любителей.
Перекись ацетона - это... Что такое Перекись ацетона?
- Перекись ацетона
- Статья удалена в соответствии с требованями Роскомнадзора.
Wikimedia Foundation. 2010.
- System of a Down (альбом)
- Максимальный тор
Смотреть что такое "Перекись ацетона" в других словарях:
перекись ацетона — сущ., кол во синонимов: 1 • взрывчатка (232) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Перекись — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Пероксид ацетона — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
Е929 — Структурная формула триперекиси ацетона Перекись ацетона (триперекись ацетона, диперекись ацетона, трициклоацетонпероксид, ТА, ДА, ТЦАП, киса) инициирующее взрывчатое вещество, впервые получено в 1885 году Вольфенштейном. Существует в виде… … Википедия
Пероксид — (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надперекиси — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надперекись — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надпероксид — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надпероксиды — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Перекиси — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Пероксид ацетона — Википедия. Что такое Пероксид ацетона
| Пероксид ацетона[1] | |
|---|---|
| тример: димер: | |
| Изомеры | |
Общие | |
| Хим. формула | C₆H₁₂O₄ |
Физические свойства | |
| Молярная масса | |
| Плотность | тример: 1,2 г/см³ |
Термические свойства | |
| Т. плав. | тример: 92—93 ℃ димер: 133—135 ℃ |
| Т. кип. | тример: 184,93 ℃ |
| Т. всп. | тример: 51,467 ℃ |
| Давление пара | тример: 0,98 мм рт. ст. (25 °C) |
Оптические свойства | |
| Показатель преломления | тример: 1,382 |
Классификация | |
| Номер CAS | 1336-17-0 |
| PubChem | 536100 |
| ChemSpider | 3582942 |
| Е-номер | E929 |
CC1(OOC(OO1)(C)C)C | |
1S/C6h22O4/c1-5(2)7-9-6(3,4)10-8-5/h2-4h4 | |
| Приводятся данные для стандартных условий (25 ℃, 100 кПа), если не указано иное. | |
Пероксид ацетона или перекись ацетона — инициирующее взрывчатое вещество, впервые полученное Рихардом Вольфенштейном в 1895 году[2][3].
История
Первые эксперименты по получению пероксидов ацетона были проведены Вольфенштейном в 1895 году, когда он изучал действие пероксида водорода на кониин в ацетоновом растворе, полагая, что ацетон и пероксид водорода не взаимодействуют. Вольфенштейн обнаружил, что из смеси равных объёмов ацетона и 10%-ного пероксида водорода выпадают кристаллы, которые он охарактеризовал как тримерный пероксид ацетона (триперекись ацетона 2). Также он заметил, что реакция происходит быстрее при добавлении малых количеств фосфорной кислоты[4].
В 1899 году Адольф Байер и Виктор Виллигер синтезировали также димерный пероксид ацетона (диперекись ацетона 1). В 1933 году Лекок наблюдал процесс деполимеризации трипероксида ацетона при определении его молекулярной массы методом криоскопии, а также при плавлении. В 1947 году изучалось влияние кислот на образование пероксидов ацетона, в частности, было замечено, что серная, соляная, фосфорная и азотная кислоты значительно ускоряют окисление ацетона пероксидом водорода, а в присутствии органических кислот (уксусной, бензойной) образования продукта не происходит[4].
К настоящему времени получены пероксиды ацетона четырёх структур[5].
Получение
Димерный пероксид ацетона (диперекись ацетона, 1) получают с выходом 94 % при обработке ацетона 86 %-ным пероксидом водорода в ацетонитриле в присутствии серной кислоты при пониженной температуре. Другим способом синтеза диперекиси ацетона является реакция ацетона с персульфатом калия в разбавленной серной кислоте. Тримерный пероксид ацетона (триперекись ацетона, 2) образуется в данных реакциях как примесь. Для препаративного получения данного продукта применяют реакцию ацетона с эквивалентным количеством 50 %-ной перекиси водорода и 0,25 эквивалентами серной кислоты. Триперекись ацетона можно очистить низкотемпературной перекристаллизацией из пентана[5]. При этом она кристаллизуется в виде длинных плоских призмовидных кристаллов[4].
Пероксиды 3 и 4 могут быть получены в данных реакциях при отсутствии минеральной кислоты. Например, смесь ацетона и 50 %-ной перекиси водорода при перемешивании в течение 3 часов при 0 °С даёт исключительно 2,2-бис(гидроперокси)пропан 3. Увеличение времени реакции приводит к образованию продукта 4[5].
Физические свойства
Трипероксид ацетона легко возгоняется:
- при температуре 14—18 °С он теряет около 6,5 % массы за 24 часа;
- при 25 °С — 68 % массы за 14 дней;
- при 50 °С — 1,5 % массы за 2 часа;
- при 100 °С — возгоняется весьма быстро[6].
Он растворим в этаноле (0,15 г / 100 г при 17 °С), диэтиловом эфире (5,5), петролейном эфире (7,35), ацетоне (9,15), сероуглероде (9,97), пиридине (15,4), бензоле (18,0), трихлорэтилене (22,7), четырёххлористом углероде (24,8), хлороформе (42,5)[6], но нерастворим в воде[7].
Химические свойства
При нагревании с разбавленной серной кислотой пероксид ацетона количественно гидролизуется с образованием ацетона и пероксида водорода:
- C3H6O2+3h3O→3C3H6O+3h3O2{\displaystyle {\mathsf {C_{3}H_{6}O_{2}+3H_{2}O\rightarrow 3C_{3}H_{6}O+3H_{2}O_{2}}}}[4]
Миллиграммовые количества дипероксида и трипероксида ацетона в течение 15 минут разлагаются сильными кислотами (например, серной кислотой или метансульфокислотой). Поскольку реакция экзотермична, действие сильных кислот на граммовые количества вызывает детонацию. Также трипероксид ацетона эффективно разрушается хлоридом олова(II)[7][8].
При получении с использованием метансульфокислоты, хлорной или серной кислоты трипероксид ацетона самопроизвольно превращается в дипероксид ацетона. Однако при использовании хлорида олова(IV), соляной или азотной кислоты он остаётся стабильным[9].
Использование в качестве взрывчатого вещества
Воспламенение пероксида ацетонаВ военных целях пероксид ацетона не используется из-за высокой летучести и чувствительности, однако, c 1980-x годов применяется в террористических целях как инициирующее или основное взрывчатое вещество[6][10]. Использование террористами связано с простотой синтеза, а также с тем, что в молекуле данного вещества отсутствует азот, что делает невозможным определение взрывающего устройства стандартными устройствами, отвечающими на азот[11]. Трипероксид ацетона обладает примерно такой же взрывной силой, как тротил. Кроме того, он весьма чувствителен к нагреванию и удару и может воспламеняться под действием открытого пламени и электрического разряда[5], что делает сам процесс создания взрывающих устройств опасным (по этой причине трипероксид ацетона получил название «Мать Сатаны»)[11].
The Times сообщает, что через несколько дней после теракта в Манчестере (теракт произошел в ночь на 23 мая 2017 года) в открытом доступе в социальной сети Facebook и на YouTube находились пошаговые инструкции по изготовлению взрывных устройств на основе пероксида ацетона, вещества, которое использовал Абеди для совершения теракта.[12]
Сообщается, что данное вещество детонирует даже при содержании воды до 25 %[7]. К удару перекись ацетона чуть менее чувствительна, чем азид свинца. По бризантности она превосходит азид свинца и гремучую ртуть[4].
При взрыве пероксида ацетона происходит резкое образование большого объёма газов: из его одной молекулы образуются три молекулы ацетона и одна молекула озона[2]. Приводят также и другое уравнение разложения:
- (C3H6O2)3→1,3CO2+2,44CO+2,61Ch5+0,63C2H6+0,23C2h5+0,47h3+0,96h3O+0,47C{\displaystyle {\mathsf {(C_{3}H_{6}O_{2})_{3}\rightarrow 1,3CO_{2}+2,44CO+2,61CH_{4}+0,63C_{2}H_{6}+0,23C_{2}H_{4}+0,47H_{2}+0,96H_{2}O+0,47C}}}[4]
Скорость детонации трипероксида ацетона составляет 5300 м/с при плотности 1,2 г/см³ и около 1430 м/с при 0,47 г/см³. В диапазоне плотностей от 0,35 до 1,2 г/см³ эта зависимость линейна и подчиняется уравнению
y=5405,1x−1149{\displaystyle y=5405,1x-1149}.
Теплота взрыва составляет 2803 кДж/кг, что составляет 67 % от тротилового эквивалента (4.19 МДж/кг)
Использование в качестве пищевой добавки
Пероксид ацетона является пищевой добавкой, которой присвоено обозначение E929. Он улучшает качество мучных изделий. Однако, по состоянию на 2017 год пероксид ацетона практически не используется с этой целью, вместо него применяются другие улучшители[13].
Обнаружение
Трипероксид и дипероксид ацетона можно обнаружить или проанализировать методом тонкослойной хроматографии на силикагеле (элюент: толуол, Rf 0,57 и 0,66 соответственно, проявка 1 % дифениламина в концентрированной серной кислоте). Подобраны также условия для анализа газовой хроматографией и масс-спектрометрией[7].
Примечания
- ↑ 17088-37-8 Acetone peroxide. Проверено 24 июля 2013. Архивировано 27 июля 2013 года.
- ↑ 1 2 Encyclopedia of Forensic Sciences, 3V Set ONLINE. — Academic Press. — 2013. — P. 102. — ISBN 978-0-12-382165-2.
- ↑ Wolffenstein R. (1895). «Ueber die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd». Berichte der Deutschen Chemischen Gesellschaft 28 (2): 2265–2269. DOI:10.1002/cber.189502802208.
- ↑ 1 2 3 4 5 6 Багал, 1975.
- ↑ 1 2 3 4 Agrawal J. P., Hodgson R. D. Organic Chemistry of Explosives. — Wiley, 2007. — P. 339—340. — ISBN 978-0-470-02967.
- ↑ 1 2 3 Yinon J. Forensic and Environmental Detection of Explosives. — John Wiley & Sons, 1999. — P. 10—12. — ISBN 0-471-98371-3.
- ↑ 1 2 3 4 Lunn G., Sansone E. B. Destruction of Hazardous Chemicals in the Laboratory. — John Wiley & Sons, 2012. — P. 459—462. — ISBN 978-0-470-48755-6.
- ↑ Oxley J. C., Smith J. L., Huang J., Luo W. Destruction of Peroxide Explosives (англ.) // Journal of Forensic Sciences. — 2009. — Vol. 54, no. 5. — P. 1029—1033. — DOI:10.1111/j.1556-4029.2009.01130.x. — PMID 19737243.
- ↑ Matyas R., Pachman J., Ang H.-G. Study of TATP: Spontaneous Transformation of TATP to DADP (англ.) // Propellants, Explosives, Pyrotechnics. — 2008. — Vol. 33, no. 2. — P. 89—91. — DOI:10.1002/prep.200700247.
- ↑ Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part I (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — Vol. 38, no. 2. — P. 244—254. — DOI:10.1002/prep.201200116.
- ↑ 1 2 Girard J. E. Criminalistics: Forensic Science, Crime and Terrorism. — 2nd Ed.. — Jones & Bartlett Publishers, 2011. — P. 422. — ISBN 978-0-7637-7731-9.
- ↑ Террорист изготовил бомбу по инструкции в YouTube. Cursorinfo. Проверено 24 июня 2017.
- ↑ Взрывоопасный кекс — о E-добавках, используемых при изготовлении хлебобулочных изделий, на канале «Наука 2.0»
Литература
- Багал Л. И. Химия и технология инициирующих взрывчатых веществ. — М.: Машиностроение, 1975. — С. 411—415.
- Wolffenstein R. Ueber die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd (нем.) // Berichte der deutschen chemischen Gesellschaft. — 1895. — Bd. 28, Nr. 2. — S. 2265—2269. — DOI:10.1002/cber.189502802208.
- Baeyer A., Villiger V. Ueber die Einwirkung des Caro'schen Reagens auf Ketone (нем.) // Berichte der deutschen chemischen Gesellschaft. — 1900. — Bd. 33, Nr. 1. — S. 858—864. — DOI:10.1002/cber.190003301153.
- Экспериментальные статьи
- Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part I (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — Vol. 38, no. 2. — P. 244—254. — DOI:10.1002/prep.201200116.
- Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part 2 (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — DOI:10.1002/prep.201200215.
перекись ацетона - Acetone peroxide
| Циклический димер и тример примеры | |||
| | |||
| имена | |||
|---|---|---|---|
| имена IUPAC 3,3-диметил-1,2-dioxacyclopropane (мономер) 3,3,6,6-тетраметил-1,2,4,5-тетраоксан (димер) 3,3,6,6,9,9-Hexamethyl- 3,3,6,6,9,9,12,12-Octamethyl- | |||
| Другие имена Triacetone triperoxide | |||
| Идентификаторы | |||
| 3D модель ( JSmol ) | |||
| ChemSpider | |||
| |||
| |||
| свойства | |||
| С 6 Н 12 О 4 (димер) С 9 Н 18 О 6 (тример) С 12 Н 24 O 8 (тетрамер) | |||
| Молярная масса | 148,157 г / моль (димер) 222,24 г / моль (тример) | ||
| Внешность | Белый кристаллический твердый | ||
| Температура плавления | 131,5 до 133 ° С (димер) 91 ° С (тример) | ||
| Точка кипения | От 97 до 160 ° C (207 до 320 ° F; 370 до 433 К) | ||
| нерастворимый | |||
| опасности | |||
| СГС пиктограммы | |||
| NFPA 704 | |||
| Взрывные данные | |||
| чувствительность Shock | Высокий / высокий во влажном состоянии | ||
| чувствительность Трение | Высокий / умеренный во влажном состоянии | ||
| скорость детонации | 5300 м / с при максимальной плотности (1,18 г / см 3 ), около 2500-3000 м / с вблизи от 0,5 г / см 3 17384 фут / с 3,29 миль в секунду | ||
| RE фактор | 0.55-0.8, зависит от меры | ||
| За исключением случаев, когда указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| N проверить ( что ?) YN | |||
| ссылки Infobox | |||
Пероксид Ацетон является органический пероксид и первичного взрывчатого вещества . Его получают с помощью реакции ацетона и перекиси водорода с получением смеси линейного мономера и циклического димера , тримера и тетрамерных форм. Тример известен как triacetone triperoxide ( TATP ) или три-циклический пероксид ацетона ( TCAP ). Димер известен как диацетоновый diperoxide (DADP) . Пероксид Ацетон принимает форму белого кристаллического порошка с характерным отбеливателя -подобных запахом (когда нечистые) или фруктового , как запах , когда чистый и может взорваться , если они подвергаются воздействию тепла, трение, статическое электричество, концентрированная серная кислота, сильные УФ - излучение или шок . В качестве не- азотно взрывчатого вещества, TATP исторически более трудно обнаружить, и он был использован в качестве взрывчатого вещества в нескольких террористических атаках с 2001 года.
история
Перекись ацетона ( в частности, triacetone triperoxide) был открыт в 1895 году Рихард Вольфенштейн . Wolffenstein в сочетании ацетона и перекиси водорода, а затем он позволил смесь стоять в течение недели при комнатной температуре, в течение которых небольшое количество кристаллов осаждается, который имел температуру плавления 97 ° С.
В 1899 году Адольф фон Байера и Виктора Филлигер описал первый синтез димера и описано использование кислот для синтеза обоих пероксидов. Байер и Филлигер подготовили димер путем объединения персульфата калия в диэтиловом эфире с ацетоном, при охлаждении. После отделения эфирного слоя, продукт был очищен и обнаружено , плавится при 132-133 ° С. Они обнаружили , что тример может быть получен путем добавления соляной кислоты к охлажденной смеси ацетона и перекиси водорода . При использовании депрессии точек замерзания для определения молекулярных весов соединений, они также определили , что форма перекиси ацетона , что они получены с помощью персульфата калия был димером, в то время как пероксид ацетона , который был подготовлен с помощью хлористоводородной кислоты был тример , как соединение Wolffenstein в.
Работа по этой методике и на различных продуктах, полученных, был исследован в середине 20-го века Милас и Голубович.
Химия
Пероксид ацетона химического названия наиболее часто используются для обозначения циклического тримера, продукт реакции между двумя предшественниками , перекисью водорода и ацетоном, в качестве кислоты- катализируемого нуклеофильного присоединения , хотя различные дополнительные мономерные и димерные формы возможны.
Синтез три-циклического пероксид ацетона.В частности, два димеры, один циклический (С 6 Н 12 О 4 ) и одной открытой цепью (С 6 Н 14 О 4 ), а также с открытой цепью мономера (С 3 Н 8 O 4 ), могут быть также образованы; в соответствии с определенным набором условий реагента и кислотного катализатора концентрации, циклический тример является первичным продуктом. Тетрамерная форма также была описана при различных каталитических условиях. Синтез тетрамерной перекиси ацетона был спорным. Под нейтральных условиях реакция сообщается с получением мономерного органического пероксида .
Наиболее распространенный путь для почти чистого TATP представляет собой Н 2 О 2 / ацетон / HCl в соотношении 1: 1: 0,25 молярных соотношениях, с использованием 30% пероксида водорода. Этот продукт содержит очень мало или ни один из DADP с некоторыми очень маленькими следами хлорированных соединений. Продукт , который содержит большую часть DADP может быть получен из 50% H 2 O 2 с использованием больших количеств конца. серная кислота в качестве катализатора или в качестве альтернативы с 30% H 2 O 2 и огромным количеством HCl в качестве катализатора.
Продукт, полученный с помощью хлористоводородной кислоты считается более стабильным, чем один сделанный с использованием серной кислоты. Известно, что следы серной кислоты в ловушке внутри сформированных кристаллов перекиси ацетона привести к нестабильности. В самом деле, захваченный серная кислота может вызвать детонацию при таких низких температурах, как 50 ° C, это наиболее вероятный механизм за случайных взрывов перекиси ацетона, которые происходят во время сушки на нагретых поверхностей.
Тетрамерная пероксид ацетонаОрганические пероксиды в целом являются чувствительными, опасными взрывчатыми веществами, и все формы перекиси ацетона чувствительны к инициации . TATP разлагается со взрывом; экспертиза взрывного разложения из TATP на самом краю детонационного фронта предсказывает «формирования ацетона и озона в качестве основных продуктов разложения , а не интуитивно ожидаемых продуктов окисления.» Очень мало тепла создается за счет взрывного разложения TATP на самом краю детонационного фронта; предшествующий вычислительный анализ показывает , что разложение TATP как энтропийные взрывы . Однако эта гипотеза была поставлена под сомнение , как не соответствующие фактические измерения. Иск энтропийных взрыва был связан с событиями , только позади детонационного фронта. Авторы 2004 Dubnikova и др. Исследование подтверждает , что принимает окончательное окислительно - восстановительная реакция (горения) озона, кислород и активных форм в воду, различные оксиды и углеводороды места в пределах примерно 180 пса после первоначальной реакции - в пределах примерно микрон детонационной волны. Детонирующие кристаллы TATP в конечном счете достигает температуры 2300 К и давлении 80 кбар. Конечная энергия детонации составляет около 2800 кДж / кг (измеренное в гелии) - достаточно - кратко - поднять температуру газообразных продуктов до 2000 ° C. Объем газов при STP составляет 855 л / кг для TATP и 713 л / кг для DADP (измеряется в гелии).
Тетрамерная форма перекиси ацетона, приготовленного в нейтральных условиях с использованием олова катализатора в присутствии хелатирующего агента или общего ингибитора радикальной химии , как сообщается, более химически стабильным, хотя все еще очень опасно первичное взрывчатое вещество . Его синтез был спорным.
Оба TATP и DADP склонны к потере масс через сублимацию . DADP имеет более низкую молекулярную массу и более высокое давление паров . Это означает , что DADP более склонны к сублимации , чем TATP.
Некоторые методы могут быть использованы для анализа следовых количеств TATP, в том числе газовой хроматографии / масс - спектрометрии (ГХ / МС), хроматографии высокого жидкости производительность / масс - спектрометрии (ВЭЖХ / МС) и ВЭЖХ с пост-колонке дериватизации.
Пероксид Ацетон растворим в толуоле, хлороформе, ацетоне, дихлорметане и метаноле. Перекристаллизае первичных взрывчатых веществ могут давать большие кристаллы, которые самопроизвольно взрываются из-за внутреннее напряжение.
Промышленное использование
Кетоновые пероксиды, включая перекись ацетона и пероксид метилэтилкетона , найти применение в качестве инициаторов для полимеризации реакций, например, силикона или полиэфирных смол , в изготовлении стекловолокна , укрепили композиты. Для этих целей, пероксиды , как правило , в виде разбавленного раствора в органическом растворителе; метил - этил - кетон пероксид является более распространенным для этой цели, так как она стабильна при хранении.
Перекись Ацетон используется в качестве муки отбеливателя для отбеливания и «зрелой» муки.
Ацетон пероксиды нежелательные побочные продукты некоторых реакций окисления , такие как те , которые используются в фенольных синтезов. Из - за их взрывной характер, их присутствие в химических процессах и химических образцов создает потенциально опасные ситуации. Случайное появление в незаконных МДМА лабораториях возможно. Многочисленные методы используются для снижения их внешний вид, в том числе сдвиг рН в более щелочной, регулируя температуру реакции, или добавление ингибиторов их производства. Например, пероксид triacetone является основным загрязнителем найден в диизопропиловом эфире в результате фотохимического окисления на воздухе.
Использование в самодельных взрывных устройствах
TATP был использован в бомбы и нападения террористов - смертников и самодельных взрывных устройств, в том числе взрывов в Лондоне 7 июля 2005 года , когда четыре террориста - смертника погибли 52 человек и ранено более 700. Это был один из взрывчатых веществ , используемых в «обувного бомбардировщика» Ричард Рид в своих 2001 неудачной попытку обуви бомбы и была использованы террористами - смертниками в ноябре 2015 года атак Парижа , 2016 Брюссель Взрыва , Манчестер Арен бомбардировка , июнь 2017 Брюссель атака , Parsons Green бомбардировка и взрывы Сурабая .
TATP ударноволновое избыточное давление составляет 70% от что для TNT, положительный импульс фазы составляет 55% от эквивалента TNT. TATP при 0,4 г / см 3 имеет примерно одну треть от бризантности тротила (1,2 г / см 3 ) , измеренная с помощью теста Hess.
TATP привлекателен для террористов , потому что она легко получена из легко доступных розничных ингредиентов, такие как отбеливатель волос и жидкость для снятия лака. Он также может избежать обнаружения , потому что это один из немногих взрывчатых веществ , которые не содержат азот , и поэтому может проходить незамеченным через традиционные взрывчатое обнаружения сканеров , предназначенных для обнаружения взрывчатых веществ , азотистых. Несколько устройств обнаружения для TATP были , однако в настоящее время разработаны.
Законодательные меры, чтобы ограничить продажу концентрированной перекиси водорода (выше 12% конц.) Были сделаны в ЕС.
Ключевым недостатком является его высокая чувствительность к случайной детонации (и в результате несчастных случаев на рабочем месте или « собственные цели » в бомбовых цехами), что привело к TATP именуемых «Мать Сатаны». TATP был найден в случайном взрыве , который предшествовал 2017 террористических актов в Барселоне и прилегающих районах .
Крупномасштабный синтез TATP часто предавала чрезмерным отбеливатель-как или фруктовым запахом. Этот запах может даже проникать в одежду и волосы в количествах, которые весьма заметно. Такой человек «пахнет химикатами». Об этом сообщили в 2016 году в Брюсселе взрывов .
Рекомендации
внешняя ссылка
Перекись ацетона - это... Что такое Перекись ацетона?
- Перекись ацетона
- Статья удалена в соответствии с требованями Роскомнадзора.
Wikimedia Foundation. 2010.
- System of a Down (альбом)
- Максимальный тор
Смотреть что такое "Перекись ацетона" в других словарях:
перекись ацетона — сущ., кол во синонимов: 1 • взрывчатка (232) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Перекись — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Пероксид ацетона — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
Е929 — Структурная формула триперекиси ацетона Перекись ацетона (триперекись ацетона, диперекись ацетона, трициклоацетонпероксид, ТА, ДА, ТЦАП, киса) инициирующее взрывчатое вещество, впервые получено в 1885 году Вольфенштейном. Существует в виде… … Википедия
Пероксид — (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надперекиси — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надперекись — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надпероксид — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надпероксиды — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Перекиси — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Перекись ацетона - это... Что такое Перекись ацетона?
- Перекись ацетона
- Статья удалена в соответствии с требованями Роскомнадзора.
Wikimedia Foundation. 2010.
- System of a Down (альбом)
- Максимальный тор
Смотреть что такое "Перекись ацетона" в других словарях:
перекись ацетона — сущ., кол во синонимов: 1 • взрывчатка (232) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Перекись — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Пероксид ацетона — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
Е929 — Структурная формула триперекиси ацетона Перекись ацетона (триперекись ацетона, диперекись ацетона, трициклоацетонпероксид, ТА, ДА, ТЦАП, киса) инициирующее взрывчатое вещество, впервые получено в 1885 году Вольфенштейном. Существует в виде… … Википедия
Пероксид — (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надперекиси — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надперекись — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надпероксид — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Надпероксиды — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Перекиси — Пероксид (ранее перекись) вещество, содержащее пероксогруппу О О (например, пероксид водорода Н2О2, пероксид натрия Na2O2). Пероксид легко выделяет кислород. Для неорганических веществ рекомендуется использовать термин пероксид, для… … Википедия
Пероксид ацетона — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
Пероксид ацетона (перекись ацетона) — инициирующее взрывчатое вещество, впервые полученное Рихардом Вольфенштейном в 1885 году[2].
История
Первые эксперименты по получению пероксидов ацетона были проведены Вольфенштейном в 1895 году, когда он изучал действие пероксида водорода на кониин в ацетоновом растворе, полагая, что ацетон и пероксид водорода не взаимодействуют. Вольфенштейн обнаружил, что из смеси равных объёмов ацетона и 10%-ного пероксида водорода выпадают кристаллы, которые он охарактеризовал как тримерный пероксид ацетона (триперекись ацетона 2). Также он заметил, что реакция происходит быстрее при добавлении малых количеств фосфорной кислоты[3].
В 1899 году Адольф Байер и Виктор Виллигер синтезировали также димерный пероксид ацетона (диперекись ацетона 1). В 1933 году Лекок наблюдал процесс деполимеризации трипероксида ацетона при определении его молекулярной массы методом криоскопии, а также при плавлении. В 1947 году изучалось влияние кислот на образование пероксидов ацетона, в частности, было замечено, что серная, соляная, фосфорная и азотная кислоты значительно ускоряют окисление ацетона пероксидом водорода, а в присутствии органических кислот (уксусной, бензойной) образования продукта не происходит[3].
К настоящему времени получены пероксиды ацетона четырёх структур[4].
Получение
Димерный пероксид ацетона (диперекись ацетона, 1) получают с выходом 94 % при обработке ацетона 86 %-ным пероксидом водорода в ацетонитриле в присутствии серной кислоты при пониженной температуре. Другим способом синтеза диперекиси ацетона является реакция ацетона с персульфатом калия в разбавленной серной кислоте. Тримерный пероксид ацетона (триперекись ацетона, 2) образуется в данных реакциях как примесь. Для препаративного получения данного продукта применяют реакцию ацетона с эквивалентным количеством 50 %-ной перекиси водорода и 0,25 эквивалентами серной кислоты. Триперекись ацетона можно очистить низкотемпературной перекристаллизацией из пентана[4]. При этом она кристаллизуется в виде длинных плоских призмовидных кристаллов[3].
Пероксиды 3 и 4 могут быть получены в данных реакциях при отсутствии минеральной кислоты. Например, смесь ацетона и 50 %-ной перекиси водорода при перемешивании в течение 3 часов при 0 °С даёт исключительно 2,2-бис(гидроперокси)пропан 3. Увеличение времени реакции приводит к образованию продукта 4[4].
Физические свойства
Трипероксид ацетона легко возгоняется:
- при температуре 14—18 °С он теряет около 6,5 % массы за 24 часа;
- при 25 °С — 68 % массы за 14 дней;
- при 50 °С — 1,5 % массы за 2 часа;
- при 100 °С — возгоняется весьма быстро[5].
Он растворим в этаноле (0,15 г / 100 г при 17 °С), диэтиловом эфире (5,5), петролейном эфире (7,35), ацетоне (9,15), сероуглероде (9,97), пиридине (15,4), бензоле (18,0), трихлорэтилене (22,7), четырёххлористом углероде (24,8), хлороформе (42,5)[5], но нерастворим в воде[6].
Химические свойства
При нагревании с разбавленной серной кислотой пероксид ацетона количественно гидролизуется с образованием ацетона и пероксида водорода:
- <math>\mathsf{C_3H_6O_2 + 3H_2O \rightarrow 3C_3H_6O + 3H_2O_2}</math>[3]
Миллиграммовые количества дипероксида и трипероксида ацетона в течение 15 минут разлагаются сильными кислотами (например, серной кислотой или метансульфокислотой). Поскольку реакция экзотермична, действие сильных кислот на граммовые количества вызывает детонацию. Также трипероксид ацетона эффективно разрушается хлоридом олова(II)[6][7].
При получении с использованием метансульфокислоты, хлорной или серной кислоты трипероксид ацетона самопроизвольно превращается в дипероксид ацетона. Однако при использовании хлорида олова(IV), соляной или азотной кислоты он остаётся стабильным[8].
Использование в качестве взрывчатого вещества
В военных целях пероксид ацетона не используется из-за высокой летучести и чувствительности, однако, c 1980-x годов применяется в террористических целях как инициирующее или основное взрывчатое вещество[5][9]. Использование террористами связано с простотой синтеза, а также с тем, что в молекуле данного вещества отсутствует азот, что делает невозможным определение взрывающего устройства стандартными устройствами, отвечающими на азот[10]. Трипероксид ацетона обладает примерно такой же взрывной силой, как тротил. Кроме того, он весьма чувствителен к нагреванию и удару и может воспламеняться под действием открытого пламени и электрического разряда[4], что делает сам процесс создания взрывающих устройств опасным (по этой причине трипероксид ацетона получил название «Мать Сатаны»)[10].
Сообщается, что данное вещество детонирует даже при содержании воды до 25 %[6]. К удару перекись ацетона чуть менее чувствительна, чем азид свинца. По бризантности она превосходит азид свинца и гремучую ртуть[3].
При взрыве пероксида ацетона происходит резкое образование большого объёма газов: из его одной молекулы образуются три молекулы ацетона и одна молекула озона[2]. Приводят также и другое уравнение разложения:
- <math>\mathsf{(C_3H_6O_2)_3 \rightarrow 1,3CO_2 + 2,44CO + 2,61CH_4 + 0,63C_2H_6 + 0,23C_2H_4 + 0,47H_2 + 0,96H_2O + 0,47C}</math>[3]
Скорость детонации трипероксида ацетона составляет 5300 м/с при плотности 1,2 г/см³ и около 1430 м/с при 0,47 г/см³. В диапазоне плотностей от 0,35 до 1,2 г/см³ эта зависимость линейна и подчиняется уравнению
<math>y=5405,1x - 1149</math>.
Его теплота взрыва составляет 2803 кДж/кг, что составляет 88 % от тротилового эквивалента.
Обнаружение
Трипероксид и дипероксид ацетона можно обнаружить или проанализировать методом тонкослойной хроматографии на силикагеле (элюент: толуол, Rf 0,57 и 0,66 соответственно, проявка 1 % дифениламина в концентрированной серной кислоте). Подобраны также условия для анализа газовой хроматографией и масс-спектрометрией[6].
Напишите отзыв о статье "Пероксид ацетона"
Примечания
- ↑ [www.chemnet.com/cas/supplier.cgi?exact=dict&terms=17088-37-8 17088-37-8 Acetone peroxide]. Проверено 24 июля 2013. [www.webcitation.org/6IPTtTTnY Архивировано из первоисточника 27 июля 2013].
- ↑ 1 2 Encyclopedia of Forensic Sciences, 3V Set ONLINE. — Academic Press. — 2013. — P. 102. — ISBN 978-0-12-382165-2.
- ↑ 1 2 3 4 5 6 Багал, 1975.
- ↑ 1 2 3 4 Agrawal J. P., Hodgson R. D. [books.google.by/books?id=2B4VqK18VOUC Organic Chemistry of Explosives]. — Wiley, 2007. — P. 339—340. — ISBN 978-0-470-02967.
- ↑ 1 2 3 Yinon J. [books.google.by/books?id=xQPUWY_Eg5oC Forensic and Environmental Detection of Explosives]. — John Wiley & Sons, 1999. — P. 10—12. — ISBN 0-471-98371-3.
- ↑ 1 2 3 4 Lunn G., Sansone E. B. [books.google.by/books?id=dU56-Wqkk-wC Destruction of Hazardous Chemicals in the Laboratory]. — John Wiley & Sons, 2012. — P. 459—462. — ISBN 978-0-470-48755-6.
- ↑ Oxley J. C., Smith J. L., Huang J., Luo W. Destruction of Peroxide Explosives (англ.) // Journal of Forensic Sciences. — 2009. — Vol. 54, no. 5. — P. 1029—1033. — DOI:10.1111/j.1556-4029.2009.01130.x. — PMID 19737243.
- ↑ Matyas R., Pachman J., Ang H.-G. Study of TATP: Spontaneous Transformation of TATP to DADP (англ.) // Propellants, Explosives, Pyrotechnics. — 2008. — Vol. 33, no. 2. — P. 89—91. — DOI:10.1002/prep.200700247.
- ↑ Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part I (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — Vol. 38, no. 2. — P. 244—254. — DOI:10.1002/prep.201200116.
- ↑ 1 2 Girard J. E. [books.google.by/books?id=ULjRbQYPUSIC Criminalistics: Forensic Science, Crime and Terrorism]. — 2nd Ed.. — Jones & Bartlett Publishers, 2011. — P. 422. — ISBN 978-0-7637-7731-9.
Литература
- Багал Л. И. Химия и технология инициирующих взрывчатых веществ. — М.: Машиностроение, 1975. — С. 411—415.
- Wolffenstein R. Ueber die Einwirkung von Wasserstoffsuperoxyd auf Aceton und Mesityloxyd (нем.) // Berichte der deutschen chemischen Gesellschaft. — 1895. — Bd. 28, Nr. 2. — S. 2265—2269. — DOI:10.1002/cber.189502802208.
- Baeyer A., Villiger V. Ueber die Einwirkung des Caro'schen Reagens auf Ketone (нем.) // Berichte der deutschen chemischen Gesellschaft. — 1900. — Bd. 33, Nr. 1. — S. 858—864. — DOI:10.1002/cber.190003301153.
- Экспериментальные статьи
- Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part I (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — Vol. 38, no. 2. — P. 244—254. — DOI:10.1002/prep.201200116.
- Oxley J. C., Smith J. L., Bowden P. R., Rettinger R. C. Factors Influencing Triacetone Triperoxide (TATP) and Diacetone Diperoxide (DADP) Formation: Part 2 (англ.) // Propellants, Explosives, Pyrotechnics. — 2013. — DOI:10.1002/prep.201200215.
Отрывок, характеризующий Пероксид ацетона
– И почему вы могли поверить, что он мой любовник?… Почему? Потому что я люблю его общество? Ежели бы вы были умнее и приятнее, то я бы предпочитала ваше.– Не говорите со мной… умоляю, – хрипло прошептал Пьер.
– Отчего мне не говорить! Я могу говорить и смело скажу, что редкая та жена, которая с таким мужем, как вы, не взяла бы себе любовников (des аmants), а я этого не сделала, – сказала она. Пьер хотел что то сказать, взглянул на нее странными глазами, которых выражения она не поняла, и опять лег. Он физически страдал в эту минуту: грудь его стесняло, и он не мог дышать. Он знал, что ему надо что то сделать, чтобы прекратить это страдание, но то, что он хотел сделать, было слишком страшно.
– Нам лучше расстаться, – проговорил он прерывисто.
– Расстаться, извольте, только ежели вы дадите мне состояние, – сказала Элен… Расстаться, вот чем испугали!
Пьер вскочил с дивана и шатаясь бросился к ней.
– Я тебя убью! – закричал он, и схватив со стола мраморную доску, с неизвестной еще ему силой, сделал шаг к ней и замахнулся на нее.
Лицо Элен сделалось страшно: она взвизгнула и отскочила от него. Порода отца сказалась в нем. Пьер почувствовал увлечение и прелесть бешенства. Он бросил доску, разбил ее и, с раскрытыми руками подступая к Элен, закричал: «Вон!!» таким страшным голосом, что во всем доме с ужасом услыхали этот крик. Бог знает, что бы сделал Пьер в эту минуту, ежели бы
Элен не выбежала из комнаты.
Через неделю Пьер выдал жене доверенность на управление всеми великорусскими имениями, что составляло большую половину его состояния, и один уехал в Петербург.
Прошло два месяца после получения известий в Лысых Горах об Аустерлицком сражении и о погибели князя Андрея, и несмотря на все письма через посольство и на все розыски, тело его не было найдено, и его не было в числе пленных. Хуже всего для его родных было то, что оставалась всё таки надежда на то, что он был поднят жителями на поле сражения, и может быть лежал выздоравливающий или умирающий где нибудь один, среди чужих, и не в силах дать о себе вести. В газетах, из которых впервые узнал старый князь об Аустерлицком поражении, было написано, как и всегда, весьма кратко и неопределенно, о том, что русские после блестящих баталий должны были отретироваться и ретираду произвели в совершенном порядке. Старый князь понял из этого официального известия, что наши были разбиты. Через неделю после газеты, принесшей известие об Аустерлицкой битве, пришло письмо Кутузова, который извещал князя об участи, постигшей его сына.
«Ваш сын, в моих глазах, писал Кутузов, с знаменем в руках, впереди полка, пал героем, достойным своего отца и своего отечества. К общему сожалению моему и всей армии, до сих пор неизвестно – жив ли он, или нет. Себя и вас надеждой льщу, что сын ваш жив, ибо в противном случае в числе найденных на поле сражения офицеров, о коих список мне подан через парламентеров, и он бы поименован был».
Получив это известие поздно вечером, когда он был один в. своем кабинете, старый князь, как и обыкновенно, на другой день пошел на свою утреннюю прогулку; но был молчалив с приказчиком, садовником и архитектором и, хотя и был гневен на вид, ничего никому не сказал.
Когда, в обычное время, княжна Марья вошла к нему, он стоял за станком и точил, но, как обыкновенно, не оглянулся на нее.
– А! Княжна Марья! – вдруг сказал он неестественно и бросил стамеску. (Колесо еще вертелось от размаха. Княжна Марья долго помнила этот замирающий скрип колеса, который слился для нее с тем,что последовало.)
Княжна Марья подвинулась к нему, увидала его лицо, и что то вдруг опустилось в ней. Глаза ее перестали видеть ясно. Она по лицу отца, не грустному, не убитому, но злому и неестественно над собой работающему лицу, увидала, что вот, вот над ней повисло и задавит ее страшное несчастие, худшее в жизни, несчастие, еще не испытанное ею, несчастие непоправимое, непостижимое, смерть того, кого любишь.
– Mon pere! Andre? [Отец! Андрей?] – Сказала неграциозная, неловкая княжна с такой невыразимой прелестью печали и самозабвения, что отец не выдержал ее взгляда, и всхлипнув отвернулся.
– Получил известие. В числе пленных нет, в числе убитых нет. Кутузов пишет, – крикнул он пронзительно, как будто желая прогнать княжну этим криком, – убит!
Княжна не упала, с ней не сделалось дурноты. Она была уже бледна, но когда она услыхала эти слова, лицо ее изменилось, и что то просияло в ее лучистых, прекрасных глазах. Как будто радость, высшая радость, независимая от печалей и радостей этого мира, разлилась сверх той сильной печали, которая была в ней. Она забыла весь страх к отцу, подошла к нему, взяла его за руку, потянула к себе и обняла за сухую, жилистую шею.
– Mon pere, – сказала она. – Не отвертывайтесь от меня, будемте плакать вместе.
– Мерзавцы, подлецы! – закричал старик, отстраняя от нее лицо. – Губить армию, губить людей! За что? Поди, поди, скажи Лизе. – Княжна бессильно опустилась в кресло подле отца и заплакала. Она видела теперь брата в ту минуту, как он прощался с ней и с Лизой, с своим нежным и вместе высокомерным видом. Она видела его в ту минуту, как он нежно и насмешливо надевал образок на себя. «Верил ли он? Раскаялся ли он в своем неверии? Там ли он теперь? Там ли, в обители вечного спокойствия и блаженства?» думала она.
– Mon pere, [Отец,] скажите мне, как это было? – спросила она сквозь слезы.
– Иди, иди, убит в сражении, в котором повели убивать русских лучших людей и русскую славу. Идите, княжна Марья. Иди и скажи Лизе. Я приду.
Когда княжна Марья вернулась от отца, маленькая княгиня сидела за работой, и с тем особенным выражением внутреннего и счастливо спокойного взгляда, свойственного только беременным женщинам, посмотрела на княжну Марью. Видно было, что глаза ее не видали княжну Марью, а смотрели вглубь – в себя – во что то счастливое и таинственное, совершающееся в ней.
– Marie, – сказала она, отстраняясь от пялец и переваливаясь назад, – дай сюда твою руку. – Она взяла руку княжны и наложила ее себе на живот.
Глаза ее улыбались ожидая, губка с усиками поднялась, и детски счастливо осталась поднятой.
Княжна Марья стала на колени перед ней, и спрятала лицо в складках платья невестки.
– Вот, вот – слышишь? Мне так странно. И знаешь, Мари, я очень буду любить его, – сказала Лиза, блестящими, счастливыми глазами глядя на золовку. Княжна Марья не могла поднять головы: она плакала.
– Что с тобой, Маша?
– Ничего… так мне грустно стало… грустно об Андрее, – сказала она, отирая слезы о колени невестки. Несколько раз, в продолжение утра, княжна Марья начинала приготавливать невестку, и всякий раз начинала плакать. Слезы эти, которых причину не понимала маленькая княгиня, встревожили ее, как ни мало она была наблюдательна. Она ничего не говорила, но беспокойно оглядывалась, отыскивая чего то. Перед обедом в ее комнату вошел старый князь, которого она всегда боялась, теперь с особенно неспокойным, злым лицом и, ни слова не сказав, вышел. Она посмотрела на княжну Марью, потом задумалась с тем выражением глаз устремленного внутрь себя внимания, которое бывает у беременных женщин, и вдруг заплакала.
– Получили от Андрея что нибудь? – сказала она.
– Нет, ты знаешь, что еще не могло притти известие, но mon реrе беспокоится, и мне страшно.
– Так ничего?
– Ничего, – сказала княжна Марья, лучистыми глазами твердо глядя на невестку. Она решилась не говорить ей и уговорила отца скрыть получение страшного известия от невестки до ее разрешения, которое должно было быть на днях. Княжна Марья и старый князь, каждый по своему, носили и скрывали свое горе. Старый князь не хотел надеяться: он решил, что князь Андрей убит, и не смотря на то, что он послал чиновника в Австрию розыскивать след сына, он заказал ему в Москве памятник, который намерен был поставить в своем саду, и всем говорил, что сын его убит. Он старался не изменяя вести прежний образ жизни, но силы изменяли ему: он меньше ходил, меньше ел, меньше спал, и с каждым днем делался слабее. Княжна Марья надеялась. Она молилась за брата, как за живого и каждую минуту ждала известия о его возвращении.
– Ma bonne amie, [Мой добрый друг,] – сказала маленькая княгиня утром 19 го марта после завтрака, и губка ее с усиками поднялась по старой привычке; но как и во всех не только улыбках, но звуках речей, даже походках в этом доме со дня получения страшного известия была печаль, то и теперь улыбка маленькой княгини, поддавшейся общему настроению, хотя и не знавшей его причины, – была такая, что она еще более напоминала об общей печали.
– Ma bonne amie, je crains que le fruschtique (comme dit Фока – повар) de ce matin ne m'aie pas fait du mal. [Дружочек, боюсь, чтоб от нынешнего фриштика (как называет его повар Фока) мне не было дурно.]
– А что с тобой, моя душа? Ты бледна. Ах, ты очень бледна, – испуганно сказала княжна Марья, своими тяжелыми, мягкими шагами подбегая к невестке.
– Ваше сиятельство, не послать ли за Марьей Богдановной? – сказала одна из бывших тут горничных. (Марья Богдановна была акушерка из уездного города, жившая в Лысых Горах уже другую неделю.)
– И в самом деле, – подхватила княжна Марья, – может быть, точно. Я пойду. Courage, mon ange! [Не бойся, мой ангел.] Она поцеловала Лизу и хотела выйти из комнаты.
– Ах, нет, нет! – И кроме бледности, на лице маленькой княгини выразился детский страх неотвратимого физического страдания.
– Non, c'est l'estomac… dites que c'est l'estomac, dites, Marie, dites…, [Нет это желудок… скажи, Маша, что это желудок…] – и княгиня заплакала детски страдальчески, капризно и даже несколько притворно, ломая свои маленькие ручки. Княжна выбежала из комнаты за Марьей Богдановной.
– Mon Dieu! Mon Dieu! [Боже мой! Боже мой!] Oh! – слышала она сзади себя.
Потирая полные, небольшие, белые руки, ей навстречу, с значительно спокойным лицом, уже шла акушерка.
– Марья Богдановна! Кажется началось, – сказала княжна Марья, испуганно раскрытыми глазами глядя на бабушку.
– Ну и слава Богу, княжна, – не прибавляя шага, сказала Марья Богдановна. – Вам девицам про это знать не следует.
– Но как же из Москвы доктор еще не приехал? – сказала княжна. (По желанию Лизы и князя Андрея к сроку было послано в Москву за акушером, и его ждали каждую минуту.)
– Ничего, княжна, не беспокойтесь, – сказала Марья Богдановна, – и без доктора всё хорошо будет.
Через пять минут княжна из своей комнаты услыхала, что несут что то тяжелое. Она выглянула – официанты несли для чего то в спальню кожаный диван, стоявший в кабинете князя Андрея. На лицах несших людей было что то торжественное и тихое.
Княжна Марья сидела одна в своей комнате, прислушиваясь к звукам дома, изредка отворяя дверь, когда проходили мимо, и приглядываясь к тому, что происходило в коридоре. Несколько женщин тихими шагами проходили туда и оттуда, оглядывались на княжну и отворачивались от нее. Она не смела спрашивать, затворяла дверь, возвращалась к себе, и то садилась в свое кресло, то бралась за молитвенник, то становилась на колена пред киотом. К несчастию и удивлению своему, она чувствовала, что молитва не утишала ее волнения. Вдруг дверь ее комнаты тихо отворилась и на пороге ее показалась повязанная платком ее старая няня Прасковья Савишна, почти никогда, вследствие запрещения князя,не входившая к ней в комнату.