Угнетение кроветворения что это такое
какие проблемы могут быть с кроветворением?
Кроветворение – это процесс, от нормального течения которого зависит жизнедеятельность человеческого организма. Поэтому важно знать, к каким проблемам может привести нарушение кроветворной функции.
Жизнедеятельность человеческого организма основана на слаженной работе всех систем, в том числе, и кроветворной функции, называемой гемопоэзом. Кроветворение – это процесс, обеспечивающий поступление в сосудистую систему всех необходимых элементов в точно определенной концентрации.
Понять, что такое кроветворение, можно, если вспомнить – кровь является жидкостью, состоящей из таких компонентов, как плазма, эритроциты, тромбоциты и лейкоциты, причем комплектующие клетки продуцируются в прочих органах, прочно связанных с сосудистой системой. Кстати, кровяные тельца не только растут, но и созревают вне русла и поставляются в сосуды уже в зрелом возрасте, постепенно отмирают и требуют замены новыми функционально самодостаточными клетками.
К сожалению, все имеет свой срок и кровяные тельца не являются исключением – каждые 3-4 месяца происходит обновление состава эритроцитов. Намного короче жизнь прочих элементов, так, тромбоциты существуют приблизительно неделю, а лейкоциты погибают в течение нескольких суток. Поэтому организму приходится непрерывно пополнять состав крови новыми клетками, в течение дня вырабатывается около 500 миллиардов новых кровяных телец.
Насколько продуктивно проходит производство, в основном зависит от костного мозга, именно он является основным поставщиком клеток, населяющих кровяное русло. Однако во многом успешность процесса зависит и от функциональности прочих органов, таких как лимфатические узлы, селезенка, тимус, печень и прочие. Основные процессы все же протекают в костном мозге и развиваются по двум направлениям: лимфоидный, формирование тканей-предшественников лимфоцитов, и миелоидный – образование предтечи других кровяных телец.
Впервые процесс кроветворения начинается уже на 16-19 день развития эмбриона и происходит в утолщениях стенок желчного мешочка, но уже спустя 40 дней переносится в такие органы, как тимус, печень и селезенка. По мере роста эмбриона развивается костный мозг и, как только его основное формирование будет завершено, он берет на себя функцию кроветворения. При этом направления, по которым происходит продуцирование кровяных телец, протекают в различных частях скелетного аппарата, так, миелопоэз свойственен для губчатых и трубчатых костей, а в продуцировании лимфоцитов принимают участие стволовые клетки.
Миелопоэз протекает по определенной схеме, так как в процессе вырабатываются сразу два типа клеток, поэтому у части телец исчезает ядро, что приводит к появлению эритроцитов а у остальных меняется кариотип полиплоидных мегакариоцитов, в результате продуцируются тромбоциты.
Лимфопоэз, как и при развитии эмбриона, у взрослого человека требует дополнительной помощи вилочковой железы, лимфатических узлов и селезенки.
Нарушение процесса кроветворения приводит к тяжелым заболеваниям, поэтому так важно следить за составом крови, не пренебрегать профилактическими медицинскими осмотрами, своевременно выявляя малейший дисбаланс в концентрации телец.
Анемия – распространенная патология, приводящая к снижению концентрации гемоглобина, а также уменьшению уровня присутствующих в крови эритроцитов. Стоит заметить, что самостоятельным заболеванием анемия не является, это следствие патологии, например, в результате дефицита соединений железа. Далеко не всегда причиной становятся болезни органов кроветворения, так, снижение гемоглобина может произойти из-за обильных менструаций либо в случае геморроя. Но не стоит забывать, что анемичные признаки характерны и для онкологии костного мозга, который является базой производства всех кровяных телец.
Гемолитическая анемия характеризуется ускоренным разрушением эритроцитов, организм просто не успевает заменить скоропостижно состарившиеся клетки новыми зрелыми. Поэтому в анализах крови можно заметить значительное количество молоденьких, недостаточно созревших кровяных телец, а также наличие билирубина, который образуется при распаде эритроцитов. Заболевание может носить наследственный характер либо провоцироваться прочими факторами, например, нарушением процесса выработки гемоглобина или дефицитом ферментных систем эритроцитов.
Геморрагический диатез – наследственная либо приобретенная патология, при которой наблюдается разжижение крови вследствие снижения уровня тромбоцитов. Среди данной группы заболеваний более всего известна гемофилия, поражающая исключительно мужчин, однако передающаяся по наследству женщинами рода. Снижение концентрации тромбоцитов до 40х10/л приводит к повышенной кровоточивости желудочно-кишечного тракта, почек, носовых ходов и т.д.
Среди заболеваний, характерных для органов кроветворения и кровеносной системы, нельзя не упомянуть о лейкозах – онкологии костного мозга, сопровождающейся изменением процесса продуцирования и распада лейкоцитов. Дифференцируют острую и хроническую форму патологии, при этом острая протекает стремительно и наиболее опасна, а хроническая может продолжаться много лет, постепенно проявляя симптоматику.
При остром лейкозе, который наиболее часто встречается у детей, костный мозг вырабатывает молодые лейкоциты, не способные дозреть и выполнять свои функции.
Хроническому лейкозу чаще подвержены пожилые люди, заболевание протекает на фоне разрастания лимфоидной ткани в таких органах, как костный мозг, печень, селезенка, лимфатические узлы.
Надо сказать, совсем недавно данные патологии считались неизлечимыми и только с развитием генной инженерии появилась возможность культивирования клеток и, соответственно, влияния на процессы кроветворения, протекающие в организме человека.
Нужно помнить, что большинство заболеваний кроветворной системы можно излечить, если не запускать процесс до запущенной стадии, так как даже при наследственной аномалии сегодня корректируют состав крови, применяя такие методы, как переливание и пересадка стволовых клеток.
Советуем к прочтению
Гемопоэз — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 марта 2019; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 марта 2019; проверки требуют 5 правок.Гемопоэз (от др.-греч. αἷμα, кровь и ποιεῖν — выработка, образование), кроветворение — это процесс образования, развития и созревания клеток крови — лейкоцитов, эритроцитов, тромбоцитов у позвоночных. Классифицируют эмбриональный (внутриутробный) гемопоэз и постэмбриональный гемопоэз.
В отличие от высших позвоночных, у рыб отсутствуют костный мозг и лимфатические узлы, гемопоэз происходит как в органах, в состав которых входит ретикулярный синцитий (жаберный аппарат, почки, лимфоидный орган), так и эндотелии сосудов жаберного аппарата и сердца и селезёнке и, в некоторых случаях, слизистая кишечника. У костных рыб основным органом кроветворения являются передние части почек, гемопоэз идёт также и в лимфоидных органах, и в селезёнке. Особенностью рыб является наличие в крови как зрелых, так и молодых эритроцитов, эритроциты имеют ядра.
Гемопоэз у человека.Гемопоэз у млекопитающих осуществляется кроветворными органами, прежде всего — миелоидной тканью красного костного мозга. Некоторая часть лимфоцитов развивается в лимфатических узлах, селезёнке, вилочковой железе (тимусе), которые совместно с красным костным мозгом образуют систему кроветворных органов.
Предшественниками всех клеток — форменных элементов крови — являются гемопоэтические стволовые клетки костного мозга, которые могут дифференцироваться двумя путями: в предшественников миелоидных клеток (миелопоэз) и в предшественников лимфоидных клеток (лимфопоэз).
Миелопоэз[править | править код]
При миелопоэзе (др.-греч. μυελός — костный мозг + ποίησις — выработка, образование) в костном мозге образуются форменные элементы крови: эритроциты, гранулоциты, моноциты и тромбоциты. Соответственно, процесс развития и созревания этих клеток называется эритропоэз, гранулоцитопоэз, моноцитопоэз и мегакариоцитопоэз[1]. Миелопоэз происходит в миелоидной ткани, расположенной в эпифизах трубчатых и полостях многих губчатых костей. Ткань, в которой происходит миелопоэз, называется миелоидной. Особенностью миелопоэза человека является изменение кариотипа клеток в процессе дифференциации, так, предшественниками тромбоцитов являются полиплоидные мегакариоциты, а эритробласты при трансформации в эритроциты лишаются ядер.
Лимфопоэз[править | править код]
Лимфопоэз происходит в лимфатических узлах, селезёнке, тимусе и костном мозге. Лимфоидная ткань выполняет несколько основных функций: образование лимфоцитов, образование плазмоцитов и удаление клеток и продуктов их распада.
Эмбриональный гемопоэз млекопитающих[править | править код]
Гемопоэз на эмбриональной стадии претерпевает изменения при онтогенезе. На ранних стадиях развития эмбрионов человека гемопоэз начинается в утолщениях мезодермы желточного мешка, продуцирующего эритроидные клетки примерно с 16—19 дня развития и прекращается после 60-го дня развития, после чего функция кроветворения переходит к печени и селезёнке, начинается лимфопоэз в тимусе (т. н. гепатоспленотимическая стадия). Последним из кроветворных органов в онтогенезе развивается красный костный мозг, играющий главную роль в постэмбриональном гемопоэзе. Костный мозг начинает формироваться в период, когда гематопоэз уже иссяк в желточном мешке, временно осуществляется в печени и активно развивается в тимусе. После окончательного формирования костного мозга гемопоэтическая функция печени угасает.
- ↑ Л. К. Жункейра, Ж. Карнейро. Гистология : учебное пособие : атлас. — Москва: ГЭОТАР-Медиа, 2009. — ISBN 978-5-9704-1352-4.
- Анисимова И. М., Лавровский В. В. Ихтиология. — Высшая школа, 1983
- Manuela Tavian, Bruno Peault. Embryonic development of the human hematopoietic system. Int. J. Dev. Biol. 49: 243—250 (2005)
Что такое кроветворение и зачем нужно на него влиять?
10.06.2017
Что такое кроветворение и зачем нужно на него влиять?
 Кроветворение – очень сложный процесс, он невидим и неощутим, а тем не менее, клетки крови участвуют в самых различных физиологических процессах, из них образуются клетки иммунной системы, и система крови реагирует на все заболевания, даже если этого не видно по общему анализу крови. Если кроветворение нарушается, то ничего не болит и человек может испытывать различные виды недомоганий, которые не позволяют однозначно связать проблемы со здоровьем с нарушением кроветворения. Чаще всего, поводом для беспокойства становится «плохой» анализ крови, но, как правило, лечащий врач не детализирует для больного – а что именно плохо. И лечит какое-нибудь заболевание в расчете на то, что кровь сама со временем нормализуется. Обычно так и бывает, но, если изменений в анализе нет, то человек направляется к гематологу. Таким образом, патология кроветворения – это не только заболевания крови, но еще и реакция крови на различные заболевания и внешние факторы – в основном, токсического характера (проф. вредности, лекарственные препараты, бытовая химия).
Кроветворение – очень сложный процесс, он невидим и неощутим, а тем не менее, клетки крови участвуют в самых различных физиологических процессах, из них образуются клетки иммунной системы, и система крови реагирует на все заболевания, даже если этого не видно по общему анализу крови. Если кроветворение нарушается, то ничего не болит и человек может испытывать различные виды недомоганий, которые не позволяют однозначно связать проблемы со здоровьем с нарушением кроветворения. Чаще всего, поводом для беспокойства становится «плохой» анализ крови, но, как правило, лечащий врач не детализирует для больного – а что именно плохо. И лечит какое-нибудь заболевание в расчете на то, что кровь сама со временем нормализуется. Обычно так и бывает, но, если изменений в анализе нет, то человек направляется к гематологу. Таким образом, патология кроветворения – это не только заболевания крови, но еще и реакция крови на различные заболевания и внешние факторы – в основном, токсического характера (проф. вредности, лекарственные препараты, бытовая химия).
Из сказанного следует два простых вывода:
поскольку клетки крови участвуют в самых различных заболеваниях, то лечить любые заболевания лучше, если одновременно воздействовать и на кроветворение, чтобы клетки крови лучше справлялись со своими функциями;
необходимо заниматься профилактикой нарушений кроветворения, поскольку это является профилактикой множества заболеваний, особенно тех, в развитие которых вовлечена иммунная система; также профилактика необходима тем людям, кто систематически подвергается рискам токсического воздействия.
Как ГЕМОЛЕПТИН действует на кроветворение?
Гемолептин позволяет сделать более адекватной реакцию системы крови на различные регулирующие стимулы и защитить кроветворные клетки от повреждений. При этом он улучшает взаимодействие системы крови и регуляторных систем организма, предупреждая появление дисбаланса между различными ростками кроветворения. Если дисбаланс уже существует, то Гемолептин будет способствовать его устранению, но не в ущерб актуальным потребностям организма. Это будет отражаться в улучшении результатов анализа крови.
Нужно помнить, что Гемолептин – это БАД, а не лекарственный препарат, поэтому никаких изощренных подходов, требующих контроля гематолога, к его применению нет. Секрет тут в том, что коммуникация процесса кроветворения с организмом осуществляется через вспомогательные клетки, находящиеся в красном костном мозге – макрофаги, клетки соединительной ткани, клетки сосудов. Через них организм сигнализирует системе кроветворения о своих потребностях, например, о том, что в организме началось воспаление и ему нужно больше лейкоцитов. Или произошла кровопотеря и организму нужно больше эритроцитов. Улучшение такой коммуникации под действием Гемолептина позволяет более точно настроить кроветворение и функциональную активность вновь образованных клеток крови к потребностям организма. При этом эффекты Гемолептина проявляются только в рамках физиологических колебаний кроветворной функции.
Что означает: «ГЕМОЛЕПТИН обновляет кровь»?
Количество тех или иных клеток крови и даже количественное соотношение между ними – это еще не все, что определяет эффективность кроветворения. Имеет значение и функциональная полноценность клеток крови, а это во многом закладывается на этапе их образования. Гемолептин оптимизирует процесс кроветворения, повышая «функционал» образующихся клеток крови. Т.е. действительно обновляет.
ГЕМОЛЕПТИН и лейкозы
Закономерным является вопрос – если Гемолептин может в ряде случаев стимулировать кроветворение, то не может ли он стимулировать рост опухолевых клеток, в частности, лейкозных? Как уже было сказано выше, Гемолептин улучшает «диалог» организма и системы кроветворения. Опухолевый же процесс подразумевает прямо противоположное явление – полное нарушение такого диалога и бесконтрольное размножение мутантного клона кроветворных клеток, подавляющего области нормального кроветворения (с этим связано угнетение кроветворения при лейкозах). Поэтому Гемолептин применим в комплексной терапии опухолевых процессов, так как позволяет поддержать кроветворную функцию и повысить ресурс выживаемости.
В каких случаях показан ГЕМОЛЕПТИН?
- Во всех случаях снижения кроветворной функции, неважно, что именно снижается – эритроциты, нейтрофилы, тромбоциты или моноциты.
- Экологические проблемы, профессиональные вредности (химическая промышленность, черная и цветная металлургия, лакокрасочные работы и любые работы с токсичными химикатами – в т. ч., гербицидами, пестицидами, дефолиантами в сельском хозяйстве).
- Адаптация к условиям гипоксии (высокогорье, спорт).
- Снижение активности иммунной системы – дефицит каких-либо клеток иммунной системы.
- Применение терапии, угнетающей кроветворение – противоопухолевы
Есть ли на рынке продукты, аналогичные ГЕМОЛЕПТИНУ?
Специализированн
На чем основана рекомендация совместного применения ГЕМОЛЕПТИНА и МУМИЧАГИ 100?
Мумие стимулирует функцию стволовой кроветворной клетки, что, в частности, проявляется ускорением под его влиянием восстановления кроветворения после лучевой болезни. Гемолептин действует на более поздних этапах кроветворения, уравновешивая между собой развитие различных ростков кроветворения (эритроидного, миелоидного, лимфоидного). Поэтому сочетание Мумичаги и Гемолептина дает более комплексное воздействие на кроветворение.
Есть ли противопоказания к приему ГЕМОЛЕПТИНА?
Противопоказания обычные – индивидуальная непереносимость компонентов, беременность и кормление. Перед применением рекомендуется проконсультирова
По какой схеме применять ГЕМОЛЕПТИН?
По 1-3 таблетки 3 раза в день, продолжительност
С ПРОДУКЦИЕЙ АПИФАРМ - БУДЬТЕ ЗДОРОВЫ И ЭНЕРГИЧНЫ!
Механизм угнетения нормального кроветворения при гемобластозах
Само по себе угнетение нормального кроветворения при опухолях из кроветворных клеток является главным звеном их механизма развития.
Нет какого-то одного механизма угнетения нормального кроветворения. Таких механизмов может быть несколько. Например, угнетение эритроцитопоэза и гранулоцитопоэза при сублейкемическом миелозе может находиться в связи с постепенным вытеснением нормального микроокружения кроветворной ткани за счет фиброза костного мозга, индуцируемого лейкозными клетками. Этот частный механизм редко свойствен другим лейкозам.
Определенной форме гемобластоза свойствен определенный довольно специфический эффект, которым может быть либо стимуляция, либо подавление, что далеко не всегда зависит от стадии и особенностей процесса. Специфичным является феномен, при котором между распространенностью опухолевых клеток в костном мозге и угнетением нормальных ростков нет отчетливой связи. Особенно ярка картина угнетения нормальных ростков на фоне малого распространения лейкозных клеток при так называемых предстадиях острого лейкоза, когда появление отдельных небольших групп бластных клеток в костном мозге сопровождается глубокой панцитопенией (чаще всего это предстадии острого эритромиелоза, миелобластного или миеломонобластного лейкоза).
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Механизма угнетений нормального кроветворения при гемобластозах, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору – клиника Eurolab всегда к Вашим услугам! Лучшие врачи осмотрят Вас, изучат внешние признаки и помогут определить болезнь по симптомам, проконсультируют Вас и окажут необходимую помощь и поставят диагноз. Вы также можете вызвать врача на дом. Клиника Eurolab открыта для Вас круглосуточно.
Как обратиться в клинику:
Телефон нашей клиники в Киеве: (+38 044) 206-20-00 (многоканальный). Секретарь клиники подберет Вам удобный день и час визита к врачу. Наши координаты и схема проезда указаны здесь. Посмотрите детальнее о всех услугах клиники на ее персональной странице.
Если Вами ранее были выполнены какие-либо исследования, обязательно возьмите их результаты на консультацию к врачу. Если исследования выполнены не были, мы сделаем все необходимое в нашей клинике или у наших коллег в других клиниках.
У Вас ? Необходимо очень тщательно подходить к состоянию Вашего здоровья в целом. Люди уделяют недостаточно внимания симптомам заболеваний и не осознают, что эти болезни могут быть жизненно опасными. Есть много болезней, которые по началу никак не проявляют себя в нашем организме, но в итоге оказывается, что, к сожалению, их уже лечить слишком поздно. Каждое заболевание имеет свои определенные признаки, характерные внешние проявления – так называемые симптомы болезни. Определение симптомов – первый шаг в диагностике заболеваний в целом. Для этого просто необходимо по несколько раз в год проходить обследование у врача, чтобы не только предотвратить страшную болезнь, но и поддерживать здоровый дух в теле и организме в целом.
Если Вы хотите задать вопрос врачу – воспользуйтесь разделом онлайн консультации, возможно Вы найдете там ответы на свои вопросы и прочитаете советы по уходу за собой. Если Вас интересуют отзывы о клиниках и врачах – попробуйте найти нужную Вам информацию в разделе Вся медицина. Также зарегистрируйтесь на медицинском портале Eurolab, чтобы быть постоянно в курсе последних новостей и обновлений информации на сайте, которые будут автоматически высылаться Вам на почту.
Если Вас интересуют еще какие-нибудь виды болезней и группы заболеваний человека или у Вас есть какие-либо другие вопросы и предложения – напишите нам, мы обязательно постараемся Вам помочь.Депрессии кроветворения - это... Что такое Депрессии кроветворения?
группа заболеваний и патологических состояний, характеризующихся уменьшением количества клеток гемопоэза.
Классификация Д. к. не разработана; четко выделяют приобретенные и наследственные формы. Условно различают также одно-, двух-и трехростковые Д. к., обусловленные поражением ростков костного мозга (эритроцитарного, гранулоцитарного, тромбоцитарного). Патологический процесс может затрагивать вначале один росток кроветворения, затем распространяться на другие. В тех случаях, когда уменьшается количество кроветворных клеток костного мозга, говорят о костномозговой гипоплазии, а когда уменьшается количество клеток крови — о цитопении. Приобретенные Д. к. возникают под влиянием разнообразных факторов: ионизирующего излучения, химических веществ, в т.ч. лекарственных средств, инфекций (например, вирусных), нередко причину установить не удается. Механизм развития Д. к. различен; в большинстве случаев отмечается снижение продукции кроветворных клеток в костном мозге, реже избыточное их разрушение. В определенной мере патогенез зависит от причины, обусловившей угнетение кроветворения. Так, ионизирующее излучение оказывает непосредственное действие на клетки крови и костного мозга; миелосан, угнетая функцию стволовой кроветворной клетки, может вызвать необратимую аплазию костного мозга; при иммунном конфликте образуются антитела к антигенам собственных клеток организма, что приводит к деструкции кроветворных клеток в костном мозге или форменных элементов крови. Клинические проявления определяются главным образом видом пораженного ростка костного мозга и степенью его угнетения. Так, при депрессии одновременно трех ростков кроветворения развиваются миелокариоцитопения, эритроцитопения (анемия), гранулоцитопения и тромбоцитопения. Если эти признаки сочетаются с преобладанием в структуре костного мозга жировой ткани над деятельной (по данным гистологического исследования трепанобиоптата костного мозга), то обычно отмечается гипопластическая анемия (см. Анемии). Одноростковая гипоплазия костного мозга, например эритробластофтиз, сопровождается глубокой анемией, обычно ретикулоцитопенией. Тромбоцитопении характеризуются геморрагиями, уменьшение числа клеток гранулоцитопоэза (см. Агранулоцитоз, Нейтропении наследственные) — инфекционными осложнениями. Двух- или трехростковые цитопении с непостоянным небольшим бластозом костного мозга и бластемией нередко заканчиваются так же, как острый лейкоз. При Д. к. по показаниям проводят трансфузии эритроцитной и (или) тромбоцитной массы, спленэктомню, плазмаферез (см. Плазмаферез, Цитаферез), трансплантацию костного мозга, назначают стероидные гормоны. Так, при галопластической анемии некоторым больным показана спленэктомия; при эритробластофтизе — плазмаферез; при иммунных цитопениях лечение обычно начинают с введения стероидных гормонов, и, если эффект отсутствует, может быть поставлен вопрос о целесообразности спленэктомии.Профилактика — строгое соблюдение мер техники безопасности при работе с источниками ионизирующего излучения; контрольные исследования крови при воздействии факторов, обладающих потенциальными гемодепрессивными свойствами, и прерывание контакта с ними в случае обнаружения каких-либо отклонений в показателях гемограммы.
Библиогр.: Гаврилов О.К., Файнштейн Ф.Э. и Турбина Н.С. Депрессии кроветворения, М., 1987; Руководство по гематологии, под ред. А.И. Воробьева, т. 2, М., 1985.Депрессии кроветворения — Медицинская энциклопедия
Депре́ссии кроветворе́ния
(лат. depressio подавление, угнетение)
группа заболеваний и патологических состояний, характеризующихся уменьшением количества клеток гемопоэза.
Классификация Д. к. не разработана; четко выделяют приобретенные и наследственные формы. Условно различают также одно-, двух-и трехростковые Д. к., обусловленные поражением ростков костного мозга (эритроцитарного, гранулоцитарного, тромбоцитарного). Патологический процесс может затрагивать вначале один росток кроветворения, затем распространяться на другие. В тех случаях, когда уменьшается количество кроветворных клеток костного мозга, говорят о костномозговой гипоплазии, а когда уменьшается количество клеток крови — о цитопении.
Приобретенные Д. к. возникают под влиянием разнообразных факторов: ионизирующего излучения, химических веществ, в т.ч. лекарственных средств, инфекций (например, вирусных), нередко причину установить не удается. Механизм развития Д. к. различен; в большинстве случаев отмечается снижение продукции кроветворных клеток в костном мозге, реже избыточное их разрушение. В определенной мере патогенез зависит от причины, обусловившей угнетение кроветворения. Так, ионизирующее излучение оказывает непосредственное действие на клетки крови и костного мозга; миелосан, угнетая функцию стволовой кроветворной клетки, может вызвать необратимую аплазию костного мозга; при иммунном конфликте образуются антитела к антигенам собственных клеток организма, что приводит к деструкции кроветворных клеток в костном мозге или форменных элементов крови.
Клинические проявления определяются главным образом видом пораженного ростка костного мозга и степенью его угнетения. Так, при депрессии одновременно трех ростков кроветворения развиваются миелокариоцитопения, эритроцитопения (анемия), гранулоцитопения и тромбоцитопения. Если эти признаки сочетаются с преобладанием в структуре костного мозга жировой ткани над деятельной (по данным гистологического исследования трепанобиоптата костного мозга), то обычно отмечается гипопластическая анемия (см. Анемии). Одноростковая гипоплазия костного мозга, например эритробластофтиз, сопровождается глубокой анемией, обычно ретикулоцитопенией. Тромбоцитопении характеризуются геморрагиями, уменьшение числа клеток гранулоцитопоэза (см. Агранулоцитоз, Нейтропении наследственные) — инфекционными осложнениями. Двух- или трехростковые цитопении с непостоянным небольшим бластозом костного мозга и бластемией нередко заканчиваются так же, как острый лейкоз.
При Д. к. по показаниям проводят трансфузии эритроцитной и (или) тромбоцитной массы, спленэктомню, плазмаферез (см. Плазмаферез, Цитаферез), трансплантацию костного мозга, назначают стероидные гормоны. Так, при галопластической анемии некоторым больным показана спленэктомия; при эритробластофтизе — плазмаферез; при иммунных цитопениях лечение обычно начинают с введения стероидных гормонов, и, если эффект отсутствует, может быть поставлен вопрос о целесообразности спленэктомии.
Профилактика — строгое соблюдение мер техники безопасности при работе с источниками ионизирующего излучения; контрольные исследования крови при воздействии факторов, обладающих потенциальными гемодепрессивными свойствами, и прерывание контакта с ними в случае обнаружения каких-либо отклонений в показателях гемограммы.
Библиогр.: Гаврилов О.К., Файнштейн Ф.Э. и Турбина Н.С. Депрессии кроветворения, М., 1987; Руководство по гематологии, под ред. А.И. Воробьева, т. 2, М., 1985.
Источник: Медицинская энциклопедия на Gufo.me
ДЕПРЕССИИ КРОВЕТВОРЕНИЯ
Депрессии кроветворения (лат. depressio подавление, угнетение) — общее название различных по патогенезу форм недостаточности кроветворения в целом или в отдельных его звеньях.
Четкой классификации депрессий кроветворения не существует, в основном их разделяют на две большие группы:
— приобретенные;
— наследственные.
Условно депрессии кроветворения можно разделить на:
— одноростковые;
— двухростковые;
— трехростковые.
Последняя классификация обусловлена поражением ростков костного мозга – тромбоцитарного, гранулоцитарного, эритроцитарного. Процесс может сначала затронуть один росток кроветворения, а впоследствии распространиться на остальные. Если количество кроветворных клеток костного мозга уменьшается, такое явление называют костномозговой гипоплазией, при уменьшении количества кровяных клеток говорят о цитопении.
Приобретенные депрессии крови могут возникнуть под влиянием ионизирующего излучения, инфекций, лекарственных средств. Развиваются они по-разному, чаще всего снижается количество продуцируемых клеток крови в костном мозге, иногда развитие депрессии связано с избыточным разрушением кровяных клеток. Патогенез заболевания зависит от причины угнетения кроветворения, так при иммунном конфликте антитела начинают вырабатываться к антигенам собственных клеток организма.
Вид развивающегося заболевания зависит от того, какой росток костного мозга был поврежден. При депрессии все трех ростков кроветворения получают свое развитие тромбоцитопения, миелокариоцитопения, гранулоцитопения и эритроцитопения. Одноростковая гипоплазия костного мозга, в частности эритробластофтиз, сопровождаются ретикулоцитопенией. Двухростковые и трехростковые цитопении с небольшим бластозом костного мозга могут закончиться также, как острый лейкоз.
В зависимости от клинических проявлений больным назначаются процедуры, например, трансфузии тромбоцитной или эритроцитной массы, плазмаферез (при эритробластофтизе), спленэктомию (при галопластической анемии) или трансплантацию костного мозга. При иммунных цитопениях чаще всего лечение начинается с назначения стероидных гормонов.
что это такое, симптомы, причины и лечение
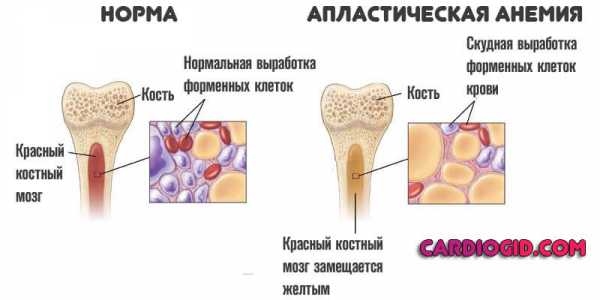
Апластическая анемия — это частный случай нарушения синтеза эритроцитов, сопровождается падением концентрации гемоглобина в результате отклонения в работе костного мозга.
В отличие от прочих форм нарушения, например железодефицитной, мегалобластной, патология куда сложнее излечивается, имеет худшие прогнозы.
Клиническая картина сама крайне опасна, несет большую угрозу для существования организма. Процесс дает кровотечения различной локализации, которые трудно остановить.
Диагностика представляет определенные сложности по причине отсутствия специфических клинических признаков, если проводить исследование рутинными способами.
Лечение строго стационарное. Длительность его неопределенно высокая, зависит от тяжести патологического процесса, характера его течения, агрессивности, стадии, также индивидуальных особенностей организма человека, первичной причины становления нарушения.
Механизм становления нарушения
В основе патогенеза расстройства лежит группа патогенетических факторов. Можно назвать четыре основных момента, которые и играют роль в формировании диагноза.
Прием некоторых лекарственных препаратов
Искусственное угнетение синтеза эритроцитов и незрелых клеток-предшественников.
Работу костного мозга нарушает группа медикаментов. Таким эффектом обладают цитостатики, которые активно применяются в лечении опухолей, особенно злокачественных.
Иммунодепрессанты, противосудорожные средства, лекарства для борьбы с малярией, некоторые гормональные медикаменты, а также фармакологические наименования для коррекции работы щитовидной железы.
Так или иначе побочный эффект не может длиться долго, но гипопластическая анемия протекает остро, достаточно и одного эпизода, чтобы создать большие риски для жизни. Отмена медикаментов становится первым шагом на пути к выздоровлению.
Вирусные поражения
Угнетать работу костного мозга могут и некоторые инфекционные структуры. В частности такой способностью обладают агенты гепатита, цитомегаловирус, штамм герпеса четвертого типа (Эпштейна-Барр). В том числе микобактерии туберкулеза.
При остром течении названных патологий апластической анемии может и не быть. Однако резко вырастают риски развития в ближайшем будущем.
Взаимодействие с химическими отравляющими компонентами
Гербицидами, средствами на основе ртути, мышьяка, бензола, органических спиртов, также прочих веществ, щелочных металлов, синильной кислоты.
Восстановление в таком случае требует исключения влияния отравляющего соединения на организм человека.
Воздействие ионизирующего излучения
Радиация сказывается на состоянии костного мозга в большей степени, что и провоцирует возможные кровотечения у пораженных людей. По мере выздоровления апластическая анемия постепенно отходит.
Названные этиологические факторы — это провокаторы, они выступают виновниками начала расстройства.
Далее же отклонение движется по одному выверенному сценарию.
Угнетается работа красного костного мозга и процесс кроветворения. Он перестает генерировать незрелые клетки, предшественники форменных, полноценных.
Отсюда снижение концентрации эритроцитов, а значит и гемоглобина, который участвует в перемещении кислорода по тканям и органам через кровеносное русло. Происходит замещение красного костного мозга — желтым, что только усугубляет аплазию.
Недостаточная транспортировка кислорода вызывает гипоксию. Клетки не могут дышать. Страдают все ткани организма.
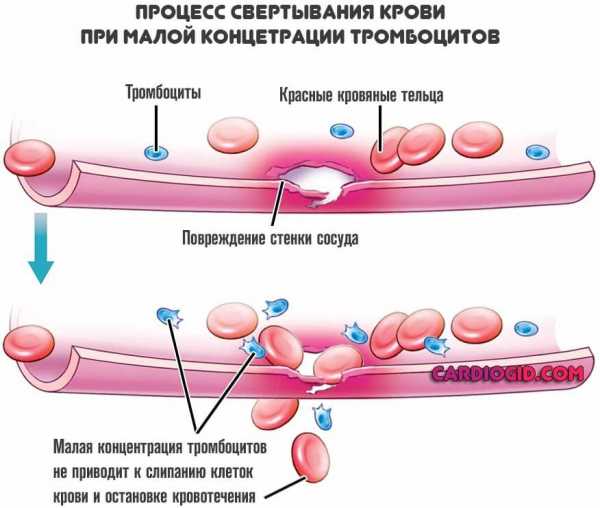
Падает концентрация тромбоцитов, повышается текучесть крови, растут риски летальных кровотечений.
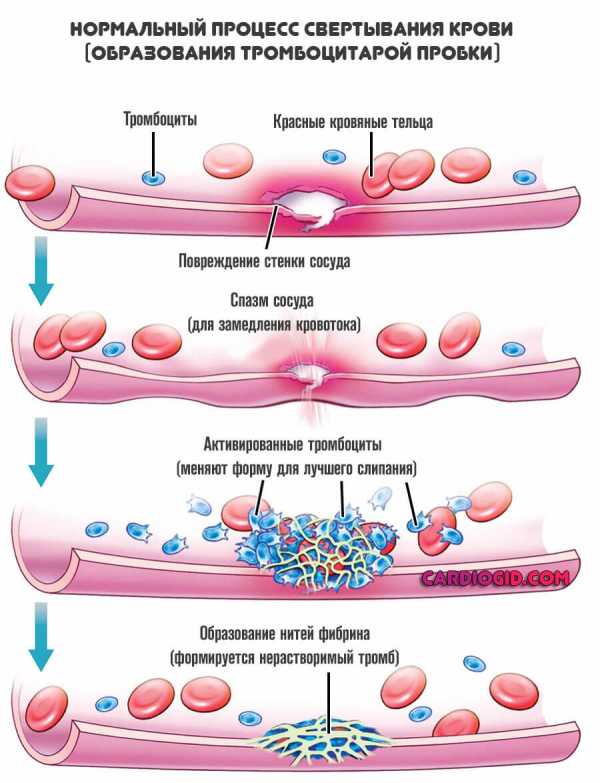
Восстановление заключается в избавлении от причины проблемы. Только так можно рассчитывать на излечение. Для грамотного терапевтического влияния требуется знать точный механизм.
Классификация
Типизацию проводят по степени тяжести апластической анемии. По этому критерию выделяют три основных формы болезни.
- Легкая. Сопровождается минимальными изменениями синтеза клеток. Возникает избыточная выработка некоторых химических веществ. Однако на этой стадии человек пока не замечает симптомов.
В редких случаях возможно образование на коже небольших язв, красных пятен. Кроме того, возникают носовые кровотечения. Обнаруживаются базовые анемические симптомы: головная боль, слабость, тошнота, прочие, в том числе снижение работоспособности. Это идеальный момент для начала лечения.
- Средняя степень. Дает уже выраженную клинику, которую трудно не заметить. Присутствуют полные геморрагические и анемические проявления. Качество жизни серьезно снижается. Летальные риски отмечаются, но пока сравнительно низкие. Показатели тромбо- и гранулоцитов находятся в пределах умеренного снижения.
- Тяжелая степень. Клиника полная, есть реальные риски смерти.
Это крайняя фаза, она же терминальная. Наблюдаются массивные нарушения работы организма, критические осложнения влекут за собой смерть пациента. Не всегда эффект дают даже полные лечебные мероприятия.
Второй способ классификации — по характеру заболевания.
Выделяют:
- Врожденную форму. Часто обнаруживаются генетические дефекты в качестве непосредственного фактора-виновника нарушения. У детей и молодых людей до 25 лет манифестация диагноза наблюдается наиболее часто. Второй пик приходится на период после 50, но уже гораздо реже.
- Приобретенную форму апластической анемии. Встречается почти в 80% случаев. Становится результатом заболеваний. В том числе онкологических, эндокринных расстройств и других возможных.
Используется классификация по агрессивности и характеру течения:
- Острая форма. Сопровождается резким падением количества форменных клеток крови, выраженной клинической картиной. Наиболее часто встречается именно этот тип процесса. О нем говорят в том случае, если симптоматический комплекс наблюдается в течении до 1 месяца.
- Подострая форма. От 30 дней до полугода. Сопровождается относительно вялой клинической картиной. Однако опасность от этого меньше не становится.
- Хронический тип. Длительность свыше 6 месяцев.
Наконец, классифицировать заболевание можно по происхождению, этиологии.
Соответственно называют:
- Первичное расстройство. Обусловлено генетическими дефектами. Присутствует с человеком явно или скрыто с самого рождения.
- Вторичная форма. Встречается в результате перенесенных прочих отклонений.
Не всегда врач с ходу и даже после тщательной диагностики может обнаружить причины патологического процесса, в такой ситуации говорят об идиопатической апластической анемии.
По мере дальнейшего обследования возможен пересмотр диагноза. В зависимости от итогов диагностики.
Симптомы
Клиническая картина определяется двумя основными синдромами. Первый — собственно анемический. Результат недостаточного питания тканей организма, также кислородного голодания.
Проявления таковы:
- Слабость. Астенические явления — это симптомы апластической анемии, которые присутствуют на протяжении всего периода течения патологического процесса. Восстановление спонтанное.
- Одышка. После незначительной физической нагрузки. Также в состоянии полного покоя.
- Тахикардия. Увеличение частоты сердечных сокращений до 120-150 ударов в минуту. Независимо от текущего положения тела, характера активности (или ее отсутствия).
- Тошнота, рвота. Временные явления. Переносятся пациентом тяжело. Возникают периодически.
- Головная боль. Интенсивность может быть самой разной. Локализация также. Сопровождается прочими неврологическими проявлениями. В том числе со стороны органов зрения.
- Мерцание мушек в глазах. Фотопсии. Ложное ощущение света в поле видимости. Результат раздражения затылочной доли мозга, ирритации коры и недостаточного кислородного обеспечения.
- Головокружение. Нарушение нормальной ориентации в пространстве, также координации движений.
- Сонливость. В течение дня. Независимо от количества часов отдыха в сутки. В ночное время возможен обратный эффект.
- Общее снижение работоспособности.
- Когнитивные нарушения. Падение качества и скорости мышления, памяти. Временное расстройство.
- Обморочные состояния. Особенно после вставания с места и перемены положения тела в пространстве.
Второй синдром в рамках диагноза — геморрагический. Сопровождается типичными признаками:
- Частые инфекционные поражения. В результате нарушения работы защитных сил организма. Регулярно возникают острые респираторные заболевания. Кроме того, повышаются риски приобретения опасных расстройств по типу ВИЧ, туберкулеза. Сопротивляемость существенно падает.
- Носовые кровотечения. В результате снижения концентрации тромбоцитов, которые ответственны за нормальную свертываемость. Повышается проницаемость капилляров, их ломкость.
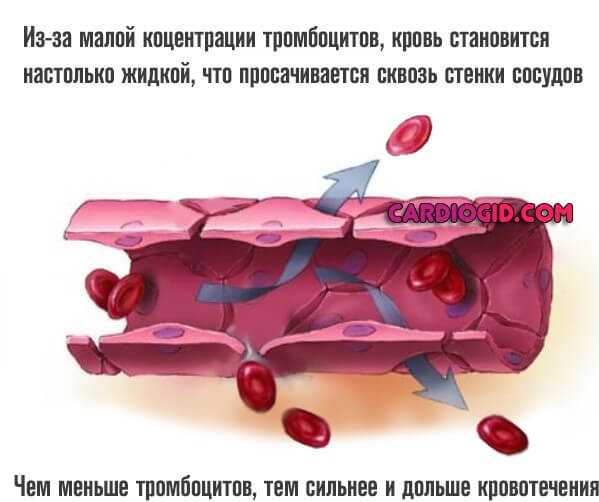
- Меноррагия. Расстройство менструального цикла. Обильные месячные возникают у каждой второй больной женщины. В том числе возможны и вне циклических изменений. Спонтанно.
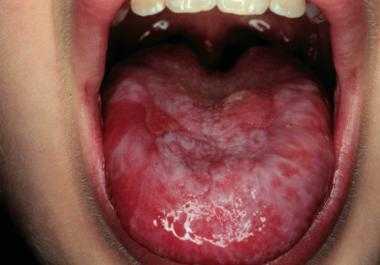
- Стоматиты. Нарушения целостности слизистых оболочек органов, полости рта, носа. Образование язв, прочих дефектов.
- Увеличение размеров селезенки. Вплоть до критического состояния с разрывом органа, массивным кровотечением и потенциальной вероятностью гибели пациента от осложнений. Сепсиса.
- Общее снижение иммунитета. Сказывается инфекционными поражениями, прочими состояниями.
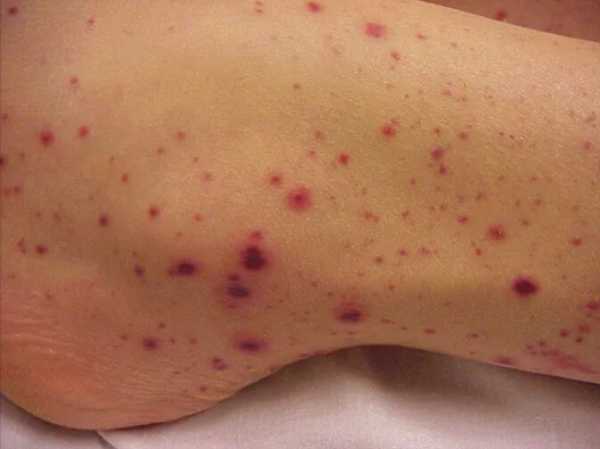
- Высыпания на коже. Петехии (небольшие красные пятна), сосудистые звезды, гематомы, синяки — характерные признаки апластической анемии. Возникают из за малой концентрации тромбоцитов в крови.
Аплазия костного мозга потенциально смертельное расстройство, симптоматика нарастает постоянно, по мере прогрессирования патологического процесса. Восстановление должно быть срочным.
Причины
Факторы становления множественны. Среди непосредственных виновников можно назвать:
- Перенесенные инфекционные расстройства. Гепатит разных видов, туберкулез, поражение герпетическими агентами.
- Применение некоторых лекарственных средств, как уже было сказано ранее.
- Облучение радиацией. В том числе при длительном воздействии небольших некритичных доз. Особенно подвержены этому расстройству работники АЭС, служащие на подлодках, прочие категории.
- Врожденные генетические аномалии.
- Доказана связь с беременностью. Однако специалисты пока не могут сказать, является ли гестация непосредственной причиной начала аномальных изменений в организме или же выступает провокатором манифестации расстройства.
- Заболевания лимфатической системы.
- Опухоли, особенно злокачественные.
Несмотря на всю эффективность диагностики, причины можно обнаружить не всегда. Примерно в 50% случаев речь идет об идиопатической разновидности анемии. Когда провокатора найти невозможно. По крайней мере, в момент выставления диагноза и его верификации.
Потребуется еще не одна неделя, а то и месяцы работы в этом направлении, динамическое наблюдение за состоянием больного.
Диагностика
Обследование представляет довольно серьезные трудности, поскольку надежных критериев пока нет, также врачи ограничены в выборе методик. Задача ложится на плечи гематолога.
Среди возможных мероприятий:
- Устный опрос больного. Нужно установить все присутствующие жалобы, чтобы составить полную клиническую картину. Это важно, поскольку позволяет выдвинуть гипотезы относительно состояния человека.
- Сбор анамнеза. Перенесенные ранее болезни, момент развития, начала симптоматических проявлений, вредные привычки, образ жизни, особенно важно установить семейную историю болезней.
- Общий анализ крови. Лабораторное исследование используется для оценки концентрации форменных клеток (эритроцитов), уровня гемоглобина, прочих показателей. Довольно информативная методика несмотря на простоту.
- Обязательно проводится исследование биохимическое. Оценке подлежат печеночные пробы, уровни специфических веществ: билирубина, щелочной фосфатазы.
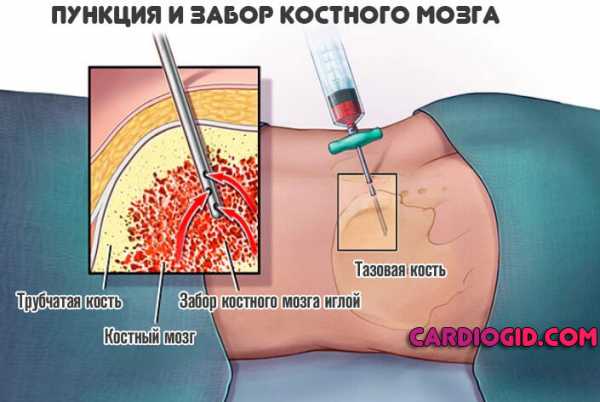
- Хорошей методикой ранней диагностики и верификации диагноза выступает пункция костного мозга для забора материала (биопсия). Используется наиболее часто в качестве крайней меры. Ввиду инвазивности (травматичности) применяется не всегда.
- Возможно назначение консультации генетика. По показаниям.
Диагностика требует терпения, хотя время на полное обследование есть не всегда. По мере дальнейшего или повторного курса возможен пересмотр изначально установленного заболевания.
Лечение
Эффективных медикаментозных методик практически нет. Основная задача — борьба с первопричиной, это может потребовать больших усилий.
Терапия в обязательном порядке проходит в стационаре. Пациента помещают в практически стерильные условия. Изолируют, чтобы не спровоцировать инфекционного поражения.
Практикуется несколько методов терапии анемии апластического типа:
- Влияние на иммунитет. Применяются препараты для коррекции работы защитных сил организма, обычно это иммуносупрессоры параллельно с гормонами.
- Переливание крови, а именно форменных клеток — тромбоцитарной и эритроцитарной массы. Мера временная, позволяющая восполнить дефицит этих телец. Переливание не делают при аутоиммунных заболеваниях.
- Возможно проведение плазмафереза. Очищения жидкой фракции крови, чтобы не провоцировать осложнения и замедлить прогрессирование патологического процесса.
Наиболее эффективный и, пожалуй, единственно действенный способ лечения апластической анемии в долгосрочной перспективе, это пересадка костного мозга. Ввиду малого количества совместимых доноров, велика вероятность длительного ожидания.
Речь идет о годах. Потому применение столь эффективной методики практикуется сравнительно редко.
На весь период лечения необходимо отказаться от курения, спиртного, прочих вредных привычек.
В целом же, устранение причины апластической анемии, ее симптомов — крупная проблема гематологии, задача восстановления решается с большим трудом.
Прогноз
Перспективы довольно туманны. Заболевание слишком серьезно для того, чтобы давать усредненные выкладки по прогнозу жизни. На вероятность выздоровления влияет группа факторов:
- Тяжесть патологического процесса, его агрессивности.
- Характер и длительность течения расстройства.
- Скорость прогрессирования.
- Семейная история.
- Возраст. Чем старше пациент, тем хуже в целом прогнозы. Хотя возможны и исключения.
- Наличие геморрагического синдрома.
- Присутствие и степень инфекционных осложнений.
Чем больше негативных факторов присутствует, тем меньше шансы на успешное восстановление.
В то же время нужно иметь в виду, что трансплантация костного мозга позволяет добиться положительного исхода почти в 90% случаев. Вопрос только в подборе донора.
Возможные осложнения
Среди последствия, с которыми встречаются пациенты:
- Выраженные массивные кровотечения. Потенциально летальные.
- Разрыв селезенки.
- Инвалидность, смертельный исход.
При остром течении прогнозы существенно хуже, меньше времени на реагирование, диагностику, помощь. Риски больше.
Угнетение костномозгового кроветворения (аплазия) провоцирует анемию, нарушение снабжения тканей организма, кислородом. Помимо этого, изменяются реологические свойства крови и присутствуют реальные угрозы смерти от осложнений.
Важно провести качественное лечение в условиях стационара. Основная проблема заключается в малом арсенале методик восстановления, курации.
Однако даже без возможности сиюминутной трансплантации есть все шансы устранения основных проявлений заболевания, поддержки организма. Это позволяет «протянуть» до подбора донора и коррекции.
Опасайтесь нарушения кроветворения
16 декабря 2013 года
Кроветворением принято называть процесс, когда образуются и созревают клетки крови. Кровяные тельца постоянно разрушаются в организме. Предполагается, что эритроциты живут около 120 суток, тромбоциты – несколько дней, лейкоциты – несколько часов. Вместо погибших появляются новые тельца. Органами кроветворения являются красный костный мозг, узлы лимфатические и селезёнка. В красном костном мозге формируются тромбоциты, зернистые лейкоциты, эритроциты. В селезёнке и лимфатических узлах происходит формирование незернистых лейкоцитов.
У всех клеток крови имеются единые клетки – гемоцитобласты. Из них путём размножения и дифференциации (созревания) происходит образование остальных клеток крови. В условиях нормального кроветворения в определённых пропорциях осуществляются все стадии созревания клеток крови. Благодаря этому обеспечиваются жизненно важные, разнообразные функции крови. Регулируются процессы кроветворения с помощью определённых химических веществ, витаминов и гормонов.
Достаточно известно о нормальном созревании эритроцитов. Этот процесс осуществляется при поступлении вместе с пищей витамина В12 и одного из гормонов почек. Данных веществ достаточно даже в ничтожном весе (стотысячная доля грамма), чтобы эритроциты нормально созревали и содержали необходимое количество переносчика кислорода – гемоглобина. В случаях кровопотери быстро восстанавливается состав крови благодаря кроветворению. Сдача донорами крови (250 мл) является совершенной безвредной процедурой. Недостаток крови восполняется быстро.
Нарушается процесс кроветворения по разным причинам. Возможно его понижение или нарушение при некоторых инфекциях (сепсис, малярия, тиф и др.) и заболеваниях. Разные яды (углерод четырёххлористый, бензол, различные красители, растворители) могут сильно угнетать кроветворение. Иногда понижение или нарушение обусловлено неполноценным питанием, в частности недостаточностью усвоения или поступления в организм витаминов, кобальта, солей железа. В костном мозге возможно преобладание молодых неполноценных клеток, которые не имеют способность созревать в эритроциты. Этот процесс приводит к возникновению пернициозной анемии.
Иногда временные нарушения функций органов кроветворения появляются при воспалительных заболеваниях, когда в кровь выходят незрелые, молодые элементы. Весьма тяжёлые нарушения процесса кроветворения могут возникнуть вследствие интенсивного воздействия на организм ионизирующей радиации, лучей рентгена. Они истощают и значительно угнетают организм, вызывают белокровие и другие системные заболевания крови.
Нарушение кроветворения обнаруживают с помощью лабораторных анализов крови, когда выявляется её формула в виде соотношения количества элементов. Для различных исследований состояния кроветворения могут использовать пункцию селезёнки и лимфатических узлов, прокол грудины для изучения костного мозга и другие методы.
Алкоголизм — это серьезное заболевание, которое требует серьезного лечения. Если ваш близкий не признает свою зависимость и отказывается от лечения, то вам необходимо лечение алкоголизма без ведома больного. На сайте centrneva.ru можно найти больше информации про такой вид лечения.
Автор: Нона Харламенкова
на Вашем сайте.
Нарушение кроветворения симптомы. Заболевания органов кроветворения
Острая лимфобластная лейкемия (острый лимфолейкоз ) – злокачественное заболевание, возникающее в результате клональной пролиферации незрелых лимфоидных клеток. Заболевание чаще развивается у детей с пиком заболеваемости от 2 до 4 лет и соотношением случаев у мальчиков и девочек 1,2:1. Клиническая картина характеризуется интоксикационным, анемическим, костно-суставным, пролиферативным и геморрагическим синдромами. Характерны неспецифические жалобы на слабость, недомогание, быструю утомляемость, снижение аппетита. Наблюдаются немотивированные подъемы температуры тела, бледность кожных покровов, что объясняется интоксикацией и анемией. Артралгия связана с остеопорозом и поднадкостничной пролиферацией опухолевого характера. Чаще беспокоят боли в области нижних конечностей и позвоночнике. Пролиферативный синдром характеризуется спленомегалией, увеличением периферических (иногда и медиастенальных) лимфоузлов, Геморрагический синдром развивается примерно в 50% случаев, характеризуется петехиями и кровоизлияниями. Обычно исследования начинаются с анализа периферической крови. При этом бласты выявляются почти всегда (в 98% случаев). Для мазка крови характерен «лейкемический провал» или лейкемическое зияние» — наличие только бластов и зрелых клеток без промежуточных стадий. Для острого лимфолейкоза характерна нормохромная анемия и тромбоцитопения. Другие признаки встречаются реже: лейкопения (20% случаев), лейкоцитоз (50%). На основании жалоб и картины крови иногда можно лишь заподозрить острый лимфолейкоз. Хронический лимфолейкоз. — Патологическое разрастаниелимфоидной ткани в костном мозге, лимфоузлах, селезенке, печени, реже в других органах. Болезнь возникает в пожилом возрасте и протекает длительно.
Симптомы и течение. Снижение веса, слабость, усталость, потеря аппетита выражены нерезко. Отмечается увеличение различных групп лимфоузлов во всех областях тела: шейных, паховых, бедренных, надключичных, локтевых. Они плотные, безболезненные, подвижные. Рентгенография обнаруживает увеличенные узлы в корнях легких. Иногда они сдавливают трахею, пищевод, полые вены. Селезенка и печень также увеличиваются. В крови повышается число лейкоцитов преимущественно за счет лимфоцитов, среди них встречаются распадающиеся лимфоциты (клетки Боткина-Гумпрехта), отмечается анемия и тромбоцитопения (снижение числа тромбоцитов).
Острая нелимфобластная лейкемия или острый миелолейкоз (острая миелоидная лейкемия) – злокачественное заболевание, возникающее в результате злокачественной транформации и нарушения дифференцировки гемопоэтических клеток на уровне миелоидных клеток-предшественниц. Острый миелолейкоз или, точнее, острая нелимфобластная лейкемия чаще всего клинически характеризуется повышением температуры, кровотечениями, увеличением размеров печени и селезенки, анемией. Несколько реже наблюдается лимфаденопатия, суставной синдром, поражение центральной нервной системы. Лабораторная диагностика опирается преимущественно на исследование красного костного мозга. Диагноз острого миелолейкоза устанавливается при наличии более 30% нелимфоидных бластных клеток. При этом прогностически благоприятным признаком является обнаружение палочек Ауэра, лейкоцитоз менее 20000, наличие более 3% атипичных эозинофилов.
Хронический миелолейкоз — характеризуется нарушением нормального созревания гранулоцитарных лейкоцитов, появлением очагов внекостно-мозгового кроветворения. Болезнь может протекать длительно с большими периодами ремиссии после курсов лечения.
Симптомы и течение.
Больные жалуются на повышенную утомляемость, слабость, плохой аппетит, снижение веса. Увеличивается селезенка, печень, возможны геморрагические проявления. В крови значительно увеличивается количество лейкоцитов, анемия. Нередко повышается уровень мочевой кислоты в сыворотке крови. На поздней стадии болезни снижается число тромбоцит
Кроветворение - это... Что такое Кроветворение?
гемопоэз (от греч. háima — кровь и póiēsis — изготовление, сотворение), процесс образования, развития и созревания клеток крови у животных и человека. Форменные элементы крови — высокоспециализированные клетки с коротким жизненным циклом: у эритроцитов (См. Эритроциты) человека он длится около 120 суток, у лейкоцитов (См. Лейкоциты) — около 5 суток, у лимфоцитов (См. Лимфоциты) — от нескольких дней до нескольких месяцев, у тромбоцитов (См. Тромбоциты) — около 4 суток. Несмотря на непрерывное разрушение клеток крови, количество их в течение жизни организма сохраняется более или менее постоянным, т. к. гибнущие клетки заменяются новыми. К. у беспозвоночных животных осуществляется в основном в полостных жидкостях и в самой крови. У взрослых млекопитающих и человека К. происходит в кроветворных органах (См. Кроветворные органы): образование эритроцитов, зернистых лейкоцитов и тромбоцитов — в костном мозге; лимфоцитов — в лимфатических узлах, селезёнке, зобной железе, костном мозге; Моноциты и Макрофаги также образуются из клеток костного мозга. Все зрелые клетки крови, несмотря на различия между ними, происходят, по-видимому, из единых родоначальных (стволовых) кроветворных клеток. Линия таких родоначальных клеток поддерживается в организме в течение всей его жизни, что обеспечивает непрерывность К. При созревании (дифференцировке (См. Дифференцировка)) кроветворные клетки подвергаются сложным изменениям и делятся ещё несколько раз. Т. о., из небольшого числа родоначальных клеток образуется большое число специализированных форменных элементов крови. К. подчиняется сложной регуляции, чем обеспечивается изменение количества и качества кровяных клеток в соответствии с потребностями организма (например, при изменении содержания кислорода в воздухе), а также восстановление их числа при потерях крови. Эта регуляция осуществляется рядом гормонов, витаминов (например, цианкобаламин — B12, фолиевая кислота — Вс), а также особыми веществами — Эритропоэтинами, к которым чувствительны различные стадии процесса К. Механизмы, регулирующие темпы размножения и созревания отдельных категорий кроветворных клеток, остаются ещё во многом неизвестными.У зародышей млекопитающих животных и человека К. начинается в желточном мешке, где первые кроветворные клетки возникают из клеток мезенхимы; затем очаги кроветворной ткани формируются в мезенхиме тела, а позже — в печени зародышей (здесь образуются эритроциты и лейкоциты) и в зобной железе (здесь образуются лимфоциты). На более поздних стадиях развития процесс К. перемещается в костный мозг, а лимфоциты начинают развиваться не только в зобной железе, но и в селезёнке и лимфатических узлах.
Лит.: Заварзин А. А., Избр. тр.; т. 4 — Очерки эволюционной гистологии крови и соединительной ткани, М.— Л., 1953; Физиология системы крови, Л., 1968; Черниговский В. Н., Шехтер С. Ю., Ярошевский А. Я., Регуляция эритропоэза, Л., 1967; Экспериментальные исследования механизмов гемопоэза, [Сб. ст.], Свердловск, 1971; Hematopoietic cellular proliferation, ed. F. Stohiman, N. Y., 1970; Regulation of hematopoiesis, ed. A. S. Gordon, V. I—2, Appleton, 1970.
А. Я. Фриденштейн.
Нарушения кроветворения лежат в основе патогенеза (механизма развития патологического процесса) болезней системы крови. Нарушения К. могут возникнуть под влиянием внешних (физических, химических, инфекционных и др.) и внутренних (гормональных, обменных, врождённых, наследственных и др.) факторов; при ряде заболеваний системы крови причины этих нарушений пока не установлены.
В зависимости от характера повреждения кроветворных органов нарушения К. определяют как гиперпластические (с избыточным образованием элементов кроветворной ткани) и гипо- и апластические (с подавлением К., нарушением деления и в меньшей степени — созревания кроветворных клеток). Определяющим в характеристике заболевания является также категория поражаемых клеток и степень их зрелости (малодифференцированные, различной степени зрелости клетки, элементы грануло-, эритро-, тромбоцито-, лимфопоэза).
Гиперпластические состояния кроветворения наиболее выражены при Лейкозах и эритремии. Клетки костного мозга при лейкозах утрачивают способность дифференцироваться (созревать), а пролиферация (размножение) у них может быть замедлена. Продолжительность жизни в организме этих незрелых элементов увеличивается, в результате чего в кроветворных органах и крови накапливается огромное количество клеток различных клеточных линий и различной степени зрелости, что и определяет форму лейкоза (острый, хронический, миело-, лимфолейкоз и др.).Кариологическими (от греч. kărgon — ядро) исследованиями при некоторых формах лейкоза обнаружены изменения в хромосомах кроветворных клеток, что свидетельствует о наследственном характере нарушений К.
При гипо- и апластических состояниях поражаются либо родоначальные кроветворные клетки, либо наиболее ранние клеточные формы эритро-, грануло- и тромбоцитопоэза. Выражением этих нарушений наряду с обеднённостью костного мозга кроветворными клетками является уменьшение в крови числа эритроцитов (и, следовательно, количества гемоглобина), лейкоцитов (гранулоцитов), тромбоцитов (гипо- и апластической анемии, агранулоцитозы, метастазы опухолей в костный мозг и др.).
При недостатке в организме некоторых витаминов, микроэлементов, ферментов и др. нарушения К. приобретают своеобразный характер. Так, при дефиците в организме витамина B12 и фолиевой кислоты нарушается нормальное образование эритроцитов и в костном мозге обнаруживаются клетки, характерные для эмбрионального кроветворения в печени (В12- и фолиеводефицитные анемии). При дефиците железа в эритроцитах содержится мало гемоглобина и, хотя общее количество эритроцитообразующих клеток в костном мозге и эритроцитов в крови может быть нормальным, развивается железодефицитная Анемия. При нарушениях структуры гемоглобина (см. Гемоглобинопатии), отсутствии или недостатке в эритроцитах некоторых ферментов (энзимопатии) и др. факторов эритроциты становятся неполноценными и быстро разрушаются либо в кровеносном русле, либо преимущественно в селезёнке (гемолитической анемии). В костном мозге и периферической крови в этих случаях обнаруживается значительное количество молодых клеток (нормобластов, ретикулоцитов) эритроцитарного ряда. Нарушения К., протекающие с поражением преимущественно лимфопоэза, приводят к нарушению Иммунитета и некоторым белковым изменениям крови. От истинных нарушений К. гиперпластического типа следует отличать реактивные его состояния, т. н. лейкемоидные реакции. Их возникновению способствуют различные инфекции, интоксикации и др. При устранении основной причины, вызвавшей реактивные состояния К., наступает фаза нормализации К.Лит.: Файнштейн Ф. Э., Апластические и гипопластические анемии, М., 1965; Кассирский И. А., Алексеев Г. А., Клиническая гематология, 4 изд., М., 1970; Поликар А., Бесси М., Элементы патологии клетки, пер. с франц., М., 1970.
А. М. Полянская.
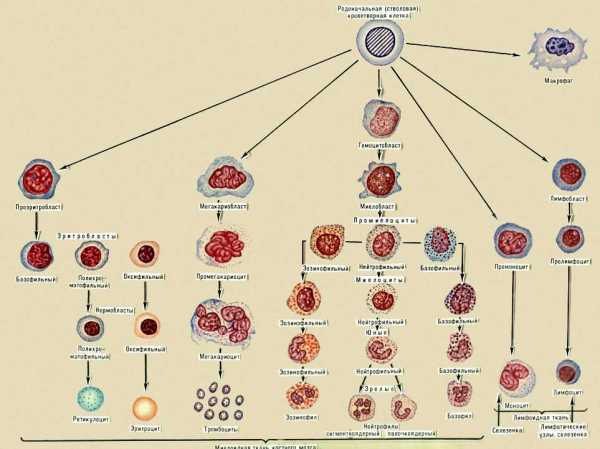
Схема развития кровяных клеток.