Вэб что это такое в медицине
Клинические формы вирусной инфекции Эпштейна — Барр | Понежева Ж.Б., Гришаева А.А., Попова Т.И.
В статье приведены современные представления об особенностях иммунопатогенеза, диагностики и терапии вирусной инфекции Эпштейна — Барр в зависимости от фазы заболевания и клинических форм. Представлены клинические примеры острой и хронической инфекции

Актуальность
Одной из актуальных проблем современной медицины является высокая заболеваемость герпесвирусными инфекциями, которые достаточно широко распространены в человеческой популяции. Сложная по сравнению с другими ДНК-содержащими вирусами структура генома вирусов семейства герпеса обусловливает основные различия в их репликативном цикле. Гены, кодирующие структурные белки, составляют у герпесвирусов всего лишь 15% ДНК, большую же часть генома составляют участки, ответственные за синтез регуляторных протеинов и ферментов, и именно эта особенность позволяет им реализовывать совершенно уникальную программу, включающую возможность латентного, персистентного и реактивированного состояния в инфицированном организме [1].
Особое место среди герпесвирусов занимает Эпштейна — Барр вирус (ЭБВ), которым инфицировано 95% населения и, как и все герпесвирусы, он способен поражать практически все органы и системы организма, вызывая латентную, острую и хроническую формы инфекции, склонные к реактивации в условиях иммуносупрессии. Активная пролиферация вируса во всех органах и системах, имеющих лимфоидную ткань, приводит к структурным изменениям, оказывающим неблагоприятное воздействие на организм в целом. Доказана ключевая роль ЭБВ в развитии таких заболеваний, как острый, хронический мононуклеоз, интерстициальный пневмонит, миокардит, гепатит, опухоли лимфоидной и эпителиальной тканей, гемофагоцитарный лимфогистиоцитоз, лейкоплакия языка и посттрансплантационные лимфопролиферативные осложнения.
Проявления ЭБВИ
Наиболее известным и изученным проявлением Эпштейна — Барр вирусной инфекции (ЭБВИ) является инфекционный мононуклеоз (ИМ). В настоящее время неясны иммунопатологические основы индивидуальных различий течения ИМ и его исходов. Клинические проявления, диагностика и лечение ИМ представлены в таблице 1.

Метаанализ 5 рандомизированных плацебо-контролируемых испытаний с участием 339 больных показал отсутствие эффекта от ацикловира у больных ИМ ЭБВ этиологии [5].
ЭБВ обладает множественными механизмами иммуносупрессии и ускользания от иммунного ответа в организме человека, что может приводить к формированию хронической ЭБВИ (ХЭБВИ) [6], в ходе которой иммунологические нарушения усугубляются, подавляется продукция интерферонов, блокируются механизмы апоптоза, что формирует вторичный иммунодефицит, способствующий развитию аутоиммунных и опухолевых процессов у генетически предрасположенных лиц.
Клинические формы ХЭБВИ представлены в таблице 2.

Накоплено немало данных об этиологической роли ЭБВ в формировании синдрома хронической усталости, развитии системных васкулитов, специфического колита, имеются данные о триггерной роли ЭБВ в развитии рассеянного склероза и системной красной волчанки [15, 16].
Описаны такие кожные проявления ХЭБВИ, как гиперчувствительность к укусам комаров и световая оспа (Hydroa vacciniforme, HV) (см. табл. 2). Световая оспа — заболевание, характеризующееся развитием поэтапной полиморфной некротической сыпи на участках кожи, подверженных солнечному облучению. Заболевание зачастую носит семейный характер, однако у ряда пациентов при гистохимическом анализе поражений кожи имеет место инфильтрация Т-клетками, экспрессирующими малую РНК, кодируемую ЭБВ. Совпадение наличия ХЭБВИ и световой оспы (HV) может перерасти в развитие злокачественной лимфомы, которая была включена в классификацию ВОЗ 2008 г. как HV-подобная лимфома [14].
Активная ЭБВИ (см. табл. 2) может служить триггером для развития идиопатической тромбоцитопенической пурпуры [17] — аутоиммунного гематологического заболевания, в основе которого лежит тромбоцитопения с развитием геморрагического синдрома. Характерными признаками данного заболевания являются множественные, полиморфные кровоизлияния в кожный покров и слизистые оболочки, а также кровотечения различной локализации (нос, десны и др.).
Гемофагоцитарный лимфогистиоцитоз (ГЛГ) — одно из наиболее опасных, жизнеугрожающих осложнений ЭБВИ, основными симптомами которого являются: лихорадка, рефрактерная к антимикробной терапии, геморрагический и отечный синдромы, желтуха, экзантема, гепатоспленомегалия, симптомы поражения центральной нервной системы (возбудимость, угнетение сознания, судороги, менингеальные знаки) [18]. Развитие ГЛГ сопряжено с расстройством иммунной регуляции в результате бесконтрольной активации и пролиферации макрофагов и Т-клеток, что проявляется избыточной продукцией цитокинов, воспалением и повреждением тканей. Выделяют первичный ГЛГ, характеризующийся наличием семейного анамнеза и определенного генетического дефекта, и вторичный ГЛГ, ассоциированный с инфекцией, аутоиммунными и онкологическими заболеваниями, а также иммунодефицитным состоянием [19].
Доказана ключевая роль ЭБВ в развитии лимфопролиферативных заболеваний. Одной из ключевых лимфом, ассоциированных с ВЭБ, считается лимфома Беркитта [20]. Клиническими проявлениями лимфом служат увеличение лимфатических узлов, спленомегалия, цитопения, лихорадка. Считается, что наличие латентной ЭБВИ в эпителии носоглотки является ранней стадией патогенеза недифференцированной назофарингеальной карциномы [21].
Критерии и методы диагностики ЭБВИ
Диагностика ЭБВИ сложна и не всегда возможна в рутинной практике клинициста. Критериями диагностики ИМ ЭБВ-этиологии являются клинико-лабораторные данные (см. табл. 1). При этом оценка результатов серологического обследования имеет некоторые особенности. Так, не всегда первоначальная продукция IgM к VCA предшествует выработке антител класса IgG к VCA, возможно одновременное появление или полное отсутствие их выработки при иммуносупрессии у пациента с ЭБВИ. Может наблюдаться длительная (более 3–4 мес.) персистенция IgM к VCA (паст-инфекция). Наличие IgG к ранним антигенам (EA) не всегда свидетельствует о ранней стадии инфекции, они могут выявляться у 70% больных острым ИМ и у большинства здоровых доноров, а также при реактивации ЭБВИ [22, 23].
Методом ПЦР определяют ДНК ЭБВ в крови или другом биологическом материале (слюна, мазки из ротоглотки), а при необходимости и в биоптатах печени, лимфоузлов, слизистой кишечника и т. д.), но качественный анализ не позволяет в клинической практике отличить здоровое носительство от активной репликации вируса. В связи с этим некоторые исследователи указывают на необходимость использования количественного варианта ПЦР [3, 22, 23], при этом определение в пробе 10 копий ДНК ЭБВ (1000 ГЭ/мл в 1 мл образца) характеризуется как здоровое носительство, а выявление 100 и более копий (10000 ГЭ/мл в 1 мл образца) указывает на активную фазу ЭБВИ.
Критериями диагностики ХЭБВИ являются признаки инфицирования более 6 мес.: лихорадка, лимфаденопатия и спленомегалия (мононуклеозоподобный синдром), выраженное повышение титров антител к антигену вирусного капсида ЭБВ (VCA ≥ 1:5120) или ранним антигенам (EA ≥1:640), обнаружение ДНК ЭБВ в крови, ДНК, мРНК или белков вируса в пораженных тканях в отсутствие другой причины иммуносупрессии [23, 24]. Важно помнить о возможном отсутствии IgM при нарастании титров IgG к вирусным белкам.
Дополнительную информацию о течении инфекции можно получить с помощью иммуноблота. Иммуноблоттинг — это высокоспецифичный и высокочувствительный референтный метод, с помощью которого определяют широкий спектр вирусспецифических белков (р125, р65, р42, р41, р40, p33, р22), характеризующих определенную фазу заболевания. Так, выявление белка VCA 125 указывает на раннюю фазу инфекции; о поздней фазе течения инфекции свидетельствует обнаружение VCA 22, который выявляется одиночно или совместно с EBNA 1 (p-79), он длительно присутствует у перенесших заболевание и убедительно свидетельствует о перенесенной инфекции. Отмечается частое присутствие IgM p-45 и IgM p-79 при активном процессе [3]. Но, к сожалению, эти методы не совсем доступны в амбулаторной практике.
Таким образом, для постановки диагноза ЭБВИ, особенно ХЭБВИ, помимо проведения общеклинического обследования, необходимы серологические исследования специфических противовирусных антител, количественное определение ДНК вируса в различном биологическом материале и определение индекса авидности в динамике.
Принципы лечения ЭБВИ
Лечение любой формы ЭБВИ, а особенно ХЭБВИ, составляет большую проблему для современной медицины. До настоящего времени нет четких критериев, позволяющих прогнозировать исход первичного инфицирования ЭБВ, также нет патогенетически обоснованной схемы лечения больных ЭБВИ, а данные отечественных исследователей об эффективности терапии не имеют достаточной доказательной базы и все указания носят рекомендательный характер [1, 24–26].
Ведущее место среди этиотропных препаратов в терапии герпесвирусных инфекций занимают ациклические аналоги гуанозина (уровень доказательности А), препараты интерферонов и иммуноглобулинов, которые являются важной дополнительной составляющей лечения (уровень доказательности В). Чувствительность различных герпесвирусов к ацикловиру можно расположить в порядке убывания следующим образом: ВПГ-1, ВПГ-2, ВГ-3 > ЭБВ, ЦМВ-5 > ВГЧ-6, ВГЧ-7, ВГЧ-8.
Доказательная база свидетельствует, что ацикловир наиболее эффективен при инфекциях, вызванных альфа-герпесвирусами (ВПГ-1, 2, ВГ-3), имеет ограниченную эффективность при ЭБВИ и назначается только в случаях тяжелого ИМ с высокой вирусной нагрузкой. Однако он практически неэффективен при инфекциях, вызванных ВГЧ-6, 7, 8. Различная чувствительность к ацикловиру обусловлена разным содержанием вирусной тимидинкиназы у герпесвирусов. В отличие от ацикловира, к валацикловиру чувствительны все вирусы герпеса и наиболее высокая чувствительность — у альфа-подсемейства [26].
Лечение больных ИМ проводят в амбулаторных условиях, госпитализируют лиц с длительной лихорадкой, выраженным синдромом интоксикации, тяжелым тонзиллитом, гепатитом, желтухой, анемией, обструкцией дыхательных путей и при развитии осложнений [24, 26]. Базисная терапия ИМ (см. табл. 1) включает охранительный режим, симптоматическую терапию: адекватную регидратацию (обильное питье), полоскание горла антисептиками и по необходимости жаропонижающие средства. Применение антибиотиков необходимо только в случаях наслоения бактериальной инфекции с явлениями лакунарной или некротической ангины, при этом препаратами выбора будут цефалоспорины 2–3-го поколения, макролиды, карбапенемы [1, 26].
Противовирусные препараты неэффективны при латентном течении ХЭБВИ [25, 26], т. к. они ингибируют ДНК-полимеразу и репликацию литической фазы вируса в инфицированных клетках, которые экспрессируют вирусную ДНК-полимеразу. При ХЭБВИ в инфицированных клетках вирус находится в латентной фазе, экспрессируя латентные белки, для синтеза которых не требуется ДНК-полимераза [2, 23, 27].
По поводу назначения глюкокортикостероидов (ГКС) мнения также расходятся. Они рекомендуются больным с тяжелым течением ИМ, обструкцией дыхательных путей, неврологическими гематологическими осложнениями (тяжелая тромбоцитопения, гемолитическая анемия) [27, 28]. При латентной ЭБВИ ГКС приводят к реактивации инфекции с литической репликацией ЭБВ через индуцирование раннего гена BZLF1 и литического трансактивирующего белка ZEBRA. Интересными представляются исследования по применению моноклональных антител к СD20 (ритуксимаб) у пациентов с иммунной тромбоцитопенической пурпурой [26]. Иммуносупрессивные препараты дают кратковременный положительный эффект в виде уменьшения симптомов ХЭБВИ без долгосрочной ремиссии и могут быть назначены при начальной фазе гемофагоцитарного лимфогистиоцитоза, который часто осложняет ХЭБВИ [18, 19]. Положительные результаты в лечении ХЭБВИ достигнуты при применении трансплантации гемопоэтических стволовых клеток. Начинать данную терапию рекомендовано в начале заболевания ввиду ее тяжелой переносимости [27, 28].
На основании изучения фармакодинамики и собственного обширного клинического опыта многие исследователи считают препараты α-интерферонов (уровень доказательности D) средством выбора в лечении тяжелых форм ЭБВИ и при нейроинфекциях как дополнение к специфическим препаратам, особенно показаны детям первых 3 лет жизни и подросткам. Эти препараты тормозят репликацию вирусов за счет разрушения вирусной мРНК, модулируют иммунный ответ, стимулируют выработку цитокинов, повышают функциональную активность макрофагов, нейтрофилов и стабилизируют клеточные мембраны. Так, в многочисленных работах [28–33] показана эффективность α-интерферона при инфекционном мононуклеозе у детей по сравнению с контрольной группой, при активации хронического мононуклеоза с интермиттирующей лихорадкой, цитопенией, дисфункцией печени, гепатоспленомегалией, аномальными титрами специфических антител и положительным геномом вируса у больного ХЭБВИ, при посттрансплантационном лимфопролиферативном синдроме, ассоциированном с ВЭБ, а также у больных ХЭБВИ при общем вариабельном иммунодефиците.
Препараты β-интерферонов снижают проницаемость гематоэнцефалического барьера и могут иметь определенные преимущества при рассеянном склерозе, ассоциированном с ЭБВ, с ремиттирующим течением, но доказательная база у таких препаратов значительно меньше, чем у α-интерферонов [32, 33].
Есть несколько исследований, указывающих на эффективность препаратов рекомбинантного γ-интерферона при ЭБВИ, которые оказывают ограниченное прямое противовирусное воздействие. Их клинический эффект опосредован усилением клеточного иммунитета, контролирующего эндогенный вирус. Терапевтический эффект этой группы препаратов продемонстрировали при тяжелой активной ХЭБВИ [34–38], рецидивирующей назофарингеальной карциноме, тяжелом лимфопролиферативном синдроме, вызванном ЭБВ. Учитывая синергическое действие, их можно применять как дополнение к терапии α-интерферонами [35, 37]. Показано, что противовирусный и иммуномодулирующий эффекты α-интерферонов частично опосредованы вторичной индукцией синтеза γ-интерферона Т-лимфоцитами [23, 36, 37]. Индукторы интерферонов имеют низкую доказательную базу при ЭБВИ, несмотря на широкое применение в клинической практике в странах постсоветского пространства.
Ряд авторов рекомендуют комплексную терапию ЭБВИ с введением препаратов иммуноглобулинов класса G. В отличие от интерферонов препараты иммуноглобулинов действуют преимущественно на внеклеточный вирус в виде вирионов. Этиотропный эффект иммуноглобулинов выражается в вируцидном и вирустатическом действии препарата и развитии антителозависимой комплемент-опосредованной цитотоксичности. Убедительно доказана их эффективность при первичной или вторичной гипоиммуноглобулинемии, а также в качестве базисной терапии при аутоиммунных осложнениях (синдром Гийена — Барре, тромбоцитопеническая пурпура, синдром Кавасаки, хроническая демиелинизирующая полинейропатия и системная красная волчанка) [36, 37]. В контролируемом нерандомизированном исследовании продемонстрирована эффективность комбинированной иммунотерапии при ЭБВИ, проявляющейся гипертрофией лимфоидных органов лимфоглоточного кольца, при реактивированной ЭБВИ с различными органными поражениями и при трудно поддающихся лечению формах болезни [37, 39], а также в профилактике виремии при ХЭБВИ. Многие исследователи [26, 38, 39] считают целесообразным применение специфического иммуноглобулина в комплексной терапии для профилактики ЭБВ-ассоциированного лимфопролиферативного синдрома у реципиентов солидных органов, при гемофагоцитарном синдроме, ассоциированном с ЭБВ, указывая на необходимость дальнейших исследований. Некоторым пациентам необходимо хирургическое лечение: удаление селезенки иногда выполняют при ИМ ЭБВ-этиологии при угрозе разрыва или начавшемся внутреннем кровотечении; возможна трахеостомия у больных с тяжелым ИМ при наличии фарингеальной обструкции и асфиксии.
В клинической практике диагностика и ведение пациентов с ЭБВИ всегда сложны и неодназначны. Приводим два клинических случая.
Клинические наблюдения
Случай 1. Пациентка Ю., 26 лет, доставлена в инфекционную клиническую больницу № 2 (ИКБ № 2) с жалобами на повышение температуры тела, слабость, появление одышки, ощущение сердцебиения при физической нагрузке.
Из анамнеза известно, что заболела 15 дней назад, когда появились повышение температуры тела до 39,0 °С, боль в горле, слабость, возникновение одышки при физической нагрузке. В последующие дни сохранялась повышенная температура тела, появились тяжесть в правом подреберье, потемнение мочи. Обследована амбулаторно: в клиническом анализе крови обнаружены лимфомоноцитоз, атипичные мононуклеары, снижение уровня гемоглобина до 73 г/л. Была госпитализирована в ИКБ № 2 с диагнозом: «Инфекционный мононуклеоз. Анемия тяжелой степени».
При поступлении состояние пациентки средней тяжести. Температура тела 38,0 °С. Выраженная слабость. Кожные покровы бледные, сыпи, геморрагий, кровоточивости нет. Склеры инъецированы, отмечается краевая иктеричность. Слизистая ротоглотки слабо гиперемирована, миндалины увеличены до II степени, имеются гнойные наложения в лакунах. Пальпируются подчелюстные, шейные до 1–1,5 см лимфатические узлы, плотные, безболезненные. Дыхание через нос свободное. Выделений из носа нет. В легких дыхание ослабленное. Хрипы не выслушиваются. ЧДД 20 в минуту. Тоны сердца приглушены, ритмичные. На верхушке сердца выслушивается систолический шум. ЧСС 80 в минуту. АД 110/70 мм рт. ст. Язык влажный, обложен белым налетом Живот при пальпации мягкий, чувствительный в правом подреберье. Перистальтика выслушивается. Перитонеальных знаков нет. Печень выступает из-под края реберной дуги на 4 см, плотная, чувствительная при пальпации. Пальпируется увеличенная селезенка, плотная, безболезненная. Симптом поколачивания по поясничной области отрицательный с обеих сторон. Физиологические отправления не нарушены. Очаговых и менингеальных знаков нет. Больной назначена терапия цефтриаксоном 2,0 г × 2 р./сут внутривенно, полоскание ротоглотки раствором фурациллина, внутривенно дезинтоксикационная терапия 5% раствором глюкозы с аскорбиновой кислотой, инъекции диклофенака при повышении температуры.
При обследовании: в общем анализе крови отмечается снижение количества эритроцитов до 1,96×1012/л, гемоглобина до 64 г/л, лейкоцитоз 17,5×109/л, лимфоцитоз 82%, среди лимфоцитов обнаружено 18 атипичных мононуклеаров. В биохимическом анализе крови отмечается умеренное повышение печеночных трансаминаз (АЛТ 106,3 ЕД/л; АСТ 165,4 ЕД/л). Содержание сывороточного железа в норме. При ПЦР-исследовании крови обнаружена ДНК ЭБВ, в реакции ИФА на антитела к VCA — IgМ положительные, IgG отрицательные.
Выполнено УЗИ органов брюшной полости: выявлены диффузные изменения в паренхиме печени и паренхиме поджелудочной железы, значительное увеличение и диффузные изменения в паренхиме селезенки.
Больная консультирована гематологом, заключение: картина крови соответствует лейкемоидной реакции по лимфоцитарному типу на фоне инфекционного мононуклеоза ЭБВ-этиологии. Рекомендована терапия эпоэтином бета, фолиевой кислотой, витамином В12. Больной выполнена 1 инъекция эпоэтина бета (2 тыс. Ед подкожно), далее ввиду возникновения у пациентки выраженного болевого синдрома и категорического отказа пациентки инъекции прекращены.
На 11-й день пребывания пациентки в стационаре отсутствует положительная динамика от проводимого лечения: в общем анализе крови сохраняется снижение эритроцитов до 1,84×1012/л, гемоглобина до 62 г/л, в биохимическом анализе крови отмечается повышенный уровень печеночных трансаминаз (АЛТ 110,4 ЕД/л; АСТ 160,1 ЕД/л). Больной назначена терапия ганцикловиром по 250 мг 2 р./сут внутривенно.
На 17-й день пребывания в стационаре пациентка пожаловалась на появление болей в животе, в связи с чем выполнено повторное УЗИ органов брюшной полости, выявлена зона инфаркта селезенки небольших размеров в нижнем полюсе. Больная консультирована хирургом, рекомендовано наблюдение в динамике.
В дальнейшем на фоне проводимой терапии отмечается положительная динамика в виде нормализации температуры тела, регресса явлений тонзиллита. В общем анализе крови обращает на себя внимание повышение гемоглобина до 96 г/л, эритроцитов до 3,01×1012/л, нормализация уровня лейкоцитов.
На 21-й день госпитализации больная выписана под наблюдение инфекциониста и гематолога по месту жительства.
Случай 2. Пациент Ж., 25 лет, поступил в ИКБ № 2 с жалобами на повышение температуры тела до 37,7 °С, сухой кашель.
Из анамнеза известно, что заболел 10.03.2019: слабость, головокружение, повышение температуры тела до фебрильных цифр. 11.03.2019: повышение температуры тела до 38,5 °С. Лечился самостоятельно: принимал тилорон, азитромицин без эффекта. 14.03.2019: осмотрен терапевтом на дому, выставлен диагноз ОРВИ, назначен осельтамивир. 15.03.2019: симптомы сохранялись, появился однократный жидкий стул без патологических примесей, насморк, сухой кашель. 19.03.2019 обследован амбулаторно: выполнена обзорная рентгенография грудной клетки — без патологических изменений, в общем анализе крови отмечается небольшой лейкоцитоз (11×109/л), остальные показатели в норме. Назначен левофлоксацин без эффекта. 21.03.2019 госпитализирован в ИКБ № 2 службой скорой помощи с диагнозом «лихорадка неясной этиологии».
При осмотре состояние пациента средней степени тяжести. Температура тела 37,7 °С. Кожные покровы физиологической окраски, умеренной влажности, сыпи нет. Слизистая ротоглотки гиперемирована, фолликулы на задней стенке глотки, миндалины не увеличены, свободны от наложений. При пальпации: периферические лимфатические узлы не увеличены. Периферических отеков нет. Дыхание через нос свободное. Выделений из носа нет. В легких дыхание жесткое, проводится во все отделы, хрипы не выслушиваются, ЧДД 18 в минуту. Тоны сердца ясные, ритмичные, ЧСС 78 в минуту, АД 100/60 мм рт. ст. Живот при пальпации мягкий, безболезненный во всех отделах. Перистальтика активна. Перитонеальных знаков нет. Печень выступает из-под края реберной дуги на 2 см, селезенка не увеличена, безболезненны. Симптом поколачивания по поясничной области сомнителен с обеих сторон. Со слов больного, стул оформлен, обесцвечен. Мочеиспускание не нарушено. Моча темная. Очаговых и менингеальных знаков нет.
При обследовании: в общем анализе крови отмечается лейкоцитоз 10×109/л, лимфоцитоз 74%, среди лимфоцитов обнаружено 17 атипичных мононуклеаров, остальные показатели в норме. В биохимическом анализе крови отмечается умеренное повышение печеночных трансаминаз (АЛТ 61 ЕД/л; АСТ 60,4 ЕД/л). В ПЦР-исследовании крови и мазка из ротоглотки ДНК ВЭБ не обнаружена, при ИФА на антитела к VCA — реакция на IgМ и IgG положительная.
По данным УЗИ органов брюшной полости и почек отмечаются увеличение и диффузные изменения в паренхиме печени, увеличение и диффузные изменения в паренхиме селезенки, умеренные диффузные изменения в паренхиме почек.
Назначен цефотаксим по 2 г 2 р./сут внутримышечно, полоскание ротоглотки раствором хлоргексидина, цетиризин, комплекс лактобактерий ацидофильных и кефирных грибков. На 3-й день пребывания в стационаре в связи с сохраняющейся лихорадкой произведена замена антимикробной терапии на ципрофлоксацин 400 мг 2 р./сут внутривенно.
На 5-й день пребывания больного в стационаре отмечена положительная динамика в виде исчезновения лихорадки, и на 9-й день больной выписан из стационара под наблюдение врача-инфекциониста по месту жительства.
Заключение
Важность проблемы изучения ЭБВИ обусловлена высокой распространенностью, специфической тропностью возбудителя к иммунокомпетентным клеткам, трудностями ранней и дифференциальной диагностики, особенностями клинического течения инфекции, отсутствием специфической профилактики и эффективной этиотропной терапии.
Учитывая разнообразие клинических форм ЭБВИ, высокий риск онкопатологии, формирование иммунодефицитов различной степени выраженности, в генезе которых ЭБВ играет ключевую роль, особое значение следует придавать своевременной диагностике и адекватной тактике ведения, т. к. они определяют исход заболевания. Необходимо более детальное и углубленное изучение иммунопатогенеза различных стадий ЭБВИ для определения критериев прогноза течения заболевания, выявления иммунологических нарушений и иммуногенетических факторов предрасположенности к ЭБВ-ассоциированным осложнениям, а также для оптимизации терапии.
Лечение больных с любой формой ЭБВИ должно быть комплексным, с учетом клинических проявлений, тяжести течения, периода болезни, что на практике бывает крайне трудно реализовать. Залогом же успешного лечения ХЭБВИ являются своевременная диагностика, правильный и строго индивидуальный подход как к этиотропной, так и к патогенетической терапии с последующим персонифицированным ведением конкретного больного на всех этапах (стационар, поликлиника). Необходимо наблюдение у инфекциониста, гематолога, иммунолога.
вирус Эпштейна Барра у детей: что это такое, симптомы, лечение
Самые распространенные среди детей заболевания — вирусные. Причина в том, что иммунитет ребенка еще недостаточно крепкий, незрелый, и ему не всегда бывает легко противостоять многочисленным угрозам извне. Но если о гриппе и ветрянке сказано и написано много, да и с корью мамам все более-менее понятно, то есть в этом мире вирусы, одни названия которых нагоняют на родителей священный ужас.
Один из таких малоизученных и очень часто встречающихся — вирус Эпштейна-Барр. О нем довольно часто спрашивают известного педиатра и телеведущего Евгения Комаровского.

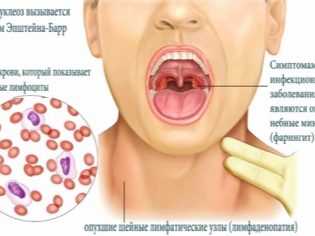
Что это такое
ВЭБ — вирус Эпштейна Барр. Один из самых распространенных вирусов на планете. Впервые был найден в образцах опухолей и описан в 1964 году английским профессором Майклом Эпштейном и его ассистенткой Ивонной Барр. Это вирус герпеса четвертого типа.
По медицинской статистике, следы перенесенной инфекции обнаруживаются в анализах крови половины детей в возрасте 5-6 лет и у 97% взрослых, причем сами они об этом зачастую даже не догадываются, ведь у большинства людей ВЭБ протекает незаметно, без симптомов.
Самая излюбленная среда обитания вируса — лимфоциты, таким образом он поражает иммунную систему ребенка. Чаще всего эта микроскопическая частица-паразит вызывает цитомегаловирус, инфекционный мононуклеоз, лимфогранулематоз, гепатит, герпес, лимфому Беркитта и ряд других малоприятных диагнозов. Вакцины от этого недуга еще не изобретено, так как на разных стадиях своего развития вирус кардинально меняет свой белковый состав и лучшие ученые умы за ним просто не успевают.

Заразиться ребенок может разными путями. Наиболее часто — ВЭБ выделяется наружу с биологическими жидкостями, обычно — со слюной. По этой причине вызываемый вирусом инфекционный мононуклеоз называют «поцелуйной болезнью».
Инфицирование может произойти во время переливания крови и ее компонентов, через общие с больным вещи и игрушки, а также вирус передается от зараженной матери через плаценту плоду во время беременности. ВЭБ легко распространяется воздушно-капельным путем, а также от донора к реципиенту во время трансплантации костного мозга.


В группе риска — дети до года, которые активно познают окружающий мир через рот, пытаясь попробовать на зуб абсолютно все попавшиеся им под руку предметы и вещи. Еще один «проблемный» возраст — дети от 3 до 6 лет, которые регулярно посещают детский сад и имеют многочисленные контакты.
Инкубационный период -от 1 до 2 месяцев, после чего у детей развиваются яркие симптомы, свойственные многим вирусным инфекциям.
Впрочем, не так страшен сам вирус со сложным названием, сколько то, что его последствия совершенно непредсказуемы. Он может пройти совершенно не заметно у одного ребенка, а у другого станет причиной развития тяжелых состояний и даже онкологических заболеваний.
Комаровский о ВЭБ
Евгений Комаровский призывает родителей не создавать лишней истерии вокруг вируса Эпштейна-Барр. Он считает, что большинство детей с этим агентом уже встречались в раннем детстве, и их иммунитет «запомнил» его и умеет идентифицировать и противостоять.
А теперь послушаем доктора Комаровского об инфекционном монокулезе.
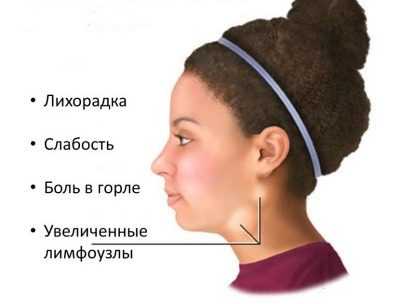
Симптомы, которые позволяют заподозрить у ребенка ВЭБ, довольно размыты:
- Раздражительность, плаксивость, повышенная капризность и частая беспричинная усталость.
- Легкое или более заметное увеличение лимфатических узлов. Чаще всего — подчелюстных и заушных. Если инфекция протекает тяжело — по всему телу.
- Отсутствие аппетита, проблемы с пищеварением.
- Сыпь.
- Высокая температура (до 40,0).
- Боли в горле (как при ангине и фарингите).
- Сильная потливость.
- Небольшое увеличение размеров печени и селезенки. У ребенка это может проявляться ноющими болями в животе.
- Желтушность кожных покровов. Этот симптом встречается крайне редко.
Комаровский подчеркивает, что на основании одних только жалоб и наличия тех или иных симптомов поставить диагноз нельзя, поскольку состояние ребенка будет напоминать и ангину, и энтеровирус, и лимфогранулематоз.
Чтобы подтвердить или опровергнуть вирус Эпштейна-Барр требуется лабораторная диагностика проб крови пациента, в том числе биохимический анализ, серологическое исследование, ПЦР, а также желательно сделать иммунограмму и провести ультразвуковое исследование органов брюшной полости — печени и селезенки.
Комаровский часто сравнивает ВЭБ с ветрянкой. И то, и другое заболевание легче переносится в раннем возрасте, чем младше человек, тем проще недуг и меньше последствий. Чем в более взрослом возрасте происходит первичное инфицирование, тем больше шансы на тяжелые осложнения.
Лечение по Комаровскому
Евгений Олегович предупреждает, что лечение антибиотиками группы пенициллинов одного из ассоциированных с ВЭБ заболеваний — инфекционного мононуклеоза может вызвать тяжелые осложнения. Обычно такое назначение бывает ошибочным, когда доктор принимает мононуклеоз за обычную бактериальную ангину. В этом случае может развиться экзантема.
Обычные дети, не страдающие ВИЧ и другими тяжелыми расстройствами иммунной системы, по мнению Евгения Комаровского, не нуждаются при мононуклеозе, вызванном ВЭБ, в никаком противовирусном лечении, и уже тем более им не надо в срочном порядке давать иммуностимуляторы. Известный педиатр уверен, что организм ребенка в состоянии самостоятельно справиться с этой угрозой.

Если течение болезни тяжелое, что, по словам Комаровского, бывает очень редко, может потребоваться лечение в условиях стационара. Там, скорее всего, будут применяться (вполне оправданно) препараты противогерпетической группы.
Во всех остальных случаях достаточно лечения симптоматического. К нему относятся жаропонижающие средства (если температура выше 38,5-39,0), средства, уменьшающие боли в горле (леденцы, антисептики, полоскания), мази, гели и наружные спреи с антисептиками при сильной кожной сыпи.
Советы
- Лучшая профилактика вируса Эпштейна-Барр у детей — хорошая привычка мыть руки почаще и не облизывать все, что плохо лежит.
- В холодные сезоны, особенно в период роста заболеваемости вирусными инфекциями, родителям стоит позаботиться не о том, каким «расчудесным» антивирусным средством напоить свое чадо, а о том, чтобы он меньше бывал в местах массового скопления людей, где помимо вирусов гриппа, можно довольно легко «подхватить» и вирус Эпштейна-Барр.
- Закаливание, прогулки на свежем воздухе, полноценное питание, богатое витаминами могут защитить ребенка не хуже дорогого препарата. ВЭБ может довольно долго «дремать» в организме, из латентного состояния вирус перейдет в активную и агрессивную фазу развития, если иммунитет ослабнет, если малыш истощен.
- Если ребенок заболел, родителям необходимо обеспечить ему постельный режим, обильное теплое питье, чтобы не допустить сильной интоксикации. Насильно кормить малыша не надо. Пусть получает пищу тогда, когда запросит ее сам. Важно, чтобы блюда были жидковатыми или протертыми, кашицеобразными.
- Вирус Эпштейна-Барр после выздоровления никуда у ребенка не исчезает. Он просто переходит в иное, «спящее» состояние. Однако его запросто могут спровоцировать и разбудить некоторые стрессовые для организма ситуации, такие, как очередная прививка. Поэтому Комаровский советует родителям всегда предупреждать медиков, что чадо перенесло инфекционный мононуклеоз.


Вэб — 24 ответа врачей на вопрос на сайте СпросиВрача
Елена , Москва
332 просмотра
Здравствуйте, ребёнку 2.5г. С 8 мес прощупываются лимфоузлы на шее и подчелюстные. (по узи были до 1 см, структура не изменённа). В 1. 2 переболели герпесной ангиной, после этого ребёнок стал часто болеть, каждые 2 мес. В 2 года снова заболел орви, и с того момента недели 3 перерыв и снова болеет. В начале марта сутки 39 температура, 2 недели потом насморк. Потом месяц вроде как ничего на вид, но ночью закладывало нос(лор сказала отек) и температура 37-37.2 держалась (причем голова была холодная на ощупь, если бы специально не меряла, не догалалась) . И спустя месяц такого состояния снова появились густые, зелёные сопли, лор сказала, что и не выздоравливали. Сдали анализы, цмв igm igg отриц, герпес 6 типа тоже. А вэб igm к vca отриц, а положительные igg к vca и igg к ebna (1.3 при норме до 1). По узи брюшной полости увеличены печень и селезенка на 1.5-2см и лимфоузлы брюшные до 1.2см. Также под челюстью 2 лимфоузла по 1.3 и подмышкой один 1.3 структура их не изменена. Какие еще анализы нам надо сдать для постановки диагноза? Каждый раз во время болезней сдавали ОАК, мононуклеаров не было, нейтрофилы ближе к нижней границе, моноциты и эритроциты немного повышены. Прочитала про лимфому, для нее тоже характерно и увеличение узлов по телу, и селезенки и печени, очень переживаю!
Хронические болезни: Аденоиды под вопросомВопрос закрыт
Анализ крови на ВЭБ инфекцию у ребенка: что это такое, расшифровка | Полезно знать
Мононуклеоз — модная тема. Все педиатры и смежные специалисты обожают его искать и находить везде, где он есть. Но нередко и там, где его нет.
Что значит модная тема? То, чем можно объяснить все проблемы — например, частые болезни у ребенка, что чаще всего, в раннем возрасте, является нормой.
Раньше у всех искали дисбактериоз и лямблии, теперь у всех подряд ищут антитела к герпесвирусам. Особенно в этом почему то преуспели ЛОРы (см. фокус-покус). Находя IgG к вирусу герпеса человека 6 типа (ВГЧ-6), цитомегаловирусу (ЦМВ) и вирусу Эпштейн-Барр (ВЭБ), они делают большие глаза, объявляют, что у ребенка мононуклеоз, и начинают его интенсивно «лечить». Хотя обнаружение IgG является вариантом нормы. IgG означает, что пациент уже перенес эту инфекцию. И это чаще всего протекает субклинически, незаметно.
Но еще дальше пошли некоторые инфекционисты. После перенесенного инфекционного мононуклеоза, эти ребята мало того, что запугивает народ россказнями про сниженный иммунитет, вред солнца и медотводы от прививок (см. монокомплекс), но и начинают интенсивно «наблюдать» пациента.
В принципе, нет ничего плохого в лишнем осмотре доктора и дополнительном клиническом анализе крови. Но некоторым специалистам этого мало и они раз за разом назначают ПЦР слюны на ВГЧ-6, ЦМВ и ВЭБ. И что интересно, вирусы то выявляются и тогда доктор назначает «лечение» — то есть разные иммуномодулятор с недоказанным действием. То не выявляются, и врач гордо объявляет, что он победил вирус, хотя это на самом деле не возможно.
Что же на самом деле означает обнаружение ВГЧ-6, ЦМВ и ВЭБ в слюне? Да собственно говоря, ничего.
Если человек сталкивался когда-либо в жизни с ВГЧ-6, ЦМВ и ВЭБ, что весьма вероятно, то эти вирусы остаются в организме, (в том числе, в слюне), навсегда. Их количество в слюне может колебаться: то увеличиваться и тогда выявляться с помощью ПЦР, то снижаться, до неопределяемого минимума. И все это совершенно не опасно. Человек живет в мире со своими микробами и различными вирусами, и они нисколько ему не мешают, если только у пациента не возникнет мощный иммунодефицит.
Поэтому ПЦР слюны может считаться подтверждением острой инфекции, только если в крови не выявляются IgG к искомому вирусу. (Исключение — новорожденные, у которых обнаружение с помощью ПЦР ВГЧ-6, ЦМВ не зависимо от IgG свидетельствует о текущей инфекции).
Если же ПЦР слюны положительная и в крови есть IgG, это говорит лишь о том, что пациент уже перенес инфекцию и сейчас не болеет.
Поделиться в соц. сетях
Нравится
Что такое вирус Эпштейна-Барр? Какие болезни он вызывает? Насколько это опасная инфекция?
Название вируса Эпштейна-Барр происходит от имени ученных впервые изучивших эту инфекцию.
В ходе микробиологических исследований было установлено, что вирус Эпштейна-Барр это разновидность вируса герпеса (в медицине его называют вирусом герпеса 4 типа).
В целом это относительно малоопасный и чрезвычайно распространенный вирус. Его следы могут быть обнаружены в организме более чем 90% всех взрослых людей во всем мире.
Здоровый человек может заразиться вирусом Эпштейна-Барр от другого человека который был заражен этой инфекцией несколько месяцев или несколько лет назад.
Этот вирус содержится в частичках слюны зараженных им людей и, следовательно, может передаваться от одного человека к другому при использовании общей посуды, при поцелуе, при кашле, чихании или при других обстоятельствах делающих возможным попадание слюны одного человека в рот другого человека.
Попав однажды в организм человека, вирус Эпштейна-Барр остается в нем навсегда и время от времени снова появляется в слюне. В такие периоды у человека нет никаких симптомов болезни, но он становится заразным для других людей.
У большинства людей, после заражения вирус Эпштейна-Барр никак себя не проявляет или вызывает только незначительные симптомы, похожие на легкую простуду.
Тем не менее, у некоторых людей, через 4-8 недель после заражения этот вирус вызывает повышение температуры, увеличение лимфатических узлов во всем теле и ангину. В медицине такие случаи болезни называются инфекционным мононуклеозом.
Большинство людей заболевающих инфекционным мононуклеозом полностью выздоравливают в течение нескольких недель. Тем не менее, в редких случаях эта болезнь может привести к тяжелым осложнениям или даже к смерти заболевшего человека.
| Подробно объяснение того какие именно осложнения может вызвать вирус Эпштейна-Барр представлено в статье Инфекционный мононуклеоз. |
Анализ крови у детей при мононуклеозе
Такая болезнь, как инфекционный мононуклеоз, нередко встречается в детском возрасте. Она вызывается вирусом группы герпеса, названным в честь обнаруживших его ученых вирусом Эпштейна-Барр. И поэтому вторым названием этого заболевания является ВЭБ-инфекция.
Болезнь передается от заболевшего ребенка здоровому через прямые контакты и воздушно-капельным путем. Ее инкубационный период довольно длительный и может достигать нескольких месяцев, а первыми проявлениями будут лихорадка, боли в горле, увеличение лимфоузлов, слабость и заложенность носа.
Чтобы подтвердить диагноз, следует сдать общий анализ крови, ведь его изменения при мононуклеозе носят специфический характер, то есть позволяют убедиться в присутствии вируса Эпштейна-Барр в детском организме.
Общий анализ крови подтвердит наличие или отсутствие инфекции
Если у ребенка есть такая инфекция, то показатели клинического анализа крови изменятся так:
- Общее число лейкоцитов увеличится (это называют лейкоцитозом).
- Процент моноцитов и лимфоцитов в лейкограмме повысится.
- На первой стадии болезни может выявляться нейтрофилез.
- Будут определяться атипичные мононуклеары. Так называют овальные или круглые одноядерные клетки, напоминающие по строению моноциты и лимфоциты, но имеющие некоторые структурные отличия. В норме такие клетки в анализе крови отсутствуют или могут быть у детей в пределах 0-1%. Их процент повышается при разных вирусных заболеваниях, опухолях и некоторых других патологиях, но при этом составляет менее 10%. Если уровень атипичных мононуклеаров превысил порог в 10%, это подтверждает наличие у ребенка инфекционного мононуклеоза.
- СОЭ будет умеренно повышена.
- Если течение болезни будет не осложненным, число тромбоцитов и эритроцитов останется нормальным. При появлении осложнений будет отмечаться их понижение.
При мононуклеозе большинство показателей анализа крови будут повышены
Чтобы уточнить диагноз и определить наличие осложнений ребенка направят на:
- Моноспот-тест. Такой анализ помогает выявить болезнь на ранней стадии и заключается в соединении крови ребенка с особыми реагентами, в результате чего при ВЭБ-инфекции происходит склеивание клеток крови и выпадение их в осадок.
- Анализ на антитела. Такое исследование определить специфические иммуноглобулины, которые вырабатываются в организме ребенка при контакте с вирусом Эпштейна-Барр.
- Биохимическое обследование крови. В таком анализе при поражении печени будут повышены ферменты и уровень билирубина.
Ребенку с инфекционным мононуклеозом проводят несколько анализов крови, поскольку на разных этапах болезни показатели могут отличаться.
К примеру, присутствие в анализе атипичных мононуклеаров может не выявляться в первые недели заболевания.
Кроме того, в процессе лечения педиатру потребуется результат анализа для выявления осложнений, а после острой фазы клинический анализ крови покажет, как идет процесс выздоровления.
Для точной картины течения болезни требуется неоднократно сдавать анализ крови
Источник:
Исследование на ХГЧ: суть метода
Данная аббревиатура расшифровывается как «хорионический гонадотропин человека». Это гормон, за выработку которого отвечает синцитиотрофобласт — часть оплодотворенной яйцеклетки. Как только последняя прикрепляется к стенке матки, ХГЧ начинает стимулировать активное развитие плаценты.
Хорионический гонадотропин человека состоит из двух единиц: альфа и бета. При этом только второй показатель имеет важное значение в диагностике беременности на ранних сроках. Анализ на бета-единицу позволяет определить зачатие уже через 2 дня после наступления оплодотворения.
Функции, которые выполняет ХГЧ:
- Способствует синтезу эстрогена и прогестерона.
- Готовит организм женщины к вынашиванию плода.
- Сохраняет желтое тело.
- Стимулирует работу надпочечников и половых желез у развивающегося плода.
- Способствует выработке клеток Лейдига, которые, в свою очередь, синтезируют у эмбрионов мужского пола тестостерон.
Важно знать о том, что тесты на беременность также основаны на выявлении уровня ХГЧ. Но в данном случае биологическим материалом является моча. В урине концентрация хорионического гонадотропина человека увеличивается медленно. Именно поэтому производители тест-полосок рекомендуют проводить исследование минимум за 1-2 дня до начала предполагаемой менструации. В крови же ХГЧ выявляется в среднем через 2 дня после оплодотворения. В связи с этим это самый надежный анализ на определение беременности на ранних сроках.
Подготовка
Забор биологического материала осуществляется в утренние часы. Сдавать кровь нужно обязательно на пустой желудок. Последний прием пищи должен состояться не раньше, чем за 10 часов до забора жидкой соединительной ткани.
Важно за 1 день до сдачи крови исключить из рациона жирную пищу и продукты, в составе которых имеется большое количество белка. Это обусловлено тем, что кровь раньше времени может свернуться, из-за чего она станет для исследования непригодной.
Если женщина принимает какие-либо лекарственные средства, об этом нужно поставить в известность врача. В некоторых случаях действие медикаментов способно исказить результаты исследования.
Как проводится?
Забор крови осуществляется стандартным образом. В качестве биологического материала используется венозная жидкая соединительная ткань. Ее забор, как правило, проводится из вены, расположенной на локтевом сгибе. Пробирка с кровью маркируется, после чего она отправляется в лабораторию.
Сроки выполнения
Исследование жидкой соединительной ткани проводится методом ИФА. В некоторых учреждениях (например, в «Юнилабе» или «Инвитро») анализ на беременность на ранних сроках готов уже через 1-2 дня. Практически каждая независимая лаборатория оказывает услугу экспресс-тестирования. Это значит, что результаты можно получить уже через 2 часа. Уточнять сроки рекомендуется непосредственно в выбранном учреждении.
Интерпретация результатов
У каждого человека (незначительная концентрация гормона присутствует даже в организме у мужчин) показатель ХГЧ индивидуален. В связи с этим только врач сможет правильно интерпретировать результаты анализа на беременность на ранних сроках.
Существуют средние нормативные значения, выраженные в мЕд/мл:
- У здоровых и не беременных женщин показатель ХГЧ варьируется в пределах 0-5.
- Если зачатие произошло, уровень гормона изменяется постоянно. 1 неделя — минимальное значение 20, максимальное — 150.
- 2-3 недели. Показатель вырастает в разы и может составлять 100-4870.
- 4 недели. Уровень ХГЧ варьируется в пределах 2500-82000.
- 5 недель. Показатель достигает 151000.
- 6 недель. Максимальное значение составляет 233000.
Таким образом, анализ ХГЧ на ранних сроках беременности крайне информативен. С его помощью возможно не только подтвердить зачатие, но и точно определить неделю гестационного периода. Кроме того, на основании результатов исследования врач получает возможность выявить у пациентки или плода различного рода патологии.
Если показатель ХГЧ у женщины варьируется в пределах 5-25 мЕд/мл, исследование необходимо пройти повторно через 2 дня. Это обусловлено тем, что данные результаты не являются однозначными.
Отклонения от нормы
Если анализ крови на беременность на ранних сроках показал слишком высокое значение хорионического гонадотропина человека, это, как правило, свидетельствует о наличии следующих состояний:
- Сахарного диабета.
- Токсикоза.
- Многоплодной беременности.
- Хромосомных аномалий у развивающегося плода.
- Пролонгированной беременности.
Кроме того, отклонение показателя ХГЧ в большую сторону наблюдается при приеме гормональных медикаментов, задачей которых является восполнение недостатка в организме прогестерона.
Низкие концентрации хорионического гонадотропина человека являются поводом для немедленного обращения к врачу. Если показатель вдвое меньше нормы, это может свидетельствовать о замершей или внематочной беременности, угрозе прерывания, перенашивании, гибели плода или плацентарной недостаточности.
Общий анализ крови на ранних сроках
Если факт зачатия подтвердился, женщине необходимо пройти еще ряд лабораторных исследований. Это нужно для того, чтобы своевременно выявить у будущей мамы или плода развитие патологического процесса. Информацию относительно того, какие анализы на ранних сроках беременности нужно сдавать, предоставляет врач-гинеколог или терапевт. Но первым в этом перечне всегда стоит клиническое исследование жидкой соединительной ткани.
Общий анализ крови на ранних сроках беременности крайне информативен. В частности, наиболее клинически значимыми являются следующие показатели:
- Эритроциты. Норма для всего периода гестации составляет от 3,5 х 1012 до 5,6 х 1012. Отклонение от нормы происходит при обезвоживании, анемии, ожирении, длительном пребывании в состоянии стресса, курении. Каждое из данных состояний у беременной женщины требует немедленной коррекции.
- Гемоглобин. В первом триместре нормальными являются значения от 112 до 160 г/л. Слишком низкий показатель может свидетельствовать о гипоксии, дефиците железа, отставании в физическом развитии плода. Кроме того, подобное состояние грозит ранним развитием процесса родоразрешения и значительной кровопотерей. Высокий показатель гемоглобина характерен для обезвоживания, кишечной непроходимости, сахарного диабета, гипервитаминоза.
- Тромбоциты. Нормальными являются значения в диапазоне от 180 х 109 до 320 х 109. Небольшое отклонение не всегда свидетельствует о наличии патологии. Если же оно значительное, выявление недуга и его лечение — это задача врача-гематолога.
- Лейкоциты. В первом триместре их показатель колеблется от 4 х 109 до 9 х 109. Высокие значения говорят, как правило, о наличии инфекционных заболеваний (в том числе передающихся половым путем), низкие — об ослаблении защитной системы организма.
- Лимфоциты. Норма — от 18 до 44 %. Отклонение в большую сторону может свидетельствовать о наличии опасных инфекционных заболеваний. Низкий показатель поводом для беспокойства не является.
При интерпретации результатов врач учитывает соотношение множества критериев. Рассматривать каждый из них по отдельности нецелесообразно, так как это приводит к ошибочным умозаключениям.
Общий анализ мочи
Еще одно важное исследование. Несмотря на то что анализ мочи на беременность на ранних сроках неинформативен, он может многое рассказать о течении гестационного периода, что особенно важно в первом триместре.
Для врачей значимыми показателями являются следующие:
- Цвет. В норме урина должна быть соломенно-желтой.
- Прозрачность. В ней не должны обнаруживаться примеси.
- Удельный вес.
- рН.
- Белок. Его не должно быть вообще.
- Сахар, билирубин, кетоновые тела, нитриты, гемоглобин. Их также в моче быть не должно.
- Эритроциты. Норма — 1-2 шт. в поле зрения.
- Лейкоциты. Норма — от 0 до 5.
- Эпителиальные клетки. Норма — от 0 до 3.
- Цилиндры.
- Количество слизи.
- Соли.
Никаких бактерий и грибков в норме в моче быть не должно. При их наличии принято говорить о развитии мочеполовой инфекции. Исследование проводится каждые 2 недели. Это позволяет своевременно выявить патологический процесс.
Биохимический анализ крови
С помощью данного исследования врач получает возможность составить максимально полную картину относительно состояния здоровья будущей мамы. Анализ в РФ обязательным не является, он только рекомендован Минздравом. Однако все врачи назначают его беременным женщинам, так как он считается крайне информативным.
Показатели, являющиеся наиболее значимыми:
- Белок общий. В первом триместре его концентрация не должна быть меньше 63 и больше 83 г/л.
- Мочевина. На раннем сроке нормальными являются значения в диапазоне от 2,5 до 7,1 ммоль/л.
- Глюкоза. Не должна превышать 5,8 ммоль/л (на любом сроке беременности).
- Креатинин. Норма для первого триместра — от 32 до 70 мкммоль/л.
- АЛТ и АСТ — не более 31 ед/л.
- Щелочная фосфатаза. В первом триместре показатель не должен быть меньше 40 и больше 150 ед.
- Железо. Норма — от 8,93 до 30,4 мкммоль/л.
Исследование проводится каждый триместр.
Анализ на сифилис, гепатит и ВИЧ
Перечисленные инфекции относятся к группе перинатальных. Другими словами, они передаются от женщины к плоду и могут привести к непоправимым последствиям. В связи с этим во время беременности кровь на сифилис, гепатит и ВИЧ необходимо сдавать дважды (до 12 и в 30 недель).
Достоверность результатов напрямую зависит от того, насколько ответственно женщина отнеслась к правилам подготовки. Любое послабление может привести к ложным значениям.
За 1 день до забора биоматериала следует отказаться от груш, моркови, жирной пищи и продуктов, богатых белком. Сдавать кровь нужно на голодный желудок. Кроме того, за 5 дней важно находиться в состоянии покоя. Следует избегать физической активности и попадания в стрессовые ситуации.
Анализ на TORCH-инфекции
Патологии, относящиеся к данной группе, крайне опасны как для плода, так и для женщины. Это обусловлено тем, что наличие данных инфекций в 17 % случаев приводит к мертворождению. Если ребенок выживет, у него с большой долей вероятности будут обнаружены серьезные нарушения.
В группу TORCH-инфекций входят: токсоплазмоз, герпес, краснуха, цитомегаловирус. У каждой женщины они протекают по-разному. Например, на первой неделе после процесса оплодотворения зародыш полностью восстанавливается или же гибнет. Инфекция передается посредством плаценты, в некоторых случаях заражение происходит во время перемещения по родовым путям.
Исследование в обязательном порядке проводится еще на этапе планирования беременности. Анализ на ранних сроках на TORCH-инфекции (до 15 недель) помогает своевременно выявить наличие недуга и предпринять все возможные меры для сохранения плода.
Группа крови и резус-фактор
Даже если женщина в прошлом уже рожала, при наступлении каждой последующей беременности проводится данное исследование. Это необходимо для того, чтобы исключить вероятность ошибки, если пациентке вследствие каких-либо причин понадобится переливание крови. Кроме того, знание группы и резус-фактора позволяет своевременно обнаружить конфликт между матерью и плодом и предпринять меры для его устранения.
В заключение
Каждая женщина при подозрении на зачатие интересуется тем, какой анализ показывает беременность на ранних сроках. Для подтверждения или исключения факта оплодотворения рекомендуется сдать кровь на ХГЧ. Это высокоточное исследование, которое в настоящее время имеет максимальную степень достоверности. Данный анализ крови на беременность на ранних сроках позволяет не только узнать, произошло зачатие или нет, но и своевременно выявить развитие всевозможных патологий. В дальнейшем женщине необходимо пройти еще ряд исследований.
Источник: fb.ru
Антитела к аскаридам — расшифровка показателей
Аскаридоз является самым распространенным гельминтозом на планете. Количество инфицированных людей достигает 20% всего населения Земли.
Эндемичными районами выступают Африка и Южная Америка, однако обнаружить единичные случаи инвазии можно и на других континентах.
Что это такое?
Аскаридоз является гельминтозом человека, разновидностью геогельминтоза, ввиду особенностей созревания неинвазионных яиц. Возбудителем заболевания является аскарида – круглый кишечный червь.
Аскариды являются раздельнополыми, самки превосходят самцов в размерах. В среднем, взрослая особь достигает в длину 25 см.
Источником инфекции является зараженный человек, выделяющий яйца гельминта в окружающую среду с фекалиями. Таким образом, основной путь попадания аскарид в организм человека – фекально-оральный.
Попасть в кишечник глисты могут с немых рук при халатном отношении к правилам личной гигиены, а также с грязных овощей и фруктов. Чаще всего заболеванию подвергаются дети и люди, работа которых сопряжена с постоянным контактом с почвой.
Жизненный цикл аскарид начинается в тонком кишечнике, откуда они с током крови проникают в дыхательную систему, печень, желчный пузырь, поджелудочную железу, а также в верхние отделы пищевода, где происходит их повторное заглатывание и перемещение обратно в тонкий кишечник в процессе пищеварения. Там происходит половое созревание особей, и они начинают размножаться, ежедневно выделяя сотни тысяч яиц.
Симптоматика аскаридоза на ранних стадиях характеризуется аллергическими реакциями организма, а на поздних – авитаминозом, нарушениями метаболических процессов, дегенеративными изменениями структуры и деятельности пищеварительного тракта.
Кроме того, при переходе глистов из ранней стадии в позднюю, который занимает около 3-х месяцев, наблюдаются ярко выраженные аллергические симптомы:
- чихание;
- кашель;
- зуд;
- гипертермия;
- общая слабость.
Это обуславливается иммунной реакцией организма на миграцию чужеродных патологических микроорганизмов.
После возвращения аскарид в тонкую кишку, симптомы стихают и заболевание принимает хроническую форму.
Диагностика
Особых показаний для проведения диагностических мероприятий не требуются, однако при назначении процедур по выявлению особей и яиц аскарид, лечащий врач руководствуется следующими основаниями:
- наличие клинических проявлений аскаридоза;
- нахождение пациента в группе риска, ввиду проживания в эндемичном районе, либо совместно с инвазированным человеком;
- необходимость дифференциации аскаридоза с другими гельминтозами или непаразитарными заболеваниями ЖКТ;
- плановый медосмотр в регионе повышенного риска заражения.
Наиболее распространенным является серологическое исследование на антитела к аскаридам и анализ кала на выявление яиц гельминтов, однако проведение диагностики предполагает поиск следов (яиц) глистов, либо самих особей по всему организму, ввиду особенностей их миграции. К дополнительным способам выявления аскаридоза относятся:
- реакция латекс-агглютинации;
- общий анализ крови;
- рентген легких;
- анализ мокроты;
- рентген тонкого кишечника с использованием контраста.
Общий анализ крови
Общий анализ крови покажет повышенное содержание эозинофилов – клеток отвечающих за борьбу против болезнетворных микроорганизмов.
Увеличение их числа всегда свидетельствует о проникновении инфекции в организм и является показателем процесса уничтожения иммунной системой чужеродных молекул.
Исследование легких
Проведение рентгена легких и лабораторного микроскопического исследования мокроты актуально через 3 месяца после заражения, так как именно за это время паразиты добираются до бронхов и могут быть там замечены.
Основанием для проведения этих анализов являются бронхолегочные симптомы, а также необходимость дифференциации аскаридоза с другими заболеваниями дыхательной системы, проявляющимися схожими признаками.
Исследование кала