Внутриклеточные инфекции что это такое
Половые инфекции
Половые инфекции или инфекции, передающиеся половым путем, в настоящее время приобретают все большее значение. К традиционным инфекциям, таким, например, как гонорея, присоединились многочисленные вирусные инфекции, которые кроме основного заболевания вызывают стойкое снижение иммунитета, протекают длительно и оказывают влияние на течение любого острого или хронического заболевания. Клиники г.Тюмени по лечению половых инфекций, здесь.
Какие заболевания относится к половым инфекциям
Половые инфекции - это заболевания, возбудитель которых передается от человека к человеку половым путем. Сюда относятся, прежде всего, это так называемые венерические заболевания - сифилис, гонорея, мягкий шанкр, лимфогранулема венерическая и гранулема венерическая. Для борьбы с этими заболеваниями кроме лечебных принимаются еще и законодательные меры в виде принудительного лечения, привлечения к уголовной ответственности за заражение другого лица и т.д. Возбудители венерических болезней, как правило, очень нестойки в окружающей среде.
В последнее время в медицине чаще используется термин «инфекции, передающиеся половым путем» (ИППП), сюда входит большая группа инфекций, как бактериального, так и вирусного происхождения. Кроме венерических заболеваний к ИППП такие заболевания, как относятся хламидиоз, уреаплазмоз, микоплазмоз, трихомониаз, генитальный герпес, вирус папилломы человека, ВИЧ-инфекция и др.
Венерические заболевания
Венерические заболевания известны давно, борьба с ними ведется всеми доступными методами, тем не менее, такие венерические заболевания, как гонорея и Сифилис в последние годы получили значительное распространение. Запущенные случаи сифилиса дают многочисленные осложнения со стороны всех органов и систем организма, особенно сильно страдает центральная нервная система. Женщина, больная сифилисом может родить ребенка с врожденной формой этого заболевания.
Скрыто протекающие случаи гонореи (особенно часто они встречаются у женщин) вызывают воспалительные заболевания внутренних половых органов и стойкое бесплодие.
Простейшие как возбудители половых инфекций
Типичным представителем этого типа инфекций является трихомониаз, который вызывается влагалищными трихомонадами - одноклеточными простейшими, которые способны существовать не только внутри организма человека, но и вне него. Питание трихомонад происходит путем поглощения клеток, в том числе бактерий (например, гонококков), которые могут долго сохранять свою жизнеспособность внутри трихомонад. Этим объясняется многочисленные рецидивы (обострения заболевания) гонореи при сочетании ее с трихомониазом.
Недолеченный или неправильно пролеченный трихомониаз является причиной длительно протекающих воспалительных заболеваний женских половых органов и бесплодия.
«Новейшие» половые инфекции
В связи с тем, что медицина научилась выявлять все большее число возбудителей инфекций, выяснилось, что в половых путях человека длительно существуют возбудители, которые находятся в «дремлющем» состоянии. К таким возбудителям относятся внутриклеточные бактерии и вирусы.
Внутриклеточные возбудители половых инфекций
К внутриклеточным возбудителям половых инфекций относятся хламидии, уреаплазмы, микоплазмы и некоторые другие возбудители. Инфекция внедряется в клетки слизистой оболочки мочеполовых органов, нарушает ее способность к фагоцитозу (фагоцитоз - «пожирание» клетками бактерий) и в дальнейшем уже беспрепятственно размножается. Инфекция поражает главным образом мочеполовую систему, но иногда переходит и на другие органы: дыхательные пути, глаза и т.д. Размножение микроорганизмов может усиливаться под воздействием женских половых гормонов, поэтому такими инфекциями чаще болеют женщины детородного возраста. Инфекция, вызванная внутриклеточными возбудителями, часто является причиной бесплодия и невынашивания беременности.
Вирусные половые инфекции
Типичными представителями вирусных половых инфекций являются половой герпес, папилломатоз и ВИЧ-инфекция. Все эти инфекции проявляются, как правило, при снижении иммунитета. Так, вирус герпеса может длительно существовать в теле челов
Внутриклеточные паразиты - названия видов, как происходит размножение в организме человека, средства от паразитических микроорганизмов
Одним из видов сосуществования является паразитизм. В этом случае микроорганизмы используют своего хозяина в качестве источника питания и как среду обитания. Их рост и развитие происходит за счет клеточного материала носителя. Часть паразитов могут существовать только за счет хозяина, другие же способны жить и в окружающей среде. Заражение любыми формами происходит извне разными путями, чаще при ослаблении иммунитета. Для обнаружения паразитов используются разные методы диагностики. При подтверждении их присутствия в организме назначается специальное лечение.
Статьи по темеЧто такое внутриклеточные паразиты
Так называют бактерии, поражающие клетки, ткани, внутренние органы живых организмов, вызывая их дисфункции. Они существуют за счет паразитирования. Понятие представляет собой тип сосуществования, при котором 2 или более организма длительное время живут вместе. При этом они никак не связаны филогенетически, а их отношения носят антагонистический характер. Получается, что один микроорганизм использует другого для жизни и питания.
Особенность морфологии внутриклеточных патогенных бактерий в том, что они размножаются только внутри живых клеток. В человеке могут поселиться возбудители многих опасных заболеваний, включая оспу, бешенство, грипп, корь и пр. В целом выделяют следующие формы внутриклеточных форм жизнедеятельности:
- бактерии;
- грибы;
- многоклеточные, например, трихинеллы;
- вирусы;
- простейшие, например, малярийный плазмодий.
Виды паразитов в организме человека
Существует несколько классификаций внутриклеточных патогенных микроорганизмов. Главным критерием для разделения их на виды выступает способ жизни. С учетом его существуют:
- Облигатные паразиты. Они не способны существовать вне клеток, а существуют только за счет своего хозяина. Примеры паразитов этого вида: хламидии, риккетсии, вирусы, возбудители холеры, лептоспиры, микоплазмы.
- Факультативные паразиты. Отличаются тем, что живут как в окружающей среде, так и в теле носителя. В организме хозяина они размножаются внутриклеточно, хотя могут делать это и внеклеточно. Примерами этого вида паразитов выступают возбудители туляремии, бруцеллеза, туберкулеза и менингококковой инфекции.
Другой критерий классификации – область локализации. Патогенные микроорганизмы могут обитать внутри человека или в наружной среде на поверхности его тела. В зависимости от этого они разделяются на:
- Эндопаразиты. К таким относят паразитарных червей и простейших паразитов.
- Эктопаразиты. Они существуют на поверхности дермы. Примером выступают вши, клещи, комары, пиявки, слепни, и грибы.
По длительности контакта с хозяином микроорганизмы делятся на стационарные и периодические. Временные паразиты пользуются телом хозяина только на этапе питания. В остальном он живет свободно в открытой природе. К временным относят комаров, слепней, москитов, клещей. Постоянные внутриклеточные паразиты взаимодействуют с хозяином длительное время, проводя всю жизнь на его теле. Примерами таких микроорганизмов служат гемоспоридии, трихинеллы, вши, чесоточный зудень, острицы, аскариды.


Облигатные
Обязательными внутриклеточными паразитами являются микроорганизмы, живущие и размножающиеся только в клетке своего хозяина. По этой причине они погибают при длительном нахождении во внешней среде. Эта группа паразитов самая многочисленная. К ней относятся глисты, вирусы, бактерии. Даже при примитивной структуре такие микроорганизмы способны откладывать большое количество яиц.
Хозяева паразита бывают промежуточными и основными. Последние необходимы для жизни половозрелых особей. Они локализуются преимущественно на одном участке в клетках, тканях, полостях или на поверхности тела. Среди часто встречаемых облигатных паразитов выделяются:
- Хламидии. Проникают в организм при половом контакте, приводя к хламидиозу. Данное заболевание мочеполовой системы часто приходится лечить у обоих партнеров.
- Риккетсии. Ими человек заражается при употреблении сырых яиц или укусах мышей. При несвоевременном обнаружении риккетсии вызывают сыпной тиф и пятнистую лихорадку.
- Вирусы. Это самая опасная группа микроорганизмов, но при этом мало изученная из-за большого разнообразия.
Факультативные паразиты
При факультативном паразитировании микроорганизм приспосабливается к хозяину как к положительной среде обитания и источнику питания. Чтобы сделать это, приживальщик может избавиться от всех своих органов. Неизменными остаются только системы размножения и питания. Существовать эти микроорганизмы могут как внутри, так и вне клеток тела своего хозяина.
После попадания в организм простейшие продолжают развиваться. При сильной иммунной системе они воспринимаются как инородное тело, поэтому погибают и выводятся естественным путем. В хозяине приживалы только размножаются. Остальные циклы их развития происходят во внешней среде, организме животных или человека. Для полного цикла некоторые микроорганизмы меняют нескольких хозяев. Самыми распространенными факультативными паразитами являются:
- Энтеротоксигенный стафилококк. При попадании в кишечник отравляет организм, приводя к патологическим изменениям сердечно-сосудистой и пищеварительной систем. Температура тела человека оптимальная для размножения стафилококка.
- Стрептококк. Шаровидные бактерии, поражающие дыхательные пути человека. Они вызывают скарлатину, расстройство кишечника, ринит.
- Клебсиелла. Это бактерия условно патогенна. Она вызывает гастроэнтерологические заболевания, пневмонию, конъюнктивит, воспаления мочевыводящих путей.
- Сальмонеллы, бруцеллы, шигеллы. Вызывают кишечные инфекции. Токсины, вырабатываемые этими бактериями, поражают также нервную систему, кровеносные сосуды, приводят к почечной недостаточности.
Пути заражения
Любой паразитирующий микроорганизм выбирает своим носителем человека либо животного. От них и можно заразиться, но разными путями. Основные из них следующие:
- внутриутробный – от матери ребенку;
- половой – через слизистые оболочки влагалища, уретры, анального отверстия;
- воздушно-капельный – при чихании, кашле;
- бытовой – через воду, предметы, продукты питания;
- контактный – при соприкосновении поверхности тела с патогенным источником.


Общие признаки заражения
Заподозрить у себя в организме наличие паразитов можно по определенным признакам. Симптоматика определяется типом возбудителя. В каждом случае есть ряд отличительных признаков. Врачи выделяют и ряд общих признаков, указывающие на присутствие паразитов. Их список включает такие симптомы, как:
- зуд и сыпь на коже;
- выделения с неприятным запахом из половых органов, жжение в их области;
- болезненные ощущения в мышцах;
- слабость;
- зуд;
- лихорадка;
- состояние депрессии;
- тошнота;
- расстройство желудка;
- бессонница;
- снижение аппетита;
- изменение массы тела;
- усталость;
- раздражительность;
- бессонница;
- инфекции половых путей.
Диагностика
Только наличия определенных симптомов для постановки диагноза мало, поэтому врач назначает пациенту ряд процедур. Они включают инструментальные и лабораторные методы диагностики. Основными из них являются;
- рентген;
- ультразвуковое исследование;
- анализ кала;
- дуоденальное зондирование;
- эндобиопсия и эндоскопия;
- анализ мочи;
- исследование образца мокроты – в случае подозрения на парагонимоз.
Более распространенными сегодня при подозрении на паразитов являются иммунологические исследования. Они определяют в крови пациента наличие антигенов и антител к патогенным возбудителям. Высокой точностью обладают следующие иммунологические исследования:
- Серологические методики, включая РАЛ, РСК. Определяют в крови наличие антител lgG, lgM, lgA. Они указывают на наличие в организме патогенных возбудителей.
- Биорезонансная диагностика. Метод эффективен даже при отсутствии ярких симптомов поражения бактериями. В основе исследования лежит теория создания телами колебаний определенной частоты, что помогает определить их тип.
- Иммуноферментный анализ крови. Его преимущества в специфичности и высокой чувствительности (до 90%). Анализ помогает определить тип возбудителя, его количество и этап развития в организме.
- ПЦР, полимеразная цепная реакция. Представляет собой анализ на изучение ДНК, позволяющий выявить в организме простейших, вирусов, хламидий. Минус в том, что анализ не определяет точное количество возбудителей.
Лечение
Подход к лечению паразитарных заболеваний должен быть комплексным. Первым делом необходимо изменить подход к питанию. Особой диеты соблюдать не требуется, но от ряда продуктов отказаться нужно. Их список включает:
- молоко;
- сахар;
- сладости;
- соленое, жирное, жареное;
- мучное;
- жирное мясо и рыбу.
Эти продукты создают благоприятную атмосферу для размножения возбудителя. Вместо вредной пищи в рацион необходимо включать больше свежих овощей и фруктов, зелени. Они обеспечивают организм витаминами и минералами, помогают быстрее выздороветь. Для очистки используют народные рецепты, но основой лечения все же выступают медикаментозные препараты – антипаразитарные средства синтетического производства. Антибиотики назначают только в случае бактериальной природы заболевания.
Определенное лекарство назначают с учетом типа возбудителя и вызванной им инфекции. Среди часто используемых средств выделяются следующие препараты:
- Ивермектин. Назван по одноименному компоненту в составе. Дополнительно содержит витамин Е и токоферола ацетат. Основное действие препарата – противопаразитарное, поэтому он применяется при аскаридозе, онхоцеркозе, трихоцефалезе, энтеробиозе, филяриатозе, стронгилоидозе. Используется Ивермектин и при чесотке и педикулезе. Доза составляет в среднем 12 мг, но точно она рассчитывается с учетом массы тела человека. Для лечения необходим разовый прием. Повторный разрешен спустя 1-2 недели. Преимущество Ивермектина в минимуме побочных действий.
- Вермокс. Содержит мебендазол, обладающий антигельминтным действием. Показания к применению Вермокса: трихинеллез, эхинококкоз, аскаридоз, энтеробиоз, стронгилоидоз, капилляриоз, гельминтоз, тениоз, альвеококкоз. Доза и схема приема определяется типом заболевания. При энтеробиозе однократно принимают 100 мг, при трихинеллезе – 3 раза в день по 200-400 мг. Плюс – возможность применения у детей с 2 лет.
- Декарис. Основан на левамизоле, обладает противогельминтным свойством. Используется при анкилостомозе, аскаридозе, трихостронгилезе, энтеробиозе, токсоплазмозе. От последнего заболевания назначают по 150 мг в день на протяжении 3 суток. В случае гельминтозов принимают однократно по 150 мг перед сном. Курс повторяют спустя 1-2 недели. Преимущество препарата – в большинстве случаев хватает одного цикла приема.

Народные средства
Не стоит полагаться исключительно на народные средства. Они должны быть вспомогательным методом лечения на фоне медикаментозной терапии. Большинство народных рецептов основаны на токсических для паразитов свойствах лечебных трав. Некоторые растения помогают избавиться от лямблий, трихомонад, токсоплазмоз, хламидий. Действенными против них считаются следующие рецепты:
- Взять по 4 ч. л. высушенных и измельченных листьев эвкалипта и цветков пижмы, 3 ч. л. плодов софоры, 2 ч. л. тысячелистника. Столовую ложку смеси заварить литром крутого кипятка. Накрыть емкость с отваром крышкой, дать постоять 20-30 минут. Перед приемом необходимо процедить. Доза составляет треть стакана 3 раза в день. Продолжать лечение необходимо не менее 2-3 недель. Рецепт эффективен против трихомонад.
- Смешать медицинский спирт и почки черного тополя в пропорции 9:1. Поместить средство в стеклянную емкость, герметично закрыть и оставить на 25 дней в затемненном месте. По истечении этого срока необходимо процедить настойку. Принимают ее по 35 капель на десертную ложку воды по 3 раза ежедневно. Курс против хламидий длится 16-18 дней.
- Подготовить стакан тыквенных семечек. Измельчить их, смешать с 2 желтками и столовой ложкой меда. Перемешать, добавить чуть-чуть воды. Съедать готовое средство натощак каждое утро. После этого необходимо полежать 2 часа, положив к животу горячую грелку. Процедуру повторяют ежедневно на протяжении 10 суток. Далее следует перерыв в пару дней, после чего должен идти еще один цикл лечения. Такой рецепт помогает от описторхов.
Профилактика
Для предотвращения паразитарных инвазий необходимо соблюдать ряд правил. Они касаются личной гигиены и правила приготовления пищи. Самым банальным правилом является мытье рук перед едой и после прогулки. Кроме этого, рекомендуется выполнять следующее:
- обеззараживать овощи, фрукты и зелень замачивание в воде на 20-30 минут, после чего промывать под струей воды;
- ягоды с шероховатым строением промывать в 1% содовом растворе;
- не пить воду из-под крана, употреблять только кипяченую;
- тщательно термически обрабатывать мясо и рыбу;
- не пить воду из открытых источников;
- регулярно проводить в доме влажную уборку;
- не грызть ногти;
- меньше употреблять дрожжевых и сладких продуктов;
- чаще стирать игрушки и одежду, особенно детскую.
Видео
 внутриклеточные паразиты Смотреть видео
внутриклеточные паразиты Смотреть видео
Внимание! Информация, представленная в статье, носит ознакомительный характер. Материалы статьи не призывают к самостоятельному лечению. Только квалифицированный врач может поставить диагноз и дать рекомендации по лечению, исходя из индивидуальных особенностей конкретного пациента.
Нашли в тексте ошибку? Выделите её, нажмите Ctrl + Enter и мы всё исправим! Рассказать друзьям:Хронические внутриклеточные инфекции и сердечно-сосудистая патология
В настоящее время науке известно не более 3 % микроорганизмов, населяющих нашу планету, остальные же обитатели микромира еще не выявлены. «Появление» каждого нового возбудителя скорее свидетельствует о разработке технологии его диагностики. Несомненно, микроорганизмы играют одну из первостепенных ролей как в развитии жизни, так и в формировании ее патологии, вплоть до изменения генома. Отношения инфекционных агентов, в частности вирусов с клетками, сложны и многообразны. В одних случаях быстро развивается болезнь, которая закономерно заканчивается гибелью клеток, в других — вирус, проникший внутрь клетки, может длительное время не проявлять своего вредоносного действия. Первый тип взаимодействия — литический и является явной или острой инфекцией, второй — латентный, или маскированный. В первом случае болезнь протекает быстро, во втором наблюдается ее длительное хроническое течение. Клетки при этом сохраняют внешне здоровый вид, и поэтому такое заболевание трудно распознать. При латентной инфекции вирусы могут оставаться в клетке неопределенно долгое время, не оказывая характерного патогенного действия. Более того, они могут передаваться потомству этой клетки и переходить из поколения в поколение. Вместе с тем «дремлющая» инфекция, особенно внутриклеточная, является раздражающим фактором для «наблюдательных» систем организма — иммунной, нервной и эндокринной, вызывая их напряженность и постоянную повышенную функциональную активность. В этой связи стрессовые ситуации — травмы, переохлаждения, интеркуррентные заболевания, обострения хронической патологии и т.д., с одной стороны, могут активизировать дремлющий инфекционный процесс с обострением его течения, с другой — привести к декомпенсации систем адаптации, иммунному дисбалансу с развитием тяжелых заболеваний. Этим, по-видимому, и определяется вывод экспертного комитета ВОЗ о росте числа аллергических, аутоиммунных и онкологических болезней, связанных с персистирующими «скрытыми» инфекциями.
Только в последние годы обнаружены инфекционные факторы возникновения и развития язвенной болезни желудка и двенадцатиперстной кишки, бронхиальной астмы, некоторых злокачественных новообразований и т.д. Поэтому значение инфекций в генезе заболеваний человека, в том числе относящихся к так называемым соматическим, еще не определено до конца.
Среди инфекций, которые сегодня рассматриваются как важные участники патогенеза хронических соматических заболеваний, большая роль отводится так называемым медленным инфекциям. Термин «медленные инфекции» был введен Сигурдсcоном (В. Sigurdsson) в 1954 г., когда он впервые сформулировал основные положения учения о медленных инфекциях.
Медленная инфекция — это форма взаимодействия вируса с организмом хозяина, являющаяся частным случаем персистенции вирусов. Для этой формы инфекции характерны следующие признаки: необычайно продолжительный инкубационный период, медленный, нередко прогрессирующий характер течения заболевания, своеобразное поражение органов и тканей, как правило, смертельный исход. Первоначально этот термин использовался в отношении инфекций у животных. Позднее было установлено, что медленные формы инфекции в определенных условиях могут вызываться многими вирусами, в том числе известными ранее лишь как возбудители острых вирусных инфекций (вирусы кори, краснухи, герпесвирусы и др.).
Исследования последних лет свидетельствуют, что высокая частота инфекционных заболеваний в раннем детском возрасте, а затем резкий рост соматических и онкологических заболеваний у детей старшего возраста и пожилых людей могут быть следствием хронического рецидивирующего течения воспалительных, иммунопатологических и деструктивно-дистрофических процессов в органах и тканях, обусловленных персистенцией инфекционных агентов. Как правило, эти инфекции характеризуются внутриклеточной жизнедеятельностью с использованием ресурсов клеток-мишеней хозяина, антибиотикоустойчивостью, выраженными иммуносупрессивными свойствами. Клетка обычно предохраняет находящиеся в ней микроорганизмы от воздействия антибактериальных средств, в связи с чем факторы иммунной системы, разрушая расположенные в ней инфекционные агенты, уничтожают вместе с ними и собственные скомпрометированные клетки. Учитывая, что одним из характерных свойств этих инфекций является длительность, а возможно, и пожизненность персистенции с рецидивами на фоне нарушения функционирования систем адаптации, воспалительный процесс также становится хроническим, персистирующим. К данной категории инфекций относят и группу герпесвирусов (герпес 1-го, 2-го типа, цитомегаловирус, вирус Эпштейна — Барр и др.), вирус гепатита В, токсоплазмы, хламидии и др.
Значимость внутриклеточных инфекций в патологии человека еще до конца не изучена, однако именно они являются главными факторами, определяющими внутриутробное поражение плода, нарушение течения беременности и родов, выкидыши, фетопатии, формирование врожденных аномалий.
Клинические проявления внутриутробных инфекций зависят от многих причин, в том числе от срока беременности, в котором был инфицирован плод. При внутриутробном инфицировании в ранние сроки беременности нередко наблюдаются выкидыши, мертворожденность, формируются инфекционные эмбриопатии. Генерализованные формы внутриутробной инфекции чаще развиваются в раннем фетальном периоде (I триместр беременности), так как плод еще не способен локализовать воспалительный процесс. Поэтому исходами беременности в эти сроки могут быть эмбриопатии с развитием грубых пороков развития плода, часто несовместимые с жизнью.
Результаты многих вирусологических и клинико-эпидемиологических обследований детей с врожденными пороками сердца свидетельствуют, что почти у 75 % детей заболевание этиологически связано с трансплацентарной передачей инфекционных агентов от матерей с персистирующей формой соответствующей инфекции. По данным И.М. Охотниковой (2004), у более 50 % детей с врожденными пороками развития выявлено активное течение энтеровирусной, цитомегаловирусной (ЦМВ), герпетической и гриппозной инфекций, у 70 % из них выявлены аномалии развития сердца, при которых наблюдались значимые, обусловленные, в том числе персистенцией вирусов, нарушения функций иммунной системы.
Согласно исследованиям, проведенным в Украине Н.В. Нагорной с соавт. (2005), у 25 % детей с пороками сердца в интраоперационных биоптатах выявляются ДНК герпесвирусных инфекций, что подтверждает их значимость во внутриутробных нарушениях органогенеза.
Инфицирование в более поздние сроки беременности сопровождается задержкой внутриутробного развития плода, его локальными и генерализованными поражениями, тяжелыми заболеваниями новорожденного или его смертью. Во II–III триместре воспалительные изменения носят пролиферативный характер, вызывая сужение или обтурацию каналов и отверстий, приводя к аномальному развитию уже сформировавшихся органов — псевдоуродствам (фиброэластоз сердца, дилатационная кардиомиопатия, гидроцефалия, гидронефроз и т.д.), а также другим признакам поражения (гепатит, миокардит, менингит, менингоэнцефалит).
Огромную роль персистирующая внутриклеточная инфекция играет в развитии миокардитов и формирующихся на их фоне кардиомиопатий. Причем инфекция, перенесенная в I–II триместрах беременности, когда еще отсутствует стандартный воспалительный ответ на инфекционный процесс (в частности, в итоге воспаления нет разрастания фиброзной ткани, а в большей мере наблюдается эластоз), вызывает формирование дилатационной кардиомиопатии; в более поздних сроках внутриутробного развития при сформировавшихся воспалительных реакциях — фиброэластоз сердца.
Перечень этиологических факторов, ответственных за развитие миокардита, включает множество инфекционных, а также ряд неинфекционных агентов. Вызвать миокардит может практически любой инфекционный агент, однако последние данные свидетельствуют, что с каждым годом вирусиндуцированный миокардит встречается все чаще (табл. 1).
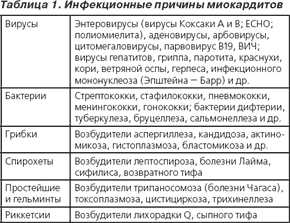
Проведенный молекулярно-биологический анализ эндомиокардиальных биоптатов показывает, что кроме энтеровирусов возбудителями миокардита могут быть также цитомегаловирус, простой герпес 2-го типа, герпесвирус человека 6-го типа, вирус гепатита C, аденовирусы, парвовирус B19. Важная роль, особенно у детей, отводится цитомегаловирусам, способным длительно существовать в организме и активироваться при нарушениях в состоянии иммунитета. Все большее распространение имеют случаи миокардита, ассоциированного с ВИЧ и вирусным гепатитом С. Протозойные и риккетсиозные миокардиты характеризуются рядом особенностей, хотя и встречаются в странах Европы, Северной Америки и Азии крайне редко.
При вирусных миокардитах выделяют фазу репликации вируса (I фаза) с вирусным поражением кардиоцитов. В эту фазу возбудитель может быть выделен из крови и сердечных биоптатов. Далее при хронизации процесса вирусные частицы могут и не обнаруживаться. Основное же значение в патогенезе вирусного поражения миокарда придается следующему за репликацией вируса клеточному и гуморальному ответу, приводящему к гистиолимфоцитарной инфильтрации и повреждению элементов сердечной мышцы (II фаза — аутоиммунная). Доказано, что нарушения иммунной системы приводят либо к длительной персистенции вирусов (до 20 % случаев) с развитием хронического воспаления, либо к формированию вирусобусловленного аутоиммунного процесса в генезе миокардитов и дилатационной кардиомиопатии у детей. В дальнейшем отмечается преобладание дистрофических и фиброзных изменений с формированием дилатационной кардиомиопатии (III фаза). Иногда вирусиндуцированный миокардит развивается в течение нескольких дней и осложняется угрожающей для жизни аритмией или быстро прогрессирующей сердечной недостаточностью. О вирусной природе миокардита следует думать в случаях тотального или регионального нарушения биомеханики стенок сердца, а также при сохранении клинических признаков заболевания, отсутствии положительной динамики в течение нескольких недель или месяцев (табл. 2).
Гистологическое исследование при этом выявляет воспалительную инфильтрацию миокарда, повреждение и некроз кардиомиоцитов с замещением их фиброзной тканью. Инфильтрат обычно состоит из различных типов клеток: лимфоцитов, полиморфонуклеаров, макрофагов, эозинофилов, плазматических и гигантских клеток, причем при вирусном поражении преобладают лимфоциты, а при бактериальном — полиморфноядерные клетки.
Процессы в сердце и сосудах обычно сопровождаются развитием многих признаков иммунного воспаления и могут осложняться инфекцией, вызываемой, в частности, Chlamydia pneumoniae и цитомегаловирусами. Многие виды микробов обладают кардиотропными свойствами за счет токсических либо других факторов.
Инфекционные заболевания, вызываемые аденовирусами, энтеровирусами и цитомегаловирусами, во многих случаях (от 3 до 23, 40 и более 50 % соответственно) сопровождаются поражениями сердца и сосудов: миоперикардитами, кардиомиопатиями и васкулитами. Участие вирусов в патологии сердца и сосудов определяется их тканевым тропизмом, способностью вызывать коагулопатию, геморрагию на фоне формирования иммунодефицитных состояний разной степени выраженности. Кардиотропные вирусы нередко служат причиной миокардита, а при персистенции вирусов и вторичном иммунном ответе на антигенную мимикрию — последующего развития кардиомиопатии, т.е. миокардита, ассоциированного с дисфункцией сердца. Миокардит и кардиомиопатия обычно рассматриваются как фазы острого и хронического органного аутоиммунного заболевания.
Вирусные миокардиты характеризуются преимущественно диффузными поражениями ткани сердца, при которых наряду со снижением сократительной способности сердца и развитием сердечной недостаточности наблюдаются различные виды нарушений ритма и проводимости сердца. Среди причин их возникновения отмечают отек и воспаление мышечной ткани с вторичными изменениями нервных элементов, в последующих стадиях миокардита — склероз с вовлечением в процесс нервных волокон и т.д. В клинико-функциональных исследованиях Н.В. Нагорной с соавт. (2003–2006) у большинства детей с нарушениями ритма сердца и аритмогенными кардиопатиями выявлено рецидивирующее течение различных герпесвирусных инфекций, причем активно текущие инфекции и особенно их ассоциации (вирусы герпеса 1-го и 2-го типа, цитомегаловирус, вирус Эпштейна — Барр) были характерны для больных с тяжелым течением кардиальных проявлений заболевания.
Проведенные нами (Е.И. Юлиш с соавт., 2004–2006) исследования нервных элементов различных органов, в том числе и сердца, при генерализованной цитомегаловирусной инфекции выявили изменения, свидетельствующие о первичности поражения вирусами нервной ткани.
При нейрогистологическом исследовании сердца детей различного возраста, умерших от врожденной цитомегаловирусной инфекции, определялись значимые повреждения нервных волокон, характер и выраженность которых коррелировали со степенью органного поражения и возрастом умершего ребенка. Так, у детей, умерших в первые шесть месяцев после рождения, изменения нервных элементов были преимущественно реактивными: гипо- и гиперимпрегнация, набухание и разволокнение нервных волокон с пролиферацией леммоцитов, извитость нервных стволов (рис. 1–3).
С возрастом ребенка и увеличением длительности активной персистенции ЦМВ-инфекции реактивные изменения становились более глубокими и разнообразными, вплоть до лизиса нервного волокна. У детей, умерших в возрасте 1,5–2 года, в миокарде не только отмечалось увеличение числа измененных нервных проводников (практически все нервные волокна подвержены изменениям, интактных элементов не выявлено), но и менялся характер этих изменений. Значительная часть нервных волокон была некротизирована, причем по самому тяжелому — коагуляционному — типу. Наблюдался распад нервных элементов на отдельные фрагменты, которые подвергались лизису, и на их месте определялись пустые капсулы, выявлялись глиозные узелки, состоящие из клеток леммоцитов, определяющих защиту нервных элементов и при необходимости — их разрушение. Обычно подобная морфологическая картина наблюдается при развитии локального аутоиммунного процесса (рис. 4, 5).

Таким образом, результаты проведенного нейрогистологического исследования цитомегаловирусного поражения нервного аппарата различных органов, в том числе и сердца, а также данные многих авторов о дегенеративном поражении нервных элементов проводящей системы сердца вследствие вирусной персистенции свидетельствуют о возможности первичности инфекции в развитии сердечных аритмий.
Точная диагностика вирусного поражения миокарда возможна лишь при подтверждении вирусного генома путем проведения полимеразной цепной реакции или гибридизации in-situ. Проведение нескольких биопсий (более трех) позволяет снизить вероятность ошибки при исследовании образцов. Uwe Kuhl, один из руководителей Европейского общества кардиологов, отмечает (рис. 6), что комбинация гистологического, иммуногистохимического и молекулярно-биологического методов анализа начала новую эру классифицирования миокардита, основанного по этиопатологическому принципу.
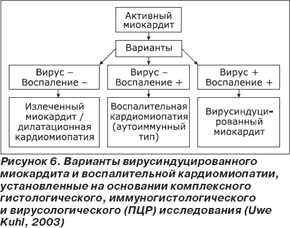
Данный подход позволяет значительно улучшить качество лечения пациентов с заболеваниями сердца. Высокая значимость персистирующих вирусных инфекций в развитии осложнений при миокардитах определили новые подходы и в лечении заболевания. По современным представлениям, лечение вирусного миокардита должно строиться с учетом фазы патологического процесса. В настоящее время изучается возможность использования для лечения вирусных кардитов новых противовирусных и иммуномодулирующих препаратов — специфических иммуноглобулинов, ациклических нуклеозидов, интерферонов, иммуномодуляторов. Мы вправе ожидать обнадеживающих результатов.
Сегодня все чаще диагностируются случаи инфарктов у детей. Считается, что это заболевание встречается значительно чаще, чем принято думать. Известно, например, что при врожденных пороках сердца даже при отсутствии структурных аномалий коронарных сосудов на аутопсии инфарктные участки в миокарде выявляются в 75 % случаев, при этом половина из них могла быть диагностирована клинически. Наиболее частыми причинами инфаркта миокарда являются воспалительные заболевания коронарных артерий — коронариты, часто связанные с неревматическими кардитами при инфекционных заболеваниях, обусловленных в большинстве случаев внутриклеточными инфекционными агентами — вирусами.
Человеческий организм ввиду своей относительной эволюционной молодости еще не успел образовать ни с одним из этих инфектов равновесной системы, что делает их в разной степени патогенными. Однажды заразившись, человек фактически никогда с ними не расстается и всю жизнь носит в себе «неразорвавшуюся бомбу». Даже неактивное, латентное течение «медленных» инфекций таит в себе разной степени патологическое воздействие на организм. В большей степени это касается детского организма, где несформировавшиеся в полной мере системы адаптации легко подвержены неблагоприятным факторам как внешней, так и внутренней среды.
Так, у детей, относящихся к группе часто и длительно болеющих и имеющих латентное течение герпеса 1-го и 2-го типа, цитомегаловирусной инфекции, вируса Эпштейна — Барр, хламидиоза, нами выявлены выраженные изменения в состоянии цитокинового статуса: даже в период клинического благополучия у них наблюдается значимый дисбаланс в соотношении про- и противовоспалительных цитокинов с преобладанием первых, что расценивалось как иммунная напряженность с риском формирования хронического воспалительного процесса.
Наблюдается «омоложение» атеросклероза, происходящее по различным причинам. Атеросклероз сердечно-сосудистой системы является основной причиной смертности населения в развитых странах. Выявлен ряд факторов риска атеросклеротического поражения сосудов, к числу которых относятся наследственность, гиперхолестеринемия, нарушенный обмен веществ, артериальная гипертензия, курение, сахарный диабет, ожирение и гиподинамия. Кроме того, есть определенные основания предполагать, что одним из таких факторов может являться инфекционный процесс. Бактериальная теория атеросклероза, впервые выдвинутая еще более ста лет назад, вновь приобретает все больший научный и практический интерес и имеет ряд доказательств. По данным многих исследований, атеросклероз может быть результатом хронической персистентной инфекции, вызванной Сhl.pneumonia. Главным аргументом в пользу хламидийной этиологии этого заболевания является корреляция сердечно-сосудистой патологии и других атеросклеротических поражений с динамикой выявления специфических антител против Сhl.pneumonia, что было показано в сероэпидемиологических исследованиях, проведенных в Финляндии, Швеции, США, Германии, Великобритании и Нидерландах и основанных на определении IgG и IgA или специфических иммунных комплексов. К настоящему времени проведено около 50 сероэпидемиологических исследований по выявлению противохламидийных антител при различных атеросклеротических заболеваниях. Более чем в 40 исследованиях обнаружена связь между присутствием специфических антител и заболеванием. Частота выявления антител к Сhl.pneumonia у лиц с доказанной сердечно-сосудистой патологией составляла в проведенных исследованиях 80–85 % (рис. 7).
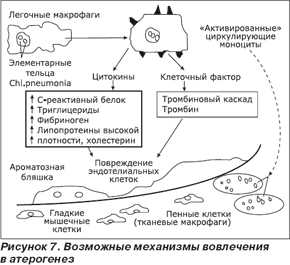
Данный возбудитель удается выявить различными методами (ПЦР, иммуногистология, электронная микроскопия, культуральный метод) из тканей атеросклеротических бляшек стенок артерий при отсутствии такового в нормальной ткани стенок сосудов. Определена возможность инфицирования и размножения Сhl.pneumonia в клетках-мишенях атеросклероза (эндотелий, макрофаги, мышечные клетки) в опытах in vitro при исследовании эндотелиальных клеток сосудов человека, а также при моделировании инфекции у животных (рис. 8).

Отмечено, что хламидийный белок обнаруживается в атеросклеротической бляшке в значительном количестве. Этот белок может являться активным, играя важную роль в атерогенезе, стимулируя выработку макрофагами фактора некроза опухоли альфа и экспрессию металлопротеиназ, желатиназы 92 кДа и способствуя разрушению тканей сосудов. Показано, что эндотелиальные клетки в ответ на проникновение Сhl.pneumonia увеличивают экспрессию генов цитокинов (интерлейкин-1), хемокинов (интерлейкин-8 и моноцитарный хемотоксический протеин-1), клеточных факторов роста (гепаринсвязанный эпидермальноподобный фактор, основной фибробластный фактор и т.д.), внутриклеточных киназ и поверхностных клеточных рецепторов с сигнальной трансдуцирующей активностью. Цитокиновый ответ на проникновение Сhl.pneumonia, по-видимому, может играть важную роль в развитии локального воспаления в местах инфекции (сосуды). Сhl.pneumonia способна инфицировать несколько типов клеток, включая моноцитпроизводные макрофагов, играющих существенную роль в развитии атеросклероза.
Хроническая хламидийная инфекция кардиоваскулярной системы может быть связана с васкулитами. Японскими исследователями показана взаимосвязь между развитием артериальной гипертензии у людей и наличием Сhl.pneumonia. В отличие от пневмоний, вызванных другими возбудителями, при хламидийной пневмонии отмечено снижение количества высоконасыщенных липопротеинов и увеличение триглицеридов, что свидетельствует о значении хламидий в нарушениях липидного обмена. Возможно, изменения в липидном профиле могут лежать в основе связи Сh.pneumonia с ишемической болезнью сердца, что было продемонстрировано в случаях ангиографически подтвержденной ишемической болезни сердца. Как показали исследования, сердечно-сосудистая патология, опосредованная Сhl.pneumonia, индуцируется антигенной мимикрией возбудителя к специфическому протеину сердечной мышцы. Установлено, что Сhl.pneumonia может индуцировать аутоиммунные процессы в сердечной мышце. Нарушение гомеостаза эндотелия в ответ на инфекцию по отношению к прокоагулянтам может приводить к увеличению локального тромбообразования и коронарной болезни сердца.
Отмечено частое присутствие Сhl.pneumonia в живой, репликативной форме в измененных тканях брюшной аорты при аневризме. У изолятов Сhl.pneumonia установлена протеазная активность, которая способствует деструктивному действию данного возбудителя на стенки сосудов.
В настоящее время проводятся по крайней мере два клинических испытания, которые могут дать ответ на вопрос, может ли применение антибиотиков замедлить развитие коронарной патологии. Это WIZARD-испытания, спонсируемые «Pfizer Co», и ACES-испытания, проводимые «National Heart Lung and Blood Institute». В испытаниях участвуют 4000 пациентов с доказанной сердечно-сосудистой патологией, которые наблюдаются на протяжении четырех лет с момента начала испытаний. В качестве антибиотика в обоих испытаниях используется азитромицин.
Таким образом, исследования различных авторов показывают, что колонизация Сhl.pneumonia стенок артерии при хроническом инфекционном процессе приводит к дисфункции и нарушению гомеостаза эндотелия сосудов, способствуя развитию атеросклеротического процесса и хронической сердечно-сосудистой патологии. Этому, возможно, способствует неоднократное в течение жизни реинфицирование человека Сhl.pneumonia, которое приводит к активации вялотекущего аутоиммунного процесса, поддерживая таким образом интрамуральный хронический воспалительный процесс.
Возможно, что не только Сhl.pneumonia, но и другие возбудители в атеросклеротической бляшке, такие как цитомегаловирус, вирус герпеса, Porphyromonas gingivalis и Streptococcus sanguis, могут вызывать повреждение клеток сосудов, приводя в дальнейшем, в ассоциации с классическими факторами риска, к развитию сердечно-сосудистой патологии и появлению атеросклеротических изменений в сосудах. По данным отечественного ученого И.М. Ганджа, значительно более выраженное развитие атероматоза аорты наблюдается у кроликов, предварительно зараженных вирусом простого герпеса. По его мнению, разрушению атеросклеротической бляшки способствует возникшая воспалительная реакция в стенке бляшки, связанная с вирусной инфекцией, которая приводит к разрыву стенки с последующим в этом месте тромбообразованием, в результате чего развивается инфаркт миокарда. Академик Е.И. Чазов придает цитомегаловирусной инфекции большую роль в процессах атерогенеза. В знаменитой Robbins Pathologic basis of disease (2000), по которой учится большинство врачей Запада, декларируется: «Атеросклероз есть хронический воспалительный ответ артериальной стенки, инициированный некоторыми формами повреждения эндотелия».
Далеко не все в приложениях теории воспаления к атеросклерозу очевидно, многое непонятно, еще больше спекуляций. Но сам факт признания явления эпохален. Он объясняет смелые гипотезы и накопившиеся эмпирические факты, в том числе в успехах лечения больных. С ним связаны надежды и планы на более успешное продвижение в ближайшем будущем.
Немалое значение придается сегодня персистирующей внутриклеточной инфекции в развитии системных заболеваний соединительной ткани, васкулитов, артритов и т.д. Не умаляя роли факторов наследственности, иммунных дефектов, структурных и биохимических изменений соединительной ткани, обнаруживаются тесные причинно-следственные связи между персистенцией внутриклеточных инфекций и коллагенозами. Это может быть связано с тем, что в результате взаимодействия микоплазм, хламидий, герпесвирусов с клетками соединительной ткани наблюдаются изменения антигенного профиля структур взаимодействующих мембран и, как следствие, индукция различных аутоиммунных реакций. Кроме того, наши исследования иммунного профиля больных с генерализованной формой этих инфекций у детей раннего возраста и данные морфологического изучения органов иммуногенеза свидетельствуют о формировании не только иммунодефицита, но и начальных стадий аутоиммунного процесса.
В исследованиях, проведенных в Институте ревматологии РАМН (Москва), получены данные о значимой роли герпесвирусов в развитии диффузных заболеваний соединительной ткани – коллагенозов. В частности, вирус запускает каскад биохимических реакций и таким образом оказывает влияние на важнейшие звенья иммунной системы — неспецифическую резистентность и антигенспецифический иммунный ответ, что может быть причиной развития аутоиммунных реакций и формирования аутоиммунных заболеваний. В этих случаях специфический антиген (вирус) рассматривается как запускающий фактор прямого или опосредованного взаимодействия с иммунокомпетентными клетками с дисрегуляцией в иммунной системе. При этом вирусы могут модулировать продукцию цитокинов, например ИЛ-6, продукция которого при коллагенозах значимо повышена. При этом нуклеарный фактор, контролируемый ИЛ-6 (NF-IL6), вовлеченный в транскрипторную регуляцию генов белков острой фазы, распознает элементы капсидной оболочки вирусов, как и ИЛ-6. Кроме того, воздействие вирусов на иммунную систему способно индуцировать синтез интерферона (ИФН)g и других провоспалительных цитокинов, например TNF, на фоне сниженной продукции эндогенного ИНФ. Совместно они усиливают экспрессию МНС 1-го класса, которая в связи с аутореактивными Т-клетками может приводить к расширенному повреждению ткани, вызванному CD+8 цитотоксическими Т-лимфоцитами. Получены данные об индукции вирусом Эпштейна — Барр (ВЭБ) синтеза IgM-ревматоидного фактора у здоровых лиц и в значительно большей степени — у больных ревматоидным артритом. Повышенный уровень антител к вирус-капсидному антигену ВЭБ в сыворотке и синовиальной жидкости при ревматоидном артрите и системной красной волчанке отражает усиленную пролиферацию инфицированных ВЭБ клонов В-клеток, возникающую в результате активации латентной инфекции.
Еще один механизм, по которому вирусы могут запускать аутоиммунный процесс, заключается в синтезе антивирусных антител, которые, являясь основной защитой организма, при определенных ситуациях могут оказывать повреждающее действие по отношению к клеткам хозяина (перекрестные реакции между вирусными и собственными антигенами, т.е. молекулярная мимикрия). Многие вирусы имеют сходные антигенные (пептидные) последовательности с клетками хозяина, что может быть в итоге случайным совпадением или результатом инкорпорации части вирусного белка при вирусной репликации в ДНК хозяина.
При хроническом воспалении, обусловленном персистенцией латентной инфекции, в периоде репарации наблюдается формирование соединительной ткани в основном за счет коллагена III типа, значительно реже — I типа, иногда — V типа. Коллаген IV типа, характерный для нормальной базальной мембраны эпидермиса, при этом не формируется. Развитие таких процессов в различных органах и структурах (сердце, сосуды, печень, почки, нервная система и т.д.) может привести к склерозированию, дистрофическим процессам и т.д. Изменения в сосудах, их эндотелиальной выстилке, структурах соединительной ткани на фоне перманентного воздействия персистирующей внутриклеточной инфекции и явились основанием инфекционной теории возникновения многих так называемых соматических заболеваний, в том числе и патологии сердечно-сосудистой системы. Так, при электронной микроскопии сосудистой стенки артериол и венул детей, умерших вследствие генерализованной цитомегаловирусной инфекции, выявляются продуктивный васкулит в стенках сосудов, пролиферация и дисфункции эндотелия в более крупных сосудах, вплоть до облитерации их просвета, деструкция эндотелия и нередко — процессы некробиоза.
Таким образом, накоплено немало данных об участии персистирующей внутриклеточной инфекции не только в формировании врожденных пороков сердца и сосудов, в развитии постмиокардических воспалительных, в том числе и аритмогенных, кардиомиопатий, атеросклеротических поражений сосудов, но и в генезе системных заболеваний соединительной ткани. Это определяет необходимость включения дополнительных методов диагностики при сердечно-сосудистой патологии у детей, особенно в случаях ее торпидного и резистентного к лечению течения, и включения в комплекс реабилитации специфической этио- и иммунотропной терапии.
Внутриклеточные паразиты: вирусы и микробы
Кроме паразитов, паразитирующих в органах или на кожных покровах, есть ещё одна большая группа паразитов – микроорганизм. Они могут вызывать различные сбои в здоровье человека, начиная от самых безобидных и заканчивая несовместимыми с жизнью. Чтобы понимать, какую опасность они несут и что собой представляют, нужно подробнее ознакомиться с внутриклеточными паразитами: микробами, вирусами и бактериями.
Особенности терминологии
Общаясь с терапевтами, паразитологами и другими врачами, человеку, далёкому от микробиологии, сложно разобраться, чем принципиально отличаются понятия микробы, вирусы и бактерии. Многие из них способны вести образ жизни паразитов, но далеко не все. Некоторые не несут для человека никакой опасности, так как паразитируют, например, в растительных, а не животных клетках.

Даже те микроорганизмы, которые живут в клетках животных, не всегда становятся паразитами человека. Многие из них проявляют узкую видовую избирательность: могут паразитировать только у представителей одного или нескольких определённых видов.
Чаще всего врачи, имеющие дело с подобными заболеваниями, упоминают микробы, бактерии и вирусы. Все эти группы могут быть облигатными – это означает, что выполнение их жизненных функций возможно только в клетках хозяина, то есть, человека.
Микробы
Первым учёным, догадавшимся, что многие заболевания вызывают невидимые глазу частички, был Гиппократ. Произошло это 3 тыс. лет тому назад. К сожалению, во времена его жизни увеличительной техники, которая могла бы подтвердить эту догадку, ещё не существовало, поэтому человечество смогло убедиться в существовании таких живых частиц лишь после того, как Левенгук 400 лет назад изобрёл микроскоп.
Обнаруженные организмы в 1878 году начали называть микробами, а сейчас они известны всем из школьного курса биологии как микроорганизмы. Увидеть их невооружённым взглядом невозможно, поэтому долгое время диагностика заболеваний, вызванных этими внутриклеточными паразитами, была очень проблематичной. Все микробы имеют размер не более 0,1 мм.
К микробам относят микроорганизмы, не имеющие ядра (например, бактерии), и ядерные эукариоты (грибы и протисты). Следует отметить отдельно, что вирусы к микробам не относятся, они выделяются специалистами в отдельную группу.
Подробным изучением микробов занимаются микробиологи. Учёные объясняют, что эти формы жизни появились задолго до того, как на Земле возникли более сложные организмы, поэтому к паразитизму такие микробы пришли, как к вторичной форме существования. Чтобы подробно изучить микробы, являющиеся внутриклеточными паразитами, понадобилось не одно десятилетие.
Многие микробы, живущие в клетках тела человека, являются симбионтами: они сосуществуют в организме, не вызывая никакого ухудшения самочувствия. Понижение количества таких симбиотических организмов нередко возникает на фоне болезни.

Некоторые из микробов являются условно-патогенными. Это означает, что они могут существовать, как симбионты, а могут провоцировать заболевания. Чаще всего такие изменения происходят после нарушения биологического баланса в организме, например, после болезни, употребления тяжёлых антибиотиков и пр.
Бактерии
Те бактерии, которые являются внутриклеточными паразитами, в медицине называются патогенами. Они вызывают инфекции, подрывающие иммунную систему или приводящие к очень тяжёлым последствиям вплоть до смерти человека. Болезни, вызываемые такими микроорганизмами, были подробно описаны в медицине намного раньше, чем микробиологи смогли обнаружить их возбудителей.
Среди бактерий, являющихся внутриклеточными патогенами, есть и те, что вызывают болезни только у людей с нарушениями иммунодефицита или с муковисцидозом.
Для лечения патологий, вызванных такими бактериями, применяют антибиотики и бактериостатики. Антибиотики убивают этих патогенов, в то время, как бактериостатики лишь приостанавливают их развитие.
Самые распространённые внутриклеточные паразиты из группы бактерий – это хламидии, эрлихии и риккетсии.
Хламидии
Хламидии – неподвижные кокки, которые даже при неблагоприятных условиях не могут образовывать спор и капсул, как многие виды бактерий. Несмотря на это, они очень жизнеспособны и устойчивы.
Особенностью хламидий является то, что они не могут самостоятельно синтезировать АТФ, поэтому, чтобы обеспечить энергией свои структуры, они черпают энергию из клетки хозяина.
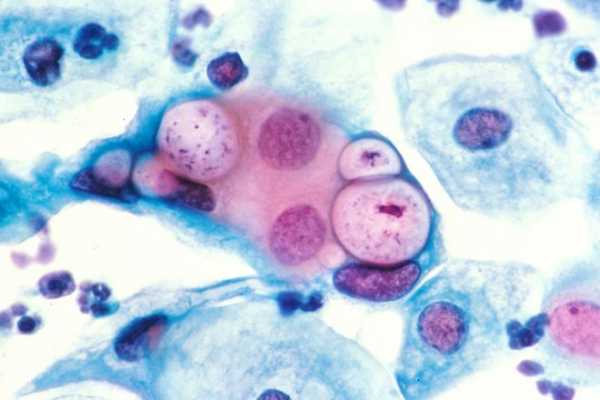
Размножение этих внутриклеточных микроорганизмов происходит внутри клеточной цитоплазмы. Здесь они могут расти и плодиться. Вне клетки они принимают сферическую форму, диаметр хламидии в таких условиях становится всего 0,3 мкм. После попадания в клетку патоген сразу расширяется, становится крупнее и активно делится. Внутри цитоплазмы образовываются целые колонии. Потом они снова выходят из материнской клетки и заселяют новые. Жизненный цикл этих паразитов происходит циклично и составляет 40-70 часов.
Хламидии, которые выступают в роли внутриклеточных патогенов:
- Psittaci – приводят к орнитозу. Болезнь проходит остро, с лихорадкой, сильной интоксикацией, поражением ЦНС, увеличением печени. Источник заражения – птицы. Человек получает бактерии вместе с вдыхаемым воздухом, они оседают в бронхах или в лёгких. Паразиты могут вызывать развитие пневмонии, менингит, эндокардит, гепатит и пр.
- Pneumoniae – вызывает бронхопневмонию. Передаётся воздушно-капельным путём.
- Trachomatis – провоцирует трахому (воспаление конъюнктивы вплоть до потери зрения), венерическую лимфогранулему, урогенитальный хламидиоз. Без соответствующего лечения, болезни, вызванные отдельными штаммами хламидий, могут привести к бесплодию.
Риккетсии
Размер риккетсий не превышает 1 мкм, в очень редких случаях встречаются формы размером до 40 мкм. Капсулы и споры эти паразиты не образуют.
Паразитируют внутри клетки, так как неспособны вырабатывать НАД – кофермент, необходимый для существования всем живым организмам. Чтобы выращивать риккетсий в лабораторных условиях, применяют эмбрионы курицы или клетки млекопитающих.
При попадании в организм эти бактерии вызывают риккетсиозы. Они могут отличаться симптомами в зависимости от того, какой штамм бактерий этого вида размножается в клетках. Большинство из них вызывают различные поражения капилляров, сыпь, лихорадку и пр. Источниками заражения этих внутриклеточных микроорганизмов являются клещи, блохи и вши.

Среди самых распространённых риккетсий, которые являются внутриклеточными паразитами человека, выделяют такие:
- Prowazekii – вызывает сыпной тиф. Источником заражения выступают грызуны, такие как крысы или мыши, а переносчиками – насекомые, живущие на этих грызунах. Заражённый человек тоже становится источником заражения, нередко такой тиф принимает форму эпидемии.
- Typhi – заражение осуществляется при укусах насекомых, живущих на грызунах.
- Sibirica – переносчиком выступают иксодовые клещи. Инфекция встречается в североазиатских районах.
- Conorii – вызывает средиземноморскую лихорадку. Заражение происходит при укусах насекомых. Вспышки наблюдаются в прибрежных районах Чёрного, Средиземного и Каспийского моря.
- Tsutsugamushi – при попадании в организм провоцирует лихорадку цуцугамуши. Промежуточным хозяином этого паразита являются грызуны, а переносчиками – клещи-краснотелки.
- Burnetii – провоцирует начало ку-лихорадки. Попадает в организм человека с клещами, которые водятся у домашних птиц и животных. Распространяется как воздушно-капельным путём, так и при укусах. Иногда возможна передача бактерий при употреблении продуктов (молока или сырого мяса). Чаще всего болезнь протекает в форме пневмонии.
Эрлихии
Внутриклеточные бактерии рода Ehrlichia – приводят к поражению гранулоцитов и других форменных элементов крови. При отсутствии лечения это заканчивается дефицитом иммунитета. Болезнь, провоцируемая наличием этих микробов в организме человека, называется эрлихиоз.
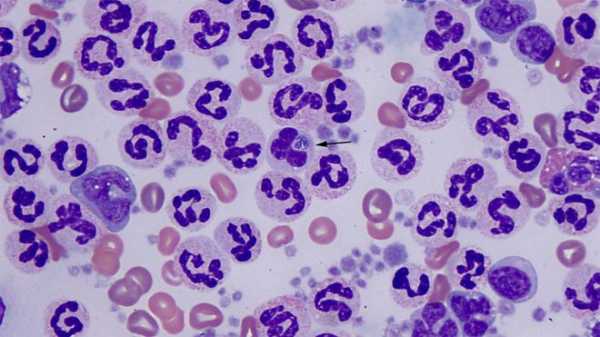
Она сопровождается высокой температурой, головной болью, миалгией, надрывным сухим кашлем, появлением сыпи на коже.
Вирусы
Эта группа включает в себя неклеточных инфекционных агентов. Их особенность заключается в том, что признаки живой природы они проявляют, только находясь внутри клетки. Для проникновения вирус находит специфическую мишень – отдельный рецептор на клеточной поверхности.
После того, как эти внутриклеточные паразиты попадают в организм, их, как и любые инородные организмы, поглощают макрофаги. Вирус вместе с ними проникает в кровоток и разносится по организму, пока не попадёт в те органы или ткани, где будет развиваться и размножаться.
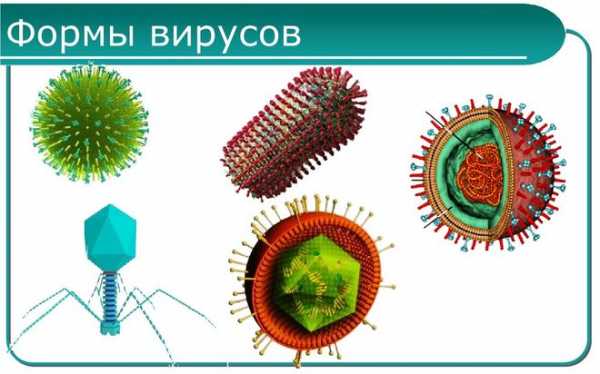
Внутриклеточные вирусы проявляют активность только внутри клетки хозяина. Но организм имеет защитные механизмы, заключающиеся в выработке интерферонов – это такие специальные белки иммунной системы. Они вырабатываются в трёх формах:
- Альфа-интерфероны – направлены на стимуляцию выработки лейкоцитов и снижения опухолевой активности;
- Бета-интерфероны – активизируют синтез фибробластов и соединительных тканей;
- Гамма-интерфероны – направлены на синтез Т-клеток.
Вирусы встраиваются в ДНК клетки и на генетическом уровне и заставляют их полностью изменить свою генетическую программу, то есть реализовать не то, что заложено в генах клетки, а то, что привнёс внутриклеточный вирус.
Самые опасные для человека следующие вирусы:
- Эбола. Изначально появился в Африке, а затем продвинулся в направлении Европы и Америки. Второе название болезни Эбола – геморрагическая лихорадка. Поскольку путешествия и перенос биологического материала охватывает огромные территории, которые раньше были защищены из-за своей отдалённости, то учёные предупреждают, что ни одна страна сейчас не может гарантировать того, что в ней в ближайшее время не начнётся эпидемия вируса Эболы.
- Бешенство. Этому вирусу подвержены как люди, так и животные. Заболевание в короткие сроки провоцирует поражение ЦНС. При вакцинации во время инкубационного периода у пациента вырабатывается иммунитет к бешенству, но если уже появились симптомы этой болезни, то вакцина не поможет.
- ВИЧ. Прозван чумой XX столетия, поскольку вызывает синдром иммунодефицита, который сказывается на работе всего организма. Даже самая незначительная инфекция при СПИДе становится причиной смерти. На данный момент вакцины от ВИЧ не существует.
- Натуральная оспа. Болезнь описана ещё в IV тысячелетии до н.э., но её причину удалось установить только в XX веке. Существует две разновидности, одна из которых вызывает летальный исход только в 3% случаев, а вторая – в 90%.
- Грипп. Человек заражается воздушно-капельным путём. Нередко возникают эпидемии гриппа, а иногда – пандемии. Фармацевтика предлагает огромное количество препаратов от этого внутриклеточного вируса, но самым эффективным на данный момент является прививание.
- Гепатит. Приводит к поражению печени. Существует в двух формах – В и С. Может перейти в хроническую форму или привести к таким тяжёлым осложнениям, как цирроз или рак печени.
- Ротавирус. Вызывает острую кишечную инфекцию. Главная опасность кроется в сильном обезвоживании, которое развивается за несколько часов. В странах, где медицина не развита, уносит огромное количество жизней каждый год.
Читайте также:
Внутриклеточные паразиты / Здоровье / Независимая газета
Каждый год в большинстве стран мира разражается эпидемия гриппа. Эта болезнь, и особенно ее осложнения уносят жизни многих тысяч людей. В Соединенных Штатах ежегодно заболевают гриппом от 25 до 55 млн. человек, во Франции – около 4 млн., в Германии – также примерно 4 млн. Грипп, которым болел не один раз каждый человек, опасен прежде всего своими осложнениями: пневмониями, бронхитами, отитами, обострениями хронических заболеваний. Такая опасность угрожает в первую очередь детям и пожилым людям, которым рекомендуется обязательно делать прививку. Во многих регионах, в том числе в Москве, им проводится бесплатная вакцинация отечественной противогриппозной вакциной.
Возбудители гриппа – вирусы. Вирусы являются неклеточной формой жизни. Один из микробиологов назвал их дурной шуткой эволюции. Размножаться они могут только внутри живых клеток того организма, в который внедрились. В сущности, вирусы – это внутриклеточные паразиты на генетическом уровне. Их природа препятствует созданию препарата, который излечивал бы болезнь, убивая вирусы. Самая действенная мера борьбы с вирусными заболеваниями, в том числе и с гриппом, – вакцинация. Сложность заключается в том, что вирус гриппа чрезвычайно изменчив. Каждый год в лабораториях Всемирной организации здравоохранения определяется циркулирующий в данное время штамм вируса и на основе его изготовляется вакцина.
Временами эпидемия гриппа приобретает страшный размах, захватывая едва ли не все страны мира, и приводит к гибели множества людей. Пандемии 1918, 1957 и 1968 годов стоили миллионов жизней. «Испанка» 1918 г. унесла больше жизней, чем Первая мировая война. Пандемии гриппа А, возникающие с интервалом в несколько лет или несколько десятков лет, обусловлены переносом на человека генов H (гемагглютинин) и N (нейраминаза) вирусов гриппа птиц.
Уже несколько лет Всемирная организация здравоохранения предупреждает о возможности пандемии гриппа. Медики опасаются появления смертельно опасного вируса, появившегося в результате смешения возбудителей человеческого и птичьего гриппа. С 1997 года неоднократно подтверждалась способность вируса гриппа птиц штамма H5N1 заражать людей, вызывая тяжелое заболевание с большой летальностью. В декабре 2003 года началось распространение птичьего гриппа по разным странам. Во всем мире ведутся работы по созданию вакцины против птичьего гриппа. И она будет создана. Но, как говорят эксперты, ни одна страна не станет продавать свою вакцину другой, пока не обеспечит собственное население, не станет и делиться своими производственными секретами: это рынок.
В России близка к завершению разработка вакцины против птичьего гриппа. ВОЗ передала штамм H5N1. Но проблема осложняется чрезвычайной изменчивостью гриппозного вируса. Штамм, который может вызывать эпидемию, неизвестен. Поэтому логично сделать несколько вакцин. На федеральном государственном предприятии «Микроген» разработано четыре прототипа вакцин с двумя разными модельными штаммами. В марте начнутся клинические испытания на добровольцах. В ходе клинических исследований будут подобраны оптимальные прививочные дозы вакцин, обеспечивающие надежную выработку у человека иммунитета против птичьего гриппа. К середине лета вакцина против птичьего гриппа получит все необходимые заключения контрольных органов. Разработанные технологии, по словам профессора Антона Катлинского, позволят в случае начала пандемии немедленно начать массовое производство вакцины против того штамма, который может вызвать заболевание. А вакцины потребуется много. Сохранившаяся в России государственная промышленность, решающая проблему биобезопасности, в силах справиться с этой задачей.
А что же пока? Пока, говорит директор Института вакцин и сывороток академик РАМН Виталий Зверев, проблема только ветеринарная. Заболевания пернатых обнаружены в шести регионах России. Принимаются радикальные меры против распространения инфекции среди птиц. Что касается людей, то нет никаких оснований для паники. Штамм прошел две трети пути по превращению в опасную для человека разновидность. До осени штамм, представляющий опасность для человека, не появится. Следует иметь в виду также, что заболевания в Юго-Восточной Азии обусловлены тем, что люди в странах этого региона живут в тесном контакте с птицей, и местными обычаями: во Вьетнаме, например, пьют кровь только что забитой птицы.
В России сезон гриппа – обычного, а не птичьего – отодвинулся благодаря морозам. И если кто-то заболеет, не следует подозревать птичий грипп. Надо лечиться, как принято, остаться дома, вызвать врача, который назначит лекарства. Хороши при гриппе и простуде народные средства. Не нужно, преодолевая себя, переносить болезнь на ногах. Это грозит осложнениями для больного и заражением окружающих. Но не только. В Германии немецкие автомобильные эксперты в очередной раз предупредили водителей при гриппе и ОРЗ не садиться за руль автомобиля. Эти недомогания и медикаменты, применяемые для лечения, по влиянию на организм напоминают последствия от употребления алкоголя и могут привести к существенному замедлению реакции и снижению концентрации внимания, что создает повышенную опасность аварии.
Комментарии для элемента не найдены.
Клинико-лабораторная характеристика персистирующих инфекций хламидийной и микоплазменной этиологии у детей | #01/11
В начале ХХ века ведущая роль принадлежала инфекциям бактериальной природы (скарлатина, дифтерия, коклюш, дизентерия). В структуре заболеваемости у детей преобладают острые инфекции верхних дыхательных путей различной этиологии. Латентные и персистирующие формы инфекций у детей остаются малоизученными. Актуальность изучения перинатальных инфекций обусловлена широкой циркуляцией возбудителей в популяции и высокой частотой передачи их ребенку от матери (В. А. Исаков с соавт., 2006). Наряду с острым течением инфекции, у ребенка может наблюдаться длительная персистенция возбудителя с формированием медленно текущего хронического инфекционного процесса. Атипичность клинических проявлений при внутриутробном заражении плода, трудность лабораторного диагноза и низкий уровень информированности врачей приводят к поздней диагностике внутриутробных инфекций у детей.
Персистирующие и латентные инфекции довольно широко распространены, однако до сих пор их последствия для будущего здоровья детей педиатрами явно недооцениваются. Чаще всего у детей они развиваются при инфицировании внутриклеточными возбудителями (хламидии, микоплазмы). Из инфекций, способных дать персистенцию на длительный срок жизни ребенка, все чаще выявляются вирусы семейства герпес. Персистирующими инфекциями именуют такие формы заболеваний, при которых после перенесенной инфекции не наступает очищения от инфекционного патогена, нередко возбудители инфекции длительно пребывают в латентном («дремлющем») состоянии либо при неблагоприятном состоянии макроорганизма способны реактивироваться с появлением новых клинических доминант.
Хламидийная инфекция. Хламидии вызывают значительно большее число болезней, чем считалось ранее. Доказана роль отдельных представителей семейства хламидий в репродуктивном здоровье женщин и формировании патологии плода и новорожденного. Заражение хламидиями возможно различными путями, в том числе воздушно-капельным, контактным, анте- и интранатальным. Восприимчивость к хламидиям всеобщая. Перенесенная инфекция не обеспечивает пожизненного иммунитета. Основной особенностью хламидий является внутриклеточный паразитизм. Хламидии обладают тропизмом к эпителиальным клеткам конъюнктивы глаз, легких и мочеполовой системы.
При нормальном противоинфекционном иммунитете большинство хламидий уничтожаются фагоцитами хозяина. Однако внутриклеточные патогены обладают способностью блокировать механизмы иммунной защиты, вследствие чего клетки хозяина не только не уничтожают хламидии, но и способствуют их росту и размножению. У матери хламидии колонизируют различные органы плода: конъюнктивы, носоглотку, среднее ухо, дыхательные пути, кишечник, вызывая их поражение. Наиболее тяжелые формы поражения хламидиями связаны с восходящим инфицированием плода. Возможность гематогенного инфицирования хламидиями подтверждается обнаружением во внутрибрюшинных отделах пупочных сосудов лимфогистиоцитарных перифлебитов, реже — периартериитов. При генерализованном инфицировании развиваются комплексные патологические изменения в виде отечно-геморрагического синдрома, синдрома дыхательных расстройств, кровоизлияний в желудочки мозга. Пневмонии хламидийной этиологии у новорожденных детей характеризуются интерстиционально-десквамативным процессом.
Клинически хламидийная инфекция у новорожденных проявляется в виде конъюнктивита, назофарингита, бронхита, пневмонии, гастроэнтерита, проктита, вульвита, уретрита, менингита, миокардита, реактивного артрита. Хламидиоз новорожденных может протекать в острой и хронической форме, возможна персистенция возбудителя. У детей старшего возраста инфицированность хламидиями с высокой частотой выявляется при хронических заболеваниях носоглотки и придаточных пазух носа. У детей с ЛОР-патологией из организованных коллективов хламидийная инфекция выявлялась у 21% пациентов, у больных, находящихся на стационарном лечении в ЛОР-отделении, хламидийная инфекция обнаруживалась в два раза чаще (Т. А. Капустина с соавт., 2007). В последнее время отмечают высокую частоту респираторного хламидиоза у больных бронхиальной астмой (25,9%), особенно при ее тяжелом течении. У детей с рецидивирующими и хроническими бронхитами респираторная хламидийная инфекция обнаруживается чаще, чем при бронхиальной астме, — 35% (Т. В. Спивак, Л. К. Катосова, 2009).
Диагностика. Для лабораторной диагностики у новорожденных используют отделяемые, смывы, мазки-отпечатки, соскобы с участков слизистой оболочки.
Цитологический метод заключается в обнаружении цитоплазматических включений хламидий в эпителиальных клетках препаратов, окрашенных по методу Романовского–Гимзы. Иммунофлюоресцентный метод — окрашивание хламидийных антигенов иммунофлюоресцентными красителями на основе моноклональных антител. Иммунофлюоресцентный метод позволяет выявлять возбудителя в конъюнктивальных, урогенитальных, ректальных и назофаренгеальных образцах.
Иммуноферментный анализ (ИФА): материалом для ИФА является кровь пациента, в которой определяются специфические антитела класса IgG, IgM. При подозрении на хламидийную инфекцию — диагностическое значение имеет обнаружение у ребенка антител класса IgM в титре выше 1:8, а также IgG-антител в титрах выше, чем у его матери (обычно выше 1:64), что свидетельствует об активной инфекции. Лабораторная диагностика базируется на выявлении антител класса IgM, тогда как IgG-антитела свидетельствуют о прошлой инфекции, а при высоких титрах IgA-антител — о реинфекции (А. А. Баранов, 2007). Метод полимеразной цепной реакции (ПЦР) основан на ферментативном размножении специфического участка ДНК (амплификации), носящего экспоненциальный характер за счет многократного повторения циклов ДНК-полимеразной реакции и температурной денатурации двухцепочечных фрагментов ДНК. Выделение ДНК хламидий у новорожденных проводится из крови, мочи и трахеобронхиальных аспиратов. Для повышения достоверности диагностики принято использовать не менее двух методов исследования.
Лечение хламидийной инфекции. Лечение хламидиозов сложное, длительное и не всегда успешное, что связано с присутствием ассоциированных инфекций, резистентностью хламидий к антибиотикам, наличием персистирующих форм и иммунодефицитного состояния больных. Для лечения используются антибиотики группы макролидов. Они относятся к числу тканевых антибиотиков, так как их концентрация в тканях значительно выше сывороточных. Новые макролиды — азитромицин (Сумамед), рокситромицин, отличаются хорошим всасыванием в желудочно-кишечном тракте, а также пролонгированным действием. При хламидийной инфекции у новорожденных проводится лечение эритромицином в течение 14 дней или Сумамедом. Короткие курсы лечения Сумамедом связаны с тем, что препарат сохраняется в бактерицидных концентрациях в очаге воспаления 5–7 дней после приема последней дозы.
Наиболее используемыми остаются 10–14-дневные курсы для лечения острой хламидийной инфекции и ее реинфекции. Перспективным методом лечения является «пульс-терапия» азитромицином. При «пульс-терапии» азитромицин назначается в дозе 10 мг/кг массы тела 1 раз в день по схеме 1–7–14 день или по второй схеме: 10 мг/кг массы тела 1 раз в день 3 дня подряд (4 дня перерыв) в течение 3 недель, что позволяет охватить несколько циклов генераций хламидий. При конъюнктивите новорожденных назначают эритромициновую глазную мазь и капли левомицетина в сочетании с приемом эритромицина внутрь. Низкая иммунологическая резистентность новорожденных с внутриутробным хламидиозом делает необходимым применение иммуномодуляторов. Такими препаратами являются интерфероны. Эффективно применение Виферона-1 в течение 10 дней. Виферон совместим со всеми лекарственными средствами, применяемыми для лечения хламидийной инфекции, при этом его длительное назначение три раза в неделю через день в течение месяца способствует нормализации микрофлоры кишечника. Важное место в лечении хламидийной инфекции должно отводиться применению в возрастных дозировках бифидум- и лактосодержащих пробиотиков.
Микоплазмоз. Этой инфекцией обусловлена значительная часть мертворождений, преждевременных родов и рождения больных детей. Акушерскую и педиатрическую патологию чаще всего вызывают следующие штаммы микоплазм: Mycoplasma pneumoniae, M. hominis, M. urealiticum. Микоплазмы представляют отдельный класс возбудителей Mollicutes, характеризующийся отсутствием ригидной клеточной оболочки, выраженным полиморфизмом, способностью к репродукции. Микоплазмы имеют высокую степень адгезии к клеточной мембране, а также механизм мимикрии под антигенный состав клетки-хозяина, что способствует длительной персистенции и снижению эффективности иммунной защиты и соответственно суперинфекции другими микроорганизмами.
При гистологическом исследовании плаценты выявляются характерные для микоплазменной инфекции изменения децидуальных клеток и периферического трофобласта (В. А. Цинзерлинг, В. Ф. Мельникова, 2002). При микоплазменном поражении последа наиболее отчетливо изменяются сосуды, что свидетельствует о важности гематогенного распространения микоплазм по плаценте.
Диагностические трудности представляют ситуации, когда в анамнезе конкретной беременности у женщины как будто нет типичных нарушений, она не переносила респираторных заболеваний, не было токсикоза, ребенок родился жизнеспособным, с хорошими показателями по шкале Апгар, нормальной массой и длиной тела. В постнатальном анамнезе у детей, если они инфицированы микоплазмами, могут появляться симптомы угнетения ЦНС, возникают респираторные заболевания, отиты, инфекции мочевыводящих путей (пиелонефриты). Поэтому в подобных случаях важно оценивать гистологический анализ плаценты.
Диагностика. Стандартом диагностики микоплазмоза является ИФА с сероконверсией IgG, IgM. Материалом для исследования является кровь ребенка, смывы с задней стенки глотки, наружных половых органов, стенок влагалища, первая порция свежевыпущенной мочи. Для ПЦР-анализа используется кровь ребенка, секрет с задней стенки глотки, мазок со стенок влагалища.
Лечение микоплазменной инфекции у детей практически не отличается от лечения хламидийной инфекции: принципы назначения макролидных антибиотиков, их суточные дозы, режим введения, длительность курса и терапия сопровождения аналогичны описанным выше. Назначение азитромицина тормозит рост M. hominis и M. urealiticum. Рост обеих микоплазм тормозят также левомицетин и особенно тетрациклины (доксициклин), а также ципрофлоксацин, но ввиду побочных эффектов и возрастных ограничений их рекомендуют назначать лишь при микоплазменных менингоэнцефалитах и тяжелых пневмониях (Н. П. Шабалов, 2002).
Под нашим наблюдением находилось 80 детей первых двух лет жизни, у которых было выявлено внутриутробное инфицирование. Преобладали пациенты первого года жизни — 68 детей (85%), старше года было 12 больных (15%). В комплекс обследования детей включались оценка клинико-анамнестических данных, анализа крови, мочи, УЗИ брюшной полости, УЗИ мозга, биохимические печеночные и почечные тесты (по показаниям), ИФА на внутриутробные инфекции, ПЦР-тесты слизи из зева на хламидии, микоплазмы, герпесвирусы, ИФА кала на ротавирусы и бактериологические посевы кала на острые кишечные инфекции.
Беременность и роды у большинства матерей наблюдаемых детей были осложненными. Токсикозы беременности и угроза выкидыша наблюдались у 38,8% и 28% матерей, гипоксия плода в родах и многоводие — соответственно у 38,8% и 16,2%, отслойка плаценты и кесарево сечение — у 17,5%. У 19 беременных женщин (24%) были различные соматические заболевания. У 52 женщин (64,9%) были выявлены инфекции: хламидийная и микоплазменная инфекция (у 35 и 16 беременных соответственно) и у 8,7% — герпесвирусные инфекции.
Заподозрить внутриутробные инфекции у наблюдаемых детей можно было в более ранние сроки их жизни, в первую очередь по высокой степени поражения у них различных органов и систем: ЦНС (54,2%), органов дыхания (48,2%), желудочно-кишечного тракта (96,3%), глаз и слезного канала (39,7%), лимфатического аппарата (4,8%). Однако диагноз хламидийной инфекции в предшествующий период их наблюдения был поставлен только трем детям из 80. Обращало на себя внимание значительное отклонение в клинических анализах крови: анемизация (30,6%), лейкопения с лимфоцитозом (42%), нейтропения (15%), ускорение СОЭ (29,8%), что в совокупности свидетельствовало о наличии воспалительного процесса в организме и выраженном снижении иммунореактивности детей.
При серологических исследованиях и ПЦР-тестировании на внутриутробные инфекции у детей в 100% случаев были обнаружены при помощи ИФА положительные антихламидийные антитела в крови и при ПЦР-тестировании — антигены Chlamydia pneumoniaе или Ch. trachomatis в слизи из носоглотки. ИФА-положительные антитела класса IgM и IgG к Ch. pneumoniaе были выявлены у 88,7% больных, антитела класса IgM и IgG к Ch. trachomatis — у 7,5% пациентов. У 27,5% наблюдаемых детей серологические титры не были диагностически значимыми. Такие пациенты расценивались как больные с латентными формами хламидиоза, они нуждались в симптоматическом лечении и диспансерном наблюдении. Больные с высокими титрами антихламидийных антител и положительным результатом ПЦР-тестов имели признаки активации хламидийной инфекции. У них были заболевания органов дыхания (трахеобронхиты, пневмонии), отиты, конъюнктивиты, дакриоциститы. У 24% детей выявлялись микст-инфекции: хламидиоз с микоплазмозом — у 6 детей и хламидиоз в ассоциации с Candida аlbicans и герпесом — у 13 детей. Необходимо иметь в виду, что хламидийная инфекция, выявляемая в первые недели жизни детей, настолько опасна своими отсроченными осложнениями, что однозначно требует проведения лечения.
Клинический пример 1. Настя К., три месяца, поступила в стационар с диагнозом направления — ОРВИ.
Жалобы: на кашель, насморк, повышение температуры до 38,5 °С, беспокойство, отказ от еды, дисфункцию кишечника.
Анамнез болезни: больна в течение 7 дней, появился кашель, насморк, повысилась температура, изменился стул, стал жидким и водянистым, участился до 6 раз в сутки. В последние два дня перед госпитализацией стала отказываться от еды.
Анамнез жизни: девочка от первой беременности, угроза ее прерывания на сроках в 16, 27 и 38 недель. Мать обследована на внутриутробные инфекции, были выявлены уреаплазмоз и цитомегаловирусная инфекция. Проведено лечение эритромицином. За время беременности перенесла два раза ОРВИ. Роды на 40-й неделе, масса тела 3350 г, длина 50 см. К груди приложена на вторые сутки жизни, в роддоме введен докорм смесью NAN-1. В родильном доме у ребенка диагностировано поражение ЦНС, гипертензионный синдром. При нейросонографии было подозрение на внутрижелудочковое кровоизлияние.
При поступлении в стационар состояние средней тяжести, лихорадка до 39 °С (держалась в течение 6 дней), стул жидкий, учащенный до 6 раз в сутки, водянистый. Аппетит снижен, рвот и срыгиваний не было. При осмотре кожа бледная. Слизистые полости рта сухие. Язык обложен беловатым налетом. Зев рыхлый, зернистый, с выраженной гиперемией. Из носа слизистые выделения, кашель редкий, влажный. Был диагностирован двусторонний средний катаральный отит. Пульс 144 в минуту, удовлетворительного наполнения. Тоны сердца ритмичные, приглушены. Границы сердца не изменены. В легких перкуторно звук с коробочным оттенком, дыхание жесткое, без хрипов. Живот умеренно вздут, перистальтика усилена, печень +2 см ниже реберной дуги, селезенка +0,5 см. Мочеиспускание достаточное.
Анализ крови: гемоглобин 109 г/л; эритроциты — 3,7×1012/л; цветовой показатель — 0,90; лейкоциты — 11,6×109/л; палочкоядерные нейтрофилы — 4%; сегментоядерные — 26%; лимфоциты — 55%; моноциты — 13%; базофилы — 2%; СОЭ — 34 мм/час. Анализ крови на 15 день госпитализации: гемоглобин — 112 г/л; эритроциты — 3,8×1012/л, цветовой показатель — 0,88; лейкоциты — 16,6×109/л; палочкоядерные нейтрофилы — 2%; сегментоядерные — 56%; лимфоциты — 34%; моноциты — 5%; эозинофилы — 2%; базофилы — 1%; СОЭ — 27 мм/час. Анализы мочи, копрограмма и биохимический анализ крови — без отклонения от нормы.
Анализ ликвора от 22.10.2008: количество — 2 мл; белок — 0,25 г/л; сахар — 2,9 ммоль/л; цитоз — 2/3. Посев ликвора — роста флоры нет. Посев крови на микрофлору — стерильный. Посев кала на острую кишечную инфекцию — отрицательный. ИФА кала на ротавирус — положительный. Серологический анализ крови методом ИФА выявил высокий титр антител к Ch. pneumoniae (1:320), антител к Ch. trachomatis не обнаружено. Выявлены также положительные титры антител класса IgG к вирусу цитомегалии и герпесвирусу. Типоспецифические антитела класса IgM к ЦМВ и герпесу — не обнаружены. Оба класса Ig (IgM и IgG) к микоплазме были отрицательные. В слизи с задней стенки глотки методом ПЦР найдены ДНК-Сh. pneumoniae, маркеров ДНК-ЦМВ и ДНК-герпеса методом ПЦР в смыве из носоглотки не было обнаружено. УЗИ органов брюшной полости выявило увеличение размеров печени и селезенки. УЗИ головного мозга обнаружило минимальные резидуальные изменения головного мозга.
На основании данных клинического и лабораторного обследования был установлен диагноз — острый энтероколит, ротавирусной этиологии, средней тяжести. Сопутствующие заболевания: хламидийная инфекция, хламидийный ринофарингит, двусторонний средний катаральный отит. Перинатальная энцефалопатия, гипертензионный синдром, ранний восстановительный период.
Проведенное лечение: дозированное питание смесью NAN-1, пероральная регидратация. Антибактериальные препараты вводились внутримышечно в течение 4 дней цефотаксим и последующих 7 дней — цефазолин (возрастные дозы), затем эритромицин по 50 тыс. ед. 3 раза в день внутрь в течение 8 дней и далее азитромицин 60 мг/сутки (1 день) и далее — по 30 мг в сутки. Антибиотики назначались в сочетании с Вифероном-1 в свечах 2 раза в день и пробиотики внутрь (Бифиформ).
В результате проведенного лечения ротавирусный энтероколит был купирован, стул оформлен, аппетит улучшился, копрограмма нормализовалась. Однако клинические анализы крови в динамике не улучшались, напротив, отмечалось нарастание анемизации (от нормохромии к гипохромии), лейкоцитоз в крови к 15-му дню лечения увеличился с 11,6×109/л до 16,6×109/л, сохранялось ускорение СОЭ 27 мм/час. Все вышеперечисленное в совокупности свидетельствовало об активации хламидийной инфекции на фоне инфицирования ротавирусами. Поэтому курс лечения макролидами был продолжен, эритромицин был заменен на азитромицин и последний препарат назначен по прерывистой схеме. Иммунотропная терапия Вифероном-1 продолжена до 3 месяцев (3 дня в неделю прием препарата, 4 дня перерыв). Диспансерное наблюдение за больной продолжено, состояние ребенка удовлетворительное, гемограмма нормализовалась.
Анализ истории данного пациента показывает отсутствие настороженности у педиатров в отношении внутриутробной инфекции у детей, даже в тех ситуациях, когда у беременной женщины было выявлено инфицирование уреаплазмозом и цитомегаловирусом. Однако после выписки из роддома ни участковый педиатр, ни невролог не провели углубленного обследования ребенка на первом месяце жизни на внутриутробную инфекцию, которая, как правило, в постнатальный период может давать активацию инфекционного процесса у ребенка на ослабленном иммунном фоне при его искусственном вскармливании. У пренатально инфицированных детей легко возникает инвазия ротавирусами, после которых реактивация ожидаема.
Клинический пример 2. Сергей Т., один месяц, поступил в больницу с жалобами на кашель, рвоту после приступа кашля. Кашель появился в последние две недели, сначала был редким, затем участился, в конце кашля небольшое отхождение слизистой мокроты. Учащение стула до 6 раз в сутки. Диагноз направления и приемного покоя больницы — острый гастроэнтерит. Острое респираторное вирусное заболевание (назофарингит).
Анамнез. Ребенок от первой беременности, отягощенной токсикозом в первую половину беременности, нефропатией во вторую ее половину, мать перенесла ОРВИ затяжного характера с длительным кашлем при сроке 12–13 недель. При обследовании беременной в 14 недель была выявлена микоплазменная инфекция. В ИФА крови обнаружены антитела класса IgG в титре 1:200 (серотип M. hominis) и положительный тест методом ПЦР слизи из носоглотки. Лечение было симптоматическим. На 38–39 неделе беременности повторно перенесла ОРВИ. Роды в срок, масса тела при рождении 3600 г, длина 51 см. Оценка по шкале Апгар 8/9 баллов. Через неделю после выписки из роддома у ребенка появились респираторные катаральные явления, рвоты при кашле и дисфункция кишечника.
При осмотре состояние средней тяжести. Кожа чистая, бледноватая. Дыхание через нос, затруднено, выделения из носа слизистые. В зеве гиперемия задней стенки глотки и небных дужек, зернистость слизистой. Тоны сердца приглушенные, частота сердечных сокращений (ЧСС) — 136 в минуту. Дыхание — 46 в минуту. Перкуссия легких — коробочный оттенок звука, дыхание жесткое, без хрипов. Живот мягкий, умеренно вздут, печень +2,0 см ниже реберной дуги. Селезенка +0,5 см. Стул жидкий, водянистый с небольшой примесью зелени, 5 раз в сутки. Мочится достаточно. Неврологический статус без особенностей.
Анализ крови: Hb — 121 г/л; Er — 4,01×1012/л; L — 9,5×109/л; палочкоядерные нейтрофилы — 2%; сегментоядерные — 12%; лимфоциты — 76%; моноциты — 8%; эозинофилы — 2%; СОЭ — 6 мм/час. Анализ мочи — без патологии. Копрограмма — цвет желтый, полужидкий, нейтральный жир +, желчные кислоты ±, мыла ±, слизь +, L — 3–5 в поле зрения. Посев кала на ОКИ и дизентерийную группу отрицательный. Анализ кала методом ИФА на ротавирус — отрицательный. Посев кала на условно-патогенную флору — отрицательный. Реакция Видаля со стафилококковым антигеном — отрицательная. Анализ крови методом ИФА на внутриутробные инфекции: IgM положительная с M. hominis, IgG положительная (в титре 1:200) с тем же серотипом микоплазм. ИФА на антитела к токсоплазмам, цитомегаловирусу, герпесу и хламидиям — отрицательные. ПЦР слизи из носоглотки выявляет антигены M. hominis.
Проведенное лечение. Цефотаксим внутримышечно, курс 5 дней, Бифиформ по 1/2 капсулы 2 раза в день — 2 недели. После получения данных обследования установлен диагноз — респираторный микоплазмоз, пренатального происхождения, активная фаза. Произведена смена антибиотика на азитромицин в сочетании с Вифероном-1 в возрастной дозе (по пролонгированной программе).
Данный клинический пример свидетельствует об активации микоплазменной инфекции у ребенка с возраста двух недель, хотя его инфицирование произошло внутриутробно от матери, перенесшей микоплазмоз во время беременности. Лечение же микоплазмоза у матери было неадекватным, ее заболевание сохраняло свою значимость вплоть до родов, когда она опять перенесла ОРЗ. Полученные результаты обследования на внутриутробные инфекции выявили типоспецифичный IgМ (маркер острого инфекционного процесса) и позволили поставить диагноз микоплазменной инфекции, активная фаза, пренатального происхождения с поражением органов дыхания и функциональными расстройствами органов пищеварения.
Выводы
- Внутриутробные инфекции у детей первого года жизни наблюдаются чаще, чем диагностируются педиатрами.
- У пациентов с рецидивирующими заболеваниями слизистой глаз, носа, глотки, органов дыхания и пищеварения наиболее часто выявляются хламидиоз и микоплазмоз.
- Для своевременной и достоверной диагностики внутриутробных инфекций следует назначать комплекс исследований с применением серии лабораторных тестов, которые следует проводить в диалектике.
Литература
- Исаков В. А., Архипова Е. И., Исаков Д. В. Герпесвирусные инфекции человека: руководство для врачей. С.-Пб, 2006, с. 302.
- Капустина Т. А., Белова Е. В., Манчук В. Т., Кин Т. И. Инфицированность хламидиями у детей с хроническими заболеваниями носоглотки и придаточных пазух носа // Росс. вестник перинатологии и педиатрии. 2007. Т. 52. № 6, с. 65–66.
- Руководство по амбулаторно-поликлинической педиатрии. Под ред. А. А. Баранова. Изд. группа «Гэстар-Медиа», 2007, с. 394–396.
- Спивак Т. В., Катосова Л. К. Роль хламидийной инфекции при бронхиальной астме у детей //Педиатрия. 2009. Т. 87. № 2, с. 19–25.
- Цинзерлинг В. А., Мельникова В. Ф. Перинатальные инфекции. СПб.: Элби- СПб; 2002, с. 52–66.
- Шабалов Н. П., Цвелев Ю. В. Основы перинатологии. М.: «Медпресс-информ», 2002, с. 476–487.
З. И. Пирогова, кандидат медицинских наук, доцент
СПБ МАПО, Санкт-Петербург
Контактная информация об авторах для переписки: [email protected]
Купить номер с этой статьей в pdf
Внутриклеточные возбудители урогенитальных инфекций у детей: проблемы и пути решения
ВНУТРИКЛЕТОЧНЫЕ ВОЗБУДИТЕЛИ УРОГЕНИТАЛЬНЫХ ИНФЕКЦИЙ У ДЕТЕЙ: ПРОБЛЕМЫ И ПУТИ РЕШЕНИЯ
Малова И.О.
г. Иркутск
Внутриклеточные возбудители урогенитальных инфекций – хламидии и урогенитальные микоплазмы, играющие значительную роль в развитии патологии мочеполового тракта у взрослых, могут выделяться и у детей младшего возраста. Выявление внутриклеточных возбудителей урогенитальных инфекций у детей является серьезной проблемой для врачей, практикующих в области микробиологии, неонатологии, педиатрии, детской гинекологии и урологии. Основные вопросы, которые решают специалисты лабораторной службы и клиницисты – это качественная и надежная лабораторная диагностика, изучение роли внутриклеточных возбудителей в развитии патологии у детей, анализ путей инфицирования, адекватная терапия и профилактика заболеваний, ассоциированных с этими микроорганизмами. Многолетний опыт научной и практической работы сотрудников кафедры дерматовенерологии ФПК и ППС Иркутского медицинского университета в области урогенитальных инфекций у детей позволяет сделать определенные выводы по обсуждаемой проблеме. На наш взгляд, крайне важным является выбор методов лабораторного исследования для идентификации внутриклеточных возбудителей у детей, а также методик забора клинического материала для этого исследования. Для выявления хламидийной инфекции рекомендуемый для детей младшего возраста культуральный метод в широкой практике неприменим из-за его дороговизны и невысокой чувствительности, поэтому необходимо использование не менее двух других регламентированных методов, чаще из которых используются ПИФ и ПЦР. Метод ИФА для выявления протихламидийных антител у детей младшего возраста далеко не всегда дает адекватные результаты, очевидно, в силу несовершенства в этом возрасте иммунной системы. Для исследования методом ПИФ и ПЦР клинический материал необходимо забирать у девочек из влагалища, у мальчиков – из уретры специальными одноразовыми и наименее травматичными зондами. Для сбора материала из уретры для проведения ПЦР-исследования у детей (особенно у мальчиков с физиологическим фимозом) целесообразно использование первой порции утренней мочи. При подозрении на наличие экстрагени-тальных очагов хламидийной инфекции материал для лабораторного исследования необ-ходимо получать из соответствующих локусов. Для выявления генитальных микоплазм у детей необходимо иметь определенные показания к обследованию: наличие воспалительных симптомов со стороны урогенитального тракта при отсутствии безусловно-патогенных микроорганизмов и повышенных титров условно-патогенной микрофлоры. Для выявления M. genitalium у детей используются только молекулярно-биологические методы (ПЦР, NASBA), для выявления U.urealyticum и M. hominis – культуральный с количественным определением или PCR – Real Time. Материалом для исследования могут быть выделения из мочеполового тракта, эпителиальные клетки и первая порция утренней мочи. Не менее важным аспектом является изучение роли внутриклеточных возбудителей в развитии воспалительных заболеваний органов мочеполового тракта у детей. C. trachomatis является безусловным патогеном и вызывает у детей младшего возраста вульвовагиниты, уретриты, уретроциститы, цервициты, сальпингиты. Описан случай хламидийного пельвиоперитонита у девочки 4-х лет. Экстрагенитальные очаги хламидийной инфекции формируются чаще при перинатальном инфицировании и представлены конъюнктивитами, назофарингитами, аденоидитами, тонзиллитами, пневмониями, анитами, проктитами. У новорожденных возможно развитие патологии ЦНС, ССС, ЖКТ на фоне хламидийной инфекции. У детей также может развиваться болезнь Рейтера. Клиническое значение генитальных микоплазм у детей младшего возраста в соответствии с требованиями доказательной медицины изучено недостаточно. Это связано прежде всего с тем, что эти микроорганизмы выявляются у детей чаще в ассоциациях с патогенными возбудителями. Микоплазменная «моноинфекция» с диагностическими титрами (104 КОЕ/мл и более) встретилась в нашей практике за более чем десятилетний период всего у 51 девочки в возрасте до 12 лет: U.urealyticum – у 39, M.hominis – у 12. У большинства (47) пациенток наличие в урогенитальном тракте микоплазм сопровождалось симптомами хронического вульвовагинита, чаще вялотекущего. При обострениях хронического рецидивирующего вульвовагинита у девочек с выявленной U.urealyticum титр условно-патогенной микрофлоры (преимущественно Staphylоcoccus p.p., Streptococcus p.p., E. coli) превышал нормальные значения (105 – 109 КОЕ/мл), что, по нашему мнению, могло обусловить развитие воспалительных симптомов. Обращало на себя внимание, что большинство (23) девочек этой группы были направлены для лабораторного обследования нефрологами с диагнозом «хронический пиелонефрит». Несколько иная ситуация сложилась с 43 пациентками младшего возраста, у которых из урогенитального тракта методом ПЦР были выявлены M.genitalium. У 38 из них установлен диагноз вульвовагинита, преимущественно с хроническим торпидным течением. Сопутствующий уретрит выявлен у 9 пациенток, у 12 девочек вульвовагинит протекал на фоне хронического пиелонефрита. Обращал на себя внимание характер выделений из влагалища при вульвовагините: у 53,5% девочек выделения были слизисто-гнойными, чего не было у пациенток с выявленными U.urealyticum и M.hominis. Вероятно, M. genitalium действует на слизистую детского влагалища более агрессивно, чем другие микоплазмы, вызывая более выраженную воспалительную реакцию. Титры условно-патогенной микрофлоры влагалища у этих пациенток были низкими. Ни у одной пациентки с микоплазменной (M.genitalium) инфекцией не было выявлено воспалительных заболеваний органов малого таза. Для этиотропного лечения хламидийной инфекции у детей рекомендован (Клинические рекомендации РОДВ «Дерматовенерология», 2007) эритромицин, а «лечение хламидийной инфекции у детей с массой тела более 45 кг и детей старше 8 лет должно проводиться в соответствии со схемами назначения у взрослых с учетом противопоказаний». Рекомендаций по лечению микоплазменной инфекции у детей вообще не существует. Собственный 9-летний опыт лечения хламидийной и микоплазменной инфекции у детей джозамицином («Вильпрафеном») показал высокую клиническую и микробиологическую эффективность этого макролидного антибиотика, а также высокую степень его безопасности. Элиминация микроорганизмов составила: C. trachomatis – 98,5%, M. genitalium – 93,0%, U.urealyticum – 92,5%, M. hominis – 90,8%. Контаминация детей чаще происходит в перинатальном периоде с преимущественным интранатальным путем инфицирования, однако не исключен и внутриутробный путь. С учетом этого, основным подходом к профилактике инфицирования следует считать своевременное обследование и лечение женщин, планирующих беременность, а также беременных женщин, которым антибактериальная терапия должна назначаться не ранее, чем с 16 недели беременности. В Клинических рекомендациях РОДВ 2007 г. указаны препараты выбора: эритромицин, джозамицин, амоксициллин, а также альтернативные препараты: азитромицин в курсовой дозе 1 г и эритромицин по 250 мг 4 раза в день в течение 14 дней. При вдумчивом и аналитическом подходе к выбору терапии хламидийной инфекции у беременных становится понятно, что джозамицин сегодня является современным и эффективным препаратом, отвечающим всем требованиям при назначении у беременных. Эритромицин в связи с развитием многочисленных побочных явлений не дает ожидаемого результата, к амоксициллину C. trachomatis никогда не были чувствительными, доза азитромицина в 1 грамм вряд ли будет достаточной для профилактики неонатального хламидиоза, а альтернативные низкие дозы эритромицина будут способствовать развитию персистирующей инфекции. Многолетний опыт лечения беременных женщин джозамицином показал, что элиминация из урогенитального тракта как хламидий, так и микоплазм достаточно высока, что является надежной профилактикой неонатального хламидиоза, а также микоплазменной инфекции.
в домашних условиях, последствия, список, способы
Бактерии холеры – физиология, методы исследования
Холера – одно из самых опасных для жизни заболеваний. При выявлении нескольких случаев инфицирования объявляется государственный карантин. По опасности для человеческой жизни холеру можно сравнить с сибирской язвой и чумой. Возбудитель заболевания – холерный вибрион, который долгое время оставался загадкой для ученых. Холерные бактерии имеют очень высокую вирулентность. Заболевание быстро распространяется по большой территории.
Многие годы пытаетесь избавиться от ПАРАЗИТОВ?
Глава Института: «Вы будете поражены, насколько просто можно избавиться от паразитов принимая каждый день...Читать далее »
Общие сведения
Холерный вибрион впервые выявил и изучил Р. Кох. Произошло это в 1883 году. Бактерию даже выделили в отдельную культуру. За несколько последних столетий было зафиксировано 7 случаев появления холеры, каждый из которых спровоцировал пандемию заболевания. Родиной холеры считается Индия. Именно там и отмечалось наибольшее количество заболевших.
Данная инфекция легко передается от человека к человеку. Бактерии оказываются во внешней среде через выделения, которые могут попадать в воду, а потом и на предметы быта. Далее, возбудитель без особых усилий внедряется в тело человека.
Заболевание практически всегда начинается внезапно. Характеризуется острым течением. Симптомы холеры приводят к быстрому обезвоживанию организма. Человек достаточно быстро теряет много жидкости, что, в конечном итоге, приводит к развитию гиповолемического шока.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для избавления от паразитов наши читатели успешно используют Intoxic. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Особенности строения вибриона
Холерный вибрион имеет продолговатую, немного изогнутую форму. Он представлен грамотрицательной полиморфной палочкой. По строению достаточно прост. Вибрион не может образовывать ни капсулы, ни споры. Относится к анаэробным бактериям, поскольку не может выжить без кислорода.
У возбудителя холеры отмечается окислительный тип метаболических реакций. В период своей жизнедеятельности бактерии ферментируют углеводы: глюкозу и сахарозу. Бактерии холеры способны к образованию индола, преобразованию нитратов в нитриты.
Холерный вибрион может хорошо расти и развиваться только в щелочной среде. Именно такие условия наблюдаются во рту у человека. Если щелочная реакция сохраняется или становится более высокой, бактерии начинают образовывать целые колонии. Если они находятся в жидкой среде, то можно заметить образование мутной пленки. Более кислая среда кишечника не подходит для бактерий данного типа. Но при дисбактериозе, когда среда становится более щелочной, бактерии начинают активно размножаться.
Антигены
Холерный вибрион имеет два антигена: О-антиген и Н-антиген. Однако не все бактерии этого вида вызывают холеру. Многие из них относят к отдельной серогруппе. Они могут провоцировать развитие гастроэнтерита, энтерита и некоторых других кишечных инфекций.
Обычно антиген состоит из трех компонентов. Различные формы возбудителей образуются из-за разного их сочетания. Поэтому и болезни тоже развиваются разные. Не все относят к смертельным недугам. Многие заболевания можно и нужно лечить.
Патогенез и уровень патогенности
Возбудитель холеры имеет специальный жгутик, при помощи которого может быстро передвигаться. Вибрион очень быстро внедряется в человеческое тело и прикрепляется к энтероцитам. Попадает в организм он через ротовую полость, реже – через кишечник. После этого происходит его контакт и сцепление с клеточными структурами. Стенки вибриона покрыты специальным филаментоподобным веществом, при помощи которого вибрион прикрепляется к клеткам. Постепенно бактерии захватывают весь тонкий кишечник и образуют большие колонии.
Вибрион выделяет специфические белковые токсины. Этим и объясняется высокий уровень патогенности возбудителя. При наличии большого количества вибрионов в кишечнике происходит нарушение водно-солевого баланса в организме и Вследствие этого наступает обезвоживание.
Жидкость, которая поступает в организм человека, не успевает усваива
Лечение ИППП в СПб - инфекций, передающихся половым путем.
Половые инфекции — бич нашего времени. Очень часто они никак себя не проявляют и становятся основной причиной хронических заболеваний и бесплодия. Лечение ИППП — важная задача для врачей-урологов, гинекологов и самого больного.
Что такое ИППП и их виды
ИППП (ЗППП) – инфекции (заболевания), передающиеся половым путем. Они включают в себя большую группу патологий, вызываемых разными возбудителями. Из них особую группу составляют пять венерических заболеваний, в том числе широко распространенные в России гонорея и сифилис. Вензаболевания вызывают тяжелые последствия, поэтому лечатся не только добровольно, но и принудительно.
Кроме того, в состав ИППП входят инфекции, которые вызывают не такие тяжелые осложнения. Возбудители их могут попадать в организм извне, а могут быть следствием чрезмерного размножения собственной условно-патогенной микрофлоры человека, обитающей на его слизистых оболочках из-за снижения иммунитета.
Выделяют следующие виды ЗППП:
Диагностика ЗППП
Для выявления данных заболеваний проводятся следующие лабораторные исследования:
- кровь на сифилис и ВИЧ;
- мазки и исследование выделений под микроскопом;
- исследование крови и мазков методом ПЦР – выявляется ДНК возбудителя и подсчитывается их количество в организме, что необходимо, например, при лечении молочницы;
- иммунологические исследования крови – выявляются антитела к возбудителям;
- посев выделений на питательные среды с выявлением возбудителя, его идентификацией и установлением его чувствительности к различным лекарствам.
Эти же исследования проводятся для оценки эффективности проводимой терапии и контроля излеченности.
Лечение венерических заболеваний
Сифилис
Самым тяжелым заболеванием в этой группе является сифилис. Он вызывается спиралевидными бактериями – спирохетами. Первые симптомы появляются через 3 – 4 недели после заражения, но могут появиться раньше (через 5 – 7 дней) и позже (в течение полугода). На месте внедрения инфекции появляется безболезненная язва (твердый шанкр), которая без лечения проходит через 6 – 7 недель. Иногда болезнь протекает бессимптомно и тогда возбудителя можно обнаружить только по анализам крови.
После того, как твердый шанкр исчезнет, заболевание переходит в новую стадию, так как возбудитель размножается в крови. Этот период (вторичный свежий сифилис) проявляется в виде разнообразной сыпи на теле. Через некоторое время сыпь исчезает, а затем появляется вновь (вторичный рецидивный сифилис). Таких волн высыпания может быть несколько, после чего заболевание переходит в конечную третью стадию. В этой стадии на коже, слизистых и внутренних органах появляются бугорки (гуммы) – следствие повышенной чувствительности организма к спирохетам. Но самих возбудителей в организме почти нет, поэтому третичный сифилис практически не заразен. Тяжелым осложнением сифилиса является разрушение гуммами внутренних органов, головного и спинного мозга.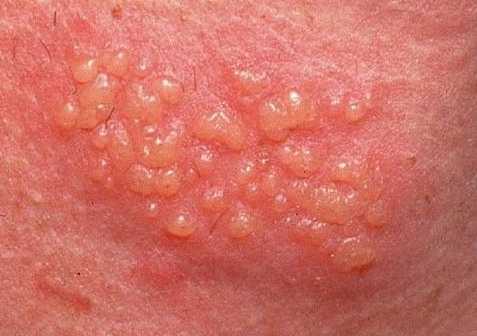
Для лечения разных стадий сифилиса разработаны специальные методики и схемы приема препаратов под контролем лабораторных исследований.
Гонорея
Гонорея вызывается гонококками, которые попадают в организм половым путем. Через 3 – 5 дней после заражения появляются учащенное мочеиспускание с резкими режущими болями и зудом. У мужчин все симптомы протекают более выраженно, у женщин достаточно часто гонорея протекает бессимптомно. Если вовремя не пролечить гонорею, она примет хроническое течение, вылечить которое будет намного сложнее. Последствием нелеченной гонореи будут многочисленные спайки во внутренних половых органах и бесплодие.
В лечении гонореи большое значение имеет ее своевременное выявление и терапия под контролем лабораторных исследований. Гонококки часто прячутся в клетках эпителия, поэтому с трудом поддаются воздействию антибактериальных препаратов. Для избавления от гонореи применяются антибактериальные препараты, иммуномодуляторы и общеукрепляющие средства, восстанавливающие защитные силы организма.
Лечение ИППП бактериального происхождения
К таким заболеваниям относятся внутриклеточные инфекции – хламидиоз, микоплазмоз и уреаплазмоз, а также вызываемый собственной условно-патогенной микрофлорой гарднереллез.
Особенность внутриклеточных возбудителей в том, что в большинстве случаев они вызывают бессимптомное течение заболевания, прячутся и размножаются в клетках эпителия половых органов, становясь причиной бесплодия и невынашивания беременности. Признаками этих ЗППП являются зуд и повышенный объем выделений из половых путей. У одних пациентов эти симптомы выражены значительно, у других же они практически отсутствуют.
Выявить эти ЗППП нелегко, так как возбудители прячутся в клетках эпителия. При смешанных ИППП, например, при сочетании с гонореей, внутриклеточные возбудители могут прятаться в клетках вместе с гонококками. Лечить такие болезни сложно. Для их выявления проводятся различные провокации, целью которых является активизации инфекции. При обострении ЗППП инфекцию будет легче идентифицировать и лечить.
Терапия проводится строго под контролем лабораторных исследований антибиотиками, к которым бактериальная флора проявляет максимальную чувствительность. После курса лечения также проводится лабораторный контроль в определенные сроки.
Гарднереллез
Гарднереллез или бактериальный вагиноз – это заболевание, связанное с нарушением иммунитета, так как вызывается бактериями – естественными обитателями слизистых половых путей. Основным его симптомом являются обильные водянистые выделения с неприятным рыбным запахом. В терапии основное место занимают средства для укрепления иммунитета. Антибиотики назначаются не всегда.
Симптомы и лечение ИППП грибкового происхождения
К грибковым ИППП относится кандидоз или молочница. Причиной ее является чрезмерное размножение грибков рода Candida, постоянно обитающих на слизистых и относящихся к условно-патогенной микрофлоре. Как и гарднереллез, молочница является следствием снижения иммунитета.
Признаком молочницы являются творожистые налеты на слизистых, сопровождающиеся сильным зудом. Лечат молочницу противогрибковыми препаратами. Обязательно назначается средства для укрепления иммунитета.
Как проявляются и лечатся вирусные ИППП
К ИППП вирусного происхождения относятся генитальный герпес, цитомегаловирусная и папилломавирусная инфекции. Условно к ЗППП относятся гепатиты В и С, ВИЧ, не поражающие половых органов.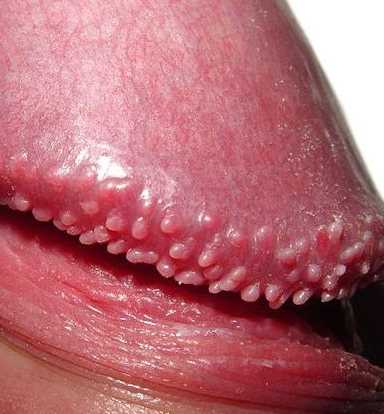
Возбудителем полового герпеса является вирус простого герпеса 2-го типа (ВПГ-2). Признак этого ЗППП – зудящие пузырьковые высыпания на слизистых. Они быстро превращаются в болезненные язвочки, которые через некоторое время самостоятельно проходят без всяких последствий. Заболевание опасно снижением иммунитета и для беременных женщин. Если беременная впервые заразилась, у нее не успели образоваться антитела к возбудителям, то это часто приводит к внутриутробной инфекции плода.
Лечение проводится противовирусными препаратами в сочетании с иммуномодуляторами, которые назначаются по индивидуально подобранной схеме.
Папилломавирусная инфекция проявляется в виде остроконечных и плоских папиллом. Основной опасностью этого ЗППП является малигнизация – перерождение в злокачественную опухоль. Особенно часто малигнизируются плоские кондиломы. Остроконечные кондиломы проявляются в виде длинный разрастаний на слизистых половых органов и анального отверстия. Заросли таких кондилом удаляются хирургическим способом, после чего назначаются противовирусные препараты и средства для укрепления иммунитета. Плоские кондиломы также удаляются и обязательно отправляются на гистологическое исследование для выявления злокачественного перерождения.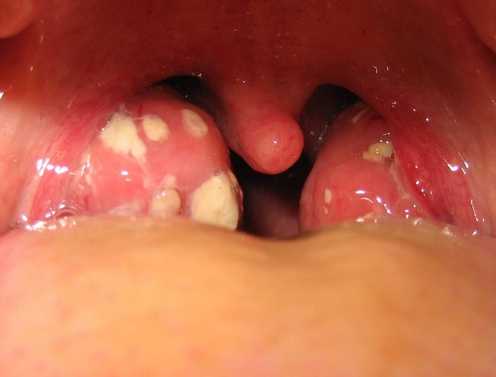
Цитомегаловирусная инфекция вызывается цитомегаловирусом (ЦМВ) – вирусом герпеса человека 5-го типа. ЦМВ инфицировано большинство человечества, заболевание обычно протекает незаметно, после чего ЦМВ остается в организме навсегда. Опасность он представляет при резком снижении иммунитета у больных СПИДом, онкобольных и т.д. – в это случае он вызывает генерализованный процесс, что часто приводит к гибели больных. Опасен он и для беременных женщин, но только если первичное заражение ЦМВ произошло во время беременности и у матери не успели выработаться защитные антитела. Лечение – противовирусная и иммуномодулирующая терапия.
Симптомы и лечение ИППП протозойного происхождения
К протозойным ЗППП относится трихомониаз, вызываемый трихомонадами. Заболевание начинается остро, с появления обильных водянистых выделений с неприятным запахом и сильного зуда. В последнее время даже трихомониаз стал проявляться не так ярко, а иногда он и вовсе протекает бессимптомно. Нелеченный трихомониаз приобретает хроническое течение и является причиной бесплодия.
Для лечения применяют антибактериальные препараты из группы нитроимидазолов (трихопол и др.), а также средства для укрепления иммунитета.
Профилактика ИППП
Для профилактики ИППП нужно соблюдать следующие правила:
- иметь половые контакты с одним проверенным партнером или их ограниченным количеством;
- отказаться от половых контактов с лицами из группы риска с асоциальным поведением;
- если партнер не один, иметь только защищенные половые контакты с использованием презервативов;
- всегда соблюдать правила гигиены – не пользоваться чужими личными вещами.
Возможность заразиться ЗППП есть всегда, даже если партнер не подозревает о наличии у него инфекции. Поэтому защитить себя можно, только ограничив число половых партнеров. При недомогании и симптомах, беспокоящих органы мочеполовой системы, незамедлительно обратитесь к врачу и сдайте необходимые анализы. Не откладывайте плановое посещение уролога.
Паразит внутри клетки. Главный инфекционист Минздрава о коронавирусе | Все о коронавирусе | Здоровье
Почему дети болеют меньше? Формируется ли иммунитет к коронавирусу? Главный инфекционист Минздрава Елена Малинникова ответила на вопросы, которые больше всего волнуют читателей.
Юлия Борта, «АиФ»: Правда ли, что коронавирус — самый опасный сегодня?
Елена Малинникова: Коронавирусы известны с 1965 года. Всего их сейчас циркулирует около 40 вариантов. Не только в человеческой популяции, но и среди животных. Если говорить о человеке, то с начала XXI века инфекции вызывают 4 основных вируса этой группы. Новый оказался более патогенным, чем остальные. Потому что вирусы, которые наблюдали в конце XX века, хоть и вызывали ОРВИ, но активно не передавались от человека к человеку. И вирусы, которые мы знаем как SARS (тяжёлый острый респираторный синдром или «атипичная пневмония» — Ред.), вызвавший вспышку в 2002 году, или коронавирус MERS (ближневосточный респираторный синдром — Ред.), вызвавший эпидемию в 2015 году Южной Корее, вызывали ОРВИ и тяжелую пневмонию, но не в таком масштабе. Сегодня мы видим активность со стороны вируса и человеческого сообщества в отношении вируса, поэтому возникает мнение, что этот вирус страшнее и тяжелее. Практика показывает, что, действительно, вирус стал более заразным, чем другие. Но при этом течение этой инфекции может протекать тяжело не всех, а только у определенного контингента больных.
— Насколько устойчив новый коронавирус во внешней среде?
— Устойчивость вируса оценивается. При передаче от человека к человеку любой вирус может приобретать активность или угасать. В принципе, по своей структуре новый коронавирус не очень устойчив, он сохраняется в окружающей среде в условиях от 7 до 7,5 PH. Если среда чуть кислее или чуть щелочнее, он не будет сохраняться. Плюс вирус прекрасно уничтожается дезсредствами. Через 10 мин его убивает ультрафиолетовое облучение. Но остается достаточно серьезная проблема в том, что вирус может хорошо сохраняться на поверхностях, если, скажем, это бумага, картон, пластик. Сколько времени он сохраняется? По разным данным, до 7-9 или 12 часов. Но это только при определенной температуре и влажности.
— Точно ли дети меньше болеют?
— Вирусы, которые вызывают ОРВИ, имеют определенную специфику. Попадая в организм человека, они не могут просто так поражать какие-то клетки. Коронавирусы, как и вирусы гриппа, поражают исключительно клетки эпителия верхних дыхательных путей, легких, кишечника, которые имеют к ним особые рецепторы. И это свойство вирус и приобрел, когда появился в человеческой популяции, преодолев межвидовой барьер.
Сейчас трудно сказать, сколько животных прошел вирус до человека. Но преодолеть межвидовой барьер вирусу очень сложно. Это долгий процесс — найти ту клеточку, куда он может прикрепиться у человека. Скорее всего, эта инфекция начала циркулировать в КНР не в декабре 2019 года. А вирус появился чуть раньше. И только в декабре китайские коллеги заявили о первом 41 больном. А с 13 января он стал циркулировать за территорией КНР.
Так вот, преодолевая межвидовой барьер, вирус ищет клетки, на которые он может сесть и дальше воспользоваться — это же внутриклеточный паразит — всеми возможностями клетки. И в итоге «садится» на клетки, которые имеют определенные белки-рецепторы. S-белок у вируса (образует ту самую корону) сцепляется, как крючочком, и прилипает к этому белку-рецептору. Это позволяет вирусу проникнуть дальше в клетку. Клеток с такими рецепторами, которые готовы принять вирус, в верхних дыхательных путях не так много. Но чем ниже, тем их больше. Есть такое предположение, что у детей этих клеток с такими рецепторами в верхних дыхательных путях практически нет. Т. е. рецепторы на этих клетках незрелые. Они не готовы принять вирус. Поэтому дети не могут активно заражаться и болеть этой инфекцией.Однако постоянно появляются новые данные о возможностях вируса. Поначалу считалось, что вирус передается только от одного человека к другому, а от него дальше, к третьему, четвертому пятому, — нет. Сейчас это тоже проверяется. Важно понимать: когда вирус находит свою популяцию, где он будет циркулировать, вирулентность, то есть токсичность, заразность его падает. Так что новый коронавирус просто занял свою нишу среди других вирусов, циркулирующих в человеческой популяции. Вообще же более 200 вирусов вызывают ОРВИ.
— Насколько эффективен карантин? Некоторые говорят, что он бесполезен.
— Наша задача — не допустить тяжелых и летальных исходов от инфекции. Для этого необходимо, чтобы люди из группы риска, которые дают такие тяжелые реакции, не имели тесного контакта с людьми, которые способны перенести инфекцию на ногах либо не болеть вообще. Задача карантина — разобщение. Это на сегодня лучшее средство профилактики. Если мы не будем распространять инфекцию в популяции, заболеваемость пойдет не по критической линии, а плавно охватит определенный контингент населения, плавно иммунизирует популяцию. Да, потом мы будем встречаться с этой инфекцией. Но будет ли вирус так активен, как его брат SARS или как MERS, которые мы периодически диагностируем, но немного? И насколько он останется активным на следующий сезон? Пока вопросы остаются.
Мы никогда не заражаемся одним вирусом. Мы заражаемся облаком разнообразных вирусов. Как они себя поведут, зависит от организма. Зависит и от того, какое количество вируса попало в организм. Рискуют больше всего пожилые люди с сердечно-сосудистыми заболеваниями и дыхательными.
— Формируется ли иммунитет к коронавирусу?
— Это называется проэпидемичивание населения. Когда появились первые выздоровевшие, стали говорить, что иммунитет после перенесенной инфекции нестоек. Сейчас мы наблюдаем циркуляцию двух вариантов вируса — S-варианта и L-варианта. Возможно, они не дают перекрестного иммунитета. Когда закончится эпидемия, вирус пройдет через человеческую популяцию, мы сможем сказать, насколько он формирует ответ иммунитета, а также уточнить показатели летальности. Сейчас смертность в среднем 3,9%, а среди пожилых достигает 20%.
В Китае эпидемия продлилась примерно сто дней. Но этот прогноз нельзя распространять на другие страны. Вообще мы не может сказать, как быстро распространяется инфекция. Те беспрецедентные меры профилактики, которые применили в КНР, не дали понимания, как эпидемия могла бы развиваться в обычных условиях. И как неожиданно инфекция стала развиваться в индустриально развитых странах. Мы не видим развития инфекции в странах, где даже, условно, хлорирование воды не практикуется. У нас в советские годы была система тотального противоэпидемического контроля. В Италии такого тотального контроля нет. Плюс туда стекается много туристических путей. Все это сыграло роль в росте заболеваемости. Но это все предварительные выводы. Многие иностранные коллеги хотят, чтобы мы поделились опытом, как мы справляемся с этой инфекцией.
— Раньше диагноз ставили после третьего теста на вирус. Сейчас говорят, что достаточно одной.
— Тест-системы совершенствуются, неудивительно, что новые более точны. Обычно когда люди заболевают, то идут в аптеку (а что бы мне выпить) либо открывают домашнюю аптечку и выбирают таблетки, чтобы полечиться. Призываю всех: как только почувствовали любые признаки ОРВИ — боль в горле, слабость, недомогание, насморк, особенно сухой кашель — идите домой, надев маску, и вызывайте врача. Не надо идти в поликлинику, чтобы сделать анализы («А вдруг меня примут?») или в аптеку искать лекарства. Не ходите больные на работу. Даже если очень нужно. Такое геройство сегодня — преступление. Любой болеющий сейчас может быть потенциально носителем коронавирусной инфекции. Хотя необязательно, что он будет болеть тяжело. Это может определить врач.
последствия, разновидности болезни, травы, у взрослых
Что такое облигатные паразиты, какие бывают виды
Облигатные паразиты имеют второе название, напрямую связанное с их жизнедеятельностью – обязательные. Для их существования необходимо обязательное присутствие носителя, вне человеческого организма они погибают. Данный вид паразитизма самый распространённый, около 80% людей страдают от облигатных микроорганизмов.
Многие годы пытаетесь избавиться от ПАРАЗИТОВ?
Глава Института: «Вы будете поражены, насколько просто можно избавиться от паразитов принимая каждый день...Читать далее »
- Обязательный паразитизм: морфология, специфические особенности
- Внутриклеточный паразитизм
- Хламидии
- Риккетсии
- Вирусы
Обязательный паразитизм: морфология, специфические особенности
Морфологические признаки облигатных особей отличительны и зависят напрямую от среды, в которой проходит их развитие. Они отличаются усовершенствованной половой системой, способны откладывать за сутки около миллиона яиц. Так как микроорганизмы паразитируют в какой-то определённой среде, они не нуждаются в перемещении, реагировании на световые и температурные раздражители. Об этом говорят органы чувств, которые изначально редуцированы, а нервная система проста в своём проявлении.
Зачастую облигатные паразиты имеют двух хозяев, один из которых является носителем личинок, в организме второго происходит непосредственная жизнедеятельность половозрелой особи, готовой к размножению.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для избавления от паразитов наши читатели успешно используют Intoxic. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
[bold]Локализация возбудителей зависит от их разновидности:[/bold]
- вирусы и хламидии относятся к внутриклеточному паразитизму;
- эктопаразиты (клещи, вши, грибы) существуют на поверхности дермы;
- эндопаразиты, к которым относятся черви, паразитируют внутри организма.
Жизненный цикл особей проходит только внутри хозяина, чужеродная среда незнакома и убивает их. Вне человеческого организма они теряют функцию размножения.
[bold]Зачастую облигатные паразиты передаются посредством:[/bold]
- перинатального заражения, либо в процессе родовой деятельности;
- контактно-полового взаимодействия;
- кровососущих насекомых.
[attention type=yellow]В основном причиной инфекции становятся простейшие или бактерии, которые живут, размножаются и погибают внутри человеческого организма.[/attention]