Бионический глаз что это такое
Визуальный протез — Википедия
Визуальный протез также известный как бионический глаз - это экспериментальное визуальное устройство, предназначенное для восстановления функции зрения у тех, кто страдает полной или частичной слепотой. Было разработано много устройств с применением технологий кохлеарных имплантатов и нейропротезирования. Идеи использования электрического тока (например, электростимуляции сетчатки) для восстановления зрения восходят к XVII веку. Их обсуждали Бенджамин Франклин, Тибериус Кавалло и Шарль Лерой.[1][2][3]
Возможность дать слепому человеку приобрести зрение при помощи бионического глаза зависит от обстоятельств, вызвавших потерю зрения. Протез сетчатки, является наиболее распространённым зрительным протезом. Для этого протеза лучше всего подходят пациенты с потерей зрения из-за дегенерации фоторецепторов. Шансы на успех увеличиваются, если зрительный нерв пациента был развит до появления слепоты. Люди с врождённой слепотой, могут не иметь полностью развитого зрительного нерва. Хотя нейропластичность позволяет нерву развиваться после установки имплантата. [4]
Визуальное протезирование разрабатывается как потенциально ценная помощь для людей с деградацией зрения. Argus II, разработанный совместно с Университетом Южной Калифорнии (USC) и производимый Second Sight Medical Products Inc., в настоящее время является единственным подобным устройством, получившим маркетинговое одобрение (знак CE в 2011 году).[5] Большинство других проектов находятся на стадии разработки.
Argus II[править | править код]
Марк Хумаюн, Юджин Дежуан, Говард Д. Филлипс, Вентай Лю и Роберт Гринбер были первыми изобретателями активного визуального протеза.[6] Они доказали работоспособность их концепции во время исследований с пациентами в Университете Джона Хопкинса. В конце 1990-х Гринберг вместе с предпринимателем по производству медицинского оборудования основал компанию Second Sight.[7] Их имплантат первого поколения имел 16 электродов и использовался в Университете Южной Калифорнии в период с 2002 по 2004 год.[8] В 2007 году компания начала испытание его 60-электродного имплантата второго поколения, получившего название Argus II.[9] В испытаниях приняло участие 30 человек из 4 стран. Весной 2011 года, на основании результатов клинического исследования, которые были опубликованы в 2012 году [10], Argus II был одобрен для коммерческого использования в Европе, и Second Sight запустил продукт в производство. В США Argus II был мертифицирован 14 февраля 2013 года. Национальный институт глаз, Министерство энергетики и Национальный научный фонд поддержали разработку Second Sight.[11]
Визуальный протез на основе микросистем (MIVP)[править | править код]
Клодом Вераарт из Университета Лувена разработал протез, который представляет собой электрод со спиральной манжетой вокруг зрительного нерва в задней части глаза. По задумке стимулятор должен получать сигналы от внешней камеры, которые преобразуются в электрические сигналы, и напрямую стимулировать зрительный нерв.
Имплантируемый миниатюрный телескоп[править | править код]
Имплантируемый миниатюрный телескоп, хотя он и не является активным протезом, выступает в роли одного из видов визуальных имплантатов, которые могут использоваться в лечении макулодистрофии на её последних стадиях. [12][13] Устройство такого типа имплантируется в глаз, увеличивая (примерно в три раза) размер изображения, проецируемого на сетчатку.[14]
Примером является телескоп, созданный VisionCare Ophthalmic Technologies. Он размером с горошину и имплантируется за радужную оболочку глаза. Изображение проецируются на здоровые участки центральной сетчатки, за пределами дегенерированной макулы и увеличивается, чтобы уменьшить влияние слепого пятна на зрение. Степень увеличения в 2,2 или 2,7 раза позволяет увидеть или различить объект, представляющий интерес, в то время как другой глаз используется для периферического зрения. Глаз, имеющий имплантат, в качестве побочного эффекта будет иметь ограниченное периферическое зрение. Пациентам, использующим устройство, все же могут понадобиться очки для оптимального зрения. Перед операцией пациенты должны сначала опробовать ручной телескоп, чтобы узнать, улучшит ли он зрение в их случае. Одним из основных недостатков является то, что он не может быть использован для пациентов, перенесших операцию по удалению катаракты. А также, чтобы установить телескоп требуется сделать большой разрез в роговице. [15]
Проект MPDA Alpha IMS[править | править код]
В 1995 году в Университетской глазной клинике Тюбингена началась разработка субретинальных протезов сетчатки. Под сетчатку укладывался чип с микрофотодиодами, который воспринимал свет и трансформировал в электрические сигналы, стимулирующие ганглионарные клетки наподобие естественного процесса в фоторецепторах неповреждённой сетчатки. Природные фоторецепторы гораздо эффективнее фотодиодов и видимый свет не достаточно мощный, чтобы стимулировать MPDA. Поэтому для повышения уровня стимуляции используется внешний источник питания. Первые эксперименты на микросвинках и кроликах были начаты в 2000 году, и только в 2009 году имплантаты были вживлены 11 пациентам в рамках клинического пилотного исследования. Первые результаты были обнадеживающими – большинство пациентов смогли отличать день от ночи, некоторые даже могли распознавать предметы – чашку, ложку, следить за перемещением крупных предметов.[16] Первые имплантации в Великобритании состоялись в марте 2012 года и были проведены Робертом МакЛареном в Оксфордском университете и Тимом Джексоном в Королевской больнице Лондона.[17][18] На 2017 год Alpha IMS, производства Retina Implant AG Germany имела 1500 электродов, размер 3×3 мм, толщиной 70 микрон. После установки под сетчатку это позволяет почти всем пациентам получить некоторую степень восстановления светоощущения.[19]
MIT Retinal Implan[править | править код]
Джозеф Риццо и Джон Уайетт из Массачусета начали исследовать возможность создания протеза сетчатки в 1989 году, и провели испытания стимуляции на слепых добровольцах в период между 1998 и 2000 годами. С тех пор они разработали субретинальный стимулятор, набор электродов, который размещён под сетчаткой и принимает сигналы изображения от камеры, установленной на пару очков. Микросхема стимулятора декодирует информацию изображения, передаваемую камерой, и соответственно стимулирует ганглиозные клетки сетчатки. Протез второго поколения собирает данные и передаёт их имплантату через радиочастотные поля из катушки передатчиков, установленных на очках. Вторичная катушка приемника зашита вокруг радужки. [20]
Искусственная кремниевая сетчатка (ASR)[править | править код]
Братья Алан Чоу и Винсент Чоу разработали микрочип, содержащий 3500 фотодиодов, которые обнаруживают свет и преобразуют его в электрические импульсы. Они стимулируют здоровые ганглиозные клетки сетчатки . ASR не требует внешних устройств. Микрочип ASR — это кремниевый чип диаметром 2 мм (та же концепция, что и в компьютерных чипах), 25 микрон толщиной, содержащий 5000 микроскопических солнечных элементов под названием «микрофотодиоды», каждый из которых имеет свой собственный стимулирующий электрод.[21]
Фотоэлектрические протезы сетчатки (PRIMA)[править | править код]
Даниэль Паланкер и его группа в Стэнфордском университете разработали фотоэлектрическую систему, она же и есть «бионический глаз». Система включает в себя субретинальной фотодиод и инфракрасную проекционную систему изображения, установленную на видеоочки.[22] Информация с видеокамеры обрабатывается в карманном компьютере и отображается в импульсном инфракрасном (850-915 нм) видеоизображении. ИК-изображение проецируется на сетчатку через естественную оптику глаза и активирует фотодиоды в субретинальном имплантате, которые преобразуют свет в импульсный бифазный электрический ток в каждом пикселе.[23] Электрический ток, протекающий через ткань между активным и обратным электродами в каждом пикселе, стимулирует близлежащие внутренние нейроны сетчатки, в первую очередь, биполярные клетки, которые передают возбуждающие ответы клеткам ганглия сетчатки. Эта технология коммерциализируется компанией Pixium Vision и, по состоянию на 2018 год, проходит клинические испытания.
Bionic Vision[править | править код]
Австралийская команда во главе с профессором Энтони Беркиттом разрабатывает два протеза сетчатки. Устройство Wide-View объединяет новые технологии с материалами, которые были успешно использованы в других клинических имплантатах. Этот подход включает в себя микрочип с 98 стимулирующими электродами и направлен на повышение мобильности пациентов, чтобы помочь им безопасно перемещаться в своей среде. Этот имплантат будет помещён в супрахориоидальное пространство. Первые тесты пациентов с этим устройством начаты в 2013 году.
Консорциум Bionic Vision Australia разрабатывает устройство High-Acuity, которое включает в себя ряд новых технологий для объединения микрочипа и имплантата с 1024 электродами. Устройство призвано улучшить зрение, чтобы помочь с такими задачами, как распознавание лиц и чтение крупным шрифтом. Бионическая зрительная система включает в себя камеру, передающую радиосигналы микрочипу, расположенному в задней части глаза. Эти сигналы превращаются в электрические импульсы, стимулирующие клетки в сетчатке и зрительный нерв. Потом они передаются в зрительные зоны коры мозга и преобразуются в изображение, которое видит пациент.
Австралийский исследовательский совет присудил Bionic Vision Australia грант в размере 42 миллионов долларов США в декабре 2009 года, и консорциум был официально запущен в марте 2010 года.[24]
Dobelle Eye[править | править код]
Dobelle Eye по функциям аналогичен устройству MIT Retinal Implan, за исключением того, что чип-стимулятор находится в зрительной коре, а не на сетчатке. Первые впечатления от имплантата были неплохие. Ещё в стадии развития, после смерти Добеля, было решено превратить этот проект из коммерческого в проект, финансируемый государством.[25]
Интракортикальный зрительный протез[править | править код]
Лаборатория нейронных протезов из Иллинойского технологического института в Чикаго, разрабатывает визуальный протез, используя внутрикорковые электроды. Аналогично системе Добеля, применение внутрикорковых электродов позволяет значительно увеличить пространственное разрешение в сигналах стимуляции. Кроме того, разрабатывается система беспроводной телеметрии для устранения необходимости в транскраниальных (внутричерепных) проводах. Электроды, покрытые слоем активированной плёнки оксида иридия (AIROF), будут имплантированы в зрительной коре, расположенной в затылочной доле мозга.[26] Наружный блок будет захватывать картинку, обрабатывать её и генерировать инструкции, которые затем будут передаваться в имплантированные модули по телеметрическому линку. Схема декодирует инструкции и стимулирует электроды, в свою очередь стимулируя зрительную кору. Группа разрабатывает датчики внешней системы захвата и обработки изображений для сопровождения специализированных имплантируемых модулей, встроенных в систему. В настоящее время проводятся исследования на животных и психофизические исследования человека для проверки целесообразности имплантации добровольцам.[27]
виды протезирования, создание, как вытащить глазной протез
Как работает бионический глаз
Главный тренд офтальмологии будущего — бионические глаза. В 2018 году уже существуют четыре успешных проекта, и искусственные глаза сейчас — далеко не картинка из футуристического фэнтези.

Фильм «Терминатор»
Самый интересный проект — это Argus II от Second Sight. Устройство состоит из импланта, очков, камеры, кабеля и видеопроцессора. Имплант, имеющий передатчик, вживляется в сетчатку. Носимая с очками камера фиксирует изображения, которые процессор обрабатывает, генерируя сигнал, передатчик импланта принимает его и стимулирует клетки сетчатки.
В чем недостаток технологии? Устройство стоит баснословные 150 тысяч долларов и не возвращает зрение полностью, лишь позволяя различать силуэты фигур. По состоянию на 2017 год 250 человек носят Argus II, что, безусловно, ничтожно мало.
У Argus II есть аналоги. Например, Boston Retinal Implant. Он тоже создан специально для пациентов с макулодистрофией и пигментным ретинитом (разложением фоторецепторов сетчатки). Он работает по похожему принципу, направляя сигналы нервным клеткам и создавая схематичное изображение объекта. Стоит назвать и IRIS, созданный для пациентов на последних стадиях деградации сетчатки.
Бионический глаз представлен полимерной матрицей, в которой имеются светодиоды. Она может фиксировать даже слабые электрические импульсы, а затем передавать их на нервные окончания. Сигналы, которые преобразуются в электрическую форму, активизируют сохранившиеся нейроны сетчатки и оптического нерва.
Видеокамера, которая встраивается в очки, записывает картинку, а полученные данные отправляет в конвертор. Здесь сигнал преобразуется и попадает на фотосенсор, который вживлен в сетчатку глазного яблока. Отсюда электрические импульсы уже проникают в зрительные центры мозга человека через волокна оптического нерва.
Когда необходимо протезирование
Глазные протезы решают не только эстетические и психологические проблемы пациента. Если человек, утративший глаз, не будет носить его заменитель, со временем конъюнктивальная полость станет меньше, а ресницы начнут загибаться вовнутрь, доставляя немало неудобств и становясь главной причиной развития хронических воспалительных процессов.
Особенно важную роль протезирование играет у детей – нахождение в конъюнктивальной полости заменителя глаза стимулирует процессы роста костей орбиты. Если протезирование не проводится, кости растут медленно, и развивается асимметрия лица. Когда это необходимо, врачи перед протезированием проводят пластику век, коррекцию полости конъюнктивы, создают опорно-двигательную культю, проводят энуклеацию, эвисцерацию либо эвисцероэнуклеацию с имплантацией.
Как правило, протезирование назначается в случае частичного или полного удаления глазного яблока из-за таких заболеваний:
- Обширная травма глаза с последующим его удалением.
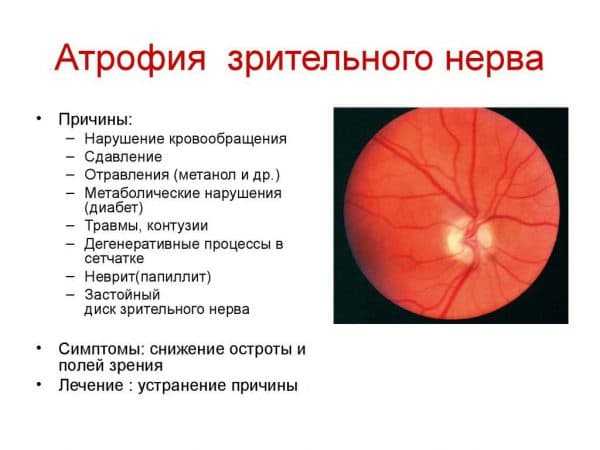
- Врожденные аномалии, в результате которых развилась атрофия зрительного органа с последующим некрозом.
- Атрофия зрительного нерва в совокупности с инфекционным невритом, давшая осложнение в виде заражения всех тканей глаза.
- Раковые опухоли.
Правила ухода за глазными протезами

Первое и главное правило эксплуатации глазных протезов – их регулярная замена. Для взрослых максимальный срок ношения одного протеза составляет 1–1,5 года, для детей – не более 6 месяцев, так как их череп и глазница постоянно растут и меняют форму. Если человек не снимает искусственный глаз дольше рекомендованных сроков, он утратит свой эстетичный вид, став шероховатым, тусклым, кроме того, накапливает бактерии. Ткани вокруг протеза могут начать воспаляться, гноиться.
Потребуется время, чтобы привыкнуть к инородному телу в глазу и научиться правильно за ним ухаживать
Если же протез испортился, треснул, деформировался раньше рекомендованного срока, его все равно следует заменить. Острые края будут травмировать края конъюнктивальной полости, вызывать разрастание грануляций, что приведет к изменению формы и объема глазницы, инфицированию и воспалений окружающих тканей.
Правила ежедневного ухода:
- Перед выниманием или надеванием протеза чисто вымыть с мылом руки и вытереть насухо, сесть за стол, покрытый плотной салфеткой. Это нужно для того, чтобы глаз не разбился, если вдруг выскользнет из рук.
- Взять протез в руку и смочить в кипяченой воде.
- Приложить к глазнице, узкий край приподняв вверх, ввести под верхнее веко широкий край.
- Одновременно оттянуть нижнее веко и ввести под него протез.
- Чтобы извлечь искусственный глаз, оттягивают нижнее веко, вводят под край глаза специальную лопаточку, делают нажим вверх и вперед – протез извлечен.
- Каждый вечер протез нужно вынимать, удалять скопившуюся слизь и дезинфицировать поверхности раствором борной кислоты.
- Конъюнктивальная полость сначала тоже промывается обычной кипяченой водой, а затем любым раствором на основе сульфацил-натрия или сульфацил-цинка, подойдет «Искусственная слеза». После этого протез снова вставляется.
Важно не вынимать его даже ночью, особенно в первые полгода, пока идет привыкание. Во время курса рентгенотерапии тоже не рекомендуется оставлять конъюнктивальную полость пустой, так как она может уменьшиться в размерах.
Перед выполнением операций по введению и извлечению глазного протеза тщательно вымойте руки, подготовьте глазные капли, салфетки, присоску. Обязательно сядьте за стол, покрытый мягкой тканью, а перед собой поставьте зеркало.
Искусственная сетчатка
Мы сказали, что пигментный ретинит поражает фоторецепторы сетчатки, из-за чего человек перестает воспринимать свет и слепнет. Это заболевание кодируется генетически. Сетчатка состоит из миллионов рецепторов. Мутация лишь в одном из 240 генов запускает их гибель и портит зрение, даже если связанные с ней зрительные нейроны будут целы.

Как быть в этом случае? Имплантировать новую сетчатку. Искусственный аналог состоит из электропроводящего полимера с шелковой подложкой, завернутого в полимерный полупроводник. Когда падает свет, полупроводник поглощает фотоны. Вырабатывается ток, и электрические разряды касаются нейронов сетчатки.
https://www.youtube.com/watch?v=C8TD6xgTk1g
Эксперимент с мышами показал, что при освещенности в 4—5 люксов, как в начале сумерек, мыши с имплантами реагируют на свет так же, как и здоровые грызуны. Томография подтвердила, что зрительная кора мозга крыс была активна. Неясно, будет ли разработка полезной для людей. Итальянский технологический институт (IIT) обещает отчитаться о результатах опытов в 2018 году.
Условия замены и хранение
Взрослые пациенты носят протез в течение 8-10 месяцев, а затем заменяют его на новый. Делать это нужно обязательно, поскольку поверхность изделия в результате постоянного ношения становится шершавой, на ней появляются борозды и мелкие раковины, травмирующие слизистую глаза.
Необходимые атрибуты для хранения протеза
Носить протез нужно постоянно. Если вы снимаете его на ночь, то не кладите в воду или дезинфицирующий раствор – вымойте с теплой водой и мылом, положите на ткань.
Ошибка в коде
Носимые, вшиваемые и встраиваемые устройства — не единственная надежда офтальмологии. Для того чтобы вернуть зрение, можно переписать генетический код, из-за ошибки в котором человек начал слепнуть. Метод CRISPR, который базируется на инъекции раствора с вирусом, несущим правильный вариант ДНК, излечивает наследственные заболевания.
Исправление кода позволяет бороться с возрастной дегенерацией сетчатки, а также с амаврозом Лебера — крайне редким недугом, убивающим светочувствительные клетки. В мире им страдает около 6 тысяч человек. Препарат Luxturna обещает покончить с ним. Он содержит раствор с правильной версией гена RPE65, шифрующего структуру необходимых белков. Это инъекционный препарат — его вводят в глаз микроскопической иглой.
Выводы
Глазное протезирование позволяет пациенту, утратившему глаз, вернуться к нормальной жизни. И во взрослом, и в детском возрасте ношение протезов является обязательным. Плановая замена производится 1-2 раза в год (стеклянные изделия нужно менять чаще).
Хирурги-офтальмологи прибегают к протезированию только в запущенных случаях, когда никакая другая коррекционная практика не способна восстановить глазное яблоко. До тех пор могут применяться различные офтальмологические методики по сохранению глаза, даже с учетом потери его главной функции.
Диагностика и восстановление после операции
Сопровождающий нас повсюду смартфон — прекрасный инструмент для быстрой и точной диагностики. Например, синхронизированный со смартфоном офтальмоскоп Peek Vision позволяет делать снимки сетчатки где и когда угодно. А Google в 2016 году представил алгоритм анализа изображений, основанный на искусственном интеллекте, который позволяет выявлять признаки диабетической ретинопатии на снимках сетчатки.
Будущее — за быстрым восстановлением после операций. Интересен препарат Cacicol, представленный турецкими исследователями в 2015 году. Их разработка снимает боль, повышенную чувствительность и жжение после операции на глазах. Препарат уже опробовали клинически: пациенты, которым сшивали роговицу (этот метод используется при лечении ее истончения — кератоконуса), отмечали снижение побочных эффектов.
Каким будет зрение будущего?
Уже сейчас офтальмология достигла поразительных успехов: прежде неизлечимую слепоту можно обратить, а наследственные заболевания побороть, переписав несколько участков генетического кода. В каком направлении будет идти развитие? Попробуем предположить:
- Лучше предотвратить, чем лечить. Окулист в смартфоне и нейронная сеть, ставящая диагноз, обещают заметно сократить риск запущенных и едва излечимых болезней глаз. Дополненная реальность (AR) позволит распространять медицинские знания в игровой и необременительной форме. Уже сейчас есть приложения AR, моделирующие последствия катаракты и глаукомы. Знание, как известно, сила.
- Заменить, если нельзя вылечить. Киборгизация — это ключевой медицинский тренд. Нынешние разработки хороши, но они реконструируют зрение лишь отчасти, позволяя различать размытые контуры. В ближайшие десять лет технология будет идти по пути повышения качества изображения и детализации. Важная задача — избавиться от носимых компонентов: камеры, очков, кабеля. Имплант должен стать мягче и, можно сказать, дружелюбнее для тканей человека, чтобы не ранить их. Вероятно, чипы без внешних вспомогательных элементов, вживляемые прямо в мозг, — это самая перспективная ветка киборгизации зрения.
- Дешевле и доступнее: 150 тысяч долларов за устройство пока делают бионические глаза очень далекими от рынка и недосягаемыми для большинства больных. Следующий шаг — сделать их максимально доступными.
- Восстановление за часы: вживление чипов, коррекция сетчатки и даже исправление ДНК требуют хирургического вмешательства. Оно оставляет резь, жжение, фантомные боли и другие неприятные следствия. Препараты будущего будут регенерировать поврежденные ткани за часы.
- Фантастическое зрение для всех: мгновенный снимок с помощью глаза и сетчатка, подключенная к интернету, только сейчас выглядят как научная фантастика.
искусственные глаза, сетчатка и импланты в мозге — Рамблер/доктор
В 2018 году 39 миллионов человек остаются слепыми. Из-за наследственных заболеваний, старения тканей, инфекций или травм. Одна из главных причин — это болезни сетчатки. Но наука развивается так быстро, что фантастика переходит из книг в лаборатории и операционные, снимая барьер за барьером. Ниже мы рассмотрим, какое будущее ждет офтальмологию, как будут лечить (и уже лечат), возвращать зрение, диагностировать недуги и восстанавливать глаза после операций.
Киборгизация: бионические глаза
Главный тренд офтальмологии будущего — бионические глаза. В 2018 году уже существуют 4 успешных проекта, и искусственные глаза сейчас — далеко не картинка из футуристического фэнтези.
Самый интересный проект — это Argus II от Second Sight. Устройство состоит из импланта, очков, камеры, кабеля и видеопроцессора. Имплант, имеющий передатчик, вживляется в сетчатку. Носимая с очками камера фиксирует изображения, которые процессор обрабатывает, генерируя сигнал, передатчик импланта принимает его и стимулирует клетки сетчатки. Так реконструируется зрение. Разработка изначально предназначалась для больных макулодистрофией. Это возрастное заболевание, оно сопровождается слабым кровоснабжением центра сетчатки и приводит к слепоте.
В чем недостаток технологии? Устройство стоит баснословные 150 тысяч долларов и не возвращает зрение полностью, лишь позволяя различать силуэты фигур. По состоянию на 2017 год 250 человек носят Argus II, что, безусловно, ничтожно мало.
У Argus II есть аналоги. Например, Boston Retinal Implant. Он тоже создан специально для пациентов с макулодистрофией и пигментным ретинитом (разложением фоторецепторов сетчатки). Он работает по похожему принципу, направляя сигналы нервным клеткам и создавая схематичное изображение объекта. Стоит назвать и IRIS, созданный для пациентов на последних стадиях деградации сетчатки. IRIS состоит из видеокамеры, носимого процессора и стимулятора. От них отличается Retina Implant AG. Имплант улавливает фотоны и активирует зрительный нерв, при этом устройство обходится без внешней камеры.
Импланты в головном мозге
Как ни странно, лечить зрение можно, не касаясь глаз. Для этого достаточно вживить в мозг чип, который будет стимулировать короткими электрическими разрядами зрительную кору. В этом направлении работает упомянутый выше Second Sight. Компания разработала альтернативную версию Argus II, которая совсем не затрагивает глаза и работает с мозгом напрямую. Девайс будет стимулировать нервные клетки током, извещая мозг о потоке света.
Искусственная сетчатка
Мы сказали, что пигментный ретинит поражает фоторецепторы сетчатки, из-за чего человек перестает воспринимать свет и слепнет. Это заболевание кодируется генетически. Сетчатка состоит из миллионов рецепторов. Мутация лишь в одном из 240 генов запускает их гибель и портит зрение, даже если связанные с ней зрительные нейроны будут целы. Как быть в этом случае? Имплантировать новую сетчатку. Искусственный аналог состоит из электропроводящего полимера с шелковой подложкой, завернутого в полимерный полупроводник. Когда падает свет, полупроводник поглощает фотоны. Вырабатывается ток и электрические разряды касаются нейронов сетчатки. Эксперимент с мышами показал, что при освещенности в 4-5 лк (Люксов), как в начале сумерек, мыши с имплантами реагируют на свет так же, как и здоровые грызуны. Томография подтвердила, что зрительная кора мозга крыс была активна. Неясно, будет ли разработка полезной для людей. Итальянский технологический институт (IIT) обещает отчитаться о результатах опытов в 2018 году.
Ошибка в коде
Носимые, вшиваемые и встраиваемые устройства — не единственная надежда офтальмологии. Для того, чтобы вернуть зрение, можно переписать генетический код, из-за ошибки в котором человек начал слепнуть. Метод CRISPR, который базируется на инъекции раствора с вирусом, несущим правильный вариант ДНК, излечивает наследственные заболевания. Исправление кода позволяет бороться с возрастной дегенерацией сетчатки, а также с амаврозом Лебера — крайне редким недугом, убивающим светочувствительные клетки. В мире им страдает около 6 тысяч человек. Препарат Luxturna обещает покончить с ним. Он содержит раствор с правильной версией гена RPE65, шифрующим структуру необходимых белков. Это инъекционный препарат — его вводят в глаз микроскопической иглой.
Диагностика и восстановление после операции
Сопровождающий нас повсюду смартфон — прекрасный инструмент для быстрой и точной диагностики. Например, синхронизированный со смартфоном офтальмоскоп Peek Vision позволяет делать снимки сетчатки где и когда угодно. А Google в 2016 году представил алгоритм анализа изображений, основанный на искусственном интеллекте, который позволяет выявлять признаки диабетической ретинопатии на снимках сетчатки. Алгоритм отыскивает мельчайшие аневризмы, указывающие на патологию. Диабетическая ретинопатия — это тяжелое поражение сосудов сетчатой оболочки глаза, ведущее к слепоте.Будущее — за быстрым восстановлением после операций. Интересен препарат Cacicol, представленный турецкими исследователями в 2015 году. Их разработка снимает боль, повышенную чувствительность и жжение после операции на глазах. Препарат уже опробовали клинически: пациенты, которым сшивали роговицу (этот метод используется при лечении ее истончения — кератоконуса), отмечали снижение побочных эффектов.
Каким будет зрение будущего?
Уже сейчас офтальмология достигла поразительных успехов: прежде неизлечимую слепоту можно обратить, а наследственные заболевания побороть, переписав несколько участков генетического кода. В каком направлении будет идти развитие? Попробуем предположить:
Лучше предотвратить, чем лечить. Окулист в смартфоне и нейронная сеть, ставящая диагноз, обещают заметно сократить риск запущенных и едва излечимых болезней глаз. Дополненная реальность (AR) позволит распространять медицинские знания в игровой и необременительной форме. Уже сейчас есть приложения AR, моделирующие последствия катаракты и глаукомы. Знание, как известно, сила. Заменить, если нельзя вылечить. Киборгизация — это ключевой медицинский тренд. Нынешние разработки хороши, но они реконструируют зрение лишь отчасти, позволяя различать размытые контуры. В ближайшие 10 лет технология будет идти по пути повышения качества изображения и детализации. Важная задача — избавиться от носимых компонентов: камеры, очков, кабеля. Имплант должен стать мягче и, можно сказать, дружелюбнее для тканей человека, чтобы не ранить их. Вероятно, чипы без внешних вспомогательных элементов, вживляемые прямо в мозг — это самая перспективная ветка киборгизации зрения. Дешевле и доступнее: 150 тысяч долларов за устройство пока делают бионические глаза очень далекими от рынка и недосягаемыми для большинства больных. Следующий шаг — сделать их максимально доступными. Восстановление за часы: вживление чипов, коррекция сетчатки и даже исправление ДНК требуют хирургического вмешательства. Оно оставляет резь, жжение, фантомные боли и другие неприятные следствия. Препараты будущего будут регенерировать поврежденные ткани за часы. Фантастическое зрение для всех: мгновенный снимок с помощью глаза и сетчатка, подключенная к интернету, только сейчас выглядят как научная фантастика.
Бионический глаз - это... Что такое Бионический глаз?
Бионический глаз ( _en. Bionic Eye) — протез сетчатки глаза высокого разрешения, разработанный Дэниелом Паланкером ( _en. Daniel Palanker), сотрудником Стэнфордского университета (Stanford University) и его научной группой "Биомедицинской физики и офтальмологических технологий" (Group of BioMedical Physics and Ophthalmic Technologies).
Они разработали протез сетчатки глаза высокого разрешения или "Бионический глаз" (Bionic Eye) [http://www.membrana.ru/print.html?1132336800] , обладающий целым рядом преимуществ перед предыдущими проектами лечения слепоты с помощью электронных имплантантов.
В Японии также создана искусственная сетчатка глаза на основе патента США, которая в перспективе поможет вернуть зрение ослепшим пациентам. Как стало известно, технология разработана специалистами корпорации «Сэйко-Эпсон» и базирующегося в Киото Университета Рюкоку. [http://www.medlinks.ru/article.php?sid=30236 ]
Искусственная сетчатка представляет собой фотосенсор, содержащий тончайшую алюминиевую матрицу с полупроводниковыми элементами из кремния. Для лучшего проведения базовых испытаний, она размещена на прямоугольной стеклянной табличке размером 1 см. Для последующих испытаний на животных, в частности, морских угрях, ее предполагается установить на гибких жидкокристаллических панелях.
По принципу действия искусственная сетчатка иммитирует настоящую: при попадании лучей света в полупроводниках образуется электрическое напряжение, которое в качестве зрительного сигнала должно передаваться в мозг и восприниматься в виде изображения.
Разрешение светочувствительной матрицы в составляет 100 пикселей, но после уменьшения размеров чипа, оно может быть увеличено до двух тысяч графических элементов. По утверждению специалистов, если такой чип имплантировать полностью незрячему человеку, он сможет с близкого расстояния различать крупные предметы — такие, например, как дверь или стол.
Из заявления американских ученых к 2009 году глазной протез можно будет увидеть на потребительском рынке. Об этом сообщил профессор офтальмологии Марк Хамейун из Института Глаза в Университете Южной Калифорнии (США). [http://www.membrana.ru/print.html?1132336800]
Первая версия протеза сетчатки глаза уже проходит так называемые «полевые» испытания. Бионическая сетчатка вживлена шести пациентам с потерей зрения в результате заболевания retinitis pigmentosa. Retinitis pigmentosa — неизлечимая болезнь, при которой человек теряет зрение. Наблюдается примерно в одном случае на каждые три с половиной тысячи человек.
Пациенты, которым был вживлен бионический глаз, показали способность не только различать свет и движение, но и определять предметы размером с кружку для чая или даже ножа. К некоторым из них вернулась способность читать крупные буквы.
Устройство для испытаний усовершенствовано. Вместо шестнадцати светочувствительных электродов в него вмонтировано шестьдесят.
В настоящее время в США уже разработан и испытывается на животных протез сетчатки глаза с более 2,5 тыс. пикселей. [http://www.membrana.ru/print.html?1132336800]
Электронный имплантант
ей более 2,5 тыс. и расстоянием между ними в 7 мкм. Это позволило в десятки раз повысить разрешающую способность сетчатки глаза. Старый протез на базе сплошной конструкции с выступающими катодами в количестве не более 100 штук не позволял увеличивать количество фотодиодов (пикселей) из-за нагрева, что не желательно для нервных окончаний сетчатки глаза. [http://www.membrana.ru/articles/health/2005/04/07/205000.html ]
Дырчатая конструкция после имплантации позволила нервным клеткам сетчатки автоматически перетекать с верхней и нижней поверхносей фотодатчика через полости и соединяться, а также уменьшить нагрев пикселей и увеличить их количество. [http://www.membrana.ru/print.html?1132336800]
См. также
* Оптические системы
* Оптические биоинженерные технологии
* Датчик
* Фотосенсор
Примечания
Wikimedia Foundation. 2010.
Вживленное зрение – Огонек № 31 (5477) от 07.08.2017
В российской медицине свершилась революция — впервые была проведена имплантация бионического глаза. Эта операция позволила пациенту прозреть в самом буквальном смысле слова — вновь увидеть свет
Елена Бабичева
Первая в России операция по вживлению бионического глаза шла шесть часов. Каждое движение хирурга выверено: у него под руками микроскопические кабели и детали сложнейшего устройства, требующие ювелирности. Работа идет сверхчувствительными инструментами, которые делают тончайшие разрезы. Время тут не ощущается: врачи шаг за шагом отрабатывают технологию. Зато за пределами операционной время тянется бесконечно. Нервничают родственники пациента, который приехал в Москву из Челябинска с робкой надеждой, что темнота, которая окружала его более 20 лет, рассеется. Нервничают коллеги по цеху и все, кто оказался причастен к этому событию. Когда профессор Христо Тахчиди, оперировавший пациента, наконец вышел из операционной, можно было констатировать, что имплантация прошла успешно. Но все ждали ответа на вопрос: удалось ли в конечном счете вернуть слепому человеку возможность вновь видеть? Ответа на него пришлось ждать несколько дней: когда зажили швы и разрезы, пациенту надели бионические очки и он увидел свет.
— В общем-то, глаз — это просто приспособление, которое передает картинку в мозг, а уже расшифровывает ее мозг,— рассказывает "Огоньку" Христо Тахчиди, профессор, директор Научного исследовательского центра (НИЦ) офтальмологии РНИМУ им. Н.И. Пирогова.— Но что делать, если глаз "не работает"? Вот это устройство, бионический глаз, и дает возможность достучаться до мозга и начать разговор.
Мы беседуем с Христо Тахчиди в том самом центре, где проходила операция, когда стало ясно, что само хирургическое вмешательство прошло успешно. Это означало, что в России положено начало новому типу высокотехнологичных операций, на которые до сих пор могли рассчитывать лишь пациенты за рубежом.
Штучный товар
Эпоха бионического глаза началась еще в начале 2000-х, когда Дэниел Паланкер и его коллеги из Стэнфордского университета разработали это устройство. А в 2004 году первый протез сетчатки глаза был вживлен 64-летней Линде Морфут из Лонг-Бич (Калифорния), у которой был диагноз "пигментный ретинит".
С тех пор конструкция менялась и совершенствовалась, а в прошлом году был создан принципиально иной тип бионического глаза, который может посылать видеосигналы через чип в мозг. Тогда же визуальный стимулятор был имплантирован в мозг 30-летней женщины, что позволило ей видеть вспышки света и различные очертания. Теперь аналогичная операция впервые проведена в России. Для этого был выбран новейший образец имплантата Argus II американской компании Second Sight.
В том, что операцию называют уникальной, нет никакого преувеличения. Действительно, кажется, повторить такое немыслимо. Тем не менее за десять с лишним лет сделано около 300 подобных операций во всем мире. И каждый раз фирма-производитель бионического глаза тщательно о
Бионический глаз человека — Циклопедия
→ Визуальный протез
→ Зрение человека
Бионический глазБионический глаз — искусственная зрительная система для восстановления потерянного зрения при некоторых формах слепоты.
Рис.1. Бионический глаз по технологии, когда видеокамера также находится на лбу, но видеосигналы передаются в микрокомпьютер размером с бумажник, который находится в кармане. Он переводит видимое изображение в набор коротких импульсов ИК (инфракрасного излучения) светодиодно-жидкокристаллического дисплея, с числом точек в несколько тысяч. Этот поток импульсов отражается от наклонного стекла, расположенного на «очках» перед глазами, проходит через хрусталик, и попадает на фотодиоды имплантата — фотосенсоры в сетчатке глаза и на «пара-центральную область» периферийного зрения[1]. Они усиливают сигнал, используя энергию от крошечной солнечной батареи, также имплантированной в радужку глаза.В глазу с поврежденной сетчаткой, например, при скотоме, вживляют имплантат — протез сетчатки глаза, дополняя сетчатку c оставшимися в ней неповрежденными нейронами искусственными фоторецепторами (рис. 1, 2).
[править] Проблема восстановления зрения при слепоте
У людей в пожилом возрасте иногда начинается возрастная деградация сетчатки глаза, при которой светочувствительные рецепторы (палочки, колбочки) начинают атрофироваться, то есть перестают реагировать на свет. Наступает полная слепота. При этом нервные клетки сетчатки глаза не погибают, что позволяет создавать системы для восстановления зрения.
[править] Скотома — одна из основных причин слепоты
→ Скотома
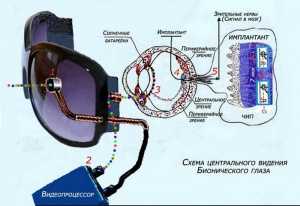 Рис.2 Применение бионического глаза при полной скотоме
Рис.2 Применение бионического глаза при полной скотоме Скотома, от греч. skotos — темнота — пятнообразный дефект, расположенный в поле зрения глаза, вызванный заболеванием сетчатки, болезнями зрительного нерва, глаукомой. Это участки сужают нормальное поле зрения, на них зрение существенно ослаблено, или отсутствует. Различают:
- Абсолютная скотома (absolute scotomata) — участок, в котором зрение отсутствует.
- Относительная скотома (relative scotoma) — участок, в котором зрение значительно снижено.
Предварительно проверить глаза на наличие скотомы можно самостоятельно, проведя исследование с помощью теста Амслера.
Бионический глаз может быть использован для компенсации потерянных зрительных ощущений:
На рис. 2 показаны:
- Видеокамера, передающая оптическое изображение на видеопроцессор;
- Видеопроцессор, который преобразует и передаёт оптическое изображение в виде видеосигналов на передатчик (2) в очках;
- Путь пересылки электронного сигнала на приёмник-ресивер в глазу;
- Полученная информация через миниатюрный проводник передаётся на электроды фотосенсора (4), вживлённого в сетчатку;
- Электронные сигналы по зрительным нервам проходят в головной мозг человека.
[править] Современные технологии восстановления зрения с помощью «бионического глаза»
В ряде случаев используют специальную полимерную пластинку-матрицу с фотодиодами, с которой можно снимать слабые электрические импульсы, передавая их в прилегающие живые нервные клетки. Аналоговые сигналы от созданного на искусственной сетчатке оптического изображения стимулируют сохранившиеся нейроны.
Изображение окружающего пространства может быть сформировано, например, при помощи видеокамеры, установленной на лбу, либо ИК-дисплея, специальных очков, и полимерного фотодатчика — фотосенсора с электродами и отверстиями. Такие системы обеспечивают привычное зрение, как периферийное, так и центральное.
При полной слепоте — в специальные очки встраивается миниатюрная видеокамера, которая работает таким образом:
- (1) информация посылается на видеопроцессор который пациент носит на поясе.
- (2) Процессор преобразует картинку в электронный сигнал и отсылает его на специальный передатчик, также встроенный в очки.
- (3) Затем, этот передатчик посылает беспроводной сигнал на тончайший электронный приёмник-ресивер встроенный в глаз, и фотосенсор (электродная панель) который имплантирован в сетчатку пациента.
Электроды искусственных рецепторов (фотодатчиков) стимулируют оставшиеся действующие зрительные нервы сетчатки глаза, посылая электрические видеосигналы в мозг через зрительные нервы.[2]
[править] Авторы удачных разработок бионического глаза
[править] Дэниел Паланкер
Дэниел Паланкер, Адъюнкт — профессор,Отдел Офтальмологии, Школа Медицины и Hansen Экспериментальная Лаборатория Физики, Стэнфордский УниверситетДэниел Паланкер (Daniel Palanker)[3] из Стэнфордского университета (Stanford University) и его научная группа "Биомедицинской физики и офтальмологических технологий" (Group of BioMedical Physics and Ophthalmic Technologies) разработали протез сетчатки глаза высокого разрешения (имплантант в сетчатку глаза) называемый «Бионическим глазом» (Bionic Eye, рис. 1-3)[4][5].
[править] Разработки группы Паланкера
- Искусственный объект — Оптикоэлектронный протез сетчатки глаза,
- Взаимодействие в ткани — механизмы и использование,
- Электрические эффекты в области ионных каналов и клеточных мембран,
- Интерфейс «Нерв-устройство»,
- Взаимодействие лазерного излучения и живой ткани,
- Микрохирургические технологии,
- Минимально-повреждающие электрооптические, терапевтические технологии
- Оптическое отображение и спектроскопия.
[править] Устройство и работа бионического глаза
→ Устройство и работа бионического глаза
[править] Устройство имплантата
Рис.3.Имплантат (рис. 3) — специальный фотодатчик со встроенными электродами, он реагируют на свет, создавая оптическое изображение. Свет от видеокамеры, проходящий через хрусталик глаза и фокусируемый на сетчатке с дополнительно вживленным имплатируемым в сетчатку глаза дырчатым полимерным фотодатчиком (в случае полной слепоты фотодатчик получает электронные импульсы изображения по тончайшим проводникам от специального вмонтированного в глаз приёмника-ресивера (3 на рис. 2).
Рис. 6. Схема трихроматизма с оппонентным отбором цвета с участием мозга из 6—7 млн колбочек (биолгических сигналов). В мозг человека идет около 1,2 млн нервных окончаний, по которым идут импульсы обработанных аналоговых сигналов от сформированного на сетчатке оптического изображенияВ настоящее время испытывается дырчатая полимерная матрица — имплантант из специального органического материала с количеством фотодиодов 2,5 тысячи на квадратный мм (рис. 3).
[править] Создание искусственной сетчатки глаза человека
→ Создание искусственной сетчатки глаза человека
Дэвид Гамм (David Gamm) директор Глазного Исследовательского института при Университете Висконсин офтальмолог, всемирно известный специалист по выращиванию сетчатки из стволовых клеток человека. Искусственная сетчатка глаза человека заменит бионический глаз и восстановит нормальное цветное зрение у людей, потерявших зрение или находятся в состоянии деградации сетчатки зрительной системы.[6]
[править] Основные вехи и последние достижения
В 2004 году 64-летней устройство с матрицей на металлической основе и 16-ю электродами апробировали на Линде Морфут из Лонг-Бич (Калифорния). В 21 год ей поставили диагноз пигментный ретинит, а к 50 годам она практически полностью ослепла (левый глаз немного воспринимал свет). установили фотодатчик По ее словам:
«Когда мне дали очки, у меня было удивительное чувство, — вспоминает она. — Я могу играть в баскетбол с внуком, могу стоять посреди тротуара. Я могу найти дверь, чтобы выйти из комнаты, и видеть, как моя внучка танцует на сцене. Когда мы приехали в Нью-Йорк, я увидела статую Свободы, какая она большая. В Париже мы ночью поднялись на Эйфелеву башню, и я видела все огни города. Я почувствовала себя в большей степени причастной к окружающему миру». The Guardian[7]
Как утверждает профессор офтальмологии Марк Хамейун из Института Глаза в Университете Южной Калифорнии (США) к 2009 году глазной протез появится на потребительском рынке по цене около пятнадцати тысяч фунтов стерлингов.[8].
При этом речь идет о протезах с фотодатчиками из полимерных материалов с дырчатой конструкцией с 2,5-ной тысячами пикселей на квадратный мм, с возможностью использования периферийного зрения[9][10].
- 1) Однако, когда протезы с фотодатчиками из полимерных материалов с дырчатой конструкцией с 2,5-ной тысячами пикселей на квадратный мм, с возможностью использования периферийного зрения[11][12] будут широко внедряться в практику, то это не значит, что зрение будет цветным.
- 2) Цветное зрение станет возможным при создании АЦП для внедрённых выше указанных имплантатов.
[править] Публикации в новостных агентствах
В 2004 году 64-летней Линде Морфут из Лонг-Бич (Калифорния) с диагнозом пигментный ретинит в возрасте 21 года, когда она практически полностью ослепла к 50 годам (Левый глаз ее немного воспринимает свет) установили фотодатчик с матрицей на основе 16-ти металлических электродов. Эта матрица имеет всего 4 строки по 4 электрода. Однако по ее словам:
- «Когда мне дали очки, у меня было удивительное чувство, — вспоминает она. — Я могу играть в баскетбол с внуком, могу стоять посреди тротуара. Я могу найти дверь, чтобы выйти из комнаты, и видеть, как моя внучка танцует на сцене. Когда мы приехали в Нью-Йорк, я увидела статую Свободы, какая она большая. В Париже мы ночью поднялись на Эйфелеву башню, и я видела все огни города. Я почувствовала себя в большей степени причастной к окружающему миру». The Guardian[13]
Как утверждал профессор офтальмологии Марк Хамейун из Института Глаза в Университете Южной Калифорнии (США) к 2009 году глазной протез появится на потребительском рынке по цене около пятнадцати тысяч фунтов стерлингов,[14] однако этого до сих пор не произошло.
При этом речь шла о протезах с фотодатчиками из полупроводниковых материалов с конструкцией состоящей из 2,5-ой тысяч пикселей на квадратный мм, с возможностью использования периферийного зрения.[15]
- В Великобритании «прозрел» полностью слепой человек. Пациенту в возрасте 76 лет по имени Рон, который ослеп 30 лет тому назад из-за наследственной болезни, удалось пересадить так называемый бионический глаз[16][17].
- 51-летнему Питеру Лэйну в Великобритании одному из первых в мире в декабре 2009 года имплантировали в глаз электронные фотодатчики, посылающие в мозг сигналы, собираемые специальными очками. Эта технология позволила англичанину впервые за 30 лет увидеть очертания объектов, например, дверь, шкаф, а также даже распознавать буквы[18].
восстановить зрение теперь можно бионическими глазами (7 фото)

Осенью этого года доктор Байелер переезжает в Калифорнийский университет в Санта-Барбаре, чтобы возглавить недавно созданную лабораторию Bionic Vision в отделениях компьютерных наук и психологических наук и наук мозга. Он надеется, что его работа приведет к восстановлению зрения у слепых, пишет PCMag.
Нейроинжиниринг — это новая междисциплинарная область, целью которой является разработка устройств, которые могут взаимодействовать с мозгом.
Человеческий мозг имеет примерно 100 миллиардов нервных клеток или нейронов и триллионы связей между ними, организованных в различные области мозга, каждая из которых поддерживает определенную задачу; например, обработка визуальной или слуховой информации, принятие решений или получение информации от А до Б.

Понимание того, как эти нейронные схемы порождают восприятие и действие, требует объединения навыков из различных дисциплин, таких как нейробиология, инженерия, информатика и статистика.
«Интерфейсы мозг-компьютер» можно использовать как для лечения неврологических и психических расстройств, так и для понимания функций мозга, и теперь инженеры разработали способы манипулирования этими нервными цепями электрическими токами, светом, ультразвуком и магнитными полями.
Примечательно, что мы можем двигать пальцем, рукой или даже ногой, просто активируя правые нейроны в моторной коре. Точно так ученые научились активировать нейроны в зрительной коре, чтобы люди видели вспышки света. Первое позволяет лечить неврологические заболевания, такие как болезнь Паркинсона и эпилепсия, тогда как последнее должно в конечном итоге позволить восстановить зрение слепым.

Сколько людей сегодня имеют протезы сетчатки?
Идея визуального протеза или бионического глаза больше не является научной фантастикой. Стоит упомянуть об Argus II — устройстве, разработанном компанией Second Sight, которое доступно в США, Европе и некоторых азиатских странах. Оно предназначено для людей, которые потеряли зрение из-за дегенеративных заболеваний сетчатки, таких как пигментный ретинит и дегенерация желтого пятна.
В мире насчитывается более 300 пользователей Argus II, а производитель, Second Sight только что начал внедрять ORION, устройство, которое полностью пропускает взгляд и напрямую взаимодействует с зрительной корой.

Кроме того, ученые с нетерпением ожидают первых результатов от PRIMA — нового субретинального устройства, разработанного Стэнфордским университетом и коммерческой французской компанией Pixium Vision.
Еще около 30 устройств находятся в разработке по всему миру. В целом, в течение следующего десятилетия должно быть доступно большое разнообразие технологий восстановления зрения.
Как работают нынешние системы
Идея состоит в том, чтобы заменить отсутствующие фоторецепторы микроэлектродной решеткой, которая имитирует их функциональность. Пользователи Argus II также носят очки со встроенной небольшой камерой, поэтому визуальный вход камеры может быть преобразован в серию электрических импульсов, которые имплантат подает на нервные контуры глаза.
Люди могут отличать свет от темного фона и видеть движение, но их зрение очень размыто. К сожалению, с современной технологией очень трудно имитировать нейронный код в глазу и зрительной коре, чтобы обмануть мозг, заставляя его думать, что он видит что-то значимое.
Цель ученых — перейти к электростимуляции и придумать код, который может интерпретировать визуальная система. Это требует как глубокого понимания лежащей в основе нейробиологии, так и технических навыков для разработки жизнеспособного решения в реальном времени.
Они придумали математические уравнения, которые описывают, как отдельные нейроны реагируют на электрическую стимуляцию. Также они выполняют простые психофизические эксперименты, например, просят пользователей Argus II нарисовать то, что они видят, когда они стимулируют разные электроды.

Затем ученые используют результаты этих экспериментов для разработки пакетов программного обеспечения, которые предсказывают, что люди должны видеть для любого конкретного образца электрической стимуляции, который может использоваться производителем устройства, чтобы сделать искусственное зрение, предоставляемое этими устройствами, более понятным для пользователя.
Будущее за бионическим (искусственным), а не за биомимическим (естественным) зрением?
Вместо того, чтобы фокусироваться на «естественном» зрении, ученые хотят создать «практическое» и «полезное» искусственное зрение. Они видят реальную возможность подключиться к существующим нервным схемам слепых и расширить их зрительные ощущения, подобно Google Glass или Microsoft HoloLens.
В настоящее время в этой области доминируют разные производители устройств, которые (по понятным причинам) защищают свою интеллектуальную собственность. Однако швейцарцы считают важным обеспечить нейтральный академический голос для продвижения инструментов и ресурсов, доступных для всех.

Есть много клинических исследовательских групп, изучающих эффекты дегенеративных заболеваний, и несколько биомедицинских групп, разрабатывающих новые устройства. Но на самом деле никто не фокусируется на новых методах и алгоритмах для улучшения кода, с которым эти устройства взаимодействуют с самой визуальной системой человека.
Группа Байелера хочет объединить идеи нейробиологии с компьютерными науками и техникой для создания более интеллектуальных интерфейсов мозг-компьютер и придумать новые способы максимизировать практичность искусственного зрения.
Технология, позволяющая задействовать эту сложную схему, не за горами.
Искусственный бионический глаз - зрительная система будущего
Люди, потерявшие зрение, сегодня имеют возможность пользоваться протезами.
Устройства изготовлены из миниатюрных электродов, вживляемых в глаз, и сенсоров, воспринимающих изображение.
Иногда чувствительные элементы устанавливаются возле органов зрения, но обеспечивается контакт с нервными волокнами для хорошей передачи импульсов к мозгу.
Механизм работы
Бионический глаз изготовлен из полимерной матрицы, укомплектован фотодиодом. Чувствительный элемент улавливает малейшие электрические импульсы и передает их нервным клеткам. Сигналы превращаются в биоэлектрическую форму и взаимодействуют с нервными тканями в сетчатке.
Устройства, альтернативные полимерным матрицам:
- инфракрасные сенсоры;
- видеокамеры;
- специальные очки.
Эти элементы возобновляют работу периферического и центрального зрения. Видеокамера записывает изображение и переносит цифровые данные в конвертер. Сигналы преобразуются и отправляются на фотосенсор, встроенный в сетчатку пациента. Потом биоэлектрические импульсы в сетчатке естественным путем переносятся в нервную систему.
Как видит человек с бионическим глазом
Люди с имплантатами видят предметы и даже различают цвета. Современные устройства позволяют определить до 8 разных оттенков. При электрической стимуляции человек видит небольшие пятна света. Через чувствительные волокна проходит несколько биоэлектрических импульсов. Возникает явление под названием фосфен. Человек воспринимает световые лучи без видимого света, естественным образом проходящего через глаз. Это напоминает цвета, которые способны различать люди, когда закрывают глаза.
 Бионический глаз работает с фосфенами и отображает сцены из окружающего мира, поэтому бионическое зрение отличается от естественного. Перед глазами появляются мигающие пятна и фигуры, которые изучаются пациентами для интерпретации новой окружающей среды, похожей на мигающую мозаику.
Бионический глаз работает с фосфенами и отображает сцены из окружающего мира, поэтому бионическое зрение отличается от естественного. Перед глазами появляются мигающие пятна и фигуры, которые изучаются пациентами для интерпретации новой окружающей среды, похожей на мигающую мозаику.
Сегодня бионические глаза позволяют определять расположение объектов, различать человеческие силуэты и дверные проемы.
Argus II
Бионический глаз изготовлен в Соединенных Штатах. Более 130 пациентов сегодня пользуются с этим устройством. Модель изготавливается из 2-х элементов: имплантат и вживленная в очки миниатюрная видеокамера. Все детали окружающего мира улавливаются сенсорами и передаются на процессор. В очках установлено средство беспроводной связи. Имплантат активирует работу сетчатки с помощью вживленных электродов. Информация через них передается напрямую в нервные волокна.
Пациенты учатся различать горизонтальные и вертикальные линии спустя неделю после начала использования. Постепенно качество зрения улучшается. Стоимость изделия 150000 фунтов. Ученые продолжают проводить исследования, совершенствовать механизмы воспроизводства зрительной информации.
Предыдущая разработка называлась Аргус 1. Современное устройство отличается от него большим количеством ячеек в чипе. Новая система более чувствительна и позволяет передавать на нервные волокна в 2 раза больше данных.
Имплантат использует 60 электродов, чтобы стимулировать оставшиеся здоровые клетки сетчатки пациента. Информация отправляется в зрительный нерв, восстанавливается способность различать цвета, форму и движение.
Имплантация бионического глаза в России
Имплантация цифровой сетчатки, взаимодействующей с бионическим глазом, проведена в России в 2017 году. Пациент, утративший зрение из-за наследственной патологии, снова различает окружающие предметы.
 Бионические имплантаты получили свое название из-за взаимодействия электронной техники и биологического организма. Такие операции часто проводятся с органами слуха. Изготавливаются имплантаты для ушей, электроды которых вставляются в улитку для взаимодействия со слуховым нервом.
Бионические имплантаты получили свое название из-за взаимодействия электронной техники и биологического организма. Такие операции часто проводятся с органами слуха. Изготавливаются имплантаты для ушей, электроды которых вставляются в улитку для взаимодействия со слуховым нервом.
Преобразователь находится за ушной раковиной, улавливает звуки из окружающего пространства и перерабатывает их в биоэлектрические импульсы. Сигнал влияет на слуховой нерв и передается в клетки мозга.
Научно-исследовательский центр в области офтальмологии ФГБОУ ВО РНИМУ имени Н.И. Пирогова выбран производителем зрительных имплантатов для проведения первой в России операции. Руководитель этого центра заинтересовался бионическим глазом и предложил российским ученым ознакомиться с новой технологией. Специалисты получили возможность изучить работу зрительной системы под новым углом, провели основательную работу со зрительным анализатором.
Это один из действующих примеров восстановления связи с нервной системой через электронику. Впервые была восстановлена цепочка передачи импульсов, нарушенная заболеванием органов зрения. Главное направление в изучении вопроса протезирования – это повышение количества сенсоров на искусственной сетчатке для более подробного снабжения информацией нейронов.
Полезное видео
Больше информации про искусственный бионический глаз можно получить, посмотрев видеоролик.
Рейтинг автора
Написано статей
Была ли статья полезной?Оцените материал по пятибальной шкале!
Если у вас остались вопросы или вы хотите поделиться своим мнением, опытом - напишите комментарий ниже.
Что еще почитать
Ученые подключили бионический глаз прямо в мозг незрячей женщины
Искусственная сетчатка помогает незрячим людям видеть уже более десяти лет. Но тем, чья болезнь возникает за пределами сетчатки, технология не может помочь. Именно поэтому новая разработка игнорирует глаза и посылает сигнал прямо в зрительную кору мозга.
Женщина из Испании, которая 16 лет была незрячей, смогла увидеть очертания мира в низком разрешении. Это получилось благодаря бионическому глазу, разработанному нейроинженером Эдуардо Фернандесом.

Фото: twitter.com
Бернадета Гомес потеряла зрение в 42 года из-за токсической невропатии зрительного нерва. Болезнь разрушила пучки нервов, соединяющие глаза с мозгом. Женщина полностью лишилась зрения – она не могла распознать даже свет.
Гомес начала работать с исследователями в конце 2018 года. В течении полугода она проводила четыре дня в неделю, настраивая технологии и проверяя ее возможности. Система работает так: к затемнённой паре очков прикреплена крошечная камера. Камера подключена к компьютеру – он преобразует прямую трансляцию видео в электронные сигналы. Эти сигналы отправляются с помощью кабеля в порт, который Фернандес хирургически внедрил в заднюю часть черепа женщины. Так изображение попадает в зрительную кору мозга.
Хотя подобные эксперименты могут не только провалиться, но и ухудшить самочувствие пациента из-за нескольких факторов риска, история Гомес оказалась успешной.

Фото: bionicsqueensland.com.au
Женщина с помощью очков видит только светящиеся очертания объектов, но этого достаточно, чтобы распознать буквы, свет и лица людей. Ученые также отметили, что Гомес поиграла в простую компьютерную игру, похожую на Pac-Man.
Эдуардо Фернандес планирует продолжить исследования. Следующими шагами станут: поиск способов предотвращения разрушения имплантатов в теле и привлечение большего количества незрячих людей. Гомес – его первая пациентка, но по словам нейроинженера, в течение нескольких лет они установят имплантаты еще пяти людям. Ученые также проводили эксперименты на животных, но «кошки и обезьяны не могут объяснить, что они видят».
Источник
Реклама на Компьютерре
Устройство и работа бионического глаза — Циклопедия
→ Бионический глаз человека
Рис.3.Имплантат (рис. 3) — специальный фотодатчик со встроенными электродами, он реагируют на свет, создавая оптическое изображение. Свет от видеокамеры, проходящий через хрусталик глаза и фокусируемый на сетчатке с дополнительно вживленным имплатируемым в сетчатку глаза дырчатым полимерным фотодатчиком (в случае полной слепоты фотодатчик получает электронные импульсы изображения по тончайшим проводникам от специального вмонтированного в глаз приёмника-ресивера (3 на рис. 2).
Рис. 6. Схема трихроматизма с оппонентным отбором цвета с участием мозга из 6—7 млн колбочек (биолгических сигналов). В мозг человека идет около 1,2 млн нервных окончаний, по которым идут импульсы обработанных аналоговых сигналов от сформированного на сетчатке оптического изображенияВ настоящее время испытывается дырчатая полимерная матрица — имплантант из специального органического материала с количеством фотодиодов 2,5 тысячи на квадратный мм (рис. 3). Для сравнения: здоровый глаз содержит на сетчатке глаза около 6—7 млн колбочек и 110—125 млн палочек — светочувствительных элементов, что эквивалентно 100 мегапикселям для матрицы цифрового фотоаппарата. Но в мозг человека идет около 1,2 млн нервных окончаний, по которым идут импульсы выделенных основных биосигналов RGB от сформированного на сетчатке оптического изображения не в цвете (см. рис.6). При этом лучи предметных точек изображений, сфокусированные на фокальную поверхность сетчатки глаза — на колбочки и палочки центральной и периферийной зоны сетчатки в виде видимых лучей в виде сигналов перерабатываются в самой сетчатке глаза (рецепторный уровень) во внешних долях мембран с участием фоторецепторов ipRGC, головного мозга, разновидностями фотопигментов опсина. Происходит оппонетный отбор (см. рис.6), выделение основных спектральных лучей — биосигналов (см. Биохимия зрительного восприятия света), равных энергии длин электромагнитных волн предметных точек RGB не в цвете (см. Трихроматизм и принцип оппонентности цветного зрения), которые передаются по зрительным нервам в мозг (нейронный уровень). Для сравнения рассмотрим работу фотосенсоров цифровых фотоаппаратов, где сфокусированные аналоговые сигналы (фотоны) изначально попадают на пиксели фотоматриц и накапливаются в виде электронов, с зарядом, равным энергии падающей длины волны также не в цвете. Аналогичный имплантат может вернуть глазу 100 % зрение (острота зрения 1:1, или относительное значение 20:20). Сравним: в случае 20:400 = 0,05 наступает «юридическая» слепота. Это означает, что при зрении = 0,05 расстояние клеток от электродов не более 30 мкм.
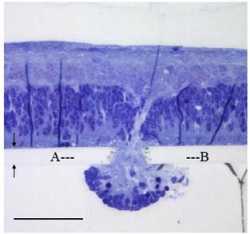 Разрез под микроскопом. Миграция клеток сетчатки крыс P7 через мембрану из полимера Mylar, расположенную в субретинальной зоне. Диаметр отверстия 16 мкм, толщина мембраны 13 мкм.[1]
Разрез под микроскопом. Миграция клеток сетчатки крыс P7 через мембрану из полимера Mylar, расположенную в субретинальной зоне. Диаметр отверстия 16 мкм, толщина мембраны 13 мкм.[1] И получается, что как только инженеры сближают электроды между собой (то есть увеличивают разрешение микросхемы), каждый из них начинает действовать сразу на ряд ближайших клеток — а должен, в идеале, — только на одну, иначе смысл в высоком разрешении изображения телекамеры полностью пропадает.
Чтобы это препятствие обойти, нужно «привязать» по одному электроду на одну, от силы — две клетки.
Для остроты в 0,25 это расстояние не должно превышать 7 мкм. Откуда получаемая плотность фотодиодов составляет 2,5 тысяч пикселей на 1 кв.мм. При такой плотности имеет место сжатие и слияние нервных клеток, что отрицательно сказывается на работе имплантированных матриц. Задача решается, если использовать работу матриц по всей глубине сетчатки глаза, или обеспечить работу электродов на минимальном расстоянии от нервных клеток. Применение конструкции на базе полимерных матриц с отверстиями 15-40 мкм (рис. 2), имплантируемых в сетчатку, показало, что за короткое время нервные клетки сами проникают в отверстия с двух сторон и объединяются, а также заполняют пространство между выступами электродов, близко подходя к электродам. Это позволило использовать такой фотосенсор в опытных работах.
Этот фотодатчик в настоящее время используется при опытах на крысах и свиньях.
[править] Восприятие изображения
→ Восприятие изображения
→ Периферийное зрение
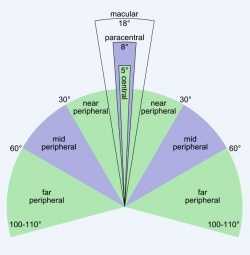 Рис.4.Боковое зрение человеческого глаза. Рис.5.Поле зрения человеческого глаза.
Рис.4.Боковое зрение человеческого глаза. Рис.5.Поле зрения человеческого глаза. Существовавший ранее метод использовал передачу изображения с видеокамеры напрямую в глаз. При этом спроецированное изображение воспринималось блоком фотодатчиков, и сигнал со ста его пикселей передавался через нервные клетки в мозг. Однако то, что «видит» видеокамера, вызывало у человека ощущение несовпадения с тем, что происходит при естественном движении яблока глаз глазного яблока.
- По другой технологии видеокамера также находится на лбу (рис. 1), но видеосигналы передаются в микрокомпьютер размером с бумажник, который находится в кармане. Он переводит видимое изображение в набор коротких не видимых импульсов инфракрасного излучения светодиодно-жидкокристаллического дисплея, с числом точек в несколько тысяч. Этот поток импульсов отражается от наклонного стекла, расположенного на «очках» перед глазами, проходит через хрусталик, и попадает на фотодиоды имплантата — фотосенсоры в сетчатке глаза. Они усиливают сигнал, используя энергию от крошечной солнечной батареи, также имплантированной в радужку глаза.
Хотя инфракрасные лучи человек не видит, но он воспринимает результат воздействия электрических импульсов на клетки сетчатки (жёлтого пятна), как изображение. Сам фотодатчик имеет размер 3 мм и покрывает 10 % поля зрения в центре сетчатки. Согласно рис. 4 это немного более области «parazentral»[1] (8 % поля зрения в центре сетчатки или это «почти периферийное», иногда называемое «пара-Центральное» видение, которое существует рядом с центром взгляда — центральной ямкой.). Суть этого изобретения состоит в том, что благодаря очкам с полупрозрачным (дихроидным зеркалом у человека сохраняется естественное восприятие сцены, расположенной перед ним, при помощи визуального объединения изображения, созданного еще живыми фоторецепторами глаза в области периферийного зрения, с наложенным на центральную область глаза изображением от видеокамеры.
Небольшие быстрые движения глаз или БДГ (Фаза быстрого сна, БДГ-фаза, REM-фаза (от БДГ — «быстрые движения глаз», англ. REM — rapid eye movement) — фаза сна, характеризующаяся повышенной активностью головного мозга.), которые также очень важные для полноценного зрительного восприятия, и при этом сохраняют свою функциональность. Человек сам смотрит как на объект, и в то же время получает дополнительное электронное инфракрасное изображение. Положение этого изображения на сетчатке и внедрённой решётке электродов меняется вместе с движением головы, а имплантант работает в условиях максимального использования оставшегося периферийного зрения.
- По технологии (рис. 2):
- 1) Видеокамера на очках записывает картинку и посылает информацию на видеопроцессор, который человек носит на поясе.
- 2) Процессор преобразует картинку в электронный сигнал и посылает его на специальный передатчик в очках.
- 3) Электронный сигнал затем посылается на приёмник-ресивер в глазу человека.
- 4) Эта информация посылается через крошечный проводок на электроды фотосенсора (протеза), присоединенные к сетчатке глаза. Электрические импульсы проходят через оптический нерв в мозг человека[2].
Как известно, фотосенсор (фотодатчик) создан и во многом копирует биологический фоторецептор (фотодатчик} сетчатку, которые работают по принципу восприятия спектральных лучей света блоками пикселей или блоками колбочек с внешними долями мембран и представляют мозаику ячеек (фотосенсор) и мозаику блоков колбочек RGB.
Как видим, что такие схемы восприятия спектральных лучей в биологии и цифровой фотографии аналогичны, и практика лечения слепоты используют принципы биофизических процессов восприятия спектральных лучей (на принципе трихроматизма). Важно подчеркнуть, что данный имплантант пока содержит около 2500 пикселей и равен по размеру пшеничного зерна. То есть он внедряется в зону сетчатки, в центре жёлтого пятна, где нет палочек. (Уже здесь ещё раз практически, в результате восстановления зрения слепого человека видим, что трихроматизм (цветное зрение) (cм. Теория трёхкомпонентного цветного зрения) верна.
Внедрённый первый протез в сетчатку глаза с 2500 пикселями, выдаёт сигналы, полученные с видеосистемы на фотосенсор, несущего пиксели, которые воспринимают спектральные лучи как любая видеокамера в цвете — RGB.
Однако, даже имплантировав решётку в толщу сетчатки, нельзя добиться слишком близкого соприкосновения электродов и её глубинных клеток, лежащих непосредственно под умершими фоторецепторами.
И получается, что как только инженеры сближают электроды между собой (то есть увеличивают разрешение микросхемы), каждый из них начинает действовать сразу на ряд ближайших клеток сетчатки (например, колбочки) — а должен, в идеале, — только на одну, иначе смысл в высоком разрешении изображения телекамеры полностью пропадает.
Но как известно и фотосенсор с пикселями, и сетчатка глаза с фоторецепторами, своими внешними долями мембран на начальном рецепторном этапе восприятия спектральных лучей в виде фотонов (с энергией длин электромагнитных волн) формируют цветные сигналы не в цвете[3], (см. Рецепторный и нейронный уровень восприятия света). Фотосенсоры цветного видео эти сигналы накапливают в пикселях как конденсаторы с количеством электронов, соответствующей энергии захваченной длины волны, потом, преобразователь АЦП переводит первичное не цветное изображение в цветное. В сетчатке — на рецепторном уровне, где внедрён фотосенсор происходит та же картина (в здоровой сетчатке вместо пикселей работают при цветном зрении колбочки, которые своими внешними мембранами воспринимают падающие спектральные лучи на рецепторном уровне также не в цвете. И пиксели, и колбочки изначально получают информацию о длине волны в виде её энергии не в цвете). Пока же на первой стадии стадии лечения слепоты удалось внедрить протез с 2500 пикселей, который приняла сетчатка и первое, что получено, это проводимые цветные не обработанные сигналы, которые поступают в мозг не как из мембран, то есть без участия фотопигментов, без оппонентного отбора, без учёта ретиномоторной реакции, без участия работы третьего фоторецептора ipRGC и т. д. (Колбочки и палочки атрофированы). В мозгу же в результате создаётся оптическое не цветное изображение в результате попадания в мозг сигналов от имплантанта — фотосенсора без системы АЦП, которые не могут преобразоваться в цветные в силу указанных выше причин. Человек видит серые контуры предметов, человек видит свет. Это не значит, что описанные устройства не несут никакой информации о цвете. Думаю в скором будущем человек будет видеть и цветное изображение. (Слово за применеие нанотехнологии, систем преобразования сигнала от фотосенсора в сигнал, который посылает здоровая колбочка).
В России проведена уникальная операция: пациенту установили бионический глаз
Бионический глаз — это электронная система зрения, которую несколько лет назад изобрели в Америке. Суть изобретения в следующем.
На переносице специальных очков установлена микрокамера, которая выводит изображение на преобразователь, укрепленный на поясе. Цифровая информация направляется на антенну, прикрепленную к дужке очков со стороны оперированного глаза. Попробуйте представить себе: преобразователь с антенной фиксируется бандажной лентой к глазному яблоку. А от преобразователя внутрь глаза идет микрокабель толщиной около 3 мм, на конце которого установлен чип размером приблизительно 5 на 10 мм. На чипе 60 ячеек, от каждой из которых идет микропровод, собственно, и формирующий микрокабель. Чип фиксируется на макулярной области сетчатки глаза.
Как работает эта система? Камера ловит изображение и передает на преобразователь, откуда оно поступает на антенну, укрепленную на дужке очков. Преобразователь переводит информацию в микротоки и отправляет их на чип. Соты чипа возбуждают расположенную под ними сетчатку, а потом этот импульс через зрительный нерв поступает в кору головного мозга. Мозг расшифровывает эту информацию.

фото: vesti.ru
Григорий Ульянов с дочерью Еленой.
Главный вопрос: что увидит человек? Бионический глаз работает по принципу, схожему с работой монитора, на котором качество изображения зависит от количества и размера светящихся точек: чем они мельче, тем четче изображение.
В чипе первой модели системы было 30 ячеек, а во второй, о которой идет речь, их стало уже 60. Так вот изображение, которое видит пациент, соответствует упрощенному зрению. Изображение черно-белое с оттенками серого, и оно достаточно размыто.
Строго говоря, пациент видит различные светящиеся геометрические фигуры, то есть круги, линии, прямоугольники, квадраты и т.д., расположенные в различных комбинациях. А каждая комбинация у конкретного пациента будет соответствовать тому или иному привычному изображению. Например, комбинация из светящегося круга, нескольких линий и треугольника может обозначать тарелку, находящуюся на столе. Интересно, что каждый пациент в зависимости от степени повреждения сетчатки предметы окружающего мира будет воспринимать в своей, абсолютно индивидуальной комбинации.
Понятно, что новому зрению пациента предстоит обучить. Выглядит это так: пациента просят посмотреть в определенном направлении и спрашивают, что он видит. Человек описывает комбинацию из светящихся фигур, и ему объясняют, что эта комбинация означает, например стакан, коробку и т.д.
Сегодня процесс обучения этому зрению можно использовать только применительно к людям, которые в прошлом видели. Но когда сами ученые овладеют языком комбинаций световых фигур, станет возможно помочь и тем, кто не видит с рождения.

Профессор Христо Тахчиди. Фото: eye-centre.ru
* * *
Эту уникальную конструкцию разработала одна американская фирма. Первых систем во всем мире имплантировано около трехсот, а систем второй модели — сорок.
А как чувствует себя человек, которому сделали уникальную операцию? Григорий Александрович Ульянов пока передвигается с помощью дочери Лены. Мне он показался инопланетянином, который спустился на землю.
Григорий Александрович сказал, что вначале очень боялся, но на операцию пошел с улыбкой, ощущения были добрые. С каждым днем чувствует себя все лучше. Сегодня, то есть 21 июля, впервые дошел «до белого света», и оказалось, что это диван. Ручка двери тоже выглядит как свет. Увидел яблоко. А вот стакан на столе пока не разглядел.
— Я не жалею, что пошел на операцию. Буду добиваться победы, буду, и все. Я все равно все увижу. У меня день рождения 1 июля, а операцию сделали 30 июня. Когда я проснулся в реанимации, врач сказал мне: с днем рождения. Получилось, что я заново родился.
Лена сказала, что отец не паникует, и его единственное желание — поскорее вернуться домой. Он собирается заниматься спортом, читать лекции для слепоглухонемых и показывать фокусы. У него есть кошка Принцесса, и он по ней скучает.
* * *
Это штучные операции. Но не только потому, что очень высокие требования к врачам, которые проходят специальную длительную подготовку. Дело в том, что используется уникальное оборудование, и важно, чтобы так называемый человеческий фактор, по сути дела, был сведен к нулю. Операцию может исполнить только виртуоз, поскольку операционный стандарт должен быть соблюден на сто процентов.
Почему я сравнила эту операцию с первым полетом в космос? Это не сравнение, это констатация факта. Потому что достигнут главный результат: с помощью электроники удалось установить связь со зрительным участком мозга. Как сказал профессор Тахчиди, «мы точно знаем, что он нам отвечает, — это начало научного прорыва в понимании процесса зрения. Появилась возможность в конце концов расшифровать это чудо природы…»
Да, пока врачи не научились возвращать пациентам зрение. Но время покажет. Бионический глаз возвращает пациенту возможность самостоятельно существовать, а значит, чувствовать себя человеком. И разве это не чудо?