Ангиогенез что это такое
Ангиогенез — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 июня 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 июня 2019; проверки требует 1 правка.Ангиогенез — процесс образования новых кровеносных сосудов в органе или ткани, в ходе которого происходит реорганизация первичной капиллярной сети, которая сокращается до более простой и четкой системы капилляров, артерий и вен. В норме в организме процессы ангиогенеза протекают с умеренной интенсивностью и активизируются только при регенерации повреждённых тканей, канализации тромбов, ликвидации очагов воспаления, образовании рубца и тому подобных процессах восстановления, а также при росте и развитии организма.
В опухолевых же тканях, особенно в тканях злокачественных опухолей, ангиогенез протекает постоянно и очень интенсивно[1][2]. Это является одной из причин быстрого роста злокачественных опухолей, поскольку они очень хорошо кровоснабжаются и получают значительные количества питательных веществ, лишая их здоровые ткани организма. Кроме того, усиленный ангиогенез в опухоли является одним из механизмов её быстрого метастазирования, так как опухолевые клетки имеют свойство метастазировать по ходу кровеносных сосудов (вдоль стенок) или разносятся по всему организму с током крови.
Усиленый ангиогенез в опухолевых тканях сделал возможным создание противоопухолевого лекарства, активируемое под действием тимидинфосфорилазы (опухолевого ангиогенного фактора), — Капецитабина.
Лекарственные средства, подавляющие злокачественный ангиогенез, преимущественно имеют своей мишенью факторы роста эндотелия сосудов (афлиберсепт[en], бевацизумаб) и их рецепторы (сорафениб, сунитиниб, пазопаниб[en], акситиниб[en], рамуцирумаб)[3].
Стимулирование ангиогенеза (терапевтический ангиогенез) используется для лечения или профилактики патологических состояний, характеризующихся снижением функции образования новых кровеносных сосудов[4], а также при создании витализированных имплантатов[5].
- ↑ Folkman, J. Tumor angiogenesis: therapeutic implications (англ.) // New England Journal of Medicine. — 1971. — Vol. 285. — P. 1182-1186.
- ↑ Dvorak, H. F. Tumors: wounds that do not heal. Similarities between tumor stroma generation and wound healing (англ.) // New England Journal of Medicine. — 1986. — Vol. 315. — P. 1650-1659.
- ↑ Kreuger, J.; Phillipson, M. Targeting vascular and leukocyte communication in angiogenesis, inflammation and fibrosis (англ.) // Nature Reviews Drug Discovery. — 2016. — Vol. 15, no. 2. — P. 125-142. — doi:10.1038/nrd.2015.2.
- ↑ Швальб П. Г., Гавриленко А. В., Калинин Р. Е. и др. Эффективность и безопасность применения препарата «Неоваскулген» в комплексной терапии пациентов с хронической ишемией нижних конечностей (IIb-III фаза клинических испытаний). Клеточная трансплантология и тканевая инженерия. 2011; 3: 76-83.
- ↑ Клабуков И.Д., Балясин М.В., Люндуп А.В., Крашенинников М.Е., Титов А.С., Мудряк Д.Л., Шепелев А.Д., Тенчурин Т.Х., Чвалун С.Н., Дюжева Т.Г. Ангиогенная витализация биосовместимого и биодеградируемого матрикса (экспериментальное исследование in vivo) (рус.) // Патологическая физиология и экспериментальная терапия. — 2018. — Т. 62, № 2. — С. 53-60. — ISSN 0031-2991.
Ангиогенез: Движущая сила любого рака
Интересно понаблюдать за перипетиями вхождения новых идей, нередко это очень трудный и тернистый путь. Давайте посмотрим, что случилось с одной революционной теорией, которая ко всеобщему облегчению уже миновала третий этап и теперь ее справедливость ни у кого не вызывает сомнений.
Речь идет об ангиогенезе (развитии кровеносных сосудов, ассоциирующихся со злокачественными новообразованиями). О самом этом понятии - ангиогенез - онкологическое сообщество до недавнего времени ничего не ведало и ведать не хотело, считая это бредом идиота-хирурга, взявшегося учить “неприкосновенную” касту онкологов. Доктор Джуда Фолкман, военный врач-хирург флота США, в середине шестидесятых годов, проводя многочисленные онкологические операции, заметил одну странную особенность. Буквально все злокачественные опухоли были насквозь пронизаны и опутаны мелкими кровеносными сосудами (капиллярами). Причем в отличие от нормальных капилляров, достаточно прочных и гибких, эти раковые сосуды и капилляры были необычно хрупкие, словно сделанные на скорую руку.
Ангиогенез и рак
Здесь нужно заметить, что кровеносная система со всеми ее сосудами и капиллярами, дается нам раз и навсегда и формируется еще в утробе матери. Между прочим, ее общая длина составляет ни много ни мало 60 000 миль, т.е. больше 100000 км.
Подписывайтесь на наш аккаунт в INSTAGRAM!
Как правило, клетки стенок кровеносных сосудов не делятся и не создают новых капилляров, за исключением чрезвычайных обстоятельств - ранение например, когда требуется провести ремонт поврежденных тканей или органов, или после менструации. Это как раз те случаи, когда необходима скорость даже в ущерб качеству. Такие сосуды крайне непрочны, при малейшем повреждении могут рваться и кровоточить, и как только необходимость в них отпадает организм от них избавляется. Для этого существует специальный механизм саморегуляции и строгого контроля.
Капилляры несут питательные вещества и кислород ко всем клеткам тела и уносят отходы их жизнедеятельности, без них ни одна клетка существовать не может. Это равно относится и к раковым клеткам. Для выживания растущая опухоль отчаянно нуждается в собственной кровеносной системе, но поскольку опухоль растет очень быстро, то и сосуды должны расти не менее быстро, т.е. опять же скорость в ущерб качеству. Да по-другому и быть не может, поскольку используется один и тот же механизм роста сосудов, как для раковой опухоли, так и для аварийного ремонта поврежденных систем организма.
Доктор Фолкман назвал это явление (обретение опухолью способности создавать собственную кровеносную систему) angiogenesis - ангиогенез, от греческого angio- сосуд и genesis- рождение. Он вполне резонно рассудил, что раковые зародыши размером с острие иглы каким-то образом умудряются использовать имеющийся у организма механизм быстрого реагирования для создания временной кровеносной системы, и если не дать им этим механизмом воспользоваться, то они так и останутся в этом спящем состоянии и никогда не смогут развиться в то, что называют злокачественной опухолью.
Реакция научного сообщества была вполне предсказуема. Хирург, который по-видимому ничего не знает о биологии рака, выступает с какой-то странной “водопроводной” теорией. Но он был не просто хирургом, но и одновременно профессором медицинского факультета в Гарварде и главой хирургического отделения в крупной детской больнице - упрямый и вовсе не робкого десятка человек. Совсем уж отмахнуться от его эксцентричных гипотез было нельзя, и в 1971 году они были опубликованы в «Медицинском Журнале Новой Англии».
Что потом началось - не опишешь словами. Никакой реакции на статью не было. Зато было другое: за ним прочно укоренилось прозвище - шарлатан, с его лекций демонстративно уходили, коллеги по работе просто от него шарахались, даже студенты стали его покидать.
В карьерной американской медицине такое пятно в преподавательской биографии никому не нужно. Непреклонность доктора Фолкмана стоила ему потери поста главы хирургического отделения.
"Бороться и искать, найти, и не сдаваться" - это про него, он вполне бы мог претендовать на роль третьего капитана в известном романе В. Каверина. Не обращая внимания на злопыхателей, доктор продолжал исследования и сформулировал свою теорию развития рака.
Вот ее основные положения:
1. Микроопухоли не могут развиться в опасные для жизни злокачественные новообразования без создания собственной кровеносной системы, питающей их.
2. Для того чтобы это сделать, микроопухоли выделяют химические субстанции, называемые ангиогенины, побуждающие кровеносные сосуды достигать их и генерировать систему новых сосудов.
3. Раковые клетки, отпочковавшиеся от основной опухоли - то есть метастазы, опасны только тогда, когда им удается создать свою собственную кровеносную систему.
4. Основная опухоль посылает метастазы. Но как всякая колониальная империя, она держит руку на пульсе и не дает своим колониям-метастазам слишком большой независимости, производя специальную химическую субстанцию - ангиостатин, блокирующую рост новых сосудов.
Да, но где доказательства, господа? Где этот мифический ангиостатин, блокирующий рост сосудов? Смешно было думать, что исследовательские лаборатории бросятся искать вещество, являющееся плодом воображения свихнувшегося хирурга, тем более, что задача представлялась совершенно непосильной - найти этот самый ангиостатин среди тысяч разных белков, которые производит растущая опухоль. Как в сказке - “Пойди туда, не знаю куда и принеси то, не знаю что”. Дурных нема. Это умные так думают и ошибаются - как в нашем случае. Но безумные идеи на то и безумные, что привлекают одержимых людей.
Таким оказался молодой исследователь-хирург Майкл О'Рейлли, чья воля и упорство была под стать боссу. В течение двух лет он искал ангиостатин в моче мышей, резистентных к метастазам. Наконец он нашел протеин, блокирующий рост сосудов куриных эмбрионов, где сосуды растут очень быстро.
Момент истины настал. Нужно было показать эффективность ангиостатина на живых организмах. Двадцати мышам ввели тип рака, чьи метастазы при удалении основной опухоли быстро прорастают в легкие. Сразу после введения раковых клеток половине мышей ввели ангиостатин. Через несколько дней в присутствии многочисленных свидетелей провели вскрытие всех участников эксперимента. Легкие контрольной группы были черными, пронизанными метастазами. У другой половины получивших инъекцию мифического ангиостатина легкие остались девственно розовыми, без каких-либо признаков рака. Случилось это в 1994 году, двадцать лет спустя.
Ангиогенез сразу занял сердца и умы всего онкологического и фармацевтического сообщества. А где же хулители, с их званиями и дипломами?Думаете, лишили-отобрали? Да ничего подобного! Они теперь в первых рядах нового прогрессивного направления в онкологии. Вещают. Ну да бог с ними.
Гораздо более интересно знать, что же с тех пор изменилось в плане эффективности лечения раковых больных. Где фармацевтические гиганты с их огромными ресурсами? Что они сделали за прошедшие 15 лет? Работали и работают, уже выдали восемь препаратов, блокирующих рост сосудов. Эти препараты выгодно отличаются от традиционных препаратов для химиотерапии, прежде всего своей избирательностью, они не затрагивают здоровые сосуды и гораздо менее токсичны для организма.
Так что же, можно теперь вздохнуть с облегчением? Нашлась, наконец, серебряная пуля, победили это чудовище? Очень хотелось бы дать утвердительный ответ. Но все мы знаем, что это не так.
В одних случаях новые препараты были весьма эффективны, в других - результаты разочаровывали. Все это было очень далеко от того сто-процентного результата, продемонстрированного на мышах. И дело не только в том, что одно дело - мыши, а совсем другое - люди. В том мышином эксперименте ангиостатин мышам вводили практически одновременно с раковыми клетками, т.е. эти клетки еще не успели сформировать собственно опухоль со своей кровеносной системой. Препарат блокировал развитие опухоли в самом зародыше, прекрасно показав справедливость теории доктора Фолкмана. Если же время упущено и основная опухоль, или ее метастазы успели сформировать свою собственную кровеносную систему, тогда одним ангиостатином не обойдешься, ведь он и задуман был как некий наместник, представитель центра, держащий под контролем заморские территории. Ну а если этим территориям удалось стать самодостаточными, кому он тогда нужен.
Что же из всего этого следует? Совершенно верно, необходимо постоянно блокировать этих монстров в колыбели. Ну вот, скажете Вы, приехали. Прикажете теперь в профилактических целях эти препараты, как витамины, глотать на постоянной основе. Ни в коем случае, даже мысли такой не держу. Эта золотая по стоимости профилактика ничего кроме вреда принести не может.
Вырисовывается какой-то замкнутый круг. Больным, а еще больше здоровым людям, (никого не хочу пугать, но как можно было заметить, отсутствие клинических показателей вовсе не означает отсутствие раковых клеток) жизненно необходимо иметь вещества типа ангиостатина на постоянной основе, но химические препараты на эту роль определенно не годятся. По счастью, ангиогенез привлек внимание не только капитанов фармацевтической индустрии, но и ученых из альтернативного сообщества.
Они и показали, что те же самые активные вещества фармацевтических препаратов, блокирующие рост сосудов, можно найти в природных соединениях и их повседневное употребление никакими побочными эффектами (медицинского и финансового характера) никому не грозит. Но вопрос этот не столь однозначен - есть вещества, блокирующие рост сосудов, а есть и провоцирующие их рост. Оказывается, организму нужны и те и другие - главное баланс. Опять настало время для мозгового штурма, надеюсь последнего в нашем расследовании. Придется потерпеть, без малопонятных терминов никак не обойтись. Рассмотрим более подробно механизм ангиогенеза не любопытства ради, а с чисто утилитарной целью - выявить его слабые места, ведь ничто в природе не совершенно.
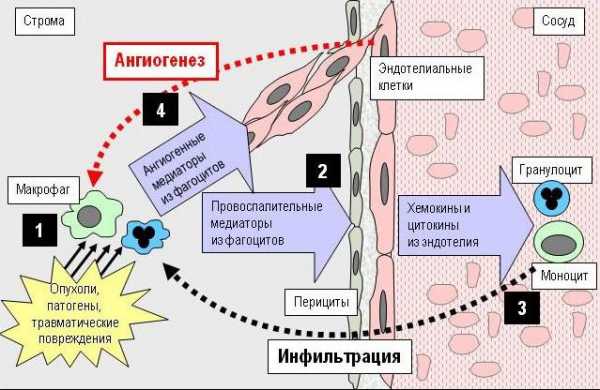
Практически все живые организмы обладают способностью восстанавливать свои поврежденные ткани, для этого существует специальный хорошо отлаженный механизм. Речь идет о воспалительном процессе. Как только случается повреждение любого рода - будь то порез, ожог, удар, инфекция и пр., он немедленно начинает работать. Каким образом? Тромбоциты крови, как сторожевые псы, фиксируют нарушителя и окружают его со всех сторон. Они подают сигнал бедствия, выделяя определенную химическую субстанцию PDGF - фактор роста, полученный из тромбоцитов.
Получив этот сигнал, в дело вступают своего рода “силы быстрого реагирования” - лейкоциты иммунной системы. Они в свою очередь начинают выделять химические вещества (сложные названия которых я опускаю ради простоты изложения), координирующие весь процесс восстановления. Для удобства назовем их воспалительные субстанции (ВС). Работа закипела. В первую очередь эти химические вещества расширяют окружающую рану, кровеносные сосуды, облегчая к ним доступ прибывающих туда в качестве своего рода подкрепления других клеток иммунной системы. Затем они как бы запаивают рану, вбрасывая в кровь огромное количество тромбоцитов, что приводит к свертыванию крови вокруг раны. Половина работы сделана.
Теперь остается разобраться с непрошеными гостями, покусившимися на целостность организма. Для этого прилегающие к ране ткани разрыхляются, давая возможность иммунным клеткам войти и уничтожить чужеродные тела. Но остались поврежденные ткани, и здесь, внимание, включается механизм восстановления повреждений.
Подписывайтесь на наш канал Яндекс Дзен!
Остановимся на этом подробнее. Те же самые химические вещества, название которых мы опустили, побуждают поврежденные ткани к росту. Ткани должны восстановить свои утерянные позиции путем ускоренного деления клеток, а для этого их, естественно, необходимо обеспечить кислородом и питательными веществами. Окружающие рану кровеносные сосуды получают команду быстро расти и организовать необходимое кровоснабжение. Все это продолжается ровно столько, сколько нужно для полного восстановления раны. Как только это происходит, рост тканей и сосудов прекращается, и созданная временная кровеносная система безболезненно удаляется из организма. Силы быстрого реагирования - клетки иммунной системы - переходят в режим ожидания.
Каждый из нас многократно испытывал на себе работу воспалительного процесса, будь это простая заноза или глубокая рана - внешние проявления могут быть разные, но стоящий за этим механизм один и тот же. Замечательное произведение природы, служащее нам верой и правдой.
Но вот оказывается, что некая группа товарищей “положила на него глаз” и научилась его использовать в своих, далеко не благих целях. Товарищи, мне кажется, в представлении не нуждаются. Знакомые все лица - раковые клетки, желающие стать отдельной самостоятельной структурой в нашем организме. Когда речь идет о стадиях, через которые должна пройти переродившаяся клетка в то, что мы называем раком, было отмечено, что при достижении третьей стадии, стадии-развития, в числе прочего злокачественная структура приобретает способность формировать обслуживающую ее кровеносную систему.
Они, эти товарищи, ничего нового не придумали, да и зачем, ведь воспалительный процесс работает очень эффективно. Они его только слегка модифицировали, сделали непрерывным. Так же как и при легитимном процессе, раковые клетки в огромных количествах производят те же самые химические субстанции (назовем их для особо любознательных товарищей – цитокин и хемокин), инициирующие воспалительный процесс, благодаря которому достигаются те же цели, что и при самовосстановлении поврежденных тканей.
Но если в первом случае производство воспалительных субстанций прекращается с завершением ремонтных работ и клетки получают команду к прекращению воспроизводства, то во втором - эти воспалительные субстанции производятся в нарастающих количествах. Они (ВС) совершенно также как и в первом случае провоцируют клетки, раковые клетки, к быстрому росту, разрыхляют окружающие ткани, облегчающие этот рост и наконец стимулируют быстрый рост кровеносных сосудов.
А где же клетки иммунной системы, почему они не выполняют своих обязанностей? Вот здесь как раз и возникает этот злобный, порочный круг. Как только опухоль выделяет в огромных количествах ВС, клетки иммунной системы немедленно туда направляются. Однако не бросаются уничтожать опухоль, а благодаря плотному туману из воспалительных субстанций впадают в растерянность, перестают понимать что от них требуется и сами в свою очередь начинают выделять эти ВС в больших количествах.
Парадокс состоит в том, что сформировавшаяся злокачественная опухоль использует защитный механизм организма - иммунную систему - для стимуляции своего роста. Печально, но факт. И это до такой степени факт, что уже существуют методики, связывающие продолжительность жизни больных с разными видами рака с интенсивностью воспалительного процесса, провоцируемого опухолью. Удалось даже выделить единичную провоспалительную субстанцию, в очень большой степени отвечающую за рост как самой опухоли, так и кровеносных сосудов и метастазирование раковых клеток, под названием транскрипцио́нный фактор NF-κB, своего рода “черный рыцарь” раковой опухоли. В этом нет никакого преувеличения, уже появились работы, показывающие, что можно предотвратить развитие практически любого вида рака путем подавления транскрипцио́нного фактора NF-κB.
Подписывайтесь на наш канал VIBER!
И это не обязательно должны быть химические препараты. Нужны молекулы природных соединений, которые являются ингибиторами транскрипцио́нного фактора NF-κB . Веществ этих на удивление много. Подробно об этом несколько позже, пока назовем только два - это одна из форм кахетина, полифенол, присутствующий в зеленом чае, и резвератрол, его можно найти в виноградных косточках и в красном вине.опубликовано econet.ru.
Задайте вопрос по теме статьи здесь
P.S. И помните, всего лишь изменяя свое сознание - мы вместе изменяем мир! © econet
Антиангиогенная терапия рака: антиангиогенные препараты и эффект

Антиангиогенная терапия является относительно новым методом лечения злокачественных новообразований. Дело в том, что быстрый рост размеров злокачественного новообразования должен обеспечиваться регулярной доставкой обильного количества питательных веществ и кислорода. Есть данные, свидетельствующие о том, что на каждый миллиметр опухолевой ткани требуется построение новой капиллярной сети. Если этого не произойдет, бесконтрольный рост новообразования будет невозможен.
Образование капиллярной сети реализуется посредством ангиогенеза, который регулируется множеством факторов, стимулирующих и блокирующих его. Если влиять на эти факторы, можно контролировать этот процесс, тем самым влияя на развитие новообразования. Более подробно остановимся на этом.
Ангиогенез — это процесс образования новых кровеносных сосудов путем выпячивания стенки уже существующего сосуда. Во взрослом организме этот процесс обеспечивает восстановление поврежденных тканей — заживление ран, ушибов, восстановление после инсультов, инфарктов и других патологических процессов.
Активация ангиогенеза происходит и при патологических процессах, например, при развитии злокачественных опухолей. Чтобы они могли интенсивно размножаться, им необходимо большое количество кислорода и питательных веществ, которые они получают из крови. Соответственно, по мере роста размера опухоли, ее ткань прорастает новыми кровеносными сосудами. А если это по каким-либо причинам невозможно, рост новообразования также невозможен.
Чтобы обеспечить процесс ангиогенеза, опухолевые клетки вырабатывают специальные молекулы — факторы роста (ФР), которые будут стимулировать прорастание новых капилляров. Самая важная из них — это фактор роста эндотелия сосудов VEGF. А вообще, открыто более 20 молекул, которые стимулируют образование новых капилляров.
Как это происходит
На поверхности эндотелиальных клеток (клетки, которые выстилают кровеносный сосуд изнутри) образуются рецепторы к ФР. В норме в клетках взрослого организма их нет. Возникают они только при определенных условиях, в нашем случае под действием опухоли. Как только ФР свяжется с рецептором, запускается каскад биохимических реакций, и начинают синтезироваться особые ферменты — металлопротеазы. Они расщепляют внеклеточное вещество, которое окружает эндотелиальные клетки и образует в нем «дырки». Через них эндотелиальные клетки выходят за пределы сосуда и мигрируют к опухоли. При этом, металлопротеазы как бы расчищают для них дорогу, облегчая миграцию. Когда формирование сосуда закончится, в дело вступают факторы, угнетающие ангиогенез — ингибиторы ангиогенеза.
Весь процесс образования капилляра можно представить следующим образом:
- Разрушение стенки кровеносного сосуда под действием металлопротеаз, синтезируемых опухолью.
- Выход эндотелиальных клеток из сосудов и их миграция по направлению к опухоли.
- Пролиферация (размножение) эндотелиальных клеток по мере продвижения в строме.
- Образование новых капиллярных трубок.
- Образование анастамозов между трубками и формирование новой капиллярной сети.
- Угнетение процесса ангиогенеза под действием антиангиогенных факторов.
Факторы, стимулирующие ангиогенез
Пока нет единой классификации факторов, которые стимулируют ангиогенез. Мы их разделим на биомеханические и физические.
Биомеханические факторы
Из биомеханических факторов наибольшее значение имеет ток крови. Постоянный ламинарный (ровный) поток крови способствует стабилизации кровеносных сосудов. И наоборот, турбулентности, циклические деформации и другие сбои приводят к активации эндотелия.
Химические факторы
- Главным стимулятором роста кровеносных сосудов является семейство факторов роста кровеносных сосудов VEGF. Они представлены несколькими видами:
- VEGF А — отвечает за миграцию и деление эндотелиальных клеток,
- VEGF B — обеспечивает эмбриональный ангиогенез. У взрослых людей его максимальная концентрация обнаруживается в сетчатке, ткани головного и спинного мозга и миокарде. Оказывает мощное нейропротекторное действие, поэтому на него возлагают большие надежды в лечении болезни Альцгеймера и инсультов. На проницаемость кровеносных сосудов и их пролиферацию он не влияет.
- VEGF С — в максимальной концентрации обнаруживается в клетках лимфатических сосудов, обеспечивает их рост. В онкологическом процессе играет роль маркера метастазирования.
- VEGF D — отвечает за развитие лимфатических сосудов в легких.
- PLGF — плацентарный фактор роста.
- FGF2 фактор роста фибробластов — при взаимодействии с рецепторами FGFR стимулирует деление эндотелиальных клеток и их миграцию.
- IGF-1 инсулиноподобный фактор роста — стимулирует рост сосудов за счет активации синтеза IL-8.
- Ангиопоэтины — способствуют выживанию мигрировавших эндотелиоцитов, формированию между ними связей, их взаимодействию с перицитами. Таким образом, стабилизируются вновь образованные сосуды.
- Тромбоцитарный фактор роста также отвечает за стабилизацию сосудов.
Факторы, угнетающие ангиогенез
- Тромбоспондины TSP. Эти факторы были открыты и описаны одними из первых. Они имеют два механизма действия — один реализуется за счет прямого действия на эндотелиоциты, а второй за счет подавления проангиогенных факторов. При прямом действии оказывается подавляющий эффект на деление клеток и их миграцию, помимо этого активируется апоптоз. Вторым механизмом действия является угнетение VEGF за счет связывания его и препятствования его выходу в межклеточное пространство. Помимо этого, тромбоспондины угнетают активность и биодоступность фактора роста фибробластов и других стимуляторов роста кровеносных сосудов.
- Ангиостатины. Они подавляют опухолевый ангиогенез, пролиферацию и миграцию эндотелиоцитов, активируют их апоптоз (гибель), блокируют внутриклеточный синтез VEGF.
- Эндостатины — подавляют размножение эндотелиоцитов и тубулогенез.
- Вазогибин — подавляет экспрессию рецепторов VEGF.
- Некоторые цитокины, например, IL4 (интерлейкин-4).
Антиангиогенные препараты
Эффект антиангиогенных препаратов основан на блокировании действия факторов роста кровеносных сосудов. Тем самым процесс образования новых капилляров замедляется, опухоль не получает достаточного количества питательных веществ и соответственно не может наращивать свою массу. С этой целью используется большое количество препаратов.
- Бевацизумаб — гуманизированные моноклональные антитела, которые избирательно связываются с биологически активной формой VEGF и блокируют его действие. Антиангиогенную терапию бевацизумабом применяют для лечения метастатических форм колоректального рака (вместе с химиотерапией), рака груди, немелкоклеточного рака легких, почечно-клеточного рака и глиобластомы.
- Афлиберцепт. Он действует как ловушка для VEGF. При соединении, он образует более прочные связи, и мешает VEGF соединяться с внеклеточным рецептором. Благодаря этому, блокируется передача внутриклеточных сигналов, запускающих процессы образования новых сосудов. Доказал свою эффективность при метастатическом колоректальном раке.
- Рамуцирумаб — блокирует рецепторы второго типа эндотелиального фактора роста и, соответственно, мешает его связыванию с VEGF. В результате становится невозможным синтез митогенактивируемых протеинкиназ, нейтрализуется размножение клеток эндотелия. Антиангиогенную терапию рамуцирумабом применяют при аденокарциномах желудка (совместно с паклитакселом или в монорежиме), немелкоклеточном раке легких и метастатическом колоректальном раке.
- Акситиниб — блокирует тирозин-киназные рецепторы эндотелиального фактора роста VEGFR, PDGFR, KIT. Применяется в рамках терапии второй линии при лечении больных распространенным раком почки.
- Вандетаниб. Подавляет активность рецептора VEGF, тем самым угнетая размножение, пролиферацию эндотелиоцитов, подавляет образование новых кровеносных сосудов, проницаемость опухолевых сосудов и уменьшает плотность сосудистой сетки. Применяется при распространенных формах медуллярного рака щитовидной железы.
- Ниндетаниб. Блокирует ангиокиназу, рецепторы VEGF 1-3 типа, рецепторы к тромбоцитарному фактору роста и фактору роста фибробластов. Применяется при рецидивирующих формах немелкоклеточного рака легкого.
- Пазопаниб. Блокирует рецепторы VEGF 1-3 типа, рецепторы к тромбоцитарному фактору роста и фактору роста фибробластов, рецепторы к фактору роста стволовых клеток. Антиангиогенная терапия пазопанибом используется при раке почки и лечении сарком мягких тканей.
- Регорафениб. Оказывает комплексное противоопухолевое действие, влияя не только на факторы роста кровеносных сосудов, но и на процессы канцерогенеза, метастазирования и на опухолевое микроокружение. Применяется при колоректальном раке, ГИСО и раке печени.
- Сорафениб — блокирует тирозин-киназные рецепторы эндотелиального фактора роста VEGFR 2,3, PDGFR, FGFR. В настоящее время применяется для лечения диссеминированного рака почки, который уже не чувствителен к стандартной терапии. Увеличивает время до прогрессирования заболевания и общую выживаемость пациентов. Также может применяться для лечения немелкоклеточного рака легких, меланомы, рака печени и предстательной железы, рака яичников и др.
- Сунитиниб. Блокирует рецепторы тромбоцитарного фактора роста, факторов роста эндотелия и стволовых клеток и колониестимулирующего фактора. Антиангиогенная терапия сунитинибом используется при ГИСО (гастроинтестинальлных стромальных опухолях).
Метрономная терапия
Метрономная химиотерапия представляет собой длительное и регулярное применение цитостатиков в низких дозировках. Препараты могут назначаться еженедельно, несколько раз в неделю и даже ежедневно. Такое лечение оказывает комплексное воздействие на опухоль:
- Оказывает антиангиогенное действие, блокируя рост опухолевых сосудов.
- В некоторой степени уничтожает или останавливает размножение злокачественных клеток.
- Стимулирует противоопухолевый иммунитет.
Антиангиогенное действие метрономной химиотерапии основано на следующих эффектах:
- Подавляют циркуляцию эндотелиальных стволовых клеток.
- Подавляет деление эндотелиальных клеток.
- Увеличивает уровень тромбоспондина — антиангиогенного фактора.
В метрономных режимах назначается винкрестин, капецитабин, циклофосфамид, метотрексат, фторурацил и многие другие препараты.
Запись на консультацию круглосуточно
Ангиогенез опухоли – сосудистый механизм опухолевого роста
По сосудам поступает питание для всех органов и тканей организма. Ангиогенез опухоли – это способность рака обеспечивать собственное кровоснабжение за счет формирования новой сосудистой сети: без питательных веществ и кислорода раковые клетки погибнут, поэтому создание опухолью новых артерий – необходимое и обязательное условие роста злокачественного новообразования.
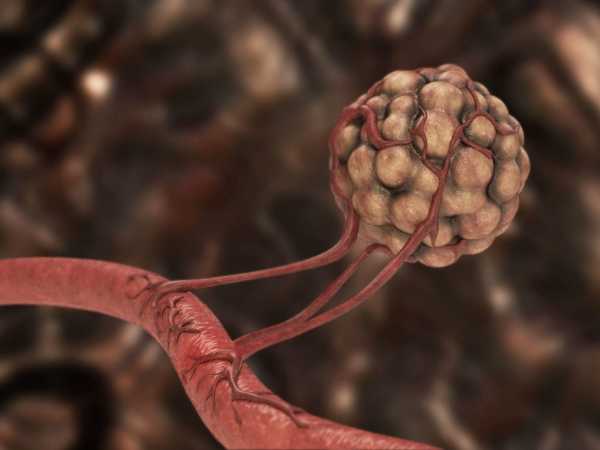
Кровоснабжение ракового очага
Ангиогенез опухоли – что это такое
У здорового взрослого человека новые сосуды не образуются – в сформировавшемся организме в этом нет никакой необходимости. В норме появление и рост новых артерий и вен происходит в следующих ситуациях:
- В период эмбриогенеза, при беременности у плода и в первые месяцы жизни ребенка;
- При регенерации тканей на фоне травмы или после операции.
Ангиогенез опухоли – это патологический вариант возникновения новой сосудистой сети, возможный за счет стимулирующего действия злокачественного новообразования на имеющиеся мелкие капилляры и артерии. На первом этапе формирования ракового очага злокачественные клетки получают питание и кислород из окружающих тканей, но этот бессосудистый механизм опухолевого роста возможен только до величины узла в 1-2 мм. Затем, если нет собственных сосудов, в опухоли происходят следующие события:
- некроз всей или локального участка новообразования;
- апоптоз раковых клеток;
- переход в дремлющее состояние.
Это относится ко всем вариантам рака, как в первичном очаге, так и в отдаленных метастазах. Коварство раковой опухоли состоит в том, что «дремлющий» метастаз может годами сохраняться в лимфоузле или в далеком от первичного очага органе, но как только появляется возможность, опухоль может вновь напомнить о себе (рецидив). Одной из таких возможностей является ангиогенез опухоли.
Механизм формирования сосудов в опухоли
Любой кровеносный сосуд состоит из клеток эндотелия. Это самые стабильные и долгоживущие клетки в живом организме, которые не обновляются длительное время (в кишечнике в каждый момент времени происходит обновление 14% клеток кишечной стенки, а в сосудах – 0.01%). Состояние покоя определяет стабильность системы: без определенного стимулирующего влияния никаких новых капилляров и артерий не будет. Ангиогенез опухоли – это прямое и выраженное воздействие раковой опухоли на эндотелий сосудов, которые находятся рядом с новообразованием. Включение механизма формирования капилляров в опухоли происходит при создании определенных условий и при обязательной величине новообразования в 1-2 мм. Основные этапы ангиогенеза:
- Активация эндотелия стимуляторами злокачественного новообразования;
- Пролиферация эндотелиальных клеток;
- Миграция эндотелия (перемещение) в опухоль;
- Появление и рост кровеносного сосуда.
Механизм ангиогенеза опухолевого очага
У организма есть возможность предотвратить ангиогенез опухоли (действие ингибиторов опухолевого роста), поэтому возникает некроз, спонтанный регресс опухоли или переход в «спящее» состояние. Но каждая битва с врагом ослабляет противоопухолевую защиту, и однажды рак сможет пробить брешь в барьере, особенно если на фоне генетической предрасположенности человек сам создает условия для онкологии.
Прогностическое значение ангиогенеза для рака
Необходимо понимать – ангиогенез опухоли является важнейшим фактором опухолевого роста: если в очаге рака стали формироваться новые капилляры, то можно ожидать в ближайшее время появление первых признаков заболевания с быстрым увеличением размеров злокачественного новообразования. И что самое худшее – появление новых артерий открывает ворота для метастазирования: раковые клетки из первичного очага могут устремиться в путешествие по организму, захватывая новые территории, расселяясь по органам и тканям, что резко снижает вероятность благоприятного прогноза для выздоровления.
| Больше познавательных и информативных статей об онкологии на канале Яндекс.Дзен Onkos |
Опухолевый ангиогенез - ФунгоДоктор
в раздел ОНКОЛОГИЯ
Ангиогенез — процесс образования новых кровеносных сосудов в органе или ткани. В здоровом организме процессы ангиогенеза протекают с умеренной интенсивностью и активизируются только при ликвидации очагов воспаления, регенерации повреждённых тканей, канализации тромбов, образовании рубцов и других процессах восстановления, а также при росте и развитии организма. В развитии онкологического заболевания образование опухолью микрососудов и формирование из них собственной сосудистой сети является важнейшим этапом. Опухоль при этом в месте своего зарождения осуществляет инфильтрацию в окружающие ткани, дальнейший рост и распространение по всему организму. Опухоль получает кислород и питательные вещества путем диффузии из окружающей ткани.
Опухолевый очаг может подвергнуться инволюции и находиться в таком состоянии неопределенно долгое время.
Переход развития опухоли в стадию прогрессии связан с созданием собственной сосудистой сети, обеспечивающей её потребности в результате чего создаётся возможность стремительного увеличения опухоли и проявлений злокачественности. На этом этапе — формирования и реализации собственного ангиогенеза опухоль проявляет себя как заболевание.
Опухолевый ангиогенез
Опухолевый ангиогенез имеет ключевое значение в развитии злокачественных новообразований. Очаги злокачественного роста обнаруживаются у большого числа обследованных людей с нормальным состоянием здоровья без признаков онкозаболевания. Злокачественные клетки обнаруживались более чем у трети практически здоровых женщин в возрасте примерно 50 лет, а частота развития рака у женщин этой возрастной группы составляет 1%. Подобная закономерность в отношении рака предстательной железы, микроочаги злокачественного перерождения наблюдаются у многих мужчин старшей возрастной группы, не имевших повода для обращения к онкологу и умерших от других причин. При аутопсии единичные злокачественные клетки в щитовидной железе обнаруживают¬ся фактически у всех лиц в возрасте 50–70 лет (при частоте рака щитовидной железы в этой возрастной группе на уровне 0,1%).
Таким образом, можно утверждать, что наличие раковых клеток в организме имеет характер биологической закономерности, на протяжении значительного периода жизни людей может сопровождать их и при этом трансформируется в онкологическое заболевание лишь в незначительном числе случаев. Одним из главных факторов, которые определяют эту трансформацию, является опухолевый ангиогенез.
Приведенные факты дают возможность рассматривать опухолевый ангиогенез как отдельный патофизиологический феномен развития новообразования, следующий за начальными этапами опухолевого роста. В связи с этим, развитие онкологической болезни укладывается в две стадии. На первой, генетическая нестабильность, которая проявляется в результате наследственной предрасположенности, эффекта канцерогенов или реализации спонтанных мутаций, ведет к злокачественной трансформации клеток и образованию микроскопических опухолей.
Для проявления свойств злокачественности "спящая" опухоль требует дальнейшего стимула и его реализации. Этот процесс определяется развитием опухолевого ангиогенеза, и, как результат, опухолевой прогрессией и клиническими проявлениями заболевания.
Механизм образования новых сосудов заложен в природе, он необходим, в частности, в процессе беременности (для формирования плаценты) овуляторного цикла и, для восстановления целостности ткани при заживлении ран и эрозий. Процесс реализуется при участии факторов (как стимулирующих, так и подавляющих ангиогенез), продуцируемых регенерирующей тканью, сосудистым эндотелием и кровью. В этом процессе участвует система гемостаза, реагирующая на кровопотерю из поврежденного сосуда и активирующая механизмы восстановления целостности ткани. В условиях реализации физиологических функций (менструального цикла) или в процессе репарации поврежден¬ной ткани обе гомеостатические системы — ангиогенеза и гемостаза — функционируют как единое целое.
Образование новых сосудов является важной составляющей процесса хронического воспаления . В связи со сходством образования новых сосудов при хроническом воспалении, механизм опухолевого ангиогенеза получил название незаживающей раны.
Вместе с тем опухолевый ангиогенез принципиально отличается от других состояний: природой ангиогенного стимула; характеристиками роста сосудов и их гистологической организацией; формированием самоподдерживающего механизма опухолевой прогрессии. Ангиогенез необходим для развивающейся опухоли, он проявляется под действием гипоксического стресса и хронического воспаления, изменения тканевого рН, длительного сдавления ткани, эффекта других факторов, стимулирующих активацию соответствующих генов.
Интенсивность ангиогенеза растущей опухоли характеризуется плотностью сосудов, которая диктуется самой опухолью; незрелостью этих сосудов, отличающей их от сосудов, васкуляризирующих здоровую ткань; и повышенной проницаемостью с образованием "сосудистых дыр", определяющих отек ткани, набухание опухолевой массы, выход опухолевых клеток и медиаторов в тканевое пространство. При этом метаболические потребности опухоли возрастают по мере ее прогрессии, а скорость роста ее сосудов в 50–100 раз превосходит рост сосудов здоровой ткани.
В конечном счете, развитие ангиогенеза приводит к образованию в общей системе кровоснабжения обособленной "сосудистой почки", состоящей из опухоли и питающей ее сосудистой сети, обеспечивающей возможности дальнейшего роста. По мере этого роста опухоль приобретает свою собственную структуру. Эта структура включает в себя паренхиму, состоящую из опухолевых клеток и питающих их сосудов, и строму, содержащую элементы здоровой ткани. Вся эта структура действует как единое целое, а сам процесс ангиогенеза диктуется "интересами" опухоли — обеспечением ее кислородом, пластическими и энергетическими ресурсами.. В конечном счете, развитие ангиогенеза приводит к образованию в общей системе кровоснабжения обособленной "сосудистой почки", состоящей из опухоли и питающей ее сосудистой сети, обеспечивающей возможности дальнейшего роста.
Скорость роста опухоли прямо зависит от интенсивности формирования микрососудов. Быстрое увеличение их плотности определяет "горячие точки" опухолевого роста и может служить прогностическим показателем для ряда опухолей — агрессивности их роста и скорости метастазирования сосудов.
Примерно у 25% женщин, прооперированных по поводу рака молочной железы с отсутствием метастазов в регионарные лимфоузлы, наблюдался рецидив заболевания. Целесообразно выделение таких больных в отдельную группу риска для постоянного наблюдения. Плотность микрососудов в наиболее васкуляризированных участках удаленной опухоли может служить при этом прогностическим показателем. По результатам клинических исследований у всех больных (т.е. 100%) с количеством микрососудов более 100 на 200 полей зрения светового микроскопа наблюдался рецидив заболевания, в сравнении с 5% больных, где плотность микрососудов составляла 33 и менее.
В результате исследований профессора Национального Университета Тайваня – Х.Чанга, веществ, извлечённых из Эноки, на раковые опухоли, было выявлено вещество которое блокирует рост кровеносной системы опухоли – комплекс белка и углевода, гликопротеид FVE (от слов Flammulina Velutipes – Extract). В результате воздействия на организм это вещество способно ингибировать ангиогенез, без кислорода крови опухолевые клетки погибают и роста опухоли не происходит.
Профилактика онкологических заболеваний грибами Майтаке, Эноки, Агарик
Этот гликопротеид выделен в таких грибах как Мейтаке, Эноки, Агарик он с успехом препятствует ангиогенезу опухоли и вызывает апоптоз (программированную гибель) опухолевых клеток. Мейтаке, также, эффективен при терапии доброкачественных новообразований (аденом,фиброаденом, полипов, миом, кист, паппилом и т.д.)
По вопросу опухолевый ангиогенез вы можете всегда обратиться за консультацией к специалистам нашего центра
В Киевском центре Фунготерапии, Биорегуляции и Аюрведы ведут прием квалифицированные врачи нетрадиционной медицины. Консультация бесплатная. Истории болезней и результаты лечения вы можете посмотреть по этой ссылке.
Записаться на прием вы можете по телефонам: (044) 331-74-44, (044) 257-01-01, (097) 231-74-44, (050) 331-74-44, (063) 187-78-78, +38(098) 583-85-85 (Viber), +38(093) 688-25-88 (WhatsApp, Telegram) e-mail:
Также вы можете задать ваш вопрос врачам в нашей группе в Viber "Нетрадиционная и народная медицина для вашего здоровья". В этой группе вы сможете узнать о новых препаратах и методах нетрадиционной медицины, прочитать статьи по теме восстановления и поддержания здоровья, обмениваться опытом исцеления и интересными материалами с участниками группы. Ссылка для вступления в группу https://invite.viber.com/?g=mIFy1dekQkk6sBNZt47xzbwJD9wAtqFm
Ангиогенез: общие сведения
Ангиогенез: общие сведения
Ангиогенез - это образование кровеносных сосудов. В норме он наблюдается только в эндометрии в фолликулярной фазе менструального цикла , в плаценте и при заживлении ран .
Кровеносная и лимфатическая сосудистые системы пронизывают каждый орган, каждую ткань организма, доставляя клеткам питательные вещества и кислород, обеспечивая в организме циркуляцию жидкости и различных сигнальных молекул. Возникновение кровеносной сосудистой системы ( васкулогенез ) - одно из самых ранних событий в эмбриогенезе. В период раннего эмбрионального развития мезодермальные клетки дифференцируются в гемангиобласты , являющиеся общими предшественниками как клеток гемопоэза, так и эндотелиальных клеток, дающих начало кровеносным сосудам. При дальнейшей дифференцировке из гемангиобластов образуются ангиобласты , агрегация которых приводит к формированию кровяных островков. Затем в результате слияния кровяных островков возникает первичное сосудистое сплетение, состоящее из мелких капилляров, сформированных клетками эндотелия. Интересно, что уже на этой стадии капилляры приобретают артериальный или венозный характер, указывая на то, что специфичность клеток генетически запрограммирована [ Coultas , 2005 ].
С формированием первичного сосудистого сплетения завершается стадия васкулогенеза, и все дальнейшие преобразования сосудистой сети происходят в процессе ангиогенеза, при котором новые сосуды образуются из уже существующих. На стадии ангиогенеза первичное сосудистое сплетение значительно расширяется за счет ветвления капилляров и превращается в высокоорганизованную сосудистую сеть. Ангиогенез начинается с локального разрушения стенки ранее существующего сосуда, активации пролиферации и миграции клеток эндотелия. Клетки эндотелия собираются в трубчатые структуры, вокруг которых в дальнейшем формируются стенки сосудов. При дальнейшем созревании сосудистой сети капилляры сливаются в более крупные сосуды, артерии и вены.
Стенки капилляров и мелких сосудов представляют собой один слой клеток ( перицитов ), тогда как стенки артерий и вен образованы несколькими слоями гладкомышечных клеток. Перициты - это клетки мезенхимального происхождения, онтогенез которых пока еще до конца не ясен. Они представляют собой гетерогенную популяцию клеток, обладающих способностью к дифференцировке в мезенхимальные клетки другого типа, такие как гладкомышечные клетки , фибробласты и остеобласты [ Gerhardt, 2003 ]. Перицитам свойственны некоторые характеристики гладкомышечных клеток, однако до сих пор не ясно, являются ли перициты и гладкомышечные клетки фенотипическими вариантами одной и той же линии клеток или они происходят от разных предшественников.
Таким образом, сосуды состоят из двух основных типов клеток: клеток эндотелия и клеток, формирующих стенки сосудов. Поэтому для понимания механизмов ангиогенеза важно понять процессы, регулирующие биологическую активность этих видов клеток, и их взаимодействие друг с другом.
Во взрослом организме образование и рост новых сосудов находятся под жестким контролем. Эти процессы активируются только в строго определенных условиях, например при заживлении ран. Для организма очень важно строго регулировать сбалансированное функционирование этой системы, поскольку как избыточное образование кровеносных сосудов, так и недостаточность развития этой системы ведут к серьезным заболеваниям.
Становится все более ясным, что возникновение и созревание новых сосудов представляют собой крайне сложные и скоординированные процессы, требующие последовательной активации целой серии рецепторов и множества лигандов, тонко отрегулированного баланса между множеством стимулирующих и ингибирующих сигналов.
При ангиогенезе эндотелиальные клетки выходят из свойственного им состояния покоя (скорость удвоения их популяции возрастает почти в 100 раз), начинают делиться и образуют эндотелиальную почку, которая прорывает базальную мембрану и внедряется в соединительную ткань. Активацию эндотелиальных клеток обеспечивают факторы роста , которые образуются в опухоли и в самих эндотелиальных клетках, а также компоненты внеклеточного матрикса . Прекращение действия этих факторов возвращает эндотелиальные клетки в состояние покоя.
Наиболее яркими примерами патологий, связанных с ангиогенезом, являются атеросклероз ( Koch et al., 1994 ), язвенная болезнь ( Folkman et al., 1987 ) и некоторые аутоиммунные заболевания . Существуют косвенные указания на нарушения нормальных процессов ангиогенеза при ряде патологий развития ( Jackson et al., 1995 ) и при опухолеобразовании .
Найдены и ингибиторы ангиогенеза , которые прямо или опосредованно подавляют пролиферацию эндотелиальных клеток и рост сосудов.
Ангиогенез свойственен любым опухолям - и доброкачественным, и злокачественным. Сосуды питают опухоль и позволяют ей метастазировать.
Иногда уже на самых ранних стадиях развития опухоли в ней появляются субпопуляции клеток с высокой способностью к метастазированию. Установлено, что рак молочной железы способен метастазировать сразу после разрастания в опухоли сосудов, когда ее размеры еще не превышают 0,125 кв. см.
Полагают, что поздно метастазирующие опухоли недостаточно васкуляризованы.
Разрастание сосудов в опухоли имеет клиническое значение. Так, при раке молочной железы (независимо от наличия регионарных метастазов), раке предстательной железы и раке яичников по степени васкуляризации опухоли можно судить о риске и распространенности метастазирования.
Установлено, что эндотелиальные клетки вырабатывают цитокины , которые стимулируют не только пролиферацию и миграцию самих эндотелиальных клеток, но и пролиферацию опухолевых клеток. Иногда эти аутокринные и паракринные факторы секретирует сама опухоль.
Роль эфринов в ангиогенезе была впервые продемонстрирована Pandey A. с соавторами [ Pandey ea 1995 ]. Исследователи обнаружили, что эфрин А1 принимает участие в развитии кровеносных сосудов роговицы глаза, он стимулирует ангиогенез in vivo и способствует хемотаксису эндотелиальных клеток in vitro. В дальнейшем в экспериментах in vitro было показано, что и другие белки семейства эфринов ( эфрин B1 , эфрин B2 , эфрин B3 ) способствуют росту капилляров и "сборке" эндотелиальных клеток внутри сосуда, т.е. стимулируют морфо- и ангиогенез, а также участвуют в процессах ремоделирования сосудов [ Adams ea 1999 , Daniel ea 1996 , Stein ea 1998 ].
Полученные результаты были подтверждены исследованиями in vivo в модельных экспериментах на животных [ Wang ea 1998 ]. У эмбрионов мыши с "нокаутом" гена EFNB2 эфрина B2 наблюдается нарушение кровоснабжения формирующихся органов и тканей, вызванное повреждением кровеносных сосудов [ Wang ea 1998 ]. В исследовании Adams R.H. с соавторами была также показана роль эфрина В3 в процессах ангиогенеза и ремоделирования сосудов [ Adams ea 1999 ].
Ссылки:
Опухолевый неоангиогенез
Цель противоопухолевой терапии — индуцировать, по возможности, избирательно гибель опухолевых клеток. Существует 3 вида клеточной смерти: некроз, апоптоз и «медленная клеточная смерть».Клеточная смерть путем некроза происходит в тканях при действии на клетки больших доз токсических веществ. Это наблюдается при высокодозной противоопухолевой химиотерапии и лежит в основе ее высокой токсичности.
Апоптоз представляет собою клеточную смерть без воспалительного повреждения тканей в многоклеточном организме. Индукция этого, щадящего для организма вида клеточной смерти, и является преимущественной целью противоопухолевой химиотерапии. Основным биохимическим признаком апоптоза служит участие в этом процессе активированных каспаз. Однако было установлено, что ингибиция каспаз не останавливает, а только отодвигает смерть клетки, по своей морфологии (интрануклеосомальная фрагментация ДНК) напоминающей апоптоз. Этот вид клеточной смерти получил название «медленной клеточной смерти».
Онкогены Ras, Raf и митоген-активированные киназы ингибируют апоптоз путем воздействия на цитохром-С/каспаза-9 путь, но при этом могут арестовывать клетки с последующим развитием «медленной клеточной смерти» за счет отсроченной фрагментации ДНК. Механизмом действия в этих случаях является ингибиция сигнальных молекул (циклокинов), в норме передающих пролиферативные сигналы. Такой вид смерти обычно связан со «старением», механизмом которого является укорочение теломерных участков хромосом, и нередко вызывается химиотерапевтическим препаратами, особенно в опухолевых клетках, резистентных к апоптозу.
Основную цель противораковой терапии можно сформулировать как уничтожение опухолевых клеток любым путем, независимо от вида индуцированной клеточной смерти. Средством выбора следует считать апоптоз или «медленную клеточную смерть» — наименее травматичные для целостного организма виды клеточной смерти.
Наиболее распространенный и хорошо отработанный способ индукции клеточной смерти опухолевых клеток — химиотерапия. Как было подробно рассмотрено в предыдущих очерках, программная противоопухолевая химиотерапия при своих несомненных достижениях имеет весьма существенные ограничения — отсутствие избирательного воздействия на опухолевые клетки и связанную с этим токсичность, а также частое развитие резистентности к используемым препаратам.
Новые пути противоопухолевой терапии
Впервые роль неоангиогенеза в формировании опухолевого роста и возможных направлениях терапии была определена около 30 лет назад в работах J.Folkman.Основные положения его гипотезы не утеряли своего значения и в наши дни и могут быть сформулированы следующим образом:
1) Большинство первичных солидных опухолей до достижения размера 1-2 мм в диаметре получают кислород и питательные вещества, необходимые для роста, из окружающих тканей путем пассивной диффузии;
2) Для дальнейшего роста опухоли необходим неоангиогенез, выражающийся в развитии новой капиллярной сети, инфильтрирующей опухоль;
3) Предполагалось, что запуск неоангиогенеза вызывается специфическим ростовым фактором, который продуцируют и высвобождают клетки опухоли;
4) Блокирование опухолевого роста возможно путем подавления образования и активности ростовых факторов ангиогенеза или непосредственным воздействием на вновь образованные, незрелые кровеносные сосуды;
5 ) Такой способ воздействия на опухоль не вызывает ее эррадикации, а всего лишь ограничивает ее рост и экспансию, переводя заболевание в вяло текущий хронический процесс.
В последние 10-15 лет все постулаты этой концепции получили свое экспериментальное и клиническое подтверждение и развитие.
Стимуляторы неоангиогенеза
Было выделено 3 вида стимуляторов неоангиогенеза:- основной фибробластный ростовый фактор (bFGF);
- фактор роста сосудистого эндотелия (VEGF);
- ангиопоэтины;
- неспецифические, такие, как матрикс металлопротеиназа (ММР)
Первым был открыт bFGF. Он был выделен из клеток хондросаркомы, способность стимулировать ангиогенез была доказана на различных моделях.
Источником bFGF могут быть многие клетки, в том числе и вновь образованные клетки эндотелия, аутокринно продуцирующие его. Стимуляцию пролиферации в клетках эндотелия фибробластный ростовый фактор осуществляет в кооперации с другими ангиостимулирующими факторами, пользуясь специфическими трансмембранными и внутрицитоплазматическими рецепторами и способствуя в то же время выбросу других молекул (коллагеназы, интегринов, рецепторов), необходимых для новообразования сосудистой сети.
Клинические данные также подтверждают роль bFGF в опухолевом неоангиогенезе. Так, повышение уровня этого фактора в спинномозговой жидкости и моче коррелирует с масштабом развития сосудистой сети в опухоли и со степенью агрессивности процесса при многих солидных опухолях, лейкозах, лимфомах у детей и у взрослых и может служить прогностическим фактором агрессивности опухолевого процесса.
VEGF был открыт и подробно охарактеризован с молекулярно-биологических позиций уже во второй половине 90-х годов. Этот фактор, существующий в нескольких изоформах, активно выделяется многими опухолевыми клетками и специфически воздействует на эндотелиальные клетки, оказывая выраженные пропролиферативные и антиапоптотические эффекты. Эндотелиальные клетки вновь образованных сосудов экспрессируют тирозин-киназные рецепторы к VEGF и активно соединяются с ним. Не исключено и участие фибробластов стромального микроокужения в выроботке фактора роста сосудистого эндотелия в ответ на опухолевый рост.
Ангиопоэтины и их тирозин-киназные рецепторы были открыты совсем недавно. Ангиопоэтин существует в двух формах: ангиопоэтин-1 (ang-1) и ангиопоэтин-2 (ang-2). Оба эти фактора пользуются одним и тем же рецептором — tie-2, лиганд для второго рецептора — tie-t остается неизвестным. Из двух ангиопоэтинов только ang-1 является облигатным стимулятором ангиопоэза, ang-2 вызывает, напротив, регрессию сосудов в тех случаях, когда действует вне кооперации с другим стимулятором — VEGF, и только при кооперации с последним — запускает ангиогенез. В эксперименте на мышах с выключенными генами было выявлено большое значение этих ангиопоэтинов и их рецепторов для развития сосудистой сети в эмбриогенезе.
ММР человека представляют собою «семью» протеолитических ферментов, состоящую из 15 энзимов, основное назначение которых — расщепление структурных белков экстрацеллюлярного матрикса (коллагена, фибронектина, ламинина, протеогликанов и др.). Физиологическая роль их связана с ремоделированием стромы в процессе ее роста и репарации. Источниками образования ММР являются многие клетки, включая фибробласты, макрофаги, гладкомышечные клетки сосудистой стенки, нейтрофилы, их продукция увеличивается под влиянием цитокинов.
Клетки некоторых опухолей сами образуют матрикс металлопротеиназа и, независимо от этого, любая опухоль является мощными индукторами образования ММР в клетках стромы. Способствуя инвазии опухолевого роста и метастазированию, ММР в то же время являются мощными стимуляторами неоангиогенеза. Эндогенные и синтетические ингибиторы матрикса металлопротеиназа, открытые в последние годы, используются в качестве потенциальных противоопухолевых агентов, основное назначение которых — подавление неоангиогенеза.
Ингибиторы неоангиогенеза
Вслед за ангиопоэтинами была открыта широкая сеть эндогенных ингибиторов ангиопоэза. Основные ингибиторы представлены в табл.4.1.Таблица 4.1. Эндогенные ингибиторы ангиопоэза
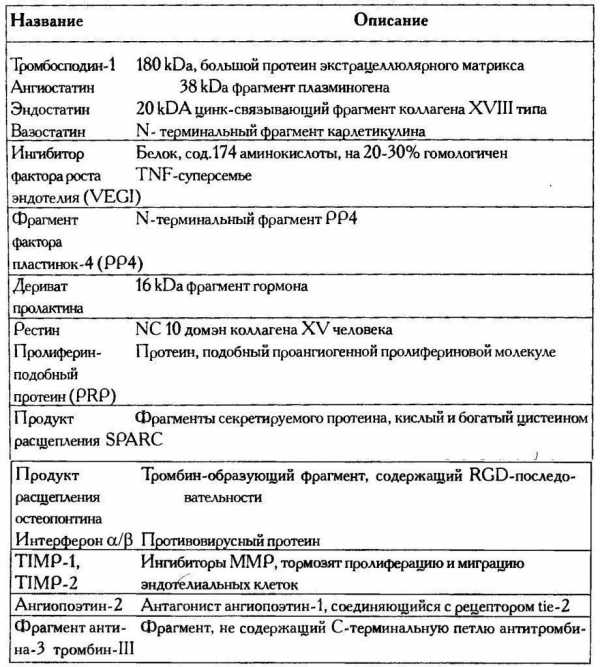
Подобно тому как антионкогены сдерживают рост опухолевого клона, ингибиторы неоангиогенеза ограничивают инфильтрацию опухоли сосудами. Большинство эндогенных ингибиторов ангиогенеза, как видно из данных, представленных в табл.4.1, являются фрагментами регуляторных белков, входят в состав экстрацеллюлярного матрикса, системы свертывания крови, и, по-видимому, неразрывно связаны с системами регулирующими клеточный гомеостаз тканей.
Можно предположить, что пусковым механизмом опухолевого ангиогенеза является сдвиг в соотношении стимуляторов к ингибиторам образования сосудов. При низком значении этого соотношения неоангиогенез блокируется или малоинтенсивен, напротив, при высоких значениях соотношения происходит активный запуск неоангиогенеза.
Взаимосвязь ангио- и туморогенеза
Получены многочисленные данные о существовании сложных взаимоотношений между механизмами, определяющими рост опухоли и контролирующими неоангиогенез.Весьма примечательным является наблюдение Bouck с соавт., о том, что потеря контролирующий роли дикого типа гена Р53 сопровождается и снижением экспрессии тромбосподина — ингибитора ангиогенеза. Это как бы устанавливает связь между генетическими основами развития опухоли и опухолевого ангиогенеза. Подтверждается это предположение также и данными о том, что активация RAS-онкогена и онкогенов семьи егbВ (стимуляторов опухолевого роста) сопровождается усилением продукции стимулятора ангиопоэза — VEGF. В то же время продукция этого стимулятора блокируется повышением активности генов опухолевой супрессии — р16 и VHL.
Эндотелиальные клетки, в свою очередь, являются источником целого ряда цитокинов (SCF, Flt3-ligand, GM-CSF, IL-6), экспрессия которых усиливается под действием фактора роста сосудистого эндотелия. Эти цитокины стимулируют рост не только стволовых клеток, но и многих исходящих из них опухолей.
Таким образом, опухоль и сосудистая сеть составляют как бы «двуединую систему», в которой опухолевые клетки стимулируют развитие неоангиогенеза, а новая капиллярная сеть, в свою очередь, питает опухоль и экспрессирует факторы, способствующие дальнейшему опухолевому росту. Разрыв этой петли обратной связи — новое направление противоопухолевой терапии.
Роль неоангиогенеза в развитии лейкозов и лимфом
Долгое время считалось, что неоангиогенез имеет значение только в развитии солидных опухолей. Однако в конце 90-х годов получены неопровержимые доказательства того, что лейкозы и лимфомы также зависимы от ангиогенеза. Данные, подтверждающие это утверждение суммированы в табл.2.Таблица 4.2. Ангиогенез в костном мозге при лейкозах

* плотность микрососудистых скоплений — по мечению антителами к фактору Виллебранда в МКАТ к CD-34+ в работе — среднее число скоплений на одно поле зрения микроскопа площадью 0,77 мм2 (при просмотре 200-250 полей зрения).
Как видно из представленных в табл.2 данных, в костном мозге больных лейкозами и МДС обнаружена высокая плотность вновь образованных сосудов. При этом, как отмечают исследователи, лейкемические клетки окружали капилляры плотным кольцом, составлявшим 5-6 слоев, в отличии от одного в контрольном костном мозге. Петли вновь образованных сосудов оставались в костном мозге больных ОЛЛ после наступления ремиссии. У больных лейкозами выявлялось и значительное повышение в моче и крови b-FGF и VEGF — стимуляторов неоангиогенеза. Таким образом, онкогематологические заболевания также могут быть мишенью для антиангиогенной терапии.
Основные принципы и перспективы терапии, направленной на подавление опухолевого неоантогенеза
Терапия, направленная на подавление ангиогенеза, может быть прямого и непрямого действия.Первое направление включает в себя агенты, мишенью действия которых являются сосуды опухоли. К ним относятся:
- ингибиторы ангиогенеза, такие как эндостатин, ангиостатин и др.
- конъюгаты VEGF-токсин
- антагонисты VEGF-рецептора.
- антитела к VEGF-рецептору;
- нейтрализующие антитела и молекулы-антагонисты к рецепторам интегринов и молекул адгезии, специфически экспрессируемых на вновь образованных эндотелиальных клетках.
Достоинством этого вида терапии является то, что ее мишенью являются здоровые, генетически стабильные клетки, а, следовательно, ее длительное применение не сопровождается развитием резистентности.
Благоприятным фактором следует считать и то, что избирательно чувствительны к ней вновь образованные эндотелиальные клетки. Это дает возможность избежать токсических поражений сосудов и не снижает доступа лекарств в опухоль.
«Непрямое» подавление ангиогенеза связано с терапией, направленной на снижение образования или нейтрализацию стимуляторов неоангиогенеза, в первую очередь фактора роста сосудистого эндотелия (VEGF) и матрикс металлопротеиназ (ММР).
Это может достигаться несколькими способами:
- нейтрализующими фактор роста сосудистого эндотелия антителами;
- ингибиторы и антагонисты ММР;
- цитотоксическими средствами.
Противососудистое действие некоторых противоопухолевых препаратов (таксаны, ингибиторы топоизомеразы, пуриновые антиметаболиты), включая цитокины и ионизирующую радиацию показано было во многих доклинических и экспериментальных исследованиях. Первым «сосудисто-направленный» эффект химиотерапии был описан Denekamp в 1993 г. В основе его лежит торможение синтеза VEGF и других стимуляторов неоангиогенеза в опухолевых клетка. Преимуществом такого способа влияния на сосуды опухоли является избирательное воздействие на новообразование сосудов, недостатком — развитие лекарственной резистентности.
Весьма перспективными в этом отношении является новый класс соединений, прокладывающий себе путь в клиническую практику, — ингибиторы молекул сигнальной трансдукции. К ним относятся, например, ингибиторы RAS — фарнезилтрансферазы и моноклональные антитела, нейтрализующие рецептор EGF (эпидермальный ростовый фактор) — Herceptin.
Способность этих препаратов блокировать ангиогенез связана с тем, что активация онкогенов в опухолевых клетках способствует не только повышению их репродуктивной активности, но и одновременно стимулирует индукцию проангиогенных факторов, таких как VEGF. Препараты, блокирующие онкопротеины, вызывают также и снижение экспрессии стимуляторов ангиогенеза. Наилучший эффект в преклинических испытаниях получен при сочетании этих препаратов с обычными цитотоксическим агентами, такими как циклофосфан, цисплатина, таксол.
Таким образом, включение препаратов, подавляющих васкуляризацию опухоли, в программную противоопухолевую терапию представляется весьма перспективным.
Проблемы, возникающие при этом, можно разделить на 2 группы:
1. Антиангиогенная терапия не вызывает быстрого сокращения массы опухоли, а лишь препятствует ее дальнейшей экспансии. Исходя из этого, в индукционной терапии ее рекомендуется сочетать с программной противоопухолевой химиотерапией.
2. Антиангиогенная терапия в арсенале противоопухолевого лечения должна быть длительной, по существу, хронической. Это делает актуальным проблему токсических осложнений. К таким осложнениям относятся спастическая дисплагия и нарушения роста у младенцев, дистрофические язвы, кардиоваскулярные осложнения у лиц пожилого возраста. Во избежание этих осложнений следует особенное внимание уделить разработке препаратов, избирательно действующих только на новообразование сосудов в опухоли.
Эта область терапии онкологических заболеваний активно развивается, начинает проходить стадию интенсивных клинических испытаний.
Е.Б. Владимирская
Опубликовал Константин Моканов
ангиогенез — со всех языков на русский
Ангиогенез — процесс образования новых кровеносных сосудов в органе или ткани. В норме в организме процессы ангиогенеза протекают с умеренной интенсивностью и активизируются только при регенерации повреждённых тканей, канализации тромбов, ликвидации очагов… … Википедия
ангиогенез — Образование новых кровеносных сосудов в поврежденных тканях [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN angiogenesis … Справочник технического переводчика
Ангиогенез — * ангіягенез * аngiogenesis формирование новых кровеносных сосудов. Индуцируя А. вокруг сердца, напр., можно генерировать натуральное (обводное) шунтирование сердца без вмешательства хирургии. И наоборот, предотвращение А. является целью… … Генетика. Энциклопедический словарь
АНГИОГЕНЕЗ — (angiogenesis) образование новых кровеносных сосудов. Данный процесс играет важную роль в развитии опухолей, способствуя их росту … Толковый словарь по медицине
Ангиогенез (Angiogenesis) — образование новых кровеносных сосудов. Данный процесс играет важную роль в развитии опухолей, способствуя их росту. Источник: Медицинский словарь … Медицинские термины
Терапевтический ангиогенез — Термин Терапевтический ангиогенез, (называемый также биологическим шунтированием) описывает тактику стимуляции образования новых кровеносных сосудов для лечения или профилактики патологических состояний, характеризующихся снижением этой функции.… … Википедия
Псориаз — Псориатическое поражение спины и рук … Википедия
Перицит, или клетка Руже — Необходимо перенести содержимое этой статьи в статью «Перицит». Вы можете помочь проекту, объединив статьи. В случае необходимости обсуждения целесообразности объединения, замените этот шаблон на шаблон {{к объединению}} и добавьте… … Википедия
Фактор роста фибробластов — Результат анализа кристаллической структуры комплекса fgf10 fgfr2b Фактор роста фибробластов … Википедия
Фактор роста эндотелия сосудов — Необходимо проверить качество перевода и привести статью в соответствие со стилистическими правилами Википедии. Вы можете помочь … Википедия
Талидомид — … Википедия
Стимуляция неоангиогенеза опухолевых клеток
Опухолевые клетки приобретают способность формировать новые кровеносные и лимфатические сосуды из эндотелиальных клеток окружающих мелких сосудов.Неоангиогенез — формирование сети капилляров из эндотелиальных клеток — обязательное и необходимое условие для роста опухолевого очага.
В ином случае клетки в центре опухоли, не получая кислорода и питательных веществ, будут погибать.
Известно также, что в ходе нормального эмбриогенеза и регенерации клеткам также необходимо ускоренно пролиферировать и мобилизовать ангиогенез, обеспечивая себе питание.
Механизм образования сосудов в норме
В формирующейся ткани рост новых кровеносных сосудов тщательно регулируется. Как известно, основу кровеносных сосудов составляют клетки эндотелия, выстилающие внутреннюю поверхность капилляров, артерий и вен.В эмбриогенезе кровеносные сосуды развиваются в результате процессов, васкулогенеза и ангиогенеза. Васкулогенез включает в себя образование из мезодермальных клеток-предшественников (ангиобластов) клеток эндотелия, их пропиферацию и-формирование капилляроподобных трубок.
Ангиогенез — дальнейшее формирование сосудистой сети — характеризуется увеличением количества сосудов за счет ветвления и разделения первоначальных капилляров. Одновременно происходит созревание сосудов, когда за счет миграции перицитов (клеток мезодермы) и гладкомышечных клеток в первоначальные капилляры формируется стенка сосуда (рис. 3.17).
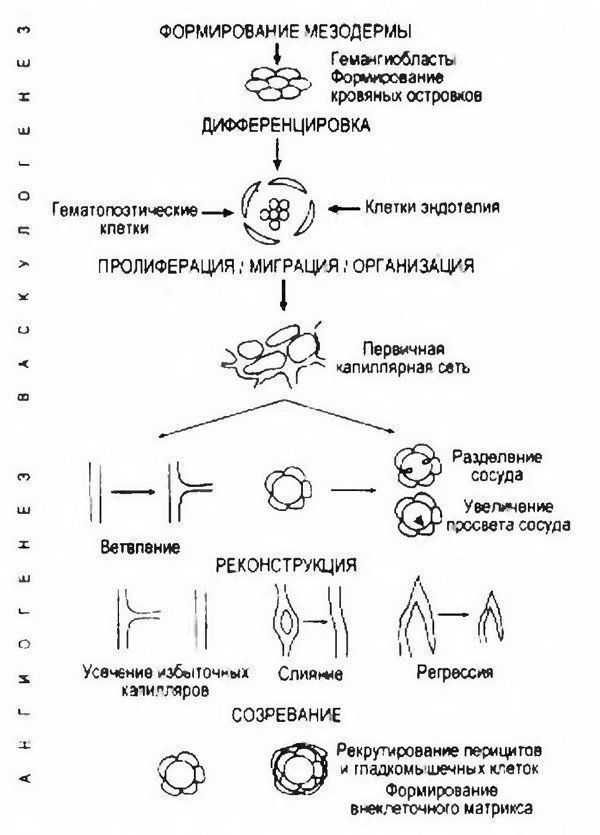
Рис. 3.17. Схема процессов васкулогенеза и ангиогенеза [Saaristo А. и совт., 2000].
Формирование стенки стабилизирует вновь образованные сосуды и прекращает в них пролиферацию и миграцию клеток эндотелия. Поэтому в организме взрослых сеть кровеносных сосудов обычно находится в покоящемся состоянии за исключением строго регулируемых процессов, связанных с женскими репродуктивными циклами.
Клетки эндотелия — одни из наиболее долгоживущих клеток организма. В нормальном кровеносном сосуде взрослого человека только 1 из каждых 10000 клеток эндотелия (0,01%) находится в цикле клеточного деления в каждый данный момент времени (для сравнения — около 14% нормальных клеток эпителия кишечника находятся в цикле деления).
Таким образом, время замещения клеток кишечника измеряется днями, а клеток эндотелия — годами. Однако в ответ на соответствующие стимулы покоящаяся сосудистая система может быть активирована в отношении роста новых капилляров.
Во взрослом организме новые сосуды образуются только в результате ангиогенеза.
Процесс постнатального ангиогенеза начинается с активации дифференцированных клеток эндотелия существующих кровеносных сосудов (а не предшественников, как при васкулогенезе), затем происходят пролиферация миграция этих клеток и формирование просвета сосуда.
Миграция клеток эндотелия в интерстициальное пространство облегчается разрушением базальной мембраны протеазами. активированными размножающимися клетками эндотелии родительского сосуда. Завершают ангиогенез формирование просвета сосуда «захват» перицитов и образование базальной мембраны.
Механизм образования сосудов в опухоли
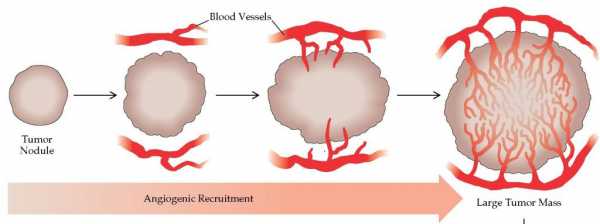
Чтобы дорасти до крупных размеров, начинающиеся опухоли должны развить способность к ангиогенезу. Идентифицированы две фазы опухолевого роста; аваскулярная и васкулярная. Аваскулярная фаза является самоограничивающейся и заключается в обеспечении роста опухоли путем диффузии питательных веществ и продуктов катаболизма через опухолевую поверхность.В начале 70-х годов XX века Дж. Фолкмен показал, что в культуре ткани, т.е при отсутствии вавкуляризации, опухолевые клетки могут расти только до узелков диаметром в 1-2 мм. И только после того как в такой опухоли «включится» ангиогенез и первичный опухолевый клон получит доступ к сосудистой системе, начинается его усиленный рост.
Общая мысль о том, что рост новообразований абсолютно зависим от их васкуляризации, подтверждается In vivo. Известно, что в опухолях солидного строения часто возникает некроз. Исследования показывают: участок некроза внутри опухоли часто идет параллельно кровеносному сосуду и отделяется от него полосой в 1-2 мм из жизнеспособных злокачественных клеток.
Эта зона в 1-2 мм вокруг сосудов и представляет собой максимальную дистанцию, на величину которой могут распространяться кислород и другие питательные материалы из кровотока окружающей микросреды посредством диффузии.
Таким образом, и первичный, и метастатический растущий опухолевый очаг обходятся без васкуляризации до тех пор, пока не достигнут диаметра в 1-2 мм. Дальнейший опухолевый рост нуждается в своих сосудах, которые обеспечат клетки питательными веществами и кислородом.
В отсутствие доступа к адекватному кровоснабжению опухолевые клетки некротизируются и/или вступают в апоптоз. Тем самым ограничивается увеличение объема опухопи и/или метастаза независимо от того, насколько высокими пролиферативными возможностями обладают сами опухолевые клетки.
Именно поэтому в отсутствие достаточного ангиогенеза метастазы остаются «спящими», что достигается равновесием между скоростью пролиферации и апоптозом клеток. Известный феномен фазы покоя злокачественных опухолей (dormant tumor), а также редчайшие варианты их спонтанного регресса (в XX веке описано около 200 таких наблюдений), предполагают, могут быть связаны с недостаточностью ангиогенеза.
Более того, нередко после хирургического удаления основного очага начинается бурный рост «дремавших» метастазов, вероятно, в силу изменения баланса про- и антиангиогенных факторов в пользу первых.
Васкулярная фаза роста опухоли представляет собой фазу быстрого распространения сосудов из опухоли в окружающие ткани. В цепом, процесс образования сосудов в опухоли, как и в нормальной ткани, заключается в ангиогенной стимуляции самой опухолью пролиферации эндотелиальных клеток капилляров окружающей стромы, их миграции в прилегающую к сосуду ткань опухоли и образование новых капилляров (рис. 3.18).
Рис. 3.18. Основные этапы неоангиогенеза. а - образование первичного опухолевого узла; б - инвазия эндотепиальных клеток в строму опухоли; в - сосудистая сеть опухоли сформирована.
Активно пролиферирующие эндотелиальные клетки выделяют протеазы. Они расщепляют базальную мембрану сосудистой стенки и внеклеточный метрике, чем облегчается проникновение эндотелиальных клеток в строму опухоли и/или органа.
Новые кровеносные сосуды образуются, когда эндотелиальные клетки из стенки небольших сосудов прикрепляются к окружающему их внеклеточному матриксу и начинают делиться. Их деление и сам процесс формирования кровеносных сосудов связан с каскадом молекулярно-биохимических реакций, регулируемыми факторами ангиогенеза.
Ростовые факторы клеток эндотелия
Принято считать, что ключевую роль в индукции ангиогенеза нормальных тканей, большинства солидных опухолей и в развитии метастазов играет ростовой фактор эндотелия сосудов (Vascular Endotelial Growth Factor, VEGF).В качестве регуляторов ангиогенеза выступают также ростовые факторы фибробластов (FGF и FGF). Названные ангиогенные факторы секретируются самими опухолевыми клетками и/или клетками воспалительного инфильтрата новообразований, например макрофагами.
Они непосредственно взаимодействуют с периэндотелиальными клетками и рецепторами на поверхности клеток эндотелия сосудов и стимулируют процессы дифференцировки, пролиферации и миграции их во внеклеточный матрикс и тем самым стимулируют процесс ветвления новых капилляров из покоящейся сосудистой системы.
Естественно, наряду с индукторами, имеются вещества с противоположным действием — ингибиторы ангиогенеза, обладающие антипролиферативным действием на клетки эндотелия. К наиболее известным ингибиторам относятся тромбоспондин-1. а также ангиостатин и эндостатин. В настоящее время уже известно несколько десятков эндогенных индукторов и ингибиторов ангиогенеза.
Таким образом, поддержание клеток эндотелия в альтернативных состояниях (покоя или ангиогенеза) осуществляется скоординированным регупяторным механизмом. При этом сам опухолевый рост стимулируется факторами, усиливающими ангиогенез, и подавляется агентами, блокирующими его (рис. 3.19).
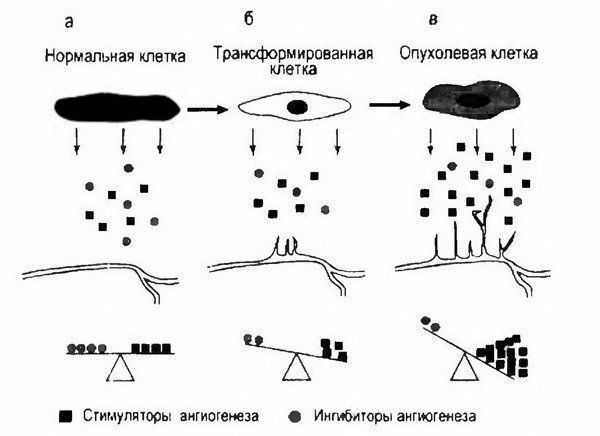
Рис. 3.19. Приобретение клетками ангиогенного фенотипа в процессе их злокачественной трансформации [Кушлинский Н.Е., и соавт., 2005]. Баланс между продукцией клетками нормальной ткани стимуляторов и ингибиторов ангиогенеза в норме (а), нарушение его в трансформированной плетке (б) и резкое увеличение продукции злокачественными клетками стимуляторов ангиогенеза, индуцирующих прорастание опухолевой ткани кровеносными капиллярами (в).
Кроме того, ключевую роль в формировании ангиогенного фенотипа неопластических клеток играет инактивация гена-супрессора р53, который контролирует функцию некоторых ингибиторов и стимуляторов ангиогенеза. К усилению стимуляции ангиогенеза может приводить активация и ряда онкогенов [RAS, МУС и др.].
И хотя механизмы поддержания баланса между регуляторами ангиогенеза во многом недостаточно изучены, возможность подавления процесса ангиогенеза, как обязательного компонента роста солидных опухолей, предоставляет собой привлекательную мишень для разработки новых терапевтических стратегий.
Прогностическая значимость неоангиогенеза при раке
Процесс неоваскуляризации опухоли — критический шаг в прогрессии болезни. Адекватная васкуляризация важна не только для продолжения опухолевого роста, но и для диссеминации опухоли в виде отдаленных метастазов, так как сосудистая и лимфатическая системы — основное передаточное средство опухолевых клеток.Рост метастазов тоже зависит от ангиогенеза. Для развития метастазов недостаточно только высвобождения опухолевых клеток и их циркуляции в лимфатическом или кровеносном русле. Клетки должны имплантироваться и расти на новом месте. Решающим фактором на этом этапе является способность развивающихся метастазов индуцировать свое собственное кровоснабжение, т.е. ангиогенез.
Очевидно, что исключительно важная роль неоангиогенеза в развитии новообразований может быть использована для прогнозирования опухолевого роста. В настоящее время уже доказано что оценка неоангиогенеза опухоли является независимым прогностическим маркером безрецидивной и общей выживаемости больных различными формами рака.
Ангиогенная активность может определяться непосредственно в опухоли прямым подсчетом количества микрососудов выявляемых иммуногистохимическим методом с помощью специфических маркеров эндотелиальных клеток (CD31 и CD34). Если плотность сосудов в опухоли превышает 100/мм2, то риск метастазирования существенно увеличивается, а прогноз болезни — значительно ухудшается.
Неоангиогенез можно также оценить косвенно по наличию/отсутствию в сыворотке крови или в моче стимуляторов неоангиогенеэа: VEGF (фактор роста эндотелия сосудов), BFGF (основной фактор роста фибробластов) и др. Наличие негативных прогностических факторов ангиогенеза потребует, очевидно, использование для таких больных программ более интенсивной терапии.
Угляница К.Н., Луд Н.Г., Угляница Н.К.
Опубликовал Константин Моканов
Ингибиторы ангиогенеза
Клетки злокачественных опухолей, так же, как и здоровые клетки, нуждаются в постоянном доступе к кислороду и питательным веществам. Опухоль не может расти, если в организме не формируются новые кровеносные сосуды, которые насыщают и питают её. Процессы образования новых кровеносных сосудов получили название «ангиогенез». Препараты, подавляющие процессы ангиогенеза (ингибиторы ангиогенеза), препятствуют этим процессам, не дают образовываться новым сосудам, тем самым замедляя или останавливая рост опухоли.
В отличие от других противоопухолевых препаратов, например, широко применяющихся химиотерапевтических агентов, ингибиторы ангиогенеза не оказывают прямого губительного влияния на опухолевые клетки. Вместо этого они зачастую воздействуют на клетки, окружающие опухоль и помогающие ей расти. По мере размножения клеток опухоли и роста её размеров, потребности раковых клеток в кислороде и питательных веществах непрерывно возрастают. Они посылают своеобразные «сигналы» которые запускают процессы ангиогенеза. На Рисунке 1 схематично представлен процесс образования новых сосудов.
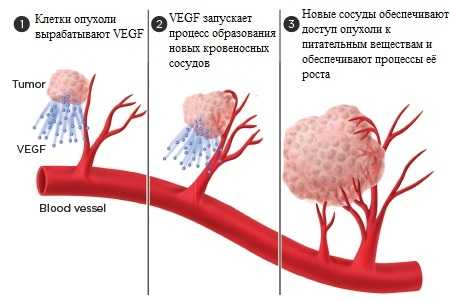
Рисунок 1. Образование новых сосудов под влиянием VEGF. VEGF - фактор роста эндотелия
В норме организм использует подобные сигналы в случаях, когда возникает кислородное голодание тканей. Если опухоли удается «обмануть» организм, в ответ на эти сигналы начинаются процессы образования новых кровеносных сосудов, которые дают опухоли возможности для дальнейшего роста и метастазирования. Если эти процессы нарушаются под действием лекарств – новые сосуды не образуются. Голодание опухолевых клеток усугубляется и они погибают. Этот принцип и лежит в основе применения ингибиторов ангиогенеза.
Ингибиторы ангиогенеза относятся к так называемой «таргетной» (целенаправленной) терапии. Они оказывают минимальное воздействие на нормальные клетки, вследствие чего риск развития нежелательных явлений на фоне их применения относительно невысок. Впервые препараты этого класса появились в конце 1990-ых годов, первым ингибитором ангиогенеза, внедренным в клиническую практику, стал бевацизумаб. Бевацизумаб представляет собой моноклональное антитело – специально сконструированный белок, способный избирательно связываться с молекулой, которая осуществляет передачу сигнала для образования новых сосудов. Эта молекула получила название фактор роста эндотелия (VEGF) В настоящее время бевацизумаб успешно применяется в лечении различных злокачественных опухолей, включая немелкоклеточный рак легкого, рак толстой кишки, почки, некоторых опухолей мозга и т. д. Другими препаратами, блокирующими работу VEGF, является афлиберцепт и рамуцирумаб. Подобно бевацизумабу, они связывают эту молекулу и препятствуют образованию новых сосудов в опухоли. Наиболее часто бевацизумаб и схожие с ним препараты применяются в комбинации с химиотерапией. В ряде исследований было показано, что добавление ингибиторов ангиогенеза к химиотерапии способствует увеличению её эффективности.
В дальнейшем были разработаны другие препараты, работающие по такому же принципу. В клиническую практику вошли такие лекарства, как сорафениб, который применяется для лечения рака печени и почки, пазопаниб и сунитиниб, играющие важнейшую роль в лечении рака почки, а также другие препараты.
Необходимо отметить, что ингибиторы ангиогенеза не являются «золотой пулей», позволяющей гарантированно остановить рост опухоли. В некоторых случаях они способны эффективно сдерживать рост опухолевых клеток, тогда как в других они не оказывают такого эффекта. В настоящее время не существует способов предсказать эффективность их применения до начала лечения.
Неясным также остается вопрос как долго следует проводить лечение препаратами этой группы. Поиск ответов на эти вопросы в настоящее время проводится в клинических исследованиях.
Применение ингибиторов ангиогенеза может сопровождаться серьезными побочными эффектами. В том числе, на фоне их применения может отмечаться значительное и стойкое повышение артериального давления, кроме того может повышаться риск развития тромбозов, кровотечений и повреждения стенок кишечника. Тем не менее, в большинстве случаев эти побочные эффекты могут быть скорректированы в случае своевременного распознавания.
Подводя итог, можно отметить, что ингибиторы ангиогенеза играют важную роль в процессе лечения многих заболеваний. Их правильное применение позволяет значительно продлить жизнь пациентам.
АНГИОГЕНЕЗ И РАК - Природа против рака
Если в маленькие опухоли питательные вещества и кислород поступают путем диффузии или через соседние капилляры, то клетки опухолей более крупного размера приобретают способность к сосудообразованию и выделяют белковый фактор, потенцирующий врастание капилляров в опухолевую ткань из прилежащей сохранной ткани. Этот полипептид называется фактором Фолькмана. При этом процесс опухолевого ангиогенеза происходит в условиях взаимодействия между опухолевыми клетками, эндотелиальными клетками и экстрацеллю-лярным матриксом.
Выделяют три этапа опухолевого ангиогенеза, следующих друг за другом по мере опухолевой инвазии — пролиферацию эндотелиальных клеток; — разрушение окружающего экстрацеллюлярного матрикса: — миграцию эндотелиальных клеток. Ангиогенез в опухоли происходит на фоне измененного экстрацеллюлярного матрикса в условиях нарушенных межклеточных и паренхиматозно-стромальных взаимоотношений. Это приводит к развитию неполноценных сосудов преимущественно капиллярного типа, часто имеющих прерывистую базальную мембрану с нарушенной эндотелиальной выстилкой. Важную роль в ангиогенезе играют стимуляторы (факторы роста сосудов) и ингибиторы ангиогенеза.
Факторы роста сосудов продуцируются различными клетками и связываются с рецепторами на поверхности эндотелиальных клеток. Процесс ангиогенеза косвенно зависит и от некоторых других пептидов, способствующих миграции в очаг опухолевого роста клеток-продуцентов факторов роста сосудов. Активированные таким образом эндотелиальные клетки начинают размножаться и расти в сторону опухоли. Процесс опухолевого ангиогенеза завершается образованием из массы эндотелиальных клеток трубочек—сосудов.
-----------------------------------------------------------
ВЕЩЕСТВА СПОСОБСТВУЮЩИЕ АНГИОГЕНЕЗУ
Angiogenin
Ангиопоэтина-1
Del-1
Факторы роста фибробластов: кислые (aFGF) и basic (bFGF)
Follistatin
Гранулоцитарный колониестимулирующий фактор (Г-КСФ)
Фактора роста гепатоцитов (HGF) /коэффициент разброса (SF)
Интерлейкина-8 (ИЛ-8)
Лептин (увеличивается при ожирении)
Midkine
Плацентарный фактор роста
Тромбоцитарный фактор роста эндотелиальных клеток (PD-ECGF)
Тромбоцитарный фактор роста-BB (PDGF-BB)
Pleiotrophin (PTN)
Progranulin
Proliferin
Трансформирующий фактор роста-Альфа (TGF-Альфа)
Трансформирующего фактора роста-бета (TGF-beta)
Фактор некроза опухоли-Альфа (ФНО-Альфа) (увеличивается при ожирении)
Фактор роста эндотелия сосудов (VEGF)/коэффициент проницаемости сосудов (VPF)
ВЕЩЕСТВА ОСТАНАВЛИВАЮЩИЕ АНГИОГЕНЕЗ
Angioarrestin
Ангиостатин (плазминогена фрагмент)
Антиангиогенная антитромбин III
Arrestin
Chondromodulin
Canstatin
Хрящ-производные ингибитора (CDI)
CD59 дополняют фрагмент
Эндостатин (коллагена XVIII фрагмент)
Endorepellin
Фибронектин фрагмент
Фибронектин фрагмент (Anastellin)
ГРО-бета
Heparinases
Гепарин hexasaccharide фрагмент
Хорионический гонадотропин (ХГЧ)
Интерферон alphagamma
Индукторы интерферона белка (IP-10)
Интерлейкин-12
Крингл 5 (плазминогена фрагмент)
Ингибиторы металлопротеиназ (TIMPs)
2-Methoxyestradiol
PEX
Пигментного эпителия производный фактор (PEDF)
Плацентарный рибонуклеазы ингибитор
Ингибитор активатора плазминогена
Тромбоцитарного фактора-4 (пп.f4)
Пролактин 16kD фрагмент
Proliferin связанной с белками (PRP)
Протромбиновое Крингл 2
Ретиноиды
Растворим Fms-как тирозин киназы-1 (S-Flt-1)
Таргетинг фибронектин привязки интегринов
Tetrahydrocortisol-S
Thrombospondin-1 (TSP-1 и -2
Трансформирующего фактора роста-бета (ТФР-b)
Тропонин I
Tumstatin
Vasculostatin
Vasostatin (calreticulin фрагмент)
-------------------------------------------------------
Источник: http://www.angio.org/
Подпишитесь на НОВОСТИ и получайте эксклюзивную информацию о самых последних исследованиях по противостоянию раку. Информация доступна только подписчикам.