Пенициллин что это такое
Бензилпенициллин — Википедия
Бензи́лпеницилли́н (пенициллин G (PCN G) или просто пенициллин (PCN)) — N-фенилацетамид 6-аминопенициллановой кислоты. Антибиотик, получаемый из плесневого гриба пеницилла (грибов рода лат. Penicillium: лат. Penicillium chrysogenum, лат. Penicillium notatum и других). В процессе жизнедеятельности эти грибы синтезируют различные формы пенициллина: один из наиболее активных в фармакологическом плане бензилпенициллин и другие виды пенициллина, которые отличаются от первого тем, что вместо бензильной группы содержат иные радикалы. Таким образом по молекулярной структуре пенициллин это кислота, из которой получают различные соли (натриевую, калиевую, новокаиновую и другие)[1]. Семейство пенициллиновых антибиотиков включает бензилпенициллин (пенициллин G), феноксиметилпенициллин (пенициллин V) и другие [2][3].
Пенициллиновые антибиотики имеют важное историческое значение, так как они являются первыми эффективными лекарствами против многих тяжёлых заболеваний и, в частности, сифилиса, а также инфекций, вызываемых стафилококками и стрептококками. Пенициллины хорошо изучены, однако в настоящее время многие бактерии приобрели устойчивость к β-лактамным антибиотикам. Хотя, например, бледная трепонема достаточную устойчивость к пеницилинам не приобрела.
Как и другие β-лактамы, пенициллины не только препятствуют размножению клеток бактерий, в том числе и цианобактерий, но также препятствуют делению хлоропластов мхов. Но не оказывают влияния на деление пластид высших сосудистых растений[4], поскольку последние не имеют мишени для пенициллина — пептидогликановой клеточной стенки.
Многие древние культуры, в том числе древние египтяне и греки, использовали плесень и некоторые растения для лечения инфекций, так как те содержали антибиотики. Например, в Древнем Египте, Китае и Индии плесневелый хлеб использовали для дезинфекции, прикладывая его к ранам и гнойникам. Упоминания об использовании плесени в лечебных целях встречаются в трудах древних учёных и философов. В 1963 году специалист по этноботанике Энрике Облитас Поблете дал описание применению плесени индейскими знахарями в XV—XVI веках.С чем мы можем не согласиться, так как в Ветхом завете рекомендовалось, стены на которых появилась плесень, разобрать, если плесень появилась повторно советовали уйти с этого места, так как оно не чисто. Согласно этому источнику евреи были рабами у древних египтян. Поэтому выше указанная информация является не менее чем вымыслом. Это так же касается и древних греков, так как не один мало мальски дошедший до нас источник, не говорит и не подтверждает данный факт.
Пенициллин — первый антибиотик — был получен на основе продуктов жизнедеятельности микроорганизмов.
В начале 1870-х годов исследованием плесени одновременно занимались медики Алексей Герасимович Полотебнов и Вячеслав Авксентьевич Манассеин, который изучив грибок Penicillium glaucum, подробно описал основные, в частности бактериостатические, свойства зелёной плесени[5]. Полотебнов, выяснив лечебное действие плесени на гнойные раны и язвы,[6] рекомендовал использовать плесень для лечения кожных заболеваний. Его работа «Патологическое значение зелёной плесени» вышла в 1873 году. Но идея на тот момент не получила дальнейшего практического применения.
В 1896 году итальянский врач и микробиолог Бартомелео Гозио выделил из Penicillium микофеноловую кислоту, которая была активна против возбудителя сибирской язвы. Пенициллин был обнаружен в 1897 году французским военным врачом Эрнестом Дюшеном. Он заметил, что арабские конюхи использовали плесень с сёдел, чтобы обработать раны на спинах лошадей. Работая с грибами рода Penicillium, Дюшен опробовал плесень на морских свинках и обнаружил её разрушающее действие на палочку брюшного тифа. Но его работа не привлекла внимания научного сообщества.
В 1904 году русский учёный М. Г. Тартаковский сообщил, что вещество, выделяемое зелёной плесенью, подавляет развитие возбудителя куриной холеры.
В 1913 году американские учёные Карл Альсберг и Отис Фишер Блек получили из Penicillium puberulum токсичную субстанцию, обладающую противомикробными свойствами (в 1936 году, когда установили её химическую структуру, выяснилось, что это была пеницилловая кислота)[7].
Пенициллин был выделен в 1928 году Александром Флемингом из штамма гриба вида Penicillium notatum на основе случайного открытия: попадание в культуру бактерий спор плесневого гриба из внешней среды оказало на бактериальную культуру бактерицидное действие [8][9].
Несмотря на то, что статья Флемминга о пенициллине вышла ещё в 1929 году, первое время она была воспринята без энтузиазма из-за отсутствия способов его химического выделения и производства. В 1942 году, почти половина всего американского запаса пенициллина[10] — одна столовая ложка[11] — была использована для лечения всего лишь одного пациента, Анны Миллер. Имевшегося в США запаса в июне 1942 было достаточно для лечения десяти пациентов[12].
В 1940—1941 годах австралийский бактериолог Хоуард У. Флори и биохимики Эрнст Чейн и Норман Хитли работали над выделением пенициллина и разрабатывали технологию его промышленного производства сначала в Англии и, затем, в США. Они же впервые применили пенициллин для лечения бактериальных инфекций в 1941 году. В 1945 году Флемингу, Флори и Чейну была присуждена Нобелевская премия по физиологии и медицине «за открытие пенициллина и его целебного воздействия при различных инфекционных болезнях».
В СССР первые образцы пенициллина получили в 1942 году микробиологи З. В. Ермольева и Т. И. Балезина. Зинаида Виссарионовна Ермольева активно участвовала в организации промышленного производства пенициллина. Созданный ею препарат пенициллин-крустозин ВИЭМ был получен из штамма гриба вида Penicillium crustosum.
Пенициллины длительное время были основными антибиотиками, широко применявшимися в клинической практике во всех технологически развитых странах[13]. Затем, по мере развития фармакологии, были выделены и синтезированы антибиотики других групп (тетрациклины, аминогликозиды, макролиды, цефалоспорины, фторхинолоны, грамицидины и другие). Однако несмотря на большое разнообразие групп антибиотиков на современном фармацевтическом рынке и развитие резистентности к пенициллинам у многих бактерий-патогенов, пенициллины по-прежнему занимают достойное место в терапии инфекционных заболеваний, ибо основным показанием к назначению того или иного антибиотика в настоящее время является чувствительность к его действию патогенной микрофлоры (определяемая в лабораторных условиях), а также минимальное количество побочных эффектов от применения антибиотика [1].
Бензилпенициллин — антибиотик группы биосинтетических пенициллинов. Оказывает бактерицидное действие за счёт ферментативного ингибирования синтеза клеточной стенки микроорганизмов.
Активен в отношении:
К действию бензилпенициллина устойчивы штаммы Staphylococcus spp., продуцирующие пенициллиназу. Разрушается в кислой среде.
Новокаиновая соль бензилпенициллина по сравнению с калиевой и натриевой солями характеризуется большей продолжительностью действия благодаря низкой растворимости и образованию депо в месте инъекции.
После внутримышечного введения быстро всасывается из места инъекции в кровоток и широко распределяется в биологических жидкостях и тканях организма, однако в спинномозговую жидкость проникает в незначительных количествах. Бензилпенициллин хорошо проникает через плацентарный барьер. Хотя в обычных условиях после применения бензилпенициллина в спинномозговой жидкости он обнаруживается в незначительном количестве, тем не менее при воспалении мозговых оболочек на фоне усиления проницаемости гематоэнцефалического барьера концентрация антибиотика в ликворе повышается. T½ — 30 мин. Выводится с мочой. После внутримышечного введения максимальная концентрация в крови наблюдается через 30—60 минут, а через 3—4 часа после однократно проведённой внутримышечной или подкожной инъекции в крови обнаруживаются лишь следовые концентрации антибиотика. Концентрация и продолжительность циркуляции бензилпенициллина в крови зависит от величины вводимой дозы. Тем не менее, для поддержания достаточно высокой концентрации, необходимой для реализации терапевтического воздействия необходимо повторять инъекции бензилпенициллина каждые 3—4 часа. Следует учитывать, что при приёме внутрь антибиотик плохо всасывается, частично разрушается желудочным соком и бета-лактамазой, продуцируемой микрофлорой кишечника, а при внутривенном введении концентрация бензилпенициллина быстро снижается[1].
Лечение заболеваний, вызванных чувствительными к бензилпенициллину микроорганизмами: крупозная и очаговая пневмонии, эмпиема плевры, сепсис, септицемия, пиемия, острый и подострый септический эндокардит, менингиты, острый и хронический остеомиелиты, инфекции мочевыводящих и жёлчных путей, ангины, гнойные инфекции кожи, мягких тканей и слизистых оболочек, рожа, дифтерия, скарлатина, сибирская язва, актиномикоз, лечение гнойно-воспалительных заболеваний в акушерско-гинекологической практике, ЛОР-заболеваний, глазных болезней, гонорея, бленнорея, сифилис.
Со стороны пищеварительной системы: диарея, тошнота, рвота.
Эффекты, обусловленные химиотерапевтическим действием: кандидоз влагалища, кандидоз полости рта.
Со стороны ЦНС: при применении бензилпенициллина в больших дозах, особенно при эндолюмбальном введении, возможно развитие нейротоксических реакций: тошнота, рвота, повышение рефлекторной возбудимости, симптомы менингизма, судороги, кома.
Аллергические реакции: повышение температуры тела, крапивница, кожная сыпь, сыпь на слизистых оболочках, боли в суставах, эозинофилия, ангионевротический отёк. Описаны случаи анафилактического шока с летальным исходом. В таком случае полагается немедленное внутривенное введение адреналина.
Повышенная чувствительность к бензилпенициллину и другим препаратам из группы пенициллинов и цефалоспоринов. Эндолюмбальное введение противопоказано пациентам, страдающим эпилепсией.
Применение при беременности возможно только в том случае, когда ожидаемая польза превышает риск развития побочных действий. При необходимости применения в период грудного вскармливания следует решить вопрос о прекращении грудного вскармливания (молоко пациентки сцеживается, чтобы лактация не прекратилась). Причина всего этого в том, что пенициллин хорошо проникает через молочные железы в молоко матери, и через плаценту к плоду, что способно вызвать негативные последствия для последнего — у детей пенициллин способен вызывать тяжёлые аллергические реакции даже при первом применении[14].
С осторожностью применяют у пациентов с нарушениями функции почек, при сердечной недостаточности, предрасположенности к аллергическим реакциям (особенно при лекарственной аллергии), при повышенной чувствительности к цефалоспоринам (из-за возможности развития перекрёстной аллергии). Если через 3-5 дней после начала применения эффекта не отмечается, следует перейти к применению других антибиотиков или комбинированной терапии. В связи с возможностью развития грибковой суперинфекции целесообразно при лечении бензилпенициллином назначать противогрибковые препараты. Необходимо учитывать, что применение бензилпенициллина в субтерапевтических дозах или досрочное прекращение лечения часто приводит к появлению резистентных штаммов возбудителей. Бензилпенициллин в форме порошка для инъекций включён в Перечень ЖНВЛС.
В случае инфекционных заболеваний, вызванных микроорганизмами не чувствительными к бензилпенициллину (в том числе при заболевании вирусами гриппа, не осложнённом бактериальной инфекцией) клиническое применение бензилпенициллина нерационально, а в связи с возможностью развития побочных эффектов от проводимого лечения антибиотиком — не вполне безопасно[1].
Angicilline, Capicillin, Cilipen, Conspen, Cosmopen, Cracillin, Crystacillin, Crystapen, Deltapen, Dropcillin, Falapen, Lanacillin, Novopen, Panavlon, Pentallin, Pharmacillin, Pradupen, Rentopen, Rhinocillin, Solupen, Solvocillin, Supracillina, Veticillin и другие[1].
Пробенецид снижает канальцевую секрецию бензилпенициллина, в результате повышается концентрация последнего в плазме крови, увеличивается период полувыведения. При одновременном применении с антибиотиками, оказывающими бактериостатическое действие (тетрациклин), уменьшается бактерицидное действие бензилпенициллина.
Биосинтез[править | править код]
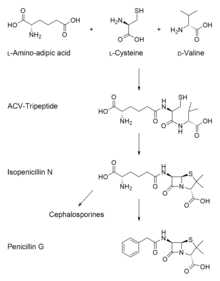 Биосинтез пенициллина. На первой стадии происходит конденсация трёх аминокислот, на второй — окисление трипептида и образование двуциклического интермедиата — пенициллина N, на третьей — трансаминирование и образование пенициллина G
Биосинтез пенициллина. На первой стадии происходит конденсация трёх аминокислот, на второй — окисление трипептида и образование двуциклического интермедиата — пенициллина N, на третьей — трансаминирование и образование пенициллина G Биосинтез пенициллина осуществляется в три стадии:
- На первой стадии происходит конденсация трёх аминокислот: L-α-аминоадиповой кислоты, L-цистеина, L-валина в трипептид.[15][16][17] Перед конденсацией в трипептид аминокислота L-валин превращается D-валин.[18][19] Указанный трипептид называется δ-(L-α-аминоадипил)-L-цистеин-D-валином (англ. ACV). Реакции конденсации и эпимеризации катализируются ферментами δ-(L-α-аминоадипил)-L-цистеин-L-валинсинтетазой (англ. ACVS) и синтетазой нерибосомных пептидов (англ. NRPS).
- Вторая стадия биосинтеза пенициллина — это окисление линейной молекулы ACV в двуциклический интермедиат изопенициллин N ферментом изопенициилин N синтетазой (англ. IPNS), продуктом гена pcbC.[15][16] Изопенициллин N — очень слабый интермедиат, так как он не обладает противомикробной активностью.[18]
- На заключительной стадии происходит трансаминирование ферментом изопенициллин N N-ацилтрансферазой, при этом α-аминоадипиловая боковая цепь изопенициллина N удаляется и заменяется на фенилуксусную кислоту. Фермент, катализирующий эту реакцию является продуктом гена penDE.[15]
Полный синтез[править | править код]
Химик Джон Шиэн (англ. Sheehan) в Массачусетском технологическом институте (англ. MIT) в 1957 году осуществил полный химический синтез пенициллина.[20][21][22] Шиэн приступил к изучению синтеза пенициллинов в 1948 году и в ходе исследований разработал новые методы синтеза пептидов, а также новые защитные группы.[22][23] Хотя метод синтеза, разработанный Шиэном не был пригоден для массового производства пенициллинов, один из интермедиатов в синтезе (6-аминопенициллановая кислота, англ. 6-APA) является ядром молекулы пенициллина.[22][24] Присоединение разных групп к ядру 6-APA позволило получить новые формы пенициллинов.
Производные[править | править код]
Выделение ядра молекулы пенициллина 6-APA, позволило получить новые полусинтетические антибиотики, обладающие лучшими свойствами, чем бензилпенициллин (биодоступность, спектр антимикробного действия, стабильность).
Первым важным полученным производным был ампициллин, который обладал более широким спектром антибактериальной активности, чем исходные препараты антибиотиков. Дальнейшие исследования позволили получить устойчивые к β-лактамазе антибиотики, в том числе, флуклоксациллин, диклоксациллин и метициллин. Эти антибиотики были эффективны против бактерий, синтезирующих бета-лактамазу, однако, неэффективны против устойчивого к метициллину золотистого стафиллококка (англ. MRSA), возникшего немного позднее.
- ↑ 1 2 3 4 5 М. Д. Машковский. Лекарственные средства. В двух частях. — 12-е изд., перераб. и доп. — М.: Медицина, 1993. — Т. II. — С. 245—251. — 688 с ил. с. — (Пособие для врачей). — 75 000 экз. — ISBN 5-225-02735-0.
- ↑ Garrod, L. P. Relative Antibacterial Activity of Three Penicillins (англ.) // British Medical Journal : journal. — 1960. — Vol. 1, no. 5172. — P. 527—529. — doi:10.1136/bmj.1.5172.527.
- ↑ Garrod, L. P. The Relative Antibacterial Activity of Four Penicillins (англ.) // British Medical Journal : journal. — 1960. — Vol. 2, no. 5214. — P. 1695—1696. — doi:10.1136/bmj.2.5214.1695. — PMID 13703756.
- ↑ Kasten, Britta; Reski, Ralf. β-lactam antibiotics inhibit chloroplast division in a moss (Physcomitrella patens) but not in tomato (Lycopersicon esculentum) (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 1997. — 30 March (vol. 150, no. 1—2). — P. 137—140. — doi:10.1016/S0176-1617(97)80193-9.
- ↑ МАНАССЕИН Вячеслав Авксентьевич (неопр.).
- ↑ ПОЛОТЕБНОВ Алексей Герасимович (неопр.).
- ↑ Медицинский музей и медицинская коммуникация. Сборник материалов V Всероссийской научно-практической конференции «Медицинские музеи России: состояние и перспективы развития». — Москва, 5—6 апреля 2018.
- ↑ Alexander Fleming – Time 100 People of the Century (неопр.). Time. — «It was a discovery that would change the course of history. The active ingredient in that mold, which Fleming named penicillin, turned out to be an infection-fighting agent of enormous potency. When it was finally recognized for what it is—the most efficacious life-saving drug in the world—penicillin would alter forever the treatment of bacterial infections.». Архивировано 16 апреля 2011 года.
- ↑ Haven, Kendall F. Marvels of Science : 50 Fascinating 5-Minute Reads (англ.). — Littleton, CO: Libraries Unlimited, 1994. — P. 182. — ISBN 1-56308-159-8.
- ↑ Мадхаван Г. Думай как инженер. — М.: Манн, Иванов и Фербер, 2016. См. главу 4.
- ↑ https://time.com/4250235/penicillin-1942-history/
- ↑ https://www.lib.niu.edu/2001/iht810139.html
- ↑ James, PharmD, Christopher W.; Cheryle Gurk-Turner, RPh. Cross-reactivity of beta-lactam antibiotics (англ.) // Baylor University Medical Center Proceedings. — Dallas, Texas: Baylor University Medical Center, 2001. — January (vol. 14, no. 1). — P. 106—107. — PMID 16369597.
- ↑ Описание пенициллина и его воздействия на человека
- ↑ 1 2 3 Al-Abdallah, Q., Brakhage, A. A., Gehrke, A., Plattner, H., Sprote, P., Tuncher, A. Regulation of Penicillin Biosynthesis in Filamentous Fungi // Molecular Biotechnolgy of Fungal beta-Lactam Antibiotics and Related Peptide Synthetases (англ.) / Brakhage A. A.. — 2004. — P. 45—90. — ISBN 3-540-22032-1. — doi:10.1007/b99257.
- ↑ 1 2 Brakhage, A. A. Molecular Regulation of β-Lactam Biosynthesis in Filamentous Fungi (англ.) // Microbiology and Molecular Biology Reviews (англ.)русск. : journal. — American Society for Microbiology (англ.)русск., 1998. — Vol. 62, no. 3. — P. 547—585. — PMID 9729600.
- ↑ Baldwin, J. E., Byford, M. F., Clifton, I., Hajdu, J., Hensgens, C., Roach, P., Schofield, C. J. Proteins of the Penicillin Biosynthesis Pathway (неопр.) // Curr Opin Struct Biol.. — 1997. — № 7. — С. 857—864.
- ↑ 1 2 Fernandez, F. J., Fierro, F., Gutierrez, S., Kosalkova, K . Marcos, A. T., Martin, J. F., Velasco, J. Expression of Genes and Processing of Enzymes for the Biosynthesis of Penicillins and Cephalosporms (англ.) // Anton Van Lee : journal. — 1994. — September (vol. 65, no. 3). — P. 227—243. — doi:10.1007/BF00871951. — PMID 7847890.
- ↑ Baker, W. L., Lonergan, G. T. «Chemistry of Some Fluorescamine-Amine Derivatives with Relevance to the Biosynthesis of Benzylpenicillin by Fermentation». J Chem Technol Biot. 2002, 77, pp1283-1288.
- ↑ Sheehan, John C.; Henery-Logan, Kenneth R. The Total Synthesis of Penicillin V (англ.) // Journal of the American Chemical Society (англ.)русск. : journal. — 1957. — 5 March (vol. 79, no. 5). — P. 1262—1263. — doi:10.1021/ja01562a063.
- ↑ Sheehan, John C.; Henery-Logan, Kenneth R. The Total Synthesis of Penicillin V (англ.) // Journal of the American Chemical Society (англ.)русск. : journal. — 1959. — 20 June (vol. 81, no. 12). — P. 3089—3094. — doi:10.1021/ja01521a044.
- ↑ 1 2 3 E. J. Corey; John D. Roberts. Biographical Memoirs: John Clark Sheehan (неопр.). The National Academy Press. Дата обращения 28 января 2013. Архивировано 28 апреля 2013 года.
- ↑ Nicolaou, K.C.; Vourloumis, Dionisios; Winssinger, Nicolas; Baran, Phil S. The Art and Science of Total Synthesis at the Dawn of the Twenty-First Century** (англ.) // Angewandte Chemie International Edition : journal. — 2000. — Vol. 39, no. 1. — P. 44—122. — doi:10.1002/(SICI)1521-3773(20000103)39:1<44::AID-ANIE44>3.0.CO;2-L. — PMID 10649349.
- ↑ Professor John C. Sheehan Dies at 76 (1 апреля 1992). Дата обращения 28 января 2013.
Пенициллин - это... Что такое Пенициллин?
Бензилпенициллин (пенициллин G или просто пенициллин) — бензиловый эфир 6-аминопенициллановой кислоты.
Исторические сведения
Пенициллин — первый антибиотик, то есть антимикробный препарат, полученный на основе продуктов жизнедеятельности микроорганизмов. Он был обнаружен в 1928 году Александром Флемингом в культуре плесневых штамма грибков Penicillium Notatum на основе случайного открытия, что попадание в культуру бактерий плесневого грибка из внешней среды оказывает бактерицидное действие на культуру.
В 1940—1941 году английский бактериолог Хоуард У. Флори, а также биохимики Эрнст Чейн и Норман У. Хитли работали над выделением и промышленным производством пенициллина сначала в Англии, затем в США. Они впервые использовали его для лечения бактериальных инфекций в 1941 году. В 1945 году Флемингу, Флори и Чейну была присуждена Нобелевская премия по физиологии и медицине «за открытие пенициллина и его целебного воздействия при различных инфекционных болезнях».
В СССР первые образцы пенициллина получили в 1942 году микробиологи З.В. Ермольева и Т.И. Балезина. Зинаида Виссарионовна Ермольева активно участвовала в организации промышленного производства пенициллина. Созданный ею препарат пенициллин-крустозин ВИ ЭМ, превосходивший недоступный зарубежный аналог, был получен из штамма грибков Penicillium Crustosum. Он спас жизни многих бойцов Советской Армии.
Фармакологическое действие
Антибиотик группы биосинтетических пенициллинов. Оказывает бактерицидное действие за счёт ингибирования синтеза клеточной стенки микроорганизмов.
Активен в отношении грамположительных бактерий: Staphylococcus spp., Streptococcus spp. (в том числе Streptococcus pneumoniae), Corynebacterium diphtheriae, Bacillus anthracis;
грамотрицательных бактерий: Neisseria gonorrhoeae, Neisseria meningitidis;
анаэробных спорообразующих палочек;
а также Spirochaetaceae.
К действию бензилпенициллина устойчивы штаммы Staphylococcus spp., продуцирующие пенициллиназу. Разрушается в кислой среде.
Новокаиновая соль бензилпенициллина по сравнению с калиевой и натриевой солями характеризуется большей продолжительностью действия благодаря низкой растворимости и образованию депо в месте инъекции.
Фармакокинетика
После внутремышечного введения быстро всасывается из места инъекции. Широко распределяется в тканях и жидкостях организма. Бензилпенициллин хорошо проникает через плацентарный барьер, ГЭБ при воспалении мозговых оболочек. T½ — 30 мин. Выводится с мочой.
Показания
Лечение заболеваний, вызванных чувствительными к бензилпенициллину микроорганизмами: крупозная и очаговая пневмония, эмпиема плевры, сепсис, септицемия, пиемия, острый и подострый септический эндокардит, менингит, острый и хронический остеомиелит, инфекции мочевыводящих и жёлчных путей, ангина, гнойные инфекции кожи, мягких тканей и слизистых оболочек, рожа, дифтерия, скарлатина, сибирская язва, актиномикоз, лечение гнойно-воспалительных заболеваний в акушерско-гинекологической практике, ЛОР-заболеваний, глазных болезней, гонорея, бленнорея, сифилис.
Режим дозирования
Индивидуальный. Вводят в/м, в/в, п/к, эндолюмбально. При в/м и в/в введении взрослым суточная доза варьирует от 250 000 до 60 млн. ЕД. Суточная доза для детей в возрасте до 1 года составляет 50 000—100 000 ЕД/кг, старше 1 года — 50 000 ЕД/кг; при необходимости суточную дозу можно увеличить до 200 000—300 000 ЕД/кг, по жизненным показаниям — до 500 000 ЕД/кг. Кратность введения 4-6 раз/сут. Эндолюмбально вводят в зависимости от заболевания и тяжести течения взрослым — 5000-10 000 ЕД, детям — 2000-5000 ЕД 1 раз/сут в течение 2-3 дней, затем переходят на в/м введение. П/к бензилпенициллин применяют для обкалывания инфильтратов (100 000—200 000 ЕД в 1 мл 0.25 %-0.5 % раствора новокаина). В полости (в том числе в брюшную, плевральную) вводят в концентрации 10 000-20 000 ЕД/1 мл для взрослых, и 2000-5000 ЕД/1 мл для детей. Продолжительность введения 5-7 дней, затем переходят на в/м введение. Бензилпенициллина калиевую соль применяют только в/м и п/к, в тех же дозах что и бензилпенициллина натриевую соль. Бензилпенициллина новокаиновую соль применяют только в/м. Средняя терапевтическая доза для взрослых: разовая — 300 000 ЕД, суточная — 600 000 ЕД. Детям в возрасте до 1 года — 50 000—100 000 ЕД/кг/сут, старше 1 года — 50 000 ЕД/кг/сут. Кратность введения 3-4 раза/сут. Длительность лечения бензилпенициллином в зависимости от формы и тяжести течения заболевания может составлять от 7-10 дней до 2 мес и более.
Побочное действие
Со стороны пищеварительной системы: диарея, тошнота, рвота. Эффекты, обусловленные химиотерапевтическим действием: кандидоз влагалища, кандидоз полости рта. Со стороны ЦНС: при применении бензилпенициллина в высоких дозах, особенно при эндолюмбальном введении, возможно развитие нейротоксических реакций: тошнота, рвота, повышение рефлекторной возбудимости, симптомы менингизма, судороги, кома. Аллергические реакции: повышение температуры тела, крапивница, кожная сыпь, сыпь на слизистых оболочках, боли в суставах, эозинофилия, ангионевротический отёк. Описаны случаи анафилактического шока с летальным исходом.
Противопоказания
Повышенная чувствительность к бензилпенициллину и другим препаратам из группы пенициллинов и цефалоспоринов. Эндолюмбальное введение противопоказано пациентам, страдающим эпилепсией.
Беременность и лактация
Применение при беременности возможно только в том случае, когда предполагаемая польза превышает риск развития побочных действий. При необходимости применения в период лактации следует решить вопрос о прекращении грудного вскармливания.
Особые указания
С осторожностью применяют у пациентов с нарушениями функции почек, при сердечной недостаточности, предрасположенности к аллергическим реакциям (особенно при лекарственной аллергии), при повышенной чувствительности к цефалоспоринам (из-за возможности развития перекрёстной аллергии). Если через 3-5 дней после начала применения эффекта не отмечается, следует перейти к применению других антибиотиков или комбинированной терапии. В связи с возможностью развития грибковой суперинфекции целесообразно при лечении бензилпенициллином назначать противогрибковые препараты. Необходимо учитывать, что применение бензилпенициллина в субтерапевтических дозах или досрочное прекращение лечения часто приводит к появлению резистентных штаммов возбудителей. Бензилпенициллин в форме порошка для инъекций включён в Перечень ЖНВЛС.
Лекарственное взаимодействие
Пробенецид снижает канальцевую секрецию бензилпенициллина, в результате повышается концентрация последнего в плазме крови, увеличивается период полувыведения. При одновременном применении с антибиотиками, оказывающими бактериостатическое действие (тетрациклин), уменьшается бактерицидное действие бензилпенициллина.
Ссылки
| Бета-лактамные антибактериальные препараты, пенициллины (J01C) | |
|---|---|
| Пенициллины широкого спектра действия | Ампициллин • Пивампициллин • Карбенициллин • Амоксициллин • Кариндациллин • Бакампициллин* • Эпициллин • Пивмециллинам • Азлоциллин • Мезлоциллин* • Мециллинам • Пиперациллин* • Тикарциллин • Метампициллин • Талампициллин • Сулбенициллин • Темоциллин • Гетациллин |
| Пенициллины, чувствительные к бета-лактамазам | Бензилпенициллин • Феноксиметилпенициллин • Пропициллин • Азидоциллин • Фенетициллин • Пенамециллин* • Кломециллин • Бензатина бензилпенициллин • Бензилпенициллин прокаина • Бензатина феноксиметилпенициллин Комбинированные препараты: «Бициллин-3» (бензатина бензилпенициллин+бензилпенициллин прокаина+бензилпенициллин) • «Бициллин-5» (бензатина бензилпенициллин+бензилпенициллин прокаина) |
| Пенициллины, устойчивые к бета-лактамазам | Диклоксациллин* • Клоксациллин* • Метициллин* • Оксациллин • Флуклоксациллин* |
| Ингибиторы бета-лактамаз | Сульбактам • Тазобактам* |
| Комбинации пенициллинов (в том числе с ингибиторами бета-лактамаз) | «Амписид» (ампициллин+сульбактам) • «Аугментин» (амоксициллин+клавулановая кислота), «Трифамокс ИБЛ» (амоксициллин+сульбактам) • «Тиментин» (тикарциллин+клавулановая кислота) • Сультамициллин Комбинации пенициллинов: «Ампиокс» (ампициллин+оксациллин) |
| Данные по лекарственным препаратам приведены в соответствии с реестром зарегистрированных ЛС и ТКФС от 15.10.2008 (* — препарат изъят из оборота) Поиск по базе данных ЛС. ФГУ НЦ ЭСМП Росздравнадзора РФ (28.10.2008). Проверено 6 ноября 2008. | |
Wikimedia Foundation. 2010.
Пенициллин — лекарство, с которого начинались антибиотики — Рамблер/новости
СодержаниеКак лечили инфекции до открытия антибиотиковИстория открытия пенициллинаДальнейшая судьба первого лекарства из группы антибиотиковКак пенициллин появился в России?Как же действует пенициллин?Пенициллин сегодня: есть ли ему место в медицине?Интересные факты о пенициллине
Какой была жизнь до изобретения антибиотиков? Банальная гнойная ангина приводила к тяжелым осложнениям со стороны сердца, почек, суставов и, нередко, к гибели. Пневмония была в большинстве случаев смертельным приговором. А сифилис медленно и верно уродовал тело человека. Любое воспалительное осложнение при родах приводило практически всегда к гибели и матери, и новорожденного. Многие из тех, кто сегодня агитирует против применения антибиотиков (а таких немало) просто не представляют, что до открытия этих лекарств любое инфекционное заболевание означало неминуемую гибель.
Именно по этой причине 6 августа 1881 года можно назвать важнейшей датой в современной медицине, ведь именно в этот день родился ученый Александр Флеминг, который в 1928 году открыл первый антибиотик — пенициллин. Как это произошло, какую нишу занимал этот препарат и есть ли ему место в современной практике по лечению инфекционных болезней? Подробности в новой статье на портале MedAboutMe.Как лечили инфекции до открытия антибиотиков
Никому не известный доктор Флеминг долгое время работал в больнице святой Марии в Шотландии. Он был врачом широкого профиля, однако активно интересовался возбудителями инфекций и тем, каким образом они вызывают различные заболевания. В то время никакого специфического способа их лечения не было. Однако врачи все равно пытались спасать жизни таким больным. Для этого они применяли различные методы.
При инфекционном процессе нередко проводили кровопускание, которое позволяло вывести наружу кровь, содержащую большое количество возбудителей. После этого больного заставляли пить много жидкости, чтобы восполнить кровопотерю. Для этой процедуры либо делали разрез в области крупного кровеносного сосуда, либо накладывали пиявок. Применяли различные травы, обладающие бактерицидным действием. Их наносили на область раны, либо давали выпить отвары, настои. Историческим методом лечения сифилиса была ртуть, которую принимали внутрь и вводили тонкими прутьями прямо в мочеиспускательный канал. Альтернативой был мышьяк, однако его применение нельзя назвать более эффективным и безопасным. На раны наносили древесный уголь, который вытягивал гной, и иногда раствор брома. Последний вызывал серьезный ожог, однако и бактерии при этом погибали.
Но в основном с инфекцией справлялся сам организм человека. Либо не справлялся. В таком случае действовал естественный отбор: люди со слабым иммунитетом быстро погибали, а с сильным — поправлялись и давали потомство.
История открытия пенициллина
Первая мировая война обнажила уязвимые места медицинской науки: большое количество солдат с инфицированным ранами погибали, даже если проводилась их полная хирургическая обработка. А ведь эти крепкие и здоровые люди могли бы поправиться и вновь участвовать в боевых действиях, если бы имелся более эффективный способ оказать им помощь. Одновременно с лечением солдат, Флеминг стал искать лекарства, которые могли бы убивать бактерии. Он провел множество опытов, не увенчавшихся успехом. Однако, в один прекрасный день, на чашку, на которой находились микроорганизмы в питательной среде, упал кусок плесневелого хлеба. Ученый обратил внимание, что в месте контакта все бактерии исчезли. Этот факт его чрезвычайно заинтересовал. По другой версии, плесень попала на колонии стрептококков, которые выращивал ученый, из-за того, что он не всегда стерилизовал свои чашки, зачастую он их даже не мыл после предыдущих опытов.
В результате после многочисленных экспериментов он смог выделить в чистом виде вещество, которое назвал пенициллин. Однако применить его на практике он не смог: оно было очень нестойким. И, тем не менее, Флеминг доказал, что оно разрушает большое количество самых распространенных микроорганизмов (стрептококк, стафилококк, дифтерийную палочку, возбудителя сибирской язвы и др.).
Дальнейшая судьба первого лекарства из группы антибиотиков
Вторая мировая волна стала толчком для дальнейшего развития микробиологии. И причина была все та же: появилась необходимость в лечении солдат, получивших ранения. В результате два британских ученых Флори и Чейн смогли выделить пенициллин в чистом виде и создать лекарство, которое было впервые введено молодому человеку с сепсисом в 1941 году. Состояние его улучшилось на какое-то время, однако он все равно погиб, так как вводимые дозы были недостаточны для того, чтобы уничтожить все патогенные бактерии. Несколькими месяцами позже пенициллин ввели мальчику с тем же сепсисом, доза при этом была подобрана правильно, и в результате в конечном итоге он поправился. Ученые героически хранили результаты своих научных трудов и не прекращали эксперименты даже во время налетов бомбардировщиков нацисткой Германии.
С 1943 года началось широкое применение пенициллина для лечения инфекционных болезней и осложнений после ранений. В результате все трое — Флеминг, Флори и Чейн в 1945 году получили Нобелевскую премию. Уже в 1950 году фармацевтические кампании Pfizer и Merck произвели по 200 тонн этого лекарства.Пенициллин довольно быстро был назван «лекарством XX века», ведь на его счету было больше спасенных жизней, чем у всех остальных вместе взятых.
Как пенициллин появился в России?
Конечно, советская разведка быстро выяснила, что в Англии и США разрабатывают какое-то сверхмощное антибактериальное лекарство на основе плесневого грибка. Руководство страны поставило перед учеными опередить зарубежных исследователей и самим получить это вещество. Однако они не успели сделать это раньше: впервые отечественный пенициллин был выделен в чистом виде в 1942 году и с 1944 года он стал применяться в качестве лекарственного средства. Автором трудов и научных опытов была Зинаида Ермольева, однако имя ее известно лишь специалистам в области микробиологии.
С 1947 года было налажено заводское производство этого антибиотика, качество которого значительно превышало результаты первых экспериментов. Учитывая наличие «железного занавеса», отечественным ученым пришлось самостоятельно проходить весь путь по открытию этого препарата, так как они не могли воспользоваться опытом своих зарубежных коллег из США и Великобритании.
Как же действует пенициллин?
Механизм действия антибиотика пенициллина очень прост: в его состав входит 6-аминопенициллановая кислота, которая разрушает клеточную стенку некоторых бактерий. Это быстро приводит к их гибели. Изначально очень большой спектр микробов оказался уязвимым перед этим лекарством: среди них стрептококки, стафилококки, кишечная палочка, возбудители тифа, холеры, дифтерии, сифилиса и др. Однако бактерии — это живые существа, и они быстро начали вырабатывать устойчивость к этому препарату. Таким образом, если его первоначальные дозы составляли несколько тысяч условных единиц 2-3 раза в день, то для того, чтобы лекарство оказывало клинический эффект на сегодняшний день требуются гораздо большие дозы: 1-2 миллиона условных единиц в сутки. Отдельные заболевания требуют вообще ежесуточного введения 40-60 миллионов условных единиц.
Препарат применяется только в виде инъекций (внутримышечных или внутривенных). Обычно его выпускают в виде порошка, который медсестра разводит перед введением физиологическим раствором или анестетиком. Ведь, как известно, инъекции пенициллина очень болезненные.
Еще одним негативным моментом в лечении пенициллином является то, что период его полувыведения составляет 3-5 часов. То есть для того, чтобы в крови поддерживалась определенная лечебная доза, необходимо шестикратное введение. Таким образом, больному делают уколы каждые 3 часа. Это достаточно изнурительно и уже через 2-3 дня превращает его ягодицы в решето, на которое невозможно ни сесть, ни лечь.
Пенициллин сегодня: есть ли ему место в медицине?
В настоящее время препарат не активен в отношении грамотрицательных бактерий и палочек, но сохраняет удовлетворительный эффект против стрептококков, стафилококков, возбудителя дифтерии, сибирской язвы и гонореи. Однако резистентность (устойчивость) этих бактерий составляет в некоторых регионах нашей страны 25% и даже выше, что значительно уменьшает вероятность успешного исхода терапии.
И, тем не менее, структура природного пенициллина и механизм его действия послужили основой для дальнейшего развития антимикробной химиотерапии. Ученые стали создавать более современные, эффективные и удобные в применении лекарства. Он явился первым представителем целой группы антибиотиков, среди которых известные многим Ампициллин, Амоксициллин, Амоксиклав и др. Эти препараты намного более активны в отношении всех вышеуказанных микроорганизмов, каждый из них имеет свой спектр действия и показания для применения.
Таким образом, можно сказать, что природный пенициллин на сегодняшний день практически не применяется. Исключение составляют лишь маленькие больницы в отдаленных уголках нашей страны. Причин несколько:
низкая эффективность, потребность в шестикратном внутримышечном введении, крайняя болезненность инъекций. Интересные факты о пенициллине Пенициллин до сих пор активно применяется для лечения всех стадий сифилиса, ведь бледная трепонема сохраняет хорошую чувствительность к этому препарату. К тому же плюсом его является то, что он разрешен во время беременности и кормления грудью, ведь в этот период очень важно, чтобы женщина была пролечена от данного тяжелого заболевания. Пенициллин нередко вызывает аллергические реакции, вплоть до анафилактического шока. Для него характерна перекрестная реакция с другими бета-лактамными антибиотиками, то есть в случае непереносимости последнего ни один из них не должен применяться. Только доктор сможет подобрать адекватную альтернативу этому препарату, которая пока еще есть. Александр Флеминг, который впервые открыл пенициллин, всегда отрицал сам факт этого открытия. Он говорит, что плесневый грибок существовал и до него, он смог лишь доказать его бактерицидный эффект. По этой причине, вероятнее всего, ученый так и не получил патент на свое изобретение. Природный пенициллин выпускался исключительно в виде инъекций, хотя неоднократно были предприняты попытки сделать таблетированную форму. Успеха смогли добиться лишь после того, как данный препарат был получен синтетическим путем — именно так появились аминопенициллины. Памятник пенициллину есть в городе Задонск Липецкой области. Он находится во дворе ветеринарной лечебницы и представляет собой красно-синий столб, обвиваемый червем, на верхушке которого находится пилюля. Это весьма странное архитектурное сооружение, дорогу к которому смогут указать лишь некоторые жители города Задонска, является единственным памятником пенициллину. Непонятно также наличие в его структуре таблетки, ведь препарат вводится только путем инъекций. Название «Пенициллин» получил новый современный комплекс артиллерийской разведки. На данный момент проводятся его государственные испытания и с 2019 года планируется начать его массовое производство. В мае 2017 года появилась новость о том, что ученые-биологи смогли «научить» обычные дрожжи вырабатывать природный пенициллин. Пока эти опыты не выходят за рамки обычных лабораторных испытаний, но специалисты делают оптимистичные прогнозы: этот факт может значительно удешевить стоимость данного антибиотика. Правда, не совсем понятна цель, ведь на сегодняшний день практически везде применяют лишь синтетические формы пенициллиновых антибиотиков.
Когда-то пенициллин спас миллионы жизней, с его открытием медицинская наука получила мощный толчок. Тысячи ученых по всему миру стали работать над вопросом изобретения других более эффективных и безопасных антибиотиков.
Комментарий экспертаАлексеева Александра, врач-клинический фармаколог, врач-терапевт, Первая городская клиническая больница (Архангельск)
Открытие природного пенициллина можно назвать огромным достижением медицинской науки, ведь он стал первым препаратом из группы антибиотиков. Однако на сегодняшний день его применение в качестве лекарственного средства сильно ограничено. Исключение составляет лечение сифилиса, так как возбудитель быстро погибает под его действием. Еще одним случаем, когда доктора могут выбрать его в качестве основного лечения, является ситуация, когда анализ на чувствительность микроорганизмов, вызывающих определенное заболевание, показывает хорошую эффективность против них. К минусам природного пенициллина можно отнести потребность в частых инъекциях, что приносит страдания больному и добавляет работы процедурной медсестре. В противовес этому есть современные антибиотики, которые можно применять 1-2 раза в сутки, они превосходят его по эффективности и безопасности и существуют в виде таблеток. К тому же он достаточно аллергичный, поэтому людям-атопикам стоит от него воздерживаться.
Пеницилл — Википедия
Пеници́лл[1][2], также пеници́ллий[3], пеници́ллиум[1] (лат. Penicillium), — род грибов-аскомицетов, относящийся к семейству Aspergillaceae порядка Эуроциевые (Eurotiales).
Один из наиболее широко распространённых в мире родов грибов, представители которого обнаруживаются в самых различных местах — в почве, на растениях, в воздухе, в помещениях, на пищевых продуктах, в морях. С эколого-трофической точки зрения, виды рода — сапротрофы и слабые паразиты растений.
Отдельные виды используются в сыроварении — Penicillium roqueforti и P. camemberti.
К роду относят продуцентов антибиотика пенициллина — среди них P. chrysogenum, являющийся одним из самых распространённых грибов в мире. Другой крайне широко распространённый вид рода — P. citrinum.
У большинства видов преобладает анаморфная гифомицетовая стадия, образующая конидиогенные клетки с цепочками конидий. Телеоморфы, как правило (и если известны), образуют жёсткие клейстотеции с восьмиспоровыми асками. Ранее к Penicillium относились исключительно анаморфные стадии грибов, в то время как телеоморфы относились к родам Eupenicillium и Talaromyces. После отмены правила раздельной номенклатуры для различных стадий жизненного цикла грибов первое из этих названий перешло в синонимику Penicillium, а ко второму роду стали относить также ряд родственных видов, известных только по анаморфной стадии и ранее включаемых в Penicillium. К 2018 году в роде описано свыше 350 признанных видов.
Основы систематики рода заложили в 1930—1940-х годах американские микологи-микробиологи Чарлз Том и Кеннет Рэйпер. В разработанной ими системе разделение рода на секции базируется на сложности строения конидиеносцев — так называемой ярусности кисточек с конидиями. Этот подход использовался и в более поздних системах классификации, поскольку оказывается удобным для определения видов по морфологическим признакам. Молекулярно-филогенетические исследования рубежа XX—XXI веков, однако, показали, что этот признак в сравнительно редких случаях коррелирует с эволюционным родством видов.
Характеристика колоний и микроморфология[править | править код]
Вегетативный мицелий обильный, полностью погружённый в агар или хотя бы частично возвышающийся над ним, формирует густые плотные колонии. Гифы неправильно ветвящиеся, септированные, обычно неокрашенные[4].
Условно выделяются четыре типа колоний пенициллов по макроморфологии. По Рэйперу и Тому, у бархатистых (англ. velvety, velutinous) колоний все или почти все вегетативные гифы погружены в субстрат; конидиеносцы густой однородной массой отходят от поверхности субстрата, придавая колониям бархатисто-зернистый облик. Войлочные (англ. lanose), или шерстистые (floccose), колонии характеризуются наличием развитого воздушного вегетативного мицелия, во время роста колоний образующего стерильный, как правило, белый край; конидиеносцы представляют собой ответвления от стерильных воздушных гиф. Колонии с мицелиальными тяжами (англ. funiculose) имеют воздушный мицелий, состоящий из сплетений гиф, как правило, восходящих над субстратом; конидиеносцы отходят от этих сплетений, также от отдельных стерильных гиф. Пучковатые (англ. fasciculate) колонии характеризуются аггрегированием простых конидиеносцев в пучки, создающим видимость крупной зернистости колонии; колонии с коремиями (coremiform) — крайний случай пучковатости, для которого характерны крупные пучки конидиеносцев с общей споровой массой, приподнятой на стерильной ножке[3][5].

Конидиеносцы образуются на недифференцированных гифах субстратного, поверхностного или воздушного мицелия, 2—5 мкм толщиной, тонкостенные, у некоторых видов с верхушечным вздутием, обычно гиалиновые, редко коричневые. Конидиеносцы септированные, на конце несут так называемую кисточку (лат. penicillus) — мутовку фиалид (одноярусная кисточка) или мутовку метул, несущих по мутовке конидиогенных клеток каждая (двухъярусная кисточка). Сам конидиеносец может дополнительно ветвиться, в результате образуются трёх- и четырёхъярусные (иногда и с большим числом ярусов) кисточки. У некоторых видов конидиеносцы заканчиваются одиночными конидиогенными клетками. Конидиогенные клетки — фиалиды (иногда называемые стеригмами) — фляговидные, обычно не превышают 15 мкм в длину. Конидии (фиалоконидии) одноклеточные, у большинства видов 2—5 мкм в наибольшем измерении, образуются базипетально на суженных в шейку верхушках фиалид. Цепочки конидий могут быстро распадаться либо длительное время сохраняться, также могут переплетаться между собой либо оставаться параллельными, образуя колонки. Конидии в массе различных оттенков зелёного, реже белые, коричневые, оливковые[4].
Некоторые виды образуют склероции в виде жёстких сплетений толстостенных гиф, представляющие собой недоразвитые клейстотеции[6].
Плодовые тела известны у сравнительно небольшого числа (около 40) видов, представляют собой видимые невооружённым глазом (100—500 мкм в диаметре) клейстотеции, шаровидные или почти шаровидные до удлинённых или неправильных, очень жёсткие, сохраняющиеся таковыми в течение недель и даже месяцев. Созревают от центра к периферии. Окраска плодовых тел белая, жёлтая, оранжевая, коричневая, редко чёрная или красная. Аски унитуникатные, обычно с 8 спорами, почти шаровидные до эллипсоидальных или грушевидных, 5—15 мкм длиной. Аскоспоры одноклеточные, широкоэллипсоидальные, линзовидные или (почти) шаровидные, 2—5 мкм в диаметре, гладкие или шероховатые, с неглубокой экваториальной бороздой или с двумя в той или иной степени выраженными параллельными экваториальными гребнями[3][4][6][7]. Отличное от других видов строение телеоморфы характерно для Penicillium eremophilum (анаморфа у этого вида неизвестна): аски у этого вида двуспоровые, клейстотеции тонкостенные[8][9].
Известны гомоталличные и гетероталличные виды, в геноме их гаплоидных клеток содержится один или два соответственно аллеля локуса MAT — MAT1-1 и (или) MAT1-2, — определяющих типы спаривания[10][11].
Расчётный размер генома у разных видов рода варьирует в довольно широких пределах — от 25 до 36 Мб. Отмечается, что Penicillium digitatum, способный поражать только плоды цитрусовых, обладает самым маленьким геномом из слабо фитопатогенных видов — 25,7 Мб. Геном патогена плодов косточковых и семечковых культур P. expansum — наибольший среди потенциальных фитопатогенов, около 31 Мб. Наиболее крупные геномы в целом — у P. camemberti и P. commune[10].
Культивирование на питательных средах[править | править код]
В качестве стандартных сред для изучения морфологии пенициллов на чашках Петри приняты агар Чапека с дрожжевым экстрактом (Czapek Yeast Extract Agar, CYA) и агар с солодовым экстрактом[de] (Malt Extract Agar, MEA). В отдельных исследованиях также используются среда Чапека[en] (Czapek Agar, CZA), овсяный агар (Oatmeal Agar, OA), креатиново-сахарозный агар (Creatine Sucrose Agar, CREA), агар с дрожжевым экстрактом и сахарозой (Yeast Extract Sucrose Agar, YES), дихлоран-глицериновый агар[de] (Dichloran 18 % Glycerol agar, DG18), агар с солодовым экстрактом в модификации Блексли, CYA с 5 % поваренной соли (CYAS) и другие[12].
Агаризованная среда Чапека использовалась в качестве основной для описания пенициллов в работах Рэйпера и Тома (1949), Пидопличко (1972), Рамиреса (1982). YES используется для определения характеристик, связанных со вторичными метаболитами грибов. Овсяный агар наиболее эффективен для стимулирования полового размножения у пенициллов. Изменение цвета среды под колониями на CREA, связанное с выделением кислот и оснований (и вообще способность или неспособность расти на этой среде, где в качестве источника азота используется креатин), помогает различить некоторые близкородственные виды. DG18 и CYAS позволяют характеризовать рост грибов при пониженной доступности воды[12].
Для развития нормальной окраски спороношения в питательных средах необходимо наличие следовых количеств сульфата цинка и сульфата меди[12].
Морфологически сходные группы грибов[править | править код]
Кисточковидно разветвлённые конидиеносцы с фиалидами, образующими конидии в базипетальных цепочках, характерны для целого ряда анаморф. Эти роды фенотипически отличимы от Penicillium по характеру ветвления конидиеносцев, форме фиалид, строению плодовых тел телеоморфы, окраске колоний.
Так, анаморфы грибов, относимых к роду Hamigera, образуют фляговидные или цилиндрические фиалиды, часто расположенные на конидиеносцах неправильно, и конидии, в массе окрашенные в коричневые тона; телеоморфы представлены мягкими аскомами из рыхлопереплетённых гиф[13].
Анаморфы Talaromyces отличаются от анаморф Penicillium обычно симметричными двухъярусными кисточками с ланцетными фиалидами; окраска спороношения часто более тёмных зелёных тонов, чем у Penicillium. Телеоморфы этого рода образуют мягкие плодовые тела из переплетённых гиф[13].
У Rasamsonia кисточки двухъярусные и трёхъярусные, с цилиндрическими фиалидами, суженными к обоим концам; конидии в массе коричневые. Плодовые тела мягкие, с тонкими стенками. Виды этого рода часто являются термофильными[13].
Sagenomella с белым, серым, зеленоватым, коричневым конидиальным спороношением, неправильно расположенными, лишь иногда собранными в мутовки, ланцетными фиалидами. Плодовые тела также мягкие, тонкостенные[13].
Trichocoma paradoxa образует двухъярусные и трехъярусные кисточки с цилиндрическими, суженными к обоим концам фиалидами, конидиальное спороношение в коричневых тонах. Плодовые тела мягкие, крупные, до 2 см в диаметре[13].
В роде Paecilomyces конидиальное спороношение в коричневых тонах, конидиеносцы неправильно мутовчато разветвлённые, фиалиды с широким основанием и длинной узкой шейкой. Плодовые тела практически не оформленные[13].
К Thermomyces относят грибы, у которых анаморфа образует одноярусные и двухъярусные кисточки либо одиночными хламидоспороподобными конидиями. Окраска спороношения зелёная. Термофилы, образующие жёсткие клейстотеции[13].
Спороносящий пеницилл на плоде мандаринаБольшинство видов — исконно почвенные сапротрофы, меньшая доля — оппортунистические паразиты растений, поражающие ослабленные всходы и длительно хранящиеся плоды растений. Встречаются и на прочих органических субстратах, пищевых продуктах[3][6].
В качестве наиболее распространённых видов рода указываются Penicillium chrysogenum, P. citrinum, P. digitatum, P. griseofulvum и P. hirsutum[14].
Отмечается, что пенициллы, как правило, составляют до 67 % преобладающих видов грибов во всех биогеоценозах с естественной растительностью (при этом общее разнообразие достигает 50—75 и более видов в 1 г почвы). Разнообразие пенициллов максимальное в почвах пустошей и пойменных лесов и минимально в почвах пустынь и тундр. Многие виды рода распространены повсеместно, однако часто выделяются только из определённых групп биогеоценозов. Так, Penicillium restrictum — стабильный индикатор почв травянистых сообществ по всему миру, P. montanense и P. lagena обычны в хвойных и хвойно-широколиственных лесах[15]
Некоторые виды способны развиваться при pH = 1,5—3, многие виды — при pH = 9—10 и выше. Penicillium roqueforti может медленно расти при концентрации кислорода 0,5 %. P. expansum нормально растёт при 2 % O2. Большинство видов, однако, требует более высоких концентраций кислорода. Ряд видов рода — умеренные ксерофилы, большинство видов растут при aw = 0,82, некоторые виды — и при aw = 0,78, P. eremophilum — облигатный ксерофил, не развивающийся при aw больше 0,90[8]. Большинство видов способны развиваться при температуре ниже 5 °C, некоторые — при 0 °C[16]. Описано несколько видов, относящихся к категории психротолерантов: в частности, Penicillium jamesonlandense и P. ribium. P. jamesonlandense плохо растёт при 25 °C, его температурный оптимум — 17—18 °C[14].
Порча пищевых продуктов[править | править код]
Спороношение пеницилла на плоде апельсинаПенициллы — весьма обыкновенные плесневые грибы, встречающиеся на разнообразных пищевых продуктах. Как правило, виды этого рода вызывают менее существенные поражения пищевых продуктов, чем виды аспергилла. Многие виды рода — почвенные обитатели, попадающие на пищевые продукты только в качестве загрязнителей. Для других видов пищевые продукты являются наиболее обычным субстратом для развития. Пенициллы, встречающиеся на пищевых продуктах, разделяются на три группы: встречающиеся на свежей пище, наиболее часто — на плодах растений; поражающие зерно после уборки и во время высушивания; и встречающиеся на переработанных продуктах питания[17].
Представители рода — наиболее часто встречающиеся плесени, поражающие плоды яблони, груши, цитрусовых. На яблоках и грушах нередко поселяется Penicillium expansum, вызывающий широко распространяющуюся гниль коричневого цвета. Этот вид обнаруживается также на плодах земляники, томата, винограда, авокадо, манго. Выделяет токсин патулин. P. solitum встречается на яблоках и грушах, однако более редок. P. digitatum часто поражает плоды апельсина, реже — других цитрусовых, образуя гниль коричневого цвета. На лимонах наиболее часто встречается P. italicum, образующий голубое или голубовато-зелёное спороношение на плодах. Близкий вид P. ulaiense также встречается на плодах апельсина и лимона[17].
Penicillium brevicompactum — неспецифичный слабый патоген, иногда вызывающий гниение яблок, винограда, грибов, маниока, картофеля. Выделяет токсин микофеноловую кислоту. P. aurantiogriseum и близкие виды выделяются с разнообразных свежих растительных продуктов, синтезируют слабые токсины пеницилловую кислоту, рокфортин C, веррукозидин. Поражения чеснока вызывает вид P. allii. P. oxalicum, выделяющий секалоновую кислоту D, известен как патоген ямса и маниока[17].
Penicillium verrucosum, выделяющий охратоксин А, — наиболее экономически значимый грибок среди представителей рода в Европе, поражает зерновые культуры. В Японии на зёрнах риса изредка встречается P. citreonigrum, выделяющий цитреовиридин[17].
Порчу сыра наиболее часто вызывает Penicillium commune, представляющий собой естественную форму используемого в сыроделии вида P. camemberti. Также на сырах, производимых без использования этого вида, в качестве агента порчи может появляться P. roqueforti. Реже на сыре встречаются P. brevicompactum, P. chrysogenum, P. glabrum, P. expansum, P. solitum, P. verrucosum, P. viridicatum[17].
На маргарине и различных вареньях иногда встречается вид Penicillium corylophilum[17].
Токсичные метаболиты[править | править код]
Впервые токсичность гриба, достоверно относящегося к пенициллам, была задокументирована в 1913 году, когда Карл Олсберг и Отис Блэк наблюдали токсическое действие экстракта Penicillium puberulum (штамм NRRL 1889, использованный ими, относится к P. cyclopium[18]), выделенного с заплесневелых початков кукурузы, на животных при введении в количествах 200—300 мг на кг массы[19].
В обзоре 1981 года 85 видов рода (включая Talaromyces) указывались как продуценты токсичных веществ. Несомненно, многие из сообщений, на которых основан этот обзор, связаны с ошибочным определением видов. В 1991 году были обобщены сведения о 27 токсичных метаболитах, продуцируемых пенициллами. Из них 17 были названы потенциально опасными токсинами грибов, встречающихся на пищевых продуктах (2006)[19].
В 2007 году Джон Питт перечислил 9 микотоксинов, продуцируемых пенициллами, наиболее потенциально опасных для человека[19]:
| Название токсина | Токсичность (испытуемое животное, ЛД50, способ введения) | Продуценты |
|---|---|---|
| Цитреовиридин | мыши, 7,5 мг/кг, внутрибрюшинно мыши, 20 мг/кг, перорально | Penicillium citreonigrum Penicillium ochrosalmoneum |
| Цитринин | мыши, 35 мг/кг, внутрибрюшинно мыши, 110 мг/кг, перорально | Penicillium citrinum Penicillium expansum Penicillium verrucosum |
| Циклопиазоновая кислота | крысы, 2,3 мг/кг, внутрибрюшинно крысы-самцы, 36 мг/кг, перорально крысы-самки, 63 мг/кг, перорально | Penicillium camemberti Penicillium commune Penicillium chrysogenum Penicillium griseofulvum Penicillium hirsutum Penicillium viridicatum |
| Охратоксин А | молодые крысы, 22 мг/кг, перорально | Penicillium verrucosum |
| Патулин | мыши, 5 мг/кг, внутрибрюшинно мыши, 35 мг/кг, перорально | Penicillium expansum Penicillium griseofulvum Penicillium roqueforti Penicillium vulpinum |
| Пенитрем A[en] | мыши, 1 мг/кг, внутрибрюшинно | Penicillium crustosum Penicillium glandicola |
| PR-токсин | мыши, 6 мг/кг, внутрибрюшинно крысы, 115 мг/кг, перорально | Penicillium roqueforti |
| Рокфортин C | мыши, 340 мг/кг, внутрибрюшинно | Penicillium chrysogenum Penicillium crustosum Penicillium roqueforti |
| Секалоновая кислота D[en] | мыши, 42 мг/кг, внутрибрюшинно | Penicillium oxalicum |
Наиболее известным и опасным токсином, продуцируемом видом рода, Питт назвал охратоксин А. Относится к категории 2B веществ, вероятно канцерогенных для человека, согласно классификации Международного агентства по изучению рака. Токсин действует на почки, возможно, связан с возникновением очагов балканской нефропатии[en]. Первоначально вещество было выделено из культуры Aspergillus ochraceus, затем было показано, что его часто продуцируют штаммы A. carbonarius и редко — A. niger. Впоследствии обнаружено, что это вещество синтезируют Penicillium verrucosum и близкий вид P. nordicum. P. verrucosum встречается на растениях ячменя и пшеницы в умеренных регионах мира — в Скандинавии, Центральной Европе, Западной Канаде. В 1986 году опубликовано исследование образцов ячменя из Дании с ферм, на которых свиньи страдали заболеванием почек. Из 70 образцов в 67 было обнаружено множество грибов P. verrucosum, из 66 образцов был выделен охратоксин А[19].
По-видимому, с зерном риса, поражённым Penicillium citreonigrum, связано широкое распространение острой формы бери-бери в Японии во второй половине XIX века. С 1910 года это заболевание стало встречаться во много раз реже, что совпало с введением жёсткой государственной инспекции рисового зерна, значительно снизившей продажу заплесневелого риса. Впоследствии поражённый P. citreonigrum рис в Юго-Восточной Азии обнаруживался редко[19].
PR-токсин и рокфортин C синтезируются штаммами Penicillium roqueforti, используемого в сыроделии. Показана связь рокфортина C с гибелью собак в Канаде. Сильно ядовитый PR-токсин быстро разлагается при хранении сыра, а токсин с достаточно большой летальной дозой 50 % рокфортин C обнаруживается и в готовых сырах. Об отравлениях человека PR-токсином или рокфортином C, связанных с употреблением в пищу сыра, не известно[19].
Использование в пищевой промышленности[править | править код]
Два вида рода часто используются в сыроделии. Для приготовления голубых сыров (рокфора, стилтона, горгондзолы, блё д'Овернь, кабралеса, данаблю и других) используется культура Penicillium roqueforti. Этот вид наиболее устойчив к продуктам молочнокислого брожения, однако способен развиваться только при небольшой концентрации поваренной соли. Грибок заселяется в отверстия в сыре, создаваемые с помощью металлических штырей, через 2—3 недели начинает интенсивно спороносить, предавая сыру сине-зелёную окраску (иногда сине-зелёный пигмент выделяется и мицелием гриба)[20].
При производстве белых сыров с плесенью (камамбер, бри, гамалуст) после первичной ферментации молочнокислыми бактериями внутри сыра начинается развитие дрожжевых грибов, а на поверхность сыра заселяется грибок P. camemberti[20].
Салями и другие сухие колбасы в ряде стран Европы (Италии, Румынии, Венгрии, Швейцарии, Испании, Франции) обычно подвергаются ферментации грибом Penicillium nalgiovense, реже — P. chrysogenum и описанным в 2015 году P. salamii[21]. Эти виды — одни из наиболее солеустойчивых плесневых грибов, их рост обычно препятствует появлению нежелательных плесневых грибков на ферментированных колбасах. P. nalgiovense выделяет протеолитические и липолитические ферменты, способствующие улучшению консистенции колбас, а образующийся при разложении белка аммиак дополняет аромат и снижает кислотность продукта[20].
Использование для производства ферментов[править | править код]
Целый ряд штаммов пенициллов используется в промышленности для синтеза ферментов. Так целлюлазы некоторых штаммов-мутантов оказываются сравнимыми по эффективности со штаммами наиболее активно используемого в промышленности вида Trichoderma reesei. Увеличенным производством целлюлаз характеризуются отдельные штаммы Penicillium brasilianum, P. brevicompactum, P. citrinum, P. chrysogenum, P. crustosum, P. echinulatum, P. expansum, P. glabrum, P. janthinellum, P. oxalicum, P. persicinum[22]. Ряд штаммов, выделяющих внекеточные хитиназы, (например, штамм вида P. ochrochloron) может использоваться для биологического контроля и производства грибных протопластов[23].
Использование в медицине[править | править код]
Структурная формула пенициллина GСреди видов рода известно множество продуцентов природных лекарственных препаратов, в том числе антибиотиков. Свойство зелёных плесеней подавлять бактериальный рост было впервые отмечено в 1868—1872 годах В. А. Манассеиным и А. Г. Полотебновым[2]. Первый известный науке бактерицидный антибиотик, активность которого была продемонстрирована Александром Флемингом в 1928 году, — пенициллин, продуцируется пенициллами, относящимися к секции Chrysogena. Технология очистки и промышленного производства пенициллина была разработана группой под руководством Х. Флори и Э. Чейна в 1941 году. В СССР пенициллин был выделен в 1942 году З. В. Ермольевой[2]. Вещества группы пенициллинов обладают активностью по отношению к грамотрицательным и многим грамположительным бактериям, ингибируя синтез клеточной стенки[24]. В 2011 году штамм, с которым работал Флеминг, в связи с пересмотром систематики этой группы пенициллов на основании полифазного подхода, был отнесён к виду Penicillium rubens, хотя ранее причислялся P. chrysogenum (P. notatum)[25].
Структурная формула гризеофульвинаГризеофульвин[en] был впервые выделен из мицелия штамма Penicillium griseofulvum А. Оксфордом, Х. Райстриком и П. Симонартом в 1938 году. Исследователи охарактеризовали этот метаболит пеницилла с химической точки зрения, описали несколько его производных. В 1946 году П. Брайен, П. Кёртис и Х. Хемминг описали нарушения роста гиф фитопатогена Botrytis allii под действием некоего «фактора искривления», вырабатываемого культурами Penicillium janczewskii. Годом позднее Дж. Гроув и Дж. Макгоуэн показали, что «фактор искривления» идентичен описанному ранее гризеофульвину. В 1958 году Дж. Джентлз в экспериментах с морскими свинками продемонстрировал эффективность гризеофульвина против грибов-дерматофитов. Гризеофульвин обладает неспецифичным фунгистатическим действием[20][26].
Структурная формула микофеноловой кислотыВ 1893—1896 годах итальянский врач Бартоломео Госио[en] выделил с заплесневелых зёрен кукурузы грибок Penicillium brevicompactum (назвав его P. glaucum) и продемонстрировал подавление развития Bacillus anthracis неизвестным метаболитом этого грибка. В 1913 году Олсберг и Блэк повторно получили это вещество из культуры штамма, определённого как P. stoloniferum, и назвали его микофеноловой кислотой[en]. Микофеноловая кислота — первое антибиотическое вещество грибкового происхождения, полученное в кристаллическом виде. Обладает антибактериальным, противогрибковым, противовирусным, противоопухолевым, противопсориазным, иммунодепрессантным действием, однако распространения в качестве антибиотика не получила, поскольку токсична. 2-Морфолиноэтиловый эфир микофеноловой кислоты (более легко усвояемое пролекарство, в организме гидролизующееся до микофеноловой кислоты) используется в качестве иммунодепрессанта при пересадке почек, сердца, печени. Это вещество также выделяется видом P. echinulatum[20][27].
Мевастатин[en] — первый известный науке статин. Получен в 1973 году в качестве метаболита Penicillium citrinum японским фармакологом Акиро Эндо. В 1976 году А. Браун выделил это же вещество из культуры P. brevicompactum, назвав его компактином. Эндо показал эффективность мевастатина в экспериментах с курицами, собаками и обезянами. Акира Ямамото из Осакского университета успешно применял небольшие дозы мевастатина для лечения пациентов с семейной гиперхолестеринемией, однако дальнейшего распространения препарат не нашёл: в 1980-х годах было показано, что при долговременном применении вещества у собак развивалась опухоль кишечника[28].
Исторические сведения, таксономия и систематика[править | править код]
Название и авторское понимание рода[править | править код]
Научное название рода Penicillium образовано от penicillus (в переводе с лат. — «кисть»), связано с кистевидными конидиеносцами, несущими фиалиды с конидиями. В русскоязычной литературе изредка встречаются переводные названия — кистеви́к[2], кистеви́дная пле́сень[29].
Род был выделен немецким естествоиспытателем Генрихом Фридрихом Линком (1767—1851) в 3-м томе «», вышедшем в Берлине 7 апреля 1809 года. Линк отнёс к роду три вида: Penicillium expansum, P. glaucum и P. candidum.
Линк описывал род следующим образом:
10. Penicillium
Вегетативное тело представлено скученными хлопьями, септированными, простыми или ветвящимися, образующими конечные прямостоячие кисточки. Споридии собраны на концах кисточек.
Оригинальный текст (лат.)
Thallus e floccis cæspitosis, septatis, simplicibus aut ramosis, fertilibus erectis apicis penicillatis. Sporidia en apicibus penicillatis collecta.
— Link H. F. Observationes in Ordines plantarum naturales // Magazin der Gesellschaft Naturforschender Freunde. — Berlin, 1809. — Vol. 3. — P. 16—17.
Впоследствии, в 1816 году, Линк описал ещё один вид с кисточковидными конидиеносцами — Penicillium roseum. Также он предположил, что отличия в окраске спороношения P. expansum и P. glaucum обусловлены только характеристиками среды произрастания и объединил их под первым названием[30]. Ещё позднее, в 1824 году, Линк относил к роду 4 вида: P. glaucum, P. candidum, P. roseum, а также P. sparsum Link, ранее, согласно автору, описанный под назвнием Aspergillus penicillatus Grev.[31]
Род в понимании Фриса и других микологов XIX века[править | править код]
Иллюстрация Mucor penicillatus Пьера БюльяраПервая иллюстрация, определённо изображающая представителя Penicillium, была создана Пьером Бюльяром и опубликована в 1809 году под названием Mucor penicillatus[32].
В первой трети XIX века были опубликованы важнейшие работы по микологии Э. Фриса, Х. Персона и Р. Гревилла. Эти авторы приняли новый род Линка, однако имели слабое представление о том, какие виды понимались под каждым названием их первооткрывателями[32].
Элиас Магнус Фрис в 1832 году в книге Systema mycologicum объединил с родом Penicillium другой род Линка, Coremium, в который Линк в 1824 году включал виды C. glaucum Link, C. candidum (Pers.) Nees и C. citrinum Pers. Фрис отнёс к Penicillium следующие виды: Penicillium fasciculatum Sommerf., P. sparsum Link, P. crustaceum (L.) Fr. (с синонимами P. glaucum Link и P. expansum Link), P. bicolor (Fr.) Fr. (с синонимом Coremium glaucum Link), P. candidum Link, P. roseum Link.
Фрис указал в качестве типа Penicillium Link название таксона Mucor crustaceus L., который автор рода Линк в его состав не включал. Это название основано на иллюстрации Пьера Антонио Микели, изображающей некий гриб, близкий к
История открытия пенициллина. Досье - Биографии и справки
ТАСС-ДОСЬЕ /Юлия Ковалева/. 75 лет назад, 12 февраля 1941 г., в Лондоне британские ученые Говард Флори и Эрнст Чейн впервые применили пенициллин для лечения человека. Редакция ТАСС-ДОСЬЕ подготовила материал об истории открытия этого препарата.
Пенициллин - антибиотик, обладающий широким антимикробным действием. Является первым эффективным лекарством против многих тяжелых заболеваний, в частности, сифилиса и гангрены, а также инфекций, вызываемых стафилококками и стрептококками. Его получают из некоторых видов плесневого грибка рода Penicillium (лат. penicillus - "кисть"; под микроскопом спороносные клетки плесени похожи на кисточку).
История открытия
Упоминания об использовании плесени в лечебных целях встречаются в трудах персидского ученого Авиценны (II в.) и швейцарского врача и философа Парацельса (XIV в.). Боливийский специалист по этноботанике Энрике Облитас Поблете в 1963 г. описал применение плесени индейскими знахарями в эпоху инков (XV-XVI вв.).
В 1896 г. итальянский врач Бартоломео Гозио, изучая причины поражения риса плесенью, вывел формулу антибиотика, схожего с пенициллином. Ввиду того, что он не смог предложить практическое применение нового лекарства, его открытие было забыто. В 1897 г. французский военный врач Эрнест Дюшен заметил, что арабские конюхи собирают плесень с сырых седел и лечат ею раны лошадей. Дюшен тщательно обследовал плесень, опробовал ее на морских свинках и выявил ее разрушающее действие на палочку брюшного тифа. Результаты своих исследований Эрнест Дюшен представил в парижском институте Пастера, но они также не были признаны. В 1913 г. американским ученым Карлу Альсбергу и Отису Фишеру Блэку удалось получить из плесени кислоту, обладающую противомикробными свойствами, однако их исследования были прерваны с началом Первой мировой войны.
В 1928 г. британский ученый Александр Флеминг проводил рядовой эксперимент в ходе исследования сопротивляемости человеческого организма бактериальным инфекциям. Он обнаружил, что некоторые колонии стафилококковых культур, оставленные им в лабораторных чашках, заражены штаммом плесени Penicillium Notatum. Вокруг пятен плесени Флеминг заметил область, в которой бактерий не было. Это позволило ему сделать вывод о том, что плесень вырабатывает убивающее бактерии вещество, которое ученый назвал "пенициллином".
Флеминг недооценил свое открытие, полагая, что получить лекарство будет очень трудно. Его работу продолжили ученые из Оксфорда Говард Флори и Эрнст Чейн. В 1940 г. они выделили препарат в чистом виде и изучили его терапевтические свойства. 12 февраля 1941 г. инъекция пенициллина впервые была сделана человеку. Пациентом Флори и Чейна стал лондонский полицейский, умиравший от заражения крови. После нескольких инъекций ему стало лучше, однако запас лекарства быстро закончился, и больной скончался. В 1943 г. Говард Флори передал технологию получения нового препарата американским ученым, в США было налажено массовое производство антибиотика. В 1945 г. Александр Флеминг, Говард Флори и Эрнст Чейн были удостоены Нобелевской премии по физиологии и медицине.
Исследования российских и советских ученых
В 1870-х гг. исследованием плесени занимались медики Алексей Полотебнов и Вячеслав Манассеин, которые обнаружили, что она блокирует рост других микроорганизмов. Полотебнов рекомендовал использовать эти особенности плесени в медицине, в частности, для лечения кожных заболеваний. Но идея не получила распространения.
В СССР первые образцы пенициллина получили микробиологи Зинаида Ермольева и Тамара Балезина. В 1942 г. они обнаружили штамм Penicillium Crustosum, продуцирующий пенициллин. В ходе испытаний лекарство показало гораздо большую активность, чем его английские и американские аналоги. Однако полученный антибиотик терял свойства при хранении и вызывал повышение температуры у пациентов.
В 1945 г. в Советском Союзе начались испытания пенициллина, разработанного по западному образцу. Технология его производства была освоена НИИ эпидемиологии и гигиены Красной Армии под руководством Николая Копылова.
Признание
Массовое производство пенициллина было налажено во время Второй мировой войны. По некоторым оценкам, благодаря этому антибиотику в годы войны и после нее были спасены около 200 млн человек. Открытие этого препарата не раз признавалось одним из важнейших научных достижений в истории человечества. Большинство современных антибиотиков были созданы именно после исследования лечебных свойств пенициллина.
Антибиотики - пенициллины
«Когда я проснулся на рассвете 28 сентября 1928 года, я, конечно, не планировал революцию в медицине своим открытием первого в мире антибиотика или бактерии-убийцы», затем Флеминг сказал: «Но я полагаю, что именно это я и сделал»
Так описывал свое открытие пенициллина Александр Флеминг, британский бактериолог, который впервые выделил пенициллин из плесневых грибов Penicillium notatum — исторически первый антибиотик в мире.
История пенициллина
Беспорядок в лаборатории Флеминга на этот раз сослужил ему хорошую службу. Одним холодным осенним утром он обнаружил, что в одной из чашек Петри с бактериями Staphylococcus aureus выросла колония плесневых грибов. Колонии бактерий вокруг плесневых грибов стали прозрачными из-за их разрушения. Тем самым - Флемингу удалось выделить активное вещество, разрушающее бактериальные клетки — пенициллин
Изначально Флеминг недооценил своё открытие, считая, что получить лекарство будет очень трудно. Однако вскоре этой идеей озаботились другие ученые и вскоре его работу продолжили Говард Флори и Эрнст Борис Чейн, разработавшие методы очистки пенициллина.
Массовое производство пенициллина было налажено во время Второй мировой войны.
В 1945 году все трое исследователей: Флеминг, Флори и Чейн были удостоены Нобелевской премии в области физиологии и медицины.
После того, как возможности данного соединения были оценены по достоинству, пенициллин стал неотъемлемой частью любой методики лечения бактериальных инфекций. К середине 20 века открытое Флемингом вещество активно использовалось в производстве лекарств, стал осуществляться его искусственный синтез, что помогло справляться с большинством неизлечимых на тот момент заболеваний, таких как сифилис, гангрена и туберкулёз.
В 1999 году журнал «Тайм» назвал Флеминга одним из ста самых важных людей XX века за его открытие пенициллина и сообщил:
«Это открытие изменит ход истории. Вещество, которое Флеминг назвал пенициллином, является очень активным противоинфекционным средством.»
Пенициллины как класс антибиотиков
Биосинтетические пенициллины продуцируются плесневыми грибами Penicillium. По химической структуре они являются одноосновными кислотами, содержащими b-лактамное и тиазолидиновое кольца.

Биосинтетические пенициллины весьма активны и являются препаратами выбора при инфекциях, вызванных пенициллиночувствительными микроорганизмами, но спектр их действия ограничен. К ним чувствительны грамположительные кокки, палочки дифтерии и сибирской язвы, возбудители некоторых анаэробных инфекций (газовая гангрена и столбняк), грамотрицательные кокки (гоно- и менингококки), спирохеты и актиномицеты. Они действуют как на внеклеточно, так и на внутриклеточно расположенные микроорганизмы.
Большинство биосинтетических пенициллинов разрушается в кислой среде желудка и потому вводится инъекционно: внутримышечно, внутривенно, внутриартериально и в полости. При тяжелых воспалительных процессах (остеомиелит, перитонит и т.д.) можно вводить бензилпенициллин через катетеризованный лимфатический сосуд, при менингите - в спинномозговой канал. Местно их применять не рекомендуется из-за высоких аллергизирующих свойств и возможности развития устойчивых форм микроорганизмов.
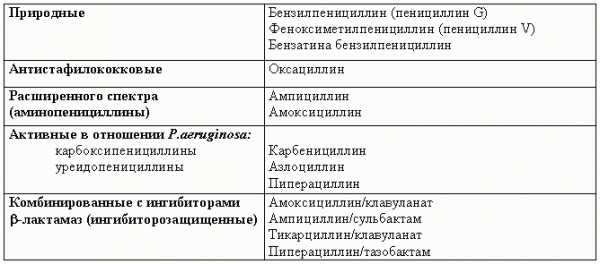
Классификация Пенициллинов
Натриевая и калиевая соль бензилпенициллина при внутримышечном введении быстро всасывается, создавая максимальную концентрацию в крови через 10-15 мин. В крови 40- 60% препарата связывается с альбуминами.
Пенициллины хорошо проникают в ткани (кроме костной), но не проходят гематоэнцефалический барьер. Длительность действия 3-4 ч, в связи с чем их следует вводить 6-8 раз в сутки. На уровень препарата в крови влияет функциональное состояние печени, где они на 30-40% инактивируются, и почек, поскольку они в основном выводятся с мочой (и желчью). Небольшое количество пенициллинов экскретируется слюнными, молочными и потовыми железами.
Для лечения инфекций, требующих длительной антибиотикотерапии (ревматизм, сифилис и др.), используют плохо растворимую соль бензилпенициллина, медленно всасывающуюся с места введения и позволяющую поддерживать терапевтическую концентрацию в крови в течение нескольких дней - бензатин бензилпенициллин (бициллин).
Так, бициллин-1 вводится 1 раз в неделю, а бициллин-5 - 1 раз в месяц.
Феноксиметилпенициллин кислоустойчив. может применяться внутрь, сохраняет в крови терапевтическую концентрацию в течение 4-6 ч, на 80% связывается с белками плазмы крови, выводится с мочой и фекалиями.
Назначают пенициллины при заболеваниях, вызванных чувствительными к ним возбудителями: при гнойных инспекциях, пневмонии, ревматизме, менингите, гонорее, спирохетозах, актиномикозе, сибирской язве. дифтерии, газовой гангрене и т.д.
Развитие устойчивости микроорганизмов к биосинтетическим пенициллинам обусловлено в первую очередь тем, что микробы начинают вырабатывать b-лактамазу (пенициллиназу), которая разрушает b-лактамное кольцо.
За последние годы получены 3 новых генерации полусинтетических пенициллинов на основе g-аминопенициллановой кислоты (структурное ядро природных пенициллинов), отличающиеся по спектру противомикробного действия, устойчивости к b-лактамазам и особенностям фармакокинетики.
- Оксациллин, клоксациллин,диклоксациллин (2-е поколение), имеющие спектр действия, аналогичный бензилпенициллину, резистентны к пенициллиназе, и их применяют для воздействия на грамположительную флору, устойчивую к природным пенициллинам.
- Ампициллин, амоксициллин и карбенициллин (3-е поколение) разрушаются пенициллиназой и неактивны в отношении пенициллинорезистентных форм микроорганизмов, но имеют более широкий спектр действия, чем природные пенициллины: к ним чувствительна не только грамположительная, но и грамотрицательная флора (энтерококки, кишечная и гемофильная палочки, некоторые штаммы шигелл, сальмонелл, бактероидов). Используются они при смешанных инфекциях.
- К карбенициллину чувствительны также многие штаммы протея и синегнойной палочки. Оксациллин, диклоксациллин, ампициллин и амоксициллин кислотоустойчивы, всасываются из желудочно-кишечного тракта, в крови связываются с белками плазмы, выводятся с мочой и желчью.
- Эти препараты можно использовать не только инъекционно, но и внутрь. Карбенициллин плохо всасывается из желудочно-кишечного тракта, вводится инъекционно. При сочетании натриевых солей ампициллина и оксациллина получили препарат ампиокс, имеющий широкий спектр действия за счет ампициллина и влияющий на пенициллинорезистентные формы грамположительных микроорганизмов за счетоксациллина. Устойчивость микроорганизмов развивается к нему медленно.
- 4-е поколение пенициллинов - уреидопенициллины (мезлоциллин, азлоциллин) слабее действуют на грамположительную, но очень мощно на грамотрицательную флору, неустойчивы к b-лактамазам.
- Эти препараты не всасываются из желудочно-кишечного тракта, вводятся парентерально, выделяются в основном почками и желчью. Уреидопенициллины используют при заболеваниях дыхательных и мочевыводящих путей, желудочно-кишечного тракта, мягких тканей и костей, вызванных грамотрицательными микроорганизмами, псевдомонадами.
Побочное действие и токсичность пенициллинов
Пенициллины относятся к малотоксичным препаратам. Наиболее частыми осложнениями являются аллергические реакции: сыпь, крапивница, ангионевротический отек, бронхоспазм, анафилактический шок. Для уменьшения аллергизации пациентам не рекомендуется местное применение пенициллинов в составе зубных порошков, жевательных резинок, эликсиров, паст и т.д.
Местнораздражающее действие препаратов может стать причиной появления инфильтратов при внутримышечном и судорог при спинномозговом введении.
Назначение внутрь может вызвать явления стоматита, глоссита, хейлита, "черного" или "волосатого" языка. При использовании пенициллинов в больших дозах возможно возникновение реакции обострения (из-за массовой гибели микроорганизмов и освобождения эндотоксина). При длительном применении больших доз пенициллинов необходимо следить за картиной крови и функцией почек.
Комбинированные препараты пенициллинов
Для воздействия на антибиотикорезистентные формы микробов создаются комплексные препараты пенициллинов с ингибиторами b- лактамаз (клавулановой кислотой и сульбактамом), имеющими в своем составе b-лактамное кольцо. Связывая b- лактамазу, они восстанавливают чувствительность микроорганизмов к пенициллинам.
На этой основе были получены амоксиклав и аугментин (сочетание амоксициллина и клавулановой кислоты) и (сультамициллин (уназин - сочетание ампициллина и сульбактама).
Пенициллин Википедия
Бензи́лпеницилли́н (пенициллин G (PCN G) или просто пенициллин (PCN)) — N-фенилацетамид 6-аминопенициллановой кислоты. Антибиотик, получаемый из плесневого гриба пеницилла (грибов рода лат. Penicillium: лат. Penicillium chrysogenum, лат. Penicillium notatum и других). В процессе жизнедеятельности эти грибы синтезируют различные формы пенициллина: один из наиболее активных в фармакологическом плане бензилпенициллин и другие виды пенициллина, которые отличаются от первого тем, что вместо бензильной группы содержат иные радикалы. Таким образом по молекулярной структуре пенициллин это кислота, из которой получают различные соли (натриевую, калиевую, новокаиновую и другие)[1]. Семейство пенициллиновых антибиотиков включает бензилпенициллин (пенициллин G), феноксиметилпенициллин (пенициллин V) и другие[2][3].
Пенициллиновые антибиотики имеют важное историческое значение, так как они являются первыми эффективными лекарствами против многих тяжёлых заболеваний и, в частности, сифилиса, а также инфекций, вызываемых стафилококками и стрептококками. Пенициллины хорошо изучены, однако в настоящее время многие бактерии приобрели устойчивость к β-лактамным антибиотикам. Хотя, например, бледная трепонема достаточную устойчивость к пеницилинам не приобрела.
Как и другие β-лактамы, пенициллины не только препятствуют размножению клеток бактерий, в том числе и цианобактерий, но также препятствуют делению хлоропластов мхов. Но не оказывают влияния на деление пластид высших сосудистых растений[4], поскольку последние не имеют мишени для пенициллина — пептидогликановой клеточной стенки.
Исторические сведения
Многие древние культуры, в том числе древние египтяне и греки, использовали плесень и некоторые растения для лечения инфекций, так как те содержали антибиотики. Например, в Древнем Египте, Китае и Индии плесневелый хлеб использовали для дезинфекции, прикладывая его к ранам и гнойникам. Упоминания об использовании плесени в лечебных целях встречаются в трудах древних учёных и философов. В 1963 году специалист по этноботанике Энрике Облитас Поблете дал описание применению плесени индейскими знахарями в XV—XVI веках.С чем мы можем не согласиться, так как в Ветхом завете рекомендовалось, стены на которых появилась плесень, разобрать, если плесень появилась повторно советовали уйти с этого места, так как оно не чисто. Согласно этому источнику евреи были рабами у древних египтян. Поэтому выше указанная информация является не менее чем вымыслом. Это так же касается и древних греков, так как не один мало мальски дошедший до нас источник, не говорит и не подтверждает данный факт.
Пенициллин — первый антибиотик — был получен на основе продуктов жизнедеятельности микроорганизмов.
В начале 1870-х годов исследованием плесени одновременно занимались медики Алексей Герасимович Полотебнов и Вячеслав Авксентьевич Манассеин, который изучив грибок Penicillium glaucum, подробно описал основные, в частности бактериостатические, свойства зелёной плесени[5]. Полотебнов, выяснив лечебное действие плесени на гнойные раны и язвы,[6] рекомендовал использовать плесень для лечения кожных заболеваний. Его работа «Патологическое значение зелёной плесени» вышла в 1873 году. Но идея на тот момент не получила дальнейшего практического применения.
В 1896 году итальянский врач и микробиолог Бартомелео Гозио выделил из Penicillium микофеноловую кислоту, которая была активна против возбудителя сибирской язвы. Пенициллин был обнаружен в 1897 году французским военным врачом Эрнестом Дюшеном. Он заметил, что арабские конюхи использовали плесень с сёдел, чтобы обработать раны на спинах лошадей. Работая с грибами рода Penicillium, Дюшен опробовал плесень на морских свинках и обнаружил её разрушающее действие на палочку брюшного тифа. Но его работа не привлекла внимания научного сообщества.
В 1904 году русский учёный М. Г. Тартаковский сообщил, что вещество, выделяемое зелёной плесенью, подавляет развитие возбудителя куриной холеры.
В 1913 году американские учёные Карл Альсберг и Отис Фишер Блек получили из Penicillium puberulum токсичную субстанцию, обладающую противомикробными свойствами (в 1936 году, когда установили её химическую структуру, выяснилось, что это была пеницилловая кислота)[7].
Пенициллин был выделен в 1928 году Александром Флемингом из штамма гриба вида Penicillium notatum на основе случайного открытия: попадание в культуру бактерий спор плесневого гриба из внешней среды оказало на бактериальную культуру бактерицидное действие[8][9].
Несмотря на то, что статья Флемминга о пенициллине вышла ещё в 1929 году, первое время она была воспринята без энтузиазма из-за отсутствия способов его химического выделения и производства. В 1942 году, почти половина всего американского запаса пенициллина[10] — одна столовая ложка[11] — была использована для лечения всего лишь одного пациента, Анны Миллер. Имевшегося в США запаса в июне 1942 было достаточно для лечения десяти пациентов[12].
В 1940—1941 годах австралийский бактериолог Хоуард У. Флори и биохимики Эрнст Чейн и Норман Хитли работали над выделением пенициллина и разрабатывали технологию его промышленного производства сначала в Англии и, затем, в США. Они же впервые применили пенициллин для лечения бактериальных инфекций в 1941 году. В 1945 году Флемингу, Флори и Чейну была присуждена Нобелевская премия по физиологии и медицине «за открытие пенициллина и его целебного воздействия при различных инфекционных болезнях».
В СССР первые образцы пенициллина получили в 1942 году микробиологи З. В. Ермольева и Т. И. Балезина. Зинаида Виссарионовна Ермольева активно участвовала в организации промышленного производства пенициллина. Созданный ею препарат пенициллин-крустозин ВИЭМ был получен из штамма гриба вида Penicillium crustosum.
Пенициллины длительное время были основными антибиотиками, широко применявшимися в клинической практике во всех технологически развитых странах[13]. Затем, по мере развития фармакологии, были выделены и синтезированы антибиотики других групп (тетрациклины, аминогликозиды, макролиды, цефалоспорины, фторхинолоны, грамицидины и другие). Однако несмотря на большое разнообразие групп антибиотиков на современном фармацевтическом рынке и развитие резистентности к пенициллинам у многих бактерий-патогенов, пенициллины по-прежнему занимают достойное место в терапии инфекционных заболеваний, ибо основным показанием к назначению того или иного антибиотика в настоящее время является чувствительность к его действию патогенной микрофлоры (определяемая в лабораторных условиях), а также минимальное количество побочных эффектов от применения антибиотика[1].
Фармакологическое действие
Бензилпенициллин — антибиотик группы биосинтетических пенициллинов. Оказывает бактерицидное действие за счёт ферментативного ингибирования синтеза клеточной стенки микроорганизмов.
Активен в отношении:
К действию бензилпенициллина устойчивы штаммы Staphylococcus spp., продуцирующие пенициллиназу. Разрушается в кислой среде.
Новокаиновая соль бензилпенициллина по сравнению с калиевой и натриевой солями характеризуется большей продолжительностью действия благодаря низкой растворимости и образованию депо в месте инъекции.
Фармакокинетика
После внутримышечного введения быстро всасывается из места инъекции в кровоток и широко распределяется в биологических жидкостях и тканях организма, однако в спинномозговую жидкость проникает в незначительных количествах. Бензилпенициллин хорошо проникает через плацентарный барьер. Хотя в обычных условиях после применения бензилпенициллина в спинномозговой жидкости он обнаруживается в незначительном количестве, тем не менее при воспалении мозговых оболочек на фоне усиления проницаемости гематоэнцефалического барьера концентрация антибиотика в ликворе повышается. T½ — 30 мин. Выводится с мочой. После внутримышечного введения максимальная концентрация в крови наблюдается через 30—60 минут, а через 3—4 часа после однократно проведённой внутримышечной или подкожной инъекции в крови обнаруживаются лишь следовые концентрации антибиотика. Концентрация и продолжительность циркуляции бензилпенициллина в крови зависит от величины вводимой дозы. Тем не менее, для поддержания достаточно высокой концентрации, необходимой для реализации терапевтического воздействия необходимо повторять инъекции бензилпенициллина каждые 3—4 часа. Следует учитывать, что при приёме внутрь антибиотик плохо всасывается, частично разрушается желудочным соком и бета-лактамазой, продуцируемой микрофлорой кишечника, а при внутривенном введении концентрация бензилпенициллина быстро снижается[1].
Показания
Лечение заболеваний, вызванных чувствительными к бензилпенициллину микроорганизмами: крупозная и очаговая пневмонии, эмпиема плевры, сепсис, септицемия, пиемия, острый и подострый септический эндокардит, менингиты, острый и хронический остеомиелиты, инфекции мочевыводящих и жёлчных путей, ангины, гнойные инфекции кожи, мягких тканей и слизистых оболочек, рожа, дифтерия, скарлатина, сибирская язва, актиномикоз, лечение гнойно-воспалительных заболеваний в акушерско-гинекологической практике, ЛОР-заболеваний, глазных болезней, гонорея, бленнорея, сифилис.
Побочное действие
Со стороны пищеварительной системы: диарея, тошнота, рвота.
Эффекты, обусловленные химиотерапевтическим действием: кандидоз влагалища, кандидоз полости рта.
Со стороны ЦНС: при применении бензилпенициллина в больших дозах, особенно при эндолюмбальном введении, возможно развитие нейротоксических реакций: тошнота, рвота, повышение рефлекторной возбудимости, симптомы менингизма, судороги, кома.
Аллергические реакции: повышение температуры тела, крапивница, кожная сыпь, сыпь на слизистых оболочках, боли в суставах, эозинофилия, ангионевротический отёк. Описаны случаи анафилактического шока с летальным исходом. В таком случае полагается немедленное внутривенное введение адреналина.
Противопоказания
Повышенная чувствительность к бензилпенициллину и другим препаратам из группы пенициллинов и цефалоспоринов. Эндолюмбальное введение противопоказано пациентам, страдающим эпилепсией.
Беременность и лактация
Применение при беременности возможно только в том случае, когда ожидаемая польза превышает риск развития побочных действий. При необходимости применения в период грудного вскармливания следует решить вопрос о прекращении грудного вскармливания (молоко пациентки сцеживается, чтобы лактация не прекратилась). Причина всего этого в том, что пенициллин хорошо проникает через молочные железы в молоко матери, и через плаценту к плоду, что способно вызвать негативные последствия для последнего — у детей пенициллин способен вызывать тяжёлые аллергические реакции даже при первом применении[14].
Особые указания
С осторожностью применяют у пациентов с нарушениями функции почек, при сердечной недостаточности, предрасположенности к аллергическим реакциям (особенно при лекарственной аллергии), при повышенной чувствительности к цефалоспоринам (из-за возможности развития перекрёстной аллергии). Если через 3-5 дней после начала применения эффекта не отмечается, следует перейти к применению других антибиотиков или комбинированной терапии. В связи с возможностью развития грибковой суперинфекции целесообразно при лечении бензилпенициллином назначать противогрибковые препараты. Необходимо учитывать, что применение бензилпенициллина в субтерапевтических дозах или досрочное прекращение лечения часто приводит к появлению резистентных штаммов возбудителей. Бензилпенициллин в форме порошка для инъекций включён в Перечень ЖНВЛС.
В случае инфекционных заболеваний, вызванных микроорганизмами не чувствительными к бензилпенициллину (в том числе при заболевании вирусами гриппа, не осложнённом бактериальной инфекцией) клиническое применение бензилпенициллина нерационально, а в связи с возможностью развития побочных эффектов от проводимого лечения антибиотиком — не вполне безопасно[1].
Синонимы бензилпенициллина
Angicilline, Capicillin, Cilipen, Conspen, Cosmopen, Cracillin, Crystacillin, Crystapen, Deltapen, Dropcillin, Falapen, Lanacillin, Novopen, Panavlon, Pentallin, Pharmacillin, Pradupen, Rentopen, Rhinocillin, Solupen, Solvocillin, Supracillina, Veticillin и другие[1].
Лекарственное взаимодействие
Пробенецид снижает канальцевую секрецию бензилпенициллина, в результате повышается концентрация последнего в плазме крови, увеличивается период полувыведения. При одновременном применении с антибиотиками, оказывающими бактериостатическое действие (тетрациклин), уменьшается бактерицидное действие бензилпенициллина.
Получение
Биосинтез
 Биосинтез пенициллина. На первой стадии происходит конденсация трёх аминокислот, на второй — окисление трипептида и образование двуциклического интермедиата — пенициллина N, на третьей — трансаминирование и образование пенициллина G
Биосинтез пенициллина. На первой стадии происходит конденсация трёх аминокислот, на второй — окисление трипептида и образование двуциклического интермедиата — пенициллина N, на третьей — трансаминирование и образование пенициллина G Биосинтез пенициллина осуществляется в три стадии:
- На первой стадии происходит конденсация трёх аминокислот: L-α-аминоадиповой кислоты, L-цистеина, L-валина в трипептид.[15][16][17] Перед конденсацией в трипептид аминокислота L-валин превращается D-валин.[18][19] Указанный трипептид называется δ-(L-α-аминоадипил)-L-цистеин-D-валином (англ. ACV). Реакции конденсации и эпимеризации катализируются ферментами δ-(L-α-аминоадипил)-L-цистеин-L-валинсинтетазой (англ. ACVS) и синтетазой нерибосомных пептидов (англ. NRPS).
- Вторая стадия биосинтеза пенициллина — это окисление линейной молекулы ACV в двуциклический интермедиат изопенициллин N ферментом изопенициилин N синтетазой (англ. IPNS), продуктом гена pcbC.[15][16] Изопенициллин N — очень слабый интермедиат, так как он не обладает противомикробной активностью.[18]
- На заключительной стадии происходит трансаминирование ферментом изопенициллин N N-ацилтрансферазой, при этом α-аминоадипиловая боковая цепь изопенициллина N удаляется и заменяется на фенилуксусную кислоту. Фермент, катализирующий эту реакцию является продуктом гена penDE.[15]
Полный синтез
Химик Джон Шиэн (англ. Sheehan) в Массачусетском технологическом институте (англ. MIT) в 1957 году осуществил полный химический синтез пенициллина.[20][21][22] Шиэн приступил к изучению синтеза пенициллинов в 1948 году и в ходе исследований разработал новые методы синтеза пептидов, а также новые защитные группы.[22][23] Хотя метод синтеза, разработанный Шиэном не был пригоден для массового производства пенициллинов, один из интермедиатов в синтезе (6-аминопенициллановая кислота, англ. 6-APA) является ядром молекулы пенициллина.[22][24] Присоединение разных групп к ядру 6-APA позволило получить новые формы пенициллинов.
Производные
Выделение ядра молекулы пенициллина 6-APA, позволило получить новые полусинтетические антибиотики, обладающие лучшими свойствами, чем бензилпенициллин (биодоступность, спектр антимикробного действия, стабильность).
Первым важным полученным производным был ампициллин, который обладал более широким спектром антибактериальной активности, чем исходные препараты антибиотиков. Дальнейшие исследования позволили получить устойчивые к β-лактамазе антибиотики, в том числе, флуклоксациллин, диклоксациллин и метициллин. Эти антибиотики были эффективны против бактерий, синтезирующих бета-лактамазу, однако, неэффективны против устойчивого к метициллину золотистого стафиллококка (англ. MRSA), возникшего немного позднее.
Пенициллин в культуре и искусстве
Примечания
- ↑ 1 2 3 4 5 М. Д. Машковский. Лекарственные средства. В двух частях. — 12-е изд., перераб. и доп. — М.: Медицина, 1993. — Т. II. — С. 245—251. — 688 с ил. с. — (Пособие для врачей). — 75 000 экз. — ISBN 5-225-02735-0.
- ↑ Garrod, L. P. Relative Antibacterial Activity of Three Penicillins (англ.) // British Medical Journal : journal. — 1960. — Vol. 1, no. 5172. — P. 527—529. — doi:10.1136/bmj.1.5172.527.
- ↑ Garrod, L. P. The Relative Antibacterial Activity of Four Penicillins (англ.) // British Medical Journal : journal. — 1960. — Vol. 2, no. 5214. — P. 1695—1696. — doi:10.1136/bmj.2.5214.1695. — PMID 13703756.
- ↑ Kasten, Britta; Reski, Ralf. β-lactam antibiotics inhibit chloroplast division in a moss (Physcomitrella patens) but not in tomato (Lycopersicon esculentum) (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 1997. — 30 March (vol. 150, no. 1—2). — P. 137—140. — doi:10.1016/S0176-1617(97)80193-9.
- ↑ МАНАССЕИН Вячеслав Авксентьевич (неопр.).
- ↑ ПОЛОТЕБНОВ Алексей Герасимович (неопр.).
- ↑ Медицинский музей и медицинская коммуникация. Сборник материалов V Всероссийской научно-практической конференции «Медицинские музеи России: состояние и перспективы развития». — Москва, 5—6 апреля 2018.
- ↑ Alexander Fleming – Time 100 People of the Century (неопр.). Time. — «It was a discovery that would change the course of history. The active ingredient in that mold, which Fleming named penicillin, turned out to be an infection-fighting agent of enormous potency. When it was finally recognized for what it is—the most efficacious life-saving drug in the world—penicillin would alter forever the treatment of bacterial infections.». Архивировано 16 апреля 2011 года.
- ↑ Haven, Kendall F. Marvels of Science : 50 Fascinating 5-Minute Reads (англ.). — Littleton, CO: Libraries Unlimited, 1994. — P. 182. — ISBN 1-56308-159-8.
- ↑ Мадхаван Г. Думай как инженер. — М.: Манн, Иванов и Фербер, 2016. См. главу 4.
- ↑ https://time.com/4250235/penicillin-1942-history/
- ↑ https://www.lib.niu.edu/2001/iht810139.html
- ↑ James, PharmD, Christopher W.; Cheryle Gurk-Turner, RPh. Cross-reactivity of beta-lactam antibiotics (англ.) // Baylor University Medical Center Proceedings. — Dallas, Texas: Baylor University Medical Center, 2001. — January (vol. 14, no. 1). — P. 106—107. — PMID 16369597.
- ↑ Описание пенициллина и его воздействия на человека
- ↑ 1 2 3 Al-Abdallah, Q., Brakhage, A. A., Gehrke, A., Plattner, H., Sprote, P., Tuncher, A. Regulation of Penicillin Biosynthesis in Filamentous Fungi // Molecular Biotechnolgy of Fungal beta-Lactam Antibiotics and Related Peptide Synthetases (англ.) / Brakhage A. A.. — 2004. — P. 45—90. — ISBN 3-540-22032-1. — doi:10.1007/b99257.
- ↑ 1 2 Brakhage, A. A. Molecular Regulation of β-Lactam Biosynthesis in Filamentous Fungi (англ.) // Microbiology and Molecular Biology Reviews (англ.)русск. : journal. — American Society for Microbiology (англ.)русск., 1998. — Vol. 62, no. 3. — P. 547—585. — PMID 9729600.
- ↑ Baldwin, J. E., Byford, M. F., Clifton, I., Hajdu, J., Hensgens, C., Roach, P., Schofield, C. J. Proteins of the Penicillin Biosynthesis Pathway (неопр.) // Curr Opin Struct Biol.. — 1997. — № 7. — С. 857—864.
- ↑ 1 2 Fernandez, F. J., Fierro, F., Gutierrez, S., Kosalkova, K . Marcos, A. T., Martin, J. F., Velasco, J. Expression of Genes and Processing of Enzymes for the Biosynthesis of Penicillins and Cephalosporms (англ.) // Anton Van Lee : journal. — 1994. — September (vol. 65, no. 3). — P. 227—243. — doi:10.1007/BF00871951. — PMID 7847890.
- ↑ Baker, W. L., Lonergan, G. T. «Chemistry of Some Fluorescamine-Amine Derivatives with Relevance to the Biosynthesis of Benzylpenicillin by Fermentation». J Chem Technol Biot. 2002, 77, pp1283-1288.
- ↑ Sheehan, John C.; Henery-Logan, Kenneth R. The Total Synthesis of Penicillin V (англ.) // Journal of the American Chemical Society (англ.)русск. : journal. — 1957. — 5 March (vol. 79, no. 5). — P. 1262—1263. — doi:10.1021/ja01562a063.
- ↑ Sheehan, John C.; Henery-Logan, Kenneth R. The Total Synthesis of Penicillin V (англ.) // Journal of the American Chemical Society (англ.)русск. : journal. — 1959. — 20 June (vol. 81, no. 12). — P. 3089—3094. — doi:10.1021/ja01521a044.
- ↑ 1 2 3 E. J. Corey; John D. Roberts. Biographical Memoirs: John Clark Sheehan (неопр.). The National Academy Press. Дата обращения 28 января 2013. Архивировано 28 апреля 2013 года.
- ↑ Nicolaou, K.C.; Vourloumis, Dionisios; Winssinger, Nicolas; Baran, Phil S. The Art and Science of Total Synthesis at the Dawn of the Twenty-First Century** (англ.) // Angewandte Chemie International Edition : journal. — 2000. — Vol. 39, no. 1. — P. 44—122. — doi:10.1002/(SICI)1521-3773(20000103)39:1<44::AID-ANIE44>3.0.CO;2-L. — PMID 10649349.
- ↑ Professor John C. Sheehan Dies at 76 (1 апреля 1992). Дата обращения 28 января 2013.
Ссылки
Спасительная плесень: история создания пенициллина | Здоровая жизнь | Здоровье
«Когда я проснулся на рассвете 28 сентября 1928 года, я, конечно, не планировал революцию в медицине своим открытием первого в мире антибиотика или бактерии-убийцы», — эту запись в дневнике сделал Александр Флеминг, человек, который изобрёл пенициллин.
Идея использовать микробов в борьбе с микробами появилась ещё в XIX веке. Учёным уже тогда было ясно, что чтобы бороться с раневыми осложнениями, надо научиться парализовать микробов, вызывающих эти осложнения, и что убить микроорганизмы можно с их же помощью. В частности, Луи Пастер открыл, что бациллы сибирской язвы погибают под действием некоторых других микробов. В 1897 году Эрнест Дучесне использовал плесень, то есть свойства пенициллина, для лечения тифа у морских свинок.
Фактически датой изобретения первого антибиотика является 3 сентября 1928 года. К этому времени Флеминг уже был известен и имел репутацию блестящего исследователя, он занимался изучением стафилококков, но его лаборатория часто была неопрятной, что и стало причиной открытия.
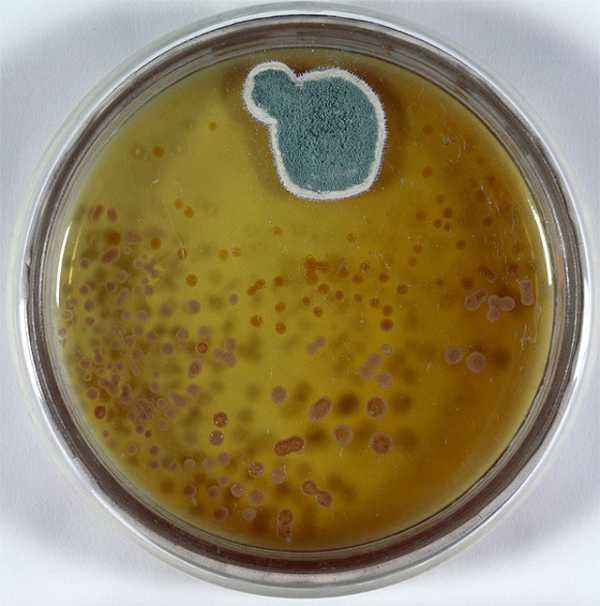 Пенициллин. Фото: www.globallookpress.com
Пенициллин. Фото: www.globallookpress.com3 сентября 1928 года Флеминг вернулся в свою лабораторию после месяца отсутствия. Собрав все культуры стафилококков, учёный заметил, что на одной пластине с культурами появились плесневые грибы, а присутствовавшие там колонии стафилококков были уничтожены, в то время как другие колонии — нет. Флеминг отнёс грибы, выросшие на пластине с его культурами, к роду пеницилловых, и назвал выделенное вещество пенициллином.
В ходе дальнейших исследований Флеминг заметил, что пенициллин воздействует на такие бактерии, как стафилококки и многие другие возбудители, которые вызывают скарлатину, пневмонию, менингит и дифтерию. Однако выделенное им средство не помогало от брюшного тифа и паратифа.
Доклад о своём открытии Флеминг опубликовал в 1929 году в Британском журнале экспериментальной патологии.
Продолжая свои исследования, Флеминг обнаружил, что работать с пенициллом трудно, производство происходит медленно, кроме этого, пенициллин не может существовать в теле человека достаточно долго, чтобы убивать бактерии. Также учёный не мог извлечь и очистить активное вещество.
До 1942 года Флеминг совершенствовал новый препарат, но до 1939 года вывести эффективную культуру так и не удалось. В 1940 году немецко-английский биохимик Эрнст Борис Чейн и Хоуард Уолтер Флори, английский патолог и бактериолог, активно занимались попыткой очистить и выделить пенициллин, и спустя некоторое время им удалось произвести достаточно пенициллина для лечения раненых.
В 1941-м лекарство удалось накопить в достаточных масштабах для эффективной дозы. Первым человеком, которого удалось спасти с помощью нового антибиотика, был 15-летний подросток с заражением крови.
В 1945 году Флемингу, Флори и Чейну была присуждена Нобелевская премия по физиологии и медицине «за открытие пенициллина и его целебного воздействия при различных инфекционных болезнях».
 Фото: www.globallookpress.com
Фото: www.globallookpress.comЗначение пенициллина в медицине
В разгар Второй мировой войны в США производство пенициллина уже было поставлено на конвейер, что спасло от гангрены и ампутации конечностей десятки тысяч американских и союзнических солдат. Со временем метод производства антибиотика был усовершенствован, и с 1952 года сравнительно дешёвый пенициллин стал применяться практически в мировых масштабах.
При помощи пенициллина можно вылечить остеомиелит и пневмонию, сифилис и родильную горячку, предотвратить развитие инфекций после ранений и ожогов — раньше все эти заболевания были смертельными. В ходе развития фармакологии были выделены и синтезированы антибактериальные препараты других групп, и когда были получены другие виды антибиотиков, перестал быть приговором и туберкулёз.
Лекарственная устойчивость
На несколько десятилетий антибиотики стали почти панацеей от всех болезней, но ещё сам первооткрыватель Александр Флеминг предупреждал, что не стоит использовать пенициллин, пока заболевание не будет диагностировано, и нельзя использовать антибиотик в течение короткого времени и в совсем малых количествах, так как при этих условиях у бактерий развивается устойчивость.
Когда в 1967 году был выявлен пневмококк, не чувствительный к пенициллину, а в 1948 году были обнаружены устойчивые к антибиотику штаммы золотистого стафилококка, учёным стало понятно, что бактерии приспосабливаются к лекарствам.
«Открытие антибиотиков было величайшим благом для человечества, спасением миллионов людей. Человек создавал всё новые и новые антибиотики против разных возбудителей инфекций. Но микромир сопротивляется, мутирует, микробы приспосабливаются. Возникает парадокс — люди разрабатывают новые антибиотики, а микромир вырабатывает своё сопротивление», — рассказала старший научный сотрудник Государственного научно-исследовательского центра профилактической медицины, кандидат медицинских наук, эксперт «Лиги здоровья нации» Галина Холмогорова.
По мнению многих экспертов, в том, что антибиотики теряют свою эффективность в борьбе с заболеваниями, во многом виноваты и сами пациенты, не всегда принимающие антибиотики строго по показаниям или в необходимых дозах.
«Проблема резистентности исключительно велика и затрагивает всех. Она вызывает большую тревогу учёных, мы можем вернуться в доантибиотиковую эру, потому что все микробы станут резистентны, ни один антибиотик не будет действовать на них. Наши неумелые действия привели к тому, что мы можем оказаться без очень мощных лекарств. Лечить такие страшные болезни, как туберкулёз, ВИЧ, СПИД, малярия, будет просто нечем», — пояснила Галина Холмогорова.
Именно поэтому к лечению антибиотиками нужно относиться очень ответственно и соблюдать ряд простых правил, в частности:
– никогда не принимать антибиотики без рекомендации врача;
– не прерывать курс лечения, даже если вам стало лучше;
– помнить, что антибиотики не помогают при вирусных инфекциях.
Читайте в соцсетях!
Что такое пенициллин и кто его открыл?
В начале прошлого столетия многие болезни были неизлечимы или с трудом подвергались лечению. Люди умирали от банальной инфекции, сепсиса и пневмонии.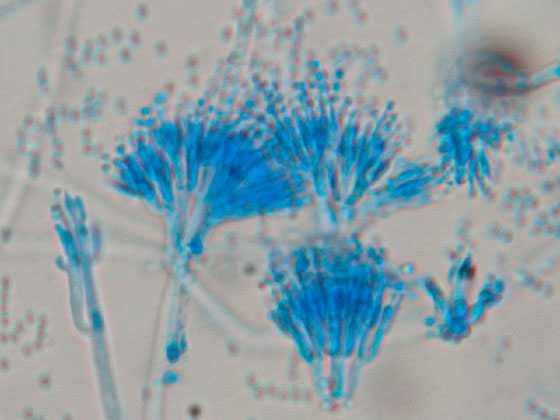 Wikimedia Commons / Carlos de Paz (CC BY-SA 2.0)
Wikimedia Commons / Carlos de Paz (CC BY-SA 2.0)
Настоящий переворот в медицине произошел в 1928 году, когда был открыт пенициллин. За всю человеческую историю еще не было такого лекарственного средства, которое спасло бы так много жизней, как этот антибиотик.
За десятки лет он излечил миллионы людей и до сегодняшнего дня остается одним из самых эффективных лекарственных препаратов. Что же такое пенициллин? И кому человечество обязано его появлением?
Что такое пенициллин?
Пенициллин входит в группу биосинтетических антибиотиков и оказывает бактерицидное действие. В отличие от многих других антисептических лекарственных средств он безопасен для человека, поскольку клетки грибков, входящих в его состав, кардинальным образом отличаются от наружных оболочек человеческих клеток.
Действие препарата базируется на угнетении жизнедеятельности болезнетворных бактерий. Он блокирует вырабатываемое ими вещество пептидогликан, благодаря чему препятствует образованию новых клеток и разрушает уже существующие.
Для чего нужен пенициллин?
Пенициллин способен уничтожать грамположительные и грамотрицательные бактерии, анаэробные палочки, гоноккоки и актиномицеты.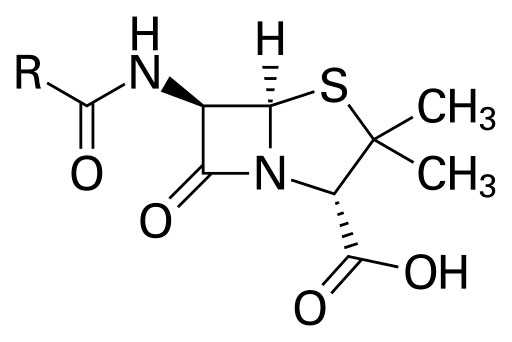
С момента своего открытия он стал первым действующим препаратом против воспаления легких, инфекций кожи и желчных путей, сибирской язвы, ЛОР-заболеваний, сифилиса и гонореи.
В наше время многие бактерии сумели адаптироваться к нему, мутировали и образовали новые виды, однако до сих пор антибиотик успешно используется в хирургии для лечения острых гнойных болезней и остается последней надеждой для больных менингитом и фурункулезом.
Из чего состоит пенициллин?
Главная составляющая пенициллина – плесневый грибок пеницилл, который образуется на продуктах и приводит к их порче. Обычно его можно увидеть в виде плесни голубого или зеленоватого цвета. Исцеляющее действие грибка было известно давно. Еще в XIX столетии арабские коневоды снимали плесень с отсыревших седел и смазывали ею раны на спинах лошадей.
В 1897 году французский врач Эрнест Дюшен первым испытал действие плесени на морских свинках и сумел вылечить их от тифа. Результаты своего открытия ученый представил в Институте Пастера в Париже, но его исследование не получило одобрения медицинских светил.
Кто открыл пенициллин?
Первооткрывателем пенициллина стал британский бактериолог Александр Флеминг, сумевший совершенно случайно выделить препарат из штамма грибков.
Долгое время после открытия другие ученые старались улучшить качество лекарства, но лишь спустя 10 лет бактериолог Говард Флори и химик Эрнст Чейн смогли изготовить действительно чистую форму антибиотика. В 1945 году за свои достижения Флеминг, Флори и Чейн получили Нобелевскую премию.
История открытия пенициллина
История открытия препарата достаточно интересна, поскольку появление антибиотика было счастливой случайностью. В те годы Флеминг жил в Шотландии и занимался исследованием в области бактериальной медицины. Он был довольно неряшлив, поэтому не всегда убирал за собой пробирки после анализов. Однажды ученый надолго отлучился из дома, оставив грязными чашки Петри с колониями стафилококка.
Вернувшись, Флеминг обнаружил, что на них вовсю расцвела плесень, а в некоторых местах были области без бактерий. На основании этого ученый пришел к выводу, что плесень способна вырабатывать вещества, убивающие стафилококки. Wikimedia Commons / Steve Jurvetson (CC BY 2.0)
Wikimedia Commons / Steve Jurvetson (CC BY 2.0)
Бактериолог выделил из грибков пенициллин, но недооценил свое открытие, посчитав изготовление лекарства слишком сложным. Работу за него закончили Флори и Чейн, которым удалось придумать методы очистки препарата и запустить его в массовое производство.
Флеминг, Александр — Википедия
В Википедии есть статьи о других людях с фамилией Флеминг.Сэр Александр Флеминг (англ. Alexander Fleming; род. 6 августа 1881 года, Дарвел, Айршир, Шотландия, Великобритания — 11 марта 1955 года, Лондон, Англия, Великобритания) — британский микробиолог. Открыл лизоцим и впервые выделил пенициллин из плесневых грибов Penicillium notatum — исторически первый антибиотик.
Оба открытия произошли в 1920-е годы и в большей степени случайно. Учёный посеял слизь из собственного носа на чашку Петри, в которой находились бактерии, и через несколько дней обнаружил, что в местах, куда была нанесена слизь, бактерии были уничтожены. Первая статья о лизоциме вышла в 1922 году.
В 1945 году Флеминг, Флори и Чейн были удостоены Нобелевской премии в области физиологии и медицины. В сентябре 1945 накануне приезда во французскую столицу Александра Флеминга парижские газеты писали:
«Для разгрома фашизма и освобождения Франции он сделал больше целых дивизий»
Беспорядок в лаборатории Флеминга ещё раз сослужил ему службу. В 1928 году он обнаружил, что на агаре в одной из чашек Петри с бактериями Staphylococcus aureus выросла колония плесневых грибов. Колонии бактерий вокруг плесневых грибов стали прозрачными из-за разрушения клеток. Флемингу удалось выделить активное вещество, разрушающее бактериальные клетки, — пенициллин, работа была опубликована. Его работу продолжили Говард Флори и Эрнст Борис Чейн[2], разработавшие методы очистки пенициллина. Массовое производство пенициллина было налажено во время Второй мировой войны.
В 1999 году журнал «Тайм» назвал Флеминга одним из ста самых важных людей XX века за его открытие пенициллина и сообщил:
Это открытие изменит ход истории. Вещество, которое Флеминг назвал пенициллином, является очень активным противоинфекционным средством.
После того, как возможности данного соединения были оценены по достоинству, пенициллин стал неотъемлемой частью любой методики лечения бактериальных инфекций. К середине века открытое Флемингом вещество широко вошло в производство фармацевтических препаратов, стал осуществляться его искусственный синтез, что помогло справляться с большинством древнейших заболеваний, таких как сифилис, гангрена и туберкулёз.
Флеминг родился 6 августа 1881 года в ферме Лохфильд, недалеко от Дарвела, расположенном в области Эршир в Шотландии. Он был третьим из четырёх детей от второй жены (к четырём детям от первого брака) фермера Хуга Флеминга (1816—1888), Грэйс Стирлинг Мортон (1848—1928), дочери соседнего фермера. Второй раз отец женился в 59 лет, а умер, когда Александру (известному как Алек) было всего 7 лет.
До двенадцати лет Флеминг учился в сельской школе в Дарвеле, а затем ещё два года в академии Килмарнок[en]. В четырнадцать лет он переехал к своим братьям в Лондон, где начал работать клерком в офисе доставки, а также посещать занятия в Королевском Политехническом институте[3] на Риджент-стрит.
Его старший брат Томас уже работал врачом-офтальмологом и, последовав его примеру, Александр также решил изучать медицину. На его выбор медицинской школы в значительной степени повлияло то, что он участвовал в матче по водному поло со студентами из госпиталя Святой Марии. В медицинской школе Флеминг выиграл стипендию в 1901 году. Также стипендии Лондонского университета MB и BS в 1906 году достались ему[4].
В то время у него не было сильного пристрастия к какой-либо конкретной области медицинской практики. Работы по хирургии показали, что он мог бы быть выдающимся хирургом. Но жизнь направила его по другому пути, связанному с «лабораторной медициной». Будучи студентом, он попал под влияние профессора патологии Алмрота Райта, который приехал в госпиталь Святой Марии в 1902 году. Райт, ещё будучи на военно-медицинской службе, разработал вакцинацию против брюшного тифа. Но у Райта были ещё и другие идеи лечения пациентов, уже страдающих от бактериальных инфекций, стимулированием их организма на немедленный ответ инфекциям выработкой «антител». Он пытался измерять количество этих антител в крови пациента. Это требовало новых методов и значительного труда. Группа молодых людей, которые присоединились к Райту, в том числе Джон Фриман, Бернард Спилсбери и Джон Уэллс, были уже не в состоянии справиться с этой работой. Поэтому и Флеминг был приглашён присоединиться к команде, как только он получил учёную степень в 1906 году.
Попав таким образом в исследовательскую лабораторию, прикреплённую к больнице, Флеминг проработал там до самой смерти пятьюдесятью годами спустя.
Во время Первой мировой войны Флеминг служил капитаном в Королевской медицинской армии. Он и многие его коллеги работали в госпиталях на поле боя на западном фронте во Франции. В 1918 году Флеминг вернулся в госпиталь Святой Марии, где он был избран профессором бактериологии в 1928 году.
За период своих исследований Флеминг внёс значительный вклад в развитие медицины, поскольку, как и его начальник Райт, он постоянно пытался изучить что-то новое. Райт предложил множество необычных способов микроизмерения с помощью капиллярных трубок, стекла, резиновых сосок и калибровки по ртути. Флеминг быстро заметил, что они могут помочь в диагностике по выявлению сифилиса, которая была разработана Вассерманом и некоторыми другими учёными в Германии. Его методики позволили провести тест с 0,5 мл крови пациента, взятых из пальца, вместо 5 мл, которые ранее нужно было брать из вены.
Очень скоро Райт был заинтересован открытием Эрлиха целебных свойств диоксидиаминоарсенобензина дигидрохлорида, известного больше как «Сальварсан» или «препарат № 606». Инъекция препарата должна была осуществляться в вену, а в то время с этим были связаны некоторые трудности. Флемингу удалось справиться с этой проблемой, и в одном из первых докладов, опубликованных на английском языке, он рассказал о технике и результатах, полученных в результате работы с 46 пациентами.
Во время Первой мировой войны стало очевидно, что бактериальная инфекция в глубоких ранах от взрывчатых веществ погубит очень много жизней и лишит огромное количество людей их конечностей. К Райту обратились с просьбой создать лабораторию по изучению этих инфекций во Франции, и он взял с собой капитана Флеминга. Эта лаборатория оказалась первой исследовательской медицинской лабораторией военного времени, она была создана в здании казино в Булони.
В начале 1915 года Флеминг сообщил об обнаружении в ранах большого количества видов микробов, некоторые из которых были ещё совсем неизвестны большинству бактериологов того времени, также он указал, что в ранах преобладали стрептококки. Оказалось, что многие из раневых инфекций были вызваны микробами, присутствующими на фрагментах одежды и в грязи и попадавшими глубоко в организм при ранениях.
Наблюдения за ранами привели ещё к одному важному заключению о том, что применение антисептиков в течение нескольких часов после ранения не полностью уничтожает бактериальные инфекции, хотя многие хирурги считали именно так. Райта же это нисколько не удивило, но им с Флемингом пришлось провести много месяцев в напряжённой работе по исследованию данного вопроса, чтобы убедить хирургов в своей правоте.
Райту и Флемингу удалось показать, что, во-первых, антисептики не достигали всех микробов, потому что очень часто последние проникали глубоко в ткани костей, хрящей, мышц и т. д., и, во-вторых, антибактериальная активность используемого раствора очень быстро уменьшалась при взаимодействии с белковыми и клеточными элементами лимфы, гноя, крови и окружающих рану тканей; раствор, таким образом, уничтожал лейкоциты пациентов, которые в естественных условиях эффективно защищают их организм.
Работа, на которой основаны эти два важнейших вывода, почти полностью принадлежала Райту, но Флеминг, который помогал в работе, внёс ценный вклад в решение технических проблем. Именно он провёл опыты с «искусственной раной», из которых стало очевидно, что антисептикам не удавалось достичь глубоких участков ран и приводить к гибели там микробов.
Другим простым устройством, которое Флемингу удалось применить (с должным признанием её автора, доктора Битти) при исследованиях антисептиков, являлось покрытие жидких культур организмов разжиженным вазелином. Рост культур приводил к образованию газов и поднятию вазелина в колонке, изменение объёма давало приблизительное представление о росте культур. С помощью этого метода можно было легко продемонстрировать, что активность многих антисептиков значительно уменьшалась в белковых жидкостях, таких как сыворотка крови. Также удивительным оказалось то, что при определённых концентрациях антисептиков (в том числе карболовой кислоты, йода, хлорноватистой кислоты, гипохлорита натрия и хлорамина-Т) бактериальный рост даже возрастал. Используя это же устройство, Флемингу также удалось продемонстрировать, что клостридия, возбуждающая заболевание гангрены, дала гораздо более обильную культуру при выращивании совместно с аэробными организмами из ран, такими как стафилококки и стрептококки.
Удалось выявить ещё один аспект «антисептической проблемы», когда Райт и Флеминг перенесли своё внимание на антибактериальное воздействие лейкоцитов в инфицированной ране. Они обнаружили, что, при благоприятных условиях, лейкоциты гноя и крови могли уничтожать очень большоe количество стафилококков и стрептококков, а под влиянием антисептиков этот эффект часто уменьшался. В сложившейся ситуации Флеминг предложил простой опыт: сперва он прикладывал стеклянную пластинку к ране, а затем сразу же на неё наносил питательную среду Агар-агар. Он провёл несколько таких опытов на ране с разной степенью промывки антисептиком и заметил, что рост бактерий был обильнее в более поздних культурах. Видимо антисептики губили много лейкоцитов, которые так необходимы для предотвращения размножения микробов.
Убедительное опытное подтверждение заключений Флеминга было проведено им после войны с использованием техники «слайд ячейки». Методика позволила легко показать, что при попадании микробов в кровь лейкоциты оказывают очень сильное бактерицидное действие, а при добавлении антисептиков эффект значительно снижается, или полностью ликвидируется.
Описание исследований Флеминга по раневым инфекциям было изложено в его Хантерийской лекции в Королевском колледже хирургов в 1919 году, и в его же сообщении «Сравнение деятельности антисептиков на бактерии и лейкоциты» в Королевском обществе в 1924 году.
Долгие размышления Флеминга и Райта на тему физиологических механизмов защиты ран при попадании инфекции привели их в 1922 году к открытию микроборастворяющего фермента, содержащегося в носовых выделениях, который он назвал «лизоцим». В некотором смысле это открытие было двойным: вещество было литическим агентом, и, как оказалось, многие микробы оказались чувствительны к его действию.
В Королевском обществе Флеминг рассказал, как он ежедневно выделял культуры из носовой секреции пациента (на самом деле его собственной) в ходе «простуды». Первые четыре дня почти ничего не появлялось, но в последний день возникло «большое количество мелких колоний, которые оказались грам-положительными кокками, которые распределялись нерегулярно, но с тенденцией к диплоккокной и тетрадной формации». С помощью Райта ему впоследствии удалось открыть микроба, который ранее не был известен, и назвал его Micrococcus Lysodeicticus (то есть растворимые).
До сих пор не совсем ясно, что заставило Флеминга исследовать носовую слизь и обнаружить вещество, которое оказывает мощное литическое действие на микробов. Вероятно, на некоторых участках пластины, где присутствовали частицы слизи, подавлялся или предотвращался рост микрококкуса. В любом случае, видимо, он подозревал это, и его подозрение подтвердилось, когда он приготовил суспензию из микробов из свежей культуры и добавил к ней каплю разбавленной носовой слизи. К его удивлению суспензия стала совершенно прозрачной уже через минуту или две.
Последующие эксперименты показали, что подобный эффект растворения микробов может быть продемонстрирован и с человеческими слезами, мокротой, слюной, с экстрактами многих тканей человеческого тела, а также с яичным белком и другими животными и растительными тканями.
Как ни странно, ни один другой микроб не растворялся настолько хорошо, как Micrococcus Lysodeicticus, хотя многие другие микробы, являющиеся возбудителями заболеваний человека, также подвергались воздействию, но только в меньшей степени. Был сделан очень важный вывод о том, что фермент лизоцим может быть получен из человеческих лейкоцитов. Бактерицидное действие лейкоцитов, полученных из человеческой крови, которое Райт и Флеминг демонстрировали во время войны, возможно, были связаны с действием этого фермента.
В целом открытие лизоцима, возможно, не было огромным интеллектуальным подвигом, но следует помнить, что сотни бактериологов во всем мире изучали носовые выделения в течение многих лет в надежде найти организмы, ответственные за «простуду», но ни одному из них не удалось открыть этот фермент. Флемингу также не удалось найти причину простуды, но открытие лизоцима, несомненно, стало важным этапом в развитии иммунологии.
«Когда я проснулся на рассвете 28 сентября 1928 года, я, конечно, не планировал революцию в медицине своим открытием первого в мире антибиотика или бактерии-убийцы», затем Флеминг сказал: «Но я полагаю, что именно это я и сделал»[5]
Попыткой очистить и выделить пенициллин занимались Чейн и Флори в Оксфорде в 1940 году. Экстракцией эфиром им удалось выделить достаточно чистый материал для предварительных испытаний его антибактериальной эффективности на лабораторных животных, заражённых соответственно вирулентными стафилококками, стрептококками и хлостридиумсептиками. (Позже оказалось, что состав, используемый в этих исследованиях содержал лишь около 1 % пенициллина.) Опыты были удивительно успешными, и учёные призвали Флори и его команду участвовать в разработке методов по извлечению. Раствор эфира был заменён на амилацетат с последующим подкислением. Таким способом были получены более стабильные образцы пенициллина и удалены излишние примеси[6][7].
Выводы Флеминга о нетоксичности пенициллина для лабораторных животных и человеческих лейкоцитов были подтверждены и расширены, и уже в 1941 году получены положительные результаты по лечению нескольких тяжёлых инфекций человека. Сразу же последовали и другие удовлетворительные результаты по лечению этим антибиотиком, таким образом пенициллину было суждено занять уникальное место среди эффективных средств против человеческих болезней. Остеомиелит и стафилококковая септицемия, родильная горячка и другие инвазивные стрептококковые инфекции, пневмония, инфекции ран и ожогов, газовой гангрены, сифилис и гонорея — лечение всех этих заболеваний было очень успешным. К 1944 году, благодаря огромным усилиям американских производителей и исследовательских групп, стало возможным лечить пенициллином каждого раненого на фронте. Когда война закончилась, поставки были достаточными, чтобы лечить население этой страны и Северной Америки. В послевоенные годы было обнаружено, что даже бактериальный эндокардит, который ранее считался смертельным заболеванием почти у 100 % пациентов, часто может быть излечен большими дозами.
Флеминг был скромен в своём участии в разработке пенициллина, описывая свою известность как «Миф Флеминга». Он был первым, кто обнаружил активные свойства вещества, что дало ему привилегию назвать его: пенициллин. Также он хранил, выращивал и распространял исходную плесень в течение двенадцати лет, и продолжал делать это до 1940 года, пытаясь получить помощь от любого химика, который мог иметь достаточно навыков, чтобы выделить из неё пенициллин. Сэр Генри Харрис сказал в 1998 году: «Без Флеминга не было бы Чейна; без Чейна не было бы Флори; без Флори не было бы Хитли; без Хитли не было бы пенициллина»[8].
Все эти открытия были сделаны благодаря усилиям Флеминга с одной стороны в 1928—1929 годы, Чейна и Флори с их коллегами с другой стороны в 1940—1943 годы. Было отмечено, что работа Флеминга с пенициллом стояли наравне с другими более ранними работами на континенте. В одной из них, Ваудремер из Института Пастера в Париже сообщил, что при длительном контакте с плесенью Aspergillus fumigatus происходила гибель инфекции туберкулёзной палочки и, на основании этого наблюдения, он пытался лечить более 200 пациентов, страдающих от туберкулёза. Но опыт оказался совершенно безрезультатным. Аналогичные опыты были проведены и с другими формами плесени и бактерий. Ясно, что антагонизм между различными микробиологическими родами и видами был «в воздухе» на протяжении нескольких лет, и Флеминг сам признал это в своей Нобелевской лекции в 1945 году.
Ясно также, что работа Флеминга принесла на свет новое вещество, которое оказалось не токсичным для тканей животных и для человеческих лейкоцитов. Все оставалось бы на том же этапе в течение целых десятилетий, если бы Флори не занялся своими исследованиями, а также если бы не было химических ноу-хау Чейна, и их совместного терпения и энтузиазма по преодолению многих трудностей, и, возможно, пенициллин ещё нельзя было бы использовать в качестве практического терапевтического агента.
Случайное открытие Флеминга и выделение пенициллина в сентябре 1928 года знаменовало начало современных антибиотиков. Флеминг также обнаружил, что бактерии обладали устойчивостью к антибиотикам, если действовали малым количеством пенициллина, либо если антибиотик употреблялся слишком короткое время. Алмрот Райт предсказал устойчивость к антибиотикам ещё до того, когда это было обнаружено экспериментально. Флеминг рассказал об использовании пенициллина в его многочисленных выступлениях по всему миру. Он предупредил, что не стоит использовать пенициллин, пока заболевание не будет диагностировано, а если антибиотик всё-таки необходим, то нельзя использовать пенициллин в течение короткого времени и в совсем малых количествах, поскольку при этих условиях у бактерий развивается устойчивость к антибиотикам.
Популярная история[9] о том, что отец Уинстона Черчилля оплачивал образование Флеминга после того, как отец Флеминга спас юного Уинстона от смерти, является легендой. Александр Флеминг в письме[10] своему другу и коллеге Андре Грация описал эту историю как «чудесные сказки». «Отец не спасал жизнь Уинстона Черчилля во время Второй мировой войны» — писал Флеминг. Когда Черчилль заболел в Карфагене в Тунисе в 1943 году, он был спасён лордом Мораном, который использовал сульфаниламиды, поскольку он не имел опыта работы с пенициллином. Хотя Дейли телеграф 21 декабря 1943 написали, что он был спасён пенициллином, на самом деле ему помог новый препарат группы сульфаниламидов — сульфапиридин, известный в то время под кодовым названием M & B 693, открытый и полученный фирмой Май и Бэйкер Лтд (Дагенхам, Эссекс) — дочерней компанией французской группы «Рон-Пуленк». В последующей радиотрансляции Черчилль упомянул новое лекарство: «Замечательный M & B»[11]. Вполне вероятно, что достоверная информация о сульфаниламидах не дошла до газет, и поскольку настоящий антибактериальный препарат сульфаниламида, пронтозил, был открыт немецкой лабораторией Байер, а Великобритания в то время находилась в состоянии войны с Германией, было решено, что лучше поднять боевой дух британских солдат историей лечения Черчилля пенициллином".
Первая жена Флеминга, Сара, умерла в 1949 году. Их единственный ребёнок, Роберт Флеминг, стал врачом. После смерти Сары Флеминг женился на гречанке Амалии Котсури-Вурекас, коллеге по госпиталю Святой Марии, 9 апреля 1953 года; она умерла в 1986 году.
Флеминг был весьма активным и деятельным масоном. Его масонская биография описывает следующие его должности и звания: член ряда английских масонских лож, в 1925 году Флеминг становится досточтимым мастером ложи «Св. Мария» № 2682, затем её секретарём, в 1935 году — досточтимый мастер ложи «Милосердие» № 3286, затем её казначей. В 1942 году Флеминг был избран первым великим диаконом Объединённой великой ложи Англии. Также, он был посвящён в 30° Древнего и принятого шотландского устава[12].
В 1955 году Флеминг умер в своём доме в Лондоне от сердечного приступа. Он был кремирован, и через неделю его прах был похоронен в соборе святого Павла.
Почётные звания и должности, наследие[править | править код]
Открытие Флемингом пенициллина изменило мир современной медицины, позволило создать ряд жизненно необходимых антибиотиков. Пенициллин спасал и до сих пор спасает миллионы людей во всем мире[13].
Лаборатория в госпитале Святой Марии в Лондоне, где Флеминг открыл пенициллин, теперь стала музеем Флеминга. Также в городе Ломита в Лос-Анджелесе, штат Калифорния создана школа, названная именем Александра Флеминга. Вестминстерский университет назвал одно из своих студенческих зданий, расположенных вблизи Олд-стрит в честь Флеминга, в его честь также названы здания Имперского колледжа. Они расположены в студенческом городке Саут-Кенсингтон, в них обучается большое количество студентов по разным медицинским специальностям.
- Флеминг, Флори и Чейн вместе получили Нобелевскую премию по физиологии и медицине в 1945 году. Согласно правилам Нобелевского комитета, приз может быть разделён между максимум тремя людьми. Нобелевская медаль Флеминга была приобретена Национальным музеем Шотландии в 1989 году и представлена в его экспозиции после масштабной реконструкции.[14]
- Флеминг был удостоен звания Хантерианского профессора Королевского колледжа хирургии в Англии.
- Флеминг и Флори были посвящены в рыцари в 1944 году.
- В 2000 году три крупных шведских журнала указали пенициллин как наиболее важное открытие тысячелетия. По оценкам некоторых изданий, с помощью этого открытия были спасены около 200 миллионов жизней.
- Статуя Александра Флеминга стоит рядом с главной ареной в Мадриде, Пласа-де-Торос-де-Лас-Вентас. Она была возведена по соглашению с благодарными матадорами, поскольку пенициллин значительно снизил число смертей.
- Флемингово Намести — площадь, названная именем Флеминга в районе Чешского технического университета в Праге.
- В 1970 году Международный астрономический союз присвоил имя Флеминга кратеру на обратной стороне Луны (совместно с Вильяминой Флеминг).
- В середине 2009 года Флеминг был изображён на новой серии банкнот, выпущенных Клайдсдейлским банком, его изображение размещено на новой купюре 5 фунтов стерлингов.
- ↑ https://royalsocietypublishing.org/doi/pdf/10.1098/rsbm.1956.0008
- ↑ Karl Grandin, ed. (1945). «Alexander Fleming Biography». Les Prix Nobel. The Nobel Foundation. Retrieved 2008-07-24.
- ↑ «Alexander Fleming Biography». Retrieved 2010-04-11.
- ↑ L. Colebrook. Alexander Fleming(1881—1955), Biogr. Mems Fell. R. Soc.1956 2, 117—127.
- ↑ Kendall F. Haven, Marvels of Science (Libraries Unlimited, 1994) p182
- ↑ L. Colebrook. Alexander Fleming, Biogr. Membs. Fell. R. Soc. 1956 2, 117—127.
- ↑ Obituary: Sir Edward Abraham — Arts & Entertainment — The Independent
- ↑ Henry Harris, Howard Florey and the development of penicillin, a lecture given on Sept. 29, 1998, at the Florey Centenary, 1898—1998, Sir William Dunn School of Pathology, Oxford University (sound recording)
- ↑ Philadelphia Enquirer, 17 July 1945: Brown, Penicillin Man, note 43 to Chapter 2
- ↑ 14 November 1945; British Library Additional Manuscripts 56115: Brown, Penicillin Man, note 44 to Chapter 2
- ↑ A History of May & Baker 1834—1984, Alden Press 1984.
- ↑ Морамарко М. Масонство в прошлом и настоящем БИОГРАФИИ МАСОНОВ — Электронная Библиотека истории масонства
- ↑ Michael, Roberts, Neil, Ingram (2001). Biology. Edition: 2, illustrated. Springer-Verlag.
- ↑ Our museums
- Моруа А. Жизнь Александра Флеминга / Пер. с фр. И.Эрбург. Послесл. И.Кассирского. — М. : Молодая гвардия, 1964. — 336 с. — (ЖЗЛ; Вып. 379). — 100000 экз.
- The Penicillin Man: the Story of Sir Alexander Fleming, Lutterworth Press, 1957, Rowland, John.
Мадам Пенициллин. Как советский учёный изобрела аналог первого антибиотика | ОБЩЕСТВО:Люди | ОБЩЕСТВО
Создателем пенициллина считается британский бактериолог Александр Флеминг, одним из первых обнаруживший лечебные свойства плесени и опубликовавший своё открытие в 1929 году. Однако об антибактериальном эффекте грибка плесени Penicillium знали ещё во времена Авиценны, в XI веке. А в 70-е годы XIX века свойства плесени широко использовали российские медики Алексей Полотебнов и Вячеслав Манассеин для лечения кожных заболеваний.
Тем не менее выделить из плесени лечебное вещество удалось только в 1929 году. Но и это всё ещё не был устойчивый пенициллин в чистом виде. А потому Нобелевскую премию в области физиологии и медицины в 1945-м Александр Флеминг разделил с Говардом Флори и Эрнстом Чейни. Учёные разработали методы очистки антибиотика и запустили производство пенициллина в США.
Между тем, как часто случается в истории, создательница советского пенициллина – выдающийся учёный-микробиолог Зинаида Ермольева, оказалась незаслуженно забытой. А ведь именно ей удалось не только создать качественный отечественный антибиотик, оказавшийся в 1,4 раза действеннее англо-американского, но и наладить его массовое производство в страшные для страны военные годы.
На что вдохновила музыка
Как вспоминала сама Зинаида Ермольева, на выбор профессии повлияла история смерти её любимого композитора - Петра Ильича Чайковского, который, как известно, умер от холеры. А потому борьба с этим страшным заболеванием стала делом всей её жизни. Окончив с золотой медалью Мариинскую женскую гимназию в Новочеркасске, юная Зинаида поступила на медицинский факультет Донского университета, по окончании которого в 1921-м осталась работать ассистентом на кафедре микробиологии.
При этом параллельно Ермольева заведовала отделением Северо-Кавказского бактериологического института.
Когда в 1922 году в Ростове-на-Дону вспыхнула эпидемия холеры, она, игнорируя возможность заражения, проводила исследования по изучению возбудителя этого смертельного заболевания. К тому же провела опаснейший эксперимент с самозаражением. В протоколе одного из них учёная писала: «Опыт, который едва не кончился трагически, доказал, что некоторые холероподобные вибрионы, находясь в кишечнике человека, могут превращаться в истинные холерные вибрионы, вызывающие заболевание».
Кстати, тогда вибрионы холеры были найдены в ростовском водопроводе. А исследования Зинаиды Виссарионовны Ермольевой послужили основой для разработки рекомендаций по хлорированию питьевой воды.
 В 1922 году Зинаида Ермольева провела опаснейший эксперимент с самозаражением холерным вибрионом. Фото: Википедия
В 1922 году Зинаида Ермольева провела опаснейший эксперимент с самозаражением холерным вибрионом. Фото: ВикипедияВ 1925 году Зинаида Виссарионовна переехала в Москву, чтобы организовать и возглавить отдел в Биохимическом институте Наркомздрава. Скромный багаж учёного состоял из единственного чемодана с пятьюстами культурами холерных и холероподобных вибрионов.
Как спасти Сталинград
«Ермольева работала по двум направлениям: занималась изучением возбудителя холеры и разработкой отечественного препарата пенициллина, - рассказывает аведующая кафедрой микробиологии и вирусологии №2 Ростовского медуниверситета, доктор медицинских наук, профессор Галина Харсеева. - В 1942-м фашистские оккупанты предприняли попытку заразить водоснабжение Сталинграда холерным вибрионом. Туда в срочном порядке направили десант, состоящий из эпидемиологов и микробиологов во главе с Зинаидой Виссарионовной Ермольевой. В склянках с собой они везли бактериофаги - вирусы, поражающие клетки возбудителя холеры. Эшелон Ермольевой попал под бомбёжку. Множество медикаментов было уничтожено».
Пришлось восстанавливать утраченные препараты. Сложнейшее микробиологическое производство наладили в подвале одного из зданий. Ежедневно холерный фаг вместе с хлебом принимали 50 тысяч человек. Ермольева лично учила девушек-санитарок делать прививки. По радио читали статьи по профилактике желудочно-кишечных заболеваний. Колодцы с водой тщательно хлорировали. Благодаря грамотно проведённым противоэпидемическим мероприятиям вспышку холеры в Сталинграде удалось предотвратить.
Оружие под названием «Крустозин»
«В годы Великой Отечественной войны основное количество смертей раненых бойцов приходилось на гнойно-асептические осложнения. Бороться с ними тогда не умели. Препараты зарубежного пенициллина союзники нам не продавали», - продолжает рассказ Галина Харсеева.
Возглавлявшей тогда Всесоюзный институт экспериментальной медицины Ермольевой правительство поручило создать отечественный аналог антибиотика. И она это сделала. Так, в 1942 году появился первый советский антибактериальный препарат под названием «Крустозин», а уже в 1943-м его запустили в массовое производство.
«Использование этого лекарства в армии резко снизило смертность и заболеваемость, связанную с гнойной инфекцией. Практически до 80% раненых стали возвращаться в строй. Изобретённый Ермольевой препарат в конце 40-х годов исследовали зарубежные учёные и пришли к выводу, что по своей эффективности он превосходит заокеанский пенициллин. Тогда Зинаида Ермольева и получила почётное имя - Мадам Пенициллин», - добавила Галина Харсеева.
 Изобретённый Ермольевой препарат в конце 40-х годов исследовали зарубежные учёные и пришли к выводу, что по своей эффективности он превосходит заокеанский пенициллин. Фото: Из личного архива Зинаиды Ермольевой
Изобретённый Ермольевой препарат в конце 40-х годов исследовали зарубежные учёные и пришли к выводу, что по своей эффективности он превосходит заокеанский пенициллин. Фото: Из личного архива Зинаиды ЕрмольевойГде взять плесень?
Существует легенда: в 1942 году к Зинаиде Виссарионовне обратился молодой генерал из близкого окружения Сталина. У него серьёзно болела маленькая дочка - у ребёнка очень долго держалась высокая температура. Врачи были бессильны, а генерал случайно узнал о новом препарате.
Ермольева ответила, что дать ему «Крустозин» она не может, так как лекарство не прошло клинических испытаний. Но генерал настаивал. И Ермольева пошла на риск. Девочка очнулась и даже узнала отца. Требовалось продолжить лечение. Но лекарства было очень мало.
Как вспоминала о тех днях сотрудница лаборатории Тамара Балезина, плесень для выработки препарата собирали везде, где только могли - на траве, в земле, на стенах бомбоубежища. В итоге ребёнка удалось спасти. В благодарность генерал предложил Ермольевой новую квартиру. Но учёная отказалась и попросила лишь об одном - спасти из тюрьмы бывшего, но всё ещё горячо любимого репрессированного мужа - вирусолога Льва Зильбера.
Согласно другой версии, с прошением помиловать экс-супруга Ермольева обращалась к Сталину.
- Но ведь он женат на другой и к вам не вернётся, - удивился тот.
- Лев Зильбер нужен науке, - ответила Зинаида Виссарионовна.
В марте 1944 года, накануне 50-летия, Льва Зильбера освободили, по-видимому, благодаря письму о невиновности учёного, направленному на имя Сталина, которое подписал ряд известных в стране людей. Позже ему вручили Сталинскую премию.
Зинаида Ермольева родилась в 1898 г. в Волгоградской области. Окончила с золотой медалью Мариинскую женскую гимназию в Новочеркасске и медицинский факультет Донского университета. Занималась изучением холеры, открыла светящийся холероподобный вибрион, носящий её имя. В 1942 г. впервые в СССР получила пенициллин. С 1952 года и до конца жизни Зинаида Ермольева возглавляла кафедру микробиологии и лабораторию новых антибиотиков ЦИУВ (Российская медицинская академия последипломного образования). Автор более 500 научных работ и шести монографий. Стала прототипом героини романа Вениамина Каверина «Открытая книга». Умерла в 1974 г.