Анализ крови холинэстераза что это такое
Холинэстераза — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 марта 2018; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 марта 2018; проверки требуют 2 правки. Трёхмерная модель молекулы ацетилхолинэстеразы
Холинэстеразы — группа ферментов из класса гидролаз карбоновых кислот, субстратами которых являются сложные эфиры холина с уксусной, пропионовой или масляной кислотами. Одной из важных качественных реакций на фермент является — ингибирование алкалоидом эзерином в концентрации 10 −5 — 10−8М.
- Название первой подгруппы гидролаз — ацетилхолин-ацетилгидролаза (шифр фермента 3.1.1.7)[1]
Чаще используют тривиальные названия — ацетилхолинэстераза, ацетилхолингидролаза или холинэстераза I. Этот подтип ферментов гидролизует ацетилхолин.
- Название второй подгруппы гидролаз — ацетилхолин-ацилгидролаза (шифр фермента 3.1.1.8), а тривиальное название холинэстераза, с синонимами псевдохолинэстераза, бутирилхолинэстераза, холинэстераза II, пропионилхолинэстераза. Гидролизует бутирилхолин, пропионилхолин и др.
- Ацетилхолинэстераза (КФ 3.1.1.7) играет ключевую роль в процессах нейрогуморальной и синаптической передачи: в холинэргических синапсах катализирует гидролиз ацетилхолина, и, как следствие, прекращает влияние данного медиатора на холинорецептор, отвечающий за возбуждение нервного волокна. При ингибировании АХЭ освобождение рецепторов от ацетилхолина происходит очень медленно (только посредством диффузии), и передача нервных импульсов заблокирована на уровне (нейротрансмиттер <-> постсинаптическая мембрана). Это вызывает дезорганизацию процессов организма, а при тяжёлых отравлениях (в частности фосфорорганическими боевыми отравляющими веществами) может привести к летальному исходу.
- Сывороточная холинэстераза(КФ 3.1.1.8.) выполняет в организме защитные функции. В частности, она предохраняет от инактивации ацетилхолинэстеразу, поскольку с большой скоростью гидролизует ингибитор данного фермента — бутирилхолин [2]. Установлено, что введение в кровь животным сывороточной холинэстеразы лошади или рекомбинантной холинэстеразы человека на 100 % защищает их от смертельных доз зарина, зомана и Vx-газов, а также карбаматов. Холинэстераза является главным ферментом, который метаболизирует кокаин и его производные с образованием нетоксичных продуктов распада, поэтому её используют при передозировке этого психоактивного вещества.
Взаимодействие холинэстеразы с ингибиторами и реактиваторами[править | править код]
Ингибитор — это вещество, которое снижает активность ферментов (каталитические яды). Ингибиторами холинэстеразы являются некоторые природные и синтетические соединения: фосфорорганические соединения (ФОС), эфиры N-алкилкарбаминовых кислот (карбаматы), четвертичные аммониевые основания, гетероциклические соединения, содержащие третичный или четвертичный атом азота. Некоторые характеристики данных веществ представлены в табл. 1. ФОС и карбаматы иногда называют «полусубстратами» или «плохими субстратами» [2].
- ФОС гидролизуются в активном центре фермента, остаток фосфорила взаимодействует с ОН-группой серина активного центра с образованием «фосфорил-фермента». Следующая стадия катализа — гидролиз «фосфорил-фермента» водой и образование свободного фермента — идет очень медленно, так что активность фермента не восстанавливается. Процесс является необратимым. Активность «фосфорил-фермента» можно восстановить при помощи реактиваторов (например дипироксима) который вытесняет остаток фосфорила из связи холинэстеразы, и молекула фермента освобождается для взаимодействия с субстратом. Фосфорорганические соединения оказывают мощное отравляющее действие на организм. Причиной отравления является накопление негидролизованного ацетилхолина, которое приводит сначала к ускорению проведения нервных импульсов(возбуждение) и далее к блокированию передачи нервных импульсов(паралич). ФОС используют в качестве боевых отравляющих веществ(БОВ), инсектицидов и лекарственных средств[3].
- Карбаматы так же, как и ФОС, гидролизуются в активном центре фермента, отщепленный остаток карбаминовой кислоты взаимодействует с ОН-группой серина с образованием «карбамоил-фермента». Следующая стадия катализа — его гидролиз водой и образование свободного фермента — идет быстрее, чем гидролиз «фосфорил-фермента», но медленнее, чем природных «ацил-ферментов». Активность холинэстеразы блокируется карбаматами на несколько часов и затем восстанавливается. Это обратимый тип ингибирования. Карбаматы широко используются в качестве лекарственных средств для лечения нейродегенеративных заболеваний, при параличах и других болезнях [4]. Описано также масштабное применение физостигмина — обратимого ингибитора холинэстеразы — в качестве профилактического средства от возможного отравления БОВ. В 1991 г. в период войны в Аденском заливе физостигмин был введен 400 тыс. американских солдат с целью скоротечного блокирования (и, следовательно, защиты от инактивации) ацетилхолинэстеразы и холинэстеразы, так как ожидалась атака армии Ирака с использованием нервных газов[5].
Таблица 1. Ингибиторы холинэстеразы и их действие
| Класс соединений | Тип связи с холинэстеразой | Ингибирование | Препараты |
|---|---|---|---|
| Фосфорорганические соединения | Ковалентная в активном центре | Необратимое | хлорофос, тиофос, армин, зарин, табун |
| Карбаматы | Ковалентная связь в активном центре | Обратимое | физостигмин, карбарил (севин), неостигмин(прозерин), аминокарб |
| Четвертичные аммониевые и гетероциклические соединения | Комплекс с анионным центром фермента | Конкурентное | алкалоиды, галантамин, такрин, донепезил, эдрофония хлорид |
Роль активности холинэстеразы в анестезиологии[править | править код]
Необходимость изучения вариантов холинэстеразы возник в середине 1960-х годов. В это время в хирургии стали использовать миорелаксант сукцинилхолин для кратковременной остановки дыхания у пациентов на 3—10 мин. Расчёт проводился на человека с нормальной активностью сывороточной холинэстеразы, но возникли осложнения — если активность холинэстеразы у пациента снижена или отсутствует, то количество миорелаксанта, воздействующее на нервно-мышечное соединение, значительно возрастает и длительность апноэ может составить несколько часов (отмечен случай 9 часового апноэ), что может угрожать жизни больного[5]. При проведении хирургических операций чувствительными к сукцинилхолину оказываются от 4 до 7 % больных. В Дании в 1972 году был создан Исследовательский центр холинэстеразы, в котором к 2000 году обследовались 2300 пациентов из 62 семей.
Изменение активности холинэстеразы при различных заболеваниях[править | править код]
Активность холинэстеразы снижается при:
Во многих случаях снижение активности холинэстеразы в сыворотке обусловлена снижением синтезирующей функции печени.
Активность холинэстеразы увеличивается при:
- ↑ Д. Г. Кнорре. «Биологическая химия: Учеб. для хим., биол. и мед. спец. вузов». — 3-е. — М.: «Высшая школа», 2000. — С. 457. — ISBN 5-06-003720-7.
- ↑ 1 2 А. П. Бресткин, А. П. Кузнецова. «Холинэстеразы наземных животных и гидробионтов». — Владивосток: «Высшая школа», 1997. — С. 15.
- ↑ Краткая химическая энциклопедия. — 1. — М.:Советская энциклопедия, 1961. — Т. 1. — С. 282.
- ↑ Машковский М.Д. Лекарственные средства. — М.:Новая волна, 2002. — С. 201.
- ↑ 1 2 Старостина В.К.,Дёгтева С.Д. Холинэстераза: методы анализа и диагностическое значение. — Новосибирск:Вектор-Бест, 2008. — С. 14.
Холинэстераза
Холинэстераза – это фермент, который расщепляет эфиры холина. Фермент представлен двумя видами: ацетилхолинэстераза и холинэстераза.
Ацетилхолинэстераза принимает участие в проведении нервного импульса, она находится в нервной ткани, скелетных мышцах, в небольших количествах – в эритроцитах. Холинэстераза вырабатывается в печени, она постоянно присутствует в крови, потому её называют «сывороточной». Фермент связывается с альбуминами, поэтому при снижении выработки данной фракции белков концентрация холинэстеразы может уменьшаться.
Уровень холинэстеразы – это «зеркало» синтетической функции печени. Её содержание в крови снижается уже при выраженном поражении печёночной ткани, когда клетки печени (гепатоциты) практически полностью теряют способность выполнять свои задачи. Низкий уровень холинэстеразы – плохой прогностический признак, поскольку он характерен для тяжёлого течения болезни. Встречается при остром гепатите, злокачественных новообразованиях печени, застое в печени при выраженной сердечной недостаточности, при циррозе печени, при повреждении паренхимы печени токсическими веществами.
Снижение уровня холинэстеразы происходит параллельно с уменьшением содержания альбумина в крови, повышением уровня трансаминаз – АлАТ и АсАТ. Возвращение фермента к нормальным значениям и снижение трансаминаз указывает на улучшение функции печени и положительную динамику в лечении.
Если у пациента снижен уровень холинэстеразы, нельзя применять лекарственные препараты группы мышечных релаксантов, которые содержат сукцинилхолин. Это вещество может спровоцировать апноэ (временную остановку дыхания).
Показания к выполнению анализа
Диагностика болезней печени.
Оценка функциональной активности печёночных клеток и степени тяжести заболевания.
Диагностика отравлений инсектицидами, содержащими фосфор.
Оценка чувствительности пациента к миорелаксантам перед оперативным вмешательством.
Подготовка к исследованию
От последнего приёма пищи до взятия крови временной промежуток должен быть более восьми часов.
Накануне исключить из рациона питания жирные продукты, не принимать спиртные напитки.
За 1 час перед взятием крови на анализ нельзя курить.
Не рекомендуется сдавать кровь сразу после выполнения флюорографии, рентгенографии, УЗИ, физиотерапевтических процедур.
Кровь на исследование сдают утром натощак, исключается даже чай или кофе.
Допустимо пить обычную воду.
За 20-30 минут до исследования пациенту рекомендован эмоциональный и физический покой.
Материал для исследования
Венозная кровь.
Интерпретация результатов
Показатели нормы могут отличаться в различных лабораториях. Обращайте внимание на нормы, указанные на бланке с результатом анализа.
Норма:
- для мужчин - 5100 - 11700 Ед/л;
- для женщин - 4000 - 12600 Ед/л.
Повышение:
1. Бронхиальная астма.
2. Нефротический синдром.
3. Миома матки.
4. Артериальная гипертензия.
5. Ожирение.
6. Сахарный диабет 2 типа у пациентов с избыточной массой тела.
7. Алкоголизм.
8. Воспалительные заболевания тонкого кишечника (экссудативный энтерит).
Снижение:
1. Болезни печени:
- гепатит острый и хронический,
- цирроз печени,
- метастазы рака других органов в печень,
- застойные явления в печени при выраженной сердечной недостаточности.
2. Воспаление желчевыводящих протоков или желчного пузыря: холангит или холецистит.
3. Отравление фосфорорганическими соединениями (инсектицидами), которые применяются в сельском хозяйстве для борьбы с насекомыми; мышьяком; грибами.
4. Инфаркт миокарда.
5. Лимфогранулематоз.
6. Плазмоцитома.
7. Миеломная болезнь.
8. Эмболия лёгочной артерии.
9. Воспалительные заболевания мышц и кожи – дерматомиозит.
10. Снижение концентрации альбуминов в крови (гипоальбуминемия) при различных заболеваниях.
11. Состояние после оперативного вмешательства, выполненного с применением миорелаксантов.
что это значит? Норма и причины отклонений
Почему сокращаются наши мышцы? Как приказ на движение передается от нервов на мышечную ткань? С помощью медиатора ацетилхолина, который выделяется в синаптическую щель между нервом и мышечным волокном. А как вновь «очистить» синапс? Благодаря работе фермента холинэстеразы. Существует несколько разновидностей. Ацетилхолинэстераза способна играть важную роль в передаче нервных импульсов (она и очищает синаптическую щель).
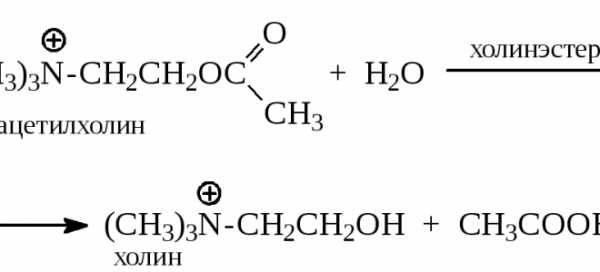
Медиатор ацетилхолин передаёт электрический ток, грубо говоря, с конечного отдела нервной клетки на мышечное волокно, и отдает приказ на сокращение. Но после этого ацетилхолин нужно убрать, чтобы он не мешал следующим сигналам. Ведь если он остается в синаптической щели, то мышца продолжит сокращаться, и возникнет спазм. Ацетилхолинэстераза и является ферментом, который быстро убирает ставший ненужным этот медиатор переноса информации.
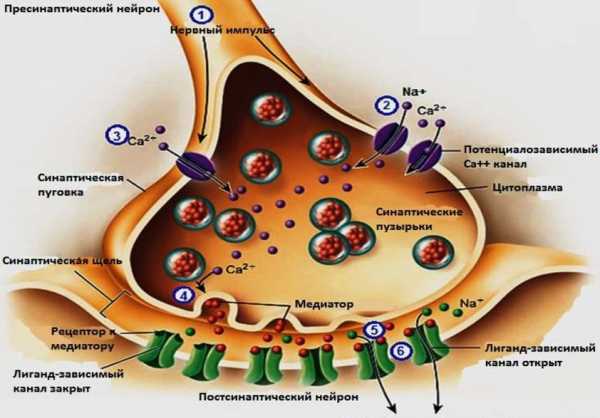
Есть ещё разновидность псевдохолинэстераза, ее цели и задачи немного другие. Это «хозяйственный фермент», который перерабатывает различные химические вещества. По какой причине может быть повышена холинэстераза крови? Этот анализ проводится не часто, но если его назначают, то для чего он нужен?
Холинэстераза
Любая разновидность холинэстеразы расщепляет сложные эфиры холина, и не только ацетилхолин. Да, в мышечном синапсе она прекрасно справляется со своими обязанностями, но откуда она берётся? Этот фермент синтезируется в печени, а затем с током крови разносится, в том числе, и в мышечную ткань. По-научному её функция заключается в «регуляции сократимости и возбудимости мышц», в том числе гладких мышц и миокарда.
Концентрация холинэстеразы в крови, на первый взгляд говорит об успешной (или плохой) функции мышечного сокращения, но на самом деле это не совсем так. Ее концентрация отражает синтетическую активность печени, ведь это фермент, а фермент принадлежит к классу белков. А мы знаем, что практически все белки, начиная от альбуминов и кончая антителами, синтезируется в печени.
Да, можно косвенно определить активность печени по уровню общего белка и альбуминов, а также по уровню протромбинового индекса, но иногда этого недостаточно, и требуется анализ крови на холинэстеразу. Как правило, при ее падении в плазме параллельно будет и снижение других белковых фракций, в том числе и альбумина. А если холинэстераза восстанавливается до нормальных значений, то это может говорить об улучшении в работе печени.
Показания к анализу
Для чего нужно исследовать холинэстеразу? Прежде всего, она косвенно свидетельствует о функции печени, об этом только что было сказано.
Второе очень важное показание к исследованию — это оценка хирургического риска, связанная с большими операциями. Известно, что при ингаляционном, или масочном наркозе, когда необходимо аппаратное дыхание (ИВЛ), пациенту нужно «выключить» собственное дыхание, и только потом подключить его к аппарату искусственной вентиляции лёгких. Чрезвычайно трудно, или даже невозможно заставить человека дышать с помощью навязанного извне аппаратного ритма, если искусственным образом не парализовать дыхательную мускулатуру. Это выполняется с помощью специальных препаратов, которые называются миорелаксантами. Их вводят анестезиологи, и затем пациент спокойно переводится на аппаратное дыхание.
Но поскольку миорелаксанты парализуют мускулатуру, а между мускулатурой и нервами существует тонкий взаимоотношения, то необходимо оценить, насколько ацетилхолинэстераза, находящаяся в синапсах, будет активной, и насколько человек быстро сможет перейти на спонтанное дыхание. Когда миорелаксанты перестают действовать, у человека возникает попытка к самостоятельному вдоху, и он начинает «бороться» с аппаратом ИВЛ. В это время важно анестезиологу убедиться, что пациент может дышать, и своевременно «разинтубировать» пациента. Десинхронизация ритма аппаратного и спонтанного дыхания и есть один из признаков реанимационной болезни. Чтобы этого не было, нужно своевременно отключить аппарат, но только тогда, когда пациент может спокойно самостоятельно дышать. Во многом это зависит от активности холинэстеразы.
В том случае, если у пациента существует наследственное отклонение в структуре или количестве фермента, или холинэстераза является низкоактивной, то после наркоза действие миорелаксантов будет чрезвычайно длительным. Если это не принять во внимание и «снять пациента с трубы» в обычные сроки, то возможен смертельный исход, поскольку парализованные релаксантом дыхательные мышцы ещё не начали работать, хотя по всем временным сроком они давно уже должны быть готовы к самостоятельному дыханию.
Наконец, третьим показанием к анализу является угнетение этого фермента при действии фосфорорганических соединений (ФОС), а также отравляющих веществ. Чаще всего это пестициды и гербициды – ядохимикаты.
В случае резкого блокирования молекулой ФОС ацетилхолинэстеразы, возникает специфическая клиническая картина. У пациента развивается мышечная слабость и мышечные подергивания, появляется хрип, затрудненное дыхание, урежается частота сердечных сокращений и падает давление. Зрачки у пациента сужаются, и превращаются в «точки». В некоторых случаях появляются судороги, развитие сопора и коматозного состояния.
Если острые клинические признаки отравления выражены довольно ярко, и говорят о развитии мускариново — никотиноподобного синдрома, то в случае хронической интоксикации, например на производстве, заметить такие признаки довольно трудно, и поэтому необходимо исследование функции этого фермента. Также возможно проведение пробы с атропином.
Референсные значения (нормы)
У мужчин и у женщин существует различная норма холинэстеразы. Нужно запомнить, что все вещества, которые имеют отношения к мышечной массе, будут иметь разную концентрацию, ведь у мужчин мышечная масса больше. Характерным примером может являться разная концентрация креатинина в плазме крови. В данном случае имеем такие значения:
- Женщины: от 4260 до 11250 Ед/л;
- У мужчин концентрация выше: от 5320 до 12920 Ед/л.
В каком случае холинэстераза повышена в плазме крови?
Причины отклонений
Холинэстераза повышается в первую очередь при:
- Ожирении самого разного генеза, и в том числе вследствие ожирения при сахарном диабете;
- Высок уровень холинэстеразы и при алкоголизме;
- Повышается этот фермент при тяжелых заболеваниях почек, в том числе при различных формах нефротического синдрома, гломерулонефритах и пиелонефритах;
- Физиологическое повышение холинэстеразы может быть на начальном этапе беременности, а затем она опускается до нормы;
- Наряду с ожирением, высокий уровень этого фермента характерен для нарушений липопротеинового обмена, а именно для гиперлипопротеинемии 4 типа.
Эта разновидность умеренной семейной гиперлипидемии, вследствие повышения концентрации липопротеинов очень низкой плотности (ЛПОНП). Частота её возникновения в обычной популяции не превышает 0,25%. Она возникает вследствие усиленного образования липопротеинов очень низкой плотности и вследствие медленного их распада.
Также повышается холинэстераза при болезнях тонкого кишечника, например, при экссудативной энтеропатии, и при язвенной болезни желудка. Будет она повышена и при таких болезнях, как бронхиальная астма и миома матки.
А если она снижена?
А в каком случае снижается холинэстераза? Прежде всего, это тяжелая печеночная патология: хронические гепатиты, цирроз, в том числе алкогольный и билиарный цирроз, гепатоцеллюлярная аденокарцинома и метастатический рак печени.
При тяжелой сердечной недостаточности снижение уровня ацетилхолинэстеразы является неблагоприятным признаком, и говорит о развитии застойной печени и скоплении свободной жидкости в брюшной полости.
Холинэстераза снижена при отравлении фосфорорганическими соединениями, например хлорофосом или дихлофосом, при истощении вследствие злокачественных новообразований, то есть при раковой кахексии. Падает концентрация холинэстеразы и при инфаркте миокарда, при уменьшении концентрации белков в плазме крови.
В некоторых случаях речь может идти о физиологическом снижении, например на поздних сроках беременности, и это тоже нормально. У здорового человека после ингаляционного наркоза с применением мышечных релаксантов будет тоже снижаться уровень ацетилхолинэстеразы, а если у него наследственный дефицит, то она будет чрезвычайно снижена. Это будет вызывать опасность для жизни, о чем было сказано выше.
Также снижается концентрация этого фермента вследствие приема некоторых лекарств. Это глюкокортикостероидные гормоны, анаболики, оральные контрацептивы. Естественно, поскольку этот фермент является белком и находится в плазме крови, то после сеансов плазмафереза концентрация холинэстеразы, как и некоторых других белков, той же массы, будет снижаться.
Исследование уровня холинэстеразы – норма концентрации фермента
Холинэстераза – это фермент, вырабатываемый в печени. Обеспечивает процесс гидролиза сложных эфиров жирных кислот.
Исследование уровня холинэстеразы позволяет определить активность ферментов (ацетилхолинэстеразы и псевдо-холинэстеразы), отвечающих за правильное функционирование нервной системы.
Ацетилхолинэстераза находится, прежде всего, в мышечной ткани, нервной ткани и эритроцитах. В свою очередь, псевдо-холинэстераза находится в печени, и, как и ацетилхолинэстераза, участвует в образовании веществ, необходимых для передачи нервных сигналов.
Показания для исследования уровня холинэстеразы
Исследование уровня холинэстеразы выполняется в случае подозрения на отравление химическими веществами, входящими в состав пестицидов (средств защиты растений). Эти химикаты, будучи фосфорорганическими соединениями, «выключают» холинэстеразу.
Измерение уровня ферментов холинэстеразы в крови позволяет определить степень воздействия токсинов. Иногда исследование проводится в целях диагностики заболеваний печени.
Врач заказывает исследование уровня холинэстеразы, если пациент проявляет такие симптомы, как покраснение кожи, диарея, замедление сердечного ритма и сужение зрачков, потому что это симптомы отравления средствами защиты растений.
Процесс исследования холинэстеразы
Уровень холинэстеразы измеряется в образце крови. Для проведения анализа в лаборатории выполняется разовый забор крови из локтевой вены. По крайней мере 8 часов до исследования необходимо воздержаться от приема пищи и жидкости. Результаты исследования, как правило, можно забрать на следующий день. Исследование проводится на сыворотке крови.
Иногда проводится дибукаиновый тест. Он позволяет различать людей, у которых низкий уровень фермента (низкая активность) возникли из-за отравления или врожденных заболеваний печени.
Нормы уровня холинэстеразы
Правильный уровень холинэстеразы находится в диапазоне 8-18 Ед/л (метод Дюпон) или 640-2000 Ед/л (метод Берингер-Мангейм). Следует, однако, помнить, что значения, являющиеся нормой, различны для разных лабораторий, поэтому так важно обсуждение результатов с врачом.
Пониженный уровень холинэстеразы может означать:
- острую инфекцию;
- хроническое недоедание;
- инфаркт миокарда;
- повреждение печени;
- цирроз печени;
- острый гепатит;
- метастазирование опухоли;
- желтуху;
- отравление фосфорорганическими соединениями.
Уровень чуть ниже нормы, может возникнуть в результате беременности или приема оральных контрацептивов. Одновременно со снижением холинэстеразы происходит снижение уровня альбумина и повышение уровня трансминазы.
Повышенная активность холинэстеразы может появиться в период восстановления после повреждения печени у людей, страдающих ожирением, и больных диабетом 2 типа, а также лиц, злоупотребляющих алкоголем.
Исследование уровня холинэстеразы позволяет определить, произошли ли отравления химическими веществами, входящими в состав пестицидов. Это исследование не относится к числу рутинных, а показаниями для его проведения являются симптомы отравления средствами защиты растений.
Холинэстераза в сыворотке
Холинэстераза в сыворотке
Общая информация об исследовании
Холинэстераза является ферментом, необходимым для работы нервной системы.
В организме есть два типа холинэстеразы: ацетилхолинэстераза, присутствующая в эритроцитах, а также в легких, селезенке, нервных окончаниях и сером веществе мозга, и псевдохолинэстераза (бутирилхолинэстераза), содержащаяся в сыворотке крови, печени, мышцах, поджелудочной железе, сердце и белом веществе мозга. Ацетилхолинэстераза участвует в передаче нервных импульсов путем расщепления ацетилхолина – химического вещества, передающего сигналы через окончания нервных клеток. Понижение активности ацетилхолинэстеразы приводит к накоплению ацетилхолина в нервных окончаниях. Это, в свою очередь, ведет к сверхраздражению нервных клеток.
Псевдохолинэстераза необходима для расщепления и метаболизации токсинов и лекарственных веществ.
Для чего используется исследование?
- Для проверки пациента, у которого был контакт с пестицидами, содержащими фосфорорганические вещества, – они могут подавлять холинэстеразную и псевдохолинэстеразную активность. Симптомы проявляются резко в случае острого отравления либо же могут возникать постепенно, по мере хронического воздействия этих веществ. Проникновение инсектицидов внутрь организма может происходить путем их вдыхания, проглатывания или контакта с кожей.
- Чтобы выявить наследственную недостаточность псевдохолинэстеразы. Иногда дефицит фермента может передаваться по наследству из-за генетических вариаций фермента. Псевдохолинэстераза необходима организму для инактивации сукцинилхолина – миорелаксанта, который обычно применяется при хирургических операциях. У пациентов с низкой активностью либо дефектной формой псевдохолинэстеразы после анестезии действие медикаментов может затянуться, угрожая длительным параличом мышц и удушьем.
Когда назначается исследование?
- Периодически пациентам, использующим фосфорорганические вещества в сельском хозяйстве или в химической индустрии.
- При оценке острого отравления вредными веществами, которые могут вызвать нервно-мышечное повреждение. Симптомы отравления различаются в зависимости от вещества, его количества и способа попадания в организм: головная боль, головокружение, тошнота, повышенная слезоточивость и слюноотделение, потливость. При очень тяжелом отравлении появляются дополнительные симптомы: рвота, понос, потемнение в глазах или расплывчатая видимость из-за сужения зрачков, слабость в мышцах, судорожное подергивание, нарушение координации движений, замедленное дыхание, ведущее к дыхательной недостаточности и необходимости искусственной вентиляции легких.
- Перед операцией, если у близких родственников пациента когда-либо был продолжительный паралич и удушье после применения сукцинилхолина.
Холинэстераза | Анализы на EUROLAB
Навигация по статье:
Что такое Холинэстераза?
В тканях человека обнаружены два различных фермента этого типа: ацетилхолинэстераза («истинная» холинэстераза), которая преимущественно находится в нервной ткани, скелетных мышцах и в низкой концентрации в эритроцитах; и сывороточная, или псевдохолинэстераза, которая широко распространена, присутствует в печени, поджелудочной железе, секретируется печенью в кровь. Сывороточная ХЭ является ферментом, катализирующим реакцию гидролиза ацетилхолина.
Определение активности холинэстеразы в сыворотке представляет наибольший клинический интерес для диагностики отравлений фосфорорганическими отравляющими веществами и инсектицидами, а также как показатель состояния белково-синтезирующей функции печени и для обнаружения атипичных вариантов фермента (дибукаин-резистентная форма).
Отравления фосфорорганическими веществами и инсектицидами сопровождаются выраженным снижением активности холинэстеразы.
Активность холинэстеразы наиболее резко снижается при тяжелых хронических заболеваниях печени, особенно при циррозе. Значительное снижение активности холинэстеразы наблюдается при распространенных бластоматозных поражениях печени. В начальных стадиях обтурационной желтухи снижение активности холинэстеразы встречается очень редко.
Почему важно делать холинэстеразы?
Ярким проявлением снижения белково-синтетической функции печени у больных вирусным гепатитом при развитии острой печеночной недостаточности является резкое снижение активности холинэстеразы; при этом степень снижения активности холинэстеразы обратно пропорциональна тяжести течения заболевания. Наиболее низкие показатели отмечаются у больных за несколько дней до развития печеночной комы. Однако длительный период полураспада сывороточной холинэстеразы (7-10 сут.) снижает ее ценность как диагностического теста при печеночной недостаточности.
При инфаркте миокарда резкое падение активности холинэстеразы отмечают к концу первых суток заболевания; оно обусловлено шоком, который приводит к тяжелому повреждению печени. В последнее время исследование этого фермента широко используется для контроля за применением релаксантов в хирургической практике. Курареподобные вещества (дитилин, сукцинилхолин), применяемые в хирургии для расслабления мышц, обычно быстро разрушаются, преимущественно холинэстераза сыворотки. Тяжелые последствия применения этих средств (длительное апноэ, холинергический шок) возможны как при приобретенном недостатке холинэстеразы (чаще при хронических заболеваниях печени), так и при врожденном ферментном дефекте.
При нефротическом синдроме активность холинэстеразы повышается. Это связано с усилением синтеза альбуминов печенью из-за быстрой потери мелкодисперсной фракции белков с мочой. Повышение холинэстеразы наблюдается также иногда при ожирении и экссудативной энтеропатии.
Активность холинэстеразы незначительно возрастает при артериальной гипертонии, сахарном диабете, столбняке, хорее, маниакально-депрессивном психозе, депрессивных неврозах, тревоге.
При каких заболеваниях делается Холинэстераза?
Показания к назначению анализа:
-
Диагностика возможного отравления фосфорорганическими инсектицидами.
-
Оценка функций печени при печеночной патологии (диагностика и мониторинг).
-
Выявление атипичных форм фермента для оценки риска осложнений при хирургических вмешательствах с применением миорелаксантов.
Для проверки/улучшения работоспособности каких органов нужно делать холинэстеразы?
Как подготовиться к сдаче холинэстеразы?
Взятие крови желательно производить натощак.
Материал для сдачи холинэстеразы
Сыворотка крови.
Срок выполнения холинэстеразы
1 рабочий день.
Повышения нормы наблюдаются при следующих заболеваниях холинэстеразы
Повышение значений:
-
Гиперлипопротеинемия IV типа.
-
Нефротическая и смешанная формы гломерулонефрита (потеря белка с мочой).
-
Ожирение, в том числе при сахарном диабете.
-
Психоз.
-
Рак молочной железы.
Понижения нормы наблюдаются при следующих заболеваниях холинэстеразы
Снижение значений:
-
Генетические варианты холинэстеразы.
-
Печеночная патология: цирроз, гепатит, метастатический рак печени, застойная печень при сердечной недостаточности (низкая активность указывает на тяжелое течение болезни и является плохим прогностическим признаком).
-
Острая или хроническая интоксикация фосфорорганическими инсектицидами (хлорофос, дихлофос).
-
Инфаркт миокарда.
-
Легочная эмболия.
-
Онкологические заболевания (раковая кахексия).
-
Плазмаферез.
-
Поздний срок беременности.
-
Синдром мальабсорбции.
-
Состояние после хирургического вмешательства с применением миорелаксантов.
-
Применение некоторых лекарственных препаратов (например, оральные контрацептивы, анаболические стероиды, глюкокортикоиды, циметидин, циклофосфамид и др.),
-
Дерматомиозит.
-
Мышечная дистрофия.
-
Эксфолиативный дерматит.
К каким докторам следует обращаться для консультаций по холинэстеразе?
Гепатолог
Токсиколог
Холинэстераза в крови повышена - причины
Если холинэстераза в крови повышена, то какие причины вызвали такой патологический процесс? Этот фермент образуется в печени и помогает диагностировать состояние этого органа при возможном отравлении инсектицидами, а также при хирургическом вмешательстве. Увеличение данного вещества происходит и в начале беременности, поэтому следует знать норму холинэстеразы в крови и причины, вызвавшие отклонение.
Функция фермента
Холинэстераза – очень нужный фермент, благодаря которому возможно оценить состояние печени при различной интоксикации. Также анализ на это вещество назначается перед серьезной операцией, чтобы исключить дальнейшее осложнение.
В организме человека имеется два типа этого фермента:- Истинная холинэстераза.
- Сывороточная холинэстераза.
В большей части вещество содержится в скелетной ткани, нервных органах и красных кровяных тельцах – эритроцитах. Нередко её именуют ацетилхолинэстераза. Если её величина падает на 40%, то это может вызвать серьезные проблемы со здоровьем.
Другую называют сывороточной холинэстеразой, она присутствует в печени и выделяется в кровь. Если её уровень будет ниже 80%, то возможен нервный паралич, а при нулевых значениях необходима реанимационная помощь.
Сывороточное вещество осуществляет защитную функцию и предохраняет организм от токсичных действий, пестицидов и нитратов, содержащихся в пище. Также оберегает от сильнодействующих препаратов и наркотических веществ.
У здорового человека холинэстераза в крови, норма колеблется от 5300 до 13000 единиц/л. Отклонение в обе стороны вызывает различные заболевания. Так, резкое снижение фермента указывает на тяжелые болезни печени.
Отклонение от нормы
Если результаты анализа имеют отклонение от нормы, то это свидетельствует о возможных заболеваниях печени или отравлении химикатами. Чтобы поставить точный диагноз, требуется проведение дополнительного обследования, окончательный результат выносит только врач, опираясь на все заключения других анализов.
Повышенная холинэстераза в крови указывает на следующие заболевания:- Ожирение.
- Алкоголизм.
- Рак молочной железы.
- Сахарный диабет.
- Столбняк.
- Невроз.
- Артериальная гипертония.
Также повышение показателя происходит на ранних сроках беременности. В некоторых случаях такая величина наблюдается при бронхиальной астме и миоме матки.
Понижение фермента отмечается перед родами, после оперативного вмешательства и приема некоторых лекарственных средств, в том числе и оральных контрацептивов. Также значение ниже нормальных показателей бывает у новорожденных с самого рождения до шести месяцев.
Если наблюдается высокий уровень холинэстеразы, следует выяснить причину такого состояния. Для этого необходимо пройти дополнительное обследование и начать лечение основного заболевания, которое спровоцировало изменение показателей.
Показания к анализу
При каких заболеваниях назначают анализ крови на холинэстеразу? Этот очень важен для диагностирования различных заболеваний. Часто биохимический анализ крови назначают при подозрении на отравление химикатами, содержащие пестициды. Обычно это средства защиты растений от различных вредителей.
Назначается анализ пациенту с такими симптомами, как покраснение и сужение глаз, жидкий стул и учащенное сердцебиение.
Показан анализ и при других обстоятельствах:- цирроз печени;
- гепатиты;
- печеночная недостаточность;
- признаки интоксикации фосфорорганическими веществами;
- оценка состояния печени перед операцией.
Чтобы результаты анализов крови были достоверными, следует соблюдать несложные правила. Для исследования берется венозная кровь.
Инструкция при сдаче анализа:- Процедура осуществляется с утра натощак, последний прием пищи разрешен не менее 8 часов.
- За день исключает употребление жирных блюд и алкоголя.
- За час до забора крови нельзя курить и заниматься спортом.
- Не рекомендуется перед процедурой проходить рентген, УЗИ и флюорографию.
Результаты обследования бывают готовы через день, за расшифровкой обращаются к лечащему врачу. Анализ крови на холинэстеразу позволяет выявить – произошло ли отравление химическими веществами, содержащимися в пестицидах. Также оценить состояние печени, и определить приобретенные или врожденные заболевания вызвали такой патологический процесс.
Ацетилхолинэстераза — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 июля 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 июля 2019; проверки требует 1 правка.| Ацетилхолинэстераза | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
 PDB rendering based on 1b41 | ||||||||||
| ||||||||||
| Идентификаторы | ||||||||||
| Символ | ACHE ; ACEE; ARACHE; N-ACHE; YT | |||||||||
| Внешние ID | OMIM: 100740 MGI: 87876 HomoloGene: 543 ChEMBL: 220 GeneCards: ACHE Gene | |||||||||
| номер EC | 3.1.1.7 | |||||||||
| Профиль экспрессии РНК | ||||||||||
| Больше информации | ||||||||||
| Ортологи | ||||||||||
| Вид | Человек | Мышь | ||||||||
| Entrez | 43 | 11423 | ||||||||
| Ensembl | ENSG00000087085 | ENSMUSG00000023328 | ||||||||
| UniProt | P22303 | P21836 | ||||||||
| RefSeq (мРНК) | NM_000665 | NM_001290010 | ||||||||
| RefSeq (белок) | NP_000656 | NP_001276939 | ||||||||
| Локус (UCSC) | Chr 7: 100.49 – 100.49 Mb | Chr 5: 137.29 – 137.29 Mb | ||||||||
| Поиск в PubMed | [1] | [2] | ||||||||
Ацетилхолинэстераза (сокр. АХЭ, англ. AChE, КФ 3.1.1.7) — гидролитический фермент из семейства эстераз, который содержится в синапсах и катализирует гидролиз нейромедиатора ацетилхолина до холина и остатка уксусной кислоты. Реакция, катализируемая ацетилхолинэстеразой, необходима для дезактивации ацетилхолина в синаптической щели и перехода клетки-мишени в состояние покоя (например, для расслабления мышечной клетки). Поэтому ингибиторы ацетилхолинэстеразы (фосфорорганические инсектициды, ДФФ, зарин, зоман и V-газы, фасцикулин и некоторые другие пептиды змеиных ядов) — мощные токсины, воздействие которых на организм человека обычно приводит к смерти от судорог дыхательной мускулатуры.
Ген, кодирующий фермент ацетилхолинэстеразу у человека, находится на длинном плече седьмой хромосомы.[1][2]
У человека за счёт альтернативного сплайсинга образуется четыре изоформы AChE — T, H, R и 4 [3].
В синапсах (в частности, в концевых пластинках нервно-мышечных синапсов) AChE присутствует в виде тетрамера изоформы T?, присоединённого к коллагеноподобному белку, который кодируется отдельным геном COLQ[4]. Мутация этого гена является одной из наиболее распространённых причин наследственной миастении (myasthenia gravis) [5]. C помощью коллагеноподобного «хвоста» ацетилхолинэстераза прикрепляется к протеогликану перлекану, входящему в состав базальной пластинки синапса. Перлекан, в свою очередь, присоединяется к дистрогликановому комплексу, встроенному в постсинаптическую мембрану мышечной клетки [6].
Ацетилхолинэстераза обнаружена в плазматических мембранах эритроцитов (изоформа H, заякоренная в мембране с помощью присоединенной жирной кислоты)[3][4] и является Yt-антигеном крови.[3][4][5] Вариант His-353 (обычный вариант с гистидином в 353 положении цепи) соответствует группе Yt(a), редкий вариант Asn-353 — группе Yt(b).
В нейронах AChE может локализоваться внутриклеточно (изоформа T). Показано, что накопление AChE внутри ядер клеток нейробластомы приводит к апоптозу [6]
- ↑ Ehrlich G., Viegas-Pequignot E., Ginzberg D., et al. Mapping the human acetylcholinesterase gene to chromosome 7q22 by fluorescent in situ hybridization coupled with selective PCR amplification from a somatic hybrid cell panel and chromosome-sorted DNA libraries. (англ.) // Genomics : journal. — Academic Press, 1992. — Vol. 13, no. 4. — P. 1192—1197. — doi:10.1016/0888-7543(92)90037-S. — PMID 1380483.
- ↑ Getman D.K., Eubanks J.H., Camp S., et al. The human gene encoding acetylcholinesterase is located on the long arm of chromosome 7. (англ.) // Am. J. Hum. Genet. (англ.)русск. : journal. — 1992. — Vol. 51, no. 1. — P. 170—177. — PMID 1609795.
- ↑ 1 2 G. Daniels. Functions of red cell surface proteins (англ.) // Vox Sanguinis (англ.)русск. : journal. — 2007. — Vol. 93. — P. 331—340. — doi:10.1111/j.1423-0410.2007.00970.x.
- ↑ 1 2 Spring F.A., Gardner B., Anstee D.J. Evidence that the antigens of the Yt blood group system are located on human erythrocyte acetylcholinesterase. (англ.) // Blood (англ.)русск. : journal. — American Society of Hematology (англ.)русск., 1992. — Vol. 80, no. 8. — P. 2136—2141. — PMID 1391965.
- ↑ АХЭ (ацетилхолинэстераза, холинэстераза).
- ↑ Yang L., He H. Y., Zhang X. J. Increased expression of intranuclear AChE involved in apoptosis of SK-N-SH cells. Neurosci. Res. 42: 261—268 (2002) [PubMed: 11985878].
- Silman I., Futerman A.H. Modes of attachment of acetylcholinesterase to the surface membrane. (англ.) // Eur. J. Biochem. (англ.)русск. : journal. — 1988. — Vol. 170, no. 1—2. — P. 11—22. — doi:10.1111/j.1432-1033.1987.tb13662.x. — PMID 3319614.
- Soreq H., Seidman S. Acetylcholinesterase--new roles for an old actor. (англ.) // Nat. Rev. Neurosci. : journal. — 2001. — Vol. 2, no. 4. — P. 294—302. — doi:10.1038/35067589. — PMID 11283752.
- Shen T., Tai K., Henchman R.H., McCammon J.A. Molecular dynamics of acetylcholinesterase. (англ.) // Accounts of Chemical Research (англ.)русск. : journal. — 2003. — Vol. 35, no. 6. — P. 332—340. — doi:10.1021/ar010025i. — PMID 12069617.
- Pakaski M., Kasa P. Role of acetylcholinesterase inhibitors in the metabolism of amyloid precursor protein. (англ.) // Current drug targets. CNS and neurological disorders : journal. — 2003. — Vol. 2, no. 3. — P. 163—171. — doi:10.2174/1568007033482869. — PMID 12769797.
- Meshorer E., Soreq H. Virtues and woes of AChE alternative splicing in stress-related neuropathologies. (англ.) // Trends Neurosci. (англ.)русск. : journal. — 2006. — Vol. 29, no. 4. — P. 216—224. — doi:10.1016/j.tins.2006.02.005. — PMID 16516310.
- Shafferman A., Kronman C., Flashner Y., et al. Mutagenesis of human acetylcholinesterase. Identification of residues involved in catalytic activity and in polypeptide folding. (англ.) // J. Biol. Chem. : journal. — 1992. — Vol. 267, no. 25. — P. 17640—17648. — PMID 1517212.
- Li Y., Camp S., Rachinsky T.L., et al. Gene structure of mammalian acetylcholinesterase. Alternative exons dictate tissue-specific expression. (англ.) // J. Biol. Chem. : journal. — 1992. — Vol. 266, no. 34. — P. 23083—23090. — PMID 1744105.
- Velan B., Grosfeld H., Kronman C., et al. The effect of elimination of intersubunit disulfide bonds on the activity, assembly, and secretion of recombinant human acetylcholinesterase. Expression of acetylcholinesterase Cys-580----Ala mutant. (англ.) // J. Biol. Chem. : journal. — 1992. — Vol. 266, no. 35. — P. 23977—23984. — PMID 1748670.
- Soreq H., Ben-Aziz R., Prody C.A., et al. Molecular cloning and construction of the coding region for human acetylcholinesterase reveals a G + C-rich attenuating structure. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1991. — Vol. 87, no. 24. — P. 9688—9692. — doi:10.1073/pnas.87.24.9688. — PMID 2263619.
- Chhajlani V., Derr D., Earles B., et al. Purification and partial amino acid sequence analysis of human erythrocyte acetylcholinesterase. (англ.) // FEBS Lett. (англ.)русск. : journal. — 1989. — Vol. 247, no. 2. — P. 279—282. — doi:10.1016/0014-5793(89)81352-3. — PMID 2714437.
- Lapidot-Lifson Y., Prody C.A., Ginzberg D., et al. Coamplification of human acetylcholinesterase and butyrylcholinesterase genes in blood cells: correlation with various leukemias and abnormal megakaryocytopoiesis. (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1989. — Vol. 86, no. 12. — P. 4715—4719. — doi:10.1073/pnas.86.12.4715. — PMID 2734315.
- Bazelyansky M., Robey E., Kirsch J.F. Fractional diffusion-limited component of reactions catalyzed by acetylcholinesterase. (англ.) // Biochemistry : journal. — 1986. — Vol. 25, no. 1. — P. 125—130. — doi:10.1021/bi00349a019. — PMID 3954986.
- Gaston S.M., Marchase R.B., Jakoi E.R. Brain ligatin: a membrane lectin that binds acetylcholinesterase. (англ.) // J. Cell. Biochem. (англ.)русск. : journal. — 1982. — Vol. 18, no. 4. — P. 447—459. — doi:10.1002/jcb.1982.240180406. — PMID 7085778.
- Ordentlich A., Barak D., Kronman C., et al. Contribution of aromatic moieties of tyrosine 133 and of the anionic subsite tryptophan 86 to catalytic efficiency and allosteric modulation of acetylcholinesterase. (англ.) // J. Biol. Chem. : journal. — 1995. — Vol. 270, no. 5. — P. 2082—2091. — doi:10.1074/jbc.270.5.2082. — PMID 7836436.
- Maruyama K., Sugano S. Oligo-capping: a simple method to replace the cap structure of eukaryotic mRNAs with oligoribonucleotides. (англ.) // Gene (англ.)русск. : journal. — Elsevier, 1994. — Vol. 138, no. 1—2. — P. 171—174. — doi:10.1016/0378-1119(94)90802-8. — PMID 8125298.
- Ben Aziz-Aloya R., Sternfeld M., Soreq H. Promoter elements and alternative splicing in the human ACHE gene. (англ.) // Prog. Brain Res. : journal. — 1994. — Vol. 98. — P. 147—153. — PMID 8248502.
- Massoulie J., Pezzementi L., Bon S., Krejci E., Valette F. Molecular and Cellular Biology of Cholinesterases. (неопр.) // Prog. Brain Res.. — 1993. — Т. 93. — С. 31—91. — PMID 8321908.
Холинэстераза (ХЭ, Cholinesterase)
array(19) { ["catalog_code"]=> string(6) "090026" ["name"]=> string(43) "Холинэстераза (Cholinesterase)" ["period"]=> string(1) "1" ["period_max"]=> string(1) "0" ["period_unit_name"]=> string(6) "к.д." ["cito_period"]=> string(1) "3" ["cito_period_max"]=> string(1) "5" ["cito_period_unit_name"]=> string(3) "ч." ["group_id"]=> string(4) "1725" ["id"]=> string(4) "1554" ["url"]=> string(39) "holinesteraza-khe-cholinesterase_090026" ["podgotovka"]=> string(181) "Взятие крови производится натощак (не менее 8 и не более 14 ч голодания). Можно пить воду без газа.
" ["opisanie"]=> string(4209) "Метод исследования: химический колориметрический
Холинэстераза (ХЭ) - фермент, в наибольшем количестве обнаружен в печени, поджелудочной железе, сердце, белом веществе головного мозга. Функция фермента состоит в расщеплении всех эфиров холина.
Пациенты с генетически обусловленной низкой активностью ХЭ при проведении хирургических операций с применением миорелаксантов имеют более высокий риск развития осложнений, обладают повышенной чувствительностью к отравлениям фосфоорганическими соединениями и карбаматами. Снижение активности ХЭ в сыворотке крови в отсутствие врожденных генетических дефектов фермента и воздействия ингибиторов указывает на нарушение синтеза фермента в печени.
ПОКАЗАНИЯ К ИССЛЕДОВАНИЮ:
- Диагностика отравления (фосфорорганические соединения, карбаматы)
- Оценка риска осложнений при хирургических операций с применением миорелаксантов
- Диагностика заболеваний печени
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ:
Референсные значения (вариант нормы):
| Параметр | Мужчины | Женщины | Единицы измерения |
|---|---|---|---|
| Холинэстераза | 4389-10928 | 2789-12669 | МЕ/л |
| Снижение значений |
|---|
|
Клинические признаки отравления фосфороограническими веществами (аналогичны чрезмерной стимуляции М- холинорецепторов): слезотечение, слюнотечение, учащенное мочеиспускание, бронхорея, диарея, рвота, брадикардия, миоз, гиперактивные кишечные шумы.
Обращаем Ваше внимание на то, что интерпретация результатов исследований, установление диагноза, а также назначение лечения, в соответствии с Федеральным законом ФЗ № 323 «Об основах охраны здоровья граждан в Российской Федерации», должны производиться врачом соответствующей специализации.
" ["serv_cost"]=> string(3) "355" ["cito_price"]=> string(3) "710" ["parent"]=> string(2) "17" [10]=> string(1) "1" ["limit"]=> NULL ["bmats"]=> array(1) { [0]=> array(3) { ["cito"]=> string(1) "Y" ["own_bmat"]=> string(2) "12" ["name"]=> string(31) "Кровь (сыворотка)" } } }Причины повышения и понижения холинэстеразы
Референтные величины (норма) активности холинэстеразы в сыворотке крови - 5300-12900 МЕ/л.
В тканях человека присутствуют два различных фермента этого типа: ацетилхолинэстераза («истинная» холинэстераза), локализующаяся преимущественно в нервной ткани, скелетных мышцах и, в низкой концентрации, в эритроцитах; и сывороточная, или псевдохолинэстераза, которая широко распространена, присутствует в печени, поджелудочной железе, секретируется печенью в кровь. Сывороточная холинэстераза - фермент, катализирующий реакцию гидролиза ацетилхолина.
Определение активности холинэстеразы в сыворотке представляет наибольший клинический интерес для диагностики отравлений фосфорорганическими отравляющими веществами и инсектицидами, а также как показатель состояния белково-синтетической функции печени и для обнаружения атипичных вариантов фермента (дибукаин-резистентная форма).
Отравления фосфорорганическими веществами и инсектицидами сопровождаются выраженным снижением активности холинэстеразы. Она резко снижается при тяжёлых хронических заболеваниях печени, особенно при циррозе. Значительное снижение активности холинэстеразы наблюдают и при распространённых бластоматозных поражениях печени. В начальных стадиях обтурационной желтухи снижение активности холинэстеразы выявляют очень редко.
Резкое снижение активности холинэстеразы - типичное проявление нарушения белково-синтетической функции печени у больных вирусным гепатитом при развитии острой печёночной недостаточности, при этом степень её снижения обратно пропорциональна тяжести заболевания. Наиболее низкие показатели отмечают у больных за несколько дней до развития печёночной комы. Тем не менее длительный период полураспада сывороточной холинэстеразы (7-10 дней) снижает её возможности в диагностике острой печёночной недостаточности.
При инфаркте миокарда резкое снижение активности холинэстеразы отмечают к концу первых суток заболевания, что обусловлено шоком, приводящим к тяжёлому повреждению печени.
В последнее время исследование этого фермента широко используют для контроля за применением релаксантов в хирургической практике. Курареподобные вещества (суксаметония йодид и др.), применяемые в хирургии для расслабления мышц, обычно быстро разрушаются, преимущественно холинэстеразой сыворотки крови. Тяжёлые последствия применения этих средств (длительное апноэ, холинергический шок) возможны как при приобретённой недостаточности холинэстеразы (чаще при хронических заболеваниях печени), так и при врождённом её дефекте.
При нефротическом синдроме наблюдают повышение активности холинэстеразы, что связано с увеличением синтеза альбуминов печенью из-за быстрой потери мелкодисперсной фракции белков с мочой. Повышение активности холинэстеразы также иногда наблюдают при ожирении и экссудативной энтеропатии.
Небольшое повышение активности холинэстеразы иногда возможно при артериальной гипертензии, сахарном диабете, столбняке, хорее, маниакально-депрессивном психозе, депрессивных неврозах, тревоге.
Холинэстераза в крови повышена причины
Содержание статьи
Типы дислипидемии и причины ее возникновения
Многие годы безуспешно боретесь с ХОЛЕСТЕРИНОМ?
Глава Института: «Вы будете поражены, насколько просто можно снизить холестерин просто принимая каждый день...
Читать далее »
К нарушениям обмена веществ в организме человека относится дислипидемия. Это патологическое состояние, при котором изменяется нормальный липидный состав крови. Это не самостоятельное заболевание. Гиперлипопротеинемия является основным фактором риска развития атеросклероза.
НАШИ ЧИТАТЕЛИ РЕКОМЕНДУЮТ!
Для снижения холестерина наши читатели успешно используют Aterol. Видя, такую популярность этого средства мы решили предложить его и вашему вниманию.
Подробнее здесь…
Нарушение жирового обмена
Нарушение липидного обмена встречается очень часто. Данная патология диагностируется преимущественно у взрослых. В организме человека синтезируются триглицериды, холестерин и липопротеиды. Последние образованы белками и жирами. Выделяют липопротеины высокой, низкой, промежуточной и очень низкой плотности. Кроме этих соединений имеются хиломикроны.
Липопротеины необходимы для переноса холестерина и построения клеток. При нарушении жирового обмена соотношение этих веществ меняется и усиливается их образование. Существует такое понятие, как гиперлипопротеинемия. Это высокий уровень липопротеинов в крови. Он является фактором риска развития сердечно-сосудистой патологии (ИБС, атеросклероза, гипертонической болезни).
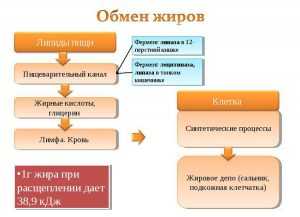 Ежегодно от этого недуга умирают десятки миллионов людей. В норме уровень холестерина здорового человека не превышает 5,2 ммоль/л. Высоким считается концентрация этого вещества более 6,2 ммоль/л. Оптимальный уровень
Ежегодно от этого недуга умирают десятки миллионов людей. В норме уровень холестерина здорового человека не превышает 5,2 ммоль/л. Высоким считается концентрация этого вещества более 6,2 ммоль/л. Оптимальный уровень