Анионит что это такое
Иониты — Википедия
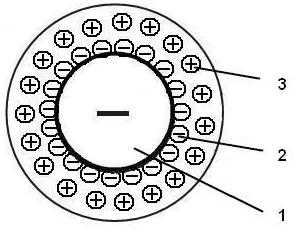
Зёрна ионита (ионообменной смолы в данном случае)Иониты — твердые нерастворимые вещества, способные обменивать свои ионы на ионы из окружающего их раствора. Обычно это синтетические органические смолы, имеющие кислотные или щелочные группы. Иониты разделяются на катиониты, поглощающие катионы, аниониты, поглощающие анионы и амфотерные иониты, обладающие обоими этими свойствами[1]. Широко применяются иониты для опреснения вод, в аналитической химии для разделения веществ методом хроматографии, в химической технологии. Иониты распространены в природе, в частности, в почве содержатся катиониты, которые предохраняют катионы необходимых растениям элементов (например, калия) от вымывания водой и обменивают их на ионы водорода выделяемой растениями кислоты, таким образом способствуя питанию растений [2]. В зависимости от природы матрицы различают неорганические и органические иониты.
В 1850 году Гарри Стивен Мейси Томпсон (англ. Harry Stephen Meysey Thompson) опубликовал статью в английском журнале[3], в которой изложил результаты экспериментов, проведённых им летом 1845 года. Он пропускал дистиллированную воду c растворённым в ней сульфатом аммония через слой почвы. На выходе количество сульфата аммония в воде значительно уменьшилось, зато она стала содержать много гипса, что свидетельствовало о том, что ионы аммония задержались почвой, обменявшись на содержавшиеся в ней ионы кальция. В том же номере журнала опубликовал статью Джон Томас Уэй (англ. John Thomas Way)[4], который провёл множество экспериментов, свидетельствующих об ионообмене в почве. Оба автора ссылаются также на фермера Хакстебла (англ. Huxtable), поставившего подобный эксперимент.
В статье, датируемой 26 июля 1905 года Р. Ганс (нем. Gans) описал методы технического получения искусственных неорганических ионитов — цеолитов[5] и указал на возможность их применения для уменьшения жёсткости воды. Действие ионитов изучали российские и советские учёные К. К. Гедройц, Н. Д. Зелинский, М. С. Цвет[1]. В 1935 году Б. А. Адамс (англ. Basil Albert Adams) и Э. Л. Холмс (англ. Eric Leighton Holmes) обнаружили свойство обменивать ионы у синтетических органических полимеров[6], тем самым пополнив группу известных ионитов ионообменными смолами. В 1950 — 1960 гг. синтетические иониты исследовали М. М. Дубинин, Б. П. Никольский, Б. Н. Ласкорин [1].
Иониты обычно состоят из зёрен, хотя производятся и иониты в виде мембран, волокон и тканей[1]. Возьмём для определённости катионит, содержащий катионы водорода. Если через такой катионит пропустить вещество без ионов, например, дистиллированную воду, то ни вещество, ни катионит никак не изменятся. Однако если пропустить раствор соли, то этот раствор превратится в кислоту, а катионит будет содержать уже не катионы водорода, а катионы соли — произойдёт ионообмен. Чтобы вернуть катионит в исходное состояние, через него нужно пропустить кислоту — катионы соли в катионите вновь заменятся на катионы водорода — а затем отмыть от остатков кислоты. Подобным же образом аниониты обменивают свои анионы на анионы среды, в которую их помещают[2].
Иониты состоят из полимерной матрицы и связанных с ней ионогенных групп. При диссоциации каждая ионогенная группа разделяется на фиксированный ион, связанный с матрицей, и подвижный ион, который и обменивается на ионы раствора. Обычно чем больше заряд обмениваемого иона, тем лучше ионит обменивается им, а если заряды одинаковы, лучше обмениваются ионы радиус которых больше. Например, сильнокислотные катиониты с сульфогруппами ионы калия K + обменивают лучше, чем ионы лития Li+[1], поскольку литий и калий расположены в одной подгруппе таблицы Менделеева и атомный номер калия больше, чем у лития, поэтому и радиус иона у него больше. Другой пример: сильноосновные аниониты обменивают ионы иода I- лучше, чем ионы хлора Cl-[1], поскольку хлор и иод расположены в одной подгруппе и атомный номер иода больше, чем у хлора, поэтому и радиус иона у него больше.
По заряду обмениваемых ионов иониты делятся на следующие типы[1]:
- Катиониты. Являясь кислотами, они поглощают положительные ионы и обменивают их на другие положительные ионы. Для регенерации катионита нужно подвергнуть его действию раствора кислоты. В свою очередь, подразделяются на следующие подтипы[1]:
- Сильнокислотные. Содержат сильно диссоциированные кислотные группы, например, сульфокислотные. Могут обменивать ионы в средах с кислой, нейтральной и щелочной реакцией.
- Слабокислотные. Содержат слабодиссоциированные кислотные группы, например, карбоксильные. Обменивают ионы только в средах с нейтральной и щелочной реакцией.
- Аниониты. Являясь основаниями, поглощают отрицательные ионы и обменивают их на другие отрицательные ионы. Для регенерации анионита его подвергают действию щёлочи. Подразделяются на следующие подтипы[1]:
- Сильноосновные. Могут обменивать ионы в средах с кислой, нейтральной и щелочной реакцией.
- Слабоосновные. Могут обменивать ионы только в средах с кислой и нейтральной реакцией.
- Среднеосновные. Содержат и группы, характерные для сильноосновных анионитов, и группы, характерные для слабоосновных анионитов.
- Амфотерные иониты или полиамфолиты. В разных ситуациях они могут вести себя или как катиониты, или как аниониты. Для регенерации амфотерных ионитов их промывают водой.
В зависимости от природы матрицы иониты делятся на неорганические и органические.
Органические иониты[править | править код]
Органические иониты — это в основном синтетические ионообменные смолы. Органическая матрица изготавливается путём поликонденсации мономерных органических молекул, таких как стирол, дивинилбензол, акриламид и т. д. В эту матрицу химическим путём вводятся ионогенные группы (фиксированные ионы) кислотного или основного типа. Традиционно вводимыми группами кислотного типа являются -СООН; -SО3Н; -РО4 Н2 и т. п., а основного типа: ≡N; =NH; -NH2; -NR3+ и т. п. Современные ионообменные смолы, как правило, обладают высокой обменной ёмкостью и стабильностью в работе.
Иониты способны к набуханию в воде, что обусловлено присутствием гидрофильных фиксированных групп, способных к гидратации. Однако беспредельному набуханию, то есть растворению, препятствуют поперечные связи. Степень поперечной связанности задается при синтезе ионитов через количество вводимого сшивающего агента — дивинилбензола (ДВБ). Стандартные смолы, используемые для умягчения, содержат 8 % ДВБ. Доступные в настоящее время смолы могут содержать от 2 до 20 %. В целом степень набухания ионитов определяется количеством сшивки ДВБ, концентрацией гидрофильных ионогенных групп в объёме зерна ионита и тем, какие противоионы находятся в ионите. Обычно однозарядные ионы, особенно ионы водорода и гидроксила, приводят к наибольшему набуханию; многозарядные противоионы приводят к некоторому сжатию и уменьшению объёма зерен.
Неорганические иониты[править | править код]
Неорганические иониты — это в основном иониты природного происхождения, к которым относятся алюмосиликаты, гидроксиды и соли поливалентных металлов. Наиболее распространенными и применяемыми для очистки воды неорганическими природными ионитами являются цеолиты.
Цеолиты — это минералы из группы водных алюмосиликатов щелочных и щелочноземельных элементов, которые характеризуются наличием трехмерного алюмокремнекислородного каркаса, образующего системы полостей и каналов, в которых расположены щелочные, щелочноземельные катионы и молекулы воды. Общий объём системы полостей и каналов цеолита составляет до 50 % объёма каркаса цеолита. Катионы и молекулы воды слабо связаны с каркасом и могут быть частично или полностью замещены путём ионного обмена и дегидрации. Ионообменные свойства цеолитов определяются особенностями химического сродства ионов и кристаллической структуры цеолита. При этом необходимо соответствие размеров входных отверстий в цеолитовый каркас и замещающих ионов, так как каркас цеолита имеет жесткую кристаллическую структуру и, в отличие от органических смол, не может набухать с изменением объёма.
Ионным обменом на цеолитах удается выделять ионы, извлечение которых другим методом часто представляет большую сложность. Установлена способность цеолитов адсорбировать радиоактивные ионы цезия из растворов, удалять NH4+, извлекать ионы Cu, Pb, Zn, Cd, Ba, Co, Ag и других металлов, очищать природные газы. Ионоситовый эффект позволяет адсорбировать из газовых и жидких систем пары азота, CO2, SO2, H2S, Cl2, NH3. Кроме этого, цеолиты могут быть использованы для удаления растворенного железа, марганца и жесткости.
В отличие от органических смол, существует ряд особенностей цеолитов. Так, общая минерализация обрабатываемой воды должна быть не менее 80 мг/л, так как при меньшем содержании солей происходит растворение алюмосиликатного каркаса цеолита. При рН обрабатываемой воды ниже 6 также возрастает вероятность разрушения кристаллической решетки.
Динамическая обменная ёмкость цеолитов ниже динамической обменной ёмкости органических смол в тех же условиях, что связано с более медленной кинетикой обмена на цеолитах. Остаточная жесткость воды после цеолитов составляет около 0,3 мг-экв/л, тогда как после органических смол — не более 0,1 мг-экв/л.
Иониты применяются для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция и магния на другие, например, натрия. Применяются они и для обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит. В пищевой промышленности иониты применяются для очистки сока сахарной свеклы от примесей при производстве сахара, используются в производстве дрожжей, глюкозы, желатина. Катиониты применяются в медицине для увеличения времени хранения крови путём замены в ней ионов кальция на ионы натрия. Широко используются иониты для выделения из растворов антибиотиков при их производстве. С помощью ионитов извлекаются редкие и рассеянные элементы из полиметаллических руд. В сельском хозяйстве иониты используются для доставки растениям необходимых им элементов[1].
АНИОНИТ — СМОЛЫ
Анионит - вид ионообменной смолы для водоподготовки. Свое наибольшее распространение получил в промышленной водоочистке. По внешнему виду напоминают полупрозрачные пластиковые бусинки диаметром около 1 мм. Аниониты, как анионообменные смолы удерживают и удаляют из воды анионы нитратов, хлоридов и сульфатов. Наряду с катионитом используется для удаления оснований и соединений из водных растворов на ТЭЦ, деминерализаторах, обессоливателях. Засыпается в ионообменный фильтр и очищает пропускаемую воду. Принцип работы базируется на реакции ионного обмена.
Основное деление по классам: сильноосновные и слабоосновные. По типу матрицы делятся на гелевые и макропористые. Эффективная работа анионообменных смол лимитируется температурным диапазоном 50°С. Температуру выше 60 градусов анионит переносит плохо.
Производство анионита сводится к процессу полимеризации дивинилбензола, как сшивателя и стирольных волокон, как обменников анионов. Путем химических реакций к нему прививаются определенные функциональные группы. От концентрации дивинилбензола зависит прочность анионообменной смолы.
В отечественной практике наибольшее распространение получили марки анионитов:
Первый применяется для водоподготовки технических растворов. Второй - водоочистка питьевых вод, электротехнических и в атомной сфере.
Купить анионит.
Покупка анионита на сайте www.smoly.ru сводится к отправке заявки на наш электронный адрес или заполнения формы заявки.
Купить анионит по оптимальным ценам на сайте можно прямо сейчас. Как производители мы гарантируем качество анионообменной смолы и полное соответствие требованиям ГОСТ 20301-74. Нашими потребителями являются теплоэнергетические компании и предприятия ВПК. Более подробно узнать о наших потребителях и получить консультацию Вы можете по телефону: 8 495 799-91-33.
Анионит, как органопоглотитель, нашел применение в создании специальных фильтрующих загрузок и для бытовых фильтров. Разрабатываются и внедряются новые технологии производственной доводки анионообменных смол до специальных требований в ионном обмене.
Виды анионита, характеристики и принцип работы.
Основная задача анионита - удаление из воды следующих групп соединений:
- Гидрокарбонаты (HCO3-)
- Сульфаты (SO42-)
- Хлориды (Cl-)
- Нитраты (NO3-)
- Силикаты (SiO32-)
Как видно все они одно- и двухвалентны и это упрощает задачу в производстве анионита: нужно привить такие функциональные группы, которые решают именно эту задачу. Для создания специальных анионообменных смол нужно понимать с какими основаниями они будут бороться в водоподготовке и основываясь на классическом ряде селективности анионов, сдвигать акценты или влево или вправо по ряду:
OH- ~ F- < HCO3- < Cl- < NO3- < PO43- < CrO42- < SO42-
Есть отличие слабоосновных и сильноосновных анионитов в диапазоне pH рабочего раствора.
Принцип работы анионита основывается на принципе равновесия ионного обмена в водных растворах и будет рассмотрен далее.
Характеристики анионита
Таблица сводных технических характеристик приведена ниже:
КАТИОНИТ — СМОЛЫ
Полифункциональный ионит. Это самый распространенный вид ионообменной смолы для водоподготовки.
Внешний вид
По внешнему виду катионит больше всего напоминает зерна пшена правильной круглой формы, но только чуть меньше в диаметре. Классический размер гранул отсеивается в диапазоне от 0,29 мм до 1,29 мм. Это самый эффективный размер для водоподготовки, так как рабочей поверхностью катионообменных смол является внешняя оболочка гранулы на которой сосредоточены ионы обмена, соответственно нужно было определить оптимальное соотношение массы к поверхности и сопоставить с производственными возможностями.
Цвет катионита, заявленный ГОСТом определяется в гамме от желтого до темно-коричневого цвета. Стоит добавить, что у отечественных ионообменных смол это как правило светло-желтый или желтый цвет с полупрозрачной структурой. На солнечном свету на воздухе гранулы просвечиваются, при помещении в воду - темнеют. Поверхность зерна прочная, ровная и гладкая, без трещин и зазубрин. Новые гранулы имеют определенную влажность, примерно 50%, уточнить можно в паспорте, это относится скорее к содержанию влаги внутри гранулы, но и внешняя влага тоже помогает гранулам не рассыпаться по поверхности. Можно даже слепить небольшую пирамидку
Классификация катионитов
Катионообменные смолы являются синтетическими органическими ионитами. Существуют еще и неорганические (природные), но применение их - это тупиковый путь развития в современной водоподготовке. Органические моно молекулы стирола и дивинилбензола составляют матрицу, к которой прививаются химическим путем фиксированные ионы (ионогенные группы). Кислотный тип ионогенных групп -СООН; -SО3Н; -РО4Н2 и определяет заряд ионита, а характер обмениваемых ионов как катионов.
Можно приводить различные деления видов, сосредоточимся лишь на важных с точки зрения распространения и областей применения этого вида ионообменной смолы.
Сильнокислотные и слабокислотные катиониты. В классике сильнокислотный может удалять жесткость (ионы жесткости) в водных растворах при любых значениях pH, но эффективно работают при показателях 2-14pH. Самые распространенные - сильнокислотные: это КУ-2-8 для технических водных растворов и КУ-2-8чС для питьевой воды. Слабокислотные работают в щелочной среде с показателями 7-14pH, но на практике при определенных условиях улавливают ионы и в более кислой среде. О методах удаления жесткости можно прочитать здесь подробнее.
Принцип работы
Принцип работы в фильтре основывается на ионном обмене. На поверхности катионита сосредоточены потенциал образующие ионы. Они имеют отрицательный заряд. Ионы диффузного слоя присутствуют рядом. Самые распространенные соли жесткости - это кальций и магний. Из водного раствора ионит на свою поверхность улавливают ионы солей, отдавая в воду натрий или водород. Каждая гранула ионита накапливает сторонние заряды до определенного предела (проскока). Теперь ионообменник нужно освободить от ненужных заряженных частиц. Пропускается раствор кислоты или поваренной соли, который снимает жесткие ионы с поверхности смолы и отправляет их в дренаж, свободное место занимает водород или натрий. Это называется регенерацией (восстановлением). Смола ионообменная вновь готова к работе.
Схематически процесс изображен на этих рисунках:
Характеристики катионита
Приведены в нижеследующей таблице:
Области применения
Как и все ионообменные смолы, катионит был специально разработан для водоподготовки. Там, где есть потребность в умягчении водных растворов применяется метод обессоливания. Марки КУ-2-8 в водородной (Н+) форме и КУ-2-8 (Na+) в натриевой форме используются в основном в тепловой энергетике и в других технолоических сферах, где есть необходимость в технической воде. КУ-2-8чС используется в водоочистке питьевых, деионизованных и демирализованных вод. О его применении в деминерализаторе можно прочитать в этой статье.
Влияние на окружающую среду
Как ионо-высокоемкий сильнокислотный сорбент с высокой температурной и химической стойкостью, механической прочностью, катионит не имеет класса опасности и может перевозиться любим видом транспорта. Упаковка в полипропиленновые мешки по 20кг позволяет исключить просыпание и загрязнение окружающей среды при доставке. Его, как и все ионообменные материалы не следует есть, не допускать попадания в глаза и не давать детям. При контакте имеет смысл вымыть руки или использовать бытовые силиконовые перчатки.
Анионит Википедия
Зёрна ионита (ионообменной смолы в данном случае)Иониты — твердые нерастворимые вещества, способные обменивать свои ионы на ионы из окружающего их раствора. Обычно это синтетические органические смолы, имеющие кислотные или щелочные группы. Иониты разделяются на катиониты, поглощающие катионы, аниониты, поглощающие анионы и амфотерные иониты, обладающие обоими этими свойствами[1]. Широко применяются иониты для опреснения вод, в аналитической химии для разделения веществ методом хроматографии, в химической технологии. Иониты распространены в природе, в частности, в почве содержатся катиониты, которые предохраняют катионы необходимых растениям элементов (например, калия) от вымывания водой и обменивают их на ионы водорода выделяемой растениями кислоты, таким образом способствуя питанию растений[2]. В зависимости от природы матрицы различают неорганические и органические иониты.
История
В 1850 году Гарри Стивен Мейси Томпсон (англ. Harry Stephen Meysey Thompson) опубликовал статью в английском журнале[3], в которой изложил результаты экспериментов, проведённых им летом 1845 года. Он пропускал дистиллированную воду c растворённым в ней сульфатом аммония через слой почвы. На выходе количество сульфата аммония в воде значительно уменьшилось, зато она стала содержать много гипса, что свидетельствовало о том, что ионы аммония задержались почвой, обменявшись на содержавшиеся в ней ионы кальция. В том же номере журнала опубликовал статью Джон Томас Уэй (англ. John Thomas Way)[4], который провёл множество экспериментов, свидетельствующих об ионообмене в почве. Оба автора ссылаются также на фермера Хакстебла (англ. Huxtable), поставившего подобный эксперимент.
В статье, датируемой 26 июля 1905 года Р. Ганс (нем. Gans) описал методы технического получения искусственных неорганических ионитов — цеолитов[5] и указал на возможность их применения для уменьшения жёсткости воды. Действие ионитов изучали российские и советские учёные К. К. Гедройц, Н. Д. Зелинский, М. С. Цвет[1]. В 1935 году Б. А. Адамс (англ. Basil Albert Adams) и Э. Л. Холмс (англ. Eric Leighton Holmes) обнаружили свойство обменивать ионы у синтетических органических полимеров[6], тем самым пополнив группу известных ионитов ионообменными смолами. В 1950 — 1960 гг. синтетические иониты исследовали М. М. Дубинин, Б. П. Никольский, Б. Н. Ласкорин[1].
Принцип действия
Иониты обычно состоят из зёрен, хотя производятся и иониты в виде мембран, волокон и тканей[1]. Возьмём для определённости катионит, содержащий катионы водорода. Если через такой катионит пропустить вещество без ионов, например, дистиллированную воду, то ни вещество, ни катионит никак не изменятся. Однако если пропустить раствор соли, то этот раствор превратится в кислоту, а катионит будет содержать уже не катионы водорода, а катионы соли — произойдёт ионообмен. Чтобы вернуть катионит в исходное состояние, через него нужно пропустить кислоту — катионы соли в катионите вновь заменятся на катионы водорода — а затем отмыть от остатков кислоты. Подобным же образом аниониты обменивают свои анионы на анионы среды, в которую их помещают[2].
Иониты состоят из полимерной матрицы и связанных с ней ионогенных групп. При диссоциации каждая ионогенная группа разделяется на фиксированный ион, связанный с матрицей, и подвижный ион, который и обменивается на ионы раствора. Обычно чем больше заряд обмениваемого иона, тем лучше ионит обменивается им, а если заряды одинаковы, лучше обмениваются ионы радиус которых больше. Например, сильнокислотные катиониты с сульфогруппами ионы калия K+ обменивают лучше, чем ионы лития Li+[1], поскольку литий и калий расположены в одной подгруппе таблицы Менделеева и атомный номер калия больше, чем у лития, поэтому и радиус иона у него больше. Другой пример: сильноосновные аниониты обменивают ионы иода I- лучше, чем ионы хлора Cl-[1], поскольку хлор и иод расположены в одной подгруппе и атомный номер иода больше, чем у хлора, поэтому и радиус иона у него больше.
Классификация
По заряду обмениваемых ионов иониты делятся на следующие типы[1]:
- Катиониты. Являясь кислотами, они поглощают положительные ионы и обменивают их на другие положительные ионы. Для регенерации катионита нужно подвергнуть его действию раствора кислоты. В свою очередь, подразделяются на следующие подтипы[1]:
- Сильнокислотные. Содержат сильно диссоциированные кислотные группы, например, сульфокислотные. Могут обменивать ионы в средах с кислой, нейтральной и щелочной реакцией.
- Слабокислотные. Содержат слабодиссоциированные кислотные группы, например, карбоксильные. Обменивают ионы только в средах с нейтральной и щелочной реакцией.
- Аниониты. Являясь основаниями, поглощают отрицательные ионы и обменивают их на другие отрицательные ионы. Для регенерации анионита его подвергают действию щёлочи. Подразделяются на следующие подтипы[1]:
- Сильноосновные. Могут обменивать ионы в средах с кислой, нейтральной и щелочной реакцией.
- Слабоосновные. Могут обменивать ионы только в средах с кислой и нейтральной реакцией.
- Среднеосновные. Содержат и группы, характерные для сильноосновных анионитов, и группы, характерные для слабоосновных анионитов.
- Амфотерные иониты или полиамфолиты. В разных ситуациях они могут вести себя или как катиониты, или как аниониты. Для регенерации амфотерных ионитов их промывают водой.
В зависимости от природы матрицы иониты делятся на неорганические и органические.
Органические иониты
Органические иониты — это в основном синтетические ионообменные смолы. Органическая матрица изготавливается путём поликонденсации мономерных органических молекул, таких как стирол, дивинилбензол, акриламид и т. д. В эту матрицу химическим путём вводятся ионогенные группы (фиксированные ионы) кислотного или основного типа. Традиционно вводимыми группами кислотного типа являются -СООН; -SО3Н; -РО4Н2 и т. п., а основного типа: ≡N; =NH; -NH2; -NR3+ и т. п. Современные ионообменные смолы, как правило, обладают высокой обменной ёмкостью и стабильностью в работе.
Иониты способны к набуханию в воде, что обусловлено присутствием гидрофильных фиксированных групп, способных к гидратации. Однако беспредельному набуханию, то есть растворению, препятствуют поперечные связи. Степень поперечной связанности задается при синтезе ионитов через количество вводимого сшивающего агента — дивинилбензола (ДВБ). Стандартные смолы, используемые для умягчения, содержат 8 % ДВБ. Доступные в настоящее время смолы могут содержать от 2 до 20 %. В целом степень набухания ионитов определяется количеством сшивки ДВБ, концентрацией гидрофильных ионогенных групп в объёме зерна ионита и тем, какие противоионы находятся в ионите. Обычно однозарядные ионы, особенно ионы водорода и гидроксила, приводят к наибольшему набуханию; многозарядные противоионы приводят к некоторому сжатию и уменьшению объёма зерен.
Неорганические иониты
Неорганические иониты — это в основном иониты природного происхождения, к которым относятся алюмосиликаты, гидроксиды и соли поливалентных металлов. Наиболее распространенными и применяемыми для очистки воды неорганическими природными ионитами являются цеолиты.
Цеолиты — это минералы из группы водных алюмосиликатов щелочных и щелочноземельных элементов, которые характеризуются наличием трехмерного алюмокремнекислородного каркаса, образующего системы полостей и каналов, в которых расположены щелочные, щелочноземельные катионы и молекулы воды. Общий объём системы полостей и каналов цеолита составляет до 50 % объёма каркаса цеолита. Катионы и молекулы воды слабо связаны с каркасом и могут быть частично или полностью замещены путём ионного обмена и дегидрации. Ионообменные свойства цеолитов определяются особенностями химического сродства ионов и кристаллической структуры цеолита. При этом необходимо соответствие размеров входных отверстий в цеолитовый каркас и замещающих ионов, так как каркас цеолита имеет жесткую кристаллическую структуру и, в отличие от органических смол, не может набухать с изменением объёма.
Ионным обменом на цеолитах удается выделять ионы, извлечение которых другим методом часто представляет большую сложность. Установлена способность цеолитов адсорбировать радиоактивные ионы цезия из растворов, удалять NH4+, извлекать ионы Cu, Pb, Zn, Cd, Ba, Co, Ag и других металлов, очищать природные газы. Ионоситовый эффект позволяет адсорбировать из газовых и жидких систем пары азота, CO2, SO2, H2S, Cl2, NH3. Кроме этого, цеолиты могут быть использованы для удаления растворенного железа, марганца и жесткости.
В отличие от органических смол, существует ряд особенностей цеолитов. Так, общая минерализация обрабатываемой воды должна быть не менее 80 мг/л, так как при меньшем содержании солей происходит растворение алюмосиликатного каркаса цеолита. При рН обрабатываемой воды ниже 6 также возрастает вероятность разрушения кристаллической решетки.
Динамическая обменная ёмкость цеолитов ниже динамической обменной ёмкости органических смол в тех же условиях, что связано с более медленной кинетикой обмена на цеолитах. Остаточная жесткость воды после цеолитов составляет около 0,3 мг-экв/л, тогда как после органических смол — не более 0,1 мг-экв/л.
Применение
Иониты применяются для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция и магния на другие, например, натрия. Применяются они и для обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит. В пищевой промышленности иониты применяются для очистки сока сахарной свеклы от примесей при производстве сахара, используются в производстве дрожжей, глюкозы, желатина. Катиониты применяются в медицине для увеличения времени хранения крови путём замены в ней ионов кальция на ионы натрия. Широко используются иониты для выделения из растворов антибиотиков при их производстве. С помощью ионитов извлекаются редкие и рассеянные элементы из полиметаллических руд. В сельском хозяйстве иониты используются для доставки растениям необходимых им элементов[1].
Примечания
Анионит Википедия
Зёрна ионита (ионообменной смолы в данном случае)Иониты — твердые нерастворимые вещества, способные обменивать свои ионы на ионы из окружающего их раствора. Обычно это синтетические органические смолы, имеющие кислотные или щелочные группы. Иониты разделяются на катиониты, поглощающие катионы, аниониты, поглощающие анионы и амфотерные иониты, обладающие обоими этими свойствами[1]. Широко применяются иониты для опреснения вод, в аналитической химии для разделения веществ методом хроматографии, в химической технологии. Иониты распространены в природе, в частности, в почве содержатся катиониты, которые предохраняют катионы необходимых растениям элементов (например, калия) от вымывания водой и обменивают их на ионы водорода выделяемой растениями кислоты, таким образом способствуя питанию растений[2]. В зависимости от природы матрицы различают неорганические и органические иониты.
История[ | ]
В 1850 году Гарри Стивен Мейси Томпсон (англ. Harry Stephen Meysey Thompson) опубликовал статью в английском журнале[3], в которой изложил результаты экспериментов, проведённых им летом 1845 года. Он пропускал дистиллированную воду c растворённым в ней сульфатом аммония через слой почвы. На выходе количество сульфата аммония в воде значительно уменьшилось, зато она стала содержать много гипса, что свидетельствовало о том, что ионы аммония задержались почвой, обменявшись на содержавшиеся в ней ионы кальция. В том же номере журнала опубликовал статью Джон Томас Уэй (англ. John Thomas Way)[4], который провёл множество экспериментов, свидетельствующих об ионообмене в почве. Оба автора ссылаются также на фермера Хакстебла (англ. Huxtable), поставившего подобный эксперимент.
В статье, датируемой 26 июля 1905 года Р. Ганс (нем. Gans) описал методы технического получения искусственных неорганических ионитов — цеолитов[5] и указал на возможность их применения для уменьшения жёсткости воды. Действие ионитов изучали российские и советские учёные К. К. Гедройц, Н. Д. Зелинский, М. С. Цвет[1]. В 1935 году Б. А. Адамс (англ. Basil Albert Adams) и Э. Л. Холмс (англ. Eric Leighton Holmes) обнаружили свойство обменивать ионы у синтетических органических полимеров[6], тем самым пополнив группу известных ионитов ионообменными смолами. В 1950 — 1960 гг. синтетические иониты исследовали М. М. Дубинин, Б. П. Никольский, Б. Н. Ласкорин[1].
Принцип действия[
Иониты и ионообменные смолы: катионит, анионит, обменная емкость.
ТОВАРЫ
Купить анионитАнионит (анионообменная смола) применяется для очистки воды от вредных органических примесей - анионов минеральных и органических кислот. Цена в СПб за 1 литр составляет...
Ионообменный фильтр от железа и органикиИонообменные фильтры предназначены для удаления из воды ионов, концентрация которых превышает нормативы. Чаще всего это ионы кальция, магния, железа, марганца, органических примесей...
Иониты
Иониты — твердые, нерастворимые полиэлектролиты, природные или искусственные (синтетические) материалы, широко используемые для процессов очистки воды: от катионов кальция и магния (умягчения), от анионов органических кислот, деминерализации и некоторых других специальных применений.
По химической природе иониты бывают неорганическими (минеральными) и органическими.
Наиболее характерными природными неорганическими ионитами являются цеолиты. К ионитам также можно отнести глины, слюду, оксиды графита, соли поликислот титана, ванадия и многие другие соединения.
Ионообменные смолы
Синтетические, искусственно полученные иониты называются ионообменными смолами.
Ионообменные смолы – это высокомолекулярные поперечно сшитые соединения, образующие полимерную матрицу, содержащую функциональные группы кислотного или основного типа, которые диссоциируют или способны ионизироваться в воде.
- функциональными группами кислотного типа являются: -СООН; -SО3Н; -РО4Н2 и др.
- функциональными группами основного типа являются: ≡N; =NH; -NH2; -NR3+ и др.
По внешнему виду ионообменные смолы - это сферические материал диаметром от 0,3 до 2,0 мм (основной размер в пределах 0,5..0,8 мм), от почти бесцветного до желто-коричневого цвета, как правило, слегка слипшиеся (поскольку влажные).
По структуре ионообменные смолы могут обладать гелевой, макропористой и промежуточной структурой, что определяется степенью сшивки полимерных молекул. Гелевая ионообменная смола обладает способностью к ионному обмену только во влажном (набухшем) состоянии, потому что у нее отсутствует истинная пористость. Макропористая ионообменная смола характеризуется наличием пор, имеющих развитую поверхность, поэтому она способна к ионному обмену как в набухшем, так и в не набухшем состоянии.
Схема зерна ионообменной смолы, анионита и катионита соответственно, в общем виде выглядит так:
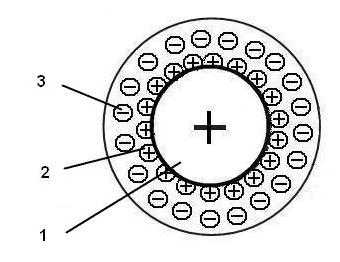
- полимерная матрица
- ионные функциональные группы полимерной матрицы
- противоионы
Упомянутые выше функциональные группы способны вступать в реакции ионного обмена с ионами растворенных веществ (примесями - применительно к воде). Если матрицу ионообменной смолы обозначить как R, то реакция такого обмена выглядит:
а) R- – H+ + Na+ + Cl- → R- – Na+ + H+ + Cl-
б) R+ – OH- + Na+ + Cl- → R+ – Cl- + Na+ + OH-
По такой реакции легко обмениваются катионы солей жесткости, ионы железа, марганца.
Из вышеприведенных реакций видно, что ионообменные смолы могут обменивать катионы (а) – в таком случае они называются катионитами, или обменивать анионы (б) – в этом случае они называются анионитами. Кроме указанных ионообменных реакций на ионообменных смолах возможны реакции комплексообразования и окислительно-восстановительные, а также физическая сорбция.
Сорбционные свойства ионообменных смол определяются не только характером функциональных групп, но и кислотностью (водородным показателем рН) очищаемой воды.
Классификация ионообменных смол
В зависимости от функциональных групп, введенных в полимерную цепь ионообменной смолы, различают:
- -SO3H - сильнокислотный катионит,
- -COOH - слабокислотный катионит.
Сильнокислотный катионит обменивает катионы любой степени диссоциации в растворах при всех возможных значениях рН. Слабокислотный катионит обменивает катионы из растворов кислот при значениях рН >5.
- -NH2, =NH, ≡N - слабоосновный анионит,
- -NR3+Hal- - сильноосновный анионит.
Сильноосновный анионит обменивает анионы любой степени диссоциации в растворах при всех возможных значениях рН. Слабоосновный анионит обменивает анионы из растворов щелочей при значениях рН <8..9.
Характеристики ионитов и ионообменных смол
Важнейшими характеристиками ионитов являются:
- полная (общая) обменная емкость — это максимальное число милиграмм-эквивалентов (мг-экв) ионов вещества, поглощаемых единицей массы или объема ионита в условиях равновесия с раствором электролита,
- динамическая (рабочая) обменная емкость - это максимальное число мг-экв ионов, поглощаемых единицей массы или объема в условиях фильтрации раствора через слой ионита до «проскока» ионов в фильтрат.
Значения полной обменной ёмкости большинства ионообменных смол лежат в пределах 2..5 мг-экв/г (1..2,5 г-экв/дм3). Процедура определения обменной ёмкости стандартизована.
Динамическая (рабочая) обменная ёмкость всегда меньше статической в связи с тем, что она зависит от следующих факторов:
- природы ионообменной смолы,
- его гранулометрической состава,
- качества исходной воды, причем зависимость определяется не только общим количеством улавливаемых ионов, но и их соотношением друг с другом, наличием в исходной воде железа, марганца, органических примесей,
- значения рН исходной воды, ее температуры и температуры регенерационного раствора,
- равномерности прохождения очищаемой воды через слой ионита,
- природы регенеранта, его чистоты, концентрации, удельного расхода,
- требуемых показателей качества получаемой воды после фильтрования через ионообменную смолу,
- высоты слоя ионита, скорости рабочего, регенерационного и взрыхляющего фильтрования,
- удельного расхода отмывочной воды,
- площади фильтрования (площади горизонтального сечения фильтра),
- добавления к регенерационному раствору комплексообразователей и других факторов.
Как заказать и купить фильтр для воды
Ионообменные смолы — Википедия
Материал из Википедии — свободной энциклопедии
Ионообменные смолы — синтетические органические иониты — высокомолекулярные синтетические соединения с трехмерной гелевой и макропористой структурой, которые содержат функциональные группы кислотной или основной природы, способные к реакциям ионного обмена.
Ионообменные смолы представляют собой твёрдые полимеры, нерастворимые, ограниченно набухающие в растворах электролитов и органических растворителях. Они способны к ионному обмену в водных и водноорганических растворах.
Ионообменные смолы получают путём полимеризации или поликонденсации.
Ионообменные смолы относятся к следующим классам:
- Катионнообменные смолы (катиониты) — содержат кислотные группы
- Анионообменные смолы (аниониты) — содержат основные группы
- Амфотерные ионообменные смолы — содержат одновременно и кислотные, и основные группы
- Селективные ионообменные смолы — содержат комплексообразующие группы
- Окислительно-восстановительные смолы — содержат функциональные группы, способные к изменению зарядов ионов
Кроме того, ионообменные смолы могут содержать группы различных классов, относясь к полифункциональным смолам.
По структуре матрицы ионообменные смолы делятся на:
- гелевые — микропоры имеют молекулярные размеры. Они представляют собой гомогенные поперечносвязанные полимеры. Фиксированные ионы равномерно распределены по всему объему полимера. Гелевые ионообменные смолы обладают высокой обменной емкостью, однако характеризуются невысокой скоростью обмена
- макропористые — размеры пор смолы имеют размеры в десятки нанометров. Имеют фиксированную систему пор и каналов, определяемую условиями синтеза. Обменная ёмкость таких смол меньше, чем гелевых при высокой скорости обмена
Как правило, ионообменные смолы получают методами полимеризации или полимераналогичных превращений.
Для получения ионообменных смол методом полимеризации используют мономеры, содержащие ионогенные группы. В случае полимераналогичных превращений ионогенные группы вводятся в инертный полимер.
Возможен синтез ионообменных смол способом поликонденсации, однако эти ионообменные смолы имеют менее однородную структуру, меньшую осмотическую стабильность и химическую стойкость.
Чаще всего используются сетчатые полимеры. Их получают суспензионной полимеризацией стирола, производных акриловой кислоты, винилпиридинов с диенами.
Ионообменные смолы в основном применяются:
- для умягчения и обессоливания воды в теплоэнергетике и других отраслях;
- для разделения и выделения цветных и редких металлов в гидрометаллургии;
- при очистке возвратных и сточных вод;
- для регенерации отходов гальванотехники и металлообработки;
- для разделения и очистки различных веществ в химической промышленности;
- в качестве катализатора для органического синтеза.
Ионообменные смолы используются в котельных, теплоэлектростанциях, атомных станциях, пищевой промышленности (при производстве сахара, алкогольных, слабоалкогольных и других напитков, пива, бутилированной воды), фармацевтической промышленности и других отраслях.
- Даффа реакция — Меди// Химическая энциклопедия в 5 томах. — М.: Большая Российская Энциклопедия, 1990. — Т. 2. — 671 с.
Cиликагель и анионит: применение
 Силикагель применение
Силикагель применение
Силикагели являются поликремниевыми кислотами в виде гель-сорбентов. Внешне они похожи на зерна, полупрозрачны, не обладают запахом цвет в основном белый, но бывают и желтые. Согласно физическим характеристикам, силикагель обладает практически нулевой растворимостью во всех водных растворах, а так же в активных химических растворителях. Отличается высокой хрупкостью. Сам гель получен из щелочных силикатов и в конце производства усушен до состояния геля.
Основной областью применения этого вещества является осушение окружающей среды. Так, его активно применяют на производстве, в местах, где необходимо бороться с высокой влажностью, а так же для удаления влаги из газов и газо-воздушных смесей. Является так же консервантом для длительного хранения стальных агрегатов, так как помогает бороться с возможной коррозией. Зачастую, силикагель является главным адсорбентом во многих лабораториях в случае, когда требуется удалить влагу из газов. Помимо всего прочего иногда он выступает катализатором химических процессов.
Применение анионита
 Область применения анионитов
Область применения анионитов
Анионит это специальная ионообменная смола, представляющая собой высокомолекулярное вещество, нерастворимое во многих средах. Анионит обладает способностью участвовать в ионообменных реакциях благодаря тому, что имеет в своём составе особые функциональные группы. Состав анионита это нерастворимая матричная основа в виде маленьких гранул не больше одного миллиметра в диаметре тёмно или светло-желтого оттенка.
Анионит получается из стирола благодаря сополимеризации с дивинилбензола, который добавляется в количестве около восьми процентов, для обеспечения поперечной сшивки полистирола. После этого анионит поступает на обработку химическими реагентами, на этом этапе так же прививаются функциональные группы. Они выполняют замещающую функцию ионов водорода в бензольном кольце. Аниониты обладают широким спектром физических и химических свойств.
Анионит имеет в первую очередь характеристику гранулометрического состава, описание структуры и механической прочности, а также насыпная масса и степень набухания в растворах. Что касается основных химических свойств, то в первую очередь это химическая и термическая стойкость, ёмкость обмена. К примеру, рассмотрим анионит АВ-17-8чс. Как и любой другой анионит, он может иметь окраску от светло-желтого до тёмно-желтого цвета. Данная ионообменная смола обладает большой многофункциональностью, макропористой гелевой структурой. Это достаточно высокомолекулярный полимер. Анионит АВ-17-8чс содержит бензилтриметиламмоний один из видов ионогенных групп.
В водных растворах и воде производит реакцию обмена анионитами. К слову, среди анионитов существует разделение по степени диссоциации. Они бывают сильно и слабоэлектролитные, которые умеют обмениваться ионами при широком диапазоне уровня рН. Сильноосновные обмениваются с анионами сильных и слабых кислот. Что касается слабоэлектролитных анионитов, то их область применения находится в узкой области рН. Аниониты в сильно кислой среде, и обмениваются анионами лишь с сильными кислотами, а катионы работают только в щелочной среде. Область применения анионита АВ-17-8чс располагается в сфере водоочистки от слабодиссоциирующих кислот (в основном это угольная и кремниевая кислоты), очистки воды для пищевой и химической промышленности, а так же широко применяется как смягчитель и обессоливатель воды в гидрометаллургии.
Поделиться ссылкой:
Иониты - это... Что такое Иониты?
Иониты — твердые нерастворимые вещества, способные обменивать свои ионы на ионы из окружающего их раствора. Обычно это синтетические органические смолы, имеющие кислотные или щелочные группы. Иониты разделяются на катиониты, поглощающие катионы, и аниониты, поглощающие анионы. Широко применяются иониты для опреснения вод, в аналитической химии для разделения веществ методом хроматографии, в химической технологии. В зависимости от природы матрицы различают неорганические и органические иониты.
Органические иониты
Органические иониты — это в основном синтетические ионообменные смолы. Органическая матрица изготавливается путем поликонденсации мономерных органических молекул, таких как стирол, дивинилбензол, акриламид и т. д. В эту матрицу химическим путем вводятся ионогенные группы (фиксированные ионы) кислотного или основного типа. Традиционно вводимыми группами кислотного типа являются -СООН; -SО3Н; -РО4Н2 и т. п., а основного типа: ≡N; =NH; -NH2; -NR3+ и т. п. Современные ионообменные смолы, как правило, обладают высокой обменной ёмкостью и стабильностью в работе.
Иониты способны к набуханию в воде, что обусловлено присутствием гидрофильных фиксированных групп, способных к гидратации. Однако беспредельному набуханию, то есть растворению, препятствуют поперечные связи. Степень поперечной связанности задается при синтезе ионитов через количество вводимого сшивающего агента — дивинилбензола (ДВБ). Стандартные смолы, используемые для умягчения, содержат 8 % ДВБ. Доступные в настоящее время смолы могут содержать от 2 до 20 %. В целом степень набухания ионитов определяется количеством сшивки ДВБ, концентрацией гидрофильных ионогенных групп в объеме зерна ионита и тем, какие противоионы находятся в ионите. Обычно однозарядные ионы, особенно ионы водорода и гидроксила, приводят к наибольшему набуханию; многозарядные противоионы приводят к некоторому сжатию и уменьшению объема зерен.
Неорганические иониты
Неорганические иониты — это в основном иониты природного происхождения, к которым относятся алюмосиликаты, гидроксиды и соли поливалентных металлов. Наиболее распространенными и применяемыми для очистки воды неорганическими природными ионитами являются цеолиты.
Цеолиты — это минералы из группы водных алюмосиликатов щелочных и щелочноземельных элементов, которые характеризуются наличием трехмерного алюмокремнекислородного каркаса, образующего системы полостей и каналов, в которых расположены щелочные, щелочноземельные катионы и молекулы воды. Общий объем системы полостей и каналов цеолита составляет до 50 % объема каркаса цеолита. Катионы и молекулы воды слабо связаны с каркасом и могут быть частично или полностью замещены путем ионного обмена и дегидрации. Ионообменные свойства цеолитов определяются особенностями химического сродства ионов и кристаллической структуры цеолита. При этом необходимо соответствие размеров входных отверстий в цеолитовый каркас и замещающих ионов, так как каркас цеолита имеет жесткую кристаллическую структуру и в отличие от органических смол не может набухать с изменением объема.
Ионным обменом на цеолитах удается выделять ионы, извлечение которых другим методом часто представляет большую сложность. Установлена способность цеолитов адсорбировать радиоактивные ионы цезия из растворов, удалять NH4+, извлекать ионы Cu, Pb, Zn, Cd, Ba, Co, Ag и других металлов, очищать природные газы. Ионоситовый эффект позволяет адсорбировать из газовых и жидких систем пары азота, CO2, SO2, H2S, Cl2, NH3. Кроме этого, цеолиты могут быть использованы для удаления растворенного железа, марганца и жесткости.
В отличие от органических смол существует ряд особенностей цеолитов. Так, общая минерализация обрабатываемой воды должна быть не менее 80 мг/л, так как при меньшем содержании солей происходит растворение алюмосиликатного каркаса цеолита. При рН обрабатываемой воды ниже 6 также возрастает вероятность разрушения кристаллической решетки.
Динамическая обменная емкость цеолитов ниже динамической обменной емкости органических смол в тех же условиях, что связано с более медленной кинетикой обмена на цеолитах. Остаточная жесткость воды после цеолитов составляет около 0,3 мг-экв/л, тогда как после органических смол — не более 0,1 мг-экв/л.
См. также
Иониты — Википедия. Что такое Иониты
Зёрна ионита (ионообменной смолы в данном случае)Иониты — твердые нерастворимые вещества, способные обменивать свои ионы на ионы из окружающего их раствора. Обычно это синтетические органические смолы, имеющие кислотные или щелочные группы. Иониты разделяются на катиониты, поглощающие катионы, аниониты, поглощающие анионы и амфотерные иониты, обладающие обоими этими свойствами[1]. Широко применяются иониты для опреснения вод, в аналитической химии для разделения веществ методом хроматографии, в химической технологии. Иониты распространены в природе, в частности, в почве содержатся катиониты, которые предохраняют катионы необходимых растениям элементов (например, калия) от вымывания водой и обменивают их на ионы водорода выделяемой растениями кислоты, таким образом способствуя питанию растений[2]. В зависимости от природы матрицы различают неорганические и органические иониты.
История
В 1850 году Гарри Стивен Мейси Томпсон (англ. Harry Stephen Meysey Thompson) опубликовал статью в английском журнале[3], в которой изложил результаты экспериментов, проведённых им летом 1845 года. Он пропускал дистиллированную воду c растворённым в ней сульфатом аммония через слой почвы. На выходе количество сульфата аммония в воде значительно уменьшилось, зато она стала содержать много гипса, что свидетельствовало о том, что ионы аммония задержались почвой, обменявшись на содержавшиеся в ней ионы кальция. В том же номере журнала опубликовал статью Джон Томас Уэй (англ. John Thomas Way)[4], который провёл множество экспериментов, свидетельствующих об ионообмене в почве. Оба автора ссылаются также на фермера Хакстебла (англ. Huxtable), поставившего подобный эксперимент.
В статье, датируемой 26 июля 1905 года Р. Ганс (нем. Gans) описал методы технического получения искусственных неорганических ионитов — цеолитов[5] и указал на возможность их применения для уменьшения жёсткости воды. Действие ионитов изучали российские и советские учёные К. К. Гедройц, Н. Д. Зелинский, М. С. Цвет[1]. В 1935 году Б. А. Адамс (англ. Basil Albert Adams) и Э. Л. Холмс (англ. Eric Leighton Holmes) обнаружили свойство обменивать ионы у синтетических органических полимеров[6], тем самым пополнив группу известных ионитов ионообменными смолами. В 1950 — 1960 гг. синтетические иониты исследовали М. М. Дубинин, Б. П. Никольский, Б. Н. Ласкорин[1].
Принцип действия
Иониты обычно состоят из зёрен, хотя производятся и иониты в виде мембран, волокон и тканей[1]. Возьмём для определённости катионит, содержащий катионы водорода. Если через такой катионит пропустить вещество без ионов, например, дистиллированную воду, то ни вещество, ни катионит никак не изменятся. Однако если пропустить раствор соли, то этот раствор превратится в кислоту, а катионит будет содержать уже не катионы водорода, а катионы соли — произойдёт ионообмен. Чтобы вернуть катионит в исходное состояние, через него нужно пропустить кислоту — катионы соли в катионите вновь заменятся на катионы водорода — а затем отмыть от остатков кислоты. Подобным же образом аниониты обменивают свои анионы на анионы среды, в которую их помещают[2].
Иониты состоят из полимерной матрицы и связанных с ней ионогенных групп. При диссоциации каждая ионогенная группа разделяется на фиксированный ион, связанный с матрицей, и подвижный ион, который и обменивается на ионы раствора. Обычно чем больше заряд обмениваемого иона, тем лучше ионит обменивается им, а если заряды одинаковы, лучше обмениваются ионы радиус которых больше. Например, сильнокислотные катиониты с сульфогруппами ионы калия K+ обменивают лучше, чем ионы лития Li+[1], поскольку литий и калий расположены в одной подгруппе таблицы Менделеева и атомный номер калия больше, чем у лития, поэтому и радиус иона у него больше. Другой пример: сильноосновные аниониты обменивают ионы иода I- лучше, чем ионы хлора Cl-[1], поскольку хлор и иод расположены в одной подгруппе и атомный номер иода больше, чем у хлора, поэтому и радиус иона у него больше.
Классификация
По заряду обмениваемых ионов иониты делятся на следующие типы[1]:
- Катиониты. Являясь кислотами, они поглощают положительные ионы и обменивают их на другие положительные ионы. Для регенерации катионита нужно подвергнуть его действию раствора кислоты. В свою очередь, подразделяются на следующие подтипы[1]:
- Сильнокислотные. Содержат сильно диссоциированные кислотные группы, например, сульфокислотные. Могут обменивать ионы в средах с кислой, нейтральной и щелочной реакцией.
- Слабокислотные. Содержат слабодиссоциированные кислотные группы, например, карбоксильные. Обменивают ионы только в средах с нейтральной и щелочной реакцией.
- Аниониты. Являясь основаниями, поглощают отрицательные ионы и обменивают их на другие отрицательные ионы. Для регенерации анионита его подвергают действию щёлочи. Подразделяются на следующие подтипы[1]:
- Сильноосновные. Могут обменивать ионы в средах с кислой, нейтральной и щелочной реакцией.
- Слабоосновные. Могут обменивать ионы только в средах с кислой и нейтральной реакцией.
- Среднеосновные. Содержат и группы, характерные для сильноосновных анионитов, и группы, характерные для слабоосновных анионитов.
- Амфотерные иониты или полиамфолиты. В разных ситуациях они могут вести себя или как катиониты, или как аниониты. Для регенерации амфотерных ионитов их промывают водой.
В зависимости от природы матрицы иониты делятся на неорганические и органические.
Органические иониты
Органические иониты — это в основном синтетические ионообменные смолы. Органическая матрица изготавливается путём поликонденсации мономерных органических молекул, таких как стирол, дивинилбензол, акриламид и т. д. В эту матрицу химическим путём вводятся ионогенные группы (фиксированные ионы) кислотного или основного типа. Традиционно вводимыми группами кислотного типа являются -СООН; -SО3Н; -РО4Н2 и т. п., а основного типа: ≡N; =NH; -NH2; -NR3+ и т. п. Современные ионообменные смолы, как правило, обладают высокой обменной ёмкостью и стабильностью в работе.
Иониты способны к набуханию в воде, что обусловлено присутствием гидрофильных фиксированных групп, способных к гидратации. Однако беспредельному набуханию, то есть растворению, препятствуют поперечные связи. Степень поперечной связанности задается при синтезе ионитов через количество вводимого сшивающего агента — дивинилбензола (ДВБ). Стандартные смолы, используемые для умягчения, содержат 8 % ДВБ. Доступные в настоящее время смолы могут содержать от 2 до 20 %. В целом степень набухания ионитов определяется количеством сшивки ДВБ, концентрацией гидрофильных ионогенных групп в объёме зерна ионита и тем, какие противоионы находятся в ионите. Обычно однозарядные ионы, особенно ионы водорода и гидроксила, приводят к наибольшему набуханию; многозарядные противоионы приводят к некоторому сжатию и уменьшению объёма зерен.
Неорганические иониты
Неорганические иониты — это в основном иониты природного происхождения, к которым относятся алюмосиликаты, гидроксиды и соли поливалентных металлов. Наиболее распространенными и применяемыми для очистки воды неорганическими природными ионитами являются цеолиты.
Цеолиты — это минералы из группы водных алюмосиликатов щелочных и щелочноземельных элементов, которые характеризуются наличием трехмерного алюмокремнекислородного каркаса, образующего системы полостей и каналов, в которых расположены щелочные, щелочноземельные катионы и молекулы воды. Общий объём системы полостей и каналов цеолита составляет до 50 % объёма каркаса цеолита. Катионы и молекулы воды слабо связаны с каркасом и могут быть частично или полностью замещены путём ионного обмена и дегидрации. Ионообменные свойства цеолитов определяются особенностями химического сродства ионов и кристаллической структуры цеолита. При этом необходимо соответствие размеров входных отверстий в цеолитовый каркас и замещающих ионов, так как каркас цеолита имеет жесткую кристаллическую структуру и, в отличие от органических смол, не может набухать с изменением объёма.
Ионным обменом на цеолитах удается выделять ионы, извлечение которых другим методом часто представляет большую сложность. Установлена способность цеолитов адсорбировать радиоактивные ионы цезия из растворов, удалять NH4+, извлекать ионы Cu, Pb, Zn, Cd, Ba, Co, Ag и других металлов, очищать природные газы. Ионоситовый эффект позволяет адсорбировать из газовых и жидких систем пары азота, CO2, SO2, H2S, Cl2, NH3. Кроме этого, цеолиты могут быть использованы для удаления растворенного железа, марганца и жесткости.
В отличие от органических смол, существует ряд особенностей цеолитов. Так, общая минерализация обрабатываемой воды должна быть не менее 80 мг/л, так как при меньшем содержании солей происходит растворение алюмосиликатного каркаса цеолита. При рН обрабатываемой воды ниже 6 также возрастает вероятность разрушения кристаллической решетки.
Динамическая обменная ёмкость цеолитов ниже динамической обменной ёмкости органических смол в тех же условиях, что связано с более медленной кинетикой обмена на цеолитах. Остаточная жесткость воды после цеолитов составляет около 0,3 мг-экв/л, тогда как после органических смол — не более 0,1 мг-экв/л.
Применение
Иониты применяются для уменьшения жёсткости воды путём замены обусловливающих её ионов кальция и магния на другие, например, натрия. Применяются они и для обессоливания воды, при этом удаляются и катионы, и анионы путём последовательного прохождения воды через катионит и анионит. В пищевой промышленности иониты применяются для очистки сока сахарной свеклы от примесей при производстве сахара, используются в производстве дрожжей, глюкозы, желатина. Катиониты применяются в медицине для увеличения времени хранения крови путём замены в ней ионов кальция на ионы натрия. Широко используются иониты для выделения из растворов антибиотиков при их производстве. С помощью ионитов извлекаются редкие и рассеянные элементы из полиметаллических руд. В сельском хозяйстве иониты используются для доставки растениям необходимых им элементов[1].
Примечания
Иониты - это... Что такое Иониты?
ионообменники, ионообменные сорбенты, твёрдые, практически нерастворимые вещества или материалы, способные к ионному обмену (См. Ионный обмен). И. могут поглощать из растворов электролитов (солей, кислот и щелочей) положительные или отрицательные ионы (катионы или анионы), выделяя в раствор взамен поглощённых эквивалентное количество других ионов, имеющих заряд того же знака. Молекулярную структуру И. можно представить в виде пространственной сетки или решётки, несущей неподвижные (фиксированные) ионы, заряд которых компенсируют противоположно заряженные подвижные ионы, так называемые противоионы. Они-то и участвуют в ионном обмене с раствором. По знаку заряда обменивающихся ионов И. делят на катиониты и аниониты. Первые проявляют кислотные свойства, вторые — основные. Если И. способны обменивать и катионы и анионы, их называют амфотерными. По химической природе И. бывают неорганическими (минеральными) и органическими, по происхождению — природными и искусственными, или синтетическими. И. подразделяют на типы и группы по специфическим свойствам, особенностям структуры, назначению и т. п. В частности, И., имеющие достаточно плотную структурную сетку с «окнами» определённого размера и избирательно поглощающие лишь те ионы, которые способны пройти в эти «окна», называют ионитовыми ситами (см. также Молекулярные сита). Из неорганических И. практическое значение имеют природные и синтетические алюмосиликаты (некоторые глинистые минералы, Цеолиты, Пермутиты), гидроокиси и соли многовалентных металлов, например гидроокись и фосфат циркония. Находят применение И., полученные химической обработкой угля, целлюлозы, лигнина и др. Однако ведущая роль принадлежит синтетическим органическим И. — ионообменным смолам (См. Ионообменные смолы).Важнейшее свойство И. — поглотительная способность, так называемая обменная ёмкость (о. ё.). Её выражают максимальным числом мг-экв ионов, поглощаемых единицей массы или объёма И. в условиях равновесия с раствором электролита (статическая о. ё.) или в условиях фильтрации раствора через слой И. до «проскока» ионов в фильтрат (динамическая о. ё.). Значения о. ё. большинства И. лежат в пределах 2—10 мг-экв/г. Определения о. ё. стандартизованы; динамическая (рабочая) о. ё. всегда меньше статической.
Кроме высокой о. ё., к И. предъявляют требования механической прочности (главным образом на истирание), термической и химической стойкости. И. обычно выдерживают длительный срок службы и легко поддаются многократной регенерации.
В зависимости от способа получения и назначения И. выпускают в различных товарных формах: в виде порошка, зёрен неправильной формы или сферических гранул, волокнистого материала, листов или плёнок (ионитовых мембран). На международный рынок И. поступают под фирменными названиями: амберлиты (США, Япония), дуолиты (США, Франция), дауэксы (США), зеролиты (Великобритания), леватиты (ФРГ), вофатиты (ГДР) и многие др. Основные промышленные марки отечественных И.: катиониты КУ-1, КУ-2, СГ-1, КБ-2, КБ-4, аниониты АВ-16, АВ-17, АН-1, АН-2Ф, АН-18, АН-31, ЭДЭ-10П.
Важнейшей областью применения И. была и остаётся Водоподготовка. С помощью ионитовых фильтров получают деминерализованную (обессоленную) воду для паросиловых установок, многих современных технологических процессов и бытовых нужд. Ионитовые фильтры и электродиализные установки с ионитовыми мембранами применяют для опреснения морской или грунтовой воды с высоким солесодержанием. В гидрометаллургии (См. Гидрометаллургия) И. используют в процессах обогащения сырья, разделения и очистки редких элементов. И. позволяют извлекать золото, платину, серебро, медь, хром, уран и др. металлы из растворов. Переработка радиоактивных отходов, удаление многих вредоносных примесей из сточных вод также успешно осуществляются с использованием И.В химической промышленности И. применяют для очистки или выделения продуктов органического и неорганического синтеза, в качестве катализаторов, как средство аналитического контроля технологических процессов. В пищевой промышленности И. используют при рафинировании сахара, для улучшения качества вин и соков, в производстве витаминов и лекарственных препаратов. С их помощью из растительного и животного сырья извлекают ценные продукты биологического синтеза, консервируют плазму крови, лечат некоторые заболевания. И. всё шире применяют в производственной практике, науке и быту.
Лит.: Гельферих Ф., Иониты, пер. с нем., М., 1962; Салдадзе К. М., Пашков А. Б., Титов В. С., Ионообменные высокомолекулярные соединения, М., 1960; Амфлетт Ч., Неорганические иониты, пер. с англ., М., 1966; Ионообменная технология под ред. Ф. Находа и Дж. Шуберта, пер. с англ., М., 1959; Тремийон Б., Разделение на ионообменных смолах, пер. с франц., М., 1967.
Л. А. Шиц.