Бикарбонат кальция что это такое
Карбонат кальция — Википедия
Карбона́т ка́льция (углеки́слый кальций) — неорганическое химическое соединение, соль угольной кислоты и кальция. Химическая формула CaCO3{\displaystyle {\mathsf {CaCO_{3}}}}.
В природе встречается в виде многочисленных минералов, например, кальцита, арагонита и ватерита, является главной составной частью известняка, мрамора, мела, входит в состав скорлупы яиц птиц.
Нерастворим в воде и этаноле.
Зарегистрирован как белый пищевой краситель (E170).
Используется как белый пищевой краситель Е170. Являясь основой мела, используется для письма на досках. Используется в быту для побелки потолков, покраски стволов деревьев, для подщелачивания почвы в садоводстве.
Массовое производство/использование[править | править код]
Таблетки из карбоната кальцияОчищенный от примесей, карбонат кальция широко используется в бумажной и пищевой промышленности, в качестве наполнителя при производстве пластмасс, красок, резины, продукции бытовой химии, в строительстве.
При производстве бумаги карбонат кальция применяют одновременно в качестве отбеливателя, наполнителя, а также раскислителя.
Используется при производстве силикатного стекла, — материала для производства оконного стекла, стеклянных бутылок, стекловолокна.
Применяется при производстве предметов гигиены (например, зубной пасты), в медицине.
В пищевой промышленности часто используется в качестве препарата препятствующего слеживанию и для препятствования слипания в комки сухих молочных продуктах.
При употреблении сверх рекомендованной дозы (1,5 г в день) может вызывать молочно-щелочной синдром (синдром Бернетта). Рекомендован при болезнях костных тканей[источник не указан 534 дня].
Производители пластмассы — одни из основных потребителей чистого карбоната кальция (более 50% всего потребления). Используемый в качестве наполнителя и красителя, карбонат кальция необходим при производстве поливинилхлорида (PVC), полиэфирных волокон (кримплен, лавсан, и т. п.), полиолефинов. Изделия из данных видов пластмасс распространены повсеместно — это трубы, сантехника, кафельная плитка, черепица, линолеум, ковровые покрытия, и т.п. Карбонат кальция составляет порядка 20% красящего пигмента, используемого при производстве красок [источник не указан 534 дня].
В строительстве[править | править код]
Строительство — ещё один из основных потребителей карбоната кальция. Например, в качестве наполнителя шпаклёвок и герметиков.
Также карбонат кальция является важным составным элементом при производстве продукции бытовой химии — средств для чистки сантехники, кремов для обуви.
Карбонат кальция широко применяется для раскисления кислых почв.
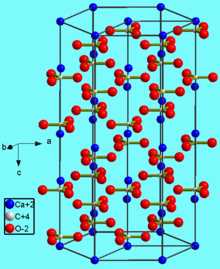
Карбонат кальция находится в минералах в виде полиморфов:
Тригональная кристаллическая структура кальцита является наиболее распространенной.
Минералы карбоната кальция находятся в следующих горных породах:
Залежи карбоната кальция в виде меловых пластов — отложений известковых раковин моллюсков, в основном, мелового периода является распространенным минералом на всех континентах.
В природе встречаются три кристаллические модификации (минералы с одинаковым химическим составом, но с различной кристаллической структурой): кальцит, арагонит и фатерит (ватерит).
Некоторые горные породы (известняк, мел, мрамор, травертин и другие известковые туфы) практически полностью состоят из карбоната кальция с различными примесями.
Кальцит является устойчивой кристаллической модификацией карбоната кальция и встречается в самых разнообразных геологических условиях: в осадочных, метаморфических и магматических горных породах.
Около 10 % всех осадочных пород составляют известняки, сложенные преимущественно кальцитовыми остатками раковин морских организмов. Арагонит является второй по распространённости кристаллической модификацией CaCO3 и в основном формируется в раковинах моллюсков и скелетах некоторых других организмов[каких?].
Также арагонит может образовываться и в неорганических процессах, например в карстовых пещерах или гидротермальных источниках.
Фатерит является наименее стабильной разновидностью этого карбоната, и очень быстро превращается в воде либо в кальцит, либо в арагонит. В природе встречается относительно редко, когда его кристаллическая структура стабилизирована теми или иными примесями.
Подавляющее количество карбоната кальция, добывающееся из полезных ископаемых, используется в промышленности. Чистый карбонат кальция (например, для производства продуктов питания или использования в фармацевтических целях), может быть изготовлен из природного минерала с малым количеством вредных примесей, например, из мрамора.
В лаборатории карбонат кальция может быть приготовлен предварительным гашением оксида кальция — негашеной извести. При этом образуется гидроксид кальция, и затем в суспензию продувается углекислый газ для получения карбоната кальция[2]:
- CaO+h3O⟶Ca(OH)2,{\displaystyle {\mathsf {CaO+H_{2}O\longrightarrow Ca(OH)_{2}}},}
- Ca(OH)2+CO2⟶CaCO3+h3O.{\displaystyle {\mathsf {Ca(OH)_{2}+CO_{2}\longrightarrow CaCO_{3}+H_{2}O}}.}
При нагревании до 900—1000 °C разлагается на кислотный оксид — углекислый газ CO2 и основный оксид — негашёную известь CaO:
- CaCO3⟶CaO+CO2↑.{\displaystyle {\mathsf {CaCO_{3}\longrightarrow CaO+CO_{2}\uparrow }}.}
Растворяется в воде при избытке углекислого газа образуя кислую соль — гидрокарбонат кальция Ca(HCO3)2:
- CaCO3+CO2+h3O⟶Ca(HCO3)2.{\displaystyle {\mathsf {CaCO_{3}+CO_{2}+H_{2}O\longrightarrow Ca(HCO_{3})_{2}}}.}.
Из-за этой реакции образуются сталактиты, сталагмиты. Природные подземные воды, обильные углекислом газом, растворяют плохо растворимый карбонат кальция с образованием много лучше растворимого в воде гидрокарбоната кальция, при выделении подземной воды в виде капель с потолков пещер при попадании в воздух с низкой концентрацией углекислого газа происходит обратная реакция превращения гидрокарбоната кальция в плохо растворимый осадок карбоната кальция, образующего красивые природные формы в пещерах, и из-за этого же механизма образуются карстовые пещеры.
При обжиге с температурой свыше 1500 °C с углеродом, например, в форме кокса, образует карбид кальция и угарный газ:
- CaCO3+4C⟶CaC2+3CO↑{\displaystyle {\mathsf {CaCO_{3}+4C\longrightarrow CaC_{2}+3CO\uparrow }}}.
Структура бикарбоната кальция, свойства, риски и использование / химия | Thpanorama
бикарбонат кальция неорганическая соль с химической формулой Ca (HCO)3)2. Это происходит в природе из карбоната кальция, присутствующего в известняковых породах и минералах, таких как кальцит.
Бикарбонат кальция более растворим в воде, чем карбонат кальция. Эта характеристика позволила сформировать карстовые системы в известняковых породах и в структурировании пещер..

Подземные воды, которые проходят через трещины, становятся насыщенными в результате вытеснения углекислого газа (СО2). Эти воды разрушают известняковые породы, выделяя карбонат кальция (СаСО3) который будет образовывать бикарбонат кальция в соответствии со следующей реакцией:
CaCO3(s) + CO2(г) + Н2O (l) => Ca (HCO)3)2(Aq)
Эта реакция происходит в пещерах, где происходит очень жесткая вода. Бикарбонат кальция находится не в твердом состоянии, а в водном растворе вместе с Са2+, бикарбонат (HCO)3-) и карбонат-ион (СО32-).
Впоследствии, когда насыщение диоксида углерода в воде уменьшается, происходит обратная реакция, то есть превращение бикарбоната кальция в карбонат кальция:
Ca (HCO)3)2(aq) => CO2 (г) + Н2O (l) + CaCO3 (S),
Карбонат кальция плохо растворим в воде, поэтому его осаждение происходит в виде твердого вещества. Вышеуказанная реакция очень важна при образовании сталактитов, сталагмитов и других образований в пещерах..
Эти скальные структуры сформированы из капель воды, которые падают с потолка пещер (верхнее изображение). CaCO3 присутствующие в каплях воды кристаллизуются с образованием упомянутых структур.
Тот факт, что бикарбонат кальция не обнаружен в твердом состоянии, затруднил его использование, и найдено несколько примеров. Кроме того, трудно найти информацию о его токсических эффектах. Имеется сообщение о совокупности побочных эффектов его применения в качестве средства профилактики остеопороза..
структура
Два аниона HCO показаны на верхнем изображении3- и катион Ca2+ взаимодействуя электростатически. Ca2+ в соответствии с изображением, оно должно быть расположено посередине, поскольку именно так HCO3- они не будут отталкивать друг друга из-за своих отрицательных зарядов.
Отрицательный заряд в HCO3- он делокализован между двумя атомами кислорода путем резонанса между карбонильной группой C = O и связью C-O-; в то время как в СО32-, Это делокализовано между тремя атомами кислорода, так как связь С-ОН депротонирована и поэтому может получить отрицательный заряд по резонансу.
Геометрию этих ионов можно рассматривать как сферы кальция, окруженные плоскими треугольниками карбонатов с гидрированным концом. С точки зрения соотношения размеров, кальций заметно меньше, чем ионы HCO3-.
Водные растворы
Ca (HCO)3)2 Он не может образовывать кристаллические твердые вещества, и он действительно состоит из водных растворов этой соли. В них ионы не одни, как на изображении, а окружены молекулами H.2О.
Как они взаимодействуют? Каждый ион окружен сферой гидратации, которая будет зависеть от металла, полярности и структуры растворенных частиц.
Ca2+ координируется с атомами кислорода воды с образованием акокомплекса Ca (OH)2)N2+, где n обычно считается равным шести; то есть «водный октаэдр» вокруг кальция.
Пока HCO анионы3- взаимодействовать с водородными связями (ИЛИ2СО-Н-ОН2) или с атомами водорода в воде в направлении отрицательного заряда делокализует (HOCO)2- H-OH, диполь-ионное взаимодействие).
Эти взаимодействия между Ca2+, HCO3- и вода настолько эффективна, что они делаю
Гидрокарбонаты — Википедия
Материал из Википедии — свободной энциклопедии
Модель иона гидрокарбоната HCO3−Гидрокарбона́ты — кислые соли угольной кислоты H2CO3. Формула аниона: HCO−
3. Устаревшие названия гидрокарбонатов: кислый, углекислый, двууглекислый, бикарбонаты.
Гидрокарбонаты щелочных металлов растворимы в воде. Также в воде хорошо растворимы гидрокарбонаты щёлочноземельных металлов, в отличие от карбонатов.
- Гидрокарбонаты образуются при длительном пропускании CO2 через раствор, содержащий карбонат:
- CaCO3+h3O+CO2→Ca(HCO3)2{\displaystyle {\mathsf {CaCO_{3}+H_{2}O+CO_{2}\rightarrow Ca(HCO_{3})_{2}}}}
- NaCl+Nh4+CO2+h3O→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NaCl+NH_{3}+CO_{2}+H_{2}O\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Гидрокарбонат натрия плохо растворим в холодной воде, поэтому его можно отделить от хлорида аммония фильтрованием.
- При нагревании гидрокарбонаты разлагаются на соответствующий карбонат, воду и углекислый газ:
- 2NaHCO3→Na2CO3+h3O+CO2{\displaystyle {\mathsf {2NaHCO_{3}\rightarrow Na_{2}CO_{3}+H_{2}O+CO_{2}}}}
- Гидролиз гидрокарбонат-иона происходит по схеме:
- HCO3−+h3O⇄OH−+h3CO3{\displaystyle {\mathsf {HCO_{3}^{-}+H_{2}O\rightleftarrows OH^{-}+H_{2}CO_{3}}}}
В итоге раствор гидрокарбонатов имеет щелочную реакцию.
- Реагирует со щелочами:
- HCO3−+OH−→CO32−+h3O{\displaystyle {\mathsf {HCO_{3}^{-}+OH^{-}\rightarrow CO_{3}^{2-}+H_{2}O}}}
- HCO3−+H+→h3O+CO2↑{\displaystyle {\mathsf {HCO_{3}^{-}+H^{+}\rightarrow H_{2}O+CO_{2}\uparrow }}}
Гидрокарбонат натрия (сода) используется в производстве искусственных минеральных вод и заправки огнетушителей, в кондитерском деле и хлебопечении, в быту, в медицине.
Гидрокарбонаты кальция и магния Са(НСО3)2, Mg(НСО3)2 обусловливают временную жёсткость воды[1].
В организме гидрокарбонаты являются буферными веществами, регулирующими постоянство реакции крови[1].
- Кнунянц И. Л. и др. т. 3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
- Ф. Н. Капуцкий, В. Ф. Тикавый. Пособие по химии для поступающих в вузы. — Минск: Выш. школа, 1979. — С. 384.
- Г. П. Хомченко. Химия для поступающих в вузы. — М.: Высшая школа, 1994. — С. 447.
- ↑ 1 2 [1]XuMuK.ru — гидрокарбонаты
Бикарбонат - кальций - Большая Энциклопедия Нефти и Газа, статья, страница 2
Бикарбонат - кальций
Cтраница 2
Бикарбонаты кальция и магния обладают значительно более высокой растворимостью, чем карбонаты этих металлов. Но бикарбонаты могут существовать в воде только при наличии в ней растворенной свободной углекислоты, количество которой зависит от давления углекислоты над поверхностью воды и от температуры воды. Повышение температуры воды приводит к уменьшению количества свободной растворенной углекислоты, в результате чего бикарбонаты распадаются на карбонаты с выделением свободной углекислоты. Образовавшиеся карбонаты выпадают из воды в виде накипи. [16]
Бикарбонат кальция Са ( НСОз) 2 - самый дешевый катодный экранирующий ингибитор, применяемый для защиты стали в системах водоснабжения. Бикарбонат кальция в подщелоченной среде образует нерастворимые соединения СаСОз, осаждающиеся на поверхности, изолируя ее от электролита. [17]
Бикарбонат кальция Са ( НСО3Ь - Катодный ингибитор коррозии, содержащийся в природной воде в виде солей карбонатной жесткости. [18]
Бикарбонат кальция Са ( НСОз) 2 - самый дешевый катодный экранирующий ингибитор, применяемый для защиты стали в системах водоснабжения. Бикарбонат кальция в подщелоченной среде образует нерастворимые соединения СаСОз, осаждающиеся на поверхности, изолируя ее от электролита. [19]
Распад бикарбонатов кальция и магния в воде может быть предотвращен введением в нее необходимого количества углекислоты. Это достигается обычно под-кислением охлаждающей воды серной кислотой или ре-карбонацией дымовыми газами от котлов. [20]
Распад бикарбонатов кальция и магния в воде может быть предотвращен введением в нее необходимого количества углекислоты. Это достигается введением в воду 10 - 15 % - го раствора серной кислоты либо рекарбонизацией воды дымовыми газами от котлов. [21]
Растворимость бикарбоната кальция при углекислотном равновесии пластовой воды с атмосферным воздухом значительно ниже, чем при пластовых ( либо промежуточных) условиях. Поэтому пластовые воды при очистке их в сооружениях открытого типа почти всегда имеют некоторое пересыщение бикарбонатом кальция Величина пересыщения, равная разности между общим и равновесным его содержанием, показывает количество осадка, которое может образовываться при разложении избытка бикарбоната. Поэтому соответствующая величина находилась экспериментально. [23]
Так, бикарбонат кальция в подщелоченной среде ( у катодных участков корродирующей поверхности металлов) дает нерастворимые соединения СаСО3, осаждающиеся и изолирующие часть поверхности от действия электролита. Этим, в частности, объясняется меньшая скорость коррозии стали в жесткой воде по сравнению с дистиллированной водой. [24]
При этом бикарбонаты кальция и магния переходят в СаСО3 и Mg ( OH) 2 и выделяются в виде твердой фазы. Сульфат магния при соединении с известью переходит в Mg ( OH) 2 с выделением последней в осадок, одновременно при этом образуется сульфат кальция. [25]
Для образования бикарбоната кальция и невыпадения кальцита из раствора необходимо некоторое количество свободной двуокиси углерода в воде. [26]
Для образования бикарбоната кальция и предотвращения выпадения кальцита из раствора необходимо некоторое количество свободного диоксида углерода. Таким образом, снижение давления в системе газ-вода, приводящее к соответствующему снижению парциального давления СО2, может быть одной из причин уменьшения растворимости кальцита и выпадения его из раствора. Именно этот фактор часто вызывает отложение кальцита на стенках НКТ добывающих скважин выше глубины
БИКАРБОНАТЫ — Большая Медицинская Энциклопедия
Бикарбонаты (совр. название гидрокарбонаты) — кислые соли угольной к-ты H2CO3; некоторые из них в организме принимают участие в поддержании постоянства pH крови. Общая формула MHCO3, где M — одновалентный металл. Бикарбонаты легко растворимы в воде. Менее других растворим бикарбонат натрия (в 100 г воды при t° 0 растворяется 6,5 г, при t° 20° — 8,8 г, при t° 50° - 12,6 г). При нагревании Бикарбонаты разлагаются с образованием карбонатов, двуокиси углерода и воды: 2NaHCO3 = Na2CO3 + CO2 + H2O. Кислоты вытесняют из Бикарбонатов двуокись углерода: NaHCO3 + HCl = NaCl + CO2 + H2O. Водные растворы Бикарбонатов вследствие гидролиза имеют слабощелочную реакцию:
HCO3- + H2O ⇆ H2CO3 + OH-
(при t° 20° раствор NaHCO3 слабо окрашивается фенолфталеином, ок. 0° гидролиз уменьшается и раствор обесцвечивается). При кипячении равновесие гидролиза смещается вправо, и угольная к-та разлагается с выделением CO2.
Бикарбонат кальция Ca(HCO3)2 и реже бикарбонат магния Mg(HCO3)2, растворенные в природных водах, обусловливают карбонатную, или временную, жесткость воды, к-рая может быть устранена кипячением. Бикарбонаты при этом разрушаются с образованием нерастворимых карбонатов, выпадающих в осадок: Ca(HCO3)2 = CaCO3 + CO2 + H2O.
Ион HCO-3 наряду с ионами Cl-, SO42-, Na+, K+, Ca2+, Mg2+ входит в группу главных ионов вод минеральных источников (см. Минеральные воды). Огромную роль играют Бикарбонаты натрия и калия, которые образуют с угольной к-той бикарбонатный буфер, участвующий в поддержании постоянства pH крови (см. Буферные системы, Кислотно-щелочное равновесие).
Широкое применение в медицинской практике находит бикарбонат натрия (Natrium bicarbonicum — NaHCO3 — двууглекислая, или питьевая, сода). Его применяют внутрь в порошках, таблетках и растворах при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки. Растворы бикарбоната натрия применяют для полосканий, промываний и ингаляций.
См. также Угольная кислота.
Библиография: Машковский М. Д. Лекарственные средства, ч. 2, с. 191, М., 1972; Некрасов Б. В. Основы общей химии, т. 2, М., 1967; Реми Г. Курс неорганической химии, пер. с нем., т. 1, М., 1972.
Е. А. Максимюк.
Бикарбонат - кальций - Большая Энциклопедия Нефти и Газа, статья, страница 1
Бикарбонат - кальций
Cтраница 1
Бикарбонаты кальция и магния обусловливают карбонатную жесткость, а хлориды и сульфаты кальция и магния - некарбонатную жесткость. [1]
Бикарбонат кальция доставляется в океан водами как холодных, так и умеренных стран, увлекается морскими течениями в жаркие тропики и здесь разлагается с выделением карбоната кальция. [3]
Бикарбонаты кальция и магния обусловливают карбонатную жесткость, а хлориды и сульфаты кальция и магния - некарбонатную жесткость. [4]
Бикарбонат кальция проявляет свои защитные свойства в агрессивной среде только в присутствии растворенного кислорода. В результате коррозии, идущей с кислородной деполяризацией, происходит защелачивание среды у катодных участков металла, что ведет к осаждению карбоната кальция вместе со ржавчиной. Образующийся в этих условиях плотный слой осадков, состоящий на 65 - 75 % из СаСО3 и на 20 - 25 % из окислов железа, обладает высокой адгезией и проявляет повышенные защитные свойства, затрудняя дальнейшую диффузию кислорода к поверхности металла. [5]
Бикарбонаты кальция и магния Са ( НСОзЬ и Mg ( HCOs) 2, называются солями карбонатной жесткости. Сульфаты и хлориды кальция и магния CaSO4, MgSC4, СаС12 и MgCb называются солями постоянной жесткости. [6]
Бикарбонаты кальция и магния сравнительно легко растворимы. [7]
Бикарбонаты кальция и магния Са ( НСОзЬ и Mg ( HCO3) 2, называются солями карбонатной жесткости. Сульфаты и хлориды кальция и магния CaSO4, MgSO4, СаС12 и MgCl2 называются солями постоянной жесткости. [8]
Бикарбонат кальция выносится в окружающую среду, а карбонат кальция выпадает в осадок и затем растворяется вновь поступающей угольной кислотой. [9]
Бикарбонаты кальция и магния обусловливают карбонатную жесткость. При нагревании воды растворенные бикарбонаты разлагаются и карбонатная жесткость при этом сильно снижается. Полного устранения карбонатной жесткости не происходит вследствие того, что карбонат кальция и особенно магния, несколько растворим в воде. [10]
Бикарбонат кальция при нагревании разлагается с образованием средней соли, двуокиси углерода и воды. [11]
Бикарбонат кальция при нагревании разлагается, причем образуются средняя соль, углекислый газ и вода. [12]
Бикарбонат кальция наряду с бикарбонатом магния обусловливает временную жесткость воды. Жесткость воды выражается в градусах ( старая единица) и в миллиграмм-эквивалентах на 1 л воды ( новая единица) ( см. примечание стр. [13]
Бикарбонаты кальция и магния сравнительно с их карбонатами отличаются большей растворимостью в воде. Например, Са ( НСОзЬ при 4 растворяется в количестве 62 мг в 1 л, между тем как СаСОз при тех же условиях растворяется в количестве лишь 11 мг в 1 л воды. [14]
Бикарбонат кальция наряду с бикарбонатом магния обусловливает временную жесткость воды. [15]
Страницы: 1 2 3 4
ГИДРОКАРБОНАТ КАЛЬЦИЯ - это... Что такое ГИДРОКАРБОНАТ КАЛЬЦИЯ?
- ГИДРОКАРБОНАТ КАЛЬЦИЯ
-
ГИДРОКАРБОНАТ КАЛЬЦИЯ (Са(НСО3)2), соль, присутствие которой обуславливает ЖЕСТКОСТЬ ВОДЫ. Это устраняется, если воду нагреть, нерастворимый гидрокарбонат кальция осаждается и образует налет внутри водопроводных труб или на стенках посуды. Тот же процесс происходит, когда вода стекает по капле с потолка пещер, образуя СТАЛАГМИТЫ и СТАЛАКТИТЫ.
Научно-технический энциклопедический словарь.
- ГИДРОДИНАМИКА
- ГИДРОКАРБОНАТ НАТРИЯ
Смотреть что такое "ГИДРОКАРБОНАТ КАЛЬЦИЯ" в других словарях:
Гидрокарбонат кальция — Общие … Википедия
Кальция гидроксид — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Кальция гидроокись — Гидроксид кальция Общие Систематическое наименование Гидроксид кальция Отн. молек. масса 74.093 а. е. м. Молярная масса 74.093 г/моль … Википедия
Гидрокарбонат калия — Общие Систематическое наименование Гидрокарбонат калия Традиционные названия Углекислый калий, кислый; бикарбонат калия Химическая формула KHCO3 Физические свойства … Википедия
Гидрокарбонат натрия — Гидрокарбонат натрия … Википедия
кальция гидрокарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
кальция бикарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
Гидроксид кальция — Общие … Википедия
Карбонат кальция — Карбонат кальция … Википедия
Хлорид кальция — Общие … Википедия
Карбид кальция — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 июля 2018; проверки требуют 18 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 июля 2018; проверки требуют 18 правок.Карби́д ка́льция (углеро́дистый ка́льций, ацетилени́д кальция) — CaC2 — в чистом виде белое кристаллическое вещество. Бинарное неорганическое соединение кальция с углеродом.
Впервые получен в 1861 году Фридрихом Вёлером нагреванием сплава цинка и кальция с углём.
В настоящее время получают прокаливанием в электрических печах (температура 1900—1950 °C) смеси оксида кальция с коксом.
- CaO+3C→CaC2+CO{\displaystyle {\mathsf {CaO+3C\rightarrow CaC_{2}+CO}}}
Полученный таким образом технический продукт имеет чисто-черный цвет вследствие загрязнения углём и другими красящими примесями. Он содержит также примеси фосфида и сульфида кальция, вследствие чего такой карбид кальция и полученный из него ацетилен имеют неприятный запах.
- Бесцветные тетрагональные кристаллы.
- Плотность: 2,2 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2[1].
- Карбид кальция имеет резкий чесночный запах.
При взаимодействии c водой карбид кальция гидролизуется с образованием ацетилена и гидроксида кальция (гашёной извести)[2]:
- CaC2+2h3O→Ca(OH)2+C2h3↑{\displaystyle {\mathsf {CaC_{2}+2H_{2}O\rightarrow Ca(OH)_{2}+C_{2}H_{2}\uparrow }}}
Представленная выше реакция является экзотермической. Следует иметь в виду, что реакция карбида кальция с водой протекает очень бурно. При нарушении правил техники безопасности при проведении этой реакции возможно получение травм и ожогов.
Внешний вид и характеристики технического карбида кальция[править | править код]
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое[3].
Карбид кальция используют при проведении автогенных работ и освещения, а также в производстве ацетиленовой сажи и продуктов органического синтеза, из которых главным является синтетический каучук.
Карбид кальция применяют в производстве цианамида кальция, из которого получают удобрения, цианистые соединения. Карбид кальция используют для получения карбидно-карбамидного регулятора роста растений, изготовления порошкового карбидного реагента.
Из 1 кг технического карбида получается от 235 до 285 л ацетилена в зависимости от его сорта и грануляции: чем чище и крупнее карбид кальция, тем большее количество ацетилена он даёт при разложении.
Для разложения 1 кг карбида кальция теоретически требуется 0,56 л воды. Практически берут от 5 до 20 л воды с целью лучшего охлаждения ацетилена и обеспечения безопасности при работе. Скорость разложения карбида кальция водой зависит от его чистоты, грануляции, температуры и чистоты воды. Чем чище карбид кальция, меньше размер его кусков, выше температура и чище вода, тем больше скорость[3].
- Среди всех неорганических производных кальция CaC2 очень ядовит.
- По степени воздействия на организм человека карбид кальция относится к 1-му классу опасности согласно ГОСТ 12.1.007.
- Попадание карбида кальция внутрь организма также является опасным.
- Пыль карбида кальция оказывает раздражающее действие на кожу, слизистые оболочки органов дыхания.
- Карбид кальция CaC2 чрезвычайно опасен для окружающей среды.
Ацетат кальция — Википедия
Материал из Википедии — свободной энциклопедии
Ацетат кальция — кальциевая соль уксусной кислоты. Бесцветное кристаллическое или аморфное вещество, хорошо растворимое в воде. Технический моногидрат может быть в форме гранул или некрупных игл. Обладает слабым вкусом и запахом уксуса. Химическая формула — Ca(CH3COO)2, однако чаще получают его моногидрат Ca(CH3COO)2•H2O.[4]
Пригорело-древесная соль — старинное название ацетата кальция — в старину получалась при сухой перегонке древесины, из-за чего древесина, естественно, обугливалась, «пригорала». Из-за того, что метод сухой перегонки древесины использовался алхимиками с незапамятных времён[5], установить человека, давшего такое название этой соли или впервые получившего её, невозможно.
В лаборатории получают действием уксусной кислоты на карбонат, оксид или гидроксид кальция.[6]
- 2Ch4COOH+CaCO3→Ca(Ch4COO)2+h3O+CO2↑{\displaystyle {\mathsf {2CH_{3}COOH+CaCO_{3}\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O+CO_{2}\uparrow }}}
- 2Ch4COOH+CaO→Ca(Ch4COO)2+h3O{\displaystyle {\mathsf {2CH_{3}COOH+CaO\rightarrow Ca(CH_{3}COO)_{2}+H_{2}O}}}
- 2Ch4COOH+Ca(OH)2→Ca(Ch4COO)2+2h3O{\displaystyle {\mathsf {2CH_{3}COOH+Ca(OH)_{2}\rightarrow Ca(CH_{3}COO)_{2}+2H_{2}O}}}
Не имеет промышленного применения.
Используется в лаборатории для получения диметилкетона (ацетона). Эту реакцию осуществляют, нагревая ацетат кальция до 160 °С[2][7]:
- Ca(Ch4COO)2→160∘CCaCO3+(Ch4)2CO{\displaystyle {\mathsf {Ca(CH_{3}COO)_{2}{\xrightarrow {160^{\circ }C}}CaCO_{3}+(CH_{3})_{2}CO}}}
Именно из-за этой реакции ацетат кальция нельзя хранить или сушить вблизи открытого огня, а помещения, в которых происходят работы с ацетатом кальция, должны быть оборудованы приточно-вытяжной вентиляцией.[8]
Также может применяться в лаборатории для получения сложных эфиров уксусной кислоты — алкилацетатов:
- Ca(Ch4COO)2+2Ch4Ch3Br→CaBr2+2Ch4COOCh3Ch4{\displaystyle {\mathsf {Ca(CH_{3}COO)_{2}+2CH_{3}CH_{2}Br\rightarrow CaBr_{2}+2CH_{3}COOCH_{2}CH_{3}}}}
Также ацетат кальция используется для получения ацетата калия обменными реакциями из карбоната и/или бикарбоната калия:
- Ca(Ch4COO)2+2KHCO3→2Ch4COOK+Ca(HCO3)2{\displaystyle {\mathsf {Ca(CH_{3}COO)_{2}+2KHCO_{3}\rightarrow 2CH_{3}COOK+Ca(HCO_{3})_{2}}}}
- Ca(Ch4COO)2+K2CO3→2Ch4COOK+CaCO3{\displaystyle {\mathsf {Ca(CH_{3}COO)_{2}+K_{2}CO_{3}\rightarrow 2CH_{3}COOK+CaCO_{3}}}}
Также ацетат кальция применяют при получении лавсана в качестве катализатора.[4]
Ещё одним способом применения ацетата кальция является приготовление аналога сухого спирта — твёрдого спиртового сольвата ацетата кальция — при смешивании ацетата кальция и этилового спирта.
Пищевая промышленность[править | править код]
Ацетат кальция зарегистрирован в пищевой промышленности в качестве пищевой добавки группы консервантов E263.[9] Может применяться как консервант, регулятор кислотности, уплотнитель растительных тканей. Останавливает развитие болезнетворных бактерий в хлебобулочных изделиях, смягчает ярко выраженный кислый вкус консервированных овощей и фруктов. В сельскохозяйственной промышленности используется для консервации кормов.[10] Так как действие ацетата кальция ограничено наличием в продуктах сульфатов, фосфатов, карбонатов и гидрокарбонатов, которые в конечном итоге дают осадки с катионом Ca2+{\displaystyle {\mathsf {Ca^{2+}}}}, то применять его лучше в сочетании с другими консервантами.
| Массовая доля основного вещества,безводная форма, %, не менее | 98 |
| Потери при просушке, %, не более | 11 |
| pH 10%-го водного раствора | 6-9 (включительно) |
| Массовая доля нерастворимых веществ, %, не более | 0,3 |
Ацетат кальция оказывает абсорбирующее действие на анионы фосфорных кислот:
- 3Ca(Ch4COO)2+2PO43−→6Ch4COO−+Ca3(PO4)2↓{\displaystyle {\mathsf {3Ca(CH_{3}COO)_{2}+2PO_{4}^{3-}\rightarrow 6CH_{3}COO^{-}+Ca_{3}(PO_{4})_{2}\downarrow }}}
Также ацетат кальция восстанавливает положительный кальциевый баланс у больных с почечной недостаточностью в легкой, средней и тяжелой форме и у больных, находящихся на гемодиализе или перитонеальном диализе[11]. Является безалюминиевым и безмагниевым фосфат-связывающим препаратом (фосфат-биндером). Фосфат-связывающая способность ацетата кальция в 2 раза выше, а всасываемость его в кишечнике значительно меньше, чем у кальция карбоната.
бикарбонат кальция - это... Что такое бикарбонат кальция?
- бикарбонат кальция
calcium bicarbonate
Русско-английский словарь по химии. 2013.
- бикарбонат бария
- бикарбонат лития
Смотреть что такое "бикарбонат кальция" в других словарях:
кальция бикарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
кальция гидрокарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
Куанг Си — Куанг Си … Википедия
РАПА — РАПА, насыщенная солями, вода соленых озер. Существует 2 главных типа соленых озер: приморские и материковые; последние представляют бессточные водоемы, которые обязаны своей соленостью.выщелачиванию окру ,жащих их горных пород; морские же… … Большая медицинская энциклопедия
кислый углекислый кальций — двууглекислый кальций бикарбонат кальция (CaCO3) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность Синонимы двууглекислый кальцийбикарбонат кальция EN calcium bicarbonate … Справочник технического переводчика
СТАЛАКТИТ — СТАЛАКТИТ, натечное минеральное образование, состоящее из крошечных кристаллов КАРБОНАТА КАЛЬЦИЯ, свешивающееся в виде сосульки или бахромы с потолка ПЕЩЕР, сложенных известняками каменноугольного периода. Сталактиты образуются водой, медленно… … Научно-технический энциклопедический словарь
Сверлящие и туфообразующие водоросли — Отдельного рассмотрения заслуживают чрезвычайно интересные и своеобразные водоросли, ебладающие способностью внедряться в субстрат или отлагать его вокруг себя. И в том и в другом случае жизнь этих водорослей связана с известью. Они… … Биологическая энциклопедия
Травертин — Травертин … Википедия
БЕРНЕТТА СИНДРОМ — (описан американским врачом C. H. Burnett, 1901–1967; синоним – молочно щелочной синдром) – сочетание гиперкальциемии, алкалоза и почечной недостаточности. Развивается у лиц с нарушенной регуляцией всасывания кальция в кишечнике при потреблении… … Энциклопедический словарь по психологии и педагогике
calcium bicarbonate — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
calcium hydrocarbonate — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
бикарбонат кальция - это... Что такое бикарбонат кальция?
- бикарбонат кальция
- calcium bicarbonate
Большой англо-русский и русско-английский словарь. 2001.
- бикарбонат
- бикасательная
Смотреть что такое "бикарбонат кальция" в других словарях:
кальция бикарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
кальция гидрокарбонат — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
Куанг Си — Куанг Си … Википедия
РАПА — РАПА, насыщенная солями, вода соленых озер. Существует 2 главных типа соленых озер: приморские и материковые; последние представляют бессточные водоемы, которые обязаны своей соленостью.выщелачиванию окру ,жащих их горных пород; морские же… … Большая медицинская энциклопедия
кислый углекислый кальций — двууглекислый кальций бикарбонат кальция (CaCO3) [http://slovarionline.ru/anglo russkiy slovar neftegazovoy promyishlennosti/] Тематики нефтегазовая промышленность Синонимы двууглекислый кальцийбикарбонат кальция EN calcium bicarbonate … Справочник технического переводчика
СТАЛАКТИТ — СТАЛАКТИТ, натечное минеральное образование, состоящее из крошечных кристаллов КАРБОНАТА КАЛЬЦИЯ, свешивающееся в виде сосульки или бахромы с потолка ПЕЩЕР, сложенных известняками каменноугольного периода. Сталактиты образуются водой, медленно… … Научно-технический энциклопедический словарь
Сверлящие и туфообразующие водоросли — Отдельного рассмотрения заслуживают чрезвычайно интересные и своеобразные водоросли, ебладающие способностью внедряться в субстрат или отлагать его вокруг себя. И в том и в другом случае жизнь этих водорослей связана с известью. Они… … Биологическая энциклопедия
Травертин — Травертин … Википедия
БЕРНЕТТА СИНДРОМ — (описан американским врачом C. H. Burnett, 1901–1967; синоним – молочно щелочной синдром) – сочетание гиперкальциемии, алкалоза и почечной недостаточности. Развивается у лиц с нарушенной регуляцией всасывания кальция в кишечнике при потреблении… … Энциклопедический словарь по психологии и педагогике
calcium bicarbonate — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas
calcium hydrocarbonate — kalcio hidrokarbonatas statusas T sritis chemija formulė Ca(HCO₃)₂ atitikmenys: angl. calcium bicarbonate; calcium hydrocarbonate; calcium hydrogen carbonate rus. кальций двууглекислый; кальций кислый углекислый; кальция бикарбонат; кальция… … Chemijos terminų aiškinamasis žodynas