Лантан что это такое
Лантан — Википедия
| Лантан | |
|---|---|
| ← Барий | Церий → | |
| Мягкий, ковкий, вязкий металл серебристо-белого цвета | |
 Лантан в ампуле | |
| Название, символ, номер | Лантан / Lanthanum (La), 57 |
| Атомная масса (молярная масса) | 138,90547(7)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 5d1 6s2 |
| Радиус атома | 187 пм |
| Ковалентный радиус | 169 пм |
| Радиус иона | 101.(+3e) 6 пм |
| Электроотрицательность | 1,10 (шкала Полинга) |
| Электродный потенциал | La←La3+ -2,38В |
| Степени окисления | 3 |
| Энергия ионизации (первый электрон) | 541,1(5,61) кДж/моль (эВ) |
| Плотность (при н. у.) | 6,162-6,18 (альфа-модификация) г/см³ |
| Температура плавления | 1193 K |
| Температура кипения | 3447-3469 K |
| Уд. теплота плавления | 8,5 кДж/моль |
| Уд. теплота испарения | 402 кДж/моль |
| Молярная теплоёмкость | 27,11[2] Дж/(K·моль) |
| Молярный объём | 22,5 см³/моль |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,772 c=12,14 Å |
| Отношение c/a | 3,22 |
| Температура Дебая | 132 K |
| Теплопроводность | (300 K) 13,4 Вт/(м·К) |
| Номер CAS | 7439-91-0 |
Ланта́н — химический элемент 3-й группы (по устаревшей классификации — побочной подгруппы третьей группы) шестого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 57, атомная масса — 138,9055[2]. Обозначается символом La (лат. Lanthanum). Простое вещество лантан — блестящий металл серебристо-белого цвета, относится к редкоземельным элементам [2].
Лантан как химический элемент не удавалось открыть на протяжении 36 лет. В 1803 г. 24-летний шведский химик Йёнс Якоб Берцелиус исследовал минерал, известный теперь под названием церит. В этом минерале была обнаружена иттриевая земля и ещё одна редкая земля, очень похожая на иттриевую. Её назвали цериевой. В 1826 г. Карл Мосандер исследовал цериевую землю и заключил, что она неоднородна, что в ней, помимо церия, содержится ещё один новый элемент. Доказать сложность цериевой земли Мосандеру удалось лишь в 1839 г. Он сумел выделить новый элемент, когда в его распоряжении оказалось большее количество церита.
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Оно было дано в честь истории его открытия и происходит от др.-греч. λανθάνω — «скрываюсь», «таюсь».
Лантан вместе с церием и неодимом относится к наиболее распространенным редкоземельным элементам. Содержание лантана в земной коре порядка 2,9·10−3% по массе, в морской воде — около 2,9·10−6мг/л [2][3]. Основные промышленные минералы лантана — монацит, бастнезит, апатит и лопарит. В состав этих минералов также входят другие редкоземельные элементы[2].
Получение лантана связано с разделением исходного сырья на фракции. Лантан концентрируется вместе с церием, празеодимом и неодимом. Сначала из смеси отделяют церий, затем оставшиеся элементы разделяют экстракцией.
Лантан — блестящий серебристо-белый металл, в чистом состоянии — ковкий и тягучий. Слабо парамагнитен. Кристаллическая структура плотноупакованная типа плотнейшей гексагональной упаковки[4].
Существует в трёх кристаллических модификациях: α-La с гексагональной решёткой (а=0,3772 нм, с=1,2144 нм, z=4, пространственная группа Р63/ттс)[2], β-La с кубической решёткой типа меди (а=0,5296 нм, z=4, пространственная группа Fm3m), γ-La с кубической объёмноцентрированной решёткой типа α-Fe (а=0,426 нм, z=2, пространственная группа Im3m, устойчив до 920 °C) температуры переходов α↔β 277 °C и β↔γ 861 °C[2]. DH° полиморфных переходов: α:β — 0,36 кДж/моль, β:γ — 3,12 кДж/моль [2]. При переходе из одной модификации в другую меняется плотность лантана: α-La имеет плотность 6,162-6,18 г/см3[4], β-La — 6,19 г/см3, γ-La — 5,97 г/см3[2].
С некоторыми металлами, например, с цинком, магнием, кальцием, таллием, оловом, свинцом, никелем, кобальтом, марганцем, ртутью, серебром, алюминием, медью, кадмием и др., металлический лантан образует сплавы. С железом лантан образует пирофорный сплав[4].
По своим химическим свойствам лантан больше всего похож на 14 следующих за ним элементов, поэтому их называют лантаноидами. Металлический лантан обладает высокой химической активностью[2].
- 4La+3O2 → 2La2O3{\displaystyle {\mathsf {4La+3O_{2}\ {\xrightarrow {}}\ 2La_{2}O_{3}}}}
- La2O3+2CO2+h3O → 2LaCO3(OH){\displaystyle {\mathsf {La_{2}O_{3}+2CO_{2}+H_{2}O\ {\xrightarrow {}}\ 2LaCO_{3}(OH)}}}
- 4La+3O2 →450oC 2La2O3{\displaystyle {\mathsf {4La+3O_{2}\ {\xrightarrow {450^{o}C}}\ 2La_{2}O_{3}}}}
- 2La+6h3O →90oC 2La(OH)3+3h3↑{\displaystyle {\mathsf {2La+6H_{2}O\ {\xrightarrow {90^{o}C}}\ 2La(OH)_{3}+3H_{2}\uparrow }}}
- 2La+3F2 →100oC 2LaF3{\displaystyle {\mathsf {2La+3F_{2}\ {\xrightarrow {100^{o}C}}\ 2LaF_{3}}}}
- 2La+3Cl2 →100oC 2LaCl3{\displaystyle {\mathsf {2La+3Cl_{2}\ {\xrightarrow {100^{o}C}}\ 2LaCl_{3}}}}
- 2La+3Br2 →toC 2LaBr3{\displaystyle {\mathsf {2La+3Br_{2}\ {\xrightarrow {t^{o}C}}\ 2LaBr_{3}}}}
- 2La+3I2 →toC 2LaI3{\displaystyle {\mathsf {2La+3I_{2}\ {\xrightarrow {t^{o}C}}\ 2LaI_{3}}}}
- Легко взаимодействует с минеральными кислотами с образованием ионов La3+ и водорода. Вполне возможно, что в водном растворе ион La3+ в значительной степени существует как комплексный ион [La(OH2)9]3+[5]:
- 2La+3h3SO4 →h3O 2La3++3SO42−+3h3↑{\displaystyle {\mathsf {2La+3H_{2}SO_{4}\ {\xrightarrow {H_{2}O}}\ 2La^{3+}+3SO_{4}^{2-}+3H_{2}\uparrow }}}
Основные соединения[править | править код]
- Ацетилацетонат лантана — органическое соединение, хелат, формула La(С5H7O2)3. Представляет собой бесцветное твёрдое вещество, хорошо растворимое в воде и органических растворителях. Получается реакцией солей лантана со спиртовым раствором ацетилацетона.
- Бензоилацетонат лантана — хелатное соединение лантана, формула La(C10H9O2)3. Образует жёлтые призматические кристаллы. Получается взаимодействием солей лантана со спиртовым раствором бензоилацетона.
- Бромид лантана(III) — бинарное соединение, формула LaBr3. Образует белые кристаллы, хорошо растворимые в воде. Получают действием бромоводорода на оксид или сульфид лантана.
- Гидрид лантана(III) — бинарное соединение, формула LaH3. Представляет собой тёмно-синее кристаллическое вещество; реагирует с водой с образованием гидроксида лантана. Получается действием водорода на лантан при 210—290 °С.
- Гидроксид лантана(III) — белое нерастворимое в воде вещество с формулой La(OH)3. Образуется при действии горячей воды на металлический лантан или на оксид. При температурах выше 300 °С — разлагается.
- Иодид лантана(III) — бинарное соединение, формула LaI3. Образует кристаллы жёлто-зелёного цвета, хорошо растворимые в воде и органических растворителях. Получают нагреванием лантана и иода в инертной атмосфере.
- Карбид лантана(III) — бинарное соединение лантана с углеродом, формула LaС2. Образует жёлтые кристаллы. Реагирует с водой с образованием гидроксида и с выделением этана и ацетилена.
- Карбонат лантана(III) — бесцветное кристаллическое вещество с формулой La2(CO3)2, образует кристаллогидрат состава La2(CO3)2·8H2O. Получается пропусканием углекислого газа через суспензию гидроксида лантана.
- Купферонат лантана — органическое вещество, хелат, формула [La{C6H5N(NO)O}3]. Образует жёлтые кристаллы. Получается реакцией хлорида лантана с раствором купферона в кислой среде.
- Нитрат лантана(III) — бесцветное кристаллическое вещество с формулой La(NO3)3; хорошо растворяется в воде и органических растворителях. Получается растворением лантана, его оксида или гидроксида в азотной кислоте.
- Оксалат лантана(III) — бесцветное вещество, формула La2(C2O4)3. Не растворяется в воде. Получается действием на растворимые соли лантана избытком щавелевой кислоты.
- Оксид лантана(III) — белые кристаллы, формула La2O3. Не растворяется в воде, но медленно реагирует с ней. Получается сгоранием лантана на воздухе или разложением его солей при высоких температурах. Растворяется в кислотах с образованием солей La(III). На воздухе поглощает углекислый газ, постепенно превращаясь в основной карбонат лантана.
- Оксисульфид лантана — желтовато-белые гексагональные кристаллы с формулой La2O2S.
- Оксифторид лантана(III) — бесцветные кристаллы кубической сингонии, формула LaOF. Получают взаимодействием фторида лантана с водяными парами при 800 °С или спеканием оксида лантана с фторидом лантана в вакууме.
- Силицид лантана(III) — бинарное неорганическое соединение, формула LaSi2. Образует серые кристаллы.
- Сульфат лантана(III) — бесцветные кристаллы, растворимые в воде, формула La2(SO4)3. Получается растворением металлического лантана, его оксида или гидроксида в серной кислоте. Разлагается при нагревании.
- Сульфиды лантана — бинарные неорганические соединения лантана и серы. Сульфид лантана(III) имеет формулу La2S3; образует жёлто-красные кристаллы, нерастворимые в воде. Получается действием паров серы на лантан при 600—800 °С. Моносульфид лантана LaS — образует золотистые кристаллы кубической сингонии. Дисульфид лантана LaS2 — коричневые кристаллы.
- Фосфат лантана(III) — бесцветные кристаллы, плохо растворимые в воде, формула LaPO4. Получается обменной реакцией между растворимой солью лантана и фосфатом щелочного металла.
- Фосфид лантана(III) — бинарное неорганическое соединение, чёрные кристаллы с формулой LaP. Получается реакцией лантана и фосфора при 400—500 °С.
- Фторид лантана(III) — бесцветное вещество с формулой LaF3. Не растворяется в воде. Получают взаимодействием лантана с плавиковой кислотой либо прямым сгоранием лантана во фторе.
- Хлорид лантана(III) — бесцветное вещество с формулой LaCl3, хорошо растворимое в воде. Получается реакцией лантана с хлором или взаимодействием его с соляной кислотой.
Минералы[править | править код]
- Бастнезит — минерал класса фторкарбонатов, формула (Ce, La, Y)CO3F. Образует прозрачные кристаллы жёлтого, оранжевого, красного и бурого цветов. Твёрдость по Моосу — 4—4,5; удельный вес — 4,93—5,18. Может содержать от 34,7 до 45,8 % оксида лантана(III)[6].
- Гадолинит — чёрный (чёрно-бурый) минерал с жирным стекловатым блеском, формула (Ce, La, Nd, Y)2FeBe2Si2O10. Твёрдость по шкале Мооса — 6,5-7[7]. Удельный вес — 4-4,3[8]. Состав непостоянен.
- Монацит — минерал класса фосфатов, формула (Ce, La, Nd, Th)[PO4]. Может иметь жёлтую, красновато-бурую, гиацинтово-красную, оливиново-зеленую окраску; цвет черты — белый (зеленовато-белый). Твёрдость по Моосу — 5—5,5; удельный вес — 4,9—5,2[9]. Из-за высокого содержания урана и тория — радиоактивен.
- Ортит — бурый или чёрный минерал, класса силикатов. Химическая формула — (Ca, Ce, La, Y)2(Al, Fe)3(SiO4)3(OH)[10]. Твёрдость по Моосу — 5,5-6[11]. Удельный вес составляет 3,3—3,8[12].
 Калильная сетка
Калильная сетка  «Горячий катод», состоящий из борида лантана LaB6 Диаграмма, показывающая поглощение света стеклом ZBLAN
«Горячий катод», состоящий из борида лантана LaB6 Диаграмма, показывающая поглощение света стеклом ZBLAN - Оксид и борид лантана используются в электронно-вакуумных лампах как материал т. н. «горячего катода», то есть катода с высокой интенсивностью потока электронов. Кристаллы LaB6 применяются в источниках катодных лучей для электронных микроскопов[15].
- Лантан применяется как компонент сплавов никеля, магния, кобальта и др.[16]
- Соединение состава La(Ni3.55Mn0.4Al0.3Co0.4Fe0.35) используется для анодного материала никель-металл-гидридных аккумуляторов. Оно представляет собой интерметаллид AB5-типа[17][18].
- Чистый лантан практически не используется по причине своей высокой стоимости; вместо него применяется мишметалл: сплав с содержанием лантана 20—45 %[19][20]. Мишметалл является компонентом жаропрочных и коррозионностойких сплавов[16].
- Для производства типичного гибридного автомобиля Toyota Prius требуется 10—15 кг лантана, где он входит в состав аккумулятора[21][22].
- Карбонат лантана используется как лекарство, имеющее собственное название Fosrenol[23], применяющееся при гиперфосфатемии для поглощения избытка фосфатов[23].
- Лантан имеет свойство поглощать водород. Один объём этого вещества способен поглотить до 400 объёмов водорода в процессе обратимой адсорбции. Это свойство применяется для создания емких аккумуляторов водорода (металлогидридное хранение водорода) и в системах сохранения энергии, так как при растворении водорода в лантане выделяется теплота[20][24].
- Соли лантана и других редкоземельных элементов применяются в угольных дуговых лампах для увеличения яркости дуги[25]. Угольные дуговые лампы были популярны в кинопроекторах. На производство последних приходится около 25 % соединений лантана, которые изначально предполагались для дуговых ламп[20][26].
- Жидким лантаном извлекают плутоний из расплавленного урана[27].
- Небольшая добавка лантана к стали увеличивает её пластичность и деформируемость. Добавка лантана к молибдену уменьшает его твёрдость и чувствительность к перепадам температур[20].
- Фторид лантана — важный компонент люминофоров. В смеси с фторидом европия он используется в кристаллической мембране ионоселективных электродов[28]. Он также входит в состав стекла ZBLAN. Оно обладает улучшенным коэффициентом пропускания в инфракрасном диапазоне и поэтому применяется в волоконной оптике[29].
- Оксид лантана(III) — компонент специальных стёкол, высокотемпературной керамики, применяется также для производства других соединений лантана[20][30].
- Хлорид и бромид лантана применяются как сцинтилляторы с высоким световым выходом, лучшим
Лантан - это... Что такое Лантан?
| Внешний вид простого вещества | |
|---|---|
| Мягкий, ковкий, вязкий металл серебристо-белого цвета | |
| Свойства атома | |
| Имя, символ, номер | Лантан / Lanthanum (La), 57 |
| Атомная масса (молярная масса) | 138,9055 а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 5d1 6s2 |
| Радиус атома | 187 пм |
| Химические свойства | |
| Ковалентный радиус | 169 пм |
| Радиус иона | 101.(+3e) 6 пм |
| Электроотрицательность | 1,10 (шкала Полинга) |
| Электродный потенциал | La←La3+ -2.38В |
| Степени окисления | 3 |
| Энергия ионизации (первый электрон) | 541,1(5,61) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 6,162 г/см³ |
| Температура плавления | 1194 K |
| Температура кипения | 3730 K |
| Теплота плавления | 8,5 кДж/моль |
| Теплота испарения | 402 кДж/моль |
| Молярная теплоёмкость | 27,11[1] Дж/(K·моль) |
| Молярный объём | 22,5 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | гексагональная |
| Параметры решётки | a=3,772 c=12,14 Å |
| Отношение c/a | 3,22 |
| Температура Дебая | 132 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 13,4 Вт/(м·К) |
Ланта́н — элемент побочной подгруппы третьей группы шестого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 57. Обозначается символом La (лат. Lanthanum). Простое вещество лантан (CAS-номер: 7439-91-0) — металл серебристо-белого цвета. Существует в трёх кристаллических модификациях: α-La с гексагональной решёткой, β-La с кубической решёткой типа меди, γ-La с кубической объёмноцентрированной решёткой типа α-Fe, температуры переходов α↔β 277 °C и β↔γ 861 °C[1].
История
Лантан, как химический элемент, не удавалось открыть на протяжении 36 лет. В 1803 г. 24-летний шведский химик Йёнс Якоб Берцелиус исследовал минерал, известный теперь под названием церита. В этом минерале была обнаружена иттриевая земля и ещё одна редкая земля, очень похожая на иттриевую. Её назвали цериевой. В 1826 г. Карл Мозандер исследовал цериевую землю и заключил, что она неоднородна, что в ней, помимо церия, содержится ещё один новый элемент. Доказать сложность цериевой земли Мозандеру удалось лишь в 1839 г. Он сумел выделить новый элемент, когда в его распоряжении оказалось большее количество церита.
Происхождение названия
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Оно было дано в честь истории его открытия и происходит от др.-греч. λανθάνω — «скрываюсь», «таюсь».
Нахождение в природе
Содержание в земной коре порядка 18 — 30 г/т, в воде океанов 0,012 мкг/л[2].
Месторождения
Главные месторождения лантана находятся в США, Казахстане, России, Украине, Австралии, Бразилии, Индии, Скандинавии[источник не указан 645 дней].
Получение
Получение лантана связано с разделением исходного сырья на фракции. Лантан концентрируется вместе с церием, празеодимом и неодимом. Сначала из смеси отделяют церий, затем оставшиеся элементы разделяют экстракцией.
Стоимость
Цены на металлический лантан чистотой 99-99,9 составляют около 2 — 4 долл за 1 г.
Применение
Производство стекла
Оксид лантана (от 5 до 40 %) применяется для варки оптического стекла (лантановое стекло), для изготовления линз и призм используемых в кино и фотоаппаратуре, а также для астрономических целей.
Производство керамических электронагревателей
Хромит лантана, легированный кальцием, стронцием, магнием, используется для производства высокотемпературных печных нагревателей (температура плавления ― 2453 °C, раб.темп. — около 1780 градусов в атмосфере кислорода). С ростом температуры электрическое сопротивление хромита лантана резко уменьшается. Коэффициент термического расширения хромита лантана очень низкий и это предопределяет долговечность электронагревателей.
Высокотемпературная сверхпроводимость
Оксид лантана применяется для синтеза высокотемпературных сверхпроводников на основе оксидов лантана, иттрия, бария, стронция, меди и др.
Металлотермия
Изредка лантан применяют в металлотермии для восстановления редких элементов.
Специальные покрытия стекла
На основе соединений лантана производятся покрытия для оконного стекла позволяющие понижать температуру в помещении на 5-7 градусов.
Термоэлектрические материалы
Монотеллурид лантана имеет очень высокую термо-э.д.с (834 мкВ/К) и применяется в термоэлектрогенераторах с высоким кпд.
Производство металлогидридных накопителей водорода
Лантан-никелевый гидрид широко употребляется как емкий аккумулятор водорода (металлогидридное хранение водорода) для автомобилей.
Ядерная энергетика
Важное значение металлический лантан высокой чистоты имеет в атомной промышленности, и конкретно, в технологии переработки ядерного топлива с целью извлечения плутония. В расплавленный металлический уран, имеющий в качестве примеси металлический плутоний, добавляют расплавленный лантан. Расплавленный лантан полностью извлекает изотопы плутония из урана и всплывает над ним, не смешиваясь с ураном. Полученный сплав сливают и перерабатывают методами химической технологии.
На текущий момент данный способ не используется. Последний плутониевый (промышленный) реактор был закрыт в Железногорске в 2010—2011 гг. Для извлечения плутония использовался экстракционный передел.
Электроника
В последние годы[когда?] в значительной степени возрос интерес к молибдату лантана, обладающему высокой проводимостью.
Электронная микроскопия
Применение катодов из LaB6 (Гексаборид лантана) в электронных микроскопах позволило повысить разрешающую способность за счёт увеличения плотности тока в 6 раз и одновременно увеличить ресурс катода в 5 раз (до 500 часов) по сравнению с вольфрамовыми катодами.
Химические источники тока
Весьма значительный интерес промышленности и электроники вызывают производство и исследования в области аккумуляторов с твёрдым электролитом. В этой области очень большое значение приобрёл фторид лантана в качестве электролита и с металлическим лантаном в качестве анода, катодом обычно является фторид висмута, свинца или меди. Привлекательная сторона таких источников тока — это очень высокая удельная энергоёмкость по объёму (3000 Вт·ч/дм³, практически достигнутая — 1500—2300 Вт·ч/дм³), длительный срок сохранности энергии, прочность, долговечность; в этой связи многие ведущие специалисты[кто?] видят в них альтернативу любым другим видам аккумуляторов.
Биологическая роль
В середине 30-х годов советский ученый А. А. Дробков исследовал влияние редкоземельных металлов на разные растения. Он экспериментировал с горохом, репой и другими культурами, вводил редкоземельные металлы вместе с бором, марганцем или без них. Результаты опытов говорили, что редкоземельные металлы нужны для нормального развития растений… Но прошла четверть века, прежде чем эти элементы стали относительно доступны. Окончательный ответ на вопрос о биологической роли лантана предстоит ещё дать.[источник не указан 307 дней]
В медицине карбонат лантана используется при гиперфосфатемии как препарат, препятствующий всасыванию фосфатов из пищи.
Изотопы
В природе лантан встречается в виде смеси двух изотопов: стабильного 139La и радиоактивного 138La (период полураспада 2·1011 лет). Доля наиболее распространённого изотопа 139La в смеси составляет 99,911 %[3]. Искусственно получены 39 неустойчивых изотопов с массовыми числами 117—155 и 12 ядерных изомеров лантана[4][5]. Наиболее устойчивым из них является лантан-137 с периодом полураспада около 60 тыс. лет. Остальные изотопы имеют периоды полураспада от нескольких миллисекунд до нескольких часов.
См. также
- Мишметалл — сплав лантана с другими редкоземельными элементами.
Примечания
Ссылки
| Электрохимический ряд активности металлов | |
|---|---|
| Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
Химический элемент лантан (Lanthanum): описание, свойства, формула
Лантан — это химический элемент периодической системы Менделеева. Его название происходит от латинского Lanthanum, в переводе с греческого «лантано» - скрытность. Лантан редкоземельный металл. Его атомный номер 57, атомарная масса 138,9050. В природе элемент состоит из двух изотопов - лантана 139 и радиоактивного лантана 138.
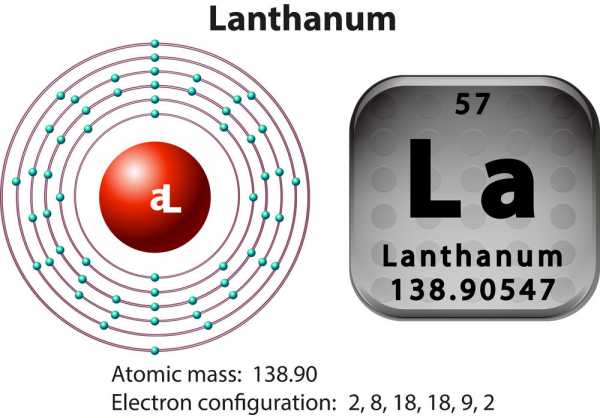
Краткая атомарная и химическая характеристика
В таблице Менделеева находятся в III B группе, шестом периоде. Рядом расположены церий, неодим.
Электронная формула лантана: KLMN4s24p64d105s25p65d16s2, Eион(Ме=>Ме++e)=5,59 эВ. Атомарное масса - 138,9055, радиус атома 187 пм, плотность – 6,162 граммов на сантиметр кубический. Кристаллическая решетка - гексагональная. Ее период – 3,750 А.
Атом химического элемента лантана - положительно заряженное ядро (+57), внутри заключено 57 протонов, 82 нейтрона. Вокруг ядра на 6 орбитах находятся в движении 57 электронов.
Подробная информация о лантане доступна в учебниках по химии и кратко о нем рассказывается в данной статье.
Кратная история открытия лантана
После того как существование химического элемента лантана было теоретически предсказано, его не смогли отыскать в течение 36 лет. К первооткрывателю этого металла следует отнести молодого шведского химика Йенса Якоба Берцелиуса, который в 1803 году тщательно изучил минерал, ставший в настоящее время известным как церит. Ученый определил, что структура его неоднородна и содержит какой-то неизвестный элемент.
Несколько ранее химик-студент по фамилии Эрдман в скальных породах Норвегии обнаружил неизвестный науке минерал, который назвал в честь учителя Карла Мозандера - мозандеритом.
Через некоторое время Мозандер еще раз подробно изучил найденные минералы и сделал вывод, что действительно, в них содержится неизвестный науке металл. Доказать это ему посчастливилось лишь в 1839 году. В результате своих опытов он выделил новый элемент, который Берцелиус предложил назвать лантаном.
Химические свойства, внешний вид
Лантан отличается мягкостью, ковкостью. Металл вязкий. Химические свойства обыкновенные, при этом он отличается высокой тугоплавкостью. Лантан – металл серебристо белого цвета. При нахождении в сухом воздухе защищают свою внутреннюю структуру оксидной пленкой, не окисляясь. Однако если в воздухе имеется хоть небольшая влажность, то металлический лантан достаточно быстро окисляется, превращаясь в гидроокись.

При нагревании этого металла до температуры 400 градусов Цельсия в кислородной среде он сгорает. Пламя яркое, с большим выделением тепла. При накаливании лантан в азотной атмосфере образует черный нитрид. В хлорной среде воспламеняется при температуре комнатной. В минеральных кислотах растворяется хорошо. На щелочные растворы не реагирует. Соединения химического элемента лантана имеют валентность 3 +.
При контакте с водородом металл начинает выделять большое количество тепла уже при температуре окружающей среды около 20-25 градусов Цельсия. Образует переменные гидриды, так как лантан отличается разными степенями поглощения водорода, которые зависят от температуры.
Получение
Изначально лантан был получен не в чистом виде, а с большим количеством примесей. Мозандер получил этот химический элемент в процессе нагрева хлористого лантана и калия.

В настоящее время, промышленность имеет возможность получать лантан с чистотой около 100 %.
Химический элемент лантан выделяют посредством длительного и сложного химического процесса, который связан с разделением на фракции исходного сырья. Лантан всегда находится в породах вместе с неодимом, церием, празеодимом. Изначально из таких пород выделяют церий, а потом иные химические элементы при ионной хроматографии и экстракции. Далее отделяют осаживанием как оксалат лантана и прокаливают. В результате получают оксид лантана.
Как металл лантан получают путем воздействия на соединения, содержащие большое количество лантана, кальцием либо электролизом в сочетании с определенными химическими катализаторами.
В настоящее время, в целях получения металла в промышленных масштабах высокой чистоты, до 99,9 %, используют более совершенные экстракционные и ионообменные методы. Подробно технологии выделения лантана изложены в специализированных учебниках по химии.

Нахождение в природе
В земной коре химический элемент лантан - редкий материал, не зря его относят к так называемым редкоземельным элементам. В природе в чистом виде не существует, входит в состав минералов, а именно: бастензита, моноцита, лопартита, апатита. Это очень рассеянный элемент. Содержание в земной коре - 1,8.10-3% от общей массы планеты.
Семейство лантаноидов
Свое название химический элемент лантан передал группе, в которой объединены 15 металлов. Они не похожи на остальные элементы. Общее их название - лантаноиды. Их отличает и то, что они до настоящего времени мало изучены, хотя применяются достаточно активно в промышленности.

В настоящее время интерес к лантаноидам очень высок. Он ощутимо возрос после того, как начали работать первые атомные реакторы. Они, в том числе, в качестве побочных продуктов образуют элементы группы лантаноидов.
Все представители металлов группы лантаноидов обладают стабильными изотопами, за исключением прометия. Всего к этому ряду (группе) редкоземельных элементов относятся следующие металлы:
- Лантан.
- Гадолиний.
- Гольмий.
- Диспрозий.
- Европий.
- Иттербий.
- Лютеций.
- Празеодим.
- Прометий.
- Самарий.
- Тербий.
- Тулий.
- Церий.
- Эрбий.
Области применения лантана
Несмотря на то что, металлы группы лантаноидов очень малочисленно в земной коре, их используют в промышленности достаточно широко.
Из материалов, содержащих лантан, изготовляют колесики чрезвычайно популярных и востребованных зажигалок.

Так, оксид лантана применяют для изготовления оптических стекол (так называемого лантанового стекла). Линзы, призмы, изготовленные с применением этого металла, используются в фото- и киноаппаратуре, в астрономической оптике.
Хромит лантана, который легирован магнием, стронцием или кальцием применяется в изготовлении надежных и высокотемпературных нагревателей, способных работать с температурой до 1780 градусов Цельсия в кислородной атмосфере. С возрастанием температуры сопротивление хромита лантана уменьшается. Коэффициент термического расширения химического элемента лантана достаточно низкий, вследствие этого электронагреватели отличаются значительной долговечностью.
Оксиды лантана используются в синтезировании сверхпроводников, которые предназначены для работы в условиях высоких температур.
Нашел свое применение химический элемент лантан в изготовлении специальных стекол, предназначенных для остекления помещений. Такие полотна, в структуру которых входят соединения лантана, имеют уникальные свойства, они способны снижать температуру в помещениях до 7 градусов.
Лантано-никелевые сплавы (гидриды) широко используются в качестве аккумуляторов водорода. Они представляют собой емкие и надежные хранилища. Для них открыта перспектива быть широко примененными в автомобилестроении, в качестве емкостей для хранения альтернативного топлива.
В электронике лантан используется в качестве проводника. Гексаборид лантана нашел свою применение в электронных микроскопах, это позволило значительно повысить разрешающую способность электронных микроскопных систем, повысить их ресурс.
В качестве еще одной перспективы применения химического элемента лантана современные исследователи видят его в качестве основной составляющей аккумуляторов нового типа с твердым электролитом. Эксперименты показывают, что такие источники обладают высокой удельной электроемкостью. У них длительный срок сохранения энергии без потерь. Отличаются прочностью и долговечностью. Вследствие чего они, возможно, в недалеком будущем составят серьезную конкуренцию другим аккумуляторам.
В медицине препараты, содержащие лантан, нашли применение при гиперфосфатемии. Их назначают в качестве лекарственного средства, который препятствует всасыванию фосфатов при приеме пищи.
Лантан в атомной промышленности
Очень важен металлический лантан, обладающий высокой чистотой, в атомной промышленности. Этот химический элемент незаменим в технологии переработки ядерного топлива для получения плутония. В расплавленный уран, в который в качестве примесей включен металлический плутоний, вливают расплавленный лантан. Он сразу же начинает извлекать в себя изотопы плутония из урана, постепенно всплывая. Начинает плавать на поверхности. С ураном не смешивается. Полученный сплав потом перерабатывают химическими способами для извлечения плутония. Вследствие этого физики-ядерщики утверждают, что лантан - это отец ядерного оружия.
лантан - это... Что такое лантан?
ЛАНТА́Н -а; м. Химический элемент (La), редкоземельный металл (применяется как легирующая добавка к алюминиевым сплавам, компонент оптических стёкол, в лазерах).
◁ Ланта́новый, -ая, -ое.
ЛАНТА́Н (лат. Lanthanum, от греческого «лантано» — скрываюсь), La (читается «лантан»), химический элемент с атомным номером 57, атомная масса 138,9055. Природный лантан состоит из двух изотопов: 139La (99,911%) и радиоактивного 138La (-радиоактивен, период полураспада Т1/2 2.1011лет). Конфигурация двух внешних электронных слоев 5s2p6d16s2. Степень окисления +3 (валентность III).Расположен в группе IIIВ в 6 периоде периодической системы. Вместе с неодимом (см. НЕОДИМ) и церием (см. ЦЕРИЙ) относится к наиболее распространенным редкоземельным элементам. Радиус атома 0,187 нм, радиус иона La3+— от 0,117 (координационное число 6) до 0,150 нм (12). Энергии последовательной ионизации 5,577, 11,06, 19,18 эВ. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,1.
История открытия
Лантан открыт в 1839 шведским химиком К. Г. Мосандером (см. МОСАНДЕР Карл Густав) в виде оксида лантана La2 O3при исследовании примесей, содержащихся в соединениях церия (см. ЦЕРИЙ).
Нахождение в природе
Содержание лантана в земной коре 2,9·10-3% (по массе). В природе вместе с другими редкоземельными элементами входит в состав минералов: монацит (см. МОНАЦИТ), бастензит, лопарит (см. ЛОПАРИТ) и апатит (см. АПАТИТ).
Получение
Получение лантана связано с разделением исходного сырья на фракции. Лантан концентрируется вместе с церием, празеодимом (см. ПРАЗЕОДИМ) и неодимом. Сначала из смеси отделяют церий (используя его способность образовывать устойчивые соединения в степени окисления +4), затем оставшиеся элементы разделяют методами ионной хроматографии и экстракции. Для отделения от других лантаноидов и редкоземельных элементов лантан осаждают в виде оксалата La2(C2O4)3·9H2O, прокаливание которого приводит к образованию La2О3. Металлический лантан получают действием на LaCl3 (LaF3) кальция или электролизом расплава LaCl3 в присутствии СаСI2 или ВаСI2.
Физические и химические свойства
Лантан — серебристо-белый металл.
До температуры 277°C устойчив a-La с гексагональной решеткой, а = 0,3772 нм и с = 1,2144 нм. При температурах 277—861°C устойчив b-La с кубической решеткой типа Cu. При температуре 861—920°C устойчив g-La с кубической решеткой типа a-Fe. Температура кипения лантана 3447°C, плотность a-La 6,162 кг/дм3.
На воздухе лантан быстро окисляется с образованием гидратированного оксикарбоната. При нагревании до 450°C в среде кислорода (см. КИСЛОРОД) La воспламеняется, образуя основной оксид La2O3. При нагревании La реагирует с N2 с образованием нитрида, с H2с образованием гидридов переменного состава. При нагревании реагирует с галогенами (см. ГАЛОГЕНЫ), серой (см. СЕРА) и фосфором (см. ФОСФОР).
Гидроксид La(ОН)3.получают действием растворов щелочей на водорастворимые соли лантана.
Плохо растворимы в воде фторид, фосфат, карбонат, оксалат и некоторые другие соли лантана.
Применение
Лантан — легирующая добавка к алюминиевым, магнивыем, никелевым, кобальтовым сплавам, компонент миш-металла (см. МИШ-МЕТАЛЛ), применяемого для улучшения свойств коррозионностойкой, быстрорежущей и жаропрочной стали. Интерметаллид LaNi5 — перспективный аккумулятор. Оксисульфид и алюминат — компоненты люминофоров. Оксид лантана используют для получения оптического стекла.
Лантан — Знаешь как
Содержание статьи
(Lanthanum; — скрываюсь, остаюсь незамеченным), La — редкоземельный хим. элемент III группы периодической системы элементов; ат. н. 57, ат. м. 138,055. Серебристо-белый металл. В соединениях проявляет степень окисления + 3. Природная смесь состоит из стабильного 139La (99,911%) и радиоактивного 138La(0,089%) изотопов. Изотоп 138La распадается путем К-захвата с периодом полураспада 1 • 1011 лет. Изотоп 139La образуется при делении урана (6,3% массы всех осколков) и является «реакторным ядом». Получены радиоактивные изотопы с массовыми числами 127—137 и 140— 144. Макс. период полураспада (6 • 104 лет) — у изотопа 137La. Лантан открыл в 1839 швед, химик К. Мозандер, доказавший неоднородность открытой ранее «цериевой земли».
По распространенности лантан занимает среди редкоземельных элементов третье место после церия и неодима. Содержание Л. в земной коре 1,8 х 10-3 %. Л. и остальные элементы цериевой подгруппы получают преим. из минералов монацита и бастнезита. В монаците содержится 17% La203, в бастнезите 24% La203. Кристаллическая решетка Л. при комнатной т-ре гексагональная плотноупако-ванная (типа альфа-лантан) с периодами а = 3,770 ± 0,002А, с =12,159 ± 0,008А и плотностью 6,162 г/см3. Имеет три аллотропические модификации. Т-ры превращений: альфа → бета 310 ± 5°С, бета → гамма 864° С. Бета-лантан имеет гранецентрированную кубическую решетку с периодом а = 5,304 ± 0,003А и плотностью 6,190 г/см3, гамма-лантан — объемноцентриро-ванную кубическую решетку с периодом а = 4,26 ± 0,01 А и плотностью 5,97 г/см3. Т-ра плавления 920 ± 5° С; т-ра кипения 3470° С. Теплота плавления 1,6 ккал/г-атом; теплота испарения 93,8 ± 0,9 ккал/г-атом. Атомная теплоемкость (кал/г-тервале т-р 0—310° С) сp = 6,27 +4- 2,6 • 10 г. Коэфф. теплопроводности альфа-лантана (в интервале т-р 25—30° С) 0,033 ± 0,003 кал/см x сек • град. Коэфф. термического расширения альфа-лантана 4,9 X 10-6 (т-ра 25° С), бета-лантана 9,6 • 10-6 (среднее значение в интервале т-р 325 — 775° С). Удельное электрическое сопротивление (ом • см) альфа-лантана 56,8 • 10 (т-ра 25° С), бета-лантана 98 • 10-б (т-ра 560° С), гамма-лантана 126 х10-6 (т-ра 890° С). Температурный коэфф. электр. сопротивления альфа-лантана (т-ра 0° С) 2,18 х10 град . Т-ра перехода в сверхпроводящее состояние альфа-лантана 4,90 ± 10 К, бета-лантана 5,85 ± 0,11 К. Работа выхода электронов 3,3 эв. Металл парамагнитен. Поперечное сечение поглощения тепловых нейтронов атомом изотопа 139La составляет 9 барн. При комнатной т-ре модуль норм, упругости 3915, по другим данным 7031— 7734 кгс/мм2; модуль сдвига 1518 кгс/мм2; коэфф. Пуассона 0,288. У литого образца (т-ра 20° С) предел текучести 12,8 кгс/мм2; предел прочности 13,3 кгс/мм2; относительное удлинение 8%. Твердость Л. по Виккер-су (т-ра 20° С): литого 50, отожженного 37, кованого 120—178 кгс/мм2. При комнатной т-ре достаточно чистый Л. поддается ковке и прессованию, но не обладает достаточной вязкостью. Возможно изготовление листов из чистого Л. ковкой при комнатной т-ре. Лантан как и другие редкоземельные металлы, обладает большой хим. активностью.
В сухом воздухе покрывается окисной пленкой голубоватого цвета, предохраняющей металл от дальнейшего окисления. Во влажном воздухе постепенно превращается в гидрат окиси белого цвета. При т-ре 450° С в среде кислорода Л. воспламеняется. С азотом Л. в раскаленном состоянии образует нитрид белого цвета. При т-ре 240° С в среде водорода образует гидрид черного цвета, однако поглощение водорода металлом происходит и при комнатной т-ре. Лантан образует также весьма прочные галогениды, сульфиды, реагирует с большинством др. хим. элементов. Легко растворяется В соляной, серной и азотной к-тах. Соли Л. белого цвета. Сплавляется со многими металлами. Плавку ведут в инертной среде или в вакууме. Металлический Л. чистотой до 99,48% получают электролитическим способом. В пром-сти наиболее широко распространен электролиз безводного хлорида в расплаве. Металл поставляют в виде слитков трапецоидальной или круглой формы массой 2—5 кг. Лантановый миш-металл применяют для улучшения св-в коррозионностойкой, быстрорежущей и жаропрочной стали. Кроме того, лантан служит компонентом алюминиевых и др. легких сплавов. Окись Л. входит в состав керамических глазурей, оптического стекла, используется в реагентах, утяжеляющих натуральный и искусственный шелк. Изотоп 140La (с периодом полураспада 40,22 ч) — радиоактивный индикатор при изучении процессов разделения Л. и лантаноидов.
Лантан в природе
Встречается в виде устойчивого изотоп 89 La ( 99,91% ) . В литосфере содержится лантана 2 ⋅ 10⁻⁴ в . Встречаются минералы достаточно богатые этим элементом , однако эти минералы настолько рассеяны , что переработка связана с концентрированием ( отделением больших количеств пустой породы ) , что связано с большими энергозатратами .Поскольку лантан имеет отрицательное значение стандартных электронных потенциалов , получают его электролизом расплавленных хлоридов или нитратов , а для понижения температур плавления добавляют соли других металлов .
Помимо электролиза его получают восстанавливая при высоких температурах из их хлоридов или фторидов наиболее активными металлами ( калием и кальцием ) :
LaCl3 + 3K = La + 3KCl
Физические и химические свойства
Лантан — серебристо — белый металл , существующий в двух кристаллических видоизменениях с различными типами и параметрами решеток .
В химических реакциях атом иттрия теряет по три электрона и ведёт себя как сильный восстановитель .
При обычных температурах поверхность его окисляется кислородом с образованием защитных плёнок . Но при нагревании в кислороде горит и образуются оксиды La2O3 .
С водой лантан взаимодействует медленно , образующиеся при этом гидроксиды покрывают его защитной плёнкой :
2La + 6h3O = 2La( OH )3↓ + 3h3↑
Из кислот лантан легко вытесняет водород :
2La + 3h3SO4 = La2( SO4 )3 + 3h3↑
и растворяется в кислотах .
Соединения лантана
Проявляет степень окисления +3 , их ионы имеют на внешнем уровне по 8 электронов , большой заряд этих ионов Э³⁺обусловливается склонность скандия к комплексообразованию .
Его оксиды отвечают формуле La2O3 , бесцветны , тугоплавки , получаются разложением нитратов :
4La( NO3 )3 = 2LaO3 + 12NO2↑ + 3O2↑
Он обладает основным характером , энергично реагировать с водой , образуя гидроксиды :
La2O3 + 3h3O = 2La( OH )3
Он мало растворим в воде , но легко растворяется в кислотах , гидроксид скандия La( OH )3 проявляет признаки амфотерности .
Соли лантана из воды кристаллизуются в виде аквасоединений . Хлориды , нитраты и ацетаты растворимы в воде и гидролизуются в незначительной степени . Мало растворимые в воде фториды , карбонаты и оксалаты лантана переходят в раствор под действием избытка осадителя с образованием комплексных соединений .Положительные ионы лантана имеют координационные числа от 3 до 6 . Важнейшие лиганды в комплексе металла — это фторид — , карбонат — , сульфат — , оксалат- ионы . Ион лантана La³⁺ образует с фторид — ионами комплексные соединения :
KF + LaF3 = K[LaYF4]
3KF + LaF3 = K3[LaF6]
Применение лантана
Оксид иттрия ( III ) La2O3 добавляют к оптическому стеклу для повышения показателя преломления . Присадка лантана к сталям , чугуну и сплавам цветных металлов повышает их устойчивость к коррозии и жаростойкость , улучшает механические свойства .
Применения актиния ограничено тем , что он опасен из за альфа излучений , а все соединения его ядовиты .
Лит.: Савицкий Е. М. [и др.]. Сплавы редкоземельных металлов. М., 1962; Ф и л я н д М. А., Семенова Е. И. Свойства редких элементов (Справочник). М.
Статья на тему Лантан
Лантан применение — Знаешь как
Содержание редкоземельных элементов в почве тундр достигает почти 0,5 %. Маловероятно, чтобы эти распространенные элементы не влияли на развитие растений, а возможно, и организмов, стоящих на других ступенях лестницы эволюции. Еще в середине 30-х годов советский ученый А. А. Дробков исследовал влияние редких земель на разные растения. Он экспериментировал с горохом, репой и другими культурами, вводил редкие земли вместе с бором, марганцем или без них. Результаты опытов говорили, что редкие земли нужны для нормального развития растений. Но прошло четверть века, прежде чем эти элементы стали относительно доступны. Окончательный ответ на вопрос о биологической роли лантана и его команды еще предстоит дать.
Металлурги в этом смысле значительно обогнали агрохимиков. С лантаном и его командой связано одно из самых значительных событий последних десятилетий в черной металлургии. Высокопрочный чугун обычно получали, модифицируя его магнием. Физический смысл этой добавки станет ясным, если вспомнить, что в чугуне 2—4,5% углерода в виде чешуйчатого графита, который и придает чугуну главный его технический недостаток — хрупкость. Добавка магния заставляет графит перейти в более равномерно распределяющуюся в металле шаровидную или глобулярную форму. В результате значительно улучшается структура, а с ней и механические свойства чугуна.
Однако легирование чугуна магнием требует дополнительных затрат: реакция идет очень бурно, расплавленный металл брызжет во все стороны, в связи с чем приходилось сооружать для этого процесса специальные камеры. Редкоземельные металлы действуют на чугун аналогично: «убирают» окисные примеси, связывают и выводят серу, способствуют переходу графита в глобулярную форму. И при этом не требуют специальных камер — реакция протекает спокойно. А результат?На тонну чугуна вводят всего 4 кг (0,4%) сплава ферроцерия с магнием, и прочность чугуна увеличивается вдвое! Такой чугун во многих случаях можно использовать вместо стали, в частности при изготовлении коленчатых валов. Мало того, что высокопрочный чугун на 20— 25% дешевле стальных отливок и в 3—4 раза дешевле стальных поковок. Стойкость против истирания у чугунных шеек валов оказалась в 2—3 раза выше, чем у стальных.
Коленчатые валы из высокопрочного чугуна уже работают в тепловозах и других тяжелых машинах. Редкоземельные элементы (в виде мишметалла и ферроцерия) добавляют и в сталь разных сортов. Во всех случаях эта добавка работает как сильный раскислитель, превосходный дегазатор и десульфатор. В некоторых случаях редкими землями легируют… легированную сталь. Хромоникелевые стали трудно прокатывать — всего 0,03% мишметалла, введенные в такую сталь, намного увеличивают ее пластичность. Это облегчает прокатку, изготовление поковок, обработку металла резанием. Редкоземельные элементы вводят и в состав легких сплавов. Известен, например, жаропрочный сплав алюминия с 11% мишметалла.
Добавки лантана, церия, неодима и празеодима позволили в три с лишним раза поднять температуру размягчения магниевых сплавов и одновременно повысили их коррозионную стойкость. После этого сплавы магния с редкоземельными элементами стали применять для изготовления деталей сверхзвуковых самолетов и оболочек искусственных спутников Земли.Редкоземельные добавки улучшают свойства и других важных металлов — меди, хрома, ванадия, титана… Не удивительно, что металлурги год от года все шире используют редкоземельные металлы.Лантан и его аналоги нашли применение и в других областях современной техники.
В химической и нефтяной промышленности они (и их соединения) выступают в качестве эффективных катализаторов, в стекольной — как красители и как вещества, придающие стеклу специфические свойства. Разнообразно применение лантаноидов в атомной технике и связанных с нею отраслях. Но об этом — позже, в разделах, посвященных каждому из лантаноидов. Укажем только, что даже созданный искусственно прометий нашел применение: энергию распада прометия-147 используют в атомных электрических батарейках. Одним словом, время безработицы редкоземельных элементов закончилось давно и бесповоротно.Не надо считать, однако, что все проблемы, связанные с «узлом» в периодической системе, уже разрешены. В наши дни особенно актуально звучат слова Дмитрия Ивановича Менделеева о «редких землях»: «Тут скопилось за последние годы очень много нового»… Однако считать, что познано все и вся, что редкоземельная тематика себя исчерпала, могут только дилетанты. Специалисты же, напротив, уверены, что познание лантана и его командытолько начинается, что эти элементы еще не раз удивят научный мир. А может,— не только научный,
РЕАКТОРНЫЙ ЯД. Природный лантан состоит из двух изотопов смассовыми числами 138 и 139, причем первый (его доля всего 0,089%) радиоактивен. Он распадается путем К-захвата с периодом полураспада 3,2 х 1011 лет. Изотоп лантан-139 стабилен. Между прочим, он образуется в атомных реакторах при распаде урана (6,3% массы всех осколков). Этот изотоп считается реакторным ядом, поскольку он довольно активно захватывает тепловые нейтроны, что характерно и для лантаноидов. Из искусственных изотопов лантана наибольший интерес представляет лантан-140 с периодом полураспада 40,22 часа. Этот изотоп применяют в качестве радиоактивного индикатора при изучении процессов разделения лантана и лантаноидов.
КАКОЕ ИЗ ТРЕХ? Элементы, следующие за лантаном, называют редкоземельными, или лантанидами, или лантаноидами. Какое из этих названий наиболее оправданно? Термин «редкие земли» появился в XVIII в. Теперь его относят к окислам скандия, иттрия, лантана и его аналогов; первоначально же этот термин имел более широкий смысл. «Землями» вообще называли все тугоплавкие окислы металлов. По отношению к элементам с атомными номерами от 57 до 71 это справедливо: температура плавления La2О3 — около 2600° С. В чистом виде многие из этих «земель» редки и поныне. Но о редкости редкоземельных элементов в земной коре говорить уже не приходится…Термин «лантаниды» ввели для того, чтобы показать, что следующие четырнадцать элементов идут за лантаном. Но тогда с равным успехом фтор можно назвать кислородидом (или оксидом)— он же следует за кислородом, а хлор — сульфидом… Но в понятия «сульфид», «фосфид», «гидрид», хлорид» и так далее химия издавна вложила другой смысл. Поэтому термин «лантаниды» большинство ученых считают неудачным и пользуются им все реже.«Лантаноиды»— более оправданно. Окончание «оид» указывает на подобие. «Лантаноиды»— значит «лантаноподобные». Видимо, этим термином и следует пользоваться для обозначения 14 элементов — аналогов лантана.
«НОВАЯ ИСТОРИЯ». В истории лантана и лантаноидов можно выделить два отрезка времени, особенно насыщенных открытиями и спорами. Первый из них относится к концу XIX в., когда лан-таноиды открывали и «закрывали» так часто, что в конце концов это стало даже не интересно… Второй бурный период — 50-е годыXX в., когда развитие атомной техники помогло получать боль-шие количества редкоземельного сырья и стимулировало новые исследования в этой области. Именно тогда наметилась тенденция получать и применять редкоземельные элементы не в смеси, а каждый по отдельности, используя их специфические свойства. Не случайно за 15 лет (с1944 по 1958 г.) количество научных публикаций, посвященных лантаноидам, выросло в 7,6 раза, а по некоторым индивидуальным элементам и того больше: по гольмию, например,— в 24, а по тулию — в 45 раз!
МАСКИРУЯСЬ ПОД КРАХМАЛ. Одно из соединений лантана —его основной ацетат — ведет себя как крахмал, если к нему добавляют иод. Белый гель принимает ярко-синюю окраску. Этим свойством аналитики иногда пользуются для открытия лантана в смесях и растворах.
ДВУХВАЛЕНТЕН ЛИШЬ ФОРМАЛЬНО. Установлено, что во всех соединениях лантан проявляет одну и ту же валентность—3+. Но как тогда объяснить существование серо-черного дигидрида LaH2 и желтого сульфида LaS? Установлено, что LaH2 — это относительно устойчивый полупродукт реакции образования LaH3 и что в обоих гидридах лантан трехвалентен. В молекуле дигидрида есть металлическая связь La —La. С сульфидом все объясняется еще проще. Это вещество обладает высокой электропроводностью, что заставляет полагать наличие в нем ионов La3+ и свободных электронов. Кстати, LaH2 тоже хорошо проводит ток, в то время как LaH3— полупроводник.
Статья на тему Лантан применение
Лантан (La) Lanthanum - все о металле (свойства и структура)

Быстрый поиск по тексту
История Лантана
Всё началась с того, что в 1826 году несколько учёных обнаружили два неизвестных материала, которые представляли собой новую землю. Данная новая земля после некоторых исследователей получила название иттрия и церия. Как ни странно, земля не была окончательно признана однородно и имела некоторые примеси. В последствии ещё долгих десятилетий данная земля подвергалась исследованиям учёных, одним из которых был Берцелиус Мозандер, на его плечи и записали открытие Лантана. Лантан был найден в цериевой земле в виде небольших Лантановых пылинок. Как не странно, с открытием Лантановой пыли не сложно было открыть и сам материал лантан.
Химические свойства Лантана
Лантан является одним из редкоземельных материалов, порядковый и атомный номер которого составляет 75. Было высчитано то, что атомная масса данного вещества составляет 138,91, при этом он обладает достаточно низкой плотностью в 6,16 г/см3.
При этом, основным и уникальным свойством данного материала является высокая тугоплавкость данного материала и его высокая температура плавления, которая составляет 920 градусов Цельсия. Твёрдость данного материала можно точно сопоставить с элементами олова, поскольку он также разлагает элементы воды. Помимо этого, данный материал обладает отличными свойствами при химических реакциях с различными кислотами. Если данный материал нагреть до определённой температуры, которая будет гораздо меньше его температуры плавления, он также может реагировать с элементами хлора и серы. На открытом воздухе данный материал очень легко окисляется, именно поэтому на его поверхности находится специализированная плёнка, которая не даёт окислиться самому материалу внутри.
Этот процесс достаточно уникален и полезен для химических и физических свойств данного материала, поскольку с течением времени на поверхности внутренняя кристаллическая решётка материала не разрушается. Материал остаётся целым и не обладает внутренними повреждениями, но при этом сверху образуется тонкая окислившаяся плёнка.
Физические свойства Лантана
Как уже упоминалось ранее, Лантан уникален своей высокой температурой плавления при низкой плотности. Его температура плавления составляет порядка 920 градусов Цельсия, но и это ещё не все его уникальные свойства. При своей относительно небольшой плотности, лантан обладает очень высокой температурой внутреннего кипения, которая составляет – 4515 градусов Цельсия. По своим физическим свойствам, лантан обладает серебристо-белёсым цветом, который немного напоминает гранулы серебра. Данный материал весьма тягучий и ковкий, что значительно расширяет круг его применения.

Как правило, в чистом виде Лантан не применяется, поскольку является достаточно дорогим материалом. Однако, данный материал очень часто добавляется в состав стали и чугуна, для повышения проводящей температуры конечного продукта. Иногда Лантан применяется также и в молекулярной биологии, поскольку он отлично позволяет расширить спектр лучей, для определения тех или иных биологических показателей. Для более простого понимания его свойств, Лантан используется при создании LED дисплеев и ламп. Также данный материал применяется при создании устройств памяти для любой вычислительной техники.
Добыча Лантана
В самой природе, Лантан встречается не так уж и часто, и как правило, содержится в таких минералах как бастнезит и монацит. Помимо этого, данный материал находится ещё в нескольких минералах, в очень малых количествах. Добычей редкоземельных материалов, в том числе Лантан, по всему миру осуществляют всего несколько стран. Самыми крупными добывающими Лантан странами является – Китай, США и Индия.
Для добычи концентрата Лантана чистотой до 99% используются принципы крупного, среднего и мелкого дробления пароды, представленной ранее. После того, как был получены мелкие крошки Лантана, он проходит процесс искусственного обогащения, что позволяет выявить чисты Лантан 99%. Данный процесс не сложный, но занимает достаточно длительный промежуток времени, что и влияет на конечную цену данного продукта.

Редкость Лантана
Данный материал является достаточно редким, поскольку в крупном количестве встречается только в двух материалах по всему миру, остальные материалы содержат лишь крохотную часть элементов Лантана. Самым крупным импортёром Лантана является Китай, который в год добывает порядка 100 тысяч тонн содержащего Лантан элемента в год. Поскольку в природе в чистом виде данный материал не содержится, происходит процесс его искусственного синтеза и обогащения. Данный процесс обладает сложной структурой и занимает длительный промежуток времени, что в свою очереди и влияет на конечное ценообразование. До процесса обогащения, будущие частицы Лантана проходят процесс дробления и молятся до крайне мелкой фракции, которая в свою очередь в конечном итоге и становится химическим элементом Лантана.
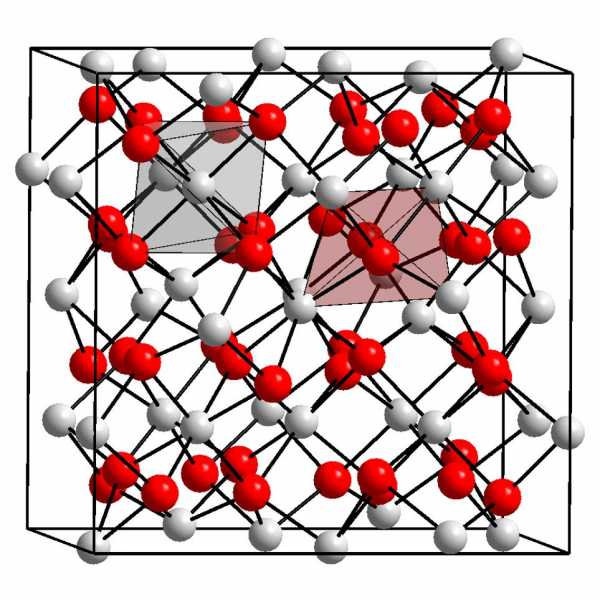
Лантаноиды — Википедия
Образцы лантаноидов в виде простых веществЛантано́иды (лантани́ды)[К 1] — семейство, состоящее из 15 химических элементов III группы 6-го периода периодической таблицы — металлов, с атомными номерами 57—71 (от лантана до лютеция)[1][2][3][4][5][6][7][8][9]. Все представители семейства имеют стабильные изотопы, кроме прометия.
Скандий, иттрий и лантаноиды относятся к группе редкоземельных элементов (сокр. РЗЭ) и часто рассматриваются в этом контексте, однако распространенность отдельных элементов показывает, что редкими они не являются. В научных материалах для обозначения лантаноидов применяют вышеуказанный термин, включая в него иттрий и скандий, или по отдельности.
Запись Ln используется для указания на все или некоторые металлы, ионы, степени окисления, при записи химических формул и пр.
У всех лантаноидов, начиная с церия и заканчивая иттербием, заполняется 4f-подоболочка; у лантана 4f-электронов нет, а у лютеция — 14. Неспаренные 4f-электроны наделяют некоторые металлы различными ценными магнитными, спектроскопическими и люминесцентными свойствами. Более того, поскольку эти электроны хорошо экранированы внешними подоболочками (5s и 5p), спектральные характеристики сохраняются при добавлении лигандов. Все лантаноиды образуют катионы Ln3+ (некоторые ещё и Ln2+, Ln4+), ионный радиус которых постоянно уменьшается при увеличении атомного номера, — этот феномен известен как лантаноидное сжатие (то же самое проявляется у актиноидов)[10]. Непрерывно понижается осно́вность элементов от лантана до лютеция, что обуславливает различие в растворимости солей и в устойчивости их комплексных соединений[11].
Химическая связь с лантаноидами имеет почти всегда ионный характер. Лантаноиды — «тяжелые» акцепторы и имеют значительное сходство по своим свойствам с донором атомов — кислородом, из-за чего наиболее вероятными биологическими лигандами для них являются карбоксильные и фосфатные группы. Координационные числа для них могут быть от 6 до 12 (8—9 преимущественно в биологических системах)[10].
Публикация работы норвежским геохимиком Виктором Гольдшмидтом, в которой впервые был употреблен термин лантаноиды, произошла в 1925 г. (аналогично было дано название актиноидам в 1937 г.)[12][13][14].
Очень много недоразумений, связанных с лантаноидами, в употреблении терминологии. Название «редкая земля» первоначально применялось для описания почти всех неизученных, неизвестных природных оксидов, и вплоть до 1920 г. к ним относили даже ThO2 и ZrO2. Примерно в то же время термин начали использовать для обозначения самих элементов, а также группы элементов, которые с большим трудом можно было отделить друг от друга[15][16].
Изначальное разделение элементов на цериевую («легкие земли»; La—Eu) и иттриевую («тяжелые земли»; Gd—Lu) группы основывалось на различии в растворимости двойных сульфатов, образованных лантаноидами, с сульфатами натрия или калия. В дальнейшем была установлена периодичность изменений свойств в группе, соответствовавшей их разделению на две подгруппы[11].
Примечателен тот факт, что термины «редкоземельные металлы» и «щелочноземельные металлы» — до сих пор использующиеся в химии — происходят от существительного слова «земля», бывшего в употреблении у алхимиков, ятрохимиков и ранних флогистонистов в качестве основного указания на огнестойкость, нерастворимость осадков, образованных после горения (окисления) или других глубинных химических взаимодействий в субстанциях. Только после 1750-х гг. химики начали понимать, что кремниевая земля (англ. silica), алюминиевая земля (англ. alumina), тальк, известь — все они являются разными землями, если судить по химическим свойствам. В 1779 г. к ним добавилась бариевая земля (англ. baryta), которую К. В. Шееле выделил из извести. А. Л. Лавуазье все пять земель в 1789 г. включил в свой список из 33 элементов, сделав примечание: они могут являться оксидами металлов с большим похождением на связь с кислородом, чем углеродом. Это и побудило многих химиков в начале XIX века восстанавливать известные земли и искать новые. Среди новых шести земель: циркониевой (1789, М. Клапрот), стронциевой (1790, А. Крофорд), бериллиевой (1798, Л. Н. Воклен) и ториевой (1829, Й. Берцелиус[К 2]) были открыты иттриевая (1794) и цериевая (1803). Открытие последней определило разницу между землями и обычными оксидами металлов, а в 1808 г. после того, как Г. Дэви восстановил электролизом щелочные земли до щелочноземельных металлов — кальция, бария, стронция и магния, — большинству химиков стало понятно, что истинные земли есть не что иное, как оксиды металлов[17].

Лантаноиды образуют самую большую группу элементов периодической системы, находящихся в природе. Их свойства настолько похожи, что с 1794 г., когда Юхан Гадолин выделил оксид иттрия, и вплоть до 1907 г. было сделано почти сто заявлений об открытии элементов[К 3]. Это объясняется тем, что в то время не существовало теста на индивидуальность элемента, а исследователям было непонятно, сколько же должно быть элементов в семействе, так как в периодической системе можно было поместить только один элемент — лантан. К 1913 г. на основании работы Г. Мозли уже стало понятно, что между лантаном и гафнием число элементов как раз равно четырнадцати[15]: при сравнении энергии рентгеновских спектров атомов элементов периодической таблицы и их атомного веса им были обнаружены пробелы, пропуски. Для устранения пропусков учёный счел необходимым расположить элементы в соответствии с химическими свойствами, а не увеличивающимся атомным весом. Его работа показала, что каждый элемент имеет постоянную величину — атомное число, увеличивающееся на постоянную величину от элемента к элементу. В конечном счёте лантаноиды были расположены в отдельном месте ниже основной таблицы. А в 1921 г. Нильсом Бором была предложена структура электронных орбиталей атома, которая объясняла проблему редкоземельных элементов[18]. (Лантаноиды часто называют и включают в понятие редкоземельные элементы, однако, например, лютеций по распространенности в земной коре превосходит серебро[3].)
Некоторое представление об их схожих химических свойствах можно получить из фактов истории изучения. Разделение различных элементов от содержащих их минералов заняло у ученых более ста лет[3][9], и даже вплоть до середины XX века (до развития ионообменной техники разделения) для получения в действительно чистом виде некоторых соединений редких лантаноидов требовалось до 40 000 повторений операции по фракционной перекристаллизации[en][19]. Например: в 1911 г. выделение чистого бромата тулия Ч. Джеймсом требовало около 15 000 таких операций[20], а за 15 лет Ж. Урбэном и его помощниками проведено суммарно около 20 000[21]. Указанный метод разделения является лишь одним из нескольких классических, и включает в себя некоторые свойства[20]:
- разница в основности позволяла при постепенном добавлении щелочи осадить в первую очередь менее осно́вные гидроксиды тяжелых лантаноидов;
- различия в растворимости таких солей, как оксалаты (например, возможность применения этого метода была обнаружена Карлом Мосандером при поиске способов получения чистых соединений эрбия и тербия[22][23]), двойные сульфаты и двойные нитраты.
Помимо вышеуказанных, существует возможность перевода в другие степени окисления, отличные от +3, например, CeIV, EuII. Указанный способ, применимый в отдельных случаях, позволял получать наиболее чистый продукт[20]. В настоящее время метод перекристаллизации является устаревшим, поскольку реакции ионного обмена и экстракция растворителем[en] по сравнению с ним более быстры и менее трудоемки[24].
До 1840-х[править | править код]
Изучение и дальнейшая классификация лантаноидов берёт своё начало с конца XVIII века: летом 1787 года шведский офицер К. А. Аррениус в карьере вблизи города Иттербю нашёл неизвестный чёрный минерал, прозванный иттербитом (позднее переименован в гадолинит)[40]. Юхан Гадолин, изучая его в 1794 году, открыл в нём новую землю — оксид иттрия[К 6]. Таким образом, с открытия одного из соединений элемента, имеющего похожие химические свойства, но не входящего в семейство, продолжилось дальнейшее изучение минералов и открытие лантаноидов[41]. Химический анализ гадолинита привел к открытию 7 химических элементов иттриевой группы и ещё семи — цериевой, при изучении церита[42]. (Иттриевая и цериевая земли были двумя началами «путей» открытия элементов-лантаноидов[42].) Примечательно, что открытие множества лантаноидов произошло благодаря минералам из их общего места происхождения: известнейшее месторождение пегматита располагается возле Иттербю в Швеции[43].
Минерал церит, открытый в 1751 году А. Кронштедтом и содержащий редкоземельные элементы, послужил отправной точкой в открытии церия[43]. В 1803 году Вильгельм фон Хизингер и Йёнс Берцелиус в Швеции (и независимо от них Мартин Клапрот во Франции) нашли в минерале новую землю, названную цериевой в честь астероида Цереры[44][45]. После открытия французский химик Луи Воклен впервые исследовал его и показал, что цериевая земля может быть белой и оранжевой. Этот факт впервые указал на существование церия в двух валентных формах. Учёный восстановил землю и пришёл к выводу, что церий является металлом, не похожим на другие известные на тот момент[46]. Впоследствии (с 1839 по 1843 годы) Карл Мосандер доказал, что эта и ранее открытая — иттриевая — земли представляли собой смеси оксидов нескольких лантаноидов[20]. Элемент был выделен В. Хиллебрандом[en] и Т. Нортоном в металлическом виде только в 1875 г[44].

В 1826 году Карл Мосандер — ученик, ассистент и один из близких друзей Й. Берцелиуса — исследовал цериевую землю и сделал заключение о её неоднородности: в ней мог содержаться минимум один новый элемент. Чтобы проверить это предположение, понадобилось много церита[47]. В 1839 году, добиваясь выделения из цериевой земли чистого препарата, учёный обработал её азотной кислотой и кристаллизовал соль, выпаривая воду. Он также установил, что эта соль (будучи загрязнённым нитратом церия[48]) при нагревании разлагается и превращается в желтоватое вещество. Обрабатывая этот жёлтый землистый остаток разведённой азотной кислотой было замечено, что интенсивно закрашенная его часть не растворяется в кислоте: это был диоксид церия, с которым впервые столкнулся Воклен[46][К 7]. После удаления нитрата церия из раствора, ученому удалось добыть новую, лантановую землю[48], название которой было предложено Берцелиусом и дано Мосандером 12 февраля 1839 г[49]. Элемент, являясь родоначальником группы элементов, был открыт вторым после церия лишь как примесь. Возможно, лантан был назван именно так потому, что «скрывался» от ученых на протяжении 36 лет[50]. В относительно чистом виде был получен в 1923 г[51].
В январе 1840 года Мосандеру удалось достичь успеха, выделив из аметистового раствора сульфата лантана две фракции:
- При нагреве раствора соли (тогда уже было известно, что её растворимость выше в холодной воде) с 9 до 40 °C, в осадок выпали кристаллы светло-аметистового цвета: сульфат лантановой земли с примесью оксида дидима[52]. При повторении с этими кристаллами вышеописанных действий 10—15 раз он получил бесцветные кристаллы (где присутствие оксида дидима было минимальным), которые, при реакции с щелочами и выпариванием воды, давали оксид белого цвета, предположительно, — истинный оксид лантана (в записной книжке учёный пометил его как Laa)[53].
- Вторая фракция была получена в растворе серной кислоты и оксида лантана: в результате реакции, осадились красные кристаллы сульфата дидимовой земли[52] (помеченной Lar, где r, предположительно, обозначает «красный», от швед. röd). Эти кристаллы при реакции с щелочами дали голубовато-фиолетовый оксид-гидрат, после выпаривания воды из которого остался оксид: «…Темно-коричневого цвета на поверхности, иногда светло-коричневого в изломах [трещинках]…»[54] При сильном нагревании до белого каления его цвет получался от загрязнённого белого до серо-зелёного, а на поверхности появлялись аметистово-красные кристаллы[55].
С этого момента учёный мог доказать, что аметистовый цвет солей оксидов церия и лантана вызван присутствием оксида Lar, а в коричневый они окрашивались при нагреве в воздухе до красного каления[55]. Карл Мосандер в 1842 году[56] назвал неизвестный оксид Lar — дидим (Di)[55], чтобы показать его связь с уже открытыми лантаном и церием[33][57][52]. После этого учёный убедился в том, что дидим был получен в чистом виде и больше к нему не возвращался[58], а данное им название «элементу» фигурировало в учебниках по химии того времени ещё 50 лет[56].
Задавшись вопросом о гомогенности образцов, из которых был получен иттрий, и вдохновлённый успехами, достигнутыми при исследовании церита, Карл Мосандер начал изучение гадолинита[59]. Осенью 1842 года учёный убедился, что образцы иттриевой земли, изолированные из гадолинита, церита, церина, ортита, — все они имели в своём составе помимо «истинного» оксида иттрия (поскольку давали бесцветные соли), ещё и неизвестный оксид жёлтого цвета, менее осно́вный, в растворах его солей — аметистовый. В феврале 1843 года этой земле было дано название о́диний (в честь бога Одина), однако результаты последующих экспериментов, проведённых в апреле, убедили его в том, что в земле было по меньшей мере три оксида. Из раствора азотной кислоты и оксида иттрия Мосандер, при фракционном осаждении, получил аммонийные осно́вные соли, при сильном нагревании которых получались три различных оксида, не похожих на ранее полученные. (Немногим ранее, в 1842 году Йёнсом Берцелиусом была проведена работа, которая подтверждала разделение иттриевой земли на три оксида, однако к апрелю 1843 года она все ещё оставалась ненапечатанной.) За наиболее осно́вным по характеру оксидом (белого цвета, в его солях — бесцветного) учёный оставил старое название — иттриевая земля, следующий — по убыванию основных свойств — был назван оксидом тербия, в чистом виде, предположительно, — белого цвета (растворы солей — розового[60]), и третий — оксид эрбия: при нагревании на воздухе оксид окрашивался в темный оттенок оранжево-желтого цвета, теряющийся при нагреве в атмосфере водорода (последние данные позволили сделать вывод о его двух валентных состояниях)[23]. Из определённо открытого на тот момент эрбия позднее выделили ещё иттербий и тулий[61].
Активность ученого привела к выводу о том, что семейство расширилось в 1843 году до шести элементов[62][63]: цериевые соединения имеют жёлтый цвет, лантановые — белый, дидимовые — красный, иттриевые и эрбиевые — белый, тербиевые — розовый[К 8]. Для доказательств открытия в то время требовалось получить данные о выделении (получении), цвете, форме кристаллов и способности образовывать соединения элементом[22]. Но даже несмотря на авторитет первооткрывателя, историю открытия тербия не раз брали под сомнение, например: Р. В. Бунзеном и П. Т. Клеве в иттриевой земле были найдены только два оксида[60]. Позднее учеными было повторно подтверждено существование элемента: исследования гадолинита Мариньяком (1878), изоляция элемента из самарскита Л. Смитом (в том же году), сообщение Ж.-Л. Соре об изучении спектров абсорбции элемента (1880), получение Ж. Урбэном чистых препаратов (начало XX века) — все они подтвердили исследования Мосандера[64][60]. Эрбий же был получен в довольно чистом металлическом виде в 1934 г[65].
Д. И. Менделеев придерживался мысли, которую потом подтвердил исследованиями, что редкоземельные элементы трёхвалентны. В итоге, в первой половине XIX века было установлено существование не только великой родины элементов, но и изучены некоторые индивидуальные свойства[66].
1843—1878[править | править код]
В 1848 г. умер Й. Берцелиус — видный учёный-химик, занимавшийся наукой почти 50 лет, — и в следующие 30 лет интерес ученых к органической химии затмил неорганическую: большинство соединений металлов научились получать традиционными методами фракционного осаждения и кристаллизации — стало понятным, что яркий период в истории открытий закончился[67]. Дальнейший прогресс требовал новых концепций и развития в технике изучения[63].

Тем не менее, изучение редкоземельных элементов не остановилось, несмотря на то, что в основном по началу внимание было приковано к лантану, церию, дидиму. Новой заметной фигурой в изучении стал Жан Шарль Мариньяк, который немногим позднее выделил три новых элемента; им же были более точно определены атомные массы нескольких элементов (церия, лантана и дидима), доработан метод отделения, разработанный Мосандером, позволявший получить более чистые препараты. В 1848 г. вычислил атомный вес церия в реакции сульфата церия(III) с хлоридом бария (позже несколько раз менялся другими исследователями), а через год вычислил веса лантана и дидима. В 1853 г. детально изучил химические свойства дидима: цвет, кристаллы солей, растворимость, методы получения галогенидов, сульфидов, фосфатов, сульфатов, оксалатов, соединений с мышьяком; ещё через два года то же самое произвел с лантаном[68].
Необходимый для дальнейшего развития науки спектральным анализом шаг вперед был сделан Р. Бунзеном и Г. Кирхгофом в 1859 г[63].
Марк Делафонтен в 1864 г. принялся работать с гадолинитом: эрбий и его соединения были детально изучены различными методами, в том числе с применением газовой горелки. Им же были предоставлены довольно ясные доказательства открытия эрбия, но не тербия[69]. И если существование первого было окончательно подтверждено нахождением в солнечном спектре Ч. Янгом в 1872 г.[70], то присутствие в природе последнего отрицалось О. Поппом (отрицал существование и тербия, и эрбия[71]), Й. Баром[de], Р. Бунзеном, П. Т. Клеве. Результаты нескольких дальнейших исследований вплоть до начала 1880-х гг. приводили ко всё большей путанице: существование тербия то подтверждалось, то отрицалось, Делафонтен сообщал об открытии ещё нескольких «элементов» (мосандрия, филипия, деципия) и т. п.[К 9][69]
Понимание того, что элементы можно организовать в логический ряд, погруппно, как предполагалось периодической таблицей Д. И. Менделеева с 1869 г. пришло не сразу[63]. Она же позволяла увидеть направление для дальнейших открытий, дать «карту» в руки ученых, понимание чего заняло долгое время[72]. Так, например, примечание Делафонтена о том, что дидим не является гомогенным, было подтверждено Лекоком де Буабодраном в 1875 г. параллельным изучением спектров галлия (экаалюминия) — первого «эка»-элемента, предсказанного таблицей Д. И. Менделеева, отражавшей реальность существования элемента и имевшей под собой более сложное объяснение положения элементов[73]. Немногим ранее, в 1870 г. Д. И. Менделеев сам предсказал существование экабора (скандия)[74], спектры которого были обнаружены Л. Нильсоном в 1879 г., а годом позже — им же выделен оксид скандия с примесью иттербия из оксенита[75].
Открытие скандия ещё до обнаружения в природе значительно помогло в дальнейшем становлении и утверждении периодической системы химических элементов[75]. Более того, различные варианты положения элементов в таблице предоставлялись исследователями в попытке разрешить задачу положения редкоземельных элементов[76], поскольку существовал недостаток знаний в теории; в то время как большинство элементов хорошо подходило для определённых ячеек (мест) таблицы, редкоземельные металлы с их очень похожими свойствами все ещё оставались в неопределённом положении, служившим источником вдохновения для исследователей[77].
После 1870-х[править | править код]
Исследования Карла Густава Мосандера (1797—1858) побудили многих химиков исследовать минералы, содержащие церий и иттрий. Однако прогресс протекал медленно до тех пор, пока ученые в конце 1870-х гг. не научились изучать химические свойства с помощью спектроскопии (помимо совершенствования техники отделения). В последующие года прогресс в изучении и открытии элементов проходил намного быстрее[66][78]. Благодаря анализам спектров были открыты (или подтверждено существование) некоторые из представителей: тербий, иттербий, гольмий, тулий и самарий. С другой стороны, применение более чувствительной техники приводило и к ошибочным выводам: даже малое количество примеси в изучаемом препарате могло сильно изменить записанный спектр[79].
Жан Мариньяк достиг успеха, изолировав иттербиевую землю от иттриевой 22 октября 1878 г.[80] следующим образом: из смеси тербия с иттрием исследователь выделил эрбиевый осадок и сделал вывод о его неоднородности на основании того, что оксид неизвестного элемента (иттербия) был, как и его соли, бесцветным, в отличие от оксида эрбия[73]; тогда же исследователь сделал заключение о 3-валентном состоянии элемента и вычислил атомный вес — 172[81][К 10]. Эту землю проверил Л. Нильсон и другие ученые, почти полностью убедившиеся в чистоте, однако некоторыми считалось, что в ней присутствовали примеси. Среди последних оказались Ж. Урбэн во Франции и К. Ауэр фон Вельсбах в Австрии (позднее оба независимо друг от друга открыли лютеций, в 1907 и 1908 гг. соответственно), к такому же выводу пришли: У. Крукс (анонсировал открытие нескольких элементов), спектроскописты Ф. Экснер и Э. Гашек (1899), а Э. А. Демарсе, изучая спектры, в 1900 г. обнаружил элемент «Θ» и сделал примечание о его вхождении в состав земли Мариньяка[81].
Минерал самарскит (открыт Г. Розе в 1839 г. и назван в честь русского горного инженера) обратил на себя большое внимание исследователей в 1878 г.; М. Делафонтен, изучая образцы минерала, обнаружил отличный спектр абсорбции дидима от изолированного из церита. Являясь потенциальным источником новых элементов, минерал был изучен П. Э. Лекоком де Буабодраном, который обнаружил необъяснимые линии в спектре, предполагающие наличие нового элемента. Позднее было доказано, что его можно отделить от дидима и деципия на основании различных химических свойств, и 16 июля 1879 г. исследователь сообщил об открытии самария, впервые выделенного из минерала[64][73][82].

Пер Теодор Клеве в 1879 г., изучая эрбий, оставшийся после отделения от иттербия, пришел к выводу о неоднородности фракции: записанный Р. Аленом спектр помог понять, что в нём находится примесь. Исследователь разделил субстанцию на три фракции: первая была похожа на иттрий, вторая — на иттербий и третья — на эрбий. Среди предполагаемых линий спектра эрбия, одна (линия) присутствовала только во фракции близкой к иттербию, но не сам иттербий; вторая аналогично — только во фракции близкой к иттрию, но не сам иттрий; обе линии очень слабо присутствовали в спектре эрбиевой фракции. Учёный понял, что открыл два новых элемента и незамедлительно дал им названия: тулий и гольмий. Тогда же Клеве сделал примечание о том, что разделение элементов было неокончательным[83]. Как только это произошло, выяснилось, что годом раньше Ж.-Л. Соре обнаружил тот же самый спектр поглощения гольмия в образце эрбия, полученным от Ж. Мариньяка; исследователь обозначил его как элемент «X»[75]. Тогда же Лекок де Буабодран подтвердил исследования и Клеве, и Соре[84].

Неуверенность в присутствии новых элементов привела к интенсивному изучению самария, в результате чего произошло открытие двух лантаноидов: гадолиния и европия[85]. В 1880 г. Ж. Мариньяк принялся за изучение самарскита. Применяя фракционное осаждение и используя сульфат калия с последующим выделением оксалатов, были получены две потенциально новые земли: Yα и Yβ. Спектральный анализ Соре позволил предположить, что Yβ — самарий, а Yα не был похож ни на один из известных элементов, включая деципий[85]. В 1881 г. Делафонте получил более чистый деципий, позволивший сделать вывод о его схожести с элементом Yα и присутствии ранее примеси самария[84].
П. Э. Лекок де Буабодран (с одобрения Мариньяка) в 1880 г. предложил назвать элемент гадолинием, однако неизвестно, назван ли был этот элемент в честь Юхана Гадолина или минерала, или в честь обоих; тем не менее, гадолиний является единственным лантаноидом, у которого название происходит из иврита: корень гадол («великий») был выбран в качестве фамилии отцом ученого и происходит от названия фермы в Финляндии (фин. Maunala), на которой он жил[9]. В 1886 г. Мариньяк дал название элементу Yα — гадолиний[84].

Э. А. Демарсе в 1885 г. получил от П. Т. Клеве загрязнённые образцы самария и, подвергнув изучению линии спектров, усомнился в присутствии примесей. Данный вопрос оставался открытым на протяжении нескольких лет, и позднее даже Лекок де Буабодран и Демарсе сообщили об обнаружении примесей (в 1892 и 1893 гг.). Чистое соединение европия было получено Э. А. Демарсе в 1901 г. Немногим позднее Жорж Урбэн (1903 и 1904 гг.) сообщил о выделении европия из гадолиния, используя новый метод, где висмут являлся сепарирующим элементом[85].
В 1882 г. Б. Браунер сообщил (помимо Ж. Мариньяка в 1853, М. Делафонте в 1875 и П. Т. Клеве в 1882 гг.) о неоднородности дидима, пометив примесь записью Diγ, а годом позже подтвердил свои предположения. Спустя несколько лет, на протяжении которых К. Ауэр фон Вельсбах занимался отделением различных открытых лантаноидов, благодаря повторению более ста раз операций по фракционной кристаллизации (не осаждению) и анализу спектров, в 1885 г. были получены фракции празеодидима (зелетоватого цвета) и неодидима[86][87]. Позднее их названия были укорочены до празеодима и неодима, а в 1890 г. открытие было независимо подтверждено А. Беттендорфом[de][87]. Первым в относительно чистом металлическом виде в 1925 г. был получен неодим[88], в 1931 г. — празеодим[89].
Детальное изучения гольмия Лекоком де Буабодраном привело к открытию диспрозия в 1886 г. Новый элемент был назван так потому, что для его выделения потребовалось провести 32 утомительных операции по осаждению солей аммония и последующих 26 — по оксалатам; последующее изучение спектров и флуоресенции позволило открыть новый элемент[75]. Открытие диспрозия было воспринято химиками без обычного для того времени неверия и споров[84]; вплоть до 1950 г. металл (наравне с остальными РЗЭ) не мог быть получен в чистом виде до развития реакций ионного обмена и техники металлографического восстановления, разработанной во главе с Ф. Спеддингом[en][90].
| Внешние изображения | |
|---|---|
| (Френк Спеддинг) | |
| Френком Спеддингом (в первом ряду, второй слева) была проделана большая работа по разработке эффективных методов разделения редкоземельных элементов. | |
К началу следующего века многие химики были убеждены в существовании следующих элементов: лантана, церия, празеодима, неодима, самария, гадолиния, тербия, диспрозия, гольмия, эрбия, тулия, иттербия[91].
Долгий путь изучения и нахождения большинства лантанидов в природе был закончен благодаря исследованиям Ж. Урбэна, который в 1907 г. (спустя более века с начала открытия церия[43]) в иттербии Ж. Мариньяка выявил наличие лютеция[66]. На год позже и независимо от Урбэна, в 1908 г. этот элемент был открыт К. Ауэром фон Вельсбахом, прозвавшим элемент кассиопеем[19]. Названия лютеций и кассиопей параллельно использовались на протяжении нескольких десятилетий, причем последний был в ходу в Германии и Австрии до 1950-х гг[79].
Если спектральный анализ дал возможность выявлять отдельные РЗЭ в разных породах, делать вывод о степени их чистоты, то он ничего не мог подсказать о начальной распространённости лантанидов, предвидеть существование новых элементов. На последний вопрос ответ был дан после исследования рентгеновских спектров РЗЭ. Так, с помощью закона Мозли было установлено, что лантан имеет порядковый номер 57, самый тяжёлый элемент из семейства лантаноидов — 71. После рентгеноспектрального установления порядковых номеров всех известных лантаноидов было обнаружено, что среди них нет элемента с номером 61[92]. Группа итальянских ученых из Флорентийского университета заявила об открытии флоре́нтия в 1924 г. Похожее сообщение об открытии илли́ния (в честь штата Иллинойс), прозвучавшее двумя годами позднее, так же являлось преждевременным[76].
Начались поиски данного элемента. Пятьдесят образцов лантаноидных минералов были подвергнуты тщательному исследованию в оптической и рентгеновской областях спектра — 61-го элемента не нашли. Немецкий химик Л. Прандтль предположил, что этого элемента либо не существует, либо его нахождение в природе так же мало, как и у технеция. Однако немецкая исследовательница И. Ноддак, которая была известна поисками элементов-аналогов марганца и особенно рения, выдвинула гипотезу о нестабильности атомов 61-го элемента, то есть о его радиоактивности: основанием для такой гипозеты являлось то, что 62-й элемент — самарий — имеет слабое радиоактивное излучение, и гипотеза подтвердилась. Атомы 61-го элемента были добыты благодаря ядерным реакциям[92]: в 1945 г. американские исследователи Дж. Маринский, Л. Гленденин и Ч. Кориелл получили 61 элемент[93] (в виде нуклида 147Pm) и химически идентифицировали два изотопа, используя ионообменную хроматографию. В 1947 г. были анонсированы его химические свойства для доказательства открытия, а годом позже дано название[94][95][96].
Тенденции в изучении[править | править код]
В 1937 г. В. Клемм и Г. Боммер подготовили РЗЭ в таком виде, который позволил им описать несколько из свойств металлов: описать их кристаллические структуры, магнитную восприимчивость, плотности, а также подтвердить данные Виктора Гольдшмидта от 1925 г. о лантаноидном сжатии (нем. die Lanthaniden-Kontraktion) при увеличении порядкового номера. Работа позволила сделать вывод о том, что элементы не так уж и сильно похожи друг на друга, судя по их свойствам, как в основном считалось ранее: были описаны дивалентные состояния у Eu и Yb, а валентность Ce оказалась больше 3+. Различия постепенно усиливались при их дальнейшем изучении[97][98][99].
С середины XX века различные вопросы, касающиеся систематики лантаноидов, Sc и Y, были предметом множества опубликованных работ, что привело, в общем и целом, к более глубокому пониманию химической, металлургической и физической природы 17 элементов[99]. Во время Второй мировой войны и в последующие годы была значительно изучена и расширена техника разделения РЗЭ с помощью ионообменных смол Ф. Спеддингом[en][К 11]. Сотни килограмм чистых оксидов элементов удалось разделить и наработать в Лаборатории Эймса[en]. Параллельно этому, редкоземельные металлы становились понемногу доступными для применения и изучения их свойств. После 1957 г., в котором промышленность начала получение соединений высокой чистоты, цены на некоторые из них (от Eu до Lu) упали в среднем в 282 раза[97][К 12].
Изучение основных физических свойств, в частности магнетизма в металлах, сплавах и соединениях, являлось объектом интенсивного изучения со стороны ученых на протяжении нескольких десятилетий. В 1960-х — начало 1970-х гг. основное внимание сфокусировалось на «тяжелых» лантаноидах; «легкие» же привлекли своё внимание в 1970-х гг., когда стали доступными в виде кристаллов[100]. В те же годы начали появляться работы, связанные с влиянием металлов на организм человека[101]: радиоактивный 144Ce был найден в костях животных и моллюсках[102], а также в легких и лимфоузлах людей, вдыхавших радиоактивные аэрозоли[103]. В середине 1980-х гг. внимание ученых привлекли их антикоррозионные свойства: были опубликованы работы, в которых описывалось положительное влияние хлоридов РЗЭ на ингибирование коррозии некоторых металлов (например, алюминия) в хлор-содержащих электролитах[104][105][106].
Лантан — Мегаэнциклопедия Кирилла и Мефодия — статья
Ланта́н (лат. Lanthanum, от греческого «лантано» — скрываюсь), La (читается «лантан»), химический элемент с атомным номером 57, атомная масса 138, 9055. Природный лантан состоит из двух изотопов: 139La (99, 911%) и радиоактивного 138La (-радиоактивен, период полураспада Т1/2 2.1011лет). Конфигурация двух внешних электронных слоев 5s2p6d16s2. Степень окисления +3 (валентность III).
Расположен в группе IIIВ в 6 периоде периодической системы. Вместе с неодимом и церием относится к наиболее распространенным редкоземельным элементам. Радиус атома 0, 187 нм, радиус иона La3+— от 0, 117 (координационное число 6) до 0, 150 нм (12). Энергии последовательной ионизации 5, 577, 11, 06, 19, 18 эВ. Электроотрицательность по Полингу 1, 1.Лантан открыт в 1839 шведским химиком К. Г. Мосандером в виде оксида лантана La2 O3при исследовании примесей, содержащихся в соединениях церия.Содержание лантана в земной коре 2, 9·10-3% (по массе). В природе вместе с другими редкоземельными элементами входит в состав минералов: монацит, бастензит, лопарит и апатит.Получение лантана связано с разделением исходного сырья на фракции. Лантан концентрируется вместе с церием, празеодимом и неодимом. Сначала из смеси отделяют церий (используя его способность образовывать устойчивые соединения в степени окисления +4), затем оставшиеся элементы разделяют методами ионной хроматографии и экстракции. Для отделения от других лантаноидов и редкоземельных элементов лантан осаждают в виде оксалата La2(C2O4)3·9H2O, прокаливание которого приводит к образованию La2О3. Металлический лантан получают действием на LaCl3 (LaF3) кальция или электролизом расплава LaCl3 в присутствии СаСI2 или ВаСI2.Лантан — серебристо-белый металл.
До температуры 277°C устойчив α-La с гексагональной решеткой, а = 0, 3772 нм и с = 1, 2144 нм. При температурах 277-861°C устойчив β-La с кубической решеткой типа Cu. При температуре 861-920°C устойчив γ-La с кубической решеткой типа α-Fe. Температура кипения лантана 3447°C, плотность α-La 6, 162 кг/дм3.
На воздухе лантан быстро окисляется с образованием гидратированного оксикарбоната. При нагревании до 450°C в среде кислорода La воспламеняется, образуя основной оксид La2O3. При нагревании La реагирует с N2 с образованием нитрида, с H2с образованием гидридов переменного состава. При нагревании реагирует с галогенами, серой и фосфором.Гидроксид La(ОН)3.получают действием растворов щелочей на водорастворимые соли лантана.
Плохо растворимы в воде фторид, фосфат, карбонат, оксалат и некоторые другие соли лантана.
Лантан — легирующая добавка к алюминиевым, магнивыем, никелевым, кобальтовым сплавам, компонент миш-металла, применяемого для улучшения свойств коррозионностойкой, быстрорежущей и жаропрочной стали. Интерметаллид LaNi5 — перспективный аккумулятор. Оксисульфид и алюминат — компоненты люминофоров. Оксид лантана используют для получения оптического стекла.- Редкоземельные элементы. Технология и применение / Под ред. Ф. Виллани (пер. с англ.). М., 1985.
Лантана (растение) — Википедия
Материал из Википедии — свободной энциклопедии
У этого термина существуют и другие значения, см. Лантана.Ланта́на (лат. Lantana) — род двудольных цветковых растений, включённый в трибу Lantaneae семейства Вербеновые (Verbenaceae). Типовой род трибы.
Научное название рода, Lantana, было впервые употреблено по отношению к этому растению Карлом Линнеем в 1737 году в книге Genera Plantarum. Этим словом в новолатинском языке называлось неродственное растение калина гордовина. В 1753 году Линней вновь использовал это название в Species Plantarum.
Представители рода — кустарники или полукустарники, часто со специфическим запахом, иногда с покрытыми шипами ветками.
Листья расположенные супротивно или спиралевидно, с цельным или в различной степени зазубренным краем, гладкие или шершавые.
Цветки собраны в небольшие густые головковидные соцветия-щитки, появляющиеся обычно в пазухах верхних листьев. Прицветники обычно не опадающие, треугольной или линейной формы. Чашечка плёнчатая, трубчатая, неясно разделённая на чашелистики. Венчик разделён на 4—5 сросшихся лепестков, с прямой или изогнутой трубкой. Окраска цветков в одном соцветии часто сильно различается — венчик может быть белым, красным, жёлтым, розовым, сиреневым. Цветки могут менять окраску: раскрываясь желтыми, к окончанию цветения становятся красными. Тычинки в количестве 4, с яйцевидными пыльниками. Пестик короткий, с головчатым рыльцем. Завязь нижняя, двухгнёздная.
Плод ягодовидный, мясистый, с деревянистым эндокарпием, с двумя семенами.
Число хромосом 2n = 22, 24, 27, 33, 44, 55 или 66.
Виды рода Лантана распространены в тропических регионах обоих полушарий. Наибольшее разнообразие видов наблюдается в Южной Америке, напротив, лишь несколько произрастают в Африке и Азии. Лантана сводчатая — сорное растение родом из Центральной и Южной Америки, натурализовавшееся в Евразии, Африке и Австралии.
Синонимы[править | править код]
Виды[править | править код]
Род Лантана включает около 130[2] видов.
- Lantana achyranthifolia Desf., 1829
- Lantana camara L., 1753 — Лантана сводчатая, или лантана камара
- Lantana canescens Kunth, 1818
- Lantana depressa Small, 1905
- Lantana exarata Urb. & Ekman, 1929
- Lantana horrida Kunth, 1818
- Lantana involucrata L., 1756
- Lantana montevidensis (Spreng.) Briq., 1904
- Lantana nivea Vent., 1803
- Lantana reticulata Pers., 1806
- Lantana strigosa (Griseb.) Urb., 1912
- Lantana trifolia L., 1753
- Lantana velutina M.Martens & Galeotti, 1844
ЛАНТАН - это... Что такое ЛАНТАН?
ЛАНТАН — (лат., от греч. lanthano быть скрытым, спрятанным). Металл, открытый в 1840 г. Мозандером в церите. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ЛАНТАН лат., от греч. lanthano, быть скрытым, спрятанным. Металл,… … Словарь иностранных слов русского языка
ЛАНТАН — (лат. Lanthanum) La, химический элемент III группы периодической системы, атомный номер 57, атомная масса 138,9055, относится к редкоземельным элементам. Назван от греческого lanthano скрываюсь, в связи с трудностями получения. Металл. Плотность… … Большой Энциклопедический словарь
ЛАНТАН — (символ La), серебристо белый металлический элемент группы ЛАНТАНИДЛОВ, впервые обнаружен в 1839 г. Основные руды, в которых он содержится, это монациты и бастнезиты. Мягкий, ковкий и вязкий, лантан применяется как КАТАЛИЗАТОР при КРЕКИНГЕ… … Научно-технический энциклопедический словарь
ЛАНТАН — (Lanthanum), La, химический элемент III группы периодической системы, атомный номер 57, атомная масса 138,9055; относится к редкоземельным элементам; металл. Открыт шведским химиком К. Мосандером в 1839 … Современная энциклопедия
Лантан — La (от греч. lanthano скрываюсь * a. lanthanum; н. Lanthan; ф. lanthane; и. lantano), хим. элемент III группы периодич. системы Менделеева, относится к редкоземельным элементам, ат. н. 57, ат. м. 138,9. Природный Л. состоит из двух… … Геологическая энциклопедия
ЛАНТАН — (Lanthanum), La, хим. элемент III группы периодич. системы элементов, ат. номер 57, ат. масса 138,9055, относится к редкоземельным элементам. Природный Л. состоит из смеси стабильного 139La (99,911%) и слаборадиоактивного 138La распад и К захват … Физическая энциклопедия
лантан — сущ., кол во синонимов: 2 • металл (86) • элемент (159) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Лантан — (хим.) один из металлов церитовой группы , по способунахождения в природе; по химическим отношениям, по способностиобразовать La2h4 его должно отнести к более основной подгруппе 3 йгруппы периодической системы (La=138,2, Б. Браунер),… … Энциклопедия Брокгауза и Ефрона
лантанід — іменник чоловічого роду … Орфографічний словник української мови
ЛАНТАН — хим. элемент, символ La (лат. Lanthanum), ат. н. 57, ат. м. 138,90; ковкий и тягучий серебристо белый металл, плотность 6170 кг/м3, tпл = 920°С. Л. применяют в производстве оптических стёкол, как лазерные материалы, в керамических… … Большая политехническая энциклопедия
Лантан — У этого термина существуют и другие значения, см. Лантан (значения). 57 Барий ← Лантан → Церий … Википедия