Лизоцим что это такое
ЛИЗОЦИМ - это... Что такое ЛИЗОЦИМ?
лизоцим — лизоцим … Орфографический словарь-справочник
лизоцим — антибиотик, обнаруживаемый в слезной жидкости, слюне человека и животных, в яичном белке, атакже у фагов, бактерий и растений. Обладает свойствами фермента мурамидазы. Катализирует гидролиз связи между N–ацетилглюкозамином и N–ацетилмурамовой… … Словарь микробиологии
лизоцим — фермент, мурамидаза Словарь русских синонимов. лизоцим сущ., кол во синонимов: 2 • мурамидаза (1) • … Словарь синонимов
ЛИЗОЦИМ — мурамидаза, фермент класса гидролаз; катализирует гидролиз (b 1,4 гликозидных связей между остатками аминосахаров N ацетилглюкозамина и N ацетилмурамовой к ты в полисахаридных цепях муреинов (гетерополисахаридов стенок бактериальных клеток), что… … Биологический энциклопедический словарь
лизоцим — лизоцим. См. мурамидаза. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО, 1995 г.) … Молекулярная биология и генетика. Толковый словарь.
ЛИЗОЦИМ — (Lysozyme) открыт Флемингом (Fleming; 1922) первоначально в слезах, но затем найден в других выделениях и в тканях человека, животных и нек рых растений. Л. характеризуется способностью быстро растворять бактерии й главным обр. сапрофиты.… … Большая медицинская энциклопедия
лизоцим — Фермент, обладающий антибактериальной активностью [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN lysozyme … Справочник технического переводчика
Лизоцим — Трёхмерная структура лизоцима Лизоцим (мурамидаза, англ. lysozyme) антибактериальный агент, фермент класса гидролаз, разрушающий клеточные стенки … Википедия
ЛИЗОЦИМ — Вещество, относящееся к группе ферментов (мурамидаза) и обладающее бактерицидным действием. Лизоцим в больших количествах находится в яйцах птиц, в слюне, в небольших количествах в крови и молоке. Поступает в плазму крови из неповрежденных… … Термины и определения, используемые в селекции, генетике и воспроизводстве сельскохозяйственных животных
лизоцим — фермент, взаимодействующий с сахарами определенных типов в клеточной стенке бактерий и разрушающий оболочки бактериальных клеток. Лизоцим содержится в слюне, некоторых других биологических жидкостях. Источник: Медицинская Популярная Энциклопедия … Медицинские термины
Лизоцим — Википедия. Что такое Лизоцим
Трёхмерная структура лизоцимаЛизоци́м (англ. lysozyme, КФ 3.2.1.17) — антибактериальный агент, фермент класса гидролаз, разрушающий клеточные стенки бактерий путём гидролиза пептидогликана клеточной стенки бактерий муреина. Главным образом, лизоцим получают из белка куриных яиц[1]. Также аналогичные ферменты содержатся в организмах животных, в первую очередь, в местах соприкосновения с окружающей средой — в слизистой оболочке желудочно-кишечного тракта, слёзной жидкости, грудном молоке, слюне, слизи носоглотки и т. д. В больших количествах лизоцимы содержатся в слюне, чем объясняются её антибактериальные свойства. В грудном молоке человека концентрация лизоцима весьма высока (около 400 мг/л). Это намного больше, чем в коровьем. При этом концентрация лизоцима в грудном молоке не снижается со временем, через полгода после рождения ребёнка она начинает возрастать.
История
В 1909 году Павел Николаевич Лащенков (Томск) открыл в курином белке протеолитический фермент, который селективно повреждал клеточные стенки, содержащие пептидогликаны. Значительно позже, в 1922 году — Александр Флеминг[2] обнаружил в носовой слизи пациента, страдающего от простуды, вещество, которое может уничтожать некоторые бактерии, такие как Micrococcus lysodeikticus. Он назвал это вещество лизоцим.
После первоначальной эйфории в погоне за антибактериальными веществами оказалось, что лизоцим имеет малое клиническое значение в качестве антибактериального средства, и после открытия пенициллина интерес к лизоциму угас, пока не был выделен и очищен лизоцим из яичного белка курицы (HEWL).
Трёхмерная структура лизоцима впервые была получена Дэвидом Чилтоном Филлипсом (1924—1999) в 1965 году, когда он получил первую модель с помощью рентгеновской кристаллографии[3][4]. Структура была публично представлена на лекции Королевского института в 1965 году [5]. Лизоцим стал второй белковой структурой и первой ферментной структурой, которая была получена с помощью рентгеновской кристаллографии, и первым ферментом, который содержит полную последовательность всех двадцати стандартных аминокислот[6].
HEWL — лизоцим, выделенный из яичного белка курицы
HEWL представляет собой полипептидную цепь (14,3 кДа), содержащую 129 аминокислотных остатков с четырьмя внутримолекулярными дисульфидными мостиками и изоэлектрической точкой вблизи ≈ 11,3; он легко растворим в водной среде.[7]
Являясь ферментом, HEWL катализирует гидролиз B-1,4 гликозидной связи между N-ацетилмурамовой кислотой и N-ацетилглюкозамином в пептидогликане клеточной стенки бактерий. Исторически сложилось так, что этот белок является одним из наиболее изученных белков в области биохимии. В отличие от большинства белков, лизоцим легко кристаллизуется, и эти кристаллы имеют хорошие преломляющие свойства. Полная первичная структура HEWL впервые была освещена в 1963[8] , и чуть позднее, в 1965 году, была создана трёхмерная структура HEWL. Расшифровка трёхмерной структуры HEWL и HEWL-субстратного комплекса открыли путь для понимания специфики лизоцима и механизма его каталитической активности.
Исследования по агрегации HEWL стали важны, когда выяснилось, что точечные мутации в человеческом лизоциме (с которым HEWL имеет 60% идентичных последовательностей) коррелировали с наследственным системным амилоидозом[9].
Это заболевание было симптоматическим, с отложением амилоидных фибрилл человеческого лизоцима (иногда в килограммовых количествах) в почках, желудочно-кишечном тракте, лимфатических узлах, кровеносных сосудах, селезёнке и печени. Лизоцим, пожалуй, единственный фермент, который образует амилоид в естественных условиях.
Лизоцим человека
Человеческий лизоцим является гликозидазой, которая функционирует в качестве антибактериального средства. Человеческий лизоцим (ЕС 3.2.1.17) содержит 130 остатков, принадлежащих к классу С-типа, и широко распространён в различных тканях и жидкостях организма, в том числе печени, суставных хрящах, крови, слюне, слёзной жидкости и молоке[10]. Он кодируется геном, расположенным на 12-й хромосоме и состоящим из 4 экзонов и 3 интронов.[11]
Лизоцим гидролизует преимущественно B-1,4 гликозидные связи между N-ацетилмурамовой кислотой и N-ацетилглюкозамином, содержащимися в структуре пептидогликана клеточной стенки некоторых микроорганизмов, особенно грамположительных бактерий, и, следовательно, играет определённую роль в защите хозяина. Фермент заставляет сахар мурамовой кислоты находиться в напряжённой конформации, и при совместном действии двух ключевых остатков — глутаминовой кислоты в положении 35 и аспарагиновой кислоты в положении 52 — гидролизует гликозидные связи.
Лизоцим интенсивно экспрессируется в кроветворных клетках, где он находится в гранулоцитах, моноцитах и макрофагах, а также в их предшественниках в костном мозге. Обычная концентрация лизоцима в плазме составляет от 4 до 13 мг/л, но только следы его можно увидеть в моче здоровых лиц. В случае нормальных субъектов, по меньшей мере, 500 мг лизоцима производятся в день, но время жизни протеина в плазме является очень коротким; 75 % элюируют в течение 1 ч, в основном, через почки[12]. Сильно повышенные концентрации лизоцима в плазме и моче связаны с целым рядом патологических состояний и мониторятся в течение многих лет, так как являются возможным маркером моноцитарного лейкоза, но в то же время, как в случае больных с миелопролиферативными расстройствами, при нормальной функции почек, производство лизоцима увеличивается до 4 раз.
За последние 30 лет человеческий лизоцим и HEWL были использованы в качестве системы отсчёта для изучения многих аспектов структуры и функции белков, в том числе стабильности белка и механизма его сворачивания. Были установлены шесть природных мутаций в человеческом лизоциме[13] , и аминокислотные замены (все расположены в B-домена области нативной структуры лизоцима)[14]. Мутации приводят к появлению нескольких вариантов белка (I56T, F57I, W64R, D67H, T70N и F57I / T70N или W112R / T70N). Все эти варианты, кроме T70N, были связаны с системными амилоидозами с участием почек, печени и селезёнки[9], в то время как не амилоидогенный вариант T70N является довольно распространённым явлением в нормальной британской популяции.
Применение
В пищевой промышленности зарегистрирован в качестве пищевой добавки E1105 (консервант).
В медицине в качестве местного антисептического средства[15].
Применение при беременности
| 1 триместр | 2 триместр | 3 триместр |
|---|---|---|
| Противопоказан, большинство врачей считает приём лекарства в это время нежелательным и опасным. | Разрешён, под врачебным наблюдением. | Приём допустим, но с учётом возможной аллергии. Не перед родами.[16] |
Механизм лизиса
Фермент атакует пептидогликаны (в частности, муреин), входящие в состав клеточных стенок бактерий (особенно много его в клеточных стенках грам-положительных бактерий — до 50-80 %). Лизоцим гидролизует β(1→4)-гликозидную связь между N-ацетилмурамовой кислотой и N-ацетилглюкозамином. Пептидогликан при этом связывается с активным центром фермента (в форме кармана), расположенным между двумя его структурными доменами. Сорбционный центр лизоцима представляет 6 карманов (A, B, C, D, E, F), причём в A, C и E может связываться только N-ацетилглюкозамин, а в B, D и F — как N-ацетилглюкозамин, так и N-ацетилмурамовая кислота. Молекула субстрата в активном центре принимает конформацию, близкую к конформации переходного состояния. В соответствии с механизмом Филлипса, лизоцим связывается с гексасахаридом, затем переводит 4-й остаток в цепи в конформацию твист-кресла. В этом напряжённом состоянии гликозидная связь между центрами D и E легко разрушается. Ингибитором лизоцима служит, в частности, трисахарид N-ацетилглюкозамина, связывающийся с каталитически неактивными центрами A, B и C и препятствующий связыванию субстрата.
Остатки глутаминовой кислоты (Glu35) и аспарагиновой кислоты (Asp52) критичны для функционирования фермента, причём Asp52 ионизирован, а Glu35 нет. Некоторые авторы полагают, что Glu35 выступает в качестве донора протона при разрыве гликозидной связи субстрата, разрушая связь, а Asp52 выступает в роли нуклеофила, при образовании интермедиата — гликозил-фермента. Затем гликозил-фермент реагирует с молекулой воды, в результате чего фермент возвращается в исходное состояние и образуется продукт гидролиза[17].
Другие авторы полагают, что реакция протекает через образование карбоксоний-иона, стабилизированного заряженной карбоксильной группой Asp52, в то время как высвобождение спирта катализируется по механизму общего основного катализа незаряженным карбоксилом Glu35.[18].
Примечания
- ↑ G. Alderton, W.H. Ward, H.L. Fevold (1945). «ISOLATION OF LYSOZYME FROM EGG WHITE». Proceedings of the Royal Society of London. Series B, Containing Papers of a Biological Character (157): 43—58.
- ↑ Alexander Fleming (1922). «On a Remarkable Bacteriolytic Element Found in Tissues and Secretions». The Journal of Biological Chemistry (93): 306—317.
- ↑ Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. (1965). «Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Angstrom resolution». Nature 206 (986): 757–61. DOI:10.1038/206757a0. PMID 5891407.
- ↑ Johnson LN, Phillips DC. (1965). «Structure of some crystalline lysozyme-inhibitor complexes determined by X-ray analysis at 6 Angstrom resolution». Nature 206 (986): 761–3. DOI:10.1038/206761a0. PMID 5840126.
- ↑ Johnson, LN (1998). «The early history of lysozme». Nat Struct Mol Biol 5 (11): 942–944. DOI:10.1038/2917. PMID 9808036.
- ↑ Canfield, RE (1963). «The Amino Acid Sequence of Egg White Lysozyme». J Biol Chem 238 (8): 2698–2707. PMID 14063294.
- ↑ Wetter, L. R., Deutsch, H. F. Immunological studies on egg white proteins IV. Immunochemical and physical studies of lysozyme. // J. Biol. Chem.. — Т. 192. — С. 237–242.
- ↑ Canfield, R. E. The amino acid sequence of egg white lysozyme // J. Biol. Chem.. — Т. 238. — С. 2698–2707.
- ↑ 1 2 Pepys, M. B., Hawkins, P. N., Booth, D. R., Vigushin, D. M., Tennent, G. A., Soutar, A. K., et al. Human lysozyme gene mutations cause hereditary systemic amyloidosis. // Nature. — Т. 362. — С. 553–557.
- ↑ Reitamo, S., Klockars, M., Adinolfi, M., Osserman, E. F. Human lysozyme (origin and distribution in health and disease) // Ric. Clin. Lab.. — Т. 8. — С. 211–231.
- ↑ Peters, C. W., Kruse, U., Pollwein, R., Grzeschik, K. H., Sippel, A. E. The human lysozyme gene. Sequence organization and chromosomal localisation. // Eur. J. Biochem.. — № 182. — С. 507–516.
- ↑ Hansen, N. E., Karle, H., Andersen, V., Olgaard, K. Lysozyme turnover in man. // J. Clin. Invest.. — Т. 51. — С. 1146–1155.
- ↑ Pepys, M. B., Hawkins, P. N., Booth, D. R., Vigushin, D. M., Tennent, G. A., Soutar, A. K., et al. // Nature. — Т. 362. — С. 553–557.
- ↑ Dumoulin, M., Kumita, J. R., Dobson, C. M. Normal and aberrant biological self-assembly: insights from studies of human lysozyme and its amyloidogenic variants. // Acc. Chem. Res.. — Т. 39. — С. 603–610.
- ↑ Местный антисептический препарат Лизобакт® — Публикации (недоступная ссылка — история). Проверено 30 мая 2011. Архивировано 3 октября 2011 года.
- ↑ Не опасен ли Лизобакт® при беременности при лечении боли в горле? (рус.), Детский сайт Малышам инфо (27 июня 2017). Проверено 29 июня 2017.
- ↑ С.Д. Варфоломеев. Химическая энзимология. — М.: Издательский центр "Академия", 2005. — С. 238—239. — ISBN 5-7695-2062-0.
- ↑ Э. Фёршт. Структура и механизм действия ферментов. — М.: "Мир", 1980. — С. 395—396. — DOI:577.15/.17[Ошибка: Неверный DOI!].
Литература
лизоцим - это... Что такое лизоцим?
лизоцимантибиотик, обнаруживаемый в слезной жидкости, слюне человека и животных, в яичном белке, атакже у фагов, бактерий и растений. Обладает свойствами фермента мурамидазы. Катализирует гидролиз связи между N–ацетилглюкозамином и N–ацетилмурамовой кислотой, что приводит к разрушению муреина. В организме растений и животных выполняет функцию неспецифического антибактериального барьера. Открыт А. Флемингом в 1922 г. Один из наиболее изученных ферментов.
(Источник: «Микробиология: словарь терминов», Фирсов Н.Н., М: Дрофа, 2006 г.)
Лизоцим(N-ацетилмурамидаза) - фермент, разрывающий 1®4-гликозидную связь между ацетилмураминовой к-той и N-ацетил-глюкозамином в молекуле пептидогликана клеточной стенки бактерий, в результате чего происходит лизис бактерий. Более чувствительны к Л. грам+ бактерии. Л. является основным (изоэлектрическая зона около 11) низкомолекулярным (м.м. около 15 тыс.) белком, состоящим из одной полипептидной цепи в 127-130 аминокислотных остатков. На N-конце полипептида располагается лизин, на С-конце - лейцин. Стабилен в кислой среде и утрачивает ферментативную активность в нейтральных и щелочных р-рах, особенно при нагревании. Устойчив к действию протеаз. Широко распространен в природе: от бактер. вирусов до человека. У людей находится в секретах кожи и слизистых оболочек, крови, молоке, сперме, лизосомах клеток, особенно фагоцитарных. Синтезируется макрофагами и полиморфноядерными лейкоцитами. Много Л. в белке яиц, соке редьки, хрена, репы. При определенных инфекц., онкологических и иных заболеваниях происходит изменение лизоцимной активности жидкостей, что используют в диагностических целях. В медицине Л. применяют чаще как местное (0,05 - 0,25% р-ры) антибактер. средство, иногда в сочетании с пенициллинами, при септических состояниях, нагноительных процессах, ожогах, отморожениях, конъюнктивитах и кератитах, гайморитах и ринитах, вызванных чувствительными к нему бактериями. Коммерческий препарат Л. изготовляют из белка куриных яиц. Это белый аморфный порошок, плохо растворим в воде, нерастворим в спирте.
(Источник: «Словарь терминов микробиологии»)
.
Лизоцим - это... Что такое Лизоцим?
лизоцим — лизоцим … Орфографический словарь-справочник
лизоцим — антибиотик, обнаруживаемый в слезной жидкости, слюне человека и животных, в яичном белке, атакже у фагов, бактерий и растений. Обладает свойствами фермента мурамидазы. Катализирует гидролиз связи между N–ацетилглюкозамином и N–ацетилмурамовой… … Словарь микробиологии
лизоцим — фермент, мурамидаза Словарь русских синонимов. лизоцим сущ., кол во синонимов: 2 • мурамидаза (1) • … Словарь синонимов
ЛИЗОЦИМ — фермент класса гидролаз, разрушающий оболочки бактериальных клеток. В организме человека и животных создает антибактериальный барьер в местах контакта с внешней средой (глаза, носоглотка и др.) … Большой Энциклопедический словарь
ЛИЗОЦИМ — мурамидаза, фермент класса гидролаз; катализирует гидролиз (b 1,4 гликозидных связей между остатками аминосахаров N ацетилглюкозамина и N ацетилмурамовой к ты в полисахаридных цепях муреинов (гетерополисахаридов стенок бактериальных клеток), что… … Биологический энциклопедический словарь
лизоцим — лизоцим. См. мурамидаза. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО, 1995 г.) … Молекулярная биология и генетика. Толковый словарь.
ЛИЗОЦИМ — (Lysozyme) открыт Флемингом (Fleming; 1922) первоначально в слезах, но затем найден в других выделениях и в тканях человека, животных и нек рых растений. Л. характеризуется способностью быстро растворять бактерии й главным обр. сапрофиты.… … Большая медицинская энциклопедия
лизоцим — Фермент, обладающий антибактериальной активностью [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN lysozyme … Справочник технического переводчика
Лизоцим — Трёхмерная структура лизоцима Лизоцим (мурамидаза, англ. lysozyme) антибактериальный агент, фермент класса гидролаз, разрушающий клеточные стенки … Википедия
ЛИЗОЦИМ — Вещество, относящееся к группе ферментов (мурамидаза) и обладающее бактерицидным действием. Лизоцим в больших количествах находится в яйцах птиц, в слюне, в небольших количествах в крови и молоке. Поступает в плазму крови из неповрежденных… … Термины и определения, используемые в селекции, генетике и воспроизводстве сельскохозяйственных животных
лизоцим — фермент, взаимодействующий с сахарами определенных типов в клеточной стенке бактерий и разрушающий оболочки бактериальных клеток. Лизоцим содержится в слюне, некоторых других биологических жидкостях. Источник: Медицинская Популярная Энциклопедия … Медицинские термины
лизоцим - это... Что такое лизоцим?
лизоцим — лизоцим … Орфографический словарь-справочник
лизоцим — антибиотик, обнаруживаемый в слезной жидкости, слюне человека и животных, в яичном белке, атакже у фагов, бактерий и растений. Обладает свойствами фермента мурамидазы. Катализирует гидролиз связи между N–ацетилглюкозамином и N–ацетилмурамовой… … Словарь микробиологии
лизоцим — фермент, мурамидаза Словарь русских синонимов. лизоцим сущ., кол во синонимов: 2 • мурамидаза (1) • … Словарь синонимов
ЛИЗОЦИМ — фермент класса гидролаз, разрушающий оболочки бактериальных клеток. В организме человека и животных создает антибактериальный барьер в местах контакта с внешней средой (глаза, носоглотка и др.) … Большой Энциклопедический словарь
ЛИЗОЦИМ — мурамидаза, фермент класса гидролаз; катализирует гидролиз (b 1,4 гликозидных связей между остатками аминосахаров N ацетилглюкозамина и N ацетилмурамовой к ты в полисахаридных цепях муреинов (гетерополисахаридов стенок бактериальных клеток), что… … Биологический энциклопедический словарь
лизоцим — лизоцим. См. мурамидаза. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО, 1995 г.) … Молекулярная биология и генетика. Толковый словарь.
ЛИЗОЦИМ — (Lysozyme) открыт Флемингом (Fleming; 1922) первоначально в слезах, но затем найден в других выделениях и в тканях человека, животных и нек рых растений. Л. характеризуется способностью быстро растворять бактерии й главным обр. сапрофиты.… … Большая медицинская энциклопедия
лизоцим — Фермент, обладающий антибактериальной активностью [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN lysozyme … Справочник технического переводчика
Лизоцим — Трёхмерная структура лизоцима Лизоцим (мурамидаза, англ. lysozyme) антибактериальный агент, фермент класса гидролаз, разрушающий клеточные стенки … Википедия
ЛИЗОЦИМ — Вещество, относящееся к группе ферментов (мурамидаза) и обладающее бактерицидным действием. Лизоцим в больших количествах находится в яйцах птиц, в слюне, в небольших количествах в крови и молоке. Поступает в плазму крови из неповрежденных… … Термины и определения, используемые в селекции, генетике и воспроизводстве сельскохозяйственных животных
лизоцим — фермент, взаимодействующий с сахарами определенных типов в клеточной стенке бактерий и разрушающий оболочки бактериальных клеток. Лизоцим содержится в слюне, некоторых других биологических жидкостях. Источник: Медицинская Популярная Энциклопедия … Медицинские термины
Лизоцим
СТАЙЛАБ предлагает тест-системы для анализа лизоцима в вине, сыре и колбасных изделиях методом иммуноферментного анализа.
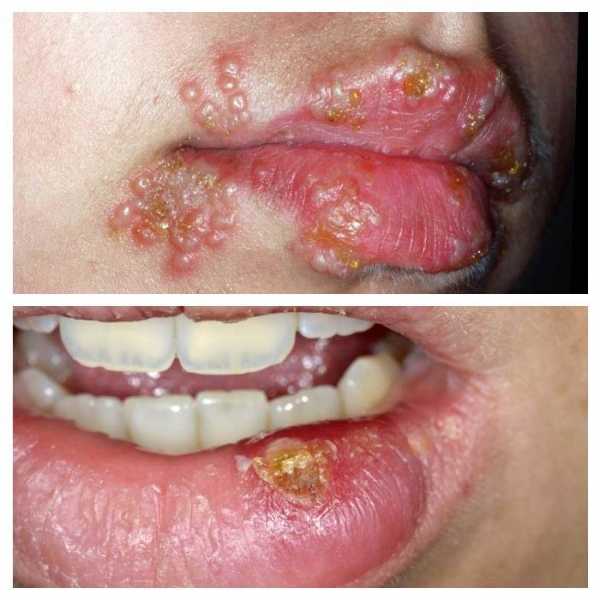
Лизоцим – это фермент, способный разрушать стенки бактерий. Такие ферменты содержатся в слюне, слизях носоглотки и ЖКТ, слезах, плазме крови, грудном молоке и моче многих животных, в том числе, и человека, а также в курином яйце и яйцах других птиц. Лизоцим является частью иммунной системы и обеспечивает защиту организма. Существует множество вариантов этого фермента, включая мутантные формы. Лизоцим куриного яйца также называют белком Gal d 4.
Лизоцим разрушает стенки грамположительных бактерий, в том числе, кисломолочных. Однако он не влияет на рост грамотрицательных бактерий и дрожжей.
В пищевой промышленности лизоцим используют в качестве консерванта, он зарегистрирован как пищевая добавка E1105. Его также применяют в научных исследованиях и для производства лекарственных средств. Продукты, содержащие лизоцим, могут привести к развитию аллергической реакции у людей, чувствительных к этому белку. К ним относятся все продукты, в состав которых входит яичный белок, яйцо или яичный порошок, а также собственно лизоцим. Помимо выпечки, хлеба, кондитерских изделий, колбас и соусов к ним относятся твердые и полутвердые сыры, а также осветленные вина. Лизоцим в них добавляют, чтобы остановить развитие микроорганизмов.
Предполагается, что лизоцим вызывает не менее 15-35% всех аллергических реакций к куриному яйцу. Это менее сильный аллерген, нежели овальбумин и овомукоид, однако он очень часто встречается в продуктах питания. Как и аллергии к другим белкам яйца, аллергия к лизоциму обычно проявляется в раннем детстве и проходит к школьному возрасту.
Как и другие продукты переработки яиц, лизоцим относится к компонентам, наличие которых, согласно ТР ТС 022/2011, необходимо указывать в составе продукции, если нет возможности гарантировать их отсутствие. В Евросоюзе действуют подобные же законодательные требования. Для определения лизоцима в пищевой продукции, в особенности, в вине и сыре, удобно использовать тест-системы для проведения ИФА. Этот высокочувствительный метод точен, не требует значительных затрат на оборудование и позволяет быстро получить результат.
Литература
- Infante S, López-Matas MÁ, Carnés J, Fuentes V, Alonso E, Zapatero L. Allergy reaction mediated by Gal d 4 (lysozyme) after the induction of tolerance with egg. Ann Allergy Asthma Immunol. 2014 Oct;113(4):491-2.
- Carstens C, Deckwart M, Webber-Witt M, Schäfer V, Eichhorn L, Brockow K, Fischer M, Christmann M, Paschke-Kratzin A. Evaluation of the efficiency of enological procedures on lysozyme depletion in wine by an indirect ELISA method. J Agric Food Chem. 2014 Jul 2;62(26):6247-53.
- Hoffman DR. Immunochemical identification of the allergens in egg white. J Allergy Clin Immunol. 1983 May;71(5):481-6.
Лизоцим — Википедия
Трёхмерная структура лизоцимаЛизоци́м (англ. lysozyme, КФ 3.2.1.17) — антибактериальный агент, фермент класса гидролаз, разрушающий клеточные стенки бактерий путём гидролиза пептидогликана клеточной стенки бактерий муреина. Главным образом, лизоцим получают из белка куриных яиц[1]. Также аналогичные ферменты содержатся в организмах животных, в первую очередь, в местах соприкосновения с окружающей средой — в слизистой оболочке желудочно-кишечного тракта, слёзной жидкости, грудном молоке, слюне, слизи носоглотки и т. д. В больших количествах лизоцимы содержатся в слюне, чем объясняются её антибактериальные свойства. В грудном молоке человека концентрация лизоцима весьма высока (около 400 мг/л). Это намного больше, чем в коровьем. При этом концентрация лизоцима в грудном молоке не снижается со временем, через полгода после рождения ребёнка она начинает возрастать.
История
В 1909 году Павел Николаевич Лащенков (Томск) открыл в курином белке протеолитический фермент, который селективно повреждал клеточные стенки, содержащие пептидогликаны. Значительно позже, в 1922 году — Александр Флеминг[2] обнаружил в носовой слизи пациента, страдающего от простуды, вещество, которое может уничтожать некоторые бактерии, такие как Micrococcus lysodeikticus. Он назвал это вещество лизоцим.
После первоначальной эйфории в погоне за антибактериальными веществами оказалось, что лизоцим имеет малое клиническое значение в качестве антибактериального средства, и после открытия пенициллина интерес к лизоциму угас, пока не был выделен и очищен лизоцим из яичного белка курицы (HEWL).
Трёхмерная структура лизоцима впервые была получена Дэвидом Чилтоном Филлипсом (1924—1999) в 1965 году, когда он получил первую модель с помощью рентгеновской кристаллографии[3][4]. Структура была публично представлена на лекции Королевского института в 1965 году[5]. Лизоцим стал второй белковой структурой и первой ферментной структурой, которая была получена с помощью рентгеновской кристаллографии, и первым ферментом, который содержит полную последовательность всех двадцати стандартных аминокислот[6].
HEWL — лизоцим, выделенный из яичного белка курицы
HEWL представляет собой полипептидную цепь (14,3 кДа), содержащую 129 аминокислотных остатков с четырьмя внутримолекулярными дисульфидными мостиками и изоэлектрической точкой вблизи ≈ 11,3; он легко растворим в водной среде.[7]
Являясь ферментом, HEWL катализирует гидролиз B-1,4 гликозидной связи между N-ацетилмурамовой кислотой и N-ацетилглюкозамином в пептидогликане клеточной стенки бактерий. Исторически сложилось так, что этот белок является одним из наиболее изученных белков в области биохимии. В отличие от большинства белков, лизоцим легко кристаллизуется, и эти кристаллы имеют хорошие преломляющие свойства. Полная первичная структура HEWL впервые была освещена в 1963[8] , и чуть позднее, в 1965 году, была создана трёхмерная структура HEWL. Расшифровка трёхмерной структуры HEWL и HEWL-субстратного комплекса открыли путь для понимания специфики лизоцима и механизма его каталитической активности.
Исследования по агрегации HEWL стали важны, когда выяснилось, что точечные мутации в человеческом лизоциме (с которым HEWL имеет 60% идентичных последовательностей) коррелировали с наследственным системным амилоидозом[9].
Это заболевание было симптоматическим, с отложением амилоидных фибрилл человеческого лизоцима (иногда в килограммовых количествах) в почках, желудочно-кишечном тракте, лимфатических узлах, кровеносных сосудах, селезёнке и печени. Лизоцим, пожалуй, единственный фермент, который образует амилоид в естественных условиях.
Лизоцим человека
Человеческий лизоцим является гликозидазой, которая функционирует в качестве антибактериального средства. Человеческий лизоцим (ЕС 3.2.1.17) содержит 130 остатков, принадлежащих к классу С-типа, и широко распространён в различных тканях и жидкостях организма, в том числе печени, суставных хрящах, крови, слюне, слёзной жидкости и молоке[10]. Он кодируется геном, расположенным на 12-й хромосоме и состоящим из 4 экзонов и 3 интронов.[11]
Лизоцим гидролизует преимущественно B-1,4 гликозидные связи между N-ацетилмурамовой кислотой и N-ацетилглюкозамином, содержащимися в структуре пептидогликана клеточной стенки некоторых микроорганизмов, особенно грамположительных бактерий, и, следовательно, играет определённую роль в защите хозяина. Фермент заставляет сахар мурамовой кислоты находиться в напряжённой конформации, и при совместном действии двух ключевых остатков — глутаминовой кислоты в положении 35 и аспарагиновой кислоты в положении 52 — гидролизует гликозидные связи.
Лизоцим интенсивно экспрессируется в кроветворных клетках, где он находится в гранулоцитах, моноцитах и макрофагах, а также в их предшественниках в костном мозге. Обычная концентрация лизоцима в плазме составляет от 4 до 13 мг/л, но только следы его можно увидеть в моче здоровых лиц. В случае нормальных субъектов, по меньшей мере, 500 мг лизоцима производятся в день, но время жизни протеина в плазме является очень коротким; 75 % элюируют в течение 1 ч, в основном, через почки[12]. Сильно повышенные концентрации лизоцима в плазме и моче связаны с целым рядом патологических состояний и мониторятся в течение многих лет, так как являются возможным маркером моноцитарного лейкоза, но в то же время, как в случае больных с миелопролиферативными расстройствами, при нормальной функции почек, производство лизоцима увеличивается до 4 раз.
За последние 30 лет человеческий лизоцим и HEWL были использованы в качестве системы отсчёта для изучения многих аспектов структуры и функции белков, в том числе стабильности белка и механизма его сворачивания. Были установлены шесть природных мутаций в человеческом лизоциме[13] , и аминокислотные замены (все расположены в B-домена области нативной структуры лизоцима)[14]. Мутации приводят к появлению нескольких вариантов белка (I56T, F57I, W64R, D67H, T70N и F57I / T70N или W112R / T70N). Все эти варианты, кроме T70N, были связаны с системными амилоидозами с участием почек, печени и селезёнки[9], в то время как не амилоидогенный вариант T70N является довольно распространённым явлением в нормальной британской популяции.
Применение
В пищевой промышленности зарегистрирован в качестве пищевой добавки E1105 (консервант).
В медицине в качестве местного антисептического средства[15].
Применение при беременности
| 1 триместр | 2 триместр | 3 триместр |
|---|---|---|
| Противопоказан, большинство врачей считает приём лекарства в это время нежелательным и опасным. | Разрешён, под врачебным наблюдением. | Приём допустим, но с учётом возможной аллергии. Не перед родами.[16] |
Механизм лизиса
Фермент атакует пептидогликаны (в частности, муреин), входящие в состав клеточных стенок бактерий (особенно много его в клеточных стенках грам-положительных бактерий — до 50-80 %). Лизоцим гидролизует β(1→4)-гликозидную связь между N-ацетилмурамовой кислотой и N-ацетилглюкозамином. Пептидогликан при этом связывается с активным центром фермента (в форме кармана), расположенным между двумя его структурными доменами. Сорбционный центр лизоцима представляет 6 карманов (A, B, C, D, E, F), причём в A, C и E может связываться только N-ацетилглюкозамин, а в B, D и F — как N-ацетилглюкозамин, так и N-ацетилмурамовая кислота. Молекула субстрата в активном центре принимает конформацию, близкую к конформации переходного состояния. В соответствии с механизмом Филлипса, лизоцим связывается с гексасахаридом, затем переводит 4-й остаток в цепи в конформацию твист-кресла. В этом напряжённом состоянии гликозидная связь между центрами D и E легко разрушается. Ингибитором лизоцима служит, в частности, трисахарид N-ацетилглюкозамина, связывающийся с каталитически неактивными центрами A, B и C и препятствующий связыванию субстрата.
Остатки глутаминовой кислоты (Glu35) и аспарагиновой кислоты (Asp52) критичны для функционирования фермента, причём Asp52 ионизирован, а Glu35 нет. Некоторые авторы полагают, что Glu35 выступает в качестве донора протона при разрыве гликозидной связи субстрата, разрушая связь, а Asp52 выступает в роли нуклеофила, при образовании интермедиата — гликозил-фермента. Затем гликозил-фермент реагирует с молекулой воды, в результате чего фермент возвращается в исходное состояние и образуется продукт гидролиза[17].
Другие авторы полагают, что реакция протекает через образование карбоксоний-иона, стабилизированного заряженной карбоксильной группой Asp52, в то время как высвобождение спирта катализируется по механизму общего основного катализа незаряженным карбоксилом Glu35.[18].
Примечания
- ↑ G. Alderton, W.H. Ward, H.L. Fevold (1945). «ISOLATION OF LYSOZYME FROM EGG WHITE». Proceedings of the Royal Society of London. Series B, Containing Papers of a Biological Character (157): 43—58.
- ↑ Alexander Fleming (1922). «On a Remarkable Bacteriolytic Element Found in Tissues and Secretions». The Journal of Biological Chemistry (93): 306—317.
- ↑ Blake CC, Koenig DF, Mair GA, North AC, Phillips DC, Sarma VR. (1965). «Structure of hen egg-white lysozyme. A three-dimensional Fourier synthesis at 2 Angstrom resolution». Nature 206 (986): 757–61. DOI:10.1038/206757a0. PMID 5891407.
- ↑ Johnson LN, Phillips DC. (1965). «Structure of some crystalline lysozyme-inhibitor complexes determined by X-ray analysis at 6 Angstrom resolution». Nature 206 (986): 761–3. DOI:10.1038/206761a0. PMID 5840126.
- ↑ Johnson, LN (1998). «The early history of lysozme». Nat Struct Mol Biol 5 (11): 942–944. DOI:10.1038/2917. PMID 9808036.
- ↑ Canfield, RE (1963). «The Amino Acid Sequence of Egg White Lysozyme». J Biol Chem 238 (8): 2698–2707. PMID 14063294.
- ↑ Wetter, L. R., Deutsch, H. F. Immunological studies on egg white proteins IV. Immunochemical and physical studies of lysozyme. // J. Biol. Chem.. — Т. 192. — С. 237–242.
- ↑ Canfield, R. E. The amino acid sequence of egg white lysozyme // J. Biol. Chem.. — Т. 238. — С. 2698–2707.
- ↑ 1 2 Pepys, M. B., Hawkins, P. N., Booth, D. R., Vigushin, D. M., Tennent, G. A., Soutar, A. K., et al. Human lysozyme gene mutations cause hereditary systemic amyloidosis. // Nature. — Т. 362. — С. 553–557.
- ↑ Reitamo, S., Klockars, M., Adinolfi, M., Osserman, E. F. Human lysozyme (origin and distribution in health and disease) // Ric. Clin. Lab.. — Т. 8. — С. 211–231.
- ↑ Peters, C. W., Kruse, U., Pollwein, R., Grzeschik, K. H., Sippel, A. E. The human lysozyme gene. Sequence organization and chromosomal localisation. // Eur. J. Biochem.. — № 182. — С. 507–516.
- ↑ Hansen, N. E., Karle, H., Andersen, V., Olgaard, K. Lysozyme turnover in man. // J. Clin. Invest.. — Т. 51. — С. 1146–1155.
- ↑ Pepys, M. B., Hawkins, P. N., Booth, D. R., Vigushin, D. M., Tennent, G. A., Soutar, A. K., et al. // Nature. — Т. 362. — С. 553–557.
- ↑ Dumoulin, M., Kumita, J. R., Dobson, C. M. Normal and aberrant biological self-assembly: insights from studies of human lysozyme and its amyloidogenic variants. // Acc. Chem. Res.. — Т. 39. — С. 603–610.
- ↑ Местный антисептический препарат Лизобакт® — Публикации (недоступная ссылка — история). Проверено 30 мая 2011. Архивировано 3 октября 2011 года.
- ↑ Не опасен ли Лизобакт® при беременности при лечении боли в горле? (рус.), Детский сайт Малышам инфо (27 июня 2017). Проверено 29 июня 2017.
- ↑ С.Д. Варфоломеев. Химическая энзимология. — М.: Издательский центр "Академия", 2005. — С. 238—239. — ISBN 5-7695-2062-0.
- ↑ Э. Фёршт. Структура и механизм действия ферментов. — М.: "Мир", 1980. — С. 395—396. — DOI:577.15/.17[Ошибка: Неверный DOI!].
Литература
ЛИЗОЦИМ - это... Что такое ЛИЗОЦИМ?
лизоцим — лизоцим … Орфографический словарь-справочник
лизоцим — антибиотик, обнаруживаемый в слезной жидкости, слюне человека и животных, в яичном белке, атакже у фагов, бактерий и растений. Обладает свойствами фермента мурамидазы. Катализирует гидролиз связи между N–ацетилглюкозамином и N–ацетилмурамовой… … Словарь микробиологии
лизоцим — фермент, мурамидаза Словарь русских синонимов. лизоцим сущ., кол во синонимов: 2 • мурамидаза (1) • … Словарь синонимов
ЛИЗОЦИМ — фермент класса гидролаз, разрушающий оболочки бактериальных клеток. В организме человека и животных создает антибактериальный барьер в местах контакта с внешней средой (глаза, носоглотка и др.) … Большой Энциклопедический словарь
ЛИЗОЦИМ — мурамидаза, фермент класса гидролаз; катализирует гидролиз (b 1,4 гликозидных связей между остатками аминосахаров N ацетилглюкозамина и N ацетилмурамовой к ты в полисахаридных цепях муреинов (гетерополисахаридов стенок бактериальных клеток), что… … Биологический энциклопедический словарь
лизоцим — лизоцим. См. мурамидаза. (Источник: «Англо русский толковый словарь генетических терминов». Арефьев В.А., Лисовенко Л.А., Москва: Изд во ВНИРО, 1995 г.) … Молекулярная биология и генетика. Толковый словарь.
ЛИЗОЦИМ — (Lysozyme) открыт Флемингом (Fleming; 1922) первоначально в слезах, но затем найден в других выделениях и в тканях человека, животных и нек рых растений. Л. характеризуется способностью быстро растворять бактерии й главным обр. сапрофиты.… … Большая медицинская энциклопедия
лизоцим — Фермент, обладающий антибактериальной активностью [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN lysozyme … Справочник технического переводчика
Лизоцим — Трёхмерная структура лизоцима Лизоцим (мурамидаза, англ. lysozyme) антибактериальный агент, фермент класса гидролаз, разрушающий клеточные стенки … Википедия
ЛИЗОЦИМ — Вещество, относящееся к группе ферментов (мурамидаза) и обладающее бактерицидным действием. Лизоцим в больших количествах находится в яйцах птиц, в слюне, в небольших количествах в крови и молоке. Поступает в плазму крови из неповрежденных… … Термины и определения, используемые в селекции, генетике и воспроизводстве сельскохозяйственных животных
лизоцим — фермент, взаимодействующий с сахарами определенных типов в клеточной стенке бактерий и разрушающий оболочки бактериальных клеток. Лизоцим содержится в слюне, некоторых других биологических жидкостях. Источник: Медицинская Популярная Энциклопедия … Медицинские термины
применение, влияние, вред и польза
 Лизоцим – вещество, которое относится к классификационной группе пищевых консервантов, и маркируется шифровым номером Е 1105.
Лизоцим – вещество, которое относится к классификационной группе пищевых консервантов, и маркируется шифровым номером Е 1105.
Поскольку природа происхождения добавки полусинтетическая, то есть сырьем для получения ее является натуральный продукт, то опасность для здоровья человека и его организма в целом практически отсутствует.
Происхождение: полусинтетическое;
Категория добавки: консервант, энзим, биологический катализатор;
Опасность: минимального уровня, практически отсутствует;
Синонимические названия: Е 1105, лизоцим, афилакт, Е-1105, Lysozyme, лізоцим, афілакт.
Общая информация
Физические свойства и характеристики добавки Е 1105 таковы: порошкообразная форма, порошок аморфный, цвет белый, запах уксусный, слабый, почти отсутствует, проявляются свойства антисептика, хорошая растворимость в водной среде, высокая устойчивость в отношении спиртовой среды.
В 1922 году был открыт данный фермент, британским бактериологом Александром Флемингом.
Природным сырьем или поставщиком добавки е 1105 является куриный яичный белок (включая и породы кур модифицированные).

Но содержание лизоцима отмечается в целом ряде живых микроорганизмов, в грудном молоке человека, животных, в слезной жидкости, в слюне, и слизистых оболочках желудочно-кишечного тракта.
Кстати сказать, именно анстисептические свойства данного вещества и наделяют слюну человека антибактериальными свойствами.
Влияние на организм
Вред
Опасность представляет только порошок Е 1105, добытый из генно-модифицированных яиц. В этом случае лизоцим способен вызвать достаточно интенсивные аллергические реакции кожного типа.

В остальных случаях это вещество является абсолютно безвредным.
Польза
Польза лизоцима проявляется через его антисептическое воздействие. В фармакологии применяется данного вида добавка в качестве мощного антисептика для местного применения.
Использование
В пищевых производствах лизоцим применяется как консервант, способный убивать ряд видов бактерий и, тем самым, продлевать срок хранения готового продукта питания человека. Так его добавляют при изготовлении сыров, молочнокислых продуктов, копченой рыбы.

В фармакологии Е 1105 играет роль антисептика. Так же его добавляют и в некоторые специализированные косметические средства (предназначенные для устранения угревой сыпи, и т. п.).
Законодательство
Разрешена данная добавка к пищевым продуктам в странах Европейского Союза, Украине и Российской Федерации. В отношении других стран информации по вопросу использования добавки Е 1105 не имеется.
ЛИЗОЦИМ — Большая Медицинская Энциклопедия
ЛИЗОЦИМ (КФ 3.2.11.17) — фермент, катализирующий гидролиз бета(1—>4)-гликозидной связи между N-ацетилмурамовой кислотой и N-ацетилглюкозамином в молекуле пептидогликана клеточной стенки бактерий (особенно грамположительных), чем вызывает их растворение (лизис) и гибель, создавая тем самым антибактериальный барьер в организме. Лизоцим находится в слезной жидкости, слизистых оболочках дыхательных путей и кишечника, мокроте, коже, молоке, почках, хряще, печени, сердце, семенной жидкости и сыворотке крови человека. В медицинской практике Лизоцим применяют в качестве антисептического средства. Определение активности Лизоцима в биологических жидкостях используют в диагностических целях, в частности для диагностики лейкемии, нек-рых заболеваний почек (гломерулонефрита, нефротического синдрома и др.). При злокачественных опухолях мочеполовых органов в моче и в сыворотке крови увеличивается активность Лизоцима, что используется как один из тестов для дифференциальной диагностики этих заболеваний.
Лизоцим применяется также в пищевой промышленности для консервирования нек-рых продуктов питания.
Лизоцим содержится в тканях различных органов и биологических жидкостях подавляющего большинства животных организмов и во многих растениях, а также в нек-рых микроорганизмах.
Впервые он был обнаружен в 1922 г. А. Флемингом в белке куриного яйца. Позже Л. нашли почти во всех тканях и биол, жидкостях человека. У человека наиболее богаты Л. (в г на 1 кг веса) лейкоциты — 10 и слезы — 7, менее богаты слюна — 0,2, молоко — ок. 0,04, плацента — 0,02, плазма крови — 0,01. Из растений в наиболее значительном количестве Л. содержится в репе, хрене, редьке, капусте и нек-рых цветах (напр., в цветах примулы). Л. обнаружен в бактериях (напр., в Вас. subtilis), а также в бактериофагах (см.), с чем, по-видимому, связано их бактерицидное действие.
В СССР первое фундаментальное исследование Л. было проведено 3. В. Ермольевой с группой сотрудников .
В тканях животных Л. локализован в лизосомах (см.). В межклеточное вещество и в биол, жидкости Л. секретируют макрофаги, причем из них выделяется до 80—90% общего количества содержащегося в них Л.
Л. из различных источников несколько отличается по аминокислотному составу. Молекула Л. представляет собой полипептидную цепь, состоящую из 127 —130 аминокислотных остатков. N-концевой аминокислотой в молекуле Л. является лизин (см.), на C-конце цепи находится лейцин (см.). Высокое содержание аргинина (см.) и лизина, преобладание свободных NH2-групп над COOH-группами придает Л. основной характер: его Изоэлектрическая точка (см.) находится между pH 10,5 и 11,0.
Молекула Л. содержит четыре S-S-связи, свободных SH-групп в лизоциме нет.
Мол. вес (масса) Л., выделенного из различных источников, колеблется в широких пределах. Так, мол. вес (масса) Л. из белка куриного яйца составляет ок. 14 000, репы —25 000, а Л., выделенный из Вас. subtilis, имеет мол. вес (массу) ок. 93 000. Лизоцимы животного происхождения, выделенные из разных источников, имеют мол. вес (массу) ок. 15 000 (от 13 000 до 18 000).
Л. растворим в воде при pH 4,0 — 6,0, довольно стабилен при кислом pH. Так, р-р Л. в 2% р-ре уксусной к-ты выдерживает нагревание до 100° в течение 45 мин., в то время как нейтральные и щелочные р-ры Л. при нагревании быстро теряют ферментативную активность. Л. довольно устойчив к действию протеолитических ферментов, в частности к трипсину и папаину. Пепсин расщепляет Л., но с небольшой скоростью; ионы нек-рых металлов (напр., Mn2+) повышают резистентность Л. к протеиназам. Л. теряет активность при блокировании свободных NH2 групп и COOH-групп, а также алифатических OH-групп. Инактивацию Л. вызывает также связывание амидных гуанидиновых группировок. Установлено, что в проявлении ферментативной активности Л., в частности в образовании ферментсубстратного комплекса, существенную роль играет остаток триптофана. Показано также, что лизоциму для гидролиза гликозидной связи необходимо кооперативное взаимодействие остатка глутаминовой к-ты, занимающей в пептидной цепи фермента положение 35, и остатка аспарагиновой к-ты, находящейся в 52-м положении.
Очищенные препараты Л. получают его адсорбцией на бентонитовой глине с последующей элюцией пиридином или на ионообменных смолах (см. Иониты). Кристаллический Л. может быть получен осаждением 5% NaCl в интервале значений pH от 3,5 до 11,0 (из р-ров Л. в буферных р-рах большой емкости или непосредственно из яичного белка). Форма кристаллов зависит от pH среды. Советскими исследователями Н. А. Черкасовым, Н. А. Кравченко и Е. Д. Каверзневой предложен быстрый метод получения очищенного Л., основанный на его биоспецифической адсорбции хитином.
Специфическая способность Л. растворять бактериальные клетки (обычно Micrococcus lysodeikticus) является основой количественного метода определения активности этого фермента.
Лизоцим как препарат
Для применения в качестве лекарственного препарата Л. получают из белка куриных яиц.
Препарат Л. представляет собой белый аморфный порошок или пористую массу со слабым запахом уксусной к-ты. Он трудно растворим в воде, практически нерастворим в спирте; pH 2% р-ра Л. 3,5—5,0.
Л. как лекарственное средство проявляет антибактериальное (иногда бактериостатическое) действие (см. Бактериолиз), подавляет рост грамположительных микробов, менее чувствительны к нему грамотрицательные бактерии. Он весьма эффективен в комбинации с антибиотиками, особенно пенициллиновой группы, усиливая их действие в десятки раз, Л. обладает заметной противогепариновой активностью.
Применяют Л. при септических состояниях, гнойных процессах, ожогах, травмах, отморожениях, конъюнктивитах, эрозиях роговицы, гайморитах и других заболеваниях, вызванных чувствительными к действию Л. микроорганизмами.
Применяют Л. местно и внутримышечно. Перед применением содержимое флакона с Л. растворяют в 2—3 мл изотонического р-ра натрия хлорида или 0,25% р-ра новокаина.
Внутримышечно вводят по 150 мг 2—3 раза в сутки в течение не менее 7 дней. При необходимости препарат можно вводить в течение 1 месяца.
Местно Л. применяют в глазной практике в виде 0,25% р-ра, к-рый закапывают в больной глаз 3—4 раза в день в течение 3—7 дней. В оториноларингологической практике применяют аэрозоли 0,05% р-ра Л. по 10 мл на сеанс, курс лечения 5 —10 дней.
При лечении ожогов, отморожений и гнойных ран на пораженное место накладывают салфетки, смоченные 0,05% р-ром Л.
Препараты Л. практически нетоксичны, не обладают местнораздражающим действием. Препарат обычно хорошо переносится. При длительном внутримышечном введении следует контролировать свертываемость крови.
Форма выпуска: герметически укупоренные флаконы, содержащие по 50, 100 и 150 мг лизоцима.
Хранение в сухом, защищенном от света месте при температуре не выше 20 градусов.
Библиогр.: Белки, под ред. Г. Нейрата и К. Бейли, пер. с англ., т. 1, с. 13, М., 1956, т. 3, с. 760, М., 1958; Бухарин О. В. и Васильев Н.Б. Лизоцим и его роль в биологии и медицине, Томск, 1974, библиогр.; Ермольева 3. В. и др. Экспериментальное изучение и клиническое применение лизоцима, Антибиотики, т. 8, № 1, с. 39, 1963; Либман Б. Г., Каргаманова К. А. и Ермольева 3. В. Применение лизоцима в медицине, Сов. мед., № 11, с. 34, 1971, библиогр.; Черкасов Н. А., Кравченко Н. А. и Каверзнева Е. Д. О хроматографическом поведении лизоцима на колонке с хитином, Докл. АН СССР, т. 170, № 1, с. 213, 1966.
Л. В. Павлихина; В. К. Лепахин (фарм.).
Лизоцим
Случайный факт:
30% мужчин обладают повышенной чувствительностью организма к изменениям погодных условий. Среди женщин метеочувствительных более 50%. — Обновить- Разрешающие применение — 4
- Упоминаний о добавке— 5
Законы и документы о пищевой добавке:
- Россия — разрешена
- Украина — разрешена
- Беларусь — разрешена
- Евросоюз — разрешена
- США — нет данных
- Канада — разрешена
Применение добавки по странам:
Описание пищевой добавки
Описание
Содержится во многих тканях человека, производится организмом человека и животных самостоятельно, является естественным антисептиком.Это белый аморфный порошок, имеет слабый запах уксусной кислоты. Лизоцим хорошо растворяется в воде, слабо растворяется в спирте.Лизоцим содержится, в первую очередь, в местах соприкосновения организма человека и животных с окружающей средой — в слизистой оболочке желудочно-кишечного тракта, слёзной жидкости, грудном молоке, слюне, слизи носоглотки и т. д. В больших количествах лизоцим содержится в слюне, чем объясняются ее антибактериальные свойства. Это фермент класса гидролаз, который был открыт в 1922 году Александром Флемингом.
Применение
В пищевой промышленности используется в качестве консерванта. Лизоцим применяется при производстве сыра и некоторых других молочнокислых продуктов. В составе лекарственных препаратов обладает муколитической и противовоспалительной способностью.Используется в медицине в качестве местного противогнилостного средства (антисептика) для обработки ран и ушибов. Используется при производстве косметической продукции.
влияние на человека
Людям с хроническими заболеваниями стоит относиться к использованию лизоцима с осторожностью. Есть сведения, что повышенная концентрация этого вещества вызывает головные боли, реже аллергические реакции.Сырьём для производства Е-1105 могут быть белки яиц от генетически модифицированных пород кур. Следовательно, использование лизоцима Е-1105, полученного из ГМ, может отрицательно сказаться на здоровье. Лизоцим Е-1105 может вызвать аллергические реакции на коже в виде сыпи.