Фосфаты что это такое
фосфаты - это... Что такое фосфаты?
ФОСФАТЫ — (фр. phosphates, от phosphore фосфор). Соль, происходящая от соединения фосфорной кислоты с различными основаниями. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ФОСФАТЫ соли, получающиеся от соединения фосфорной … Словарь иностранных слов русского языка
ФОСФАТЫ — ФОСФАТЫ, соли ортофосфорной кислоты h4PO4 (ортофосфаты) и полифосфорных кислот (полифосфаты). Ортофосфаты встречаются в природе в виде минеральных образований (известно около 190), важнейшие из них апатит и фосфорит. Природные фосфаты сырье для… … Современная энциклопедия
Фосфаты — ФОСФАТЫ, соли ортофосфорной кислоты h4PO4 (ортофосфаты) и полифосфорных кислот (полифосфаты). Ортофосфаты встречаются в природе в виде минеральных образований (известно около 190), важнейшие из них апатит и фосфорит. Природные фосфаты сырье для… … Иллюстрированный энциклопедический словарь
ФОСФАТЫ — соли и эфиры фосфорных кислот. Различают: ортофосфаты (соли и эфиры ортофосфорной кислоты Н3РО4) и полимерные фосфаты (полифосфаты, метафосфаты, ультрафосфаты). Соли входят в состав фосфорных удобрений, минеральных подкормок, моющих средств и др … Большой Энциклопедический словарь
«Фосфаты» — производств. объединение по добыче фосфоритов и произ ву минеральных удобрений и кормовых добавок в Mоск. обл. Cоздано в 1962 на базе Лопатинского и Eгорьевского рудников. Cырьевой базой является Eгорьевское м ние, эксплуатирующееся c… … Геологическая энциклопедия
фосфаты — ФОСФАТЫ, ов, ед. фосфат, а, муж. (спец.). Соли или эфиры фосфорных кислот. | прил. фосфатный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ФОСФАТЫ — м лы, соли ортофосфорной кислоты Н3РО4, довольно многочисленные и весьма разнообразные по составу. Среди Ф. различают: безводные кислые монетит СаН[РО4] и др.; безводные нормальные витлокит Са3[РО4]2, монацит (Ce,La,Di)[PO4] и др.; кислые водные… … Геологическая энциклопедия
ФОСФАТЫ — соли (см.), главное применение в качестве ингредиентов фосфорных удобрений и моющих средств, для умягчения воды и др … Большая политехническая энциклопедия
Фосфаты — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
Фосфаты — соли и эфиры фосфорных кислот. Из солей различают ортофосфаты и полимерные (или конденсированные) Ф. Последние делят на полифосфаты, имеющие линейное строение фосфат анионов, метафосфаты с кольцеобразным (циклическим) фосфат анионом и… … Большая советская энциклопедия
Фосфаты — [phosphates] соли и эфиры фосфорных кислот. Из солей различают ортофосфаты и полимерные (или конденсированные) фосфаты. К фосфатам относят также весьма стойкие соединения ВРО4 и АlРО4. Все встречающиеся в природе соединения фосфора ортофосфаты.… … Энциклопедический словарь по металлургии
Фосфаты природные - это... Что такое Фосфаты природные?
- Фосфаты природные
- (a.
natural phosphates; H. naturliche Phosphate; ф. phosphates naturels; и. fosfatos naturales, fosfatos nativos, fosfatos virgenes) - класс минералов, солей ортофосфорной к-ты H3PO4. B природе известно св.
230 Ф. п., среди к-рых выделяют: простые (c одним) и сложные (c двумя и более видообразующими катионами), кислые (типа CaHPO4-монетит), средние и основные (c OH-группой), a также c др. дополнит, анионами (F-, Cl, O2-, (AsO4)3-, (SiO4)3- и др.), безводные и водные. Bедущие литофильные катионы: Ca2+, Al3+, Fe2+, Mn3+, Mg2+, Na+, реже встречаются уранил-фосфаты, a также фосфаты TR, Be и халькофилов Cu2+, Zn, Pb, Bi.
Hаиболее распространены в природе простые нормальные и водные фосфаты крупных катионов Ca2+ и TR3+ (апатит, монацит, ксенотим, рабдофанит, чёрчит) Mежду катионами Al 3+ и Fe3+, Fe2+ и Mn2+благодаря близости размеров ионов широко развит изоморфизм.
Из-за относит. сложности состава Ф. п. более свойственны кристаллы низкой симметрии. Пространств. расположение катионов и дополнит, анионов, a также молекул воды определяет координационные, цепочечные, слоистые и каркасные мотивы в кристаллич. структуре Ф. п. Bодные Ф. п. co слоистым структурным мотивом имеют листовато-уплощённый или таблитчатый габитус кристаллов либо сложены чешуйчатыми агрегатами. Простые безводные фосфаты Al, Mg, Mn, Fe и Ca отличаются более высокой твёрдостью (4-5) и плотностью (3200-7000 кг/м3), более сложные водные имеют тв. 3-4, плотность 1600-4000 кг/м3. Ф. п. иногда бесцветны, чаще интенсивно окрашены, напр. для ф. п. Al и Fe особенно характерен синий цвет разл. оттенков. Mн. фосфатам свойственна люминесценция.
Ф. п. встречаются в виде акцессорных минералов в пегматитах, скарнах, грейзенах; характерны для гипергенных образований, где представлены чаще землистыми, сферич. агрегатами или в виде корочек нарастают на др. минералы. Kрупные скопления фосфатов связаны c щелочными породами и карбонатитами, a также c осадочными породами (фосфориты).
Ф. п. тяжёлых металлов образуются в зоне окисления мн. рудных м-ний. Pедкоземельные и радиоактивные фосфаты (монацит, ксенотим) накапливаются в речных и прибрежно-морских россыпях. Яркая окраска нек-рых уранил- фосфатов (урановые слюдки) используется в качестве поискового признака руд урана. Д. A. Mинеев.
Горная энциклопедия. — М.: Советская энциклопедия. Под редакцией Е. А. Козловского. 1984—1991.
- «Фосфаты»
- Фосфор
Смотреть что такое "Фосфаты природные" в других словарях:
ФОСФАТЫ ПРИРОДНЫЕ — класс минералов, соли ортофосфорной кислоты; ок. 180 минеральных видов. Преобладают островные и слоистые структуры. Выделяют групы безводных и водных, простых и двойных (сложных) природных фосфатов. Твердость 2 6,5; плотность 1,7 6 г/см³.… … Большой Энциклопедический словарь
фосфаты природные — класс минералов, соли ортофосфорной кислоты; свыше 230 минеральных видов. Преобладают островные и слоистые структуры. Выделяют группы безводных и водных, простых и двойных (сложных) природных фосфатов. Твёрдость 2 6,5; плотность 1,6 4 г/см3.… … Энциклопедический словарь
Фосфаты природные — класс минералов солей ортофосфорной кислоты h4PO4, весьма разнообразных по составу. Включают около 180 минералов; ср. соли (например, ксенотим Y [PO4], Монацит) редки. В основном Ф. п. – сложные соединения с двумя и более катионами [Са2 + … Большая советская энциклопедия
ФОСФАТЫ ПРИРОДНЫЕ — класс минералов, соли ортофосфорной кислоты; св. 230 минер. видов. Преобладают островные и слоистые структуры. Выделяют группы безводных и водных, простых и двойных (сложных) Ф. п. Тв. 2 6,5; плотн. 1,6 4 г/см3. Большинство минералов гипергенного … Естествознание. Энциклопедический словарь
Фосфаты — соли и эфиры фосфорных кислот. Из солей различают ортофосфаты и полимерные (или конденсированные) Ф. Последние делят на полифосфаты, имеющие линейное строение фосфат анионов, метафосфаты с кольцеобразным (циклическим) фосфат анионом и… … Большая советская энциклопедия
ФОСФАТЫ — ФОСФАТЫ, соли ортофосфорной кислоты h4PO4 (ортофосфаты) и полифосфорных кислот (полифосфаты). Ортофосфаты встречаются в природе в виде минеральных образований (известно около 190), важнейшие из них апатит и фосфорит. Природные фосфаты сырье для… … Современная энциклопедия
Фосфаты — ФОСФАТЫ, соли ортофосфорной кислоты h4PO4 (ортофосфаты) и полифосфорных кислот (полифосфаты). Ортофосфаты встречаются в природе в виде минеральных образований (известно около 190), важнейшие из них апатит и фосфорит. Природные фосфаты сырье для… … Иллюстрированный энциклопедический словарь
Природные минеральные пигменты — У этого термина существуют и другие значения, см. Пигмент. Выкраски минералов пигментов на желтке, палитра для иконописи (кроме охр). Подборка и изображение: Виктор Слётов, с http://mindraw.web.ru … Википедия
Хлориды природные — (a. natural chlorides; н. naturliche Chloride; ф. chlorures naturels; и. cloruros naturales, cloruros nativos, cloruros virgenes) класс минералов, соли соляной к ты. Известно порядка 100 минеральных видов X. п., при этом в класс X. п.… … Геологическая энциклопедия
Хроматы природные — (a. natural chromates; н. naturliche Chromate; ф. chromates naturels; и. cromatos nativos, cromatos naturales, cromatos virgenes) класс минералов, соли хромовых кислот. Bключает 15 16 минеральных видов, видообразующими катионами в к рых… … Геологическая энциклопедия
ФОСФАТЫ - это... Что такое ФОСФАТЫ?
ФОСФАТЫ — (фр. phosphates, от phosphore фосфор). Соль, происходящая от соединения фосфорной кислоты с различными основаниями. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ФОСФАТЫ соли, получающиеся от соединения фосфорной … Словарь иностранных слов русского языка
ФОСФАТЫ — ФОСФАТЫ, соли ортофосфорной кислоты h4PO4 (ортофосфаты) и полифосфорных кислот (полифосфаты). Ортофосфаты встречаются в природе в виде минеральных образований (известно около 190), важнейшие из них апатит и фосфорит. Природные фосфаты сырье для… … Современная энциклопедия
Фосфаты — ФОСФАТЫ, соли ортофосфорной кислоты h4PO4 (ортофосфаты) и полифосфорных кислот (полифосфаты). Ортофосфаты встречаются в природе в виде минеральных образований (известно около 190), важнейшие из них апатит и фосфорит. Природные фосфаты сырье для… … Иллюстрированный энциклопедический словарь
ФОСФАТЫ — соли и эфиры фосфорных кислот. Различают: ортофосфаты (соли и эфиры ортофосфорной кислоты Н3РО4) и полимерные фосфаты (полифосфаты, метафосфаты, ультрафосфаты). Соли входят в состав фосфорных удобрений, минеральных подкормок, моющих средств и др … Большой Энциклопедический словарь
«Фосфаты» — производств. объединение по добыче фосфоритов и произ ву минеральных удобрений и кормовых добавок в Mоск. обл. Cоздано в 1962 на базе Лопатинского и Eгорьевского рудников. Cырьевой базой является Eгорьевское м ние, эксплуатирующееся c… … Геологическая энциклопедия
фосфаты — ФОСФАТЫ, ов, ед. фосфат, а, муж. (спец.). Соли или эфиры фосфорных кислот. | прил. фосфатный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ФОСФАТЫ — м лы, соли ортофосфорной кислоты Н3РО4, довольно многочисленные и весьма разнообразные по составу. Среди Ф. различают: безводные кислые монетит СаН[РО4] и др.; безводные нормальные витлокит Са3[РО4]2, монацит (Ce,La,Di)[PO4] и др.; кислые водные… … Геологическая энциклопедия
Фосфаты — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
Фосфаты — соли и эфиры фосфорных кислот. Из солей различают ортофосфаты и полимерные (или конденсированные) Ф. Последние делят на полифосфаты, имеющие линейное строение фосфат анионов, метафосфаты с кольцеобразным (циклическим) фосфат анионом и… … Большая советская энциклопедия
Фосфаты — [phosphates] соли и эфиры фосфорных кислот. Из солей различают ортофосфаты и полимерные (или конденсированные) фосфаты. К фосфатам относят также весьма стойкие соединения ВРО4 и АlРО4. Все встречающиеся в природе соединения фосфора ортофосфаты.… … Энциклопедический словарь по металлургии
Ортофосфат - это... Что такое Ортофосфат?
Ортофо́сфорная кислота́ (H3PO4) — твёрдое вещество при комнатной температуре, бесцветные гигроскопичные кристаллы.
При температуре выше 213 °C превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют её 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других обычных растворителях.
Получение
Фосфорную кислоту получают из фосфорита:
- Са3(PO4)2 + 3H2SO4 = 3CaSO4 + 2H3PO4
Можно получить гидролизом пентахлорида фосфора:
- PCl5 + 4 H2O → H3PO4 + 5 HCl
Или взаимодействием с водой оксида Р2O5, полученного сжиганием фосфора:
- Р2O5 + 3H2O = 2H3PO4
С водой реакция идет очень бурно, поэтому Р2O5 обрабатывают нагретым до 200° С концентрированным раствором H3PO4.
Расплавленная H3PO4 и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например НClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот явялется реакция с нитратом серебра — образуется жёлтый осадок:
- Н3РО4 + 3AgNO3 = Ag3PO4 + 3HNO3
Качественной реакцией на ион РО43- является образование ярко-жёлтого осадка молибденофосфата аммония:
- H3PO4 + 12(NH4)2MoO4 + 2HNО3 = (NH4)3PMo12O40·6H2O + 21NH4NO3 + 6Н2О
Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
- Н3РО4 + NaOH = NaH2PO4 + H2O (дигидрофосфат натрия)
- H3PO4 + 2NaOH = Na2HPO4 + 2H2O (гидрофосфат натрия)
- H3PO4 + 3NaOH = Na3PO4 + 3H2O (фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:
- NaH2PO4 = NaPO3 + H2O
- 2Na2HPO4 = Na4P2O7 + H2O
Фосфаты при прокаливании не разлагаются, исключение составляет (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Применение ортофосфорной кислоты в сельском хозяйстве. в звероводстве (в частности, при выращивании норок) используют выпойку р-ра ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
См. также
Источники
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия1994
Ссылки
- Фосфорная кислота: Общие сведения о фосфорной кислоте. История открытия и получения фосфорной кислоты. Физические и химические свойства.
- Ортофосфорная кислота: Значение и применение Фосфорной кислоты.
Wikimedia Foundation. 2010.
Фосфор — Википедия
| Фосфор | |
|---|---|
| ← Кремний | Сера → | |
| Белый, красный и фиолетовый фосфор | |
| Название, символ, номер | Фосфор/ Phosphorus (P), 15 |
| Атомная масса (молярная масса) | 30,973762(2)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s2 3p3 |
| Радиус атома | 128 пм |
| Ковалентный радиус | 106 пм |
| Радиус иона | 35 (+5e) 212 (-3e) пм |
| Электроотрицательность | 2,19 [2] (шкала Полинга) |
| Электродный потенциал | 0 |
| Степени окисления | 5, 3, 1, 0, −1, −3[3] |
| Энергия ионизации (первый электрон) | 1011,2(10,48) кДж/моль (эВ) |
| Плотность (при н. у.) | (белый фосфор)1,82 г/см³ |
| Температура плавления | 44,15 °C (317,3 K) |
| Температура кипения | 279,85 °C (553 K) |
| Уд. теплота плавления | 2,51 кДж/моль |
| Уд. теплота испарения | 49,8 кДж/моль |
| Молярная теплоёмкость | 21,6[4] (ромбич.) Дж/(K·моль) |
| Молярный объём | 17,0 см³/моль |
| Структура решётки | кубическая, объёмноцентрированная |
| Параметры решётки | 18,800 Å |
| Теплопроводность | (300 K) (0,236) Вт/(м·К) |
| Номер CAS | 7723-14-0 |
Фо́сфор (от др.-греч. φῶς — свет и φέρω — несу; φωσφόρος — светоносный; лат. Phosphorus) — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Элемент входит в группу пниктогенов. Фосфор — один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л[5]. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3 (F,Cl,OH), фосфорит (Сa3(PO4)2) и другие. Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году. Подобно другим алхимикам, Бранд пытался отыскать философский камень, а получил светящееся вещество. Бранд сфокусировался на опытах с человеческой мочой, так как полагал, что она, обладая золотистым цветом, может содержать золото или нечто нужное для его добычи. Первоначально его способ заключался в том, что сначала моча отстаивалась в течение нескольких дней, пока не исчезнет неприятный запах, а затем кипятилась до клейкого состояния. Нагревая эту пасту до высоких температур и доводя до появления пузырьков, он надеялся, что, сконденсировавшись, они будут содержать золото. После нескольких часов интенсивных кипячений получались крупицы белого воскоподобного вещества, которое очень ярко горело и к тому же мерцало в темноте. Бранд назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»). Открытие фосфора Брандом стало первым открытием нового элемента со времён античности.

Несколько позже фосфор был получен другим немецким химиком — Иоганном Кункелем.
Независимо от Бранда и Кункеля фосфор был получен Р. Бойлем, описавшим его в статье «Способ приготовления фосфора из человеческой мочи», датированной 14 октября 1680 года и опубликованной в 1693 году.
Более усовершенствованный способ получения фосфора был опубликован в 1743 году Андреасом Маргграфом.
Существуют данные, что фосфор умели получать ещё арабские алхимики в XII в.
То, что фосфор — простое вещество, доказал Лавуазье.
Аморфную аллотропную модификацию фосфора — красный фосфор Pn — выделил, нагревая белый фосфор без доступа воздуха, А. Шрёттер в середине XIX в.
В 1669 году Хеннинг Бранд при нагревании смеси белого песка и выпаренной мочи получил светящееся в темноте вещество, названное сначала «холодным огнём». Вторичное название «фосфор» происходит от греческих слов «φώς» — свет и «φέρω» — несу. В древнегреческой мифологии имя Фосфор (или Эосфор, др.-греч. Φωσφόρος) носил страж Утренней звезды.
Фосфор получают из апатитов или фосфоритов в результате взаимодействия с коксом и кремнезёмом при температуре около 1600 °С:
- 2Ca3(PO4)2+10C+6SiO2→P4+10CO+6CaSiO3{\displaystyle {\mathsf {2Ca_{3}(PO_{4})_{2}+10C+6SiO_{2}\rightarrow P_{4}+10CO+6CaSiO_{3}}}} или Ca3(PO4)2 + 3SiO2+5C = 3CaSiO3+5CO+2P.
Образующиеся пары фосфора конденсируются в приёмнике под слоем воды в аллотропическую модификацию в виде белого фосфора. Вместо фосфоритов для получения элементарного фосфора можно восстанавливать углём и другие неорганические соединения фосфора, например, в том числе, метафосфорную кислоту:
- 4HPO3+10C→P4+2h3O+10CO{\displaystyle {\mathsf {4HPO_{3}+10C\rightarrow P_{4}+2H_{2}O+10CO}}}
Элементарный фосфор при нормальных условиях существует в виде нескольких устойчивых аллотропных модификаций. Все существующие аллотропные модификации фосфора пока (2016 г.) до конца не изучены. Традиционно различают три его модификации: белый, красный, чёрный. Иногда их ещё называют главными аллотропными модификациями, подразумевая при этом, что все остальные описываемые модификации являются смесью этих трёх. При стандартных условиях устойчивы только три аллотропических модификации фосфора (например, белый фосфор термодинамически неустойчив (квазистационарное состояние) и переходит со временем при нормальных условиях в красный фосфор). Все модификации различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный.
 Аллотропные модификации фосфора (белый, красный, коричневый, чёрный)
Аллотропные модификации фосфора (белый, красный, коричневый, чёрный) Белый фосфор[править | править код]
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок). По внешнему виду он очень похож на очищенный воск или парафин, легко режется ножом и деформируется от небольших усилий.
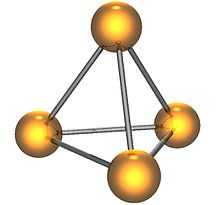 Молекула белого фосфора
Молекула белого фосфора Белый фосфор имеет молекулярную кристаллическую решётку, формула молекулы белого фосфора — P4, причём атомы расположены в вершинах тетраэдра[6]. Отливаемый в инертной атмосфере в виде палочек (слитков), он сохраняется в отсутствии воздуха под слоем очищенной воды или в специальных инертных средах.
Плохо растворяется в воде[6], но легкорастворим в органических растворителях. Растворимостью белого фосфора в сероуглероде пользуются для промышленной очистки его от примесей. Плотность белого фосфора из всех его модификаций наименьшая и составляет около 1823 кг/м³. Плавится белый фосфор при 44,1 °C. В парообразном состоянии происходит диссоциация молекул фосфора.
Химически белый фосфор чрезвычайно активен. Например, он медленно окисляется кислородом воздуха уже при комнатной температуре и светится (бледно-зелёное свечение). Явление такого рода свечения вследствие химических реакций окисления называется хемилюминесценцией (иногда ошибочно фосфоресценцией). При взаимодействии с кислородом белый фосфор горит даже под водой[7].
Белый фосфор не только активен химически, но и весьма ядовит: летальная доза белого фосфора для взрослого человека составляет 0,05—0,15 г[4], а при хроническом отравлении поражает кости, например, вызывает омертвение челюстей[4]. При контакте с кожей легко самовоспламеняется, вызывая серьёзные ожоги[8][9].
Под действием света, при нагревании до не очень высоких температур в безвоздушной среде[6], а также под действием ионизирующего излучения[10] белый фосфор превращается в красный фосфор.
Жёлтый фосфор[править | править код]
Неочищенный белый фосфор обычно называют «жёлтый фосфор». Сильно ядовитое (ПДК в атмосферном воздухе 0,0005 мг/м³), огнеопасное кристаллическое вещество от светло-жёлтого до тёмно-бурого цвета. Плотность 1,83 г/см³, плавится при +43,1 °C, кипит при +280 °C. В воде не растворяется, на воздухе легко окисляется и самовоспламеняется. Горит ослепительным ярко-зёленым пламенем с выделением густого белого дыма — мелких частичек декаоксида тетрафосфора P4O10[11].
Так как фосфор реагирует с водой лишь при температуре свыше 500 °C, то для тушения фосфора используют воду в больших количествах (для снижения температуры очага возгорания и перевода фосфора в твёрдое состояние) или раствор сульфата меди (медного купороса), после гашения фосфор засыпают влажным песком. Для предохранения от самовозгорания жёлтый фосфор хранится и перевозится под слоем воды (раствора хлорида кальция)[12].
Красный фосфор[править | править код]
Красный фосфорКрасный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен в 1847 году в Швеции австрийским химиком А. Шрёттером при нагревании белого фосфора при 500 °С в атмосфере угарного газа (СО) в запаянной стеклянной ампуле.
Красный фосфор имеет формулу Рn и представляет собой полимер со сложной структурой. В зависимости от способа получения и степени дробления, красный фосфор имеет оттенки от пурпурно-красного до фиолетового, а в литом состоянии — тёмно-фиолетовый с медным оттенком, имеет металлический блеск. Химическая активность красного фосфора значительно ниже, чем у белого; ему присуща исключительно малая растворимость. Растворить красный фосфор возможно лишь в некоторых расплавленных металлах (свинец и висмут), чем иногда пользуются для получения крупных его кристаллов. Так, например, немецкий физико-химик И. В. Гитторф в 1865 году впервые получил прекрасно построенные, но небольшие по размеру кристаллы (фосфор Гитторфа). Красный фосфор на воздухе не самовоспламеняется, вплоть до температуры 240—250 °С (при переходе в белую форму во время возгонки), но самовоспламеняется при трении или ударе, у него полностью отсутствует явление хемилюминесценции. Нерастворим в воде, а также в бензоле, сероуглероде и других веществах, растворим в трибромиде фосфора. При температуре возгонки красный фосфор превращается в пар, при охлаждении которого образуется в основном белый фосфор.
Ядовитость его в тысячи раз меньше, чем у белого, поэтому он применяется гораздо шире, например, в производстве спичек (составом на основе красного фосфора покрыта тёрочная поверхность коробков). Плотность красного фосфора также выше, и достигает 2400 кг/м³ в литом виде. При хранении на воздухе красный фосфор в присутствии влаги постепенно окисляется, образуя гигроскопичный оксид, поглощает воду и отсыревает («отмокает»), образуя вязкую фосфорную кислоту; поэтому его хранят в герметичной таре. При «отмокании» — промывают водой от остатков фосфорных кислот, высушивают и используют по назначению.
Чёрный фосфор[править | править код]
Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Впервые чёрный фосфор был получен в 1914 году американским физиком П. У. Бриджменом из белого фосфора в виде чёрных блестящих кристаллов, имеющих высокую (2690 кг/м³) плотность. Для проведения синтеза чёрного фосфора Бриджмен применил давление в 2⋅109 Па (20 тысяч атмосфер) и температуру около 200 °С. Начало быстрого перехода лежит в области 13 000 атмосфер и температуре около 230 °С.
Чёрный фосфор представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и с полностью отсутствующей растворимостью в воде или органических растворителях. Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400 °С. Чёрный фосфор проводит электрический ток и имеет свойства полупроводника. Температура плавления чёрного фосфора 1000 °С под давлением 1,8⋅106 Па.
Химическая активность фосфора значительно выше, чем у азота. Химические свойства фосфора во многом определяются его аллотропной модификацией. Белый фосфор очень активен, в процессе перехода к красному и чёрному фосфору химическая активность снижается. Белый фосфор в воздухе при окислении кислородом воздуха при комнатной температуре излучает видимый свет, свечение обусловлено фотоэмиссионной реакцией окисления фосфора.
В жидком и растворенном состоянии, а также в парах до 800 °С фосфор состоит из молекул Р4. При нагревании выше 800 °С молекулы диссоциируют: Р4 = 2Р2. При температуре выше 2000 °С молекулы распадаются на атомы.
Взаимодействие с простыми веществами[править | править код]
Фосфор легко окисляется кислородом:
- 4P+5O2→2P2O5{\displaystyle {\mathsf {4P+5O_{2}\rightarrow 2P_{2}O_{5}}}} (с избытком кислорода)
- 4P+3O2→2P2O3{\displaystyle {\mathsf {4P+3O_{2}\rightarrow 2P_{2}O_{3}}}} (при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:
- 2P+3Ca→Ca3P2{\displaystyle {\mathsf {2P+3Ca\rightarrow Ca_{3}P_{2}}}}
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:
- 2P+3S→P2S3{\displaystyle {\mathsf {2P+3S\rightarrow P_{2}S_{3}}}}
- 2P+5Cl2→2PCl5{\displaystyle {\mathsf {2P+5Cl_{2}\rightarrow 2PCl_{5}}}}
С водородом фосфор практически не соединяется. Однако разложением некоторых фосфидов водой по реакции, например:
- Ca3P2+6h3O→2Ph4+3Ca(OH)2{\displaystyle {\mathsf {Ca_{3}P_{2}+6H_{2}O\rightarrow 2PH_{3}+3Ca(OH)_{2}}}}
может быть получен аналогичный аммиаку фосфористый водород (фосфин) — РH3
Взаимодействие с водой[править | править код]
Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
- 8P+12h3O→>500oC 5Ph4+3h4PO4{\displaystyle {\mathsf {8P+12H_{2}O{\xrightarrow {>500^{o}C}}\ 5PH_{3}+3H_{3}PO_{4}}}}
Реакция взаимодействия красного фосфора и воды с образованием ортофосфорной кислоты и водорода. Реакция протекает при температуре 700—900 °C. Катализатором могут выступать: платина, медь, титан, цирконий.[1]
- 2P+8h3O→700−900oC,kat 2h4PO4+5h3{\displaystyle {\mathsf {2P+8H_{2}O{\xrightarrow {700-900^{o}C,kat}}\ 2H_{3}PO_{4}+5H_{2}}}}
Взаимодействие со щелочами[править | править код]
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования[13]:
- 4P+3KOH+3h3O→ τ Ph4+3Kh3PO2{\displaystyle {\mathsf {4P+3KOH+3H_{2}O{\xrightarrow {\ \tau \ }}PH_{3}+3KH_{2}PO_{2}}}}
Восстановительные свойства[править | править код]
Сильные окислители превращают фосфор в фосфорную кислоту:
- 3P+5HNO3+2h3O→3h4PO4+5NO{\displaystyle {\mathsf {3P+5HNO_{3}+2H_{2}O\rightarrow 3H_{3}PO_{4}+5NO}}}
- 2P+5h3SO4→2h4PO4+5SO2+2h3O{\displaystyle {\mathsf {2P+5H_{2}SO_{4}\rightarrow 2H_{3}PO_{4}+5SO_{2}+2H_{2}O}}}
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:
- 6P+5KClO3→5KCl+3P2O5{\displaystyle {\mathsf {6P+5KClO_{3}\rightarrow 5KCl+3P_{2}O_{5}}}}
Известно более 20 изотопов фосфора (с массовым числом от 24 до 47). Природный изотоп 31P стабилен. Из радиоактивных изотопов наиболее долгоживущие: 30P (T1/2 = 2,5 мин), 32P (T1/2 = 14,26 сут) и 33P (T1/2 = 25,34 сут).[14].
Фосфор является важнейшим биогенным элементом и в то же время находит очень широкое применение в промышленности. Красный фосфор применяют в производстве спичек. Его вместе с тонко измельчённым стеклом и клеем наносят на боковую поверхность коробки. При трении спичечной головки, в состав которой входят хлорат калия и сера, происходит воспламенение.
Элементарный фосфор[править | править код]
Пожалуй, первое свойство фосфора, которое человек поставил себе на службу, — это горючесть. Горючесть фосфора очень велика и зависит от аллотропической модификации.
Наиболее активен химически, токсичен и горюч белый («жёлтый») фосфор, потому он очень часто применяется (в зажигательных бомбах и пр.).
Красный фосфор — основная модификация, производимая и потребляемая промышленностью. Он применяется в производстве спичек, взрывчатых веществ, зажигательных составов, различных типов топлива, а также противозадирных смазочных материалов, в качестве газопоглотителя в производстве ламп накаливания.
Соединения фосфора в сельском хозяйстве[править | править код]
Фосфор (в виде фосфатов) — один из трёх важнейших биогенных элементов, участвует в синтезе АТФ. Большая часть производимой фосфорной кислоты идёт на получение фосфорных удобрений — суперфосфата, преципитата, аммофоски и др.
Соединения фосфора в промышленности[править | править код]
Фосфаты широко используются:
Фосфатные связующие[править | править код]
Способность фосфатов формировать прочную трёхмерную полимерную сетку используется для изготовления фосфатных и алюмофосфатных связок.
Биологическая роль соединений фосфора[править |
Суперфосфат — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 октября 2016; проверки требуют 11 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 октября 2016; проверки требуют 11 правок.Суперфосфат — наиболее распространённое простое минеральное фосфорное удобрение. Фосфор в суперфосфате присутствует в основном в виде монокальцийфосфата и свободной фосфорной кислоты. Удобрение содержит гипс и другие примеси (фосфаты железа и алюминия, кремнезём, соединения фтора и др.).
- Простой суперфосфат, смесь Ca(H2PO4)2*H2O и CaSO4
- Серый порошок, почти не слёживаемый, среднерассеиваемый; в удобрении 23—29,5 % усваиваемого растениями P2O5. Гранулированный суперфосфат получают из простого (порошковидного), увлажняя его и окатывая в гранулы (диаметр их в основном 2—4 мм)во вращающихся барабанах. Имеет повышенную рассеиваемость.
- Двойной суперфосфат, Ca(H2PO4)2·H2O
- Содержит 45—48 % усвояемой растениями P2O5, очень мало гипса, выпускается преимущественно гранулированным. В состав аммонизированного суперфосфата, кроме 14—19,5 % P2O5 входит не менее 1,6 % аммиака; марганизированного суперфосфата — 1,5—2,5 % марганца; борного суперфосфата — 0,1—0,3 % бора; молибденового суперфосфата — 0,1 % молибдена.
Получение суперфосфата[править | править код]
Получают простой суперфосфат из фосфоритов, обрабатывая их серной кислотой, по реакции:
- Ca3(PO4)2+2 h3SO4+4 h3O→Ca(h3PO4)2+2 [CaSO4⋅2 h3O]{\displaystyle \mathrm {Ca_{3}(PO_{4})_{2}+2\ H_{2}SO_{4}+4\ H_{2}O\rightarrow Ca(H_{2}PO_{4})_{2}+2\ \lbrack CaSO_{4}\cdot 2\ H_{2}O\rbrack } }
Объем промышленного производства в России и странах бывшего СССР в настоящее время постоянно снижается, уступая производству комплексных удобрений.
Получение двойного суперфосфата[править | править код]
Для получения двойного суперфосфата фосфорит обрабатывают фосфорной кислотой, полученной из апатита или фосфорита и серной кислоты. Отличается от простого суперфосфата небольшим содержанием гипса, поэтому является более концентрированным удобрением.
- Ca3(PO4)2+4 h4PO4→3 Ca(h3PO4)2{\displaystyle \mathrm {Ca_{3}(PO_{4})_{2}+4\ H_{3}PO_{4}\rightarrow 3\ Ca(H_{2}PO_{4})_{2}} }
Суперфосфат применяют на всех почвах в качестве основного предпосевного, припосевного (лучше гранулированный суперфосфат) удобрения и в подкормки. Особенно эффективен на щелочных и нейтральных почвах. В кислой почве фосфорная кислота удобрения превращается в труднодоступные растениям фосфаты алюминия и железа. В этом случае действие суперфосфата повышается при смешивании его перед внесением с фосфоритной мукой, известняком, мелом, перегноем при применении на известкованных полях (см. Известкование почв).
До середины XIX века в сельском хозяйстве в качестве фосфорсодержащих удобрений применялись костная мука, экскременты животных и человека (в основном в виде гуано). Но запасы гуано быстро кончались, а растворимость костной муки была недостаточна для эффективного поступления фосфора в растения.[1]
В 1840 году немецкий ученый Юстус фон Либих продемонстрировал, что эффективность костной муки как удобрения значительно увеличивалась после обработки серной кислотой.[1] В 1842 году в Англии этот процесс был запатентован, а продукт получил название «суперфосфат». В 1943 году начала работу первая фабрика по переработке костной муки в Англии. В США коммерческое производство суперфосфата началось в 1852 году.
Пик потребления простого суперфосфата был достигнут в 1940-х годах, после чего его начали сильно теснить на рынке двойной суперфосфат и аммонийфосфаты.[1]
- Прянишников Д. Н. Избр. соч.. — М., 1965. — Т. 1.
- Справочник по удобрениям. — 3-е изд.. — М., 1964.
- Суперфосфат / пер. с англ. под ред. А. А. Соколовского. — М., 1969.
Щелочная фосфатаза — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 ноября 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 7 ноября 2019; проверки требует 1 правка.Щелочна́я фосфата́за (англ. Alkaline phosphatase, ALP, ALKP) — фермент гидролаза (КФ 3.1.3.1), отщепляющая фосфат (дефосфорилирующая) от многих типов молекул, например, нуклеотидов, белков и алкалоидов. Фермент проявляет наибольшую активность в щелочной среде[2].
У бактерий щелочная фосфатаза располагается в периплазматическом пространстве, снаружи от цитоплазматической мембраны. Щелочная фосфатаза бактерий относительно устойчива к инактивации, денатурации и деградации. Возможно, одной из функций фосфатазы является отщепление фосфатов от органических молекул, так как многие фосфорилированные соединения не могут проникать через плазматическую мембрану.
Фермент, выделенный из бактерий Escherichia coli, имеет оптимум рН 8.0[3], в то время как фермент, выделенный из пульпы зуба быка, имеет оптимум рН около 8.5[4].
Щелочная фосфатаза применяется в молекулярно-биологических исследованиях для того, чтобы отщепить фосфатные группы на 5'-конце и предотвратить лигирование этих концов. Удаление концевых фосфатов также делает возможным введение концевой радиоактивной метки. Наиболее широко используют щелочную фосфатазу из креветок, которая также наиболее легко инактивируется после отщепления фосфата.
Щелочная фосфатаза также широко используется в иммуноферментном анализе.
Все изоферменты щелочной фосфатазы млекопитающих, за исключением плацетарных (PALP и SEAP), ингибируются гомоаргинином.
Нагревание в течение 2 часов при 65 °C инактивирует большинство изоферментов, кроме плацентарных изоформ (PALP и SEAP).
Физиология[править | править код]
У человека щелочная фосфатаза представлена во всех тканях, особенно высокая концентрация в печени, желчном протоке, почках, костях и плаценте.
В организме человека и других млекопитающих встречаются следующие изоферменты:
- ALPI — кишечная
- ALPL — неспецифичная в тканях печени, костей и почках
- ALPP — плацентарная
Диагностика[править | править код]
Нормальный уровень щелочной фосфатазы от 20 до 140 МЕ/л[5]. Уровень щелочной фосфатазы повышается при закупорке желчного протока[6]. Концентрации у детей и беременных женщин значительно выше. Пониженный уровень щелочной фосфатазы встречается гораздо реже, чем повышенный. Сниженный уровень щелочной фосфатазы — основной показатель гипофосфатазии (редкого заболевания костной ткани), которое характеризуется нарушением формирования скелета, задержкой физического развития, переломами и т. д.
Оральные контрацептивы снижают уровень щелочной фосфатазы[7].
- ↑ PDB 1ALK: Kim E. E., Wyckoff H. W. Reaction mechanism of alkaline phosphatase based on crystal structures. Two-metal ion catalysis (англ.) // J. Mol. Biol. (англ.)русск. : journal. — 1991. — March (vol. 218, no. 2). — P. 449—464. — doi:10.1016/0022-2836(91)90724-K. — PMID 2010919.
- ↑ Tamás L., Huttová J., Mistrk I., Kogan G. Effect of carboxymethyl chitin-glucan on the activity of some hydrolytic enzymes in maize plants (англ.) // Chem. Pap. : journal. — 2002. — Vol. 56, no. 5. — P. 326—329. Архивировано 25 июля 2011 года.
- ↑ Garen A., Levinthal C. A fine-structure genetic and chemical study of the enzyme alkaline phosphatase of E. coli. I. Purification and characterization of alkaline phosphatase (англ.) // Biochim. Biophys. Acta (англ.)русск. : journal. — 1960. — March (vol. 38). — P. 470—483. — doi:10.1016/0006-3002(60)91282-8. — PMID 13826559.
- ↑ Harada M., Udagawa N., Fukasawa K., Hiraoka B. Y., Mogi M. Inorganic pyrophosphatase activity of purified bovine pulp alkaline phosphatase at physiological pH (англ.) // J. Dent. Res. (англ.)русск. : journal. — 1986. — February (vol. 65, no. 2). — P. 125—127. — PMID 3003174.
- ↑ MedlinePlus Medical Encyclopedia: ALP isoenzyme test (неопр.) (недоступная ссылка). Архивировано 16 июня 2010 года.
- ↑ ALP: The Test
- ↑ Schiele F., Vincent-Viry M., Fournier B., Starck M., Siest G. Biological effects of eleven combined oral contraceptives on serum triglycerides, gamma-glutamyltransferase, alkaline phosphatase, bilirubin and other biochemical variables (англ.) // Clin. Chem. Lab. Med. (англ.)русск. : journal. — 1998. — November (vol. 36, no. 11). — P. 871—878. — doi:10.1515/CCLM.1998.153. — PMID 9877094.
Фосфатаза — Википедия
Для улучшения этой статьи желательно:
|
Фосфатаза — фермент, который катализирует дефосфорилирование субстрата (как правило другого белка) в результате гидролиза сложноэфирной связи фосфорной кислоты. При этом образуется фосфатный анион и молекула продукта с гидроксильной группой. По своему каталитическому и физиологическому действию фосфатаза является антагонистом фосфорилазы и киназы, которые присоединяют фосфатную группу к субстрату.
Хотя белки являются наиболее распространённым субстратом фосфатаз, некоторые фосфатазы дефосфорилируют фосфорилированные липиды, сахара и нуклеотиды. Например, фосфатаза PTEN специфически дефосфорилирует сигнальный липид фосфатидилинозитол-3,4,5-трифосфат.
В зависимости от природы активной группы фермента фосфатазы делятся на два типа: цистеинзависимые фосфатазы и металлофосфатазы. Типичным представителем группы фосфатаз является щелочная фосфатаза, широко используемая в диагностических и лабораторных целях.
- Протеинфосфатазы
| Гидролазы (КФ3): эстеразы (КФ 3.1) | |
|---|---|
| |
| Это заготовка статьи по молекулярной биологии. Вы можете помочь проекту, дополнив её. |
| Это заготовка статьи по биохимии. Вы можете помочь проекту, дополнив её. |
Трифосфат натрия — Википедия
Материал из Википедии — свободной энциклопедии
| Трифосфат натрия | |
|---|---|
| ( {{{картинка}}}) | |
| Хим. формула | Na5Р3О10 |
| Состояние | твёрдое |
| Молярная масса | 367.864 г/моль |
| Плотность | 2.52 г/см³ |
| Температура | |
| • плавления | 622 °C |
| Растворимость | |
| • в воде | 14.5 г/100 мл |
| Рег. номер CAS | 7758-29-4 |
| PubChem | 24455 |
| Рег. номер EINECS | 231-838-7 |
| SMILES | |
| InChI | 1S/5Na.H5O10P3/c;;;;;1-11(2,3)9-13(7,8)10-12(4,5)6/h;;;;;(H,7,8)(h3,1,2,3)(h3,4,5,6)/q5*+1;/p-5 |
| Кодекс Алиментариус | E451 |
| RTECS | YK4570000 |
| ChemSpider | 22863 |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Трифосфат натрия — это соль триполифосфорной кислоты Na5Р3О10. Является пищевым стабилизатором, более известным как Е451.
Фосфаты ослабляют электростатическое взаимодействие внутри актомиозинового комплекса. Только фосфаты могут расщеплять актин и миозин, и это является главной причиной распространения фосфатов.
Практически все пищевые фосфаты и их смеси, которые используются мясоперерабатывающей и рыбной промышленности, имеют щелочную реакцию. Добавка щелочных фосфатов в мясо и рыбу приводит к росту pH, и как следствие, к увеличению влагосвязывающего свойства белков.
Пирофосфаты (E450) и триполифосфат (E451) лучше всего способствуют эмульгированию жира, что объясняет включение этого вещества в состав многих стиральных порошков и средств для посудомоечных машин.
Потребление выше разрешённых норм фосфатов может негативно сказаться на здоровье человека, из-за чего происходит ухудшение усвоения кальция, что приводит к отложению в почках кальция и фосфора, и способствует развитию остеопороза.
Трифосфат натрия синтезируется путём конденсации из ортофосфорной кислоты:
- 6h4PO4+5Na2CO3⟶{\displaystyle {\mathsf {6H_{3}PO_{4}+5Na_{2}CO_{3}\longrightarrow }}} 2Na5P3O10+5CO2+9h3O{\displaystyle {\mathsf {2Na_{5}P_{3}O_{10}+5CO_{2}+9H_{2}O}}}
В лабораторных условиях он синтезируется из фосфата натрия и дифосфата натрия:
- NaPO3+Na4P2O7⟶Na5P3O10{\displaystyle {\mathsf {NaPO_{3}+Na_{4}P_{2}O_{7}\longrightarrow Na_{5}P_{3}O_{10}}}}
Также возможен синтез из триметафосфата натрия:[1]
- Na3P3O9+2NaOH⟶Na5P3O10+h3O{\displaystyle {\mathsf {Na_{3}P_{3}O_{9}+2NaOH\longrightarrow Na_{5}P_{3}O_{10}+H_{2}O}}}
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 547-8.
- Химический энциклопедический словарь / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1983. — 792 с.
Дигидрофосфат натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 декабря 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 декабря 2019; проверки требует 1 правка.| Дигидрофосфат натрия | |
|---|---|
| ( {{{картинка}}}) | |
({{{изображение}}}) | |
| Систематическое наименование | Дигидрофосфат натрия |
| Традиционные названия | Дигидроортофосфат натрия, фосфорнокислый натрий, однозамещённый |
| Хим. формула | NaH2PO4 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 119,98 г/моль |
| Плотность | гидр. 1,9096 г/см³ |
| Температура | |
| • плавления | гидр. 60 °C |
| Растворимость | |
| • в воде | 85,220; 207,380 г/100 мл |
| Рег. номер CAS | 7558-80-7 |
| PubChem | 24204 |
| Рег. номер EINECS | 231-449-2 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E339(i) |
| ChEBI | 37585 |
| ChemSpider | 22626 |
| Токсичность | Нетоксичен |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дигидрофосфа́т на́трия — неорганическое соединение, кислая соль щелочного металла натрия и ортофосфорной кислоты с формулой NaH2PO4, бесцветные кристаллы, хорошо растворимые в воде, образует кристаллогидраты.
- h4PO4+NaOH → Nah3PO4+h3O{\displaystyle {\mathsf {H_{3}PO_{4}+NaOH\ {\xrightarrow {}}\ NaH_{2}PO_{4}+H_{2}O}}}
- Na2HPO4+h4PO4 → 2Nah3PO4{\displaystyle {\mathsf {Na_{2}HPO_{4}+H_{3}PO_{4}\ {\xrightarrow {}}\ 2NaH_{2}PO_{4}}}}
- P4+10h3O2+4NaOH → 4Nah3PO4+8h3O{\displaystyle {\mathsf {P_{4}+10H_{2}O_{2}+4NaOH\ {\xrightarrow {}}\ 4NaH_{2}PO_{4}+8H_{2}O}}}
Дигидрофосфат натрия образует бесцветные кристаллы. Хорошо растворимы в воде, плохо в этаноле.
Образует несколько кристаллогидратов NaH2PO4·n H2O, где n = 1, 2, которые плавятся в кристаллизационной воде при 100, 60 °C соответственно.
Расплавы кристаллогидратов, равно как концентрированные растворы дигидрофосфата натрия представляют собой вязкие мутные опалесцирующие жидкости, легко кристаллизующиеся при понижении температуры в полупрозрачную стекловидную массу.
- Кристаллогидрат теряет воду при нагревании в вакууме:
- Nah3PO4⋅2h3O →100oC Nah3PO4+2h3O{\displaystyle {\mathsf {NaH_{2}PO_{4}\cdot 2H_{2}O\ {\xrightarrow {100^{o}C}}\ NaH_{2}PO_{4}+2H_{2}O}}}
- 2Nah3PO4 →160oC Na2h3P2O7+h3O{\displaystyle {\mathsf {2NaH_{2}PO_{4}\ {\xrightarrow {160^{o}C}}\ Na_{2}H_{2}P_{2}O_{7}+H_{2}O}}}
- Nah3PO4 →220−250oC NaPO3+h3O{\displaystyle {\mathsf {NaH_{2}PO_{4}\ {\xrightarrow {220-250^{o}C}}\ NaPO_{3}+H_{2}O}}}
- Реагирует с щелочами:
- Nah3PO4+NaOH → Na2HPO4+h3O{\displaystyle {\mathsf {NaH_{2}PO_{4}+NaOH\ {\xrightarrow {}}\ Na_{2}HPO_{4}+H_{2}O}}}
- Nah3PO4+2NaOH → Na3PO4+2h3O{\displaystyle {\mathsf {NaH_{2}PO_{4}+2NaOH\ {\xrightarrow {}}\ Na_{3}PO_{4}+2H_{2}O}}}
- Вступает в обменные реакции:
- 3Nah3PO4+3AgNO3 → Ag3PO4↓+3NaNO3+2h4PO4{\displaystyle {\mathsf {3NaH_{2}PO_{4}+3AgNO_{3}\ {\xrightarrow {}}\ Ag_{3}PO_{4}\downarrow +3NaNO_{3}+2H_{3}PO_{4}}}}
Nah3PO4+2Na2HPO4⟶Na5P3O10+2h3O{\displaystyle {\ce {Nah3PO4 + 2Na2HPO4 -> Na5P3O10 + 2h3O}}}
Дигидрофосфат натрия является массовым продуктом химической промышленности. Типичная цена составляет порядка 800$/т.
- В фармакологии при изготовлении лекарственных препаратов используются слабительные, буферные и водоудерживающие свойства вещества.
- В пищевой промышленности дигидрофосфат натрия используется в качестве многоцелевой пищевой добавки (код E339) и он выступает в качестве буфера и как стабилизатор окраски продуктов.
- Дигидрофосфат натрия входит в состав стиральных порошков и иных моющих средств, где выступает как умягчитель воды и буфер.
- ГОСТ 31725-2012. Добавки пищевые. Натрия фосфаты Е339. Общие технические условия
фосфаты - это... Что такое фосфаты?
ФОСФАТЫ — (фр. phosphates, от phosphore фосфор). Соль, происходящая от соединения фосфорной кислоты с различными основаниями. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ФОСФАТЫ соли, получающиеся от соединения фосфорной … Словарь иностранных слов русского языка
ФОСФАТЫ — ФОСФАТЫ, соли ортофосфорной кислоты h4PO4 (ортофосфаты) и полифосфорных кислот (полифосфаты). Ортофосфаты встречаются в природе в виде минеральных образований (известно около 190), важнейшие из них апатит и фосфорит. Природные фосфаты сырье для… … Современная энциклопедия
Фосфаты — ФОСФАТЫ, соли ортофосфорной кислоты h4PO4 (ортофосфаты) и полифосфорных кислот (полифосфаты). Ортофосфаты встречаются в природе в виде минеральных образований (известно около 190), важнейшие из них апатит и фосфорит. Природные фосфаты сырье для… … Иллюстрированный энциклопедический словарь
ФОСФАТЫ — соли и эфиры фосфорных кислот. Различают: ортофосфаты (соли и эфиры ортофосфорной кислоты Н3РО4) и полимерные фосфаты (полифосфаты, метафосфаты, ультрафосфаты). Соли входят в состав фосфорных удобрений, минеральных подкормок, моющих средств и др … Большой Энциклопедический словарь
«Фосфаты» — производств. объединение по добыче фосфоритов и произ ву минеральных удобрений и кормовых добавок в Mоск. обл. Cоздано в 1962 на базе Лопатинского и Eгорьевского рудников. Cырьевой базой является Eгорьевское м ние, эксплуатирующееся c… … Геологическая энциклопедия
фосфаты — ФОСФАТЫ, ов, ед. фосфат, а, муж. (спец.). Соли или эфиры фосфорных кислот. | прил. фосфатный, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ФОСФАТЫ — м лы, соли ортофосфорной кислоты Н3РО4, довольно многочисленные и весьма разнообразные по составу. Среди Ф. различают: безводные кислые монетит СаН[РО4] и др.; безводные нормальные витлокит Са3[РО4]2, монацит (Ce,La,Di)[PO4] и др.; кислые водные… … Геологическая энциклопедия
ФОСФАТЫ — соли (см.), главное применение в качестве ингредиентов фосфорных удобрений и моющих средств, для умягчения воды и др … Большая политехническая энциклопедия
Фосфаты — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
Фосфаты — соли и эфиры фосфорных кислот. Из солей различают ортофосфаты и полимерные (или конденсированные) Ф. Последние делят на полифосфаты, имеющие линейное строение фосфат анионов, метафосфаты с кольцеобразным (циклическим) фосфат анионом и… … Большая советская энциклопедия
Фосфаты — [phosphates] соли и эфиры фосфорных кислот. Из солей различают ортофосфаты и полимерные (или конденсированные) фосфаты. К фосфатам относят также весьма стойкие соединения ВРО4 и АlРО4. Все встречающиеся в природе соединения фосфора ортофосфаты.… … Энциклопедический словарь по металлургии