Трихлорэтилен что это такое
Трихлорэтилен — Википедия
| Трихлорэтилен | |||
|---|---|---|---|
{{{картинка малая}}}) | |||
| Хим. формула | C2HCl3 | ||
| Рац. формула | CCl2=CHCl | ||
| Состояние | бесцветная, подвижная жидкость | ||
| Примеси | стабилизаторы тимол (0.01%) или фенол (0.001%) | ||
| Молярная масса | 131,39 г/моль | ||
| Плотность | 1,4642 г/см³ | ||
| Поверхностное натяжение | 0,02928 Н/м | ||
| Динамическая вязкость | 0,00058 Па·с | ||
| Энергия ионизации | 9,45 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | -73 °C | ||
| • кипения | 86,7 °C | ||
| Пределы взрываемости | 8 ± 1 об.%[1] | ||
| Критическая точка | |||
| • температура | 271°C °C | ||
| • давление | 5,02МПа | ||
| Энтальпия | |||
| • образования | -7,53 кДж/моль | ||
| Давление пара | 58 ± 1 мм рт.ст.[1] | ||
| Растворимость | |||
| • в воде | 0,027 г/100 мл | ||
| Рег. номер CAS | 79-01-6 | ||
| PubChem | 6575 | ||
| Рег. номер EINECS | 201-167-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | KX4550000 | ||
| ChEBI | 16602 | ||
| ChemSpider | 13837280 | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Трихлорэтилен (Trichoraetylenum) — хлорорганическое соединение, бесцветная, прозрачная, подвижная, летучая жидкость со своеобразным запахом, напоминающим запах хлороформа, и сладким, жгучим вкусом. Плотность 1,462—1,466. Полностью перегоняется при температуре + 86—88 °C. Практически нерастворим в воде; смешивается с органическими растворителями, не воспламеняется и не взрывается. Под действием света и воздуха разлагается с образованием фосгена и галогенсодержащих кислот и приобретает розовое окрашивание. Для стабилизации трихлорэтилена к нему добавляют 0,01 % тимола или 0.001% фенола.
Кроме применения в медицине в качестве наркозного средства, трихлороэтилен также используется в индустрии и в печатном деле как промышленный растворитель.
Трихлорэтилен нельзя хранить на свету так как в присутствии кислорода воздуха он разлагается с образованием токсичного (и воспламеняющегося) продукта - дихлорацетилена, который, в свою очередь, разлагается на фосген, угарный газ и хлороводород. Реакцию катализируют пары йода, минеральные кислоты и натронная известь (применяется в закрытых и полузакрытых системах анестезии).
В присутствии катализаторов и при высоких температурах может образовывать другие хлорорганические соединения, чаще -предельного строения.
В присутствии хлорида алюминия трихлорэтилен взаимодействует с хлороводородом, при этом происходит конденсация, полимеризация и осмоление.
Трихлорэтилен хорошо растворяет парафины и воска. Нерастворим в большинстве спиртов и кетонов.
Трихлорэтилен получают путём каталитического высокотемпературного хлорирования сырья, содержащего смеси различных хлорорганических соединений, в том числе хлорэтанов и хлорэтиленов с последующим дистилляционным разделением продуктов.
Так при синтезе трихлорэтилена из отходов производства винилхлорида, дихлорэтана процесс проводят на кипящем слое силикагелевого катализатора при температуре от 400°С до 450°С; при окислительном хлорировании хлорэтанов или хлороэтиленов в качестве катализатора используются хлориды меди или калия на силикагелевом носителе, а температура процесса снижается до 350° - 400°С.
Трихлорэтилен является мощным наркотическим средством. Наркотический эффект наступает быстро и заканчивается через 2-3 минуты после прекращения подачи трихлорэтилена. От других наркотических веществ отличается тем, что уже в небольших концентрациях в первой стадии наркоза вызывает сильную анальгезию [источник не указан 2483 дня].
Применяют трихлорэтилен для наркоза по полуоткрытой системе при помощи специальных наркозных аппаратов с калиброванным испарителем без абсорбера.
Для наркоза и длительной анальгезии трихлорэтилен применяют в концентрации 0,6—1,2 об. %.
Наиболее показано применение трихлорэтилена для кратковременного наркоза, для анальгезии при небольших хирургических операциях и болезненных манипуляциях, для обезболивания родов. Для этих целей используют трихлорэтилен в концентрации 0,3—0,6 об. % (обычно 0,5 об. %) в смеси с кислородом или воздухом либо со смесью, содержащей 50 % закиси азота и 50 % кислорода. Вдыхание может производиться при помощи специальных аппаратов для аутоанальгезии, причём маску больные (или роженицы) сами удерживают на лице: при появлении боли начинают вдыхать указанную смесь.
Трихлорэтилен может также применяться для снятия болевого синдрома при невралгии тройничного нерва, почечных коликах и заболеваниях, сопровождающихся сильными болями. В стоматологической практике препарат применяют для обезболивания при экстракции зубов, операциях на челюсти и других.
При правильном дозировании трихлорэтилен хорошо переносим, не вызывает раздражения дыхательных путей, усиления саливации и увеличения секреции бронхиальных желез. Не наблюдается существенных изменений кровообращения (могут отмечаться небольшое повышение АД и учащение пульса), не оказывает отрицательного влияния на сократительную деятельность матки у рожениц, на состояние плода и новорождённого. В отдельных случаях при вдыхании паров трихлорэтилена возможны тошнота и рвота.
При передозировке (свыше 1,5 об. %) может наступить резкое угнетение дыхания с нарушениями сердечного ритма. В концентрации свыше 0,8 об. % трихлорэтилен угнетает сократительную деятельность матки.
В связи с тем, что трихлорэтилен является сильным наркотическим средством, при его применении для обезболивания родов необходимо после обезболивания 3—4 схваток делать перерыв на 7—10 минут. Общая длительность применения препарата не должна превышать 4 часов.
При наркозе трихлорэтиленом нельзя применять адреналин в связи с возможным нарушением ритма сердца (вплоть до фибрилляции желудочков).
Трихлорэтилен - токсичное вещество[2]; употребление алкогольных напитков усиливает его действие[3]. По данным[4]ПДК в воздухе рабочей зоны равна 30 мг/м3 (среднесменная за 8 часов) и 10 мг/м3 (максимально-разовая). А порог восприятия запаха может быть 538 мг/м3[5] и 440-580 мг/м3[6]. Можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с "заменой фильтров по появлении запаха под маской" (как это почти всегда рекомендуется в РФ поставщиками СИЗОД) приведёт к чрезмерному воздействию трихлорэтилена на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Для защиты от трихлорэтилена следует использовать значительно более эффективные изменение технологии и средства коллективной защиты.
Препарат противопоказан при заболеваниях печени и почек, нарушениях сердечного ритма, заболеваниях лёгких, анемии. В акушерской практике противопоказан также при преждевременных родах и тяжёлых токсикозах второй половины беременности.
Список Б, в сухом, прохладном, защищённом от света месте. Через каждые 6 месяцев препарат подвергают аналитической проверке.
Трилен, хлорилен, наркоген, третилен, трихлорэтилен, трихлоран, трихлорен, тримар.
Трегер Ю.А. Трихлорэтилен // Химическая энциклопедия: в 5 т. / Н. С. Зефиров (гл. ред.). — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан—Ятрохимия. — С. 10—11. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ↑ 1 2 3 http://www.cdc.gov/niosh/npg/npgd0629.html
- ↑ Бунятян А.А. Трихлорэтилен // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1985. — Т. 25. Теннис - Углекислота. — 544 с. — 150 000 экз.
- ↑ МКХБ Международная организация труда. МКХБ № 0081. Трихлорэтилен (рус.). www.ilo.org/dyn/icsc/ (2018). Дата обращения 12 ноября 2019.
- ↑ (Роспотребнадзор). № 2121. Трихлорэтен (трихлорэтилен) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» (рус.) / утверждены А.Ю. Поповой. — Москва, 2018. — С. 144. — 170 с. — (Санитарные правила).
- ↑ Torkelson T.R. and Rowe V.K. Halogenated Aliphatic Hydrocarbons Containing Chlorine, Bromine and Iodine // Patty’s Industrial Hygiene and Toxicology (англ.) / Clayton G.D. and F.E. Clayton (eds.). — 3ed ed., rev.. — New York: John Wiley & Sons, 1981. — Vol. 2B, Toxicology. — P. 3433–3601. — ISBN 978-0471079439.
- ↑ Johannes May. Odor Thresholds of Solvents for Assessment of Solvent Odors in the Air [Geruchsschwellen von Losemitteln zur Bewertung von Losemittelgeruchen in der Luft] (нем.) // Staub, Reinhaltung der Luft. — Dusseldorf: VDI-Verlag GmbH, 1966. — September (vol. 26 (H. 9). — S. 385–389. — ISSN 0039-0771., цитируется по: Office of Air Quality Planning and Standards. Reference Guide To Odor Thresholds For Hazardous Air Pollutants Listed In The Clean Air Act Amendments Of 1990 (англ.). — Research Triangle Park, North Carolina: United States Environmental Protection Agency, 1992. — P. 2-35 (67). — 89 p. — (EPA600/R-92/047).
Тетрахлорэтилен — Википедия
| Тетрахлорэтилен[1][2][3][4] | |||
|---|---|---|---|
| |||
| Систематическое наименование | 1,1,2,2-тетрахлорэтен | ||
| Традиционные названия | перхлорэтилен | ||
| Хим. формула | C2Cl4 | ||
| Рац. формула | C2Cl4 | ||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 165,83 г/моль | ||
| Плотность | 1,6230 г/см³ | ||
| Динамическая вязкость | 0,88·10-3 Па·с | ||
| Энергия ионизации | 9,32 ± 0,01 эВ[5] | ||
| Температура | |||
| • плавления | −22,4 °C | ||
| • кипения | 121 °C | ||
| • вспышки | 45 °C | ||
| Критическая точка | |||
| • температура | 340 °C | ||
| • давление | 44,3 атм | ||
| Уд. теплоёмк. | 858 Дж/(кг·К) | ||
| Энтальпия | |||
| • образования | −51,1 кДж/моль | ||
| • кипения | 34,7 кДж/моль | ||
| Давление пара | 1,86 кПа (20 °С) | ||
| Растворимость | |||
| • в воде | 0,015 г/100 мл | ||
| Диэлектрическая проницаемость | 2,20 | ||
| Показатель преломления | 1,5044 | ||
| Дипольный момент | 0 Кл·м[6] | ||
| Рег. номер CAS | 127-18-4 | ||
| PubChem | 31373 | ||
| Рег. номер EINECS | 204-825-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | KX3850000 | ||
| ChEBI | 17300 | ||
| Номер ООН | 1897 | ||
| ChemSpider | 13837281 | ||
| Предельная концентрация | 10 мг/м3 | ||
| Токсичность | При длительном контакте оказывает токсическое действие на ЦНС и печень | ||
| Фразы риска (R) | R40, R51/53 | ||
| Фразы безопасности (S) | R23, R36/37, R61 | ||
| Краткие характер. опасности (H) | |||
| Меры предостор. (P) | |||
| Пиктограммы СГС | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Медиафайлы на Викискладе | |||
Тетрахлорэтилен (перхлорэтилен) — бесцветная жидкость с резким запахом, хлорорганический растворитель. Широкое применение находит в химчистке и обезжиривании металлов.
Впервые тетрахлорэтилен был получен М. Фарадеем при термическом разложении гексахлорэтана[4].
- CCl3−CCl3→[t]CCl2=CCl2+Cl2{\displaystyle {\mathsf {CCl_{3}{-}CCl_{3}{\xrightarrow[{}]{[t]}}CCl_{2}{=}CCl_{2}+Cl_{2}}}}
В промышленности тетрахлорэтилен получают несколькими способами. Первый метод, игравший важное промышленное значение в прошлом, заключается в получении тетрахлорэтилена из ацетилена через трихлорэтилен. Хлорирование трихлорэтилена в жидкой фазе при температуре 70—110 °С в присутствии FeCl3 (0,1—1% масс.) даёт пентахлорэтан, который затем подвергают жидкофазному (80—120 °С, Ca(OH)2) или каталитическому термическому крекингу (170—330 °С, активированный уголь). Общий выход достигает 90—94% по ацетилену. Однако после повышения цен на ацетилен этот метод утратил своё значение[7].
- C2h3+2Cl2→C2h3Cl4{\displaystyle {\mathsf {C_{2}H_{2}+2Cl_{2}}}\rightarrow {\mathsf {C_{2}H_{2}Cl_{4}}}}
- C2h3Cl4→C2HCl3+HCl{\displaystyle {\mathsf {C_{2}H_{2}Cl_{4}}}\rightarrow {\mathsf {C_{2}HCl_{3}+HCl}}}
- C2HCl3+Cl2→C2HCl5{\displaystyle {\mathsf {C_{2}HCl_{3}+Cl_{2}}}\rightarrow {\mathsf {C_{2}HCl_{5}}}}
- C2HCl5→C2Cl4+HCl{\displaystyle {\mathsf {C_{2}HCl_{5}}}\rightarrow {\mathsf {C_{2}Cl_{4}+HCl}}}
Главным методом получения тетрахлорэтилена является окислительное хлорирование этилена или 1,2-дихлорэтана. Субстрат, кислород и хлор реагируют в присутствии катализатора (хлорид калия, хлорид меди(II) на силикагеле) при 420—460 °С. В результате серии реакций происходит образование трихлорэтилена и тетрахлорэтилена. Выход по хлору составляет 90—98%. Побочным процессом является окисление этилена до оксидов углерода, который ускоряется при превышении оптимальной температуры процесса. Продукты разделяются и очищаются перегонкой. Соотношение продуктов можно регулировать соотношением реагентов[8].
- Ch3=Ch3+Ch3Cl−Ch3Cl+2,5Cl2+1,75O2→CHCl=CCl2+CCl2=CCl2+3,5h3O{\displaystyle {\mathsf {CH_{2}{=}CH_{2}+CH_{2}Cl{-}CH_{2}Cl+2,5Cl_{2}+1,75O_{2}}}\rightarrow {\mathsf {CHCl{=}CCl_{2}+CCl_{2}{=}CCl_{2}+3,5H_{2}O}}}
Высокотемпературное хлорирование углеводородов C1—C3 или их хлорпроизводных является вторым по важности источником тетрахлорэтилена. Он не требует чистого сырья и позволяет использовать отходы производства[9].
В 1985 году производство тетрахлорэтилена в США составило 380 тыс. тонн, в Европе — 450 тыс. тонн. Из-за оптимизации процесса химчистки и уменьшения выбросов вещества в атмосферу, а также по причине ужесточающихся экологических требований производство тетрахлорэтилена сокращалось с конца 1970-х годов. Уже в 1993 году объёмы производства в США оценивались в 123 тыс. тонн в год и 74 тыс. тонн в ФРГ[10].
Тетрахлорэтилен негорюч, невзрывоопасен и не самовоспламеняется[1]. Он смешивается с большинством органических растворителей. С некоторыми растворителями тетрахлорэтилен образует азеотропные смеси.
| Второй компонент | Массовая доля тетрахлорэтилена | Т. кип. азеотропной смеси при 101,3 кПа, °С |
|---|---|---|
| вода | 15,9 | 87,1 |
| метанол | 63,5 | 63,8 |
| этанол | 63,0 | 76,8 |
| пропанол-1 | 48,0 | 94,1 |
| пропанол-2 | 70,0 | 81,7 |
| бутанол-1 | 29,0 | 109,0 |
| бутанол-2 | 40,0 | 103,1 |
| муравьиная кислота | 50,0 | 88,2 |
| уксусная кислота | 38,5 | 107,4 |
| пропионовая кислота | 8,5 | 119,2 |
| изомасляная кислота | 3,0 | 120,5 |
| ацетамид | 2,6 | 120,5 |
| пиррол | 19,5 | 113,4 |
| 1,1,2-трихлорэтан | 43,0 | 112,0 |
| 1-хлор-2,3-эпоксипропан | 51,5 | 110,1 |
| этиленгликоль | 6,0 | 119,1 |
Тетрахлорэтилен является самым устойчивым соединением из всех хлорпроизводных этана и этилена. Он устойчив к гидролизу и меньше способствует коррозии, чем другие хлорсодержащие растворители[4].
Окисление
Окисление тетрахлорэтилена на воздухе даёт трихлорацетилхлорид и фосген, процесс протекает под действием УФ-излучения:
- 2CCl2=CCl2+1,5O2→[hv]CCl3−COCl+2COCl2{\displaystyle {\mathsf {2CCl_{2}{=}CCl_{2}+1,5O_{2}{\xrightarrow[{}]{[hv]}}CCl_{3}{-}COCl+2COCl_{2}}}}
Этот процесс может быть замедлен при использовании аминов и фенолов в качестве стабилизаторов (обычно применяют N-метилпиррол и N-метилморфолин). Процесс, однако, может использоваться для производства трихлорацетилхлорида[4].
Хлорирование
При реакции тетрахлорэтилена с хлором в присутствии небольшого количества хлорида железа(III) FeCl3 (0,1 %) в качестве катализатора при 50-80 °С образуется гексахлорэтан[11]:
- CCl2=CCl2+Cl2→[FeCl3]CCl3−CCl3{\displaystyle {\mathsf {CCl_{2}{=}CCl_{2}+Cl_{2}{\xrightarrow[{}]{[FeCl_{3}]}}CCl_{3}{-}CCl_{3}}}}
По реакции тетрахлорэтилена с хлором и HF в присутствии SbF5 синтезируют фреон-113[1].
- CCl2=CCl2+3HF+Cl2→[SbF5]CClF2−CCl2F+3HCl{\displaystyle {\mathsf {CCl_{2}{=}CCl_{2}+3HF+Cl_{2}{\xrightarrow[{}]{[SbF_{5}]}}CClF_{2}{-}CCl_{2}F+3HCl}}}
Гидролиз
Происходит только при нагревании в кислой среде (лучше всего с серной кислотой):
- CCl2=CCl2+h3O→[t,h3SO4]CCl3−COOH+HCl{\displaystyle {\mathsf {CCl_{2}{=}CCl_{2}+H_{2}O{\xrightarrow[{}]{[t,H_{2}SO_{4}]}}CCl_{3}{-}COOH+HCl}}}
при этом образуется трихлоруксусная кислота.
Восстановление
Тетрахлорэтилен может быть частично или полностью восстановлен в газовой фазе в присутствии таких катализаторов как: никель, палладий, платиновая чернь и др.:
- CCl2=CCl2+2h3→[t,kat:Ni,Pd,PtO2]2C+4HCl{\displaystyle {\mathsf {CCl_{2}{=}CCl_{2}+2H_{2}{\xrightarrow[{}]{[t,kat:Ni,Pd,PtO_{2}]}}2C+4HCl}}}
Около 60 % всего расходуемого тетрахлорэтилена находит применение как растворитель в химчистке. Тетрахлорэтилен заменил все другие растворители в этой области, поскольку он не горюч и может быть безопасно использован без особых мер предосторожности. Из-за своей устойчивости тетрахлорэтилен содержит низкий процент стабилизаторов и по этой же причине используется наряду с трихлорэтиленом и 1,1,1-трихлорэтаном для обезжиривания металлов, особенно, алюминия. В меньших количествах тетрахлорэтилен применяется в текстильной промышленности и производстве фреона-113[12][1].
Перхлорэтилен токсичен. При длительном вдыхании паров перхлорэтилена человек начинает смеяться, как при реакции от оксида азота, после чего могут возникнуть признаки тошноты, склонность ко сну, видимая припухлость надбровных дуг и щек. При попадании на кожу перхлорэтилен оставляет ожог, и трескается место кожи. При попадании небольшого количества в глаза, достаточно просто промыть большим количеством воды.
- ↑ 1 2 3 4 Химическая энциклопедия / Под ред. И. Л. Кнунянца. — М: Большая Российская энциклопедия, 1992. — Т. 4. — С. 557. — ISBN 5-85270-039-8.
- ↑ Dean J. A. Lange's Handbook of Chemistry. — McGraw-Hill, 1999. — ISBN 0-07-016384-7.
- ↑ Sigma-Aldrich. Tetrachloroethylene, anhydrous (неопр.). Дата обращения 24 апреля 2013. Архивировано 29 апреля 2013 года.
- ↑ 1 2 3 4 5 Ullmann, 2006, p. 75.
- ↑ http://www.cdc.gov/niosh/npg/npgd0599.html
- ↑ CRC Handbook of Chemistry and Physics / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 15–21. — ISBN 978-1-4822-0868-9
- ↑ Ullmann, 2006, p. 76.
- ↑ Ullmann, 2006, p. 74, 76.
- ↑ Ullmann, 2006, p. 77—78.
- ↑ Ullmann, 2006, p. 79—80.
- ↑ Ошин Л.А. Промышленные хлорорганические продукты. — М.: Химия, 1978. — 656 с.
- ↑ Ullmann, 2006, p. 79.
- Rossberg M., Lendle W., Pfleiderer G., Tögel A., Dreher E.-L., Langer E., Rassaerts H., Kleinschmidt P., Strack H., Cook R., Beck U., Lipper K.-A., Torkelson T. R., Löser E., Beutel K. K., Mann T. Chlorinated Hydrocarbons // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2006. — doi:10.1002/14356007.a06_233.pub2.
- U.S. Department of Health and Human Services. Toxicological profile for tetrachloroethylene (неопр.) (1997). Дата обращения 24 апреля 2013. Архивировано 29 апреля 2013 года.
| Трихлорэтилен | |||
|---|---|---|---|
{{{картинка малая}}}) | |||
| Хим. формула | C2HCl3 | ||
| Рац. формула | CCl2=CHCl | ||
| Состояние | бесцветная, подвижная жидкость | ||
| Примеси | стабилизаторы тимол (0.01%) или фенол (0.001%) | ||
| Молярная масса | 131,39 г/моль | ||
| Плотность | 1,4642 г/см³ | ||
| Поверхностное натяжение | 0,02928 Н/м | ||
| Динамическая вязкость | 0,00058 Па·с | ||
| Энергия ионизации | 9,45 ± 0,01 эВ[1] | ||
| Температура | |||
| • плавления | -73 °C | ||
| • кипения | 86,7 °C | ||
| Пределы взрываемости | 8 ± 1 об.%[1] | ||
| Критическая точка | |||
| • температура | 271°C °C | ||
| • давление | 5,02МПа | ||
| Энтальпия | |||
| • образования | -7,53 кДж/моль | ||
| Давление пара | 58 ± 1 мм рт.ст.[1] | ||
| Растворимость | |||
| • в воде | 0,027 г/100 мл | ||
| Рег. номер CAS | 79-01-6 | ||
| PubChem | |||
Трихлорэтилен — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
| Трихлорэтилен | |
| Trichloroethylene-3D-balls.png | |
| Trichloroethylene-3D-vdW.png | |
| Общие | |
|---|---|
| Рац. формула | CCl2=CHCl |
| Физические свойства | |
| Состояние | бесцветная, подвижная жидкость |
| Примеси | стабилизаторы тимол (0.01%) или фенол (0.001%) |
| Молярная масса | 131,39 г/моль |
| Плотность | 1,4642 г/см³ |
| Поверхностное натяжение | 0,02928 Н/м |
| Динамическая вязкость | 0,00058 Па·с |
| Термические свойства | |
| Т. плав. | -73 °C |
| Т. кип. | 86,7 °C |
| Кр. темп. | 271°C °C |
| Кр. давл. | 5,02МПа |
| Энтальпия образования | -7,53 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,027 г/100 мл |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Трихлорэтилен | ||
Торговые названия | ||
|---|---|---|
Трихлорэтилен (Trichoraetylenum) — бесцветная, прозрачная, подвижная, летучая жидкость со своеобразным запахом, напоминающим запах хлороформа, и сладким, жгучим вкусом. Плотность 1,462—1,466. Полностью перегоняется при температуре + 86—88 °C. Практически нерастворим в воде; смешивается с органическими растворителями, не воспламеняется и не взрывается. Под действием света и воздуха разлагается с образованием фосгена и галогенсодержащих кислот и приобретает розовое окрашивание. Для стабилизации трихлорэтилена к нему добавляют 0,01 % тимола или 0.001% фенола.
Кроме применения в медицине в качестве наркозного средства, трихлороэтилен также используется в индустрии и в печатном деле как промышленный растворитель.
Свойства
Трихлорэтилен нельзя хранить на свету так как в присутствии кислорода воздуха он разлагается с образованием токсичного (и воспламеняющегося) продукта - дихлорацетилена, который, в свою очередь, разлагается на фосген, угарный газ и хлороводород. Реакцию катализируют пары йода, минеральные кислоты и натронная известь (применяется в закрытых и полузакрытых системах анестезии).
В присутствии катализаторов и при высоких температурах может образовывать другие хлорорганические соединения, чаще -предельного строения.
В присутствии хлорида алюминия трихлорэтилен взаимодействует с хлороводородом, при этом происходит конденсация, полимеризация и осмоление.
Трихлорэтилен хорошо растворяет парафины и воска. Нерастворим в большинстве спиртов и кетонов.
Получение
Трихлорэтилен получают путём каталитического высокотемпературного хлорирования сырья, содержащего смеси различных хлорорганических соединений, в том числе хлорэтанов и хлорэтиленов с последующим дистилляционным разделением продуктов.
Так при синтезе трихлорэтилена из отходов производства винилхлорида, дихлорэтана процесс проводят на кипящем слое силикагелевого катализатора при температуре от 400°С до 450°С; при окислительном хлорировании хлорэтанов или хлороэтиленов в качестве катализатора используются хлориды меди или калия на силикагелевом носителе, а температура процесса снижается до 350° - 400°С.
Биологическое действие
Трихлорэтилен является мощным наркотическим средством. Наркотический эффект наступает быстро и заканчивается через 2-3 минуты после прекращения подачи трихлорэтилена. От других наркотических веществ отличается тем, что уже в небольших концентрациях в первой стадии наркоза вызывает сильную анальгезиюК:Википедия:Статьи без источников (тип: не указан)[источник не указан 2485 дней].
Применяют трихлорэтилен для наркоза по полуоткрытой системе при помощи специальных наркозных аппаратов с калиброванным испарителем без абсорбера.
Для наркоза и длительной анальгезии трихлорэтилен применяют в концентрации 0,6—1,2 об. %.
Наиболее показано применение трихлорэтилена для кратковременного наркоза, для анальгезии при небольших хирургических операциях и болезненных манипуляциях, для обезболивания родов. Для этих целей используют трихлорэтилен в концентрации 0,3—0,6 об. % (обычно 0,5 об. %) в смеси с кислородом или воздухом либо со смесью, содержащей 50 % закиси азота и 50 % кислорода. Вдыхание может производиться при помощи специальных аппаратов для аутоанальгезии, причём маску больные (или роженицы) сами удерживают на лице: при появлении боли начинают вдыхать указанную смесь.
Трихлорэтилен может также применяться для снятия болевого синдрома при невралгии тройничного нерва, почечных коликах и заболеваниях, сопровождающихся сильными болями. В стоматологической практике препарат применяют для обезболивания при экстракции зубов, операциях на челюсти и других.
При правильном дозировании трихлорэтилен хорошо переносим, не вызывает раздражения дыхательных путей, усиления саливации и увеличения секреции бронхиальных желез. Не наблюдается существенных изменений кровообращения (могут отмечаться небольшое повышение АД и учащение пульса), не оказывает отрицательного влияния на сократительную деятельность матки у рожениц, на состояние плода и новорождённого. В отдельных случаях при вдыхании паров трихлорэтилена возможны тошнота и рвота.
При передозировке (свыше 1,5 об. %) может наступить резкое угнетение дыхания с нарушениями сердечного ритма. В концентрации свыше 0,8 об. % трихлорэтилен угнетает сократительную деятельность матки.
В связи с тем, что трихлорэтилен является сильным наркотическим средством, при его применении для обезболивания родов необходимо после обезболивания 3—4 схваток делать перерыв на 7—10 минут. Общая длительность применения препарата не должна превышать 4 часов.
При наркозе трихлорэтиленом нельзя применять адреналин в связи с возможным нарушением ритма сердца (вплоть до фибрилляции желудочков).
Противопоказания
Препарат противопоказан при заболеваниях печени и почек, нарушениях сердечного ритма, заболеваниях лёгких, анемии. В акушерской практике противопоказан также при преждевременных родах и тяжёлых токсикозах второй половины беременности.
Хранение
Список Б, в сухом, прохладном, защищённом от света месте. Через каждые 6 месяцев препарат подвергают аналитической проверке.
Синонимы
Трилен, хлорилен, наркоген, третилен, трихлорэтилен, трихлоран, трихлорен, тримар.
Напишите отзыв о статье "Трихлорэтилен"
Литература
Трегер Ю.А. [www.xumuk.ru/encyklopedia/2/4597.html Трихлорэтилен] // [www.xumuk.ru/encyklopedia/ Химическая энциклопедия: в 5 т] / Зефиров Н. С. (гл. ред.). — М.: Большая Российская энциклопедия, 1998. — Т. 5: Три—Ятр. — С. 10—11. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
Примечания
Отрывок, характеризующий Трихлорэтилен
Пьер ничего не отвечал, но ласково смотрел в глаза французу. Это выражение участия было приятно ему.– Parole d'honneur, sans parler de ce que je vous dois, j'ai de l'amitie pour vous. Puis je faire quelque chose pour vous? Disposez de moi. C'est a la vie et a la mort. C'est la main sur le c?ur que je vous le dis, [Честное слово, не говоря уже про то, чем я вам обязан, я чувствую к вам дружбу. Не могу ли я сделать для вас что нибудь? Располагайте мною. Это на жизнь и на смерть. Я говорю вам это, кладя руку на сердце,] – сказал он, ударяя себя в грудь.
– Merci, – сказал Пьер. Капитан посмотрел пристально на Пьера так же, как он смотрел, когда узнал, как убежище называлось по немецки, и лицо его вдруг просияло.
– Ah! dans ce cas je bois a notre amitie! [А, в таком случае пью за вашу дружбу!] – весело крикнул он, наливая два стакана вина. Пьер взял налитой стакан и выпил его. Рамбаль выпил свой, пожал еще раз руку Пьера и в задумчиво меланхолической позе облокотился на стол.
– Oui, mon cher ami, voila les caprices de la fortune, – начал он. – Qui m'aurait dit que je serai soldat et capitaine de dragons au service de Bonaparte, comme nous l'appellions jadis. Et cependant me voila a Moscou avec lui. Il faut vous dire, mon cher, – продолжал он грустным я мерным голосом человека, который сбирается рассказывать длинную историю, – que notre nom est l'un des plus anciens de la France. [Да, мой друг, вот колесо фортуны. Кто сказал бы мне, что я буду солдатом и капитаном драгунов на службе у Бонапарта, как мы его, бывало, называли. Однако же вот я в Москве с ним. Надо вам сказать, мой милый… что имя наше одно из самых древних во Франции.]
И с легкой и наивной откровенностью француза капитан рассказал Пьеру историю своих предков, свое детство, отрочество и возмужалость, все свои родственныеимущественные, семейные отношения. «Ma pauvre mere [„Моя бедная мать“.] играла, разумеется, важную роль в этом рассказе.
– Mais tout ca ce n'est que la mise en scene de la vie, le fond c'est l'amour? L'amour! N'est ce pas, monsieur; Pierre? – сказал он, оживляясь. – Encore un verre. [Но все это есть только вступление в жизнь, сущность же ее – это любовь. Любовь! Не правда ли, мосье Пьер? Еще стаканчик.]
Пьер опять выпил и налил себе третий.
– Oh! les femmes, les femmes! [О! женщины, женщины!] – и капитан, замаслившимися глазами глядя на Пьера, начал говорить о любви и о своих любовных похождениях. Их было очень много, чему легко было поверить, глядя на самодовольное, красивое лицо офицера и на восторженное оживление, с которым он говорил о женщинах. Несмотря на то, что все любовные истории Рамбаля имели тот характер пакостности, в котором французы видят исключительную прелесть и поэзию любви, капитан рассказывал свои истории с таким искренним убеждением, что он один испытал и познал все прелести любви, и так заманчиво описывал женщин, что Пьер с любопытством слушал его.
Очевидно было, что l'amour, которую так любил француз, была ни та низшего и простого рода любовь, которую Пьер испытывал когда то к своей жене, ни та раздуваемая им самим романтическая любовь, которую он испытывал к Наташе (оба рода этой любви Рамбаль одинаково презирал – одна была l'amour des charretiers, другая l'amour des nigauds) [любовь извозчиков, другая – любовь дурней.]; l'amour, которой поклонялся француз, заключалась преимущественно в неестественности отношений к женщине и в комбинация уродливостей, которые придавали главную прелесть чувству.
Так капитан рассказал трогательную историю своей любви к одной обворожительной тридцатипятилетней маркизе и в одно и то же время к прелестному невинному, семнадцатилетнему ребенку, дочери обворожительной маркизы. Борьба великодушия между матерью и дочерью, окончившаяся тем, что мать, жертвуя собой, предложила свою дочь в жены своему любовнику, еще и теперь, хотя уж давно прошедшее воспоминание, волновала капитана. Потом он рассказал один эпизод, в котором муж играл роль любовника, а он (любовник) роль мужа, и несколько комических эпизодов из souvenirs d'Allemagne, где asile значит Unterkunft, где les maris mangent de la choux croute и где les jeunes filles sont trop blondes. [воспоминаний о Германии, где мужья едят капустный суп и где молодые девушки слишком белокуры.]
Наконец последний эпизод в Польше, еще свежий в памяти капитана, который он рассказывал с быстрыми жестами и разгоревшимся лицом, состоял в том, что он спас жизнь одному поляку (вообще в рассказах капитана эпизод спасения жизни встречался беспрестанно) и поляк этот вверил ему свою обворожительную жену (Parisienne de c?ur [парижанку сердцем]), в то время как сам поступил во французскую службу. Капитан был счастлив, обворожительная полька хотела бежать с ним; но, движимый великодушием, капитан возвратил мужу жену, при этом сказав ему: «Je vous ai sauve la vie et je sauve votre honneur!» [Я спас вашу жизнь и спасаю вашу честь!] Повторив эти слова, капитан протер глаза и встряхнулся, как бы отгоняя от себя охватившую его слабость при этом трогательном воспоминании.
Слушая рассказы капитана, как это часто бывает в позднюю вечернюю пору и под влиянием вина, Пьер следил за всем тем, что говорил капитан, понимал все и вместе с тем следил за рядом личных воспоминаний, вдруг почему то представших его воображению. Когда он слушал эти рассказы любви, его собственная любовь к Наташе неожиданно вдруг вспомнилась ему, и, перебирая в своем воображении картины этой любви, он мысленно сравнивал их с рассказами Рамбаля. Следя за рассказом о борьбе долга с любовью, Пьер видел пред собою все малейшие подробности своей последней встречи с предметом своей любви у Сухаревой башни. Тогда эта встреча не произвела на него влияния; он даже ни разу не вспомнил о ней. Но теперь ему казалось, что встреча эта имела что то очень значительное и поэтическое.
«Петр Кирилыч, идите сюда, я узнала», – слышал он теперь сказанные сю слова, видел пред собой ее глаза, улыбку, дорожный чепчик, выбившуюся прядь волос… и что то трогательное, умиляющее представлялось ему во всем этом.
Окончив свой рассказ об обворожительной польке, капитан обратился к Пьеру с вопросом, испытывал ли он подобное чувство самопожертвования для любви и зависти к законному мужу.
Вызванный этим вопросом, Пьер поднял голову и почувствовал необходимость высказать занимавшие его мысли; он стал объяснять, как он несколько иначе понимает любовь к женщине. Он сказал, что он во всю свою жизнь любил и любит только одну женщину и что эта женщина никогда не может принадлежать ему.
– Tiens! [Вишь ты!] – сказал капитан.
Потом Пьер объяснил, что он любил эту женщину с самых юных лет; но не смел думать о ней, потому что она была слишком молода, а он был незаконный сын без имени. Потом же, когда он получил имя и богатство, он не смел думать о ней, потому что слишком любил ее, слишком высоко ставил ее над всем миром и потому, тем более, над самим собою. Дойдя до этого места своего рассказа, Пьер обратился к капитану с вопросом: понимает ли он это?
Капитан сделал жест, выражающий то, что ежели бы он не понимал, то он все таки просит продолжать.
– L'amour platonique, les nuages… [Платоническая любовь, облака…] – пробормотал он. Выпитое ли вино, или потребность откровенности, или мысль, что этот человек не знает и не узнает никого из действующих лиц его истории, или все вместе развязало язык Пьеру. И он шамкающим ртом и маслеными глазами, глядя куда то вдаль, рассказал всю свою историю: и свою женитьбу, и историю любви Наташи к его лучшему другу, и ее измену, и все свои несложные отношения к ней. Вызываемый вопросами Рамбаля, он рассказал и то, что скрывал сначала, – свое положение в свете и даже открыл ему свое имя.
Более всего из рассказа Пьера поразило капитана то, что Пьер был очень богат, что он имел два дворца в Москве и что он бросил все и не уехал из Москвы, а остался в городе, скрывая свое имя и звание.
Уже поздно ночью они вместе вышли на улицу. Ночь была теплая и светлая. Налево от дома светлело зарево первого начавшегося в Москве, на Петровке, пожара. Направо стоял высоко молодой серп месяца, и в противоположной от месяца стороне висела та светлая комета, которая связывалась в душе Пьера с его любовью. У ворот стояли Герасим, кухарка и два француза. Слышны были их смех и разговор на непонятном друг для друга языке. Они смотрели на зарево, видневшееся в городе.
Ничего страшного не было в небольшом отдаленном пожаре в огромном городе.
Глядя на высокое звездное небо, на месяц, на комету и на зарево, Пьер испытывал радостное умиление. «Ну, вот как хорошо. Ну, чего еще надо?!» – подумал он. И вдруг, когда он вспомнил свое намерение, голова его закружилась, с ним сделалось дурно, так что он прислонился к забору, чтобы не упасть.
Не простившись с своим новым другом, Пьер нетвердыми шагами отошел от ворот и, вернувшись в свою комнату, лег на диван и тотчас же заснул.
На зарево первого занявшегося 2 го сентября пожара с разных дорог с разными чувствами смотрели убегавшие и уезжавшие жители и отступавшие войска.
Поезд Ростовых в эту ночь стоял в Мытищах, в двадцати верстах от Москвы. 1 го сентября они выехали так поздно, дорога так была загромождена повозками и войсками, столько вещей было забыто, за которыми были посылаемы люди, что в эту ночь было решено ночевать в пяти верстах за Москвою. На другое утро тронулись поздно, и опять было столько остановок, что доехали только до Больших Мытищ. В десять часов господа Ростовы и раненые, ехавшие с ними, все разместились по дворам и избам большого села. Люди, кучера Ростовых и денщики раненых, убрав господ, поужинали, задали корму лошадям и вышли на крыльцо.
Трихлорэтилен
Трихлорэтилен
Трихлорэтилен
Химическая формула продукта: ClCH = CCl2
Торговые обозначения продукта:
1.Трихлорэтилен
2.ТСЕ
3.1,1-дихлор-2-хлоротеном
4.1-хлор-2,2-дихлорэтилен
Описание продукта.
Трихлорэтилен является тяжелой, стабильной, токсичный, негорючей жидкостью с запахом хлороформа; процесс кипения у Трихлорэтилена наступает при температуре 87 ° С ; слабо растворим в воде, растворим со смазками и обычными органическими растворителями. Трихлорэтилен получают путем хлорирования этилена или дихлорэтана. Из - за опасений по поводу их токсичности, использование снижается. Запрещается употреблять в пищу, при производстве лекарств и косметики. В настоящее время в основном используется в процессе парового обезжиривания или в этапных производствах сборки металлических деталей. Трихлорэтилен также используется в качестве промышленного растворителя в процессах экстракции, в качестве разбавителя при производстве красок и клеев, в обработке текстильных продуктов. Он используется в качестве прерывателя цепи для производства ПВХ. Он также используется в качестве хладагента, в качестве теплообменной жидкости, в качестве промежуточного химического продукта или сырья в производстве хлоруксусной кислоты, пестицидов, смолы, дегтя, красок и лаков. Он используется в сухих операциях очистки.
Вплоть до 1977 года, трихлорэтилен имел функции, связанные с прямым потреблением продукта человеком. Используется в качестве общего наркоза, при обработке кожных ран и использовался в качестве хирургического дезинфицирующего средства, а так же трихлорэтилен применялся в качестве специи в кофейном производстве. Человек опирался на трихлорэтилен во многих сферах жизнедеятельности, как при прямом потреблении продукта, так и руководствуясь медицинскими функциями, в частности чтобы дезинфицировать травмы. В 1977 году эти виды использования трихлорэтилена были запрещены FDA из-за потенциального вреда для здоровья человека и окружающей среды.На сегодняшний день существуют различные варианты использования трихлорэтилена. По состоянию на 1986, 80% трихлорэтилена было использовано в качестве обезжиривания паров в процессе производства металлических деталей. Трихлорэтилен также используется в качестве промежуточного химического вещества, а некоторые даже производятся на экспорт. Цель трихлорэтилена в парах обезжиривания металлических деталей очень важна. Трихлорэтилен применяется в автомобильной и металлургической промышленности, трихлорэтилен оказывается мощным средством в удалении жира, масла, воска и смолы. Трихлорэтилен также используется текстильной промышленности. Основное применение трихлорэтилена заключается в очистке хлопка, шерсти и других тканях. Он также используется в качестве растворителя для безводной технологии очистки и обработки поверхностей. Трихлорэтилен также найден и используется в таких продуктах, как красители, типографские красок, краски, клеи, для удаления красок, коррекции пишущих жидкостей, а также пятновыводителей широкого спектра. Существенное количество трихлорэтилена используются каждый год в производстве поливинилхлорида. Это нестабильная и опасная жидкость, которая не является горючей. TCE представляет собой бесцветную или синюю органическую жидкость, которая имеет запах несколько похожий на хлороформ. Запах сладкий, и он имеет сладкий, все же жгучий привкус.
До 1968 г. около 85% производимого трихлорэтилена было основано на ацетилене. Процесс основанный на ацетилене состоит из двух этапов: ацетилен сначала хлорируют до 1,1,2,2-тетрахлорэтан, с катализатором, содержащим хлорид трехвалентного железа, фосфора или хлорид сурьмы, а затем продукт дегидролангируется до получения трихлорэтилена. Современный метод производства основывается на этилене или 1,2-дихлорэтане. В процессе получения трихлорэтилена используют реакцию на основе некаталитического хлорирования дихлорэтана и других углеводородов С2 со смесью кислорода и хлора или хлористого водорода.
Физико-химические свойства трихлорэтилена.
|
№ |
Показатель |
Значение |
|
1 |
Точка кипения трихлорэтилен |
87 ° C |
|
2 |
Температура плавления трихлорэтилен |
-86 до -88 ° C |
|
3 |
Растворимость в воде, г / 100 мл при 20 ° C |
0,1 |
|
4 |
Относительная плотность трихлорэтилен (вода = 1) |
1,5 (20 ° С) |
|
5 |
Давление паров трихлорэтилен, кПа при 20 ° C |
7,8 |
|
6 |
Относительная плотность пара трихлорэтилен (воздух = 1) |
4.5 |
|
7 |
Относительная плотность смеси трихлорэтилен пар/воздух при 20 ° C (воздух = 1) |
1.3 |
|
8 |
Температура самовоспламенения трихлорэтилен |
410 ° C |
|
9 |
Пределы взрываемости трихлорэтилен, объем% в воздухе |
7.9 - 100 |
|
10 |
Октанол вода коэффициент раздела |
2.42 |
|
11 |
Электрическая проводимость трихлорэтилен |
800 мкСм / м |
Транспортировка и хранение трихлорэтилена.
Этот материал является очень токсичной жидкостью (мутаген, раздражитель кожных покровов, потенциальный канцероген. Перед обработкой, чрезвычайно важно, чтобы технические средства контроля присутствовали на территории складского помещения и что требования защиты оборудования и меры личной гигиены персонала соблюдаются. Люди, работающие с этим химическим веществом должны быть надлежащим образом подготовлены и уведомлены о его свойствах. Техническое обслуживание и аварийный персонал должны быть предупреждены о потенциальной опасности. Если трихлорэтилен высвобождается из контейнера, сразу надеть респиратор и покинуть зону опасности. Незащищенные люди должны избегать любых контактов с этим химическим веществом, включая загрязненное оборудование. Закрытые системы обработки для процессов с участием этого материала должны быть максимально доступны. Хранить продукт следует в хорошо вентилируемом помещении. Избегайте образования паров или тумана. Не следует проводить сварочных работ, а так же наличия открытого пламени или иных источников воспламенения вблизи хранимого препарата во избежании формирования токсичных оснований хлористого водорода.
Не используйте с несовместимыми материалами, такими как сильные основания (например, гидроксид натрия) и щелочных металлов (например, натрия и его сплавов). Проверьте контейнеры на наличие утечек перед началом работы. Открытые контейнеры следует хранить на устойчивой поверхности. Хранить контейнеры плотно закрытыми, когда он не используется. Сохранение рабочих зон в чистоте имеет важное значение. Используйте рабочие поверхности, которые могут быть легко обезврежены.
Области применения трихлорэтилена.
1. Трихлорэтилен применяют для производства химикатов в сельскохозяйственной промышленности. Основным продуктом являются вещества беспестицидной группы.
2. Трихлорэтилен купить используется в качестве сырьевого ресурса на широком спектре промышленных производств, а так же участвует в некоторых этапах химического производства промышленными преприятиями.
3. Трихлорэтилен применяется при производства растворителей, используемых для обработки поверхностей и продуктов с целью очистки или обезжиривания.
4. Трихлорэтилен купить и применить для производства растворителей, которые будут являться частью основного производственного продукта или смеси продуктов, сформированных под выполнение узкоспециализированных задач.
5. Трихлорэтилен применяется при промышленном производстве клеев и материалов-герметиков для повседневного использования.
6. Трихлорэтилен применяется в текстильной промышленности в качестве на этапах обработки продуктов для получения оными дополнительных свойств.
7. Трихлорэтилен применяется при промышленном производстве хладагентовой группы веществ, а так же при производстве веществ теплообменной группы.
8. Трихлорэтилен используется в металлургической промышленности при производстве и обработки металлов и деталей.
Трихлорэтилен — Википедия. Что такое Трихлорэтилен
| Трихлорэтилен | |
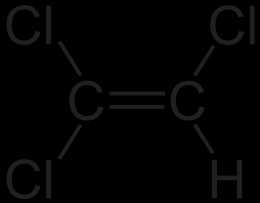 | |
| Общие | |
|---|---|
| Хим. формула | C₂HCl₃ |
| Рац. формула | CCl2=CHCl |
| Физические свойства | |
| Состояние | бесцветная, подвижная жидкость |
| Примеси | стабилизаторы тимол (0.01%) или фенол (0.001%) |
| Молярная масса | 131,39 г/моль |
| Плотность | 1,4642 г/см³ |
| Поверхностное натяжение | 0,02928 Н/м |
| Динамическая вязкость | 0,00058 Па·с |
| Энергия ионизации | 9,45 ± 0,01 эВ[1] |
| Термические свойства | |
| Т. плав. | -73 °C |
| Т. кип. | 86,7 °C |
| Пр. взрв. | 8 ± 1 об.%[1] |
| Кр. темп. | 271°C °C |
| Кр. давл. | 5,02МПа |
| Энтальпия образования | -7,53 кДж/моль |
| Давление пара | 58 ± 1 мм рт.ст.[1] |
| Химические свойства | |
| Растворимость в воде | 0,027 г/100 мл |
| Классификация | |
| Рег. номер CAS | 79-01-6 |
| PubChem | 6575 |
| Рег. номер EINECS | 201-167-4 |
| SMILES | |
| InChI | |
| RTECS | KX4550000 |
| ChEBI | 16602 |
| ChemSpider | 13837280 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Трихлорэтилен (Trichoraetylenum) — хлорорганическое соединение, бесцветная, прозрачная, подвижная, летучая жидкость со своеобразным запахом, напоминающим запах хлороформа, и сладким, жгучим вкусом. Плотность 1,462—1,466. Полностью перегоняется при температуре + 86—88 °C. Практически нерастворим в воде; смешивается с органическими растворителями, не воспламеняется и не взрывается. Под действием света и воздуха разлагается с образованием фосгена и галогенсодержащих кислот и приобретает розовое окрашивание. Для стабилизации трихлорэтилена к нему добавляют 0,01 % тимола или 0.001% фенола.
Кроме применения в медицине в качестве наркозного средства, трихлороэтилен также используется в индустрии и в печатном деле как промышленный растворитель.
Свойства
Трихлорэтилен нельзя хранить на свету так как в присутствии кислорода воздуха он разлагается с образованием токсичного (и воспламеняющегося) продукта - дихлорацетилена, который, в свою очередь, разлагается на фосген, угарный газ и хлороводород. Реакцию катализируют пары йода, минеральные кислоты и натронная известь (применяется в закрытых и полузакрытых системах анестезии).
В присутствии катализаторов и при высоких температурах может образовывать другие хлорорганические соединения, чаще -предельного строения.
В присутствии хлорида алюминия трихлорэтилен взаимодействует с хлороводородом, при этом происходит конденсация, полимеризация и осмоление.
Трихлорэтилен хорошо растворяет парафины и воска. Нерастворим в большинстве спиртов и кетонов.
Получение
Трихлорэтилен получают путём каталитического высокотемпературного хлорирования сырья, содержащего смеси различных хлорорганических соединений, в том числе хлорэтанов и хлорэтиленов с последующим дистилляционным разделением продуктов.
Так при синтезе трихлорэтилена из отходов производства винилхлорида, дихлорэтана процесс проводят на кипящем слое силикагелевого катализатора при температуре от 400°С до 450°С; при окислительном хлорировании хлорэтанов или хлороэтиленов в качестве катализатора используются хлориды меди или калия на силикагелевом носителе, а температура процесса снижается до 350° - 400°С.
Биологическое действие
Трихлорэтилен является мощным наркотическим средством. Наркотический эффект наступает быстро и заканчивается через 2-3 минуты после прекращения подачи трихлорэтилена. От других наркотических веществ отличается тем, что уже в небольших концентрациях в первой стадии наркоза вызывает сильную анальгезию[источник не указан 1966 дней].
Применяют трихлорэтилен для наркоза по полуоткрытой системе при помощи специальных наркозных аппаратов с калиброванным испарителем без абсорбера.
Для наркоза и длительной анальгезии трихлорэтилен применяют в концентрации 0,6—1,2 об. %.
Наиболее показано применение трихлорэтилена для кратковременного наркоза, для анальгезии при небольших хирургических операциях и болезненных манипуляциях, для обезболивания родов. Для этих целей используют трихлорэтилен в концентрации 0,3—0,6 об. % (обычно 0,5 об. %) в смеси с кислородом или воздухом либо со смесью, содержащей 50 % закиси азота и 50 % кислорода. Вдыхание может производиться при помощи специальных аппаратов для аутоанальгезии, причём маску больные (или роженицы) сами удерживают на лице: при появлении боли начинают вдыхать указанную смесь.
Трихлорэтилен может также применяться для снятия болевого синдрома при невралгии тройничного нерва, почечных коликах и заболеваниях, сопровождающихся сильными болями. В стоматологической практике препарат применяют для обезболивания при экстракции зубов, операциях на челюсти и других.
При правильном дозировании трихлорэтилен хорошо переносим, не вызывает раздражения дыхательных путей, усиления саливации и увеличения секреции бронхиальных желез. Не наблюдается существенных изменений кровообращения (могут отмечаться небольшое повышение АД и учащение пульса), не оказывает отрицательного влияния на сократительную деятельность матки у рожениц, на состояние плода и новорождённого. В отдельных случаях при вдыхании паров трихлорэтилена возможны тошнота и рвота.
При передозировке (свыше 1,5 об. %) может наступить резкое угнетение дыхания с нарушениями сердечного ритма. В концентрации свыше 0,8 об. % трихлорэтилен угнетает сократительную деятельность матки.
В связи с тем, что трихлорэтилен является сильным наркотическим средством, при его применении для обезболивания родов необходимо после обезболивания 3—4 схваток делать перерыв на 7—10 минут. Общая длительность применения препарата не должна превышать 4 часов.
При наркозе трихлорэтиленом нельзя применять адреналин в связи с возможным нарушением ритма сердца (вплоть до фибрилляции желудочков).
Противопоказания
Препарат противопоказан при заболеваниях печени и почек, нарушениях сердечного ритма, заболеваниях лёгких, анемии. В акушерской практике противопоказан также при преждевременных родах и тяжёлых токсикозах второй половины беременности.
Хранение
Список Б, в сухом, прохладном, защищённом от света месте. Через каждые 6 месяцев препарат подвергают аналитической проверке.
Синонимы
Трилен, хлорилен, наркоген, третилен, трихлорэтилен, трихлоран, трихлорен, тримар.
Литература
Трегер Ю.А. Трихлорэтилен // Химическая энциклопедия: в 5 т / Зефиров Н. С. (гл. ред.). — М.: Большая Российская энциклопедия, 1998. — Т. 5: Три—Ятр. — С. 10—11. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
Примечания
|
|
Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я
Синонимы:
chlorylennarcogen trethylene trichloran trichloroethylene trilen трилен
Внешний вид:
бесцветн. жидкостьБрутто-формула (система Хилла): C2HCl3Формула в виде текста: CHClCCl2Молекулярная масса (в а.е.м.): 131,39Температура плавления (в °C): -86,4Температура кипения (в °C): 87,19Растворимость (в г/100 г или характеристика):ацетон: растворимвода: 0,11 (25°C) диэтиловый эфир: смешивается хлороформ: растворим этанол: смешивается
Вкус, запах, гигроскопичность:
запах: хлороформаПлотность:1,465 (20°C, г/см3)Показатель преломления (для D-линии натрия):1,4773 (20°C)Давление паров (в мм.рт.ст.):73 (25°C)Диэлектрическая проницаемость:3,42 (16°C)Дипольный момент молекулы (в дебаях):0,9 (20°C)Динамическая вязкость жидкостей и газов (в мПа·с):0,566 (25°C)Стандартная мольная теплоемкость Cp (298 К, Дж/моль·K):122,6 (ж)Энтальпия кипения ΔHкип (кДж/моль):34,56Биологическое действие:Мощное наркозное средство. Наркотический эффект наступает быстро и заканчивается через 2-3 мин после прекращения подачи трихлорэтилена. От других наркозных средств отличается тем, что уже в небольших концентрациях вызывает сильную анальгезию. Для наркоза и длительной анальгезии трихлорэтилен применяют в концентрации 0,6-1,2 об%. Симптомы острого отравления:При передозировке (свыше 1,5 об%) может наступить резкое угнетение дыхания с нарушениями сердечного ритма. Критическая температура (в °C):271Критическое давление (в МПа):5,02Применение:Лекарственное средство для ингаляционного наркоза. Дополнительная информация:Под действием света и воздуха разлагается с образованием фосгена и галогенсодержащих кислот и приобретает розовое окрашивание. Для стабилизации трихлорэтилена к нему добавляют 0,01% тимола.
Источники информации:Алф. указатель: 1-9 A-Z А Б В Г Д Е Ж З И К Л М Н О П Р С Т У Ф Х Ц Ч Щ Э Я Еще по теме: |

|
Трихлорэтилен - это... Что такое Трихлорэтилен?
- Трихлорэтилен
- CCl2=CHCI, бесцветная жидкость с запахом, напоминающим запах хлороформа; tkип 87,2 °C, плотность 1,465 г/см3 (20 °C). Плохо растворяется в воде (0,11 г в 100 г при 25 °С), образует азеотропные смеси (См. Азеотропная смесь) с водой (tkип 73,6 °С; 5,4% воды), метиловым и этиловым спиртами, уксусной кислотой и др. При длительном хранении на свету Т. постепенно окисляется кислородом воздуха до Фосгена COCl2. При действии на Т. концентрированной азотной кислоты наряду с др. продуктами образуется Хлорпикрин CCl3NO2. Основной промышленный способ получения Т. — дегидрохлорирование симметричного Тетрахлорэтана кипячением с известью или пиролизом при 400— 500 °С.
Благодаря высокой растворяющей способности (Т. хорошо растворяет жиры, воски, смолы, каучук, серу, фосфор и др.), невысокой температуре кипения, незначительной токсичности и негорючести Т. широко используют для обезжиривания тканей, кожи, металлов, для экстракции жиров и масел из природного сырья, для чистки одежды и др. целей. Предельно допустимая концентрация паров в воздухе 0,05 мг/л.
Большая советская энциклопедия. — М.: Советская энциклопедия. 1969—1978.
- Трихлоруксусная кислота
- Трихобактерии
Смотреть что такое "Трихлорэтилен" в других словарях:
трихлорэтилен — трихлорэтилен … Орфографический словарь-справочник
ТРИХЛОРЭТИЛЕН — Cl2C = CHCl, бесцветная жидкость, tкип =87,2 .C. Растворитель для обезжиривания металлов, тканей, кожи; используется для экстракции жиров, при химической чистке одежды … Большой Энциклопедический словарь
трихлорэтилен — сущ., кол во синонимов: 1 • растворитель (67) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
трихлорэтилен — Cl2C=CHCl, бесцветная жидкость, tкип 87,2°C. Растворитель для обезжиривания металлов, тканей, кожи; используется для экстракции жиров, при химической чистке одежды. * * * ТРИХЛОРЭТИЛЕН ТРИХЛОРЭТИЛЕН, Cl2C = CHCl, бесцветная жидкость, tкип =87,2… … Энциклопедический словарь
трихлорэтилен — trichloretilenas statusas T sritis chemija formulė CHCl=CCl₂ atitikmenys: angl. trichloroethylene rus. трихлорэтилен ryšiai: sinonimas – trichloretenas … Chemijos terminų aiškinamasis žodynas
Трихлорэтилен — … Википедия
трихлорэтилен — трихлорэтил ен, а … Русский орфографический словарь
трихлорэтилен — этилентрихлорид … Cловарь химических синонимов I
ТРИХЛОРЭТИЛЕН ДЛЯ НАРКОЗА — ( Тгiсhоrаеtуlеnum рго nаrсоsi ). Синонимы: Трилен, Chlorylen, Nаrсоgen, Тrеthylеnе, Тrichlorathylen, Тrichlorаn, Trichloren, Тrichloroethylene, Тrilen, Тrimar и др. Бесцветная, прозрачная, подвижная, летучая жидкость со своеобразным запахом,… … Словарь медицинских препаратов
Трихлорэтилен для наркоза — … Википедия
трихлорэтилен - Trichloroethylene - qwe.wiki
| | |||
| имена | |||
|---|---|---|---|
| название IUPAC трихлорэтен | |||
| Другие имена 1,1,2-трихлорэтен; 1,1-дихлор-2-хлорэтилен; 1-хлор-2,2-дихлорэтан; Ацетилен трихлорид; TCE; Trethylene; Triclene; Tri; Trimar; Trilene; HCC-1120 | |||
| Идентификаторы | |||
| 3D модель ( JSmol ) | |||
| Сокращения | TCE | ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ИКГВ InfoCard | 100.001.062 | ||
| Номер EC | 201-167-4 | ||
| KEGG | |||
| номер RTECS | KX4550000 | ||
| UNII | |||
| |||
| |||
| свойства | |||
| С 2 Н Cl 3 | |||
| Молярная масса | 7002131380000000000 ♠131,38 г · моль -1 | ||
| Внешность | Бесцветная жидкость | ||
| запах | хлороформ -как | ||
| плотность | 1,46 г / см 3 при 20 ° C | ||
| Температура плавления | -84,8 ° С (-120,6 ° F, 188,3 К) | ||
| Точка кипения | 87,2 ° С (189,0 ° F, 360,3 К) | ||
| 1,280 г / л | |||
| Растворимость | эфир , этанол , хлороформ | ||
| войти P | 2,26 | ||
| Давление газа | 58 мм рт.ст. (0,076 атм) при 20 ° C | ||
| -65,8 · 10 -6 см 3 / моль | |||
| 1,4777 при 19,8 ° C | |||
| Фармакология | |||
| N01AB05 ( ВОЗ ) | |||
| опасности | |||
| Основные опасности | Вреден при проглатывании или вдыхании, канцерогенные | ||
| Паспорт безопасности | См: страницы данных Mallinckrodt Baker | ||
| NFPA 704 | |||
| 420 ° С (788 ° F, 693 К) | |||
| пределы взрываемости | 8% -10,5% | ||
| Смертельная доза или концентрация ( LD , LC ): | |||
| 8450 частей на миллион (мышь, 4 ч) 26300 (крыса, 1 час) | |||
| 2900 частей на миллион (человек) 37200 частей на миллион (морской свинки, 40 мин) 5952 частей на миллион (кат, 2 ч) 8000 частей на миллион (крыса, 4 ч) 11000 (кролик) | |||
| Пределы воздействия здоровья США ( NIOSH ): | |||
| PEL (допустимый) | СПВ 100 частей на миллион частей на миллион С 200 300 частей на миллион (5-минутный максимальный пик в любых 2-х часов) | ||
| REL (рекомендуется) | Калифорния | ||
| IDLH (Непосредственная опасность) | Са [1000 частей на миллион] | ||
| Родственные соединения | |||
| Винилхлорид | |||
| Родственные соединения | Хлороформ 1,1,1-трихлорэтан 1,1,2-трихлорэтан | ||
| Дополнительная страница данных | |||
| Показатель преломления ( п ), Диэлектрическая постоянная (ε г ) и т.д. | |||
| Термодинамические | Фазовое поведение твердое тело-жидкость-газ | ||
| УФ , ИК , ЯМР , МС | |||
| За исключением случаев, когда указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |||
| N проверить ( что ?) YN | |||
| ссылки Infobox | |||
Химическое соединение трихлорэтилен является галоидоуглеродным обычно используются в качестве промышленного растворителя . Это ясно не воспламеняется жидкость со сладким запахом. Не следует путать с аналогичным 1,1,1-трихлорэтана , который широко известен как Хлоротен .
IUPAC имя трихлорэтен . Промышленные сокращения включают TCE , трихлор , мотодельтаплан , Tricky и три . Это было продано под различными торговыми названиями. Под торговыми названиями Trimar и трихлорэтилен , трихлорэтилен был использован в качестве летучего анестетика и как вдыхаемый акушерской анальгетика в миллионах пациентов.
Подземная вода и питьевая вода загрязнение от промышленных выбросов является серьезной проблемой для здоровья человека и осаждали многочисленные инциденты и судебные процессы.
история
Pioneered от Imperial Chemical Industries в Великобритании, ее развитие было воспринято в качестве анестезирующего революции. Первоначально думали , что обладает меньше гепатотоксичностью , чем хлороформ , и без неприятной остроты и воспламеняемости эфира , использование TCE было то не менее , вскоре иметь несколько подводных камней. Они включали продвижение сердечной аритмии , низкую летучесть и высокой растворимости , предотвращающую быстрые обезболивающие индукции, реакции с натронной известью , используемой в системах поглощения диоксида углерода, длительная дисфункцией неврологической при использовании с натронной известью, а также доказательством гепатотоксичности , как было обнаружено хлороформом.
Введение галотана в 1956 году значительно уменьшилось использование TCE в качестве общего анестетика. ТХЭ по - прежнему используется в качестве анальгетика при вдыхании во время родов , заданной самостоятельного введения. Фетальная токсичность и проблемы для канцерогенного потенциала TCE привели к отказу в развитых странах в 1980 - х.
Из - за опасения по поводу его токсичности, применение трихлорэтилена в пищевой и фармацевтической промышленности , было запрещено в большинстве стран мира , начиная с 1970 - х лет. Законодательство вынудило замену трихлорэтилена во многих процессах в Европе , как химическое вещество классифицируется как канцероген , несущего R45 фразы риски , может вызвать рак . Многие обезжиривания химических альтернатив продвигаемые , такие как Ensolv и Leksol; Однако, каждый из них основан на п -пропил бромиде , который несет в себе риск фраза R60 в мае снижает фертильность , и они не были бы юридически приемлемой заменой.
Грунтовые загрязнение TCE стало важной экологической проблемой для воздействия на организм человека .
В 2005 году было объявлено, Агентством по охране окружающей среды Соединенных Штатов, что агентство завершит свою окончательную оценку здоровья для трихлорэтилена и опубликовала список новых значений TCE токсичности. Результаты исследования были формально охарактеризовать химикат как канцероген для человека и не-канцерогенной опасности для здоровья. 2011 токсикологические выполняются по охране окружающей среды продолжает список трихлорэтилена в качестве известного канцерогена.
производство
До начала 1970 - х годов, большинство трихлорэтилен было произведено в двухступенчатом процессе с ацетиленом . Во- первых, ацетилена обрабатывают хлором с использованием хлорида железа катализатора при температуре 90 ° С для получения 1,1,2,2-тетрахлорэтан в соответствии с химическим уравнением
- HC≡CH + 2 Cl 2 → Cl 2 CHCHCl 2
1,1,2,2-тетрахлорэтан затем дегидрохлорируется дать трихлорэтилен. Это может либо быть выполнено с помощью водного раствора гидроксида кальция
- 2 Cl 2 CHCHCl 2 + Са (ОН) 2 → 2 ClCH = CCl 2 + CaCl 2 + 2 Н 2 О
или в паровой фазе при нагревании его до 300-500 ° С на хлорид бария или хлорид кальция катализаторе
- Cl 2 CHCHCl 2 → ClCH = CCl 2 + HCl ,
Сегодня, однако, большинство трихлорэтилена получают из этилена . Во- первых, этилен хлорируют над хлорида трехвалентного железа катализатора с получением 1,2-дихлорэтана .
- СН 2 = СН 2 + Cl 2 → ClCH 2 CH 2 Cl
При нагревании до примерно 400 ° С с дополнительным количеством хлора, 1,2-дихлорэтан, преобразуется в трихлорэтилена
- ClCH 2 CH 2 Cl + 2 Cl 2 → ClCH = CCl 2 + 3 HCl
Эту реакцию можно катализировать с помощью различных веществ. Наиболее часто используемый катализатор представляет собой смесь хлорида калия и хлорида алюминия . Тем не менее, различные формы пористого углерода , также могут быть использованы. Эта реакция производит тетрахлорэтилена в качестве побочного продукта, и в зависимости от количества хлора , подаваемого в реакционную смесь, тетрахлорэтилен может даже быть основным продуктом. Как правило, трихлорэтилен и тетрахлорэтилен собираются вместе и затем разделены перегонкой .
Пользы
Трихлорэтилен является эффективным растворителем для различных органических материалов.
Когда он был впервые широко произведен в 1920 - х годах, использует главным образом трихлорэтилен в том , чтобы извлечь растительные масла из растительных материалов , такие как соевые , кокосовый орех , и ладонь . Другие области применения в пищевой промышленности включено кофе Decaffeination и приготовление приправы экстрактов из хмеля и пряностей . Он также используется для удаления остаточной воды в производстве 100% -ного этанола.
С 1930 - х по 1970 - е годы, как в Европе , так и в Северной Америке, трихлорэтилен был использован в качестве летучего анестетика почти всегда вводят с закисью азота. Выпускаемый в Великобритании по ICI под торговым названием Trilene он был окрашен в синий цвет (с красителем под названием waxoline синий) , чтобы избежать путаницы с аналогичной пахнущие хлороформом. TCE заменил ранее анестетиков хлороформ и эфир в 1940 - х годах, но сам был заменен в 1960 - е годы в развитых странах с введением галотана , что позволило значительно быстрее индукции и восстановления и был значительно легче управлять. Trilene также был использован в качестве мощного вдыхаемого анальгетика, главным образом , во время родов. Он был использован с галотаном в поле анестезирующего устройства Tri-службе , которая используется вооруженными силами Великобритании в полевых условиях. В 2000 году , однако, TCE был до сих пор используется в качестве анестетика в Африке.
Он также был использован в качестве сухой очистки растворителя, хотя заменены в 1950 - х годах тетрахлорэтилен (также известный как перхлорэтилен), для очистки места , где он не был использован до 2000 года , за исключением.
Трихлорэтилен был продан как «Ecco 1500 Anti-Static Film очиститель и кондиционер» до 2009 года для использования в автоматических моющих машинах киноленте, а также для ручной очистки с безворсовых салфетками.
Пожалуй, наибольшее применение TCE было как обезжиривания металлических деталей. Спрос на TCE как обезжиривания начал снижаться в 1950 - х годах в пользу менее токсичных 1,1,1-трихлорэтан . Тем не менее, производство 1,1,1-трихлорэтан было прекращено в большинстве стран мира в соответствии с положениями Монреальского протокола , и , как следствие , трихлорэтилен испытал некоторый всплеск использования в качестве обезжиривания.
TCE также была использована в Соединенных Штатах для очистки керосина топлива ракетных двигателей (TCE не используется для очистки водородного топлива двигателей , таких как Space Shuttle Main Engine ). Во время статического обжига РПА-1 топливо будет оставить залежи углеводородов и пары в двигателе. Эти отложения должны были быть сброшены от двигателя , чтобы избежать возможности взрыва при обработке двигателя и будущего стрельбы. TCE был использован немедленно промыть топливную систему двигателя до и после каждого испытательного запуска. Процедура промывки участвует насосные TCE через топливную систему двигателя и позволяя переполнение растворителя в течение периода времени в пределах от нескольких секунд до 30-35 минут, в зависимости от двигателя. Для некоторых двигателей, газовый генератор двигателя и жидкий кислород (LOX) купола были также продували TCE до испытания обжига. Ракетный двигатель F-1 имел свой LOX купол, газовый генератор, и тяговую камера топливо куртка продувает TCE во время запуска препаратов.
ТХЭ также используется в производстве целого ряда фторированных углеводородных хладагентов , таких как 1,1,1,2-тетрафторэтан более широко известный как HFC 134a. TCE был также использован в промышленных холодильных системах из - за его высокой возможности передачи тепла и его низкой температуры спецификации. Многие приложения промышленных холодильных используется TCE до 1990 - х годов в таких приложениях, как тестирование автомобилей.
Химическая нестабильность
Несмотря на широкое использование в качестве металла обезжиривания, сама трихлорэтилен неустойчив в присутствии металла более длительного воздействия. Уже в 1961 году это явление было признано в обрабатывающей промышленности, когда стабилизирующие добавки были добавлены к коммерческой разработке. Поскольку реактивная нестабильность усугубляется более высокими температурами, поиск стабилизирующих добавок проводили путем нагрева трихлорэтилена до температуры кипения в дефлегматоре и наблюдая разложение. Первая широко используются стабилизирующая добавка была диоксаном ; Однако, его использование было запатентовано компанией Dow Chemical Company , и не может быть использована другими производителями. Значительные исследования имели место в 1960 - х годах для разработки альтернативных стабилизаторов для трихлорэтилена. Другие химические стабилизаторы включают кетоны , такие как метилэтилкетон .
Физиологические эффекты
При вдыхании, трихлорэтилен производит центральной нервной системы депрессии , что приводит к общей анестезии . Эти эффекты могут быть опосредованы трихлорэтилена , действующей в качестве положительного аллостерического модулятора ингибирующих ГАМК А рецепторов и глицина. Его результаты высокой растворимости в крови менее желательной медленной индукции анестезии. При низких концентрациях он относительно не раздражает дыхательные пути. Более высокие концентрации приводят к тахипноэ . Многие виды сердечных аритмий может произойти и усугубляются эпинефрина (адреналина). Было отмечено , в 1940 - х годах , что ТХЭ реакцию с диоксидом углерода (СО 2 ) , поглощающих систем ( кальцинированной извести ) , чтобы произвести dichloroacetylene и фосген . Черепной нерв дисфункция (особенно пятый черепной нерв) была общей анестезия , когда TCE была дана с помощью СО 2 , поглощающие системы. Эти нервные дефициты могут длиться в течение нескольких месяцев. Иногда онемение лица было постоянным. Расслабление мышц с TCE анестезией , достаточной для проведения операции было бедно. По этим причинам, а также проблем с гепатотоксичностью , TCE потерял популярность в Северной Америке и Европе более мощного anesthestics , такие как галотан по 1960.
Симптомы острого немедицинского воздействия аналогичны таковые алкогольное опьянение , начиная с головной болью, головокружением и спутанностью и прогрессируют с увеличением экспозиции к потере сознания. Дыхательная и кровеносная депрессия может привести к летальному исходу.
Многое из того, что известно о человеческих последствиях для здоровья трихлорэтилен основан на профессиональных вредностей. Помимо эффектов на центральную нервную систему, на рабочем месте воздействие трихлорэтилена было связано с токсическими эффектами в печени и почках. Со времени, профессиональные пределы воздействия на трихлорэтилене ужесточил, что приводит к более жесткому контролю вентиляции и личного использование защитного оборудования работников.
Исследования , проведенные биопробы рака , выполненных Национальный институт рака (позже Национальная программа по токсикологии ) показали , что воздействие трихлорэтилена является канцерогеном у животных, производя рак печени у мышей, а также рак почки у крыс.
11 Доклад Национальной токсикологической программы по канцерогенам классифицирует трихлорэтилен, как «разумно ожидается, будет канцерогенных для человека», основанный на ограниченные доказательства канцерогенности, полученные из исследований у человека и достаточное доказательство канцерогенности исследований на экспериментальных животных.
Один недавний обзор эпидемиологии рака почки оценили курение сигарет и ожирение , как наиболее важных факторов риска рака почки , чем воздействия растворителей , таких как трихлорэтилен. В отличии от этого , самого последней общей оценки рисков для здоровья человека , связанных с трихлорэтилен состояниями «[т] здесь соответствие между животными и человеком исследованиями, который поддерживает вывод , что трихлорэтилен является потенциальным канцерогеном почки». Доказательства , как представляется, менее определенным в это время относительно взаимоотношений между людьми и раком печени наблюдается у мышей с США NAS указывает , что воздействие низкого уровня не может представлять собой значительный риск развития рака печени в общей популяции.
Недавние исследования на лабораторных животных и наблюдениях в популяциях человека свидетельствуют о том, что воздействие трихлорэтилена может быть связанно с врожденными дефектами сердца Пока не ясно, какие уровни воздействия связаны с пороками сердца у людей, есть согласованность между пороками сердца, наблюдаемых в исследованиях общины подвергаются загрязнению трихлорэтилена в грунтовых водах, и наблюдаемые эффекты в лабораторных животных. В исследовании, опубликованном в августе 2008 года, продемонстрировал эффекты TCE на митохондриях человека. В статье рассматриваются вопросы, может ли это повлиять на женскую репродуктивную функцию.
Профессиональное воздействие TCE было коррелирует с развитием симптомов болезни Паркинсона в трех работников лаборатории. Ретроспективный твин исследование пар несогласованных Паркинсона показали шестикратное увеличение риска Паркинсона , связанных с воздействием TCE на рабочем месте.
Риски для здоровья трихлорэтилена были широко изучены. Агентство США по охране окружающей среды (EPA) спонсировало «состояние науки» анализ последствий для здоровья , связанных с воздействием трихлорэтилена. Национальная академия наук пришла к выводу , что данные о канцерогенной опасности и других потенциальных опасностях для здоровья от воздействия TCE укрепились , поскольку EPA выпустила токсикологическую оценку TCE, и призывает федеральные агентства завершить оценку риски для TCE с использованием имеющейся информации, так что решения по управлению рисками для этого химического вещества могут быть ускорены.
В Европе Научный комитет по ПДК (SCOEL) рекомендует для трихлорэтилена в ПДК (8 час времени средневзвешенную) 10 частей на миллион и краткосрочного предела воздействия (15 мин) от 30 частей на миллион.
воздействие человеческого
Воздействие TCE происходит в основном через загрязненную питьевую воду. С удельным весом больше 1, трихлорэтилен может присутствовать в виде плотной неводной фазы жидкости (DNAPL) , если достаточное количество пролиты в окружающей среде. Другой существенный источник воздействия паров в суперфонде участках , которые загрязненная подземные вод, такие как патронный завод Города - побратимы армии , был забрасывая. ТХЭ легко улетучивается из горячей воды и в воздухе. Длинный, горячий душ затем испаряться больше TCE в воздух. В доме плотно закрыт , чтобы сохранить стоимость отопления и охлаждения, эти пары затем разослать.
Первый известный доклад TCE в грунтовых водах был дан в 1949 году два английских государственных химиков , которые описаны два отдельных случаев загрязнения также промышленными выпусками TCE. На основании имеющихся федеральных и государственных исследований, от 9% до 34% от источников питьевого водоснабжения , апробированных в США может иметь некоторое загрязнение TCE, хотя EPA сообщил , что большая часть поставок воды в соответствии с максимальным уровнем загрязняющих веществ (MCL) из 5 частей на миллиард. Кроме того, все большее беспокойство в последние года на участках с загрязнением TCE в почве или грунтовых вод было пары проникновения в зданиях, что привело воздух внутри помещений экспозиций, в недавнем случае в Маккук полевых окрестностях Дейтона, штат Огайо. Трихлорэтилен был обнаружен в 852 сайтов суперфонда по всей территории Соединенных Штатов, в соответствии с Агентством по токсическим веществам и регистрации заболеваний (ATSDR). В соответствии с Законом безопасного питьевой воды 1974 года, и с поправками , ежегодное тестирование качества воды является обязательным для всех дистрибьюторов общественных питьевой воды. Текущие рекомендации по охране окружающей среды для TCE онлайн. Столик ЕРА «TCE Релизы на землю» датирована 1987 по 1993 год, тем самым опуская один из крупнейших сайтов по очистке Суперфонда в стране, в Северной ИВТ в Скоттсдейле, штат Аризона. Ранее TCE сбрасывали здесь, и впоследствии были обнаружены в муниципальных колодцах питьевой воды в 1982 году, до периода исследования.
В 1988 году EPA обнаружили тонны TCE , которые были просочились или сбрасывали в землю военной и полупроводниковой промышленности США (компании , включая Fairchild Semiconductor , корпорации Intel и Raytheon Company ) только за пределами NASA Ames в Моффетфильде, Mountain View, Калифорния.
В 1998 году поставки View-Master завод хорошо в Бивертон, штат Орегон было установлено , были загрязнены с высокими уровнями TCE. Было подсчитано , что 25000 заводчан были выставлены к нему от 1950-2001.
В случае Лиль, штат Иллинойс , выпуски трихлорэтилена (TCE), предположительно , произошло на имущество Lockformer , начиная с 1968 года и продолжается в течение неопределенного периода времени. Компания использовала TCE в прошлом как обезжириватель для очистки металлических деталей. Загрязнения на сайте Lockformer в настоящее время под следствием Агентства США по охране окружающей среды (USEPA) и Иллинойс EPA. В 1992 году Lockformer проводили отбор проб почвы на их собственности и нашли TCE в почве на уровне выше , чем 680 частей на миллион (частей на миллион). В течение лета 2000 года группа жителей наняла адвокат, а 11 октября 2000 года эти жители имели свою частную колодезную воду испытания частного окружающей среды консультант. Группа владела дома к югу от собственности Lockformer в предполагаемом пути потока грунтовых вод. Консультант собирает второй раунд также пробы воды 10 ноября 2000 года, и TCE был обнаружен в некоторых из колодцев. Начиная с декабря 2000 года, штат Иллинойс EPA собрали около 350 больше частных проб колодезной воды к северу и югу от собственности Lockformer.
По состоянию на 2007, 57000 фунтов, или 28,5 тонн TCE были удалены из системы скважин, когда поставляемые питьевой воды для жителей Скоттсдейл, штат Аризона . Один из трех колодцев питьевой воды , ранее находящихся в собственности города Феникс и в конечном итоге проданы в город Скотсдейл, испытано на 390 частей на миллиард TCE , когда он был закрыт в 1982 г. Город Скоттсдейл недавно обновила свой сайт , чтобы уточнить , что загрязненные колодцы были «в районе Scottsdale,» и изменены все ссылки на измеренных уровней TCE обнаружил , когда скважины были закрыты ( в том числе «390 частей на миллиард)» , чтобы «след».
Кэмп Лежен в Северной Каролине может быть крупнейший сайт загрязнения TCE в стране. Законодательство может заставить EPA создать консультативное здоровье и национальное регулирование общественных питьевой воды , чтобы ограничить трихлорэтилен.
На протяжении более двадцати лет эксплуатации, RCA корпорации были заливки токсичных сточных вод в скважину в его Таоюань , Тайвань объекта. Загрязнение от завода не было обнаружено до 1994 года, когда бывшие работники привели его к свету. Исследование Управления по охране окружающей среды Тайваня подтвердило , что RCA был демпинг хлорированных органических растворителей в секретную скважину и привел к загрязнению в почву и грунтовые воды , прилегающую к месту установки. Высокие уровни TCE и тетрахлорэтилена (PCE) могут быть найдены в подземных водах , проведенной по мере в двух километрах от участка. Организация бывших сотрудников RCA отчеты 1375 случаев рака, 216 случаев смерти от рака, и 102 случаев различных опухолей среди его членов.
В июне 2012 года жители области прочь Stony Hill Road, Wake Forest, NC связывались по охране окружающей среды и DWQ о возможном загрязнении TCE после того как власти следовали на существующие загрязнения TCE в 2005 Последующие испытания EPA нашли несколько сайтов с обнаруживаемыми уровнями TCE и несколько с уровнями выше ПДК .
1998 фильм Гражданское действие драматизирует EPA иск Энн Андерсон и др., V. Cryovac, Inc. относительно трихлорэтилен загрязнения , которые произошли в Woburn, штат Массачусетс в 1980 - х годах.
Существующие регулирование
До последних лет, Агентство США по регистрации токсичных веществ и заболеваний (ATSDR) не утверждало , что трихлорэтилен было мало-по-нет канцерогенного потенциала, и, вероятно, соканцерогенно , то есть, он действовал совместно с другими веществами , чтобы способствовать формированию опухолей.
Государственные, федеральные и международные учреждения классифицировать трихлорэтилен как известный или вероятный канцероген. В 2014 году Международное агентство по изучению рака обновила свою классификацию трихлорэтилена в 1 -й группе, что указывает на достаточно доказательств того , что он вызывает рак почки в организме человека, а также некоторые признаки рака печени и неходжкинской лимфомы. Регуляторы California EPA считают известным канцерогеном и выдал оценку риска в 1999 году сделал вывод , что это было намного более токсичны , чем предыдущие научные исследования показали.
В Европейском Союзе , то Научный комитет по ПДК (SCOEL) рекомендует установить ПДК для рабочих , подвергающихся воздействию трихлорэтилена 10 частей на миллион (54,7 мг / м 3 ) в течение 8-часового TWA и 30 частей на миллион (164,1 мг / м 3 ) для СТЭЛ (15 минут).
Действующее законодательство ЕС, направленные на защиту работников от рисков для их здоровья (в том числе химических агентов Директива 98/24 / EC и канцерогены Директива 2004/37 / EC) в настоящее время не налагают обязательные минимальные требования для контроля рисков для здоровья работников на этапе использования или на протяжении всего жизненного цикла трихлорэтилена. Однако, в случае, если текущее обсуждение в рамках Директивы канцерогенов приведет к установке связывания Предельнодопустимыеконцетрациивредныхвеществврабочейзона для трихлорэтилена для защиты работников; этот вывод может быть пересмотрен.
Растворители Выбросы Директивы 1999/13 / EC и промышленные выбросы Директива 2010/75 / ЕС налагать обязательные минимальные требования по выбросам трихлорэтилена в окружающую среду для определенных видов деятельности, включая очистку поверхности. Однако деятельность с потреблением растворителя ниже определенного порогового значения, не подпадают под этим минимальным требованиям.
Согласно европейским нормам, использование трихлорэтилена запрещено для физических лиц в концентрации более чем на 0,1%. В промышленности, трихлорэтилен должен быть заменен до 21 апреля 2016 года (если исключение не запрашиваются до 21 октября 2014 года) с другими продуктами , такими , как тетрахлорэтилен ( перхлорэтилен ), метиленхлорид ( дихлорметан ), или другими производными углеводородами ( кетоны , спирты ,. ..)
Предлагаемые США федеральное регулирование
В 2001 году проект доклада Агентства по охране окружающей среды (EPA) заложили основу для новых жестких стандартов по ограничению облучения населения на трихлорэтилен. Оценка отправляется бой между EPA и Министерством обороны (МО), в Департаменте энергетики и НАСА , которые обратились непосредственно в Белом дом. Они утверждали , что EPA произвела вредную науку, ее предположения были сильно испорчены, и что доказательства оправдательных химиката было проигнорированы.
DoD около 1400 военных свойств общенациональные, которые загрязнены трихлорэтилен. Многие из этих сайтов, подробно и обновляется www.cpeo.org и включают в себя бывший завод боеприпасов в районе Twin Cities. Двадцать три места в комплексе Министерства энергетики ядерного оружия - в том числе в Ливерморской национальной лаборатории в районе залива Сан - Франциско, и центров НАСА, в том числе Лаборатории реактивного движения в La Cañada Флинтридж сообщается, имеют загрязнения TCE.
Политические назначенцы в EPA стороны с Пентагоном и согласились отступить оценку риски. В 2004 году Национальная академия наук получил контракт на $ 680,000 для изучения этого вопроса, выпустив свой доклад летом 2006 года доклад поднял больше озабоченность по поводу воздействия на здоровье TCE.
В ответ на повышенное внимание к окружающей среде токсинов, таких как TCE и роли, которую они могут играть в детской болезни, в 2007 году, сенатор Барак Обама предложил S1068, в соавторстве с Хиллари Клинтон и Джон Керри. Это законодательство, направленное на информирование и защита общин, которые находятся под угрозой загрязнения окружающей среды. собственный законопроект сенатора Клинтон, S1911, известен как Закон о сокращении TCE.
Сокращение производства и рекультивация
В последнее время наблюдается существенное сокращение объемов производства трихлорэтилена; альтернативы для использования в обезжиривания металла имеются в большом количестве, хлорированные алифатические углеводороды, сворачиваются в большом большинстве отраслей промышленности в связи с потенциалом для необратимых последствий для здоровья и юридической ответственности, которая следует в результате.
Американские военные практически исключили ее использование химического вещества, закупая только 11 галлонов в 2005 году около 100 тонн она ежегодно используются в США в 2006.
Недавние исследования сосредоточены на реабилитации в месте трихлорэтилена в почву и грунтовые воды вместо удаления для лечения внеплощадочных и утилизации. Естественно встречающиеся бактерии были идентифицированы с возможностью разлагать TCE. Dehalococcoides зр. деградирует трихлорэтилен путем восстановительного дехлорированием в анаэробных условиях. В аэробных условиях, Pseudomonas Fluorescens могут совместно метаболизировать TCE. Загрязнение почвы и грунтовых вод на TCE также успешно устранено путем химической обработки и добычи. Бактерии еигораеа Nitrosomonas может ухудшить различные галогенированные соединения , в том числе трихлорэтилена. Толуол диоксигеназа сообщалось, участвует в деградации TCE по Pseudomonas putida . В некоторых случаях, Xanthobacter autotrophicus может конвертировать до 51% от TCE к СО и СО 2 .
Рекомендации
дальнейшее чтение
- Агентство по регистрации токсичных веществ и заболеваний (ATSDR). 1997. Токсикологическая Профиль для трихлорэтилена. ссылка на сайт
- Доэрти, Ричард Э. (2000). «История производства и использование тетрахлорметана, тетрахлорэтилен, трихлорэтилен и 1,1,1-трихлорэтан в Соединенных Штатах: Часть 2 - трихлорэтилен и 1,1,1-трихлорэтан». Экологическая криминалистика . 1 (2): 83-93. DOI : 10,1006 / enfo.2000.0011 .
- Lipworth, Loren; Tarone, Роберт E .; McLaughlin, Джозеф К. (2006). «Эпидемиология РАКА ПОЧКИ». Журнал урологии . 176 (6): 2353-8. DOI : 10.1016 / j.juro.2006.07.130 . PMID 17085101 .
- Агентство США по охране окружающей среды (USEPA). 2011. токсикологической для трихлорэтилена [5]
- Национальная академия наук (NAS). 2006. Оценка рисков здоровья человека трихлорэтилен - Основные научные вопросы. Комитет по населенным Риски для здоровья трихлорэтилена, Национального научно - исследовательского совета. ссылка на сайт
- Национальная программа США по токсикологии (NTP). 2005. трихлорэтилен, в 11 - м ежегодном докладе канцерогенов. ссылка на сайт
внешняя ссылка
Хлорэтан — Википедия
Материал из Википедии — свободной энциклопедии
Хлорэтан (хлорэтил, лат. Aethylii chloridum) — бесцветный легкосжижаемый газ со слабым характерным запахом, огнеопасен. Применяется в медицине для анестезии методом сильного охлаждения, ранее иногда использовался для ингаляционного наркоза, и применяется в рекреационных целях, наподобие попперс и закиси азота.
Также известен как хладагент R-160.
Этилхлорид, Aether chloratus, Aethylis chloridum, Aethylium chloratum, Chelen, Chlorene, Chloretan, Ethylis chloridum, Ethyl chloride, Kelen, Хлористый этил, хлорэтан.
Хлорэтил является мощным наркотическим средством. При концентрации хлорэтила во вдыхаемой смеси 3—4 об. % наступает хирургическая стадия наркоза. Наркоз развивается быстро, в течение 2—3 мин, стадия возбуждения непродолжительна. Пробуждение наступает быстро.
Основной недостаток хлорэтила — малая терапевтическая широта и в связи с этим опасность передозировки.
В настоящее время хлорэтил применяют для наркоза редко (лишь при очень кратковременных оперативных вмешательствах), в основном он используется как местное средство для кратковременного поверхностного обезболивания кожных покровов.
При попадании на кожу он вызывает вследствие быстрого испарения сильное охлаждение кожи, ишемию и понижение чувствительности, что позволяет пользоваться им при небольших поверхностных операциях (разрезы кожи).
Кроме того, хлорэтилом пользуются для уменьшения кожного зуда, а также для лечения (криотерапия) рожистого воспаления, нейромиозитов, невралгий, термических ожогов, бородавчатой формы красного лишая, очаговой алопеции. Для этих целей с бокового капилляра ампулы с хлорэтилом снимают резиновый колпачок, согревают ампулу в ладони и выделяющуюся струю направляют на поверхность кожи (с расстояния 25—30 см). После появления на коже «инея» ткани становятся плотными и нечувствительными. В лечебных целях процедуры производят раз в день в течение 7—10 дней.
Применять хлорэтил следует с осторожностью: возможны гиперемия и повреждение целостности кожи с экссудацией.
Противопоказания[править | править код]
Противопоказаниями к применению являются нарушения целостности кожных покровов, заболевания сосудов (варикозное расширение вен, сосудистые спазмы). Больные не должны вдыхать хлорэтил, испаряющийся с поверхности кожи.
Физические свойства[править | править код]
Прозрачная, бесцветная, легко летучая жидкость своеобразного запаха. Трудно растворим в воде (приблизительно 1:50). Смешивается во всех соотношениях со спиртом и эфиром. Огнеопасен. Горит, окрашивая пламя в зелёный цвет. Плотность 0,919—0,923 (при 0 °C). Температура кипения +12—13°С.
Форма выпуска[править | править код]
Хранение[править | править код]
В прохладном, защищённом от света месте.
Трихлоруксусная кислота — Википедия
Материал из Википедии — свободной энциклопедии
| Трихлоруксусная кислота | |
|---|---|
| Систематическое наименование | Трихлорэтановая кислота |
| Традиционные названия | Трихлоруксусная кислота |
| Хим. формула | C2HCl3O2 |
| Состояние | кристаллическое |
| Молярная масса | 163,4 г/моль |
| Плотность | 1,63 г/см³ |
| Температура | |
| • плавления | 57 °C |
| • кипения | 196 °C |
| Давление пара | 1 ± 1 мм рт.ст.[1] |
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 0,77 |
| Рег. номер CAS | 76-03-9 |
| PubChem | 6421 |
| Рег. номер EINECS | 200-927-2 |
| SMILES | |
| InChI | |
| RTECS | AJ7875000 |
| ChEBI | 30956 |
| ChemSpider | 10772050 |
| Предельная концентрация | 5 мг/м3 |
| ЛД50 | 5000 мг/кг (крысы, внутрижелудочно), 250 мг/кг (мыши, подкожно) |
| Токсичность | Токсична, является ирритантом, весьма едкая |
| Фразы риска (R) | R35, R50/53 |
| Фразы безопасности (S) | (S1/2), S26, S36/37/39, S45, S60, S61 |
| Пиктограммы ECB | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Трихлоруксусная кислота CCl3СООН — полностью галогенированный (по метильной группе) аналог уксусной кислоты, в котором 3 атома водорода метиловой группы полностью замещены атомами хлора.
Физические свойства[править | править код]
Трихлоруксусная кислота представляет собой бесцветные гигроскопичные кристаллы, существующие в τ- и β-кристаллических формах. Имеет специфический уксусный неприятный запах. Хорошо растворима в воде.
Химические свойства[править | править код]
В водных растворах является сильной одноосновной кислотой, pKa = 1,66 (25 °C, вода). Образует соли с неорганическими основаниями, со спиртами образует сложные эфиры. По атому хлора вступает в реакции нуклеофильного замещения, аналогичные реакциям моно- и дихлоруксусным кислотам. Соли трихлоруксусной кислоты называются трихлорацетатами.
Легко декарбоксилируется, при нагревании с щелочами и аминами образует хлороформ.
Получение[править | править код]
Получают синтезом, по реакции хлора с уксусной кислотой в присутствии катализатора (обычно ацетилацетата):
Ch4COOH+3Cl2→CCl3COOH+3HCl{\displaystyle {\mathsf {CH_{3}COOH+3Cl_{2}\rightarrow CCl_{3}COOH+3HCl}}}
В промышленности трихлоруксусную кислоту синтезируют методом взаимодействия хлораля 42%-ной азотной кислотой при температуре 60-65 °C, окислением тетрахлорэтилена, окислением хлораля гипохлоритом кальция.
- Используется в химическом синтезе, хроматографии, как дифференцирующий растворитель.
- В косметике — средства для химического пилинга.
- Широко используется в биохимии для осаждения макромолекул, таких как белки, ДНК и РНК. Натриевая соль этой кислоты используется в качестве гербицида.
Токсична, всасывается через кожу, оказывает прижигающее действие.
Образуется в атмосфере в результате реакции с участием некоторых хлорорганических соединений, растворителей, которые используются в промышленности для очистки и обезжиривания материалов. Повышенная концентрация ТХУ[2][3] в приземном воздухе опасна как для растений, так и для животных. Это особенно заметно в регионах с неблагоприятными климатическими условиями: в степях, полупустынях, северных и высокогорных территориях.
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.